
일천궁과 토천궁에서 발생하는 총채벌레류의 분자동정

This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Cnidium officinale Makino and Ligusticum chuanxiong Hort. are important medicinal crops in Korea. However, there is insufficient information on the identification of thrips, which attack these plants. Until now, one species of thrips has been recorded as a main pest.
To identify the thrips emerging in C. officinale Makino and L. chuanxiong Hort., these plants were independently cultivated in two local areas. Thirty individuals of each plant species were selected randomly and surveyed for the presence of thrips. After confirming the existence of thrips, 100 thrips individuals were collected from each crop using the beating method. To identify thrips species, we performed PCR-restriction fragment length polymorphism (RFLP)-based analysis using ITS2 primer sets. Six thrips species were identified: western flower thrips (Frankliniella occidentalis), flower thrips (F. intonsa), onion thrips (Thrips tabaci), chrysanthemum thrips (T. nigropilosus), chilli thrips (Scirtothrips dorsalis), and grass thrips (Anaphothrips obscurus). The proportion of these species differed between the host plant species.
Six thrips species were major pests of two medicinal crops. Integrated pest management is required to control these thrips species, and will enhance the yield and quality of C. officinale and L. chuanxiong.
Keywords:
Cnidium officinale Makino, Ligusticum chuanxiong Hort, Thrips, Molecular Identification, PCR-RFLP, ITS2 Primer서 언
약용식물이란 식물 전체 또는 잎, 줄기, 뿌리, 종자 추출물 등을 약으로 이용하는 식물을 말하며, 약용작물은 약용식물 중에서 수요가 많거나 야생 채취로 인해 고갈 등 경제성이 있어 약으로 쓸 목적으로 재배 생산하는 식물을 지칭한다 (RDA, 2013).
최근 약용작물의 활용범위가 예전의 약재 위주에서 건강기능식품 및 기능성화장품으로 확대되면서 수요가 증가추세에 있지만 국내 생산으로 충당하기에는 부족한 것이 현실이다. 따라서 수입 원재료에 대한 안정성 문제가 부각될 수밖에 없고 2019년부터 PLS (positive list system, 농약허용물질목록관리제도) 제도가 전면 시행됨에 따라 농약의 안전사용기준이 중요해질 수밖에 없다.
재배작물의 종류, 작부방식의 변화 및 이상기후 발생 등은 해충상의 변화뿐만 아니라 돌발병해충의 출현을 유발하기도 한다 (Jeon et al., 2000; Cho, 2006). 이러한 병해충의 시기적절한 방제를 위해서는 발생정보가 풍부해야 하지만, 다른 경제작물에 비해 약용작물은 상대적으로 부족하다.
현재까지 보고된 결과를 보면 국화과 약초류 10 종을 대상으로 한 피해조사 (Ahn et al., 1990), 25 종의 약용작물에서 식물기생선충의 종류와 피해조사 (Park et al., 1992), 인삼포장 발생 해충조사 (Kim, 1994), 경남지역 5 종 약용작물에 대한 해충조사 (Shin et al., 2002), 약용작물 전시포 발생 곤충상 조사 (Lee et al., 2007) 및 약용작물 발생 총채벌레류 종류 및 피해조사 (Kang et al., 2012)가 있다.
대한민국약전에는 천궁 (Cnidium Rhizome)의 기원식물로 천궁 C. officinale Makino 또는 중국천궁 L. chuanxiong Hort. (산형과, Umbelliferae)로 표기되어 있고 (KFDA, 2012), 국가표준재배식물목록에는 천궁 (C. officinale Makino)으로 기재되어 있다 (KNA, 2016). 하지만 재배농가와 한약재 판매회사에서는 C. officinale Makino를 일천궁으로, L. chuanxiong Hort.를 토천궁으로 구분하고 있다. 일천궁은 중국에서 들여온 도입식물로 염색체 불화합성으로 인해 꽃이 거의 피지 않고 종자 또한 맺히지 않는다 (BHMPES, 2012). 형태적으로 일천궁과 토천궁의 가장 큰 차이는 뿌리줄기 (근경)이다. 일천궁은 근경이 여러 개의 소근경이 모여있는 둥근 형태이지만, 토천궁은 가는 수염뿌리처럼 근경이 발달해 있다. 외부형태는 차이를 보이지만 약리성분에서는 차이가 크지 않는 것으로 알려져 있다. 토천궁은 평창, 태백, 삼척을 중심으로 여름기온이 다소 서늘한 산간고랭지에서 주로 재배되는 반면, 일천궁은 영양, 청송, 안동, 봉화에서 주로 재배하고 있다. 토천궁과 일천궁은 유기물 함량이 많고 물빠짐이 좋으며 습윤한 토질에서 생육이 양호하다. 하지만 천궁은 연작장해가 심한 작물이므로 재배지를 바꿔가야 하므로 연작을 피할 수 있는 논이나 밭에서 주로 재배되고 있는 실정이다 (BHMPES, 2012).
현재까지 국내 약용작물에서 보고된 총채벌레류에는 도라지에서는 싸리총채벌레 (Megalurothrips distalis)와 대만총채벌레 (Frankliniella intonsa)가, 더덕에서는 대만총채벌레와 파총채벌레 (Thrips tabaci)가, 구기자에서는 꽃노랑총채벌레 (Frankliniella occidentalis)가, 삽주에서는 미나리총채벌레 (T. nigropilosus)와 싸리총채벌레가, 방풍과 시호에서는 파총채벌레가, 참당귀와 감초에서 대만총채벌레가 동정되었다 (Kang et al., 2012).
총채벌레류들은 일반적으로 식물 표피에서 성충과 약충 단계를 지내면서 식물체를 가해하다가 식물조직 내에 알을 산란하고 토양에서 전용과 용의 단계를 거치는 복잡한 생활사를 갖고 있다 (Ananthakrishan, 1993). 하지만 발육시기별 서식장소의 다양성과 알에서 성충까지의 발육기간이 짧고 채소, 과수 및 화훼류 등을 가해하는 광식성 해충으로 기주식물이 220 여종 이상으로 보고된 바 있다 (Yudin et al., 1986; Ananthakrishan, 1993).
총채벌레류는 주로 식물의 잎이나 꽃 등 연약한 부위나 조직 틈에 서식하고 재배 초기에 생장점 부위를 집중적으로 가해하기 때문에 생육초기 낮은 밀도로 발생하더라도 예찰 및 방제를 수행하지 않을 경우에는 작물의 생육 위축 등 많은 피해를 주는 것으로 알려져 있다 (Cho et al., 2006). 총채벌레류에 대한 약제 저항성 계통의 출현 등에 관한 지속적인 보고는 농약을 사용한 방제 때 약제의 교차사용 등 여러 가지 주의가 필요함을 제시하고 있다 (Cho et al., 2006; Bielza et al., 2007).
국내 대표 약용작물인 천궁에 발생하는 총채벌레로는 파총채벌레가 보고된 바 있지만 (ATRI, 1994) 최근 연구보고는 없다. 따라서 일천궁과 토천궁에서 발생하는 총채벌레류를 조사하여 향후 천궁의 병해충 방제연구의 기초자료로 활용하고 자 한다.
재료 및 방법
1. 천궁 가해 총채벌레 피해증상 확인 및 채집
일천궁 (C. officinale Makino)과 토천궁 (L. chuanxiong Hort.)을 가해하거나 서식하고 있는 총채벌레류를 확인하기 위해 일천궁은 2018년 7월, 토천궁은 2018년 8월에 국립산림과 학원 산림약용자원연구소 한천연구시험림 내 일천궁 재배지와 경북 봉화군 춘양면 소재 토천궁 재배지에서 채집하였다 (Table 1).
총채벌레류 피해증상 확인은 Kang 등 (2012)이 제시한 방법을 이용하였다. 재배지별로 30 주 이상의 식물체를 임의로 선택하여 육안조사를 실시하였고 총채벌레류의 피해가 있으면 타락법을 실시하여 총채벌레류의 서식 및 발생유무를 재차 확인하였다.
에어필터식 흡충기 (#SL13014, Shinll Science, Seoul, Korea)를 이용하여 각 기주식물별로 100 마리 이상의 총채벌레류를 포집한 후 실험실로 가져와 실체현미경 (SteREo Discovery V8, Carl-Zeiss, Jena, Germany)을 이용하여 간이동정을 하였고 보다 정확한 분자동정을 위해 개체별로 번호를 표시한 후 미소 붓을 이용하여 마이크로튜브에 담아 −20℃에 보관하였다.
2. Genomic DNA 추출, PCR 증폭 및 PCR-RFLP 실시
총채벌레류의 genomic DNA는 RED Extract-NAmp Tissue PCR Kit (#090M6175, Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하여 각 개체별로 추출하였다.
Genomic DNA에 존재하는 ITS2 (internal transcribed spacer 2) 영역의 증폭을 위해 Toda 와 Komazaki (2002)가 사용했던 프라이머 (Toda-F2; 5’-TGTGAACTGCAGGACACATGA-3’, Toda-R2; 5’-GGTAATCTCACCTGAACTGAGGTC-3’)을 이용하였다.
PCR 반응액은 Ahn 등 (2014)이 제시한 방법대로 제조하였는데 genomic DNA 1㎕가 포함된 반응액 50㎕ (2.0 mM MgCl2, 0.2 mM dNTP, 0.2 μM primer, 1× PCR buffer)에 1 unit의 Taq DNA polymerase (Bioneer Co., Daejon, Korea)를 첨가하였다. 유전자 증폭은 Thermal cycler (TP600, TaKaRa Bio Inc., Shiga, Japan)를 이용하여, 94℃에서 10 분간 초기 denaturation을 실시한 이후, 94℃에서 1 분간 denaturation, 55℃에서 1 분간 annealing, 72℃에서 1 분간 extension 하는 반응을 35 회 반복한 이후, 마지막으로 72℃에서 10 분간 extension을 실시하였다.
PCR 결과산물 5㎕를 2% agarose gel에 전기영동으로 전개시켜 증폭 여부를 확인한 후, 남은 PCR 결과산물을 Qiaquick PCR Purification Kit (Qiagen Inc., Germantwon, MD, USA)를 이용하여 정제하였다.
PCR-RFLP (polymerase chain reaction-restriction fragment length polymorphism)를 실시하기 위해 정제된 PCR 결과산물 10㎕에 제한효소 RsaI (Thermo Fisher Scientific, Waltham, MA, USA) 5 unit를 처리하고 37℃에서 2 시간 동안 반응시킨 후, 60℃에서 20 분간 제한효소를 불활성화시키고, 2% agarose gel (TAE buffer)에 전기영동하여 제한효소의 작용으로 조각난 DNA 단편의 패턴을 확인하였다.
3. BLAST 검색 및 계통도 작성
ITS2-PCR의 염기서열 분석은 바이오니아 (Bioneer Co., Daejon, Korea)에 의뢰하여 진행하였다. 분석된 염기서열은 NCBI에 등록된 총채벌레류들의 ITS2 염기서열과 nucleotide BLAST (blastn) 분석 후 유사도가 가장 높은 종을 찾아 확인하였다.
계통도는 염기서열을 동일한 크기로 정리한 다음 MEGA 4 (Tamura et al., 2007; https://www.megasoftware.net/mega4)와 BioEdit (Ver 7.0, Isis Pharmaceuticals Inc., Carlsbad, CA, USA)의 Clustal W 방법을 사용하여 정렬한 후 작성하였다.
동정된 총채벌레류를 바탕으로 일천궁과 토천궁 각 기주별총채벌레 분포정도를 분석하였으며 Steel-Dwass test를 통해 각 기주식물별 총채벌레류의 유의차를 비교하였다.
결과 및 고찰
ITS2-PCR 및 PCR-RFLP을 이용한 분자동정 결과, 꽃노랑총채벌레, 대만총채벌레, 볼록총채벌레, 미나리총채벌레, 파총채벌레, 대관령총채벌레 등 총 6 종의 총채벌레류가 일천궁 (C. officinale Makino)과 토천궁 (L. chuanxiong Hort.)에서 발생하거나 서식하는 것으로 확인하였다 (Fig. 1). 이러한 분자동정 결과를 바탕으로 기주식물별 분포비율을 분석하였다 (Fig. 2).
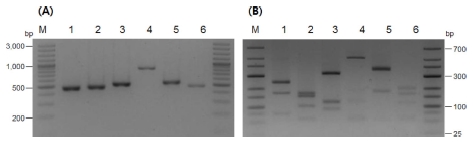
Gel-electrophoresis of ITS2-PCR products using ITS2 primer on genomic DNA from the six thrips species (A) and PCR-RFLP using Rsa I (B). M; 1,000 bp (A) and 100 bp ladder (B). lane 1; F. occidentalis (442 bp), lane 2; F. intonsa (455 bp), lane 3; T. tabaci (498 bp), lane 4; T. nigropilosus (850 bp), lane 5; S. dorsalis (510 bp), lane 6; A. obscurus (460 bp). Parenthesis means expect size of each species.
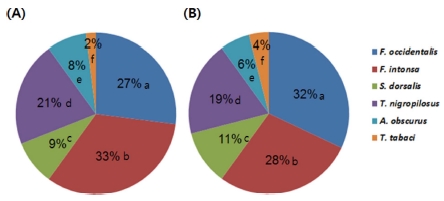
The distribution ratios of six thrips species in two medicinal crops, C. officinale (A) and L. chuanxiong (B). A hundred thrips were collected in each host plants and each ratio was calculated based on molecular identification by PCR. Values for each ratios labeled with different letters are significantly different (p < 0.05) by the Steel-Dwass test.
일천궁에서는 대만총채벌레 (33%) > 꽃노랑총채벌레 (27%) > 미나리총채벌레 (21%) > 볼록총채벌레 (Scirtothrips dorsalis) (9%) > 대관령총채벌레(Anaphothrips obscurus)(8%) > 파총채벌레 (2%) 순인 반면, 토천궁에서는 꽃노랑총채벌레 (32%) > 대만총채벌레 at (28%) > 미나리총채벌레 (19%) > 볼록총채벌레 (11%) > 대관령총채벌레 (6%) > 파총채벌레 (4%) 순이었다. 두 작물 모두 대만총채벌레와 꽃노랑총채벌레가 60% 이상의 가장 많은 분포비율을 보였다 (Fig. 2).
또한 볼록총채벌레와 대관령총채벌레 및 미나리총채벌레의 발생이 관찰되었는데 (Fig. 3) 볼록총채벌레는 오미자의 주요 해충으로 보고되어지고 있는 바 (Ham et al., 2013) 기주 또는 서식식물의 확대와 관련 있을 것으로 판단된다.
계통도 작성 결과, 이번 연구에서 확인된 대관령총채벌레를 NCBI에 등록된 대만종의 5.8S, ITS2 및 28S rRNA 유전자와 비교했을 때 동일한 그룹에 속하지 않은 것으로 확인하였다. 미나리총채벌레 역시 동일 유전자의 영국종과 비교했을 때도 다른 그룹에 속하는 것을 확인하였는데 모두 지리적 분포로 인한 차이로 판단된다 (Fig. 4).
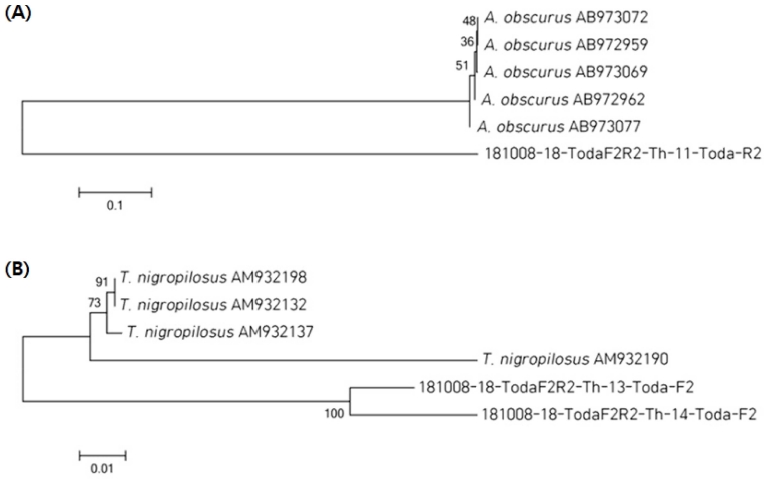
Phylogenetic trees of A. obscurus (A) and T. nigropilosus (B). The tree was constructed by using the MEGA4 after aligning the sequences with Megalign and generating evolutionary distance matrix inferred by the neighbor-joining method using Tamura 3 parameter. The numbers at the nodes indicate the levels of bootstrap support based on data for 1,500 replicates. The scale bar indicates 0.01 substitutions per nucleotide position. The 5.8S, ITS2, and 28S rRNA genes reported in Taiwan (AB973072, AB972959, AB973069, AB972962, and AB973077) and England (AM932198, AM932132, and AM932137) local species of A. obscurus and T. nigropilosus were used for phylogenetic trees construction. The 181008-18-TodaF2R2-Th-11-Toda-R2 of A. obscurus and 181008-18-TodaF2R2-Th-14-Toda-F2 of T. nigropilosus as same gene were identified from domestic species, respectively.
RDA (2003)은 1999 - 2003년까지 국내 총채벌레아목의 분류동정을 진행하여 천궁에서 꽃노랑총채벌레, 대만총채벌레, 볼록총채벌레, 파총채벌레 및 미나리총채벌레의 서식을 확인하였다. 대관령총채벌레는 이번 연구를 통해 처음 확인하였고 향후 대관령총채벌레의 발생 및 서식식물의 범위가 다양한 약용작물까지 확대될 수 있음을 시사하고 있다.
온난지역에 분포하는 대관령총채벌레는 주로 옥수수, 밀 등의 곡물류 및 티모시 등 벼과 (Poaceae) 작물을 가해하여 grass thrips로 불리면서 (Mirab-Balou and Chen, 2010) 세계적으로 분포하는 해충으로 알려져 있으며 (Bailey, 1948; Köppä, 1970; Nakahara, 1995; Mound and Kibby, 1998) 높은 생식능력으로 빠르게 개체군을 형성하여 작물에 심각한 피해를 준다 (Jiang et al., 2015, 2016).
성충과 유충은 잎의 세포 내용물을 흡즙하여 노란색 또는 흰색의 줄무늬와 식물체에 ‘silvertop’이라는 흔적을 잎에 남기고 은색 패치와 생장 부위의 왜소화를 유발하는 것으로 알려져 있다 (Kamm, 1971; Mound and Masumoto, 2009). 특히 피해 받은 티모시는 품질이 크게 감소하며, 종자로부터 출아한 옥수수 떡잎이 피해를 받게 되면 수량이 크게 감소된다(Reisig et al., 2009).
한편, chrysanthemum thrips라 부르는 미나리총채벌레는 북반구에 널리 퍼져 있으며 (Mound and Walker, 1982), 다식성으로 다양한 작물을 가해한다 (Morison, 1957; Palmer et al., 1989). 일본에서는 국화의 주요 해충으로 알려져 있으며 (Uesumi, 1989; Ikeda, 1990) 뉴질랜드에서는 서양가시엉겅퀴[Cirsium vulgare (Savi) Ten.]에서 관찰되기도 하였다 (Walker and Michaux, 1989).
미나리총채벌레는 장시형 (macropters), 단시형 (brachypters) 및 중간 표현형의 날개 다형성을 보이는 암컷이 있는 반면, 수컷은 단시형을 보인다 (Nakao, 1993). 이러한 암컷의 날개형성 결정에 관해 Nakao (1993, 1994)는 광주기, 온도 및 먹이식물의 영향이 있음을 구명하였다.
대관령총채벌레의 성충 또한 단시형 (brachypters), 장시형 (macropters), 및 중간 표현형을 나타내는데, 이러한 3 가지 형태의 날개 표현형의 변화는 역시 광주기, 기주식물의 품질 및 개체군 밀도와 환경조건에 따라 달라질 수 있음을 보고하였다 (Kamm, 1972; Reisig et al., 2010). 이렇듯 국외에서는 여러 총채벌레류의 생리, 생태 등 다양한 연구결과가 보고되고 있지만, 국내에서는 꽃노랑총채벌레, 대만총채벌레, 오이총채벌레 등 주요 총채벌레류를 제외하고는 아직까지 연구보고나 정보가 부족한 실정이다.
일반적으로 총채벌레류는 식물의 향기에 반응한다 (de Kogel and Koschier, 2002). Koschier 등 (2000)은 휘발성 물질에 대한 꽃노랑총채벌레의 유인반응을 평가하였는데 3 종류의 benzenoids인 benzaldehyde와 p- 와 o-anisaldehyde, 4 종류의 monoterpens인 geraniol, nerol, linalool과 (+)-citronellol, sesquiterpene인 (E)-β-farnesene, eugenol, 3-phenylpropionaldehyde, 2 종류의 phenylpropanoids에 분명한 유인력이 있음을 보고하였다. 또한 den Belder 등 (2001)은 부추 포장에서 olfactory bioassay를 통해 파총채벌레의 암컷성충이 aldehyde 성분에 유인됨을 보여주었다.
일천궁에서는 62 종의 휘발성 물질과 12 종의 방향성 물질 (Chung, 2004), 토천궁에서는 73 종의 휘발성 물질이 분석되었다 (Zhang et al., 2007). 일천궁에서는 크게 hydrocarons, alochols, esters, phthalides 및 기타로 구성된 반면, 토천궁에서는 hydrocarons, alochols, acids 및 기타로 구성되어 두 식물의 성분구성에 차이가 있음을 확인하였다. 향후 이러한 주성분 이외에도 다른 휘발성 물질에 대한 추가적인 연구의 진행과 함께 화학생태학의 기반 위에서 식물과 곤충간의 상호작용에 대한 연구 또한 필요할 것으로 판단된다.
총채벌레류의 분자동정을 위해 Toda 와 Komazaki (2002)가 제시한 ITS2 영역의 프라이머를 사용하였다. Kang 등 (2012)이 이미 언급했듯이 이번 연구에서도 ITS2-PCR 산물의 제한효소 처리 결과가 여러 번 다르게 나타나는 것을 확인하였고 전기영동 후 젤에서 작은 밴드를 찾기 어려웠다.
지금까지 총채벌레류의 종 판별을 위해 많은 프라이머들이 개발되어 보고되었다 (Brunner et al., 2002; Nakahara and Minoura, 2015; Yeh et al., 2014, 2015). 하지만 국내 발생종의 판별을 위한 진단 프라이머 개발은 진행되지 않고 있다. 약용작물뿐만 아니라 과수류, 채소류, 화훼류 등의 경제작물에서 피해를 주는 총채벌레류는 단일종보다는 여러 종의 복합발생이 많을 것으로 추정된다. 따라서 한 번에 여러 종의 총채벌레류 판별이 가능하도록 경제적이면서도 효과적인 분자동정법이 필요할 것으로 판단된다.
Acknowledgments
본 연구는 산림청 국립산림과학원 연구개발사업(과제번호: FE0702-2018-01)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
REFERENCE
- Agricultural Technology Research Institute(ATRI), (1994), Cnidium officinale, In Compendium of medicinal plant pests with color plates Agricultural Technology Research Institute, Seoul, Korea, p102.
- Ahn, SB, Lee, SH, and Cho, WS., (1990), The insect pest species on the composite herb plants and their damages, Research Reports of the Rural Development Adminstration, Crop Protection, 32, p26-32.
-
Ahn, SJ, Cho, MR, Park, CH, Kang, TJ, Kim, HH, Kim, HW, and Yang, CY., (2014), Halo spot symptom induced by oviposition of Frankliniella occidentalis on grape fruits: Molecular diagnosis by a species-specific DNA amplification and microscopic characterization of the symptom, Korean Journal of Applied Entomology, 53, p281-286.
[https://doi.org/10.5656/ksae.2014.08.0.032]

- Ananthakrishan, TN., (1993), Bionomics of thrips, Annual Review of Entomology, 38, p71-92.
-
Bailey, SF., (1948), Grain and grass-infesting thrips, Journal of Economic Entomology, 41, p701-706.
[https://doi.org/10.1093/jee/41.5.701]

- Bielza, P, Quinto, V, Contreras, J, Torné, M, Martín, A, and Espinosa, PJ., (2007), Resistance to spinosad in the western flower thrips, Frankiniella occidentalis(Pergande), in greenhouses of south-easter spain, Pest Management Science, 63, p682-687.
- Bongwha Highland Medicinal Plants Experiment Station (BHMPES), (2012), General information, cultivars and characteristics, In Easy guide to understanding cultivation of Cnidium officinale Makino and Ligusticum chuanxiong Hort Bongwha Highland Medicinal Plants Experiment Station, Daegu, Korea, p7-21.
-
Brunner, PC, Fleming, C, and Frey, JE., (2002), A molecular identification key for economically important thrips species (Thysanoptera: Thripidae) using direct sequencing and a PCR-RFLP-based approach, Agricultural and Forest Entomology, 4, p127-136.
[https://doi.org/10.1046/j.1461-9563.2002.00132.x]

- Cho, SR., (2006), Environmental friendly control of caterpillars occurring on leaf vegetables in greenhouse with entomopathogenci nematodes, Ph.D. Thesis, Gyeongsang National University, Jinju, Korea, p120.
- Chung, MS., (2004), Volatile compounds of Cnidium officinale MAKINO, Food Science and Biotechnology, 13, p603-608.
- de Kogel, WJ, and Koschier, EH., (2002), Thrips responses to plant odours, In Thrips and Tospoviruses: Proceedings of the 7th international symposium on thysanoptera, Australian National Insect Collection, Canberra, Australia, p189-190.
- den Belder, E, Elderson, J, and Agca, I., (2001), Is olfactory orientation of Thrips tabaci disrupted by a non-host plant?, Proceedings of the Section Experimental and Applied Entomology of the Netherlands Entomological Society, 12, p61-64.
- Ham, EH, Lee, YS, Lee, JS, and Park, JK., (2013), Biological control of magnolia white scale; Pseudaulacapsis cockkerelli(Cooley) (Hemiptera: Diaspididae) and yellow tea thrips; Scirtothrips dorsalis Hood(Thysanoptera: Thripidae) on five flavor berry orchards, using Chrysoperla nipponensis(Okamoto) (Neuroptera: Chrysopidae) and Amblyseius swirskii Athias-Henriot(Acari: Phytoseiidae), Korean Journal of Nature Conservation, 7, p142-146.
- Ikeda, F., (1990), Thrips nigropilosus Uzel, In Chrysanthemum pest control Kokkaen Publishing, Osaka, Japan, p154-155.
- Jeon, HY, Kim, DS, Cho, MR, Yiem, MR, and Chang, JS., (2000), Recent status of major fruit tree pest occurrence in Korea, Journal of Korea Society for Horticultural Science, 41, p607-612.
-
Jiang, HX, Niu, SH, Li, XW, Zhang, XC, and Feng, JN., (2015), Comparison of developmental and reproductive biology in wing diphenic Anaphothrips obscurus(Thysanoptera: Thripidae), Journal of Asia-Pacific Entomology, 18, p735-739.
[https://doi.org/10.1016/j.aspen.2015.09.003]

-
Jiang, HX, Zhang, XC, Niu, SH, and Feng, JN., (2016), Effects of temperature on the development, reproduction and population growth of Anaphothrips obscurus(Thysanoptera: Thripidae), Journal of Asia-Pacific Entomology, 19, p1175-1181.
[https://doi.org/10.1016/j.aspen.2016.10.011]

-
Kamm, JA., (1971), Silvertop of bluegrass and bentgrass produced by Anaphothrips obscurus, Journal of Economic Entomology, 64, p1385-1387.
[https://doi.org/10.1093/jee/64.6.1385]

- Kamm, JA., (1972), Environmental influence on reproduction, diapause, and morph determination of Anaphothrips obscurus(Thysanoptera: Thripidae), Environmental Entomology, 1, p16-19.
-
Kang, TJ, Ahn, SJ, An, TJ, Cho, MR, Jeon, HY, and Jung, JA., (2012), Thrips in medicinal crops in Korea: Identification and their damages, Korean Journal of Medicinal Crop Science, 20, p487-492.
[https://doi.org/10.7783/kjmcs.2012.20.6.487]

- Kim, KW., (1994), Surveys on ginseng damage by insect and other animal pest, Korean Journal of Applied Entomology, 33, p237-241.
- Köppä, P., (1970), Studies on the thrips(Thysanoptera) species most commonly occurring on cereals in Finland, Annales Agriculturae Fenniae, 9, p191-265.
- Korea Food and Drug Administration(KFDA), (2012), The Korean pharmacopoeia, Korea Food and Drug Administration, Cheongju, Korea, p10.
- Korea National Arboretum(ANA), (2016), Standard checklist of cultivated plants in Korea, Korea National Arboretum, Seoul, Korea, p101.
- Koschier, EH, de Kogel, WJD, and Visser, JH., (2000), Assessing the attractiveness of volatile plant compounds to western flower thrips Franliniella occidentalis, Journal of Chemical Ecology, 26, p2643-2655.
- Lee, DW, Han, GY, Park, JC, Ryu, HB, Kim, DS, Lee, SM, Kim, CS, Park, CG, and Choo, HY., (2007), Kinds and occurring time of insect pests in medicinal plant garden, Korean Journal of Medicinal Crop Science, 15, p371-390.
-
Mirab-Balou, M, and Chen, XX., (2010), First description of the male of the wheat thrips, Anaphothrips obscurus(Thysanoptera: Thripidae), Zootaxa, 2540, p65-68.
[https://doi.org/10.11646/zootaxa.2540.1.4]

- Morison, GD., (1957), A review of british glasshouse thysanoptera, Transactions Royal Entomological Society London Ecological Entomology, 109, p467-534.
- Mound, L, and Masumoto, M., (2009), Australian Thripinae of the Anaphothrips genus-group(Thsanoptera), with three new genera and thirty-three new species, Zootaxa, 1, p1-8.
- Mound, LA, and Kibby, G., (1998), Thysanoptera: An identification guide, CAB International, Wallingford. Oxon, England, p70.
- Mound, LA, and Walker, AK., (1982), Thrips nigropilosus Uzel, In Fauna of New Zealand number 1 terebrantia(Insecta: Thysanoptera) Manaaki Whenua Press, Lincoln, New Zealand, p74.
- Nakahara, S, and Minoura, K., (2015), Identification of four thrips speices(Thysanoptera: Thripidae) by multiplex polymerase chain reaction, Research Bulletin of the Plant Protection Service Japan, 51, p37-42.
- Nakahara, S., (1995), Review of the nearctic species of Anaphothrips(Thysanoptera: Thripdidae), Insecta Mundi, 9, p221-248.
-
Nakao, S., (1993), Effects of temperature and photoperiod on wing form determination and reproduction of Thrips nigropilosus Uzel(Thysanoptera: Thripidae), Applied of Entomology and Zoology, 28, p463-472.
[https://doi.org/10.1303/aez.28.463]

- Nako, S., (1994), Effects of food type on wing form determination and development in female Thrips nigropilosus Uzel(Thysanoptera: Thripidae), Applied of Entomology and Zoology, 29, p273-278.
- Palmer, JM, Mound, LA, and du Heaume, GJ., (1989), CIE guides to insects of importance to man. 2. Thysanoptera, CAB International, Wallingford, England, p73.
- Park, SD, Choo, YD, Jung, GC, Park, SD, Choi, DW, and Choi, YE., (1992), Nematodes associated with medicinal herbs, Korean Journal of Applied Entomology, 31, p396-415.
-
Reisig, DD, Godfrey, LD, and Marcum, DB., (2009), Thresholds, injury, and loss relationships for thrips in Phleum pratense(Poales: Poaceae), Environmental Entomology, 38, p1737-1744.
[https://doi.org/10.1603/022.038.0627]

- Reisig, DD, Godfrey, LD, and Marcum, DB., (2010), Plant quality and conspecific density effects on Anaphothrips obscurus(Thysanoptera: Thripidae) wing dephenism and population ecology, Environmental Entomology, 39, p685-694.
- Rural Development Administration(RDA), (2003), Taxonomic study on the Korean Terebrantia(Thysanoptera), In 2003 Crop Protection Research Rural Development Administration, Suwon, Korea, p731-751.
- Rural Development Administration(RDA), (2013), The meaning of medicinal crops, In Medicinal Crops-guideline of agricultural technology 7(revision) Rural Development Administration, Paju, Korea, p10.
- Shin, HY, Lee, DW, Choo, HY, and Chung, DC., (2002), Insect pests of major medicinal crops in gyeongnam province, Journal of Agriculture and Life Sciences, 36, p83-93.
-
Tamura, K, Dudley, J, Nei, M, and Kumar, S., (2007), MEGA4: Molecular evolutionary genetics analysis(MEGA) software version 4.0, Molecular Biology and Evolution, 24, p1596-1599.
[https://doi.org/10.1093/molbev/msm092]

-
Toda, S, and Komazaki, S., (2002), Identification of thrips species(Thysanoptera: Thripidae) on Japanese fruit trees by polymerase chain reaction and restriction fragment length polymorphism of the ribosomal ITS2 region, Bulletin of Entomological Research, 92, p359-363.
[https://doi.org/10.1079/ber2002177]

- Uesumi, Y., (1989), Thrips nigropilosus Uzel, In Pest thrips in Japan Zenkoku Noson Kyoiku Kyokai Publishing Co. Ltd., Tokyo, Japan, p313-314.
- Walker, AK, and Michaux, B., (1989), The chrysanthemum thrips, Thrips nigropilosus Uzel(Terebrantia: Thysanoptera), on Scotch thistle, Cirsium vulgare(Savi) Ten.(Compositae: Cynareae) in New Zealand, New Zealand Entomologist, 1, p17-19.
-
Yeh, WB, Tseng, MJ, Chang, NT, Wu, SY, and Tsai, YS., (2015), Agronomically important thrips: Development of species-specific primers in multiplex PCR and microarray assay using internal transcribed spacer 1(ITS1) sequences for identification, Bulletin of Entomological Research, 105, p52-59.
[https://doi.org/10.1017/s000748531400073x]

- Yeh, WB, Wu, SY, Tseng, MJ, Chang, NT, and Chen, WP., (2014), Multiplex PCR for molecular identification of economically important thrips, Formosan Entomologist, 34, p211-225.
- Yudin, LS, Cho, JJ, and Mitchell, WC., (1986), Host range western flower thrips, Frankiniella occidentalis(Thysanoptera: Thripidae), with special reference to Leucaena glauce, Environmental Entomology, 15, p1292-1295.
-
Zhang, C, Qi, M, Shao, Q, Zhou, S, and Fu, R., (2007), Analysis of the volatiles compounds in Ligusticum chuanxiong Hort. using HS-SPME-GC-MS, Journal of Pharmaceutical and Biomedical Analysis, 44, p464-470.
[https://doi.org/10.1016/j.jpba.2007.01.024]


