HPLC에 의한 차나무 잔가지(부산물)의 추출물 내 지표 성분의 정량분석
 ; Hyeon Jeong Im
; Hyeon Jeong Im ; Hea Seok Jeong
; Hea Seok Jeong ; Hae Jin Cho
; Hae Jin Cho ; Hyun Sim Woo
; Hyun Sim Woo ; Yu Jin Oh
; Yu Jin Oh ; Soo In Lee
; Soo In Lee ; Hyun Chul Kim
; Hyun Chul Kim ; Kyung Wan Ahn ; Yeong Su Kim
; Kyung Wan Ahn ; Yeong Su Kim ; Dae Wook Kim†
; Dae Wook Kim†
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Camellia sinensis L.(CS) is a perennial evergreen species of plant whose leaves are used to produce tea. In this plant species, the parts used are the leaves, sub-branch parts are thrown out.
Ethanol extract of sub-branch parts was used for isolation of major compounds by column chromatography. Structures were identified as caffeine (1), (-)-epicatechin (2) and (-)-epicatechin gallate (3) by interpretation of spectroscopic analysis, including 1H- and 13C-NMR. High-performance liquid chromatography (HPLC) method was used to compare the quantitative level of marker compounds in various extraction solvents of sub-branch parts of CS. The content of caffeine, (-)-epicatechin, and (-)-epicatechin gallate in 30% ethanol extract showed higher value with 3.28 ± 0.57 ㎎/g, 5.53 ± 0.88 ㎎/g, and 1.29 ± 0.24 ㎎/g, respectively.
These results indicated that not only leaves parts but also sub-branch, could be a good source for the functional material and pharmaceutical industry.
Keywords:
Camellia sinensis L., Sub-branch, Marker Compounds, HPLC, Quantitative Analysis서 언
차나무 (Camellia sinensis L.)는 동백나무과 (Theaceae)에 속하는 아열대성 상록의 다년생 식물로 열대지방에서 아열대지방까지 세계적으로 자라고 있으며, 우리나라에는 제주도를 비롯하여 전남 전 지역, 경남 하동, 진주, 울산지역 등의 일부지역에 국한되어 재배하고 생산된다 (Park, 2007). 특히, 2000년대 이후 건강에 대한 관심과 웰빙 트렌드의 영향으로 국내 녹차 소비가 확대되어 우리나라 차 문화에 대한 관심과 유행이 점점 높아지고 있다. 차나무 품종은 인도의 아샘종, 미얀마의 산종, 중국의 대엽종과 소엽종 등 네 종류로 분류되고 우리나라에는 잎이 작고 엽육이 두꺼운 소엽종이 대부분을 차지하고 있다 (Choi and Rhyu, 1992).
차나무의 잎은 4 월 초부터 5 월 하순까지 10 일 간격으로 채엽시기에 따라 우전, 세작, 중작, 및 대작으로 구분되고 시기별로 기능성 물질의 함량, 색, 맛 등의 차이를 보이고 있다 (Oh and Hong, 1995; Chung, 2004). 채집 시기가 빠른 우전의 경우 아주 어린잎을 손으로 뜯어서 수확하는 방식으로 생산량이 적으나 총 질소, 카페인 및 아미노산 등의 함량이 많아 값이 매우 비싼 것이 특징이고 반면 늦게 수확하는 대작의 경우 카테킨 함량이 많은 것으로 보고되며 대량으로 생산하기 위해 기계로 표면을 깎아서 잎과 잔가지를 분리하게 된다 (Park and Lim, 2002; Kim et al., 2004).
차나무의 잎으로 생산하는 녹차는 우수한 영양성분 뿐만 아니라 각종 약리적 성분을 지고 있으며 대표 기능성 물질인 caffeine은 주로 각성 작용, 이뇨, 강심, 피로회복 등의 약리작용을 나타내고, catechine 류와 theaflavin 류 등의 플라보노이드 물질이 함유되어 있어 녹차 특유의 떫은맛을 나타낼 뿐 아니라 항산화, 항암, 콜레스테롤 제거, 동맥경화증과 고혈압 예방, 항당뇨, 충치 예방, 환경호르몬의 체외 배설 촉진 등이 밝혀져 있다 (Goto et al., 1996; Kasaoka et al., 2002; Crespy and Williamson, 2004; Kim et al., 2006; Vermeer et al., 2008; Kim et al., 2010; Okumura et al., 2012; Kerio et al., 2013; Oda et al., 2017; Xu et al., 2018). 차나무 종자의 항균, 항박테리아 및 항종양 활성 보고와 화장품 및 식용으로도 이용되며 (Yoon et al., 2005; Jung et al., 2007; Mukherjee et al., 2011; Khan et al., 2018), 착유 후 종자 박은 비료나 가축의 사료로 사용된다 (Wee et al., 2015). 차나무 잎과 종자에 비해 그 활용도가 낮은 차나무의 뿌리와 가지에 대한 연구가 미흡한 실정이다. 본 연구는 채엽시기 발생되는 부산물 잔가지를 기능성 원료 및 의약 소재개발 가능성을 분석하기위해 지표 성분을 분리하고, HPLC를 이용하여 추출 용매별 함량을 분석하였다.
재료 및 방법
1. 기기 및 시약
Open column chromatography용 silica gel 60 (Merk, Darmstadt, Germany), sephadex LH-20 (GE Healthcar Bio-Sciences AB, Uppsala, Sweden)을 사용하였고, thin layer chromatography (TLC) plate는 Kieselgel 60 F254 (Merk, Darmstadt, Germany)를 사용하였다. 지표성분 분리, 정제 및 함량분석을 위해 recycling Prep-HPLC (JAI Ltd., Tokyo, Japan)와 Agilent 1290 Infinity II HPLC system (Aglient Technology Inc., Santa Clara, CA, USA)를 사용하였다. Recycling Prep-HPLC에 사용된 column은 JAIGEL-ODS AP (10㎛, 20 x 500㎜, JAI KOREA Co., Japan), HPLC에 사용된 column은 ZORBAX Eclipse plus C18 (5㎛, 4.6 * 150㎜, Aglient Technology Inc., Santa Clara, CA, USA)이다.
NMR spectrum은 800 MHz NMR (Bruker, Billerica, MA, USA)를 사용하여 측정하였고, NMR chemical shift value는 part per million (ppm) 단위로 나타내었다. Recycling-Prep LC 및 분석 용매는 J.T. Baker (Phillipsburg, NJ, USA)로부터 구입한 HPLC급 용매를 사용하였다. NMR용 용매는 Deuterium oxide 및 MeOD (BK Instruments Inc, Daejeon, Korea)가 사용되었고, 발색시약으로는 10% aq H2SO4를 사용하였다.
2. 물질의 분리 및 동정
본 실험에 사용된 차나무 (Camellia sinensis L.)는 2018년 6월 하동에서 재배된 차나무 1㎏을 수집하였다. 표본은 국립백두대간수목원 자원식물산업실에 보관 중이다. 채엽시기에 발생되는 잔가지 (부산물) 370 g을 50% EtOH로 추출, 여과하여 Diaion HP-20으로 엽록소를 제거하였다. 추출물을 감압 농축한 후 극성에 따라 CH2Cl2, EtOAa n-BuOH 및 water로 분획하였다. n-BuOH 분획물 12 g을 silica gel column chromatography 하였으며 용매의 극성을 높여가며 (CHCl3 – MeOH = 15 : 1→ 1 : 1, v/v) 용리하였고, 500㎖씩 분취하였다. 분취액을 TLC로 확인하여 3 개 (BU1-BU3)의 분획으로 나누었다. BU3 분획을 반복적인 Recycling Preparative-LC를 이용하여 3 종의 지표 성분을 분리하고, Sephadex LH-20으로 순도 95% 이상으로 정제하였고 이들 각각의 1H- 및 13C-NMR spectrum을 측정하여 문헌치와 비교하여 화학적 구조를 밝혔다 (Srtkowski et al., 1995; Watandabe, 1998; Kwon et al., 2002).
Caffeine (1) – 1H-NMR (800 MHz, methanol-d4+D2O) δ 3.29 (3H, s, H-1), 3.48 (3H, s, H-3), 3.95 (3H, s, H-7), 7.89 (1H, s, H-8). 13C-NMR (200 MHz, methanol-d4 + D2O) δ 27.4 (C-1), 29.4 (C-3), 33.1 (C-7), 107.4 (C-5), 143.1 (C-8), 148.3 (C-4), 151.9 (C-2), 155.5 (C-6).
(-)-epicatechine (2) – 1H-NMR (800 MHz, methanol-d4+ D2O) δ 2.73 (1H, dd, J = 2.89 and 16.8 Hz, H-4), 2.89 (1H, dd, J = 4.59 and 16.54 Hz, H-4), 4.24 (1H, tri, H-3), 4.86 (1H, s, H-2), 6.01 (1H, d, J = 2.28 Hz, H-8), 6.04 (1H, d, J = 2.28 Hz, H-6), 6.86 (1H, br-s, H-5'), 6.86 (1H, br-s, H-2'), 7.01 (1H, s, H-6'). 13C-NMR (200 MHz, methanol-d4+D2O) δ 27.8 (C-4), 65.9 (C-3), 78.9 (C-2), 94.9 (C-8), 95.5 (C-6), 99.3 (C-10), 114.2 (C-6'), 115.3 (C-5'), 118.6 (C-2'), 130.9 (C-1'), 144.1 (C-3'), 144.2 (C-4'), 155.64 (C-7), 155.79 (C-9), 156.08 (C-5).
(-)-epicatechine gallate (3) – 1H-NMR (800 MHz, methanol-d4+D2O) δ 2.89 (1H, dd, J = 1.69 and 17.76 Hz, H-4), 3.03 (1H, dd, J = 4.23 and 17.51 HZ, H-4), 5.07 (1H, s, H-2), 5.50 (1H, m, H-3), 6.08 (1H, d, J = 2.25 Hz, H-8), 6.09 (1H, d, J = 2.30 Hz, H-6), 6.80 (1H, d, J = 8.32, H-5'), 6.87 (1H, dd, J = 2.02 and 8.28 Hz, H-6'), 6.98 (2H, s, H-2", 6"), 7.00 (1H, d, J = 1.96 Hz, H-2'). 13C-NMR (200 MHz, methanol-d4 + D2O) δ 25.4 (C-4), 69.1 (C-3), 77.2 (C-2), 95.0 (C-6), 95.7 (C-8), 98.6 (C-10), 109.4 (C-2", 6"), 114.1 (C-2'), 115.4 (C-5'), 118.6 (C-6'), 120.1 (C-1"), 130.1 (C-1'), 138.5 (C-4"), 144.1 (C-4'), 144.2 (C-3'), 144.7 (C-3", 5"), 155.6 (C-9), 155.7 (C-5), 155.9 (C-7), 166.8 (C-7").
3. HPLC 분석 표준액 조제
분리한 3 종의 지표 성분 (순도 95% 이상)을 1.0㎎씩 정확히 측량하여 HPLC용 MeOH 1㎖에 녹여서 standard stock solution을 제조하였다. 이를 희석하여 25, 50, 100, 125, 250, 500, 1,000㎎/㎖ 7 구간의 농도 working standard solution을 제조하여 실험에 사용하였다.
4. 검액 조제
분쇄된 차나무 잔가지 각각 1 g을 취하여 water-ethanol 혼합물 (95%, 70%, 50%, 30% and 0%) 10㎖을 추출 용매로 사용하여 35 ± 5℃에서 2 시간 동안 초음파 추출하였다.
5. HPLC 분석조건
HPLC 이동상은 A, B 두 용액계를 사용하였다. 이동상 A용액은 0.1% formic acid 수용액이었고, B 용액은 0.1% formic acid가 함유된 MeCN을 사용하였으며 모든 용매는 사용 전 탈기 및 필터로 여과 후 사용하였다. 칼럼의 유속은 1.0㎖/min이었으며 분석 시간은 0 분에서 6 분까지 이동상 A를 95%로 용리하였고, 6 분에서 30 분까지 이동상을 B를 70%가 되도록 한 다음, 30 분에서 35 분까지 이동상을 B를 70%가 되도록 한 다음, 30 분에서 35 분까지 이동상 B를 100%가 되도록 한 다음 45 분에서 50 분까지 이동상 B를 100%로 유지하면서 분석을 실시하였다. 시료 주입은 10㎕를 주입하고, 칼럼의 온도는 40℃ 설정하고, UV는 280㎚ 파장에서 측정하였다.
6. 검량선 작성 및 검출 한계 (LOD), 정량 한계 (LQD) 측정
각 표준용액의 7 가지 농도로 확립된 HPLC 조건으로 시험을 실시하였으며 검량선은 y = ax + b (y; peak 면적, x; 시료의 농도)의 형태로 작성하였다. 각각의 표준용액 LOD (limit of detection: 검출 한계)와 LQD (limit of quantitation; 정량 한계)는 희석한 표준용액을 injection한 후, signal/noise 비율을 3과 10으로 계산하였다.
7. 통계분석
모든 측정값은 3 반복 실험한 결과의 평균과 표준편자 (mean ± SD)를 나타냈고, 각 실험군 간의 통계 분석은 SAS program (Statistical Analysis System, verson 8.1, SAS Institute Inc., Cary, NC, USA)을 이용하였다. 유의성 검증은 분산분석 (ANOVA)을 한 후 p < 0.05 수준에서 Duncan’s Multiple Range Test (DMRT) 방법으로 분석하였다.
결과 및 고찰
1. 지표물질 분리 및 동정
녹차 잎 생산 후 발생되는 부산물인 차나무 (Camellia sinensis L.) 잔가지를 50% 에탄올로 침지하여 얻어진 추출, 여과하여 감압 농축하고 농축액을 증류수로 현탁 시켜 극성별로 용매 분획한 후 n-BuOH 분획물을 silica gel, Sephadex LH-20 및 Recylcing Prep-HPLC로 column chromatography를 실시하여 3 종의 지표 성분을 분리 및 정제하였다 (Fig. 1).
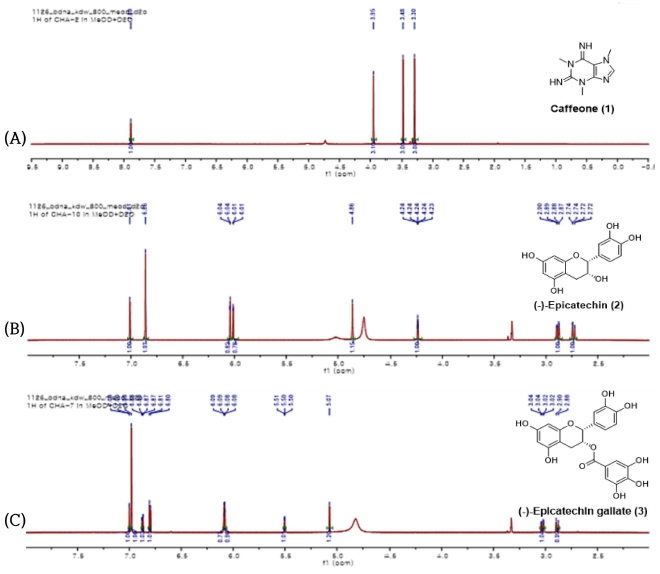
1H-NMR spectrum and structure of compounds isolated from C. sinensis L. branches. (A); caffeine, (B); (-)-Epicatechin, (C); (-)-Epicatechin gallate.
화합물 1은 1H-NMR에서 δ 3.29, 3.48, 3.95에서 3 개의 methyl singlet 피크가 존재하고 δ 7.89에서 1H의 proton이 singlet으로 나타나는 것과 13C-NMR 스펙트럼을 문헌과 비교한 결과 이 화합물은 caffeine (1)으로 확인하였다 (Srtkowski et al., 1995).
화합물 2는 1H-NMR에서 H-2 proton이 B 환에 의해 singlet로 δ 4.86에서 나타났고 δ 4.24에서 J = 2.9Hz의 triplelet로 H-3 proton이 나타나는 것으로 보아 (-)-cis catechin type 임을 보여주고 있다. 13C-NMR 스펙트럼도 이를 증명하고 있으므로 이 화합물은 (-)-epicatechin (2)으로 확인하였다.
화합물 3은 화합물 2과 유사한 signal이 관찰 되었고 δ 6.98의 2H의 singlet로 존재하는 gallate 화합물의 H가 존재함이 확인되고 13C-NMR 스펙트럼도 이를 증명하고 있으므로 이 화합물은 (-)-epicatechin gallate (3)로 동정하고, 3 가지 단일물질을 정량분석을 위한 지표물질로 이용하였다.
2. 검량선 및 검출한계, 정량한계 조사
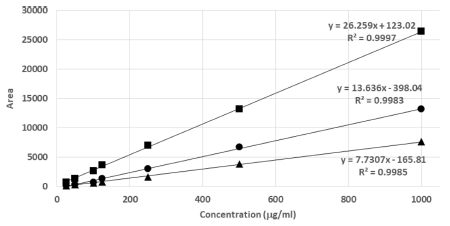
차나무 잔가지의 기능성 물질의 함량을 분석하기 위해 분리한 단일물질을 이용하여 설정된 HPLC 분석조건에서 retention time 12.2, 13.1, 및 14.6 분에서 각각 caffeine, (-)-epicatechin, 및 (-)-epicatechin gallate의 peak를 나타내었다 (Fig. 2). 3 가지 표준물질의 UV 파장에 대한 분석에서 최대 흡광 파장인 280㎚ 부근으로 측정되었고, 표준물질의 농도를 달리하여 분석한 후 y 축을 피크 면적, x 축을 표준용액의 농도 (㎎/㎖)로 하여 검량선을 작성한 결과 Fig. 3과 같다. 검량선의 상관계수 (r2) 값들은 모두 0.998 이상으로 비교적 양호한 직선성을 보였으며, 검출한계는 0.04 - 1.41㎎/㎖, 정량한계는 0.18 - 4.28㎎/㎖ 수준으로 미량의 성분을 검출과 정량이 가능함을 확인하였다 (Table 1).
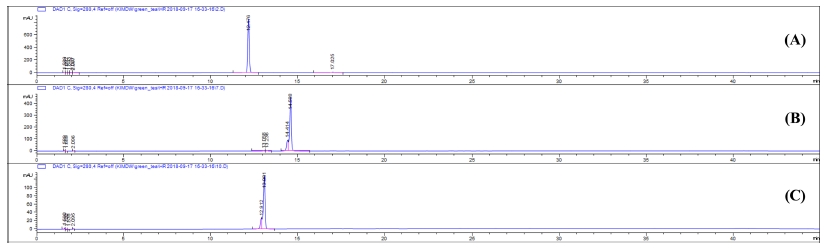
Analytical HPLC chromatogram of isolated compounds.Identification of compounds. (A); caffeine, (B); (-)-epicatechin gallate, (C); (-)-epicatechin.
3. 차나무 잔가지의 추출 조건별 지표성분 함량분석
녹차 생산 중 발생되는 부산물 (잔가지)을 바이오 식의약 분야 활용 가능성을 확인하기 위해 기능성 소재로 적용하기에 적합한 물과 에탄올을 농도별 (water; 30%, EtOH; 50% EtOH; 70% EtOH; 95% EtOH)로 추출하고 회귀직선방정식에 시험용액 시험결과로 얻어진 피크면적을 대입하여 시험용액 내에 지표성분 caffeine, (-)-epicatechin (EC), 및 (-)-epicatechin gallate (ECg)의 농도를 구하고 함량을 계산식에 대입하여 정량하였다 (Fig. 4). 추출조건에 따른 3 가지 주요성분의 전체 함량은 30% 에탄올 용매에서 10.10 ± 1.69㎎/g으로 가장 높은 함량을 나타내었으며 50% 에탄올 (8.27 ± 0.59㎎/g), 70% 에탄올 (5.58 ± 1.03㎎/g), 95% 에탄올 (1.95 ± 0.38㎎/g), 물 (1.87 ± 0.06 ㎎/g) 순으로 나타났다 (Table 2).
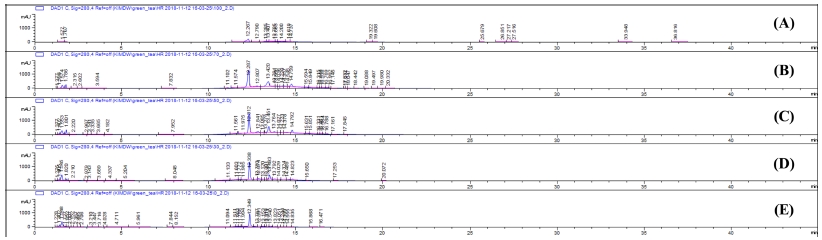
HPLC chromatogram (absorbance at 280㎚) from Camellia sinensis L. branches extracted with different solvents. (A); water, (B); 30% EtOH, (C); 50% EtOH, (D); 70% EtOH, (E); 95% EtOH.
Lee 등 (2014)은 차나무 잎의 (녹차) 수확 시기에 따라 우전, 세작, 종작 그리고 대작으로 나누어 주요성분 함량의 변화를 분석하였고, 특히 5 월 말 채엽된 대작의 주요성분 결과 caffein (26.74㎎/g), EC (12.59㎎/g), 및 ECg (39.61㎎/g)으로 보고되었으며 분석 성분의 전체 함량을 비교 하였을 때 잔가지 추출물 보다 녹차 추출물에서 약 7 배 높은 것으로 확인하였다.
Kim (1996)은 카페인이 뿌리와 종자에는 함유되어 있지 않지만, 찻잎의 경우 종자 발아 시에 생성되며, 계절별로는 봄철보다 여름철에 함량이 증가하게 된다고 보고되었으며 잔가지 (부산물) 함량 분석 결과에서는 모든 추출조건에서 카페인이 검출되는 것을 확인하였다. 게다가 물과 95% 에탄올을 비교하였을 때 caffeine의 경우 물 (0.79 ± 0.02㎎/g)보다는 에탄올 (1.63 ± 0.29㎎/g)에 2 배 정도 높게 추출되고, catechin류의 경우 에탄올 (0.32 ± 0.09㎎/g)보다는 물 (1.08 ± 0.04㎎/g)에서 약 3 배정도 높게 추출되는 것을 확인하였다.
본 연구는 차나무 잎 수확 후 발생되는 부산물 (잔가지)에 기능성 활성 성분인 caffeine, (-)-epicatechin 그리고 (-)-epicatechin gallate와 같은 생리활성 성분이 확인 되었고, 이상의 결과는 3 가지 지표성분의 추출 및 분리에 대한 기초 자료로 활용될 수 있을 것으로 생각되며 다양한 기능성 원료 및 의약품으로 개발 가능성을 확인하였다.
Acknowledgments
본 연구는 2018년 산림청(한국임업진흥원) 산림과학기술 연구개발사업(과제번호: 2018121A00-1920-AB01)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
REFERENCE
- Choi, SH, and Rhyu, MR., (1992), Analysis of theanine contents in commercial green tea, Korean Journal of Food Science and.
- Chung, DH., (2004), Components and efficacy of tea, Hongikjae, Seoul, Korea, p43-46.
- Crespy, V, and Williamson, G., (2004), A review of the health effects of green tea catechins in vivo animal models, Journal of Nutrition, 134, p3431-3440.
-
Goto, T, Yoshida, Y, Kiso, M, and Nagashima, H., (1996), Simultaneous analysis of individual catechins and caffeine in green tea, Journal of Chromatography A, 749, p295-299.
[https://doi.org/10.1016/0021-9673(96)00456-6]

-
Jung, E, Lee, J, Baek, J, Jung, K, Lee, J, Huh, S, Kim, S, Koh, J, and Park, D., (2007), Effect of Camellia japonica oil on human type I procollagen production and skin barrier function, Journal of Ethnopharmacology, 112, p127-131.
[https://doi.org/10.1016/j.jep.2007.02.012]

- Kasaoka, S, Hase, K, Morita, T, and Kiriyama, S., (2002), Green tea flavonoids inhibit the LDL oxidation in osteogenic disordered rats fed a marginal ascorbic acid in diet, Journal of Nutritional Biochemistry, 12, p96-102.
-
Kerio, LC, Wachira, FN, Wanyoko, JK, and Rotich, MK., (2013), Total polyphenols, catechin profiles and antioxidant activity of tea products from purple leaf coloured tea cultivars, Food Chemistry, 136, p1405-1413.
[https://doi.org/10.1016/j.foodchem.2012.09.066]

-
Khan, MI, Ahhmed, A, Shin, JH, Baek, JS, Kim, MY, and Kim, JD., (2018), Green tea seed isolated saponins exerts antibactieral effects against various strains of gram positive and gram negative bacteria, a comprehensive study in vitro and in vivo, Evidence-Based Complementary and Alternative Medicine, 2018, 3486106 https://www.hindawi.com/journals/ecam/2018/3486106/ (cited by 2019 Jan 31).
[https://doi.org/10.1155/2018/3486106]

- Kim, JD, Lee, BI, Jeon, YH, Bak, JP, Jin, HL, and Kim, BO., (2010), Anti-oxidative and anti-inflammatory effects of green tea mixture and dietary fiber on liver of high fat diet-induced obese rats, Korean Journal of Medicinal Crop Science, 18, p224-230.
- Kim, JT., (1996), Science and culture of tea, Borim press, Seoul, Korea, p160.
- Kim, NY, Lee, JH, and Heo, MY., (2006), Protective effects of green tea extracts on oxidative stress, Korean Journal of Medicinal Crop Science, 14, p322-328.
- Kim, SH, Han, DS, and Park, JD., (2004), Changes of some chemical compounds of Korean(Posong) green tea according to harvest periods, Korean Journal of Food Science and Technology, 36, p542-546.
- Kwon, YM, Lee, JH, and Lee, MW., (2002), Phenolic compounds from barks of Ulmus macrocarpa and Its antioxidative activities, Korean Journal of Pharmacognosy, 33, p404-410.
-
Lee, LS, Kim, SH, Kim, YB, and Kim, YC., (2014), Quantitative analysis of major constituents in green tea with different plucking periods and their antioxidant activity, Molecules, 19, p9173-9186.
[https://doi.org/10.3390/molecules19079173]

-
Mukherjee, PK, Maity, N, Nema, NK, and Sarkar, BK., (2011), Bioactive compounds from natural resources against skin aging, Phytomedicine, 19, p64-73.
[https://doi.org/10.1016/j.phymed.2011.10.003]

- Oda, Y, Hidaka, M, and Suzuki, A., (2017), Caffeine has a synergistic anticancer effect with cisplatin via inhibiting fanconi anemia group D2 protein monoubiquitination in hepatocellular carcinoma cells, Biological and Pharmaceutical Bulletin, 40, p2005-2009.
- Oh, MJ, and Hong, BH., (1995), Variation of pectin, catechins and caffein contents in Korean green tea(Camellia sinensis L.) by harvesting time and processing recipe, Korean Journal of Crop Science, 40, p775-781.
-
Okumura, T, Tsukui, T, Hosokawa, M, and Miyashita, K., (2012), Effect of caffeine and capsaicin on the blood glucose levels of obese/diabetic KK-Ay mice, Journal of Oleo Science, 61, p515-523.
[https://doi.org/10.5650/jos.61.515]

- Park, JH, and Lim, KC., (2002), Growth and constituents of tea shoots for powder green tea, Korean Journal of Medicinal Crop Science, 10, p379-383.
- Park, YG., (2007), Strategy of gene conservation of Camellia sinensis in Korea, Journal of Korean Tea Society, 13, p125-140.
- Srtkowski, J, Stefaniak, L, Nicol, L, Martin, ML, Martin, GJ, and Webb, GA., (1995), Complete assignments of the 1H, 13C and 15N NMR spectra of caffeine, Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 51, p839-841.
-
Vermeer, MA, Mulder, TP, and Molhuizen, HO., (2008), Theaflavins from black tea, especially theaflavin-3-gallate, reduce the incorporation of cholesterol into mixed micelles, Journal of Agricultural and Food Chemistry, 56, p12031-12036.
[https://doi.org/10.1021/jf8022035]

- Watandabe, M., (1998), Catechins as antioxidants from Buckwheat(Fagopyrum esculentum Moench) groats, Journal of Agricultural and Food Chemistry, 46, p839-845.
-
Wee, JH, Sung, HM, Jung, KO, Kim, SJ, Shin, YR, Park, JH, and Kim, JD., (2015), Anti-adipogenic effects of the water extracts of defatted green tea seed cake, Korean Journal of Food Science and Technology, 47, p525-533.
[https://doi.org/10.9721/kjfst.2015.47.4.525]

- Xu, J, Wang, M, Zhao, J, Wang, YH, Tang, Q, and Khan, IA., (2018), Yellow tea(Camellia sinensis L.), a promising Chinese tea: Processing, chemical constituents and health benefits, Food Research International, 107, p567-577.
- Yoon, WH, Choi, JH, Lee, KH, and Kim, CH., (2005), Antimicrobial and antitumor activities of seed extracts of Camellia sinensis L, Korean Journal of Food Science and Technology, 37, p108-112.