
소리쟁이 뿌리로부터 세포독성물질 분리 및 정제
 ; Jae Yeon Kim*
; Jae Yeon Kim* ; Nam Woo Kwon*
; Nam Woo Kwon* ; Bang Yeon Hwang**
; Bang Yeon Hwang** ; Jun Gu Kim**
; Jun Gu Kim** ; Sun Hee Woo***
; Sun Hee Woo*** ; Moon Soon Lee*, †
; Moon Soon Lee*, †
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In the present study, we identified two cytotoxic compounds from the root of Rumex crispus L. using a bioassay-based method.
Compared with the other fractions, the diethyl ether (Et2O) fraction of R. crispus root extract exhibited the strongest of 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical-scavenging effect [scavenging concentration 50% (SC50) = 63.8 ± 1.47 ㎍/㎖], nitric oxide (NO) production inhibitory effect on the mouse macrophage cell line RAW264.7 [inhibitory concentration 50% (IC50) = 60.9 ± 7.52 ㎍/㎖] and cytotoxicity effect on the human hepatoma cell line, HepG2 [lethal concentration 50% (LC50) = 115.4 ± 1.86 ㎍/㎖]. According to the bioassay-based method, two cytotoxic compounds were purified from the Et2O fraction by using column chromatography and preparative high performance liquid chromatography (prep-HPLC). These two compounds were identified as parietin and chrysophanol by using nuclear magnetic resonance (NMR) and liquid chromatography quadruple time of flight mass spectrometry (LC-QTOF-MS). In addition, both parietin and chrysophanol exhibited a cytotoxicity effect on HepG2 cells, their LC50 values were 169.1 ± 17.67 μM and 111.5 ± 6.62 μM, respectively.
Parietin and chrysophanol isolated from the Et2O fraction of the R. crispus root extract showed cytotoxicity in HepG2 cell.
Keywords:
Rumex crispus L., Chrysophanol, Cytotoxicity, HepG2, Parietin서 언
소리쟁이 (Rumex crispus L.)는 마디풀과 (Polygonaceae) 여러해살이풀로서 습지 가까이에서 자생하고 대한민국 전역에서 발견된다. 소리쟁이 뿌리는 한방에서 양제근 (羊蹄根), 우이대황 (牛耳大黃)이라 하고, 변비, 황달, 토혈 (吐血), 기능성 자궁출혈 등에 효과를 가지는 식물로, 특히 한의학 문헌에서 약용으로 버짐이나 개창 (疥瘡)과 같은 피부병 치료에 사용한다고 기재되어 있다 (Lee et al., 2007; Ko et al., 2009).
최근 연구에 의하면, 소리쟁이 뿌리에 함유된 다양한 생리 활성물질은 항염증, 항산화, 항균효과를 나타내는 것으로 알려져 있으며 (Yıldırım et al., 2001; Park et al., 2018), 특히 대장암 등의 여러 암세포에 관한 연구가 활발히 이루어지고 있다 (Bhandari and Clack, 2015). 또한 소리쟁이를 비롯한 Rumex속 식물에 대한 성분연구로는 chrysophanol 등 anthraquinone 유도체에 대한 것이 대부분이다 (Choi et al., 2004). Anthraquinone 유도체는 예로부터 천연염료나 설사약으로서 사용되어 왔으며, 생체 내 항생물질 형성의 중간체로서도 중요한 역할을 담당하고 있다 (Hwang et al., 2004). 최근 anthraquinone의 약리활성연구로는 Aspergillus versicolor로부터 분리한 anthraquinone의 항미생물효과, emodin의 대장암세포에 대한 항암효과, chrysophanol의 항염증효과 등이 있다 (Saunders et al., 2018; Wang et al., 2018).
Reactive oxygen species (ROS, 활성산소종)는 일반적인 세포의 대사를 통해 합성되는 물질로 산소가 4 개의 전자를 받으면서 H2O를 만드는 중에 생겨나는 superoxide anion (), 과산화수소 (H2O2), hydroxyl기 (-OH) 등과 같은 부산물이다 (Nho et al., 2018). 이러한 ROS들은 적은 양일 경우 체내에서 빠르게 비활성 형태로 전환되지만, 비정상적으로 많은 양이 생성될 경우 세포 구조와 기능에 심각한 손상을 입히고, 체세포 돌연변이와 종양세포를 형성한다 (Reuter et al., 2010). 또한 산화 스트레스는 DNA 손상과 DNA 돌연변이를 증가시키고, 세포의 비정상적인 증식을 유발하여, 암세포 형성과 진행을 유도한다.
염증은 병원균 침입이나 조직 손상에 의해 일어나는 선천적 면역과정으로 (Bae and Bae, 2012), 염증 초기단계에는 체내 면역체계를 활성화시키고 단시간 내에 회복되지만, 회복되는 시간이 길어지면 만성 염증단계로 넘어가 암과 같은 다양한 만성 질환을 유발한다. 염증에는 macrophage나 mast cell과 같은 백혈구에서 생성된 다양한 신호전달물질이 관여하며, 이중 macrophage는 대표적인 염증 매개물인 NO 생성에 관여한다. NO는 급성염증과 만성염증 반응에서 L-arginine으로부터 inducible nitric oxide synthase (iNOS)에 의해 과량 생성되며 염증반응을 촉진시키는 것으로 알려져 있다. 따라서 NO 생성이나 iNOS 발현 등으로 항염증 물질을 탐색하는데 지표로 사용한다 (Baek et al., 2009). NO는 혈액응고, 혈압조절 등의 기능이 있으며, 과량 존재하게 되면 인체에 유해한 영향을 미치게 되어 세포손상으로 염증이나 암 등을 야기하기도 한다 (Lowenstein et al., 1994).
암은 국내 통계청 2018년 자료에 의하면 우리나라에서 가장 높은 사망원인이며, 특히 간암은 우리나라에서 높은 유병률과 사망률을 나타내는 예후가 나쁜 악성종양으로서 진행된 상태에서 발견한 경우 대부분이 6 개월 이내에 사망하며 효과적인 치료와 생존기간 향상을 위해 조기진단은 매우 중요하다 (Ahn et al., 2001). 이에 개똥쑥 추출물의 HepG2 세포 (Kim et al., 2016a)와 Hep3B 세포 (Kim et al., 2016b)에 대한 apoptosis 효과, 오미자 추출물의 SNU-398 세포 증식억제 효과 (Rho and Oh, 2002) 등 다양한 천연물로부터 간암세포에 대한 독성물질을 찾는 연구가 활발히 진행되고 있다.
본 연구에서는 국내 자생식물인 소리쟁이의 뿌리로부터 항암활성물질을 분리하기 위하여, 추출물과 각 용매 분획별의 DPPH assay와 NO assay를 진행하였고, 간암세포주 HepG2를 이용하여 세포독성효과를 확인하였다. 또한 활성분획으로부터 column chromatography와 HPLC, prep-HPLC를 이용하여 물질을 분리한 후, NMR과 LC-QTOF-MS를 통해 구조를 동정하였다.
재료 및 방법
1. 실험 재료
본 실험에서 사용한 소리쟁이 (Rumex crispus L.)의 뿌리는 2017년 6월에 충정북도 청주시 분평동 미평천 일대에 자생하는 것을 채취하여, 세척 및 건조한 다음 1 - 2 ㎝ 정도로 절단하여 실험에 사용하였다.
2. 추출 및 분획
건조한 소리쟁이 뿌리 시료 (1.5㎏)를 세절한 후 70% ethanol (EtOH)을 추출용매로 상온에서 2 주씩 3 회 반복하여 추출하였다. 추출액은 여과와 농축 및 건조하여 400 g (26.7%)의 추출물을 얻었다. 이 중 일부를 증류수에 분산시킨 후 diethyl ether (Et2O), ethyl acetate (EtOAc), n-butanol (n-BuOH)을 사용하여 순차적으로 용매분획을 실시하였다.
분획된 시료는 여과와 농축 및 건조 후 추출물과 함께 4℃ 이하로 냉장 보관하면서 실험에 사용하였으며, 분획 수율은 Et2O, EtOAc, n-BuOH 및 물층에서 각각 5% (20 g), 6.75% (27 g), 20% (80 g) 및 60.75% (243 g)로 나타났다.
3. DPPH free radical 소거활성 측정
소리쟁이 뿌리 추출물과 각 분획물의 항산화활성을 비교하기 위하여 DPPH (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하여 free radical 소거활성을 측정하였다 (Blois, 1958).
각 시료를 methanol에 12.5 - 500 ㎍/㎖의 다양한 농도로 용해시킨 시료액 100 ㎕와 200 μM로 용해시킨 DPPH 용액 100 ㎕를 혼합하여 30 분간 실온에서 방치한 후 microplate reader (Bio-Rad, Hercules, CA, USA)를 사용하여 520 ㎚에서 흡광도를 측정하였다. DPPH free radical을 50% 소거하는 시료의 농도 (SC50)를 확인하였으며, 대조군으로는 ascorbic acid를 사용하였다.
(A0=DPPH 용액의 흡광도, A1= DPPH 용액과 시료 반응액의 흡광도)
4. 세포배양
마우스 대식세포주인 RAW264.7은 American Type Culture Collection (ATCC, Rockville, MD, USA)로부터 구입하여 사용하였다. RAW264.7 세포는 10% fetal bovine serum (FBS, Seradigm, Radnor, PA, USA), 1% penicillin-streptomycin (Sigma-Aldrich Co., St Louis, MO, USA)를 첨가한 Dulbecco’s modified eagle’s medium (DMEM, GibcoTM, Thermo Fisher Scientific Inc., Waltham, MA, USA)을 이용하여 5% CO2 incubator에서 배양하였다. 간암세포주인 HepG2 세포는 Korean Cell Line Bank (KCLB, Seoul, Korea)로부터 구입하여 사용하였으며, RPMI 1640 (GibcoTM, Thermo Fisher Scientific Inc., Waltham, MA, USA) 배지에 10% FBS와 1% penicillin-streptomycin를 혼합한 배지를 사용하여 5% CO2 incubator에서 배양하였다.
5. Nitric oxide (NO) 생성 억제활성 측정
RAW 264.7 세포를 96 well plate에 2.0 × 105 cells/㎖ 분주한 다음, 5% CO2, 37℃에서 배양하여 사용하였다. 분주한 세포에 각 시료를 dimethyl sulfoxide (DMSO, Sigma-Aldrich Co., St Louis, MO, USA)에 12.5 - 500㎍/㎖의 다양한 농도로 용해시키고 1 ㎕ 처리하여 24 시간 동안 배양하였다. 그 후 배지에서 생성된 NO를 Griess reagent system (Promega, Madison, WI, USA)에 따른 NO colorimetric assay로 분석하였다 (Amano and Noda, 1995).
NO 생성 억제율 (I)은 다음과 같이 계산하였다.
(B0= LPS 처리군 흡광도, B1= LPS와 샘플 처리군 흡광도)
또한 세포 생존율은 well 당 10㎕의 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT, Sigma-Aldrich Co., St Louis, MO, USA) 시약을 처리한 후 6 시간 뒤 생성된 formazan을 DMSO에 녹인 후, microplate reader로 520 ㎚에서 흡광도를 측정하였다.
6. MTT assay에 의한 세포독성의 측정
소리쟁이 뿌리 추출물과 분획물 그리고 compound I과 II의 세포독성은 MTT assay에 의해 측정하였다 (Gerlier and Thomasset, 1986). 세포독성 시험에 사용된 HepG2 세포는 37℃, 5% CO2 조건에서 RPMI 배지에 96 well plate에 1.5 × 105 cells/㎖의 농도로 분주하고 24 시간 배양하여 부착 및 안정화시킨 후, 농도별로 희석한 시료를 처리하여 24 시간 동안 배양하였다. DMSO에 용해시켜 제조한 5 ㎎/㎖ MTT 용액을 각 well에 10 ㎕씩 가하고, 37℃, 5% CO2 조건에서 6 시간 동안 반응시켜 formazan으로 환원되도록 하였다. 배지를 제거한 후 각 well에 200 ㎕의 DMSO를 첨가하여 생성된 formazan을 용해시켜 520 ㎚에서 흡광도를 측정하였으며, 시료액 대신 DMSO를 사용한 blank의 흡광도를 기준으로 세포생존율을 산출하였다.
7. 화합물의 분리 및 정제
소리쟁이 Et2O 분획을 Diaion HP-20 컬럼을 이용하여 고분자물질을 제거하였다. 컬럼 용출물을 농축한 다음 silicagel column chromatography (Φ5 × 40 ㎝, chloroform : methanol : water = 90 : 10 : 1)을 실시하여 29 개의 분획물을 얻었다 (ES1 - ES29). 그 중 ES1 - ES4의 분획을 재결정하여 황색 결정 (29.4 ㎎)을 분리하였다. 이를 prep-HPLC (Waters Co., Milford, MA, USA)를 통하여 2 개의 물질 compound I과 II를 분리, 정제하였다 (Table 1).
8. 구조 동정
Compound I과 II의 구조는 NMR (Bruker Biospin, Billerica, MA, USA)과 LC-QTOF-MS (Bruker Biospin, Billerica, MA, USA)를 이용하여 동정하였다. 구조는 각각 중수소 chloroform (CDCl3)에 용해시켜 1H-NMR (400 MHz)과 13C-NMR (100 MHz) 스펙트럼을 통해 확인하고, 분자식과 분자량은 compound I과 II를 1㎍/㎖의 농도가 되도록 methanol로 희석하여 LC-QTOF-MS를 통해 확인하였다 (Table 2).
Compound I − orange amorphous powder, 1H-NMR (CDCl3); δ = 2.38 (3H, 3-CH3, s), 3.87 (3H, 6-OCH3, s), 6.70 (1H, H-7, d, J = 2.5 Hz), 7.09 (1H, H-2, d, J = 1.0 Hz), 7.38 (1H, H-5, d, J = 2.7 Hz), 7.64 (1H, H-4, d, J = 1.1 Hz), 12.06 (1H, 1-OH, s), 12.26 (1H, 8-OH, s). 13C-NMR (CDCl3); 162.5 (C-1), 124.5 (C-2), 148.5 (C-3), 121.3 (C-4), 108.3 (C-5), 166.6 (C-6), 106.8 (C-7), 165.5 (C-8), 190.8 (C-9), 182.1 (C-10), 135.3 (C-11), 110.3 (C-12), 113.7 (C-13), 133.2 (C-14), 56.1 (6-OCH3), 22.2 (3-CH3), ESI-MS’ m/z (rel. int.) = 284.07 [M+]
Compound II − Yellow crystals, 1H-NMR (CDCl3); 7.38 (1H, H-5, dd, J = 1, 7.5 Hz), 7.61 (1H, H-6, dd, J = 7.6, 8.4 Hz), 7.60 (1H, H-4, d, J = 1.1 Hz), 7.24 (1H, H-7, dd, J = 1.2, 8.4 Hz), 7.04 (1H, H-2, d, J = 1 Hz), 2.40 (3H, 3-CH3, s), 12.0 (1H, 1-OH, s), 12.1 (1H, 8-OH, s). 13C-NMR (CDCl3); 162.5 (C-1), 124.4 (C-2), 149.4 (C-3), 121.4 (C-4), 120.0 (C-5), 137.0 (C-6), 124.6 (C-7), 162.8 (C-8), 192.6 (C-9), 182.1 (C-10), 133.7 (C-11), 115.9 (C-12), 113.8 (C-13), 133.3 (C-14), 22.3 (3-CH3), ESI-MS m/z (rel. int.) = 254.06 [M+]
9. 통계처리
모든 측정값은 3 회 이상 반복 실험한 결과의 평균값과 표준오차 (mean ± standard error)로 표시하였다. 실험에서 얻어진 결과의 통계적 유의성은 windows용 SPSS 12.0 (SPSS Inc., Chicago, IL, USA)을 이용하였고, 유의적 차이가 있는 항목은 p < 0.05 수준에서 One-way ANOVA를 실시하였으며, Duncan’s Multiple Range Test (DMRT)로 그 유의성을 검정하였다.
결과 및 고찰
1. DPPH free radical 소거효과
소리쟁이 (Rumex crispus L.) 뿌리 추출물 및 분획물의 DPPH free radical 소거활성은 Fig. 1과 같다. 뿌리 추출물은 농도 의존적으로 소거활성이 증가하였으며, 분획물은 Et2O층, EtOAc층, 물층, n-BuOH층의 순으로 높은 활성을 보였다 (Fig. 1A). 가장 높은 활성을 보인 Et2O층은 200 ㎍/㎖ 농도에서 78.4%의 소거활성을 나타내었다 (Fig. 1B). SC50은 추출물에서 240.9 ± 5.67 ㎍/㎖이었으며, 추출분획 Et2O층, EtOAc층, n-BuOH층 및 물층에서 각각 63.8 ± 1.47, 97.4 ± 1.82, 169.6 ± 4.15 및 163.2 ± 2.07 ㎍/㎖로서 Et2O층이 다른 분획에 비해 상대적으로 적은 양에서 50%의 소거활성을 나타내었다.
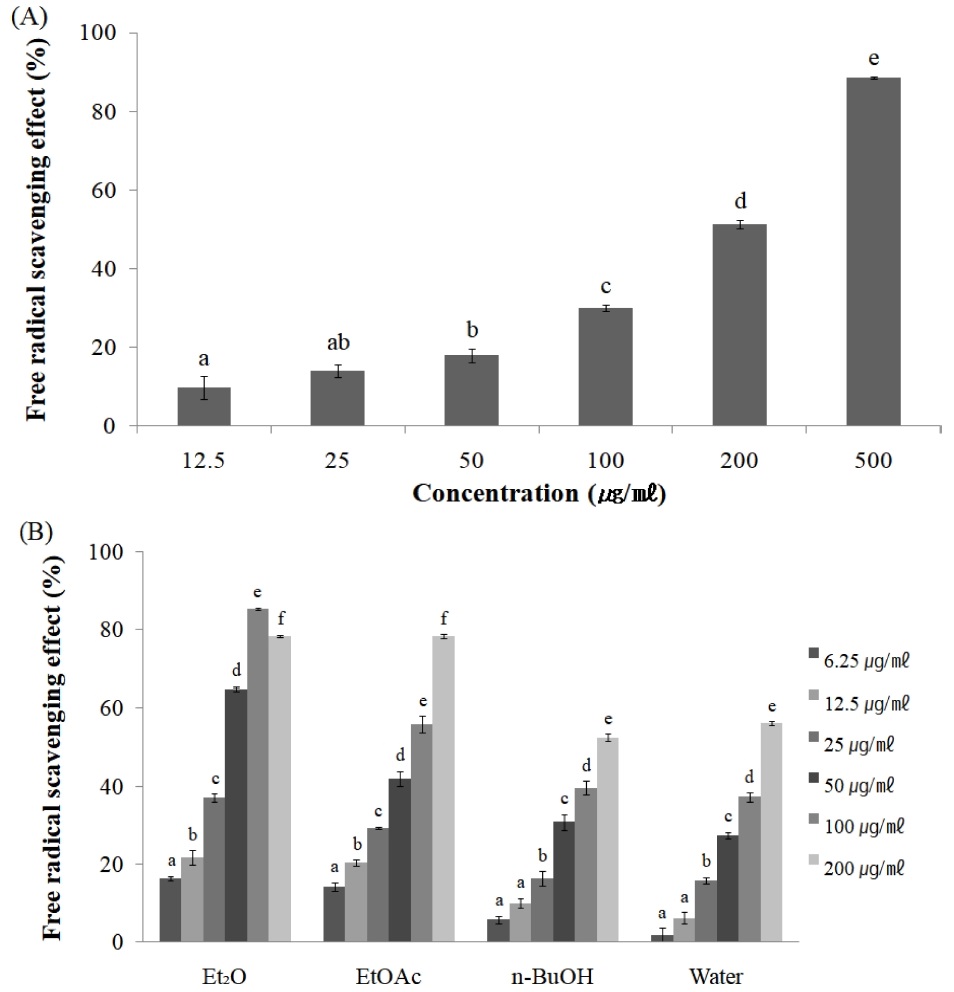
DPPH free radical scavenging effect of EtOH extract (A) and solvent fractions (B) from R. crispus root. Mean values ± SE from triplicate separated experiments are shown. *Mean within a column followed by same letter are not significant based on the Duncan's Multiple Range Test (DMRT) (p < 0.05). Et2O, diethyl ether fraction; EtOAc, ethyl acetate fraction; n-BuOH, n-butanol fraction.
항산화 활성은 일반적으로 polyphenol 성분의 함량이 높은 극성분획에서 free radical 소거효과도 우수한 경향이 있다고 보고되고 있으며 (Anagnostopoulou et al., 2006), 소리쟁이 동속 식물의 선행연구에서 참소리쟁이 (Rumex japonicus) 지상부의 EtOAc 분획 (Elzaawley et al., 2005), 애기수영 (R. acetocella) 잎의 n-BuOH 분획 (Baig et al., 2011)과 같은 극성분획의 DPPH 소거능이 좋았다는 보고와는 달리, 비극성 분획에서 높은 활성이 나온 것으로 보아, 카로테노이드, lycopene 등과 같은 지용성 항산화물질이 함유되어 있는 것으로 사료된다 (Krinsky, 1989; Sies and Stahl, 1998).
2. NO 생성 억제효과
본 연구에서 항염증활성을 비교하기 위해 RAW264.7 세포에 NO 유도물질인 LPS를 처리한 다음 소리쟁이 뿌리 추출물 및 분획물을 농도별로 처리하여 LPS에 의한 NO 생성억제량을 측정하였다 (Fig. 2).
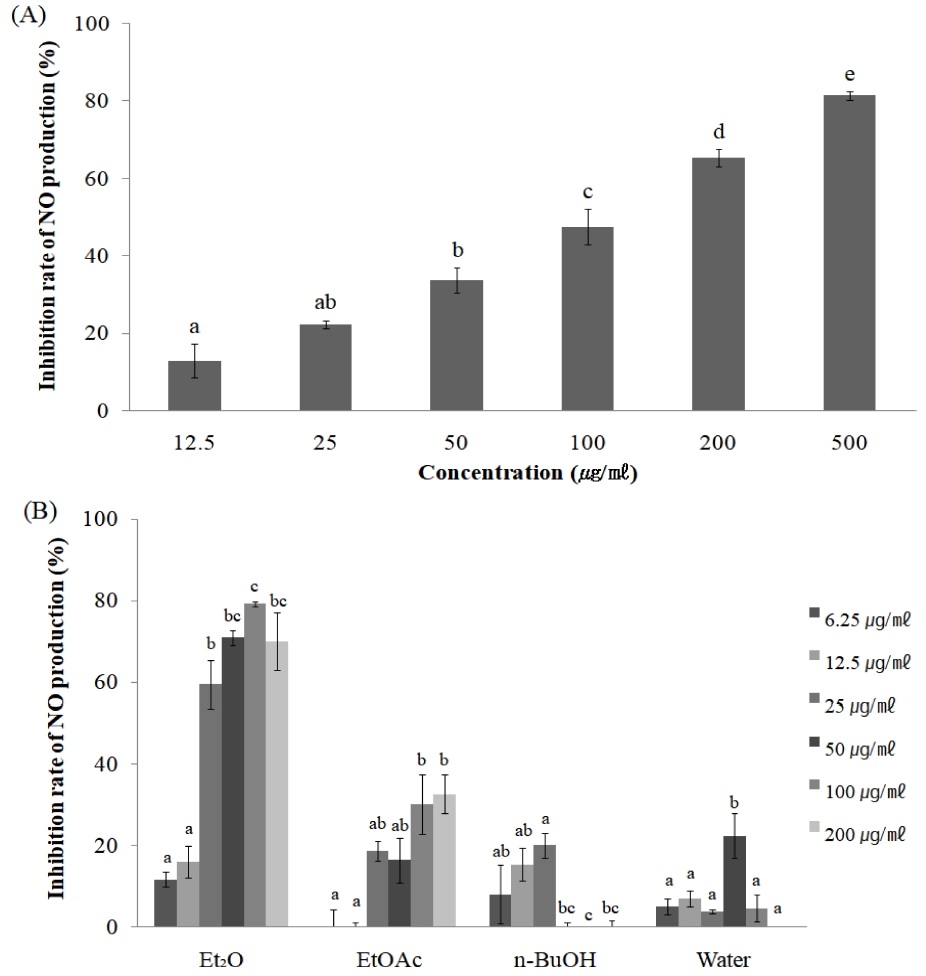
Inhibitory effects of NO production in LPS-induced RAW264.7 cells by the EtOH extract (A) and solvent fraction (B) of R. crispus root. Mean values ± SE from triplicate separated experiments are shown. *Mean within a column followed by same letter are not significant based on the Duncan's Multiple Range Test (DMRT) (p < 0.05). Et2O, diethyl ether fraction; EtOAc, ethyl acetate fraction; n-BuOH, n-butanol fraction.
추출물은 농도 의존적으로 NO 생성억제효과를 보였으며, 특히 500 ㎍/㎖에서 81.4%의 효과를 보였고, IC50은 197.7 ± 5.46 ㎍/㎖로 나타났다 (Fig. 2A). 또한 추출분획은 200 ㎍/㎖ 농도에서 Et2O층, EtOAc층은 각각 70% (IC50= 60.9 ± 7.52 ㎍/㎖), 32.8% (IC50= 270.3 ± 60.69 ㎍/㎖)을 나타내었으나, n-BuOH층과 물층에서는 유의한 억제효과를 나타내지 않았다 (Fig. 2B). 추가적으로 시료의 NO 생성억제효과가 세포독성에 의한 위양성 효과인지를 확인하기 위해 각 시료를 농도별로 RAW264.7 세포를 이용하여 MTT assay로 생존율을 확인하였을 때 모두에서 세포독성은 인정되지 않았다.
선행연구에 의하면, Rumex crispus 잎의 에탄올 추출물이 LPS를 처리한 RAW264.7 세포의 NO 생성과 iNOS, COX-2의 발현을 저해한다는 보고가 있으며 (Im et al., 2014), 동속 식물의 선행연구로는 R. nepalensis 뿌리의 chloroform분획과 EtOAc분획이 COX-1, COX-2를 저해하여 항염증 효과를 나타낸다는 보고가 있으며, R. abyssinicus 뿌리의 메탄올 추출물이 in vivo 상에서 incision wound model 마우스를 이용하여 염증회복효과가 있음을 확인하였다 (Gautam et al., 2010; Mulisa et al., 2015). 따라서 본 연구도 Et2O층과 EtOAc층이 iNOS, COX-2과 같은 염증 관련 유전자의 발현을 저해하여 항염증활성을 보일 것으로 사료된다.
추출물을 용매분획하면 분획에 따라 항산화와 항염증 활성이 다양하게 나타난다. 본 연구를 통하여 소리쟁이 뿌리 추출물의 Et2O층에서 항산화와 항염증 활성이 높은 것으로 확인되었다.
3. HepG2에서의 세포독성
간암에 대한 항암효과를 검토하기 위하여 인체 유래 간암세포주 HepG2를 선택하여 MTT assay에 의한 세포독성을 살펴본 결과는 Fig. 3과 같다.
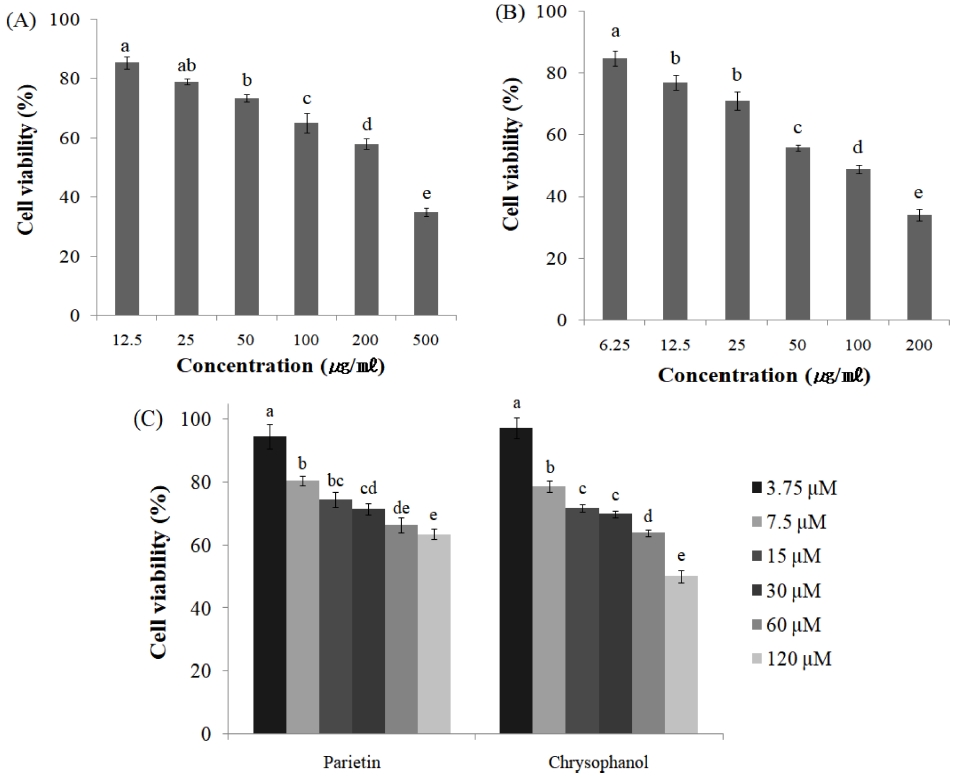
Cell viabilities of HepG2 cells treated with EtOH extract (A), Et2O fraction (B) and parietin, chrysophanol (C) of R. crispus root. Mean values ± SE from triplicate separated experiments are shown. *Mean within a column followed by same letter are not significant based on the Duncan's Multiple Range Test (DMRT) (p < 0.05).
소리쟁이 뿌리 추출물을 각 세포에 12.5, 25, 50, 100, 200 및 500 ㎍/㎖의 농도로 증가시킬 때 간암세포주인 HepG2에서 각각 85.5%, 79.0%, 73.5%, 65.2%, 58.1% 및 35.0%의 세포생존율을 보였으며 (Fig. 3A), 항산화활성과 항염증활성을 보인 Et2O층의 HepG2에 대한 암세포 생존율을 분석한 결과, 6.25, 12.5, 25, 50, 100 및 200 ㎍/㎖의 농도에서 각각 84.7%, 76.9%, 71.0%, 55.8%, 48.9% 및 34.1%의 세포생존율을 보였다 (Fig. 3B). 이는 추출물과 Et2O 분획물 모두 무처리구에 비해 처리농도가 증가할수록 세포생존율이 떨어지는 것으로 나타나 암세포의 생육저해가 일어나고 있음을 유추할 수 있었다.
이상의 결과로부터 간암세포 HepG2에 대한 암세포 억제활성은 소리쟁이 70% ethanol 추출물에서 농도 의존적으로 억제활성을 나타내었고, 특히 Et2O 분획 층에서 처리농도에 관계없이 34.1 - 84.7%의 높은 억제활성을 나타내어 소리쟁이 추출물의 Et2O층이 매우 유효한 억제능력을 보인 것으로 평가하였다. 또한 선행연구에 의하면, Rumex acetosa의 지상부로부터 분리한 parietin, emodin과 같은 anthraquinone 유도체가 A549, SK-OV-3, SK-MEL-2 등 5 가지의 인간유래 암세포에 대해 항암활성을 보였다는 보고가 있으며 (Lee et al., 2005), 참소리쟁이 (R. japonicus) 뿌리로부터 분리한 physcion 8-O-β-glucopyranoside는 apoptosis 유도를 통한 A549세포 증식억제효과를 나타낸다는 보고된 바 있다 (Xie and Yang, 2014). 따라서 본 연구에서도 Et2O층에 다양한 anthraquinone 유도체가 함유되어 항암활성을 나타낼 것이라 사료된다.
Et2O층에서 분리한 parietin과 chrysophanol의 HepG2에 대한 암세포 생존율을 분석한 결과, parietin은 3.75, 7.5, 15, 30, 60, 120 μM의 농도에서 각각 94.6%, 80.4%, 74.4%, 71.6%, 66.4%, 63.5%의 세포생존율을 보였으며, LC50은 169.1 ± 17.67 μM로 나타났다 (Fig. 3C). 또한 chrysophanol은 3.75, 7.5, 15, 30, 60, 120 μM의 농도에서 각각 97.3%, 78.7%, 71.9%, 69.9%, 63.9%, 50.2%의 세포생존율을 보였으며, LC50은 111.5 ± 6.62 μM로 나타났다 (Fig. 3C).
4. Compound I과 compound II 구조 동정
앞의 결과를 바탕으로 소리쟁이 분획물 중 항암활성으로 유효한 Et2O 분획에서 compound I과 compound II를 분리하였다.
Compound I은 오렌지색 무정형 결정으로 1H-NMR 결과 6.70, 7.09, 7.38, 7.64 ppm에서 방향족 고리에 직접 결합한 수소, 12.06 ppm과 12.26 ppm에서 anthraquinone의 1 번 탄소와 8 번 탄소에 결합한 hydroxyl group의 수소, 2.38 ppm과 3.87 ppm에서 각각 3 번 탄소와 6 번 탄소에 치환된 methyl group과 methoxyl group의 수소가 관측되고, 13C-NMR 결과 106.8 - 166.55 ppm에서 방향족 고리의 탄소, 182.1 ppm과 190.8 ppm은 carbonyl group의 탄소, 그리고 22.1 ppm과 56.1 ppm에서 methyl group과 methoxyl group의 탄소가 각각 관측되었다 (Table 3).
또한 LC-QTOF-MS의 high resolution mass spectrum (HR-MS)을 이론값과의 오차정도와 isotope 패턴 등을 참고하여 compound I의 분자식이 C16H12O5 (M.W. = 284.07)임을 확인하였다 (Fig. 4). 이들 proton signal의 chemical shift 및 coupling constant 값의 비교분석과 기존 문헌의 data를 비교한 결과 compound I의 구조는 Fig. 4와 같은 parietin (6-methoxy-3-methyl-1,8-dihydroxyanthraquinone)으로 동정하였다 (Danielsen et al., 1992).
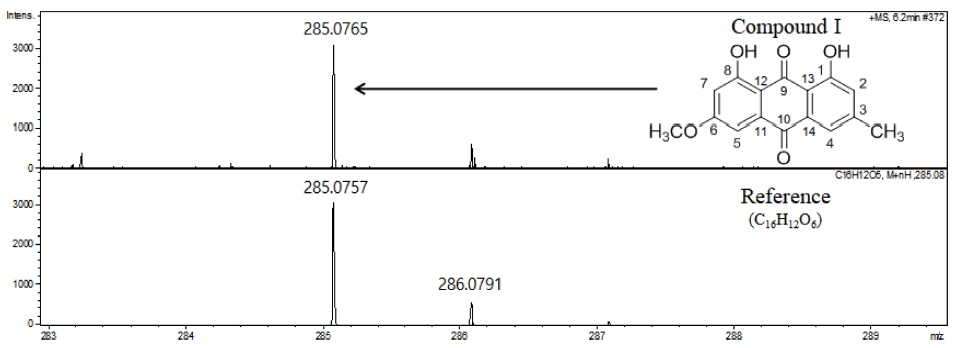
High resolution mass spectrum of compound I. HR-MS data was measured by LC-QTOF-MS. ESI-MS; m/z (rel. int.) = 284.07 [M+].
Compound II는 황색의 결정으로 1H-NMR 결과 7.09 ppm - 7.60 ppm에서 방향족 고리의 수소, 11.9 ppm과 12.1 ppm에서 1 번과 8 번 hydroxyl group의 수소, 2.40 ppm에서 3 번 탄소에 치환된 methyl group의 수소가 관측되고, 13C-NMR 결과 113.7 - 162.7 ppm에서 방향족 고리의 탄소, 182.1 ppm과 192.6 ppm에서 carbonyl group 탄소, 22.3 ppm은 3 번 탄소에 치환된 methyl group의 탄소가 각각 관측되었다 (Table 4). 또한 LC-QTOF-MS의 HR-MS data를 이론값과의 오차정도와 isotope 패턴 등을 참고하여 compound II의 분자식이 C15H10O4 (M.W. = 254.06)을 확인하였다 (Fig. 5). 이들 proton signal의 chemical shift 및 coupling constant 값의 비교분석과 기존 문헌의 data를 비교한 결과 compound II의 구조는 Fig. 5와 같은 chrysophanol (3-methyl-1,8-dihydroxyanthraquinone)로 동정하였다 (Danielsen et al., 1992).
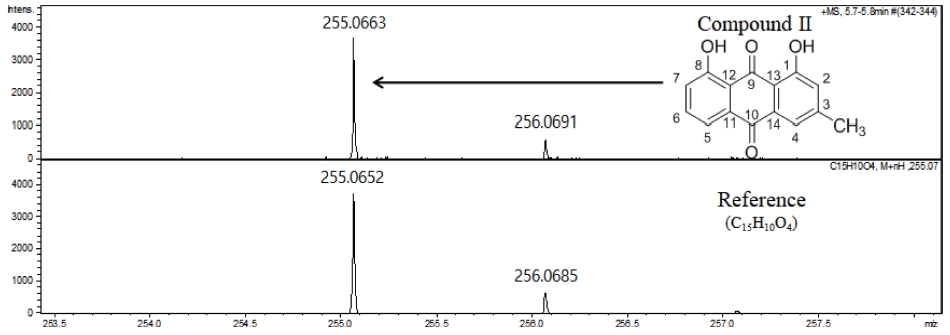
High resolution mass spectrum of compound II. HR-MS data was measured by LC-QTOF-MS. ESI-MS; m/z (rel. int.) = 254.06 [M+].
이상의 결과를 종합하면, 본 연구에서는 소리쟁이 뿌리 EtOH 추출물의 활성분획 Et2O층으로부터 column chromatography, prep-HPLC, NMR, LC-QTOF-MS를 통해 2 개의 유효물질 parietin과 chrysophanol을 얻어냈다.
두 물질의 선행 연구를 보면, 이끼류와 대황에서 발견되는 오렌지 색소인 parietin (physcion)이 독성 없이 인간 백혈병 세포의 성장을 늦추고 죽일 수 있으며, 생쥐에 이식된 폐 및 두경부 종양에서 유래된 인간 암 세포주의 성장을 억제한다고 보고된 바 있다 (Lin et al., 2005). Anthraquinone 유도체인 chrysophanol은 rat hepatocytes (Kågedal et al., 1990)와 human leukemia HL-60 세포 (Ueno et al., 1995)에서 apoptosis를 포함한 세포독성 효과를 유발하지 않는다고 보고된 바 있지만, 간암세포인 J5 cell (Lu et al., 2010), 폐암세포인 A549 cell (Ni et al., 2014)에 처리하면 apoptosis가 아닌 necrosis와 관련된 기전에 의해 암세포의 사멸을 유도한다고 보고된 바 있다. 이에 두 물질이 간암세포 HepG2 세포억제활성에 깊은 관련이 있다고 유추된다. 또한 본 연구는 간암세포에 대한 항암물질연구의 기초자료가 될 것이며, 더 나아가 간암에 대한 천연물 항암제 개발에 기여될 것이라 사료된다.
References
- Ahn, SH, Han, KH, Yoon, YH, Hong, SP, Paik, YH, Chon, CY, Moon, YM, Song, KJ, Kim, DK, and Suh, I., (2001), Risk factors for hepatocellular carcinoma in Korea, Korean Journal of Medicine, 60, p123-130.
- Amano, F, and Noda, T., (1995), Improved detection of nitric oxide radical(NO·) production in an activated macrophage culture with a radical scavenger, carboxy PTIO, and griess reagent, FEBS letters, 368, p425-428.
-
Anagnostopoulou, MA, Kelfalas, P, Papageorgiou, VP, Assimopoulou, AN, and Boskou, D., (2006), Radical scavenging activity of various extracts and fractions of sweet orange peel(Citrus sinensis), Food Chemistry, 94, p19-25.
[https://doi.org/10.1016/j.foodchem.2004.09.047]

-
Bae, GC, and Bae, DY., (2012), The anti-inflammatory effects of ethanol extract of Allium Hookeri cultivated in South Korea, Korean Journal of Herbology, 27, p55-61.
[https://doi.org/10.6116/kjh.2012.27.6.55]

- Baek, S, Choi, JH, Ko, SH, Lee, YJ, Cha, DS, Park, EY, Kang, YG, and Jeon, H., (2009), Antioxidant and anti-inflammatory effect of Nardostachys chinensis in IFN-γ/LPS-stimulated peritoneal macrophage, Korean Journal of Oriental Physiology and Pathology, 23, p853-859.
- Baig, H, Ahmed, D, Zara, S, Aujla, MI, and Asghar, MN., (2011), In vitro evaluation of antioxidant properties of different solvent extracts of Rumex acetosella leaves, Oriental Journal of Chemistry, 27, p1509-1516.
- Bhandari, M, and Clack, B., (2015), Extraction of anti-cancer water soluble compounds from Rumex crispus, The FASEB Journal, 29(supplement1), 897.30 https://www.fasebj.org/doi/abs/10.1096/fasebj.29.1_supplement.897.30 (cited by 2018 July 20).
-
Blois, MS., (1958), Antioxidant determinations by the use of a stable free radical, Nature, 181, p1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Choi, GJ, Lee, SW, Jang, KS, Kim, JS, Cho, KY, and Kim, JC., (2004), Effects of chrysophanol, parietin, and nepodin of Rumex crispus on barley and cucumber powdery mildews, Crop Protection, 23, p1215-1221.
[https://doi.org/10.1016/j.cropro.2004.05.005]

-
Danielsen, K, Aksnes, DW, and Francis, GW., (1992), NMR study of some anthraquinones from rhubarb, Magnetic Resonance in Chemistry, 30, p359-360.
[https://doi.org/10.1002/mrc.1260300414]

-
Elzaawely, AA, Xuan, TD, and Tawata, S., (2005), Antioxidant and antibacterial activities of Rumex japonicus HOUTT. aerial parts, Biological and Pharmaceutical Bulletin, 28, p2225-2230.
[https://doi.org/10.1248/bpb.28.2225]

-
Gautam, R, Karkhile, KV, Bhutani, KK, and Jachak, SM., (2010), Anti-inflammatory, cyclooxygenase(COX)-2, COX-1 inhibitory, and free radical scavenging effects of Rumex nepalensis, Planta medica, 76, p1564-1569.
[https://doi.org/10.1055/s-0030-1249779]

-
Gerlier, D, and Thomasset, N., (1986), Use of MTT colorimetric assay to measure cell activation, Journal of Immunological Methods, 94, p57-63.
[https://doi.org/10.1016/0022-1759(86)90215-2]

- Hwang, SW, Ha, TJ, Lee, JR, Lee, J, Nam, SH, Park, KH, and Yang, MS., (2004), Isolation of anthraquinone derivatives from the root of Rumex japonicus H, Journal of Applied Biological Chemistry, 47, p274-278.
- Im, NK, Jung, YS, Choi, JH, Yu, MH, and Jeong, GS., (2014), Inhibitory effect of the leaves of Rumex crispus L. on LPS-induced nitric oxide production and the expression of iNOS and COX-2 in macrophages, Natural Product Sciences, 20, p51-57.
- Kim, BM, Kim, GT, Kim, EJ, Lim, EG, Kim, SY, and Kim, YM., (2016a), Extract from Artemisia annua Linné induces apoptosis through the mitochondrial signaling pathway in HepG2 cells, Journal of the Korean Society of Food Science and Nutrition, 45, p1708-1716.
- Kim, EJ, Kim, GT, Kim, BM, Lim, EG, Ha, SH, Kim, SY, and Kim, YM., (2016b), Apoptotic effect of extract from Artemisia annua Linné by Akt/mTOR/GSK-3β signal pathway in Hep3B human hepatoma cells, Journal of Life Science, 26, p764-771.
- Ko, SK, Kim, YC, Kim, JS, Kim, CM, Ro, JS, Moon, YH, Park, JH, Seo, EK, Sung, HK, Shin, SW, Yang, KS, Oh, OJ, Woo, ER, Lee, SK, Lee, SH, Lee, JK, Lim, DS, Lim, JP, Chung, SR, Hong, SH, and Hwang, WK., (2009), General medicinal botany, Hakchangsa, Seoul, Korea, p153.
-
Krinsky, NI., (1989), Antioxidant functions of carotenoids, Free Radical Biology and Medicine, 7, p617-635.
[https://doi.org/10.1016/0891-5849(89)90143-3]

-
Lee, NJ, Choi, JH, Koo, BS, Ryu, SY, Han, YH, Lee, SI, and Lee, DU., (2005), Antimutagenicity and cytotoxicity of the constituents from the aerial parts of Rumex acetosa, Biological and Pharmaceutical Bulletin, 28, p2158-2161.
[https://doi.org/10.1248/bpb.28.2158]

- Lee, SS, Kim, DH, Yim, DS, and Lee, SY., (2007), Anti-inflammatory, analgesic and hepatoprotective effect of semen of Rumex crispus, Korean Journal of Pharmacognosy, 38, p334-338.
-
Lin, R, Elf, S, Shan, C, Kang, HB, Ji, Q, Zhou, L, Hitosugi, T, Zhang, L, Zhang, S, Seo, JH, Xie, J, Tucker, M, Gu, TL, Sudderth, J, Jiang, L, Mitsche, M, de Berardinis, RJ, Wu, S, Li, Y, Mao, H, Chen, PR, Wang, D, Chen, GZ, Hurwitz, SJ, Lonial, S, Khoury, HJ, Arellano, ML, Khuri, FR, Lee, BH, Lei, Q, Brat, DJ, Ye, K, Boggon, TJ, He, C, Kang, SM, Fan, J, and Chen, J., (2015), 6-phosphogluconate dehydrogenase links oxidative PPP, lipogenesis and tumour growth by inhibiting LKB1-AMPK signaling, Nature Cell Biology, 17, p1484-1496.
[https://doi.org/10.1038/ncb3255]

-
Lowenstein, CJ, Dinerman, JL, and Snyder, SH., (1994), Nitric oxide: A physiologic messenger, Annals of Internal Medicine, 120, p227-237.
[https://doi.org/10.7326/0003-4819-120-3-199402010-00009]

-
Lu, CC, Yang, JS, Huang, AC, Hsia, TC, Chou, ST, Kuo, CL, Lu, HF, Lee, TH, Wood, WG, and Chung, JG., (2010), Chrysophanol induces necrosis through the production of ROS and alteration of ATP levels in J5 human liver cancer cells, Molecular Nutrition and Food Research, 54, p967-976.
[https://doi.org/10.1002/mnfr.200900265]

-
Mulisa, E, Asres, K, and Engidawork, E., (2015), Evaluation of wound healing and anti-inflammatory activity of the rhizomes of Rumex abyssinicus J.(polygonaceae) in mice, BMC Complementary and Alternative Medicine, 15, p341, (cited by 2019 March 3).
[https://doi.org/10.1186/s12906-015-0878-y]

- Nho, JH, Jang, JH, Jung, HK, Lee, MJ, Sim, MO, Jeong, DE, and Cho, HW., (2018), Ethanol extracts from Astilbe chinensis (Maxim.) Franch. Et Savat. exhibit inhibitory activities on oxidative stress generation and viability of human colorectal cancer cells, Korean Journal of Medicinal Crop Science, 26, p141-147.
-
Ni, CH, Yu, CS, Lu, HF, Yang, JS, Huang, HY, Chen, PY, Wu, SH, Ip, SW, Chiang, SY, Lin, JG, and Chung, JG., (2014), Chrysophanol-induced cell death(necrosis) in human lung cancer A549 cells is mediated through increasing reactive oxygen species and decreasing the level of mitochondrial membrane potential, Environmental Toxicology, 29, p740-749.
[https://doi.org/10.1002/tox.21801]

- Park, ES, Song, GH, Kim, SH, Lee, SM, Kim, YG, Lim, YL, Kang, SA, and Park, KY., (2018), Rumex crispus and Cordyceps militaris mixture ameliorates production of pro-inflammatory cytokines induced by lipopolysaccharide in C57BL/6 mice splenocytes, Preventive Nutrition and Food Science, 23, p374-381.
-
Reuter, S, Gupta, SC, Chaturvedi, MM, and Aggarwal, BB., (2010), Oxidative stress, inflammation, and cancer: How are they linked?, Free Radical Biology and Medicine, 49, p1603-1616.
[https://doi.org/10.1016/j.freeradbiomed.2010.09.006]

- Rho, SN, and Oh, HS., (2002), Effect of omija(Schizandra chinensis baillon) extracts on the growth of liver cancer cell line SNU-398, Korean Journal of Nutrition and Health, 35, p201-206.
- Saunders, IT, Kapur, N, Mir, H, and Singh, S., (2018), Emodin inhibits colon cancer by modulating apoptotic and cell survival signals, American Association for Cancer Research, 78(supplement1), http://cancerres.aacrjournals.org/content/78/13_Supplement/312.short (cited by 2019 March 23).
-
Sies, H, and Stahl, W., (1998), Lycopene: Antioxidant and biological effects and its bioavailability in the human, Proceedings of the Society for Experimental Biology and Medicine, 218, p121-124.
[https://doi.org/10.3181/00379727-218-44285a]

-
Ueno, Y, Umemori, K, Niimi, EC, Tanuma, SI, Nagata, S, Sugamata, M, Ihara, T, Sekijima, M, Kawai, KI, Ueno, I, and Tashiro, F., (1995), Induction of apoptosis by T-2 toxin and other natural toxins in HL-60 human promyelotic leukemia cells, Journal of Natural Toxins, 3, p129-137.
[https://doi.org/10.1002/nt.2620030303]

-
Wang, W, Chen, R, Luo, Z, Wang, W, and Chen, J., (2018), Antimicrobial activity and molecular docking studies of a novel anthraquinone from a marine-derived fungus Aspergillus versicolor, Natural Product Research, 32, p558-563.
[https://doi.org/10.1080/14786419.2017.1329732]

-
Xie, QC, and Yang, YP., (2014), Anti-proliferative of physcion 8-O-β-glucopyranoside isolated from Rumex japonicus Houtt. on A549 cell lines via inducing apoptosis and cell cycle arrest, BMC complementary and alternative medicine, 14, p377, (cited by 2019 March 8).
[https://doi.org/10.1186/1472-6882-14-377]

- Yıldırım, A, Mavi, A, and Kara, AA., (2001), Determination of antioxidant and antimicrobial activities of Rumex crispus L. extracts, Journal of Agricultural and Food Chemistry, 49, p4083-4089.
