배암차즈기와 홍삼 복합물의 호흡기 보호 및 질환 치료 상승 효과
 ; Hyo Min Gwak*
; Hyo Min Gwak* ; Moon Yong Lee* ; Jong Su Kyung**
; Moon Yong Lee* ; Jong Su Kyung** ; Kyoung Hwa Jang**
; Kyoung Hwa Jang** ; Chang Kyun Han**
; Chang Kyun Han** ; Won Kyung Yang***
; Won Kyung Yang*** ; Seung Hyung Kim***
; Seung Hyung Kim***
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
We recently reported that Salvia plebeia R. Br. extracts suppress leukotriene production and effectively inhibit the airway inflammatory response by modulating inflammatory chemokine and cytokine expression. Here, we investigated the synergistic airway anti-inflammation effect of Salvia plebeia and Panax ginseng (Korean red ginseng, KRG) that has been used to treat various immune diseases such as asthma.
To evaluate the synergistic airway anti-inflammatory effect of Salvia plebeia and KRG, we measured the inhibitory effect of monotheraphy with either or co-theraphy with both on leukotriene and reactive oxygen species (ROS) production. Using coal a combustion, fly ash, and diesel exhaust particle (CFD)-induced respiratory disease mouse model, we found that co-theraphy synergistically suppressed airway inflammatory signs such as alveolar wall thickness and collagen fibers deposition, and decreased the number of total cell, CD11b+Gr-1+ cells, and inflammatory cytokines (IL17A, TNF, MIP-2 and CXCL-1) in bronchoalveolar lavage (BAL) fluid.
We confirmed respiratory protection as a therapeutic effect of the Salbia plebeia-KRG 3 : 1 complex (KGC-03-PS) via anti-tracheal muscle contraction and expectorant animal studies using a CFD-induced respiratory disease mouse model.
Keywords:
Salvia plebeia R. Br., Korean Red Ginseng (KRG), CFD-Induced Respiratory Disease Model, Airway Inflammation서 언
최근 우리나라의 대기환경은 자동차 배기가스, 국내·외 산업용 연소물질, 황사뿐만 아니라, PM (particulate matter) 2.5 및 PM 10 등 다양한 종류의 미세먼지의 유입에 의한 대기오염정도가 증가되어 사회적인 문제로 대두되고 있다. 이러한 대기오염물질의 지속적인 흡입은 기관지 염증 및 기관지 손상을 불러일으키며 이러한 증상이 계속되었을 때, 급·만성기관지염, 천식, 알러지성 비염 등을 초래하고 심해지면 만성폐쇄성폐질환 (chronic obstructive pulmonary disease, COPD)를 유발한다 (Bohadana et al., 2000). 한편, 대기오염물질 중에서 특히 직경이 2.5 ㎛ 이하인 초미세먼지 (PM 2.5)는 코와 기도 점막에 잘 걸러지지 않고, 기관지 및 폐포에 침작되어 인체에 미치는 영향은 크다고 알려져 있으며, 대기오염물질의 종류, 크기, 함유성분 및 양에 따라서 다양한 호흡기 및심혈관 질환을 유발한다고 보고되고 있다 (Cho et al., 2008).
자동차 매연이나 화력발전소의 분진 및 산업체에서 생산되는 연소물, 화학 유독물질, 중금속 등의 대기오염물질들은 입자의 크기가 작아 기도를 통과해서 기관지 및 폐포에 도달하여 염증을 유도한다. 일반적으로 기관지 염증이 일어나게 되면 기관지 폐세정액의 과립구와 림프구의 총 세포 수가 증가하고 기도와 폐포로의 침윤을 한다. 또한 호산구, 호중구, Th2 세포, 비만세포 등 염증 세포에서 분비된 tumor necrosis factor-alpha (TNF-α), interleukin-4 (IL-4), IL-5, IL-6, IL-10, IL-13, IL-33 등의 염증성 사이토카인은 점액세포의 크기의 증대, 점액의 농도 및 양을 증가시켜 호흡기 기관지 전체의 염증 반응을 유도한다 (Barnes, 1994; Nials and Uddin, 2008; Ghio et al., 2012).
특히 대기오염물질 성분 중 자동차배기가스 (diesel exhaust particles, DEPs)는 IL-17A 분비량을 증가시켜 기관지염증을 유발하고 천식 등의 증상상을 악화시킨다 (Brandt et al., 2013). 자동차 매연에는 다양한 종류의 유해성분인 black carbon, hydrocarbons (C14-C35)과 그 유도체, heterocyclics, polycyclic aromatic hydrocarbons (PAH)과 그의 유도체 등을 함유하고 있으며 (Akiyama, 2006), 이들 유해 성분들은 기관지염증, 비염이나 기관지 천식 등 알레르기성 만성호흡기 질환의 진행을 촉진시키는 직접적인 원인이 된다고 보고되고 있다 (Wichmann, 2007; Inoue et al., 2008).
그러나 미세먼지 등 대기오염물질에 의해 유발되는 호흡기 질환에 대한 개선 및 기관지 기능을 보호할 수 있는 직·간접적인 치료 약물에 대한 연구는 아직까지 잘 이뤄지고 있지 않기 때문에, 미세먼지 등 대기오염 물질을 흡입했을 때 호흡기를 보호할 수 있는 기능성 신소재의 개발이 필요하다.
꿀풀과 (Labiatae)에 속하는 일년생 또는 이년생 직립초목인 배암차즈기 (Salvia Plebera R. BR)는 곰보배추라고 불리면서 우리나라, 일본, 중국 등의 산간지역에서 자생하며, 아시아에서는 예로부터 독감, 간염, 감기 등의 치료를 위한 약초로 사용을 했다는 기록이 있다 (Choi et al., 2016).
기존에 연구에서 배암차즈기는 기관지 항염증 작용, 항산화 작용, 간 보호, 아토피 개선 효과가 있는 것으로 알려져 있다 (Gu and Weng, 2001; Choi et al., 2014; Jang et al., 2016). 배암차즈기의 주요 성분 중 가장 많이 함유되어있는 rosmarinic acids는 알레르기성 질환 및 호산구성 기도염증에 개선효과가 보고되어 있고 (Costa et al., 2012; Liang et al., 2016), luteolin은 알레르기성 천식 및 비염 억제 효과, 항염증 및 간 보호작용이 있다고 알려져있다 (Lee et al., 2011; Choi et al., 2015; Jang et al., 2017). Hispidulin은 항염작용을 한다는 보고가 있고 (Yin et al., 2008), 또한 nepetin은 항균작용이 있다고 알려져 있다 (Talib et al., 2012). 최근에는 3 종의 배암차즈기로부터 호흡기 염증 억제 비교 및 활성 성분 규명에 대한 연구가 이루어져있고, 호흡기 손상 억제 마우스 모델에서 효과적으로 호흡기 염증억제 효과가 있다고 보고되고 있다 (Shin et al., 2016; Song et al., 2017).
오랫동안 고려인삼 (Panax ginseng C. A. Meyer)은 중요 강장제로서 ‘체내의 오장을 보하며, 정신을 안정시키고, 장복하면 몸이 가뿐하게 되어 수명이 길어진다’고 많은 문헌에서 기술되어 있다 (Mahady et al., 2001). 그리고 홍삼에는 백삼에 없는 다양한 종류의 사포닌을 함유하고 있으며 페놀성 성분 및 폴리아세틸렌 등의 비극성 성분의 함량이 백삼에 비해 높게 존재한다는 것이 보고되었다 (Nam, 2005). 홍삼 사포닌은 암 예방 효과, 혈압 강하 활성, 뇌신경세포 보호 및 학습능력 개선효과, 항혈전 효능, 항산화 활성 등이 보고되고 있다 (Bae and Kim, 1998; Jung et al., 1998; Jeon at al., 1999; Keum et al., 2000; Kim et al., 2004). 최근에는 천식 등 호흡기 질환 모델 뿐만 아니라 황사 및 디젤연소 물질의 노출에 의해 유발된 알러지성 기관지 염증을 홍삼 사포닌 등이 효과적으로 방어한다고 알려져 있다 (Kim at al., 2014; Chen et al., 2015).
따라서 본 연구에서는 배암차즈기 및 홍삼을 이용하서 단독 또는 복합물에의한 호흡기 염증 억제 시너지 효과를 확인하고자 하였다. 이를 위해 배암차즈기 및 홍삼 비율별 leukotriene 발현 및 ROS (reactive oxygen species) 생성 억제 활성을 비교하였고, 또한 대기오염물질로 유도된 호흡기 손상 마우스 모델, 거담활성 및 기관지 수축억제 실험을 통해서 배암차즈기 홍삼 3 : 1 복합제 (KGC-03-PS)의 호흡기 기능 보호 및 기관지 항염증 활성을 검증하였다.
재료 및 방법
1. 시약 및 재료
실험에 사용한 acetonitrile, ethanol, methanol은 Merck Millipore (Billerica, MA, USA)에서, dimethyl sulfoxide (DMSO), phosphate buffered saline (PBS), formalin solution, luteolin, hispidulin, rosmarinic acid, nepetin 등과 호흡기 치료제인 montelukast, N-acetylcysteine, 2-7-dicholordihydrofluorescein diacetate (DCF-DA), aluminium hydroxide는 Sigma-Aldrich (St. Louis, MO, USA)에서, RPMI, dulbecco’s modified eagle's medium (DMEM), fetal bovine serum (FBS), penicillin-streptomycin-amphotericin B (antibotics), 0.25% trypsin-EDTA (TE)는 Gibco (Carlsbad, CA, USA)에서 구매하였고 FACS (fluorescence-activated cell sorting) 분석용 항체인 FITC (fluorescein isothiocyanate) anti-mouse Gr-1 (RB6-8C5, rat IgG2b) 및 R-phycoerythrin (PE) anti-mouse CD11b (aM, Rat IgG2b)는 Biosciences (Franklin Lakes, NJ, USA)에서 구매하였고, MIP-2 (DY452-05)와 CXCL-1 (DY453-05)는 R&D system (Minneapolis, MN, USA)을 구매하여 사용하였다.
2. 홍삼, 배암차즈기 및 복합물 시료 제조
본 실험에 사용한 홍삼 (Korean red ginseng, KRG)은 인삼공사로부터 홍삼을 제공 받아 사용하였다. 가루로 균질화된 6년근 홍삼분말을 증류수를 이용해서 80℃에서 24 시간 동안 2 회 열탕 추출하였다. 2016년에 수확한 배암차즈기 (Salvia. plebera R. BR.)를 부안동진농장으로부터 구입하여 뿌리를 제거한 지상부 500 g을 증류수에 희석하여 제조한 30% 주정용액 10 ℓ이용해서 80℃에서 4 시간 동안 2 회 열탕 추출하였다. 모든 시료는 40% 이상으로 감압 농축한 후 분무건조기를 이용하여 건조하여 분말상태로 제조하였다.
배암차즈기 및 홍삼 추출물 3 : 1 비율의 복합제인 KGC-03-PS (KGC3P)은 초저온냉동고 (-80℃)에 보관하면서 적당한 농도로 희석하여 성분분석 및 효능평가에 사용하였다.
3. 성분 분석
배암차즈기의 유효성분인 nepetin, luteolin, hispidulin, rosmarinic acid 분석을 위해 사용한 용매로서 acetonitrile과 water는 HPLC용 특급 등급의 용매로, trifluoroacetic acid (TFA)는 분석용 등급의 용매로써 Merck Millipore (Billerica, MA, USA)에서 구입하여 사용하였다.
배암차즈기의 유효 및 지표 성분으로써 hispidulin (SML0582), luteolin (L9283), 그리고 rosmarinic acid (536954) 등의 표준품들은 Sigma-Aldrich (St. Louis, MO, USA)에서, 또한 nepetin (ASB-00005380-005)은 chromadex (Irvine, CA, USA)에서 구입하여 사용하였다.
HPLC 분석은 Waters 2695 기기 및 996 photodiode array detector (Waters, Milford, MA, USA)에 의하여 수행하였다. 배암차즈기 추출물은 70% 메탄올을 이용해서 20 ㎎/㎖ 농도로 용해한 후, PVDF syringe filter를 사용하여 여과한 후 성분 분석에 사용하였다. 사용한 colume으로 Optima pak C18 column (5 ㎛, 4.6 ㎜ × 250 ㎜)을 사용하여 수행되었으며, 칼럼의 온도는 40℃로 유지하였고, 검출은 PDA detector를 사용하였다. 이동상으로써 acetonitrile (A) 및 0.1% TFA 함유 water (B)를 이용해서 gradient system (0 min; 10% A, 10 min; 10% A, 50 min; 50% A, 52 min; 100% A, 62 min; 100% A, 65 min; 10% A, 75 min; 10% A)을 이용해서 최적화 하였고, 유속은 1.0 ㎖/min으로, 주입량은 20 ㎕로 하였다.
홍삼의 지표성분인 ginsenoside Rg1, Rb1, Rg3 함량 분석은 UPLC-PDA (Waters, Milford, MA, USA)를 이용해서 실시하였다. 2 g의 KGC-03-PS를 30% 메탄올 10 ㎖를 이용하여 30 분간 초음파 추출 후 3,000 rpm에서 10 분간 원심분리해서 추출 상등액을 수거하였다. BEH C18 column (100 ㎜ × 2.1㎜, 1.7㎛, Waters, Milford, MA, USA)을 사용하여 ginsenoside를 분석하였으며, 칼럼의 온도는 40℃로 유지하였고, 검출은 203 ㎚의 photodiode array detector (UV 검출기, Waters, Milford, MA, USA)를 사용하였다. 이동상은 물에 희석된 0.001% phosphoric acid (A) 및 acetonitrile에 희석된 0.001% phosphoric acid (B)를 이용한 gradient system (0 - 25.0 min; 15% B, 35.0 min; 20% B, 39.5 min; 30% B, 40.5 min; 32% B, 42.5 min; 40% B, 46.0 min; 65% B, 47.0 - 49.0 min; 90% B, 51.0 - 53.0 min; 15% B)으로 하였고, 유속은 0.6 ㎖/min, 주입량은 2 ㎕로 하였다.
4. 대기오염불질 (Coal fly dust) 제조
대기오염물질은 다양한 성분을 가진 대기 중 부유 물질인데, 그 중 석탄연소물 (coal combustion)은 화력발전소에서 사용되는 석탄 5 g을 700℃의 가열로 (ULVAC-RIKO TPC5000, Methuen, MA, USA)에서 10 분간 연소시키면서 발생되는 연소물을 glass fiber filter pad에 포집하였고, 포집된 TPM (total particulate matter) 성분은 DMSO 용액을 이용해서 10 ㎎ TPM/㎖로 농도로 추출해서 석탄 연소물용액을 제조해서 실험에 사용하였다.
플라이애쉬 (fly ash)는 일본 JIS type-II fly ash (Yoshitaka, 2007)를 구매하여 사용하였으며, 충북대학교에서 얻은 디젤연소분진 (diesel exhaust particule, DEP) (Lim and Kim, 2009)과 혼합하여 DMSO로 희석하여 최종적으로 미세먼지 혼합물 (coal combustion-fly ash-diesel exhaust particles complex, CFD)을 제조하였다.
5. 세포 배양
ROS 생산 억제 in vitro 실험을 위해 사용한 MH-S murine alveolar macrophage cell line (ATCC, Rockville, MD, USA)는 RPMI 1640 medium (Gibco, Carlsbad, CA, USA)에 10% fetal bovine serum (Gibco, Carlsbad, CA, USA)과 1% antibiotics (Gibco, Carlsbad, CA, USA)를 첨가하여 사용하였고, 항온 (37℃)과 항습을 유지하는 5% CO2 incubator에서 배양하였다.
염증지표 성분인 leukotriene 발현 억제 in vitro 실험을 위해 사용한 rat basophilic leukemia cell (RBL-2H3)은 10% FBS, 1% antibiotics가 포함된 DMEM (Thermo Fisher Scientific Inc., Waltham, MA, USA)으로 5% CO2, 37℃ incubator에서 T-75 culture flask에서 배양하였다.
6. DCF-DA cellular reactive oxygen species detection assay
ROS 생산 억제 in vitro 실험을 위해, 5 × 105 개수의 MH-S 세포를 FACS (fluorescence-activated cell sorting) tube에 분주하고 FACS buffer로 2 회 세척한 다음, DCF-DA 용액을 각 tube당 10 μM의 농도로 분주하여 세포를 현탁 하였다. 37℃ 암실에서 30 분간 staining한 후 FACSCaliburTM flow cytometry system (BD Biosciences, Mountain View, CA, USA)를 이용하여 분석하였다.
7. Leukotriene assay
12-well plate에 RBL-2H3 세포를 5 × 105 cells/well 만큼 분주하여 complete DMEM 1 ㎖로 배양하였다. 24 시간 후 PBS (phosphate buffered saline) 1 ㎖로 세척한 후 배암차즈기 추출물이 들어간 DMEM 500 ㎕로, 양성대조군은 100 μM montelukast가 포함된 DMEM 500 ㎕로 10 분간 배양한 후 1 ㎎/㎖ calcium ionophore 10 ㎕를 넣어 10 분간 배양하였다. 이후 상층액을 모아 1,500 rpm에서 원심 분리해 잔여세포를 침전시키고, 다시 상층액을 취해 -20℃에 보관하였다. 상층액에 포함된 leukotriene의 농도는 cysteinyl lekotriene ELISA kit (ADI-901-070, Enzo Life Sciences Inc., Farmingdale, NY, USA)를 이용해 제조사에서 제공한 방법으로 측정하였다 (Shin et al., 2016).
8. CFD를 이용한 호흡기 손상 동물 모델
본 실험은 동물보호법 (제정 1991년 5월 31일 법률 제4379, 일부개정 2015년 1월 20일 법률 제 13023호)에 근거한 KT&G 연구원 동물실험윤리위원회에 의해 승인되었다 (승인번호: KT&G18-010).
본 연구를 위해 사용한 수컷 BALB/c 마우스 (23 - 25 g, Orientbio, Eumseong, Korea)의 사육실은 실험 기간 동안 평균 온도 23 ± 2℃, 습도 50 ± 2%로 유지하였으며, 밤낮 주기 (12 시간 light / 12 시간 dark, light turn on 9 am)가 조절되는 환경에 수용하였다. 실험 기간 동안 물과 고형사료는 자유롭게 섭취할 수 있도록 제공하였다.
CFD 유발 호흡기 손상 모델 대조군, 약물 투여군 및 양성 대조군 각각 6 마리씩 설정하였다. 약물희석은 0.5% CMC (carboxymethyl cellulose)로 혼탁하여 투여하고, 대조군은 0.5% CMC 용액을 동량 투여하였다. 약물투여는 경구투여용 금속제 존대 (zonde)를 이용하여 위내로 강제 경구투여 하였다.
대기오염물질인 CFD (coal + fly ash + DEP) 유발 호흡기 손상 모델은 실험동물에 CFD 구성성분인 coal (석탄 탄소물), fly ash (화력발전소 등의 연소보일러에서 부산되는 석탄재), DEP (디젤연소분진)을 혼합하여 INT (Intra-Nazal-Trachea) injection 방법으로 주입하여 기도와 폐 손상과 염증을 유발시킨다 (Song et al., 2017).
천연물추출물은 11 일 간 투여하며, 투여시작일로부터 4 일 후, 7 일 후, 10 일 후에 총 3 회 INT로 미세먼지 혼합물을 주입한다. 양성대조군인 N-acetyl-L-cysteine (200 ㎎/㎏)는 처음 INT 후 하루 뒤부터 투여 시작한다. CFD 혼합물은 DMSO에 녹인 coal (5 ㎎/㎖), fly ash (10 ㎎/㎖), DEP (5 ㎎/㎖) stock을 각각 coal (0.25 ㎎/㎖), fly ash (0.5 ㎎/㎖), DEP (0.25 ㎎/㎖)로 생리식염수로 희석하여 제조하였다.
INT injection 방법은 생쥐를 urethan으로 가마취시키고 고무줄로 고정하여 기도를 확보한 후 구강을 통해 기도로 CFD 혼합물을 50 ㎕ 주입하고 바로 코에 CFD 혼합물을 50 ㎕를 함께 넣어주어 생쥐가 숨 쉬는 과정에서 기관지를 통해 폐로 CFD 혼합물이 흡입될 수 있게 하였다.
9. Histopathology
기관지 염증평가를 위해 기관지 세척 (airway lamina washing)을 통해 마우스의 기관지폐세정액 (airway lavage)으로부터 기관지폐포세척액 (bronchoalveolar lavage fluid, BAL fluid)을 분리한 다음, 분리한 BAL fluid를 cytospin을 이용해서 슬라이드 도말한 후 Diff-quick 용액으로 염색하여 neutrophils 및 eosinophil 등의 감별을 실시하였다.
마우스로부터 분리한 폐 조직은 10% 포르말린 용액에 고정하여 sucrose를 이용해 탈수과정을 거친 후 조직병변 관찰을 위해 hematoxylin과 eosin 용액을 이용하여 염색한 다음 조직병리학적 검사를 실시하였다. 그 외에 다른 section은 masson’s trichrome 용액 (Sigma-Aldrich Co., St. Louis, MO, USA)으로 염색한 후 light microscopy를 이용하여 교원섬유 등 다양한 증상의 감별을 실시하였다.
10. Flow cytometric analysis
세포의 종류 및 수의 차이를 분석하기 위하여 각 세포 샘플은 staining solution (PBS containing 1% FBS and 0.01% NaN3)에서 정해진 antibody를 이용하여 10 분간 염색한 다음 FACScalibur flow cytometry system (BD Biosciences, Mountain View, CA, USA)를 이용하여 유세포 (FACS) 분석을 실시하였다. 분석 결과는 Cell Quest software (BD Biosciences, Mountain View, CA, USA)를 이용하여 세포를 분석하였고, 분석한 세포 수와 백분율을 이용해 총 세포 수 및 %를 계산하였다. 유세포 분석을 위한 antibody는 BD PharMingen (San Diego, CA, USA)에서 구입해서 사용하였다.
11. ELISA (Enzyme-Linked immunosorbent assay)
단백질의 생성정도를 측정하기 위해 ELISA를 이용하여 분석하였다. IL-17A (M17AFO), TNF-α (MTA00B), MIP-2 (MM200), 그리고 CXCL-1 (MKC00B) 단백질량을 BAL fluid에서 ELISA kit (R&D system, Minneapolis, MN, USA)를 사용하여 제조사의 지시에 따라 시행하였다.
먼저, coating antibody를 microplate에 100 ㎕ 씩 분주하고 4℃에서 24 시간 반응시켰다. 각 well을 wash buffer로 세 번 세척하고 assay diluent를 200 ㎕ 씩 넣어서 1 시간 동안 실온에서 배양하였다. 배양하는 동안 표준품과 상등액을 준비하고 완료되면 microplate를 세 번 세척한 후 각 표준품과 상등액을 100 ㎕ 씩 넣고 2 시간 동안 실온에서 배양하였다. Microplate를 세 번 세척하고 detection antibody를 만들어서 각 well에 100 ㎕ 씩 넣고 실온에서 배양하였다. 1 시간 후, microplate를 다섯 번 세척하고 substrate solution을 만들어서 각 well에 100 ㎕ 씩 넣고 30 분 동안 어두운 곳에서 실온으로 배양하였다. Stop solution을 각 well에 넣고 microplate spectrophotometer (Biotek, Winooski, VT, USA)를 이용하여 흡광도 450 ㎚로 측정하였다.
12. Real-time reverse transcription polymerase chain reaction (Real-time RT-PCR)
각 세포와 조직들로부터 유전자의 발현을 분석하기 위해 TRIzol reagent 용액 (Thermo Fisher Scientific Inc., Waltham, MA, USA)을 이용하여 RNA를 분리하였다. 추출한 RNA를 RTase, dNTP, buffer, Oligo-dT를 넣은 후 42℃ water bath에서 2 시간 동안 반응시켜 cDNA를 합성하였다.
합성된 cDNA에 2 × SYBR green PCR Master Mix (Applied Biosystems, Grand Island, NY, USA), 200 nM primers, rox dye를 넣은 후 각 cycle은 95℃ 15 sec, 55℃ 15 sec, 72℃ 15 sec의 조건으로 Applied Biosystems 7500 Real-Time PCR system (Applied Biosystems, Grand Island, NY, USA)를 이용하여 PCR을 수행하였다. 각 유전자의 발현은 housekeeping 유전자 glyceraldehyde-3-phosphate dehydrogenase (GAPDH)를 internal control로 사용하여 상대적 정량값을 비교분석하였다 (Table 1).
13. 거담 활성
본 실험은 동물보호법 (제정 1991년 5월 31일 법률 제4379, 일부개정 2015년 1월 20일 법률 제 13023호)에 근거한 KT&G 연구원 동물실험윤리위원회에 의해 승인되었다 (승인번호: KT&G18-005).
거담활성 측정은 마우스 모델을 이용한 페놀레드 배출법에 의한 객담 배출 효과를 평가하는 방법으로써 양성 대조 약물로는 우수한 거담활성이 입증된 ambroxol (250 ㎎/㎏)을 사용하였다 (Lina et al., 2008). 시험약물을 수컷 마우스 (8 주령, Samtako Co., Ltd., Osan, Korea)에 경구 투여하고 30 분 후, 페놀레드 (500 ㎎/㎏)를 복강주사하고 다시 30 분 후 디에틸에테르를 이용해 마취시켜 복부 대동맥을 절단하여 방혈시킨 후, 기관 (trachea) 전체를 절제하였다.
분리된 기관을 1㎖의 생리식염수에 넣어 30 분 동안 세척하였고, 10,000 rpm으로 5 분간 상온에서 원심분리하여 얻은 상등액에 1 N NaOH 용액을 첨가 (상등액 1㎖당 1 N NaOH 0.1㎖ 첨가)한 후 546 ㎚에서 흡광도를 측정하여 배출된 페놀레드의 농도로서 거담 활성을 평가하였다.
14. 기관지수축억제 활성
본 실험은 동물보호법 (제정 1991년 5월 31일 법률 제4379, 일부개정 2015년 1월 20일 법률 제 13023호)에 근거한 KT&G 연구원 동물실험윤리위원회에 의해 승인되었다 (승인번호: KT&G18-007).
기니픽 적출 기관지를 이용해서 배암차즈기 홍삼 3 : 1 복합물 (KGC-03-PS)의 기관지 수축억제 활성을 평가하였으며 (Jones et al., 1995) 비교약물인 롤리프람 (rolipram)은 5 μM, KGC-03-PS는 100 ㎍/㎖, 200 ㎍/㎖, 400 ㎍/㎖ 로 처리하였다. 수컷 기니피그 (350 - 400 g, Orientbio Co., Eumseong, Korea)를 구입 일주일 후에 기니피그를 실혈 치사시킨 후 기관지를 적출하였다.
타이로이드 (tyrode) 액상에서 기관지에 붙어있는 타 조직을 제거한 후 연골이 2 - 3 개가 포함되도록 링 모양으로 절개하였다. 절개 후에는 기관지 근육을 보존하면서 링의 연골부분을 절개하고 양쪽으로 실을 연결한 후 장기욕조 (organ bath)에 현수 (suspension)하였고, 일정시간의 안정화시켰다. 이후, 카바콜 (carbachol) 25 ng/㎖을 넣고 기관지 수축을 유발하였고 시료의 동시 투여에 의해 기관지 수축억제 활성을 측정하였다.
기관지 수축 억제율 (%)은 카바콜에 의한 수축을 비교하여 계산하였으며, 기관지의 수축이완은 힘변환기 (force transducer, WPI, Sarasota, FL, USA)와 연결된 생리 활성 측정기 (powerlab 8/30, AD Instument, Sydney, Australia)를 이용하여 측정하였다.
15. 통계분석
실험 집단 간 수치 데이터는 각 실험군 결과값 means ± standard error (SE)로 나타내었으며, 동물실험에서는 SPSS 11.0 software (IBM-SPSS Inc., Chicago, IL, USA)를 이용하여 일원배치 분산분석 (One-way analysis of variance; ANOVA) 후에 Duncan’s Multiple Comparison Tests (DMRT)로 유의성을 검증하였고, 세포실험에서는 독립표본 T-검정 (independent samples t-test)을 이용하여 유의성을 검증하였다. p 값이 0.05 또는 0.01 구분하여 분석하였으며, 각 경우에 해당 시 통계적으로 유의적 차이가 있는 것으로 판정하였다.
결과 및 고찰
1. 추출물로부터 주요 활성 성분 분석
본 연구에서 사용한 천연물 추출물들의 지표 (유효) 성분 함량을 측정학기위해서, 표준품과 함께 배암차즈기 추출물, 홍삼 추출물 및 KGC-03-PS (배암차즈기/홍삼 3 : 1 복합물)를 UPLC 및 HPLC를 이용해서 함량을 분석하였다. 배암차즈기 추출물에서 rosmarinic acid (69.86 ㎎/g), luteolin (1.72 ㎎/g), nepetin (8.26 ㎎/g), hispidulin (7.56 ㎎/g)의 성분함량을 확인할 수 있었고, 홍삼 추출물에서의 ginsenoside Rg1, Rb1 그리고 Rg3의 함량은 각각 1.37 ㎎/g, 8.36 ㎎/g, 2.74 ㎎/g을 나타내었다 (자료 미제시). KGC-03-PS에서는 nepetin (5.42 ㎎/g), ginsenoside Rg1 (0.22 ㎎/g), ginsenoside Rb1 (2.06 ㎎/g), ginsenoside Rg3 (0.51 ㎎/g)의 성분함량이 나타났다 (Fig. 1).
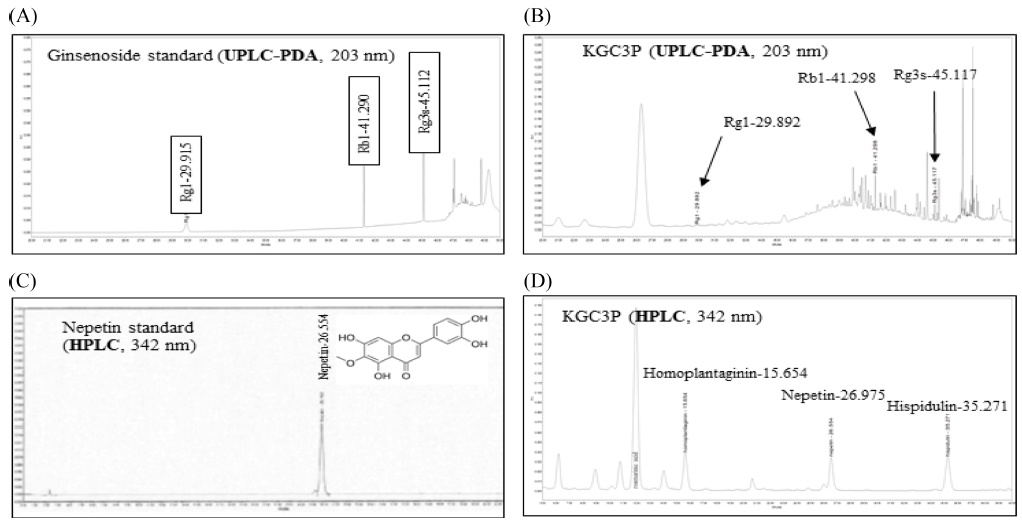
Chromatogram and structure of four compounds purified from KGC-03-PS (KGC3P). Rg1, Rb1, Rg3s, and nepetin were identified as marker compounds of the Korean red ginseng and Salvia plebeia R. Br. mixture (KGC3P). (A) UPLC-PDA chromatograms of three standard ginsenoside mixtures at 203 ㎚, (B) UPLC-PDA chromatogram for KGC3P mixture at 203 ㎚, (C) HPLC chromatograms for standard nepetin at 342 ㎚ and, (D) HPLC chromatograms for KGC3P mixture at 342 ㎚.
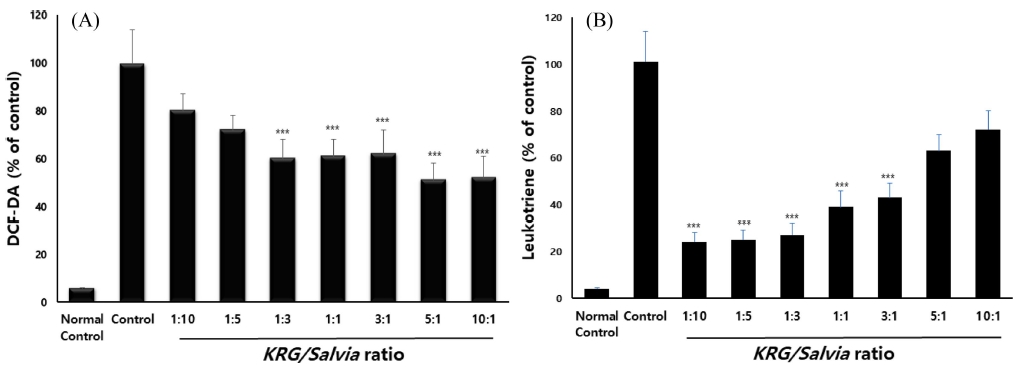
Determination of optical ratio between Korean red ginseng and Salvia plebeia R. Br on suppression of creating radical and leukotriene. (A) The MH-S cells were combinedly treated (100 ㎍/㎖) with Korean red ginseng (KRG) and Salvia plebeia (Salvia) extract and after stimulation of coal combustion-fly ash-diesel exhaust particles complex (CFD) (50 ㎍/㎖), (B) The RBL-2H3 cells were combinedly treated (100 ㎍/㎖) with Salvia plebeia extract and Korean red ginseng after stimulation of calcium ionophre (20 ㎍/㎖). Data are shown as means ± SE. Significant difference from vehicle control; ***p < 0.01.
2. 배암차즈기/홍삼 혼합 비율별 항산화 및 항염증 활성
이전의 연구 결과에서 항산화 및 항염증 활성이 보고된 배암차즈기와 홍삼에 대한 비율별 혼합물에 대한 효능을 비교평가 하였다 (Song et al., 2017).
50 ㎍/㎖의 대기오염물질 복합물 (CFD) 처리한 MH-S 세포에 홍삼 및 배암차즈기 추출물을 10 : 1, 5 : 1, 3 : 1, 1 : 1, 1 : 3, 1 : 5, 1 : 10의 비율로 섞은 혼합물 100 ㎍/㎖ 농도로 처리한 결과, CFD에 의해 증가된 ROS의 생성량이 감소되는 것을 관찰할 수 있었고, 특히 홍삼/배암차즈기 혼합 비율이 10 : 1, 5 : 1, 3 : 1, 1 : 1, 1 : 3에서 유의적인 (p < 0.01) ROS 생성 억제를 보였다. RBL-2H3 세포주를 이용해서 홍삼 및 배암차즈기 비율별 혼합물 (100 ㎍/㎖) 의 leukotriene 발현 억제 활성을 측정한 결과, 배암차즈기/홍삼 복합물 비율이 3 : 1, 1 : 1, 1 : 3, 1 : 5, 1 : 10에서 유의적인 (p < 0.01) leukotriene 발현 억제 활성이 나타냈다.
이와 같은 결과는, 항산화 활성은 홍삼 함량이 많을수록 높았고, 함염증 활성은 배암차즈기 함량이 많을수록 높았다. 그중 1 : 3의 홍삼/배암차즈기 혼합물에서만 대조군에 비해 높은 수준 (p < 0.01)의 ROS 생성 및 leukotriene 발현 억제 모두 나타났다.
3. CFD 유발 호흡기 손상 모델에서 배암차즈기/홍삼 혼합 비율별 호흡기 염증 억제 활성 비교
홍삼과 배암차즈기 추출물을 각각 비율별로 (1 : 1, 1 : 3, 1 : 5, 1 : 10, 3 : 1) 투여한 군과 단독 투여군, 정상군, CFD-대조군, 양성대조군 생쥐에서 분리한 lung을 10% formaldehyde 용액에 고정한 후 H&E, MT 염색을 수행하였다. 정상군에 비해 coal과 fly ash와 DEP를 INT방법으로 주입한 CTL 그룹에서 H&E 염색법을 통해 폐세포 벽이 두꺼워지는 것을 확인할 수 있었고, M-T염색법을 통해 교원섬유가 증가하는 것을 확인할 수 있었다.
Positive control인 N-acetylcysteine (NAC) 투여 그룹은 CTL 그룹에 비해 얇은 폐세포 벽과 교원섬유가 감소하는 것을 확인할 수 있었다. 홍삼과 배암차즈기를 단독으로 각각 투여한 그룹에서도 CTL 그룹에 비해 얇은 폐 세포벽과 교원섬유가 감소하는 것을 확인 할 수 있었다. 혼합물 비율별 투여 군중에서는 홍삼과 배암차즈기를 1 : 3 비율로 혼합하여 투여한 그룹에서 효과적으로 CTL 그룹에 비해 폐 세포벽이 얇아지고 교원섬유가 감소하는 것을 확인할 수 있었다 (Fig. 3).
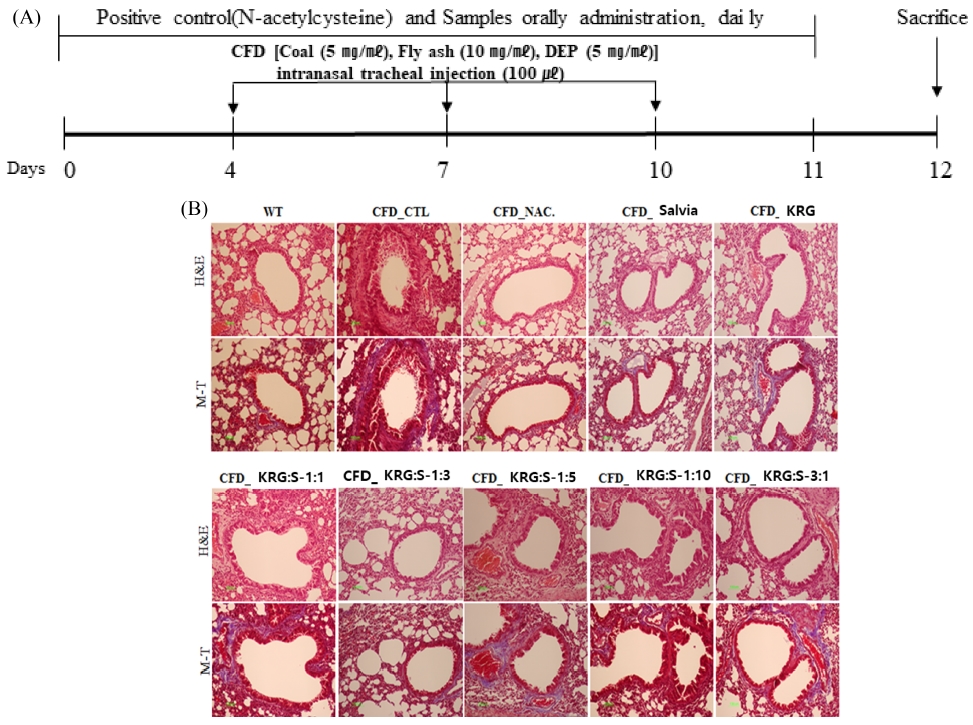
Experimental schedule to make coal combustion-fly ash-diesel exhaust particles complex (CFD)-induced mice model and Histopathology. (A) Mice were individually or combinedly treated (200 ㎎/㎏ BW) with Salvia plebeia extract and Korean red ginseng and N-acetylcysteine (NAC, 10 ㎎/㎏) daily for 10 days and intra-nasal trachea injected with 4 ㎎/㎏ CFD at day 4 and day 7. At day 10, mice were sacrificed, (B) The thickness of alveolar wall and detection of collagen fibers in lung tissue was measured by H&E (Hematoxylin&Eosin) staining and M-T (Masson’s Trichrome) staining assay, respectively. (WT; Balb/c normal, CFD-CTL; CFD-induced mice model control, CFD_NAC; CFD-induced model and orally administration of NAC, CFD_Salvia; CFD-induced model and orally administration of Salvia extract, CFD_KRG; CFD-induced model and orally administration of Korean red ginseng, CFD_KRG:S-1:1; CFD-induced model and orally administration of Korean red ginseng and Salvia 1 : 1 complex). Lung tissue were observed using a visible-light microscope at a magnification of 200× (green color bar; 100 ㎛).
CFD 유도 마우스 모델에 양성대조군으로 NAC와 홍삼 : 배암차즈기를 비율별 (1 : 1, 1 : 3, 1 : 5, 1 : 10) 투여에 따른 BAL과 lung에서의 총세포수을 측정한 결과, BAL과 lung에서의 총세포수는 홍삼/배암차즈기의 비율 1 : 3과 1 : 5가 대조군 (CFD_CTL)에 비하여 통계학적으로 유의성 있게 감소를 나타내었고 이중 홍삼/배암차즈기의 비율 1 : 3에서 가장 큰 억제효과를 나타내었다 (Fig. 4A, B).
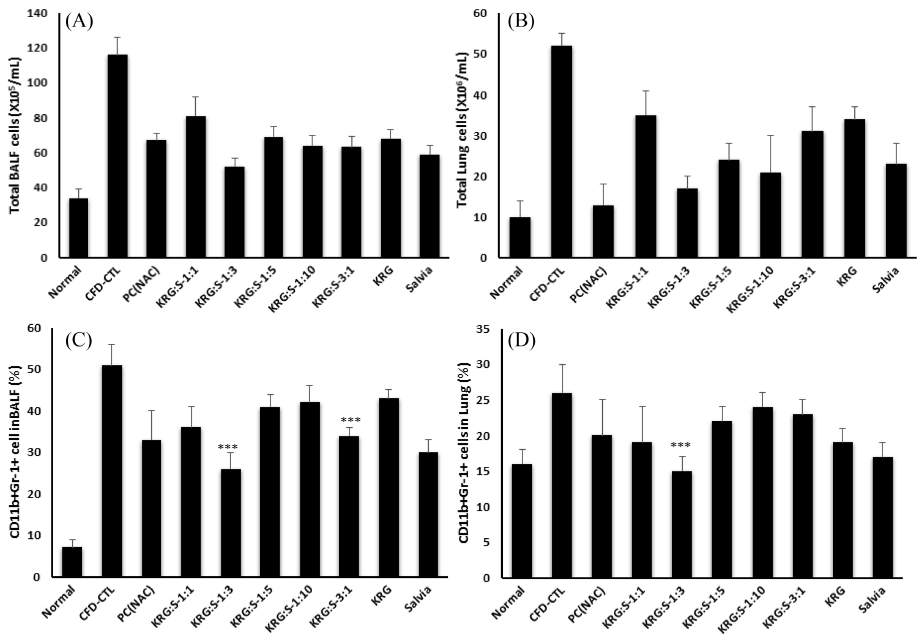
The Effect of Salvia plebeia, Korean red ginseng and complexs on the infiltration of granulocytes in airway from coal combustion-fly ash-diesel exhaust particles complex (CFD)-induced mice model. The total BAL (A) and lung cells (B) were counted using flow cytometey and the granulocytes infiltrated to BAL. The percentage of CD11b+Gr-1+ cells in (C) BAL and (D) lung was evaluated by flow-cytomery. Data are shown as means ± SE. Significant difference from CFD-CTL control; ***p < 0.01.
마우스의 BAL과 폐 조직에서 flow cytometry 분석을 통해 세포수를 CD11b+/Gr-1+ 백분율 (%)로 분석한 후 총 세포수를 적용하여 각 조직에서의 절대 총 세포 수를 산출하였다. 그 결과 CFD 주입한 대조군의 BAL과 폐에서 CD11b+/Gr-1+ 면역 세포 수가 유의성 있게 증가함을 확인하였다. 배암차즈기 투여군의 BAL과 폐에서는 홍삼/배암차즈기 복합물 투여에 따라 CD11b+/Gr-1+ 면역 세포 수가 유의성 있는 수준으로 감소함을 확인하였다. 특히 BAL 및 폐조직에서 침윤된 CD4+와 CD11b+Gr-1+의 총 활성 세포수는 NAC와 홍삼/배암차즈기의 비율 1 : 3 복합물이 대조군 (CFD_CTL)에 비하여 통계학적으로 유의성 있게 감소되었다 [Fig. 4. C, D, (p < 0.01)].
또한 BAL fluid에서 ELISA를 통해 염증유발인자 IL-17A, TNF-α, MIP-2, 그리고 CXCL-1의 생산량을 측정한 결과, 대조군의 BAL fluid에서 IL-17A, TNF-α, MIP-2, 그리고 CXCL-1의 생산량이 모두 통계학적 유의성 있게 증가하였다. 그러나 홍삼 및 배암차즈기 단독 또는 비율별 복합물 투여군에서 IL-17A, TNF-α, MIP-2, 그리고 CXCL-1의 생산량이 감소함을 확인하였다. 특히 호흡기염증 유발 인자의 감소는 홍삼/배암차즈기의 비율 1 : 3 복합물 투여시 대조군 (CFD_CTL)에 비하여 통계학적으로 유의성 있게 감소되었고 (Fig. 5, p < 0.01), 홍삼 또는 배암차즈기 단독 투여군에 비해서도 유의성 있게 감소시겠다.
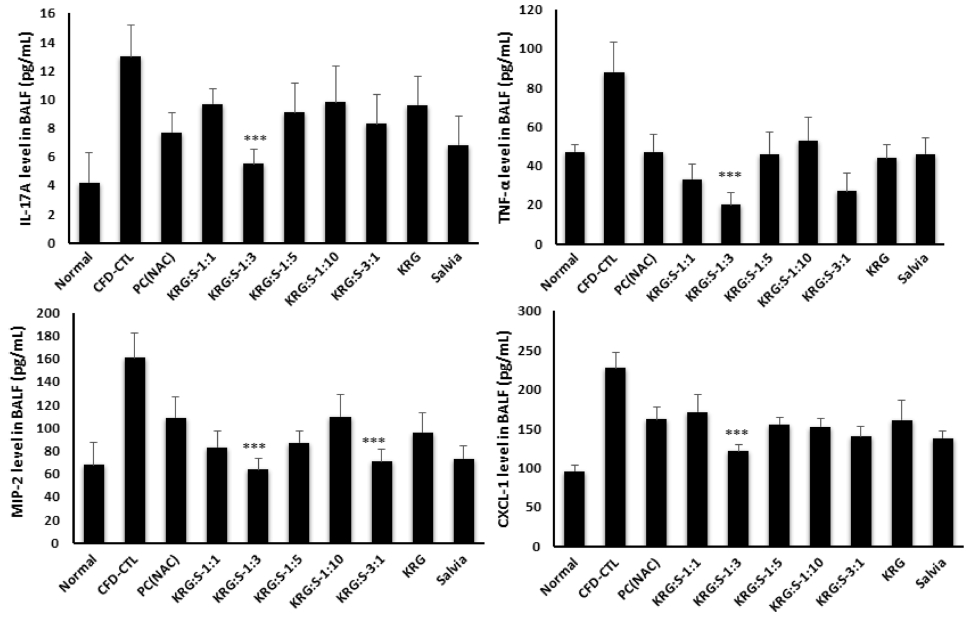
The Effect of Salvia plebeia, Korean red ginseng and complexs on pro-inflammatory cytokine in BALF. The production of IL-17A, TNF-α, MIP-2, and CXCL-1 proteins in airway was measured by ELISA. Data are shown as means ± SE. Significant difference from CFD-CTL control; ***p < 0.01.
CFD 유도 마우스 모델에 홍삼/배암차즈기 비율별 (1 : 1, 1 : 3, 1 : 5, 1 : 10, 3 : 1) 투여에 따른 lung에서의 염증사이토카인 (IL-17A, IL-1β, IL-6, TNF-a) mRNA 유전자 발현을 측정한 결과, Fig. 6에서처럼 모든 염증사이토카인 (IL-17A, IL-1β, IL-6, TNF-a) mRNA 유전자 발현에서 홍삼/배암차즈기의 비율 1 : 3이 대조군 (CFD_CTL)에 비하여 통계학적으로 유의성 있게 감소를 나타내었다 (p < 0.01). 염증성사이토카인인 IL-17A과 TNF-α, 그리고 CXC 케모카인 ligand 계열인 Cxcl 유전자가 염증과 관련하여 염증세포인 호중구의 염증반응에 관여한다는 보고에 따라 (Kolaczkowska and Kubes, 2013), 홍삼/배암차즈기 복합물은 이들 cytokine들의 발현을 조절함에 따라 기관지 염증세포를 감소시키는 것으로 사료된다.
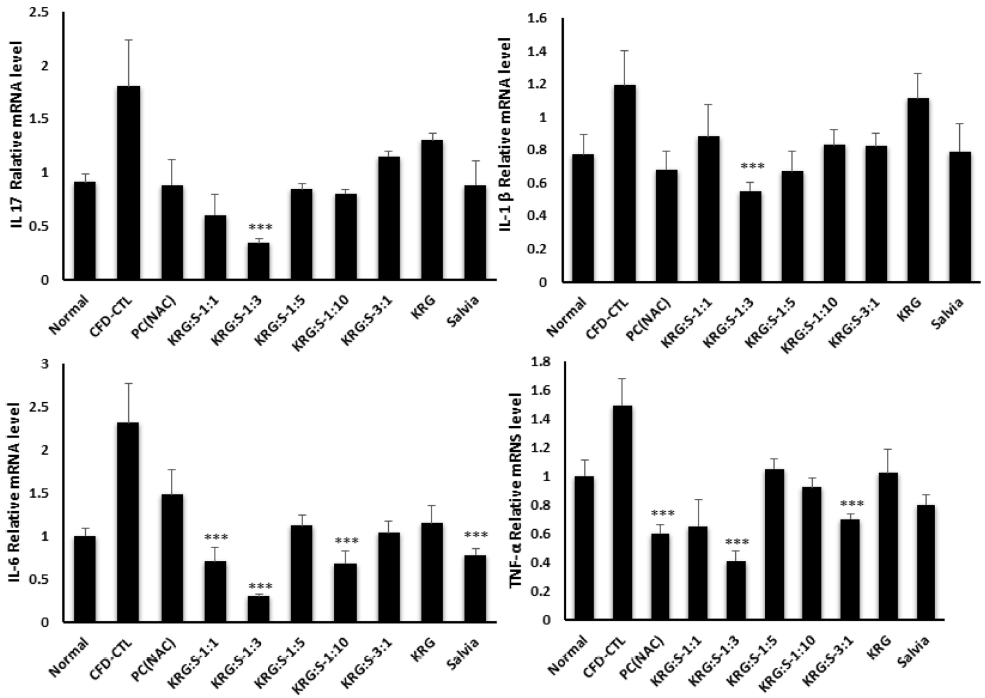
The restoration of airway immune response associated chemokines and inflammatory cytokines by Salvia plebeia, Korean red ginseng and complexs in coal combustion-fly ash-diesel exhaust particles complex (CFD)-induced mice models. The gene expression of airway immune response associated chemokines and inflammatory cytokines in lung isolated from CFD-induced mice models were analyzed by real-time PCR. Data are shown as means ± SE. Significant difference from CFD-CTL control; ***p < 0.01.
3. CFD 유발 호흡기 손상에 대한 KGC-03-PS의 방어효과
대기오염물질의 기관지 주입과 함께 배암차즈기/홍삼 3 : 1 복합물인 KGC-03-PS (KGC3P)를 매일 경구 투여하여, CFD에 의해 유도된 호흡기 질환 마우스 모델에서 배암차즈기/홍삼 복합물의 호흡기 염증 증상의 개선 효과를 관찰하였다.
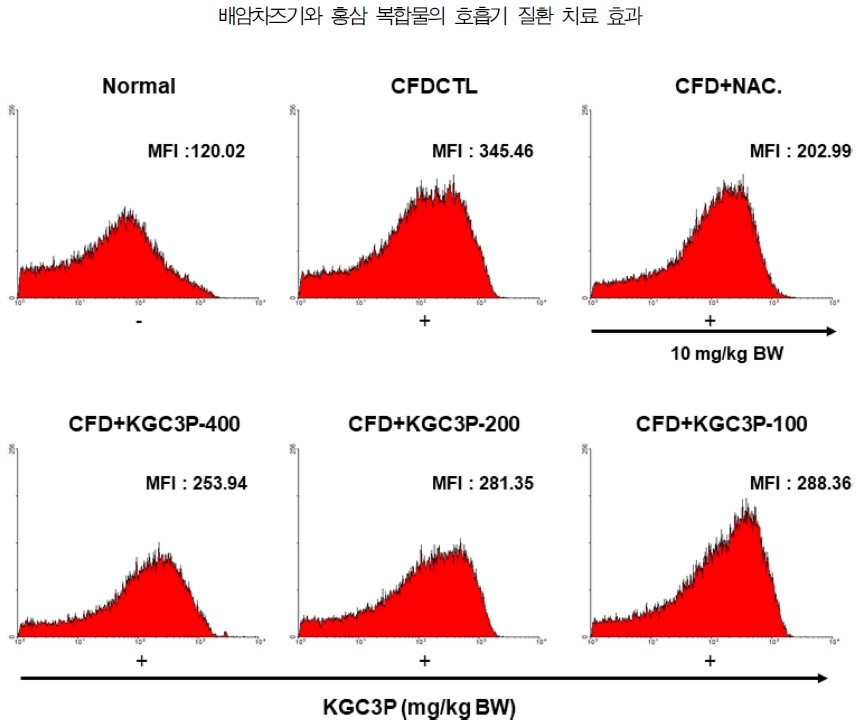
마우스의 BAL 세포의 총 세포 수를 관찰한 결과 미세먼지에 의해 유도된 호흡기 질환 마우스 그룹에서 BAL의 전체 세포 수가 증가하였으며, 증가된 BAL 및 폐의 전체 세포 수가 KGC3P를 50 ㎎/㎏, 100 ㎎/㎏, 200 ㎎/㎏, 400 ㎎/㎏ 경구 투여한 마우스 그룹에서 농도별로 감소됨을 확인할 수 있었다. 특히 KGC3P를 100 ㎎/㎏, 200 ㎎/㎏, 400 ㎎/㎏ 투여군이 대조군 (CFD_CTL)에 비하여 통계학적으로 유의성 있게 감소를 나타내었다 (p < 0.01). 또한 BAL 세포에서 호중구 수를 확인하기 위해 Diff-Quik 염색한 결과, CFD에 의해 유도된 호흡기 질환 마우스 그룹에서 호중구 (neutrophils)의 수가 증가하였으나, BAL에 침윤된 호중구 (neutrrophil)의 총세포수는 NAC와 KGC3P 용량별 (50 ㎎/㎏, 100 ㎎/㎏, 200 ㎎/㎏, 400 ㎎/㎏) 투여시 대조군 (CFD_CTL)에 비하여 통계학적으로 유의성 있게 농도 의존적 감소를 나타내었다 (Fig. 7).
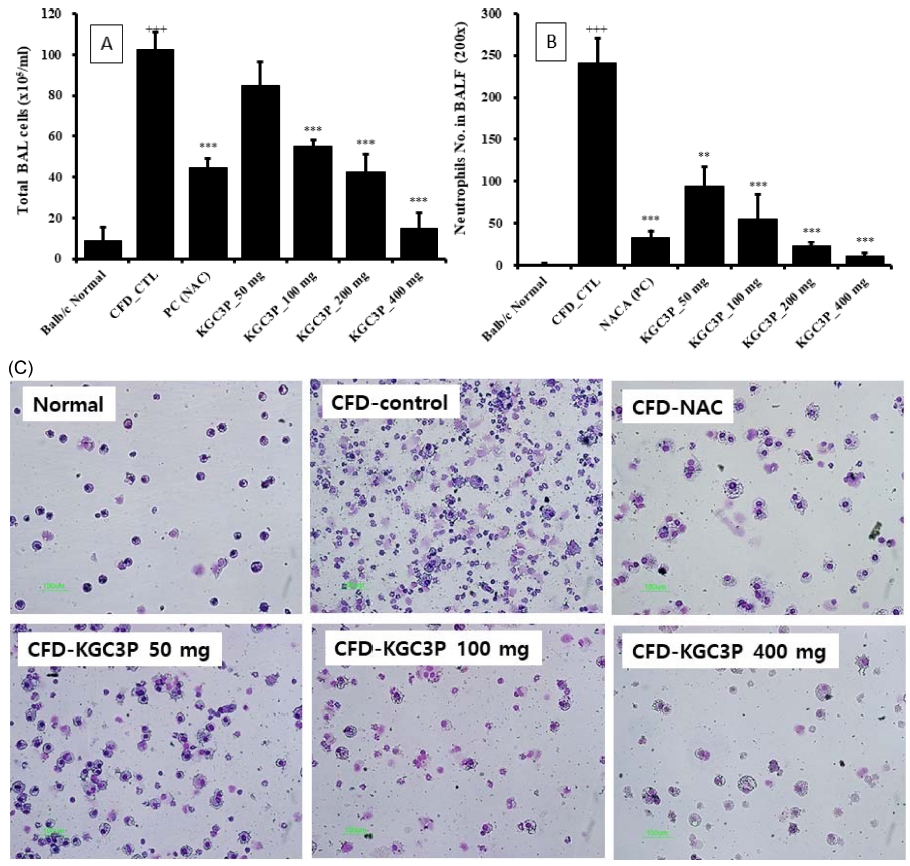
The effect of KGC3P on airway immune cell number and neutrophilic airway inflammation in coal combustion-fly ash-diesel exhaust particles complex (CFD)-induced airway inflammation mice model. Mice were treated with KGC-03-PS (50 ㎎/㎏, 100 ㎎/㎏, 200 ㎎/㎏ and 400 ㎎/㎏) and N-acetylcysteine (NAC, 10 ㎎/㎏) daily for 10 days and intra-nasal trachea injected with 4 ㎎/㎏ CFD at day 4 and day 7. At day 10, mice were sacrificed. (A) The total BAL cell and (B) neutrophils were counted using flow cytometey and cytospin, respectively. (C) photomicrograph (original magnification, × 200) of BALF cytospins from a CFD-induced airway inflammation. Data are shown as means ± SE. Significant difference from CFD-CTL control; ***p < 0.01.
CFD에 의해 유도된 호흡기 질환 마우스 모델의 기관지폐세척액에서 ROS 생성량을 관찰하기 위해, DCF-DA로 염색한 BAL fluid를 유세포 분석기를 이용하여 분석한 결과, 미세먼지에 의해 유도된 호흡기 질환 마우스 그룹의 BAL fluid에서 ROS의 생성량이 증가됨을 확인하였으며, 증가된 ROS의 생성량은 100, 200, 400 ㎎/㎏의 KGC3P 경구 투여에 의해 농도의존적으로 감소됨을 확인하였다 (Fig. 8). 따라서 KGC3P가 CFD에 의해 유도된 호흡기 산화적 손상 지표인 ROS 생성을 억제 시킨다는 사실을 알 수 있었다.
4. 배암차즈기, 홍삼 단독 및 복합물의 거담활성
페놀레드 배출법에 의한 객담배출 함량을 측정함으로써 배암차즈기, 홍삼 및 배암차즈기/홍삼 3 : 1 복합물인 KGC-03-PS에 대한 거담 활성을 평가 하였다. 배암차즈기, 홍삼 및 복합물의 200 ㎎/㎏ 경구 투여에 의해 모두 양성 대조군인 ambroxol 수준의 객담배출 효과를 보였으며, 홍삼 및 배암차즈기 단독투여군에 비해 KGC-03-PS 투여에 의해 가장 높은 거담활성이 나타났다 (Fig. 9).
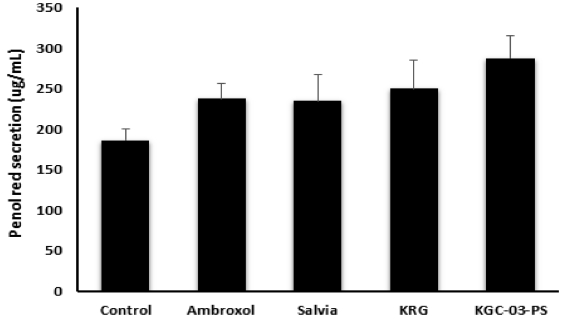
Effect of Salvia, Korea red ginseng and KGC-03-PS on the amount of tracheal phenol red secretion in mice.Mice were orally treated with Ambroxo (250 ㎎/㎏), Salvia (200 ㎎/㎏), KRG (200 ㎎/㎏) and KGC-03-PS (200 ㎎/㎏). Results are expressed as means ± SE. 2 – 3 experiments. Significant difference from vehicle control; **p < 0.05.
5. 배암차즈기/홍삼 복합물의 용량별 기관지 수축 억제 활성
배암차즈기/홍삼 3 : 1 복합물인 KGC-03-PS가 적출기관지수축에 미치는 영향을 측정하여 Fig. 10에 나타내었다. 기니픽에서 적출한 기관기는 carbachol 처리에 의해 수축이 유발 되었다. 양성 대조군인 rolimpram에 의해 약 18% 기관지 수축억제 활성이 나타났으며, KGC-03-PS 투여에 의해 농도의존적으로 기관지 수축억제 활성이 나타났으며, 200 또는 400 ㎍/㎖ 처리시 통계학적으로 유의한 (p < 0.01) 이완율을 나타내어 높은 기관지수축 억제 활성을 확인하였다.
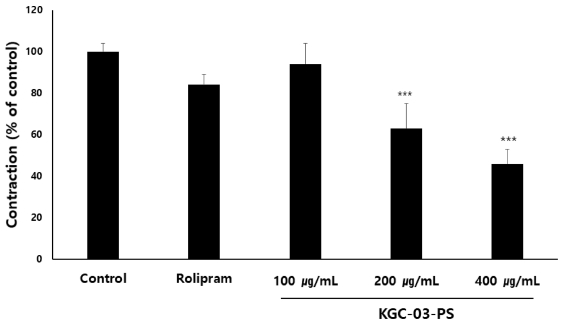
Effect of KGC-03-PS on carbachol-induced contraction of isolated trachea from guinea pigs. The concentration are expressed as a percentage of the maximal concentration induced by carbachol (25 ng/㎖). Rolipram; 5 ㎍/㎖. Each bar represents the means ± SE. of 2 - 3 experiments. Significant difference from vehicle control; ***p < 0.01.
본 연구에서는 항산화 및 항염증 활성이 보고된 홍삼과 배암차즈기에 대한 비율별 혼합물에 대한 효능을 비교한 결과, 항산화 활성은 홍삼함량이 많을수록 높았고, 함염증 활성은 배암차즈기 함량이 많을수록 높았다. 그중 배암차즈기 홍삼 3 : 1 혼합물에서만 대조군에 비해 높은 수준 (p < 0.01)의 ROS 생성 및 leukotriene 발현 억제 활성이 모두 나타났다. 대기오염물질 (CFD)에 의해 유발된 호흡기 손상 마우스 모델에서 홍삼 및 배암차즈기 단독 투여군에 비해 배암차즈기/홍삼 복합물에 의한 호흡기염증 억제 시너지 효과를 확인하였고, 또한 염증 사이토카인과 케모카인의 회복을 관찰할 수 있었다. 또한 거담활성 및 기관지 수축억제 실험을 통해서 배암차즈기/홍삼 3 : 1 복합물 (KGC-03-PS)의 호흡기 기능 보호 및 개선 효능을 검증하였고, 지표 및 유효성분인 nepetin, ginseniside Rg1, Rb1, Rg3의 함량을 분석하였다. 따라서 KGC-03-PS는 대기오염물질 등에 의해 유발된 호흡기 손상의 염증을 개선하고 호흡기 관련 질병의 치료에 도움을 줄 수 있을 것으로 보인다.
Acknowledgments
본 연구는 농림수산식품기술기획평가원의 고부가가치식품기술개발사업(과제번호: 115002-03)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Akiyama, K., (2006), Gas chromatographic analysis and aerosol mass spectrometer measurement of diesel exhaust particles composition, Talanta, 70, p178-181.
[https://doi.org/10.1016/j.talanta.2006.02.044]

- Bae, KC, and Kim, SH., (1998), Antioxidant effects of Korea ginseng radix, Korean red ginseng radix and total saponin, Korean Journal Oriental Medical Pathology, 12, p72-81.
-
Barnes, PJ., (1994), Cytokines as mediators of chronic asthma, American Journal of Respiratory and Critical Care Medicine, 150, p42-49.
[https://doi.org/10.1164/ajrccm/150.5_pt_2.s42]

-
Bohadana, AB, Massin, N, Wild, P, Toamain, JP, Engel, S, and Goutet, P., (2000), Symptoms, airway responsiveness, and exposure to dust in beech and oak wood workers, Occupational and Environmental Medicine, 57, p268-273.
[https://doi.org/10.1136/oem.57.4.268]

-
Brandt, EB, Kovacic, MB, Lee, GB, Gibson, AM, Acciani, TH, Le Cras, TD, Ryan, PH, Budelsky, AL, Khurana, and Hershey, GK., (2013), Diesel exhaust particle induction of IL-17A contributes to severe asthma, Journal of Allergy and Clinical Immunology, 132, p1194-1204.
[https://doi.org/10.1016/j.jaci.2013.06.048]

-
Chen, T, Xiao, L, Zhu, L, Ma, S, Yan, T, and Ji, H., (2015), Anti-asthmatic effects of ginsenoside Rb1 in a mouse model of allergic asthma through relegating Th1/Th2, Inflammation, 38, p1814-1822.
[https://doi.org/10.1007/s10753-015-0159-4]

-
Cho, BO, Yin, HH, Fang, CZ, Ha, HO, Kim, SJ, Jeong, SI, and Jang, SI., (2015), Synergistic anti-inflammatory effect of rosmarinic acid and luteolin in lipopolysaccharide-stimulated RAW264.7 macrophage cells, Korean Journal of Food Science and Biotechnology, 47, p119-125.
[https://doi.org/10.9721/kjfst.2015.47.1.119]

- Cho, YS, Lee, JT, Jung, CH, Chun, YS, and Kim, YS., (2008), Relation between particulate matter measured by optical particle counter and mortality in Seoul, Korea, during 2001, Journal of Environmental Health, 71, p37-43.
-
Choi, JK, Oh, HM, Lee, SY, Kwon, TK, Shin, TY, Rho, MC, and Kim, SH., (2014), Salvia plebeia suppresses atopic dermatitis-like skin lesions, The American Journal of Chinese Medicine, 42, p967-985.
[https://doi.org/10.1142/s0192415x1450061x]

-
Choi, SI, Cho, IH, Han, SH, Jeon, YJ, Choi, JG, Kim, JS, and Lee, JH., (2016), Antiobesity effects of Salvia plebeia R. Br. extract in high-fat diet-induced obese mice, Journal of Medicinal Food, 19, p1048-1056.
[https://doi.org/10.1089/jmf.2016.3763]

-
Costa, RS, Carneiro, TC, Cerqueira-Lima, AT, Queiroz, NV, Alcântara-Neves, NM, Pontes-de-Carvalho, LC, Velozo, Eda S, Oliveira, EJ, and Figueiredo, CA., (2012), Ocimum gratissimum Linn. and rosmarinic acid, attenuate eosinophilic airway inflammation in an experimental model of respiratory allergy to Blomia tropicalis, International Immunopharmacology, 13, p126-134.
[https://doi.org/10.1016/j.intimp.2012.03.012]

-
Ghio, AJ, Smith, CB, and Madden, MC., (2012), Diesel exhaust particles and airway inflammation, Current Opinion in Pulmonary Medicine, 18, p144-150.
[https://doi.org/10.1097/mcp.0b013e32834f0e2a]

- Gu, L, and Weng, X., (2001), Antioxidant activity and components of Salvia plebeia R. Br. Chinese Herb, Food Chemistry, 73, p299-305.
- Inoue, KI, Koike, E, Yanagisawa, R, and Takano, H., (2008), Effects of pulmonary exposure to diesel exhaust particles on extrathoracic CD4 polarization in asthmatic mice, Immunopharmacology and Immunotoxicology, 31, p1-6.
-
Jang, HH, Cho, SY, Kim, MJ, Kim, JB, Lee, SH, Lee, MY, and Lee, YM., (2016), Anti-inflammatory effects of Salvia plebeia R. Br extract in vitro and in ovalbumin-induced mouse model, Biological Research, 49, p41, (cited by 2019 May 5).
[https://doi.org/10.1186/s40659-016-0102-7]

- Jang, TY, Jung, AY, Kyung, TS, Kim, DY, Hwang, JH, and Kim, YH., (2017), Anti-allergic effect of luteolin in mice with allergic asthma and rhinitis, Central-European Journal of Immunology, 42, p24-29.
- Jeon, BH, Kim, HS, and Chang, SJ., (1999), Effect of saponin and non-saponin of on Panax ginseng on the blood pressure in the renovascular hypertensive rats, Journal of Ginseng Research, 23, p81-87.
-
Jones, TR, Labelle, M, Belley, M, Champion, E, Charette, L, Evans, J, Ford-Hutchinson, AW, Gauthier, JY, Lord, A, Masson, P, McAuliffe, M, McFarlane, CS, Metters, KM, Pickett, C, Piechuta, H, Rochette, C, Rodger, IW, Sawyer, N, Yoyng, RN, Zamboni, R, and Abraham, WM., (1995), Pharmacology of montelukast sodium(Singulair), a potent and selective leukotriene D4 receptor antagonist, Canadian Journal of Physiology and Pharmacology, 73, p191-201.
[https://doi.org/10.1139/y95-028]

-
Jung, KY, Kim, DS, Oh, SR, Lee, IS, Lee, JJ, Park, JD, Kim, SI, and Lee, HK., (1998), Platelet activating factor antagonist activity of ginsenosides, Biological and Pharmaceutical Bulletin, 21, p79-80.
[https://doi.org/10.1248/bpb.21.79]

-
Keum, YS, Park, KK, Lee, JM, Chun, KS, Park, JH, Lee, SK, Kwon, HJ, and Surh, YJ., (2000), Antioxidant and anti-tumor promoting activities of the methanol extract of heat-processed ginseng, Cancer Letters, 150, p41-48.
[https://doi.org/10.1016/s0304-3835(99)00369-9]

- Kim, DH, Kwak, KH, Lee, KJ, Kim, SJ, Shin, YC, Chun, BG, and Shin, KH., (2004), Effect of Korea red ginseng total saponin on repeated unpredictable stress-induced changes of proliferation of neural progenitor cells and BDNF mRNA expression in adult rat hippocampus, Journal of Ginseng Research, 28, p94-103.
-
Kim, JH, Lee, TJ, Im, JA, and Lee, DC., (2014), Effect of Korean red ginseng on artificial sand dust(ASD) induced allergic lung inflammation, Biomedical Science Letters, 20, p173-179.
[https://doi.org/10.15616/bsl.2014.20.3.173]

-
Kolaczkowska, E, and Kubes, P., (2013), Neutrophil recruitment and function in health and inflammation, Nature Reviews Immunology, 13, p159-175.
[https://doi.org/10.1038/nri3399]

-
Lee, WC, Jung, HA, Choi, JS, Kim, YS, and Lee, SM., (2011), Protective effects of luteolin against apoptotic liver damage induced by D-galactosamine/lipopolysaccharide in mice, Journal of Natural Productions, 74, p1916-1921.
[https://doi.org/10.1021/np2003935]

-
Liang, Z, Nie, H, Xu, Y, Peng, J, Zeng, Y, Wei, Y, Wen, X, Qiu, J, Zhong, W, Deng, X, and He, J., (2016), Therapeutic effects of rosmarinic acid on airway responses in a murine model of asthma, International Immunopharmacology, 41, p90-97.
[https://doi.org/10.1016/j.intimp.2016.10.010]

- Lim, HB, and Kim, SH., (2009), The effect of crude saponins of Korean red ginseng against airway inflammation and airway hyperresponsiveness induced by exhaust particles in mice, Korean Journal of Medicinal Crop Science, 17, p90-96.
-
Lin, BQ, Li, PB, Wang, YG, Peng, W, Wu, Z, Su, WW, and Ji, H., (2008), The expectorant activity of naringenin, Pulmonary Pharmacology & Therapeutics, 21, p259-263.
[https://doi.org/10.1016/j.pupt.2007.05.001]

- Mahady, Gail B, Fong, Harry HS, and Farnsworth, NR., (2001), Botanical Dietary Supplements, CRC Press, Boca Raton. FL, USA, p207-215.
- Nam, KY., (2005), The comparative understanding between red ginseng and white ginseng processed ginseng(Panax ginseng C.A. Meyer), Journal of Ginseng Research, 29, p1-18.
-
Nials, AT, and Uddin, S., (2008), Mouse models of allergic asthma: Acute and chronic allergen challenge, Disease Models and Mechanisms, 1, p213-220.
[https://doi.org/10.1242/dmm.000323]

-
Shin, HJ, Gwak, HM, Jang, M, Park, SH, Min, HJ, Lee, JM, Lee, MY, Kim, JH, Kim, SW, Han, CK, and Kim, SH., (2016), Ani-inflammatory activity of three kinds of Salvia and its active compounds, Korea Journal of Medicinal Crop Science, 24, p401-407.
[https://doi.org/10.7783/kjmcs.2016.24.5.401]

- Song, HW, Ji, KY, Kim, BK, Yang, WK, Han, CK, Shin, HJ, Park, YC, Hwang, JS, Kang, HS, and Kim, SH., (2017), Respiratory protective effect of Salvia plebeia R. Br. extracts against ambient particulate matter-induced airway inflammation, Korea Journal of Medicinal Crop Science, 25, p269-281.
-
Talib, WH, Zarga, MH, and Mahasneh, AM., (2012), Antiproliferative, antimicrobial and apoptosis inducing effects of compounds isolated from Inula viscosa, Molecules, 17, p3291-3303.
[https://doi.org/10.3390/molecules17033291]

- Wichmann, HE., (2007), Diesel exhaust particles, Inhalation Toxicology, 19, p241-244.
-
Yin, Y, Gong, FY, Wu, XX, Sun, Y, Li, YH, Chen, T, and Xu, Q., (2008), Anti-inflammatory and immunosuppressive effect of flavones isolated from Artemisia vestita, Journal of Ethnopharmacology, 120, p1-6.
[https://doi.org/10.1016/j.jep.2008.07.029]

- Yoshitaka, I., (2007), Research on the quality distribution of JIS type-Ⅱ fly ash in Japan, World of Coal Ash, www.flyash.info/2007/67ishikawa.pdf (cited by 2019 May 7).