
생육시기 별 새싹율무의 유리당, 기능성 성분 및 항산화활성 변화
 ; Jeong Hoon Lee*
; Jeong Hoon Lee* ; Jin Tae Jung*
; Jin Tae Jung* ; Yun Ji Lee*
; Yun Ji Lee* ; Myeong Won Oh*
; Myeong Won Oh* ; Jae Ki Chang*
; Jae Ki Chang* ; Heon Sang Jeong**, †
; Heon Sang Jeong**, † ; Chun Geon Park*, ‡
; Chun Geon Park*, ‡
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Adlay (Coix lacryma-jobi L. var. ma-yuen Stapf.) is an important medicinal and cereal crop that contains high levels of protein, fatty acids and crude fiber, as well as calcium, phosphorus, zinc, minerals, and essential amino acids. Despite its economic significance, little is known about biological activity in adlay sprouts. This study investigated the total free sugar, polyphenol and flavonoid content, and antioxidative activity in adlay sprouts at different growth stages.
The total free sugar and coixol content of germinated adlay sprouts were analyzed by high performance liquid chromatography. The total phenolic content was measured by the Folin and Denis, and flavonoid content by the Davis method. Antioxidative activity was tested by the 2,2-diphenyl-1-picryl hydrazyl method. All measured component, including total phenolic and coixol content (2.71 ± 0.02 ㎎/g and 59.70 ± 0.01 ㎎/g), and antioxidant capacity (IC50; 453.93 ㎍/㎖) were highest in 3 day old adlay sprouts. In contrast, total free sugar and flavonoid content (3.02% and 0.60 ± 0.02 ㎎/g) were highest in sprouts at 5 days after sowing. In addition, there was a strong positive correlation between antioxidative activity and total polyphenol content (r = 0.902, p < 0.001).
Adlay sprouts between 3 days and 5 days following germination contain high levels of functional components and free sugar. This study therefore suggests that adlay sprouts can be developed as a valuable health-promoting food and a good source of natural antioxidants.
Keywords:
Coix lacryma-jobi L. var. ma-yuen Stapf., Adlay, Antioxidant, Flavonoids, Free sugar, Polyphenols, Sprout서 언
율무 (Coix lacryma-jobi L. var. ma-yuen Stapf.)는 화본과에 속하는 1년생 초본식물로서 주로 아시아 지역의 열대 및 아열대에 분포한다 (Lee et al., 2002). 율무는 다른 잡곡에 비해 단백질, 지방 및 조섬유 함량이 높고 칼슘, 인, 아연, 미네랄 및 필수아미노산을 함유하고 있어 (An et al., 2015) 주로 율무쌀이나 율무차 등의 건강보조식품으로 이용되어왔다 (Yoon et al., 1997).
한의학에서는 율무의 약명을 의이인 (薏苡仁) 이라고 부르며 이뇨, 소염 및 진통 등의 효과가 있어 신장질환, 신경통, 당뇨병 등의 치료에 사용되어왔다 (Kim and Lee, 2000). 또한 율무에는 coixenolide, coixol, lactams 등의 생리활성물질이 함유되어 있어 항산화, 항염증 및 항고혈압 등에 효과가 있는 것으로 보고되고 있다 (Sato and Osawa, 2010; Chung et al., 2011; Wang et al., 2012; Xi et al., 2016). 이러한 기능성분 중 coixol과 coixenolide는 진통 및 항암효과가 있어 최근 항암제로 개발되고 있다 (Zhang et al., 2019). 이와 같이 영양학적, 약리학적 우수성에도 불구하고 율무는 대부분 잡곡 또는 차로 이용되어왔으며 관련 연구 또한 율무첨가물 및 가공품의 특성과 같은 조리과학적 연구가 대부분이었다 (Paik and Chun, 1989; Park and Lee, 1999; Chae and Hong, 2007).
최근 질병예방 및 치료를 위한 목적으로 채소나 잡곡과 같은 식물성 식품 섭취에 대한 관심이 증가하고 있다 (Lee et al., 2009; Park et al., 2011). 그 중 새싹 채소는 건강식품으로 각광 받고 있어 무 (Park et al., 2015), 메밀 (Choi et al., 2015), 보리 (Lee et al., 2018), 땅콩 (Kim, 2013) 및 인삼 (Jang et al., 2018) 등의 새싹을 활용한 기능성 식품소재 개발 연구가 활발히 진행되고 있다.
새싹은 일반적으로 발아한지 일주일 정도 된 어린 떡잎 상태를 말하며, 이 때 각종 아미노산, 효소, 비타민, 무기질을 비롯한 식이섬유를 다량 함유하고 있다 (Shin et al., 2009). 또한 발아과정 중 지방 및 칼로리가 낮아지며 외부 공격으로부터 자신을 보호하기 위하여 다양한 생리활성물질을 생성한다 (Khalil et al., 2007). 땅콩의 경우 종자보다 새싹에서 resveratrol의 함량이 더 높은 것으로 보고되었으며 (Wang et al., 2005), 보리새싹은 알콜성 지방간질환 예방에 효과가 탁월한 polycosanol과 saponarin이 다량으로 함유되어 있는 것으로 보고되었다 (Ramakrishna et al., 2017). 새싹인삼의 경우 주요 생리활성 성분인 사포닌 함량이 뿌리에 비하여 6 배 높고 비타민 C 함량은 65.9 ㎎/g 정도로 높아 식품재료로 활용 가치가 매우 높다고 보고되었다 (Shi et al., 2007; Jang et al., 2018).
새싹이 갖는 식품소재의 이점에도 불구하고 현재까지 율무는 주로 종자와 뿌리의 생리활성 및 성분에 대한 연구가 대부분이었으며, 율무새싹에 관한 연구는 미비한 실정이다. 따라서 본 연구는 율무새싹의 생육시기 별 유리당, 기능성 성분 및 항산화 효과를 조사하여 율무 새싹의 기능성 식품 및 의약품 소재로서의 활용성을 알아보고자 한다.
재료 및 방법
1. 실험재료
본 실험은 2018년 10월부터 2018년 11월까지 국립원예특작과학원 인삼특작부 환경조절온실에서 수행되었다. 실험재료는 2005년 경기도농업기술원에서 육성된 ‘조현’ 품종을 사용하였으며 An 등 (2015) 의 방법으로 종자소독 및 침종을 실시하였다. 소독된 종자를 실온에서 3 시간 음건한 후 펄라이트가 담긴 직경 15 ㎝, 높이 20 ㎝의 포트에 파종하였다. 이 후 온도 23 ± 2℃, 습도 75 ± 10%, 광도 80 ± 10 μ㏖ · m−2· s−1 조건에서 10 일간 재배하였다. 발아일수 기간에 따른 생리활성과 지표성분 변이를 알아보기 위하여 3 일, 5 일, 7 일, 9 일 발아된 율무 (Coix lacryma-jobi L. var. ma-yuen Stapf.)의 새싹을 채취하였다. 채취한 새싹을 세척한 후 –80℃에서 24 시간 동결 건조하여 분쇄한 것을 4℃에 보관하면서 실험에 사용하였다.
2. 발아일수에 따른 생육특성 조사 및 유리당 함량분석
새싹율무의 생육특성은 재배 후 3 일에서 9 일까지 2 일 간격으로 시행되었으며 새싹의 총 길이 및 생체중, 엽초와 엽신의 길이를 3 개체씩 3 반복으로 측정하였다.
유리당 함량 측정은 건조시료 0.5 g에 증류수 25 ㎖를 가하고 30 분간 초음파 추출한 다음 3,000 rpm에서 10 분간 원심분리하여 상등액을 취한 후 동일한 방법으로 반복하여 50 ㎖을 획득하였다. 이 후 50 ㎖의 추출물을 0.45 ㎛ syringe filter (Millipore, Bedford, MA, USA)로 여과시킨 시료를 HPLC systems (Alliance 2695, Waters, Milford, MA, USA)으로 분석하였다. 컬럼은 Shodex NH2P-50 (4.6 ㎜ × 150 ㎜, Showa Denko, Tokyo, Japan), 검출기는 ELSD (Waters 2420 ELSD, Waters, Milford, MA, USA)를 사용하였으며, 이동상은 75% acetonitrile, 유속은 1.5 ㎖/min, 시료주입량은 10 ㎕이었다. 표준물질로는 glucose, fructose, sucrose 및 maltose (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였다.
3. 총 폴리페놀 및 총 플라보노이드 함량분석
총 폴리페놀 함량 측정은 Folin and Denis (1912)의 방법을 변형시켜 실시하였다. 각 시료용액 0.2 ㎖에 증류수 0.8 ㎖와 Folin-Ciocalteau's phenol reagent 0.1 ㎖를 가하여 실온에서 3 분간 반응시켰다. 여기에 포화 Na2CO3 용액 0.2 ㎖과 증류수 1.8 ㎖를 가하여 혼합하고 실온에서 1 시간 반응시킨 후 725 ㎚에서 흡광도를 측정하였다. 표준물질인 catechin을 이용하여 농도별 표준 곡선을 작성한 후 총 폴리페놀 함량을 구하였다.
총 플라보노이드 함량은 Davis (1947)의 방법을 변형시켜 실시하였다. 에탄올 추출물 0.2 ㎖에 1 N NaOH 0.2 ㎖와 diethylene glycol 2 ㎖를 첨가하여 37℃ 항온수조에서 1 시간 반응시킨 후 420 ㎚에서 흡광도를 측정하였다. 표준물질로는 naringin을 이용하였으며 표준곡선을 작성한 후 각 시료의 총 플라보노이드 함량을 구하였다.
4. DPPH 라디컬 소거능 측정
추출물의 2,2-diphenyl-1-picryl hydrazyl (DPPH)에 의한 전자공여능 (electron donating ability, EDA)은 Jothy 등 (2011)의 방법에 따라 측정하였다. 0.2 mM DPPH 용액 40 ㎕에 시료 160 ㎕를 첨가한 후 실온에서 30 분 방치하여 517 ㎚에서 흡광도 감소치를 측정하였다. 시료 추출물의 농도를 3 구간으로 희석하여 흡광도를 측정한 후 EDA 값을 50% 감소시키는 IC50 (inhibition concentration)을 각 시료의 농도로 표현하였다. 모든 실험은 3 회 반복 측정하였으며 아래의 식으로 계산하였다.
ODsample; 추출물을 넣었을 때의 흡광도 값
ODcontrol; 추출물대신 동량의 증류수를 첨가했을 때의 흡광도 값
5. ABTS radical 소거능 측정
2,2′-azinobis-(3-ethylbenzothiazoline-6-sulphonate) (ABTS) radical을 이용한 항산화력 측정은 Re 등 (1999)의 방법으로 수행되었다. 7mM ABTS 용액과 2.45mM potassium persulpate을 1 : 1로 혼합하여 30℃인 암실에서 12 시간 이상 방치한 후 5 mM potassium phosphate buffer (pH 7.4)를 이용하여 734 ㎚에서 흡광도 값이 0.7 - 0.8이 되도록 희석하였다. 희석된 용액 180 ㎕에 시료 20 ㎕을 가하여 5 분 방치한 후 흡광도를 측정하였고 시험군과 대조군의 간의 흡광도비 (%)로 나타내었다. 대조구는 ascorbic acid를 사용하였고 DPPH 라디칼에 대한 전자공여능과 동일한 식을 이용하여 ABTS 라디칼에 대한 전자공여능과 IC50을 산출하였다.
6. 발아 단계에 따른 coixol 함량변이
율무의 지표성분인 coixol의 함량 측정은 Zhang 등 (2010)의 방법을 변형하여 다음과 같이 실시하였다. 건조 율무새싹 20 ㎎에 MeOH 1 ㎖을 가하여 1 시간 동안 ultrasonicator (Kodo Technical Research Co., Ltd., Hwaseong, Korea)에서 추출한 후 다시 30 초 동안 vortexing 하였다. 이 후 60℃에서 1 시간 동안 추출한 후 12,000 rpm에서 15 분간 원심분리하여 얻은 상등액을 모았다. 위의 방법을 2 회 반복하여 얻어진 추출물 1 ㎖을 0.2 ㎛ syringe filter (Nalgene, Rochester, NY, USA)로 여과하여 분석시료로 사용하였다. 정량분석을 위하여 coixol 표준품 (Sigma-Aldrich Co., St. Louis, MO, USA)을 13, 25, 50, 100, 200, 400 ppm의 농도로 분석하여 y = 20.638x - 26.714 (R2= 0.99)의 검량선을 작성하였다.
Coixol의 정량분석은 Agilent 1100 Series HPLC (Agilent Technologies, Palo Alto, CA, USA)를 이용하였으며 분석 조건은 다음과 같다. 실험에 사용된 컬럼은 YMC ODS-AM (4.6 ㎚ × 250 ㎚, 5 ㎛, YMC Co., Ltd., Kyoto, Japan)이며 측정온도는 25℃, 유속은 1.0 ㎖/min, UV 검출기는 290 ㎚ 파장으로 설정하였다. 이동상으로는 acetonitrile과 0.1% phosphoric acid (25 : 75, v/v)를 사용하였고 기울기 용리조건 (gradient system)을 이용하여 분석하였다.
7. 통계처리
통계분석은 SAS 프로그램 (ver. 9.1; SAS Institute Inc., Cary, NC, USA)을 이용하여 각 측정군의 평균과 표준편차를 산출하고, p < 0.05 수준에서 Duncan's Multiple Range Test (DMRT)로 유의성을 검정하였으며 상관관계는 Pearson의 적률 상관계수 (Pearson’s correlation coefficient)를 이용하여 유의성을 표기하였다.
결과 및 고찰
1. 발아일수에 따른 새싹율무의 생육특성 및 유리당 함량 변화
발아일수에 따른 율무 (Coix lacryma-jobi L. var. ma-yuen Stapf.)새싹의 생육특성 변화는 Fig. 1과 같다. 파종 후 1 일에서 2 일 경과 후에 새싹이 출아되었으며 3 일차부터 5 일차까지 엽초와 엽신의 신장이 급격하게 이루어졌다. 이 후 7 일차부터 9 일차까지 본엽이 전개되기 시작하였다. 율무새싹은 생육이 진전됨에 따라 초장과 생체중이 뚜렷하게 증가하였다. 3 일차의 초장과 생체중은 각각 21.62 ± 1.66 ㎜과 224.5 ± 40.38 ㎎인 반면 9 일차에서는 각각 165.46 ± 9.01 ㎜와 498.01 ± 64.73 ㎎으로 확인되어 초장은 약 8 배, 생체중은 약 2 배 가량 증가된 것을 알 수 있었다. 특히 엽초와 엽신이 출현하는 3 일차와 5 일차 사이에서 길이 (21.62 ± 1.66 ㎜ → 70.48 ± 4.56 ㎜)와 부피생장 (224.5 ± 40.38 ㎎ → 412.04 ± 48.43 ㎎)이 급격하게 이루어졌다 (Table 1). 이는 배유의 저장양분이 엽초와 엽신으로 이동되어 왕성한 생장을 유도함으로써 초장과 생체중이 증가된 것으로 판단된다. 새싹으로 재배되는 보리, 메밀, 무, 땅콩 등을 포함한 대부분의 작물에서도 3 일에서 6 일 사이에 엽초, 엽신, 상배축 및 하배축 등의 초기생육이 가장 활발하고 이 시기에 유용성분의 함량이 가장 많이 증대되는 것으로 알려져 있다 (Kim, 2013; Choi et al., 2015; Park et al., 2015; Lee et al., 2018).
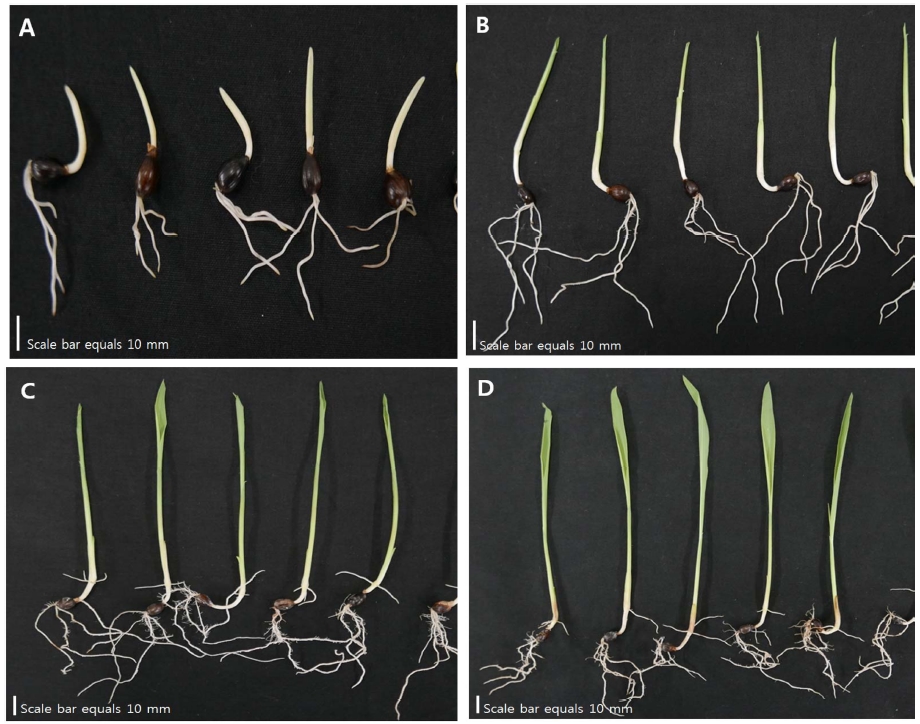
Adlay sprouts at different germination stages. A; representing initial radicle and epicotyl emergence (after 3 days), B; representing emergence of the coleoptile (after 5 days), C; representing epicotyl and coleoptile elongation (after 7 days), D; representing first leaf and root elongation and differentiation (after 9 days).
발아일수에 따른 율무 새싹의 유리당 함량 변화는 Fig. 2와 Table 2와 같다. 율무 새싹의 총 유리당 함량은 2.02% - 3.02% 사이에 분포하였으며 5 일차 새싹이 3.02%로 가장 높은 함량을 보였다. 발아 후 5 일차까지 총 유리당 함량이 증가하다가 이후 감소하는 경향을 보였다. Glucose와 fructose의 함량은 각각 5 일차 (2.72 ± 0.04%)와 7 일차 (0.39 ± 0.01%)에서 가장 높았으며 sucrose, maltose의 함량은 발아일수에 따라 유의적인 차이를 나타내지 않았다. 이러한 결과는 단자엽 식물인 벼, 호밀, 밀 등의 곡류에서 발아 이후 glucose와 fructose의 함량이 증가한 결과와 매우 유사하였다 (Kim et al., 2010; Kim et al., 2015). 이와 같은 유리당 함량 변화는 발아 시 α-amlyase 등과 같은 효소의 활성이 증가함에 따라 탄수화물이 분해되어 fructose 및 glucose와 같은 단당류로 전환되었기 때문이라 판단된다 (Kim, 2008).
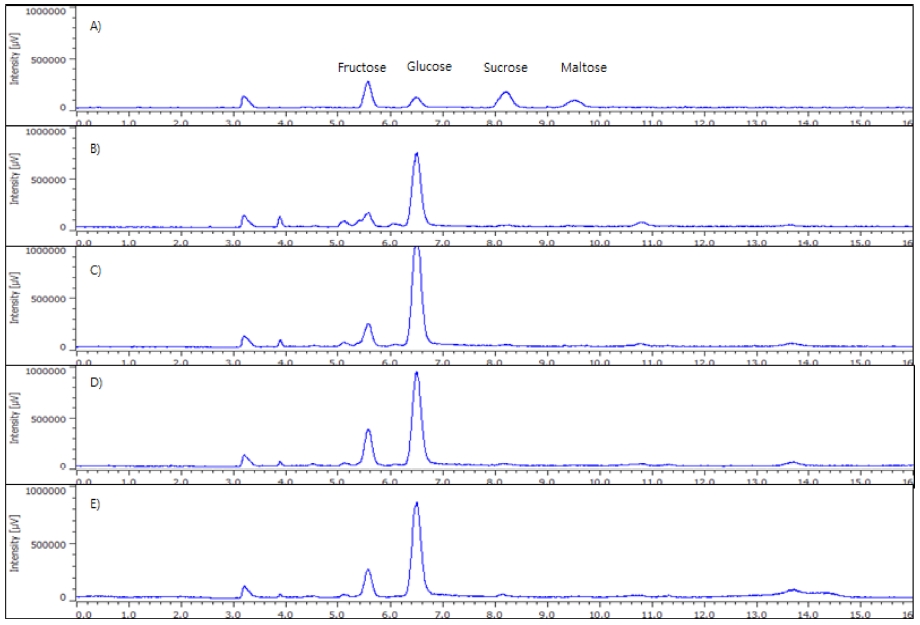
HPLC chromatogram of free sugars from adlay sprouts. A); standard (fructose, glucose, sucrose and maltose), B); germinated seeds for 3 days, C); germinated seeds for 5 days, D); germinated seeds for 7 days, E); germinated seeds for 9 days.
유리당은 식품의 향기와 감미에 영향을 주기 때문에 식품소재 개발에 매우 중요한 요소로 작용한다. 또한 새싹은 짧은 생육기간 동안 종자에서 출현하는 어린 잎을 사용하기 때문에 수확물의 생산량이 고려되어야 한다. 이상의 결과로 볼 때 율무 새싹의 최적 재배 기간은 5 일 전후로 판단되었다.
2. 발아일수에 따른 새싹율무의 항산화 물질 및 항산화 활성 변이
율무의 발아일수 별 항산화 물질의 함량변이를 알아보기 위하여 총 폴리페놀 및 총 플라보노이드를 각각 측정하였다. 율무 새싹은 발아 후 3 일에서 총 폴리페놀 함량이 가장 높았고 7 일차에서 총 플라보노이드 함량이 가장 높았다. 전반적으로 생육기시별 항산화 물질의 함량은 총 폴리페놀 함량이 총 플라보노이드 함량 보다 4 배에서 5 배 정도 높았다. 특히 발아 후 3 일차에서 총 폴리페놀의 함량이 2.71 ± 0.02 ㎎/g으로 가장 높았으며 총 플라보노이드 함량은 발아 후 7 일차에서 0.60 ± 0.02 ㎎/g으로 가장 높았다. 새싹 율무의 총 폴리페놀 함량은 발아 후 3 일차까지 증가하다가 이후 점차 감소하는 경향을 보였다. 총 플라보노이드의 함량은 7 일차까지 증가하다 이후 감소하는 것으로 확인 되었다 (Table 3).
일반적으로 식물은 유묘기에 외부공격으로부터 자신을 보호하기 위하여 다양한 생리활성물질을 생산하는 것으로 알려져 있다. 보리, 땅콩, 적채 등의 새싹에서 폴리페놀과 플라보노이드는 엽초 및 배축이 신장하는 유묘기 때 축적이 되는데 (Wang et al., 2005; Vale et al., 2014; Ramakrishna et al., 2017), 본 연구의 결과와 유사한 경향으로 확인되었다. 이상의 결과로 율무새싹의 폴리페놀은 엽초와 엽신이 급격하게 신장되는 시기 (3 일차)에 합성되었다가 생육이 진전됨에 따라 점차 분해되는 것으로 판단되었다.
일반적으로 새싹은 성체의 잎줄기에 비해 높은 폴리페놀 함량을 나타내는 것으로 알려져 있다. 우엉의 경우에도 새싹에서 페놀그룹의 함량이 생육초기에 가장 높은 함량을 보이다가 성체가 되면서 그 함량이 낮아진다고 보고하였다 (Lee et al., 2009).
율무새싹도 이와 유사하게 생육이 점차 진전됨에 따라 폴리페놀이 다른 물질로 분해 또는 전환되어 사용되는 것으로 판단되었다. 플라보노이드는 엽초와 엽신이 신장하는 시기에 합성이 시작되어 본엽이 전개되는 시점까지 축적량이 증가하고 이후 일정량을 유지하는 것으로 보아 새싹과 성엽 간에 함량변이가 크지 않음을 추측할 수 있었다. 완두, 브로콜리의 유묘에서 플라보노이드의 함량은 배축이 신장하는 시기부터 본엽이 전개되는 시기까지 큰 차이가 없다고 보고되어 본 연구결과와 비슷한 경향을 보였다. 따라서 율무의 플라보노이드는 생육시기에 따라 축적량이 크게 변화하지 않아 폴리페놀과 같이 다른 물질로 전환되거나 분해되지 않는 것으로 추측되었다.
DPPH 라디컬 소거능 (IC50 값 기준)은 3 일차 새싹에서 453.93 ㎍/㎖으로 가장 강했으며 9 일차는 680.07 ㎍/㎖으로 가장 약했다. 3 일차를 기준으로 생육이 진행됨에 따라 항산화활성이 점점 낮아지는 것을 확인할 수 있었다. ABTS 라디컬 소거능 (IC50 값 기준) 또한 3 일차에서 129.00 ㎍/㎖으로 가장 강했으며 9 일차는 339.10 ㎍/㎖으로 가장 약하게 확인되어 DPPH 라디컬 소거능과 동일한 결과를 나타내었다 (Fig. 3). 이는 폴리페놀 및 플라보노이드 함량이 항산화 활성에 많은 영향을 준 것으로 판단되며 Han 등 (2019)이 오미자를 대상으로 항산화 물질 (폴리페놀, 플라보노이드)과 항산화 활성을 실험한 결과와도 매우 유사한 것으로 확인되었다.
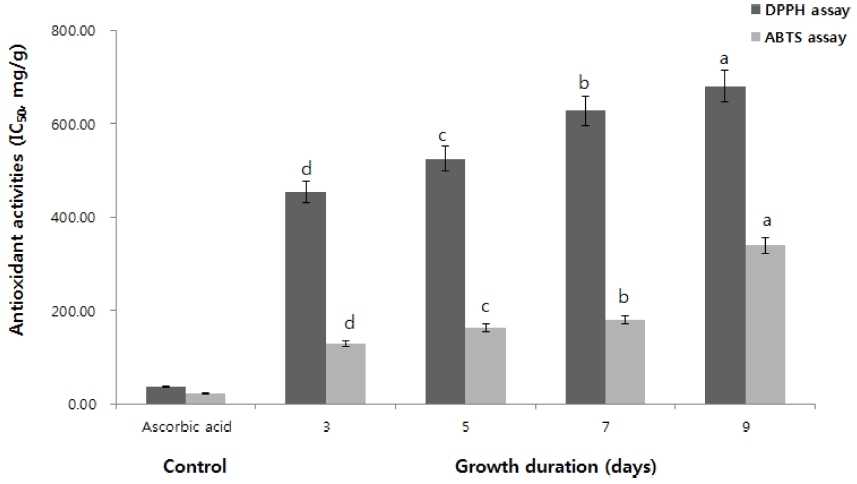
Antioxidant activity of adlay sprouts at different growth stage. Vertical bar indicated standard errors (n = 3). Different lower-case letter above each bar indicated that the means were significantly different according to the Duncan’s Multiple Range Test (DMRT, p < 0.05).
이상의 결과로, 생육일수에 따라 율무 새싹의 생리활성물질이 변화하는 것을 확인할 수 있었다. 따라서 폴리페놀과 플라보노이드와 같은 기능성 성분의 함량 변이를 고려한다면 율무새싹의 최적 재배일수는 3 - 5 일이 적당하다고 판단되었다.
3. 지표성분 함량 변화
생육일수에 따른 새싹율무의 coixol 함량 결과는 Fig. 4와 Table 4와 같다. 율무의 coixol은 주로 뿌리에 존재하는 것으로 알려져 있어 지상부와 지하부를 따로 분리하여 상대 비교하였다.
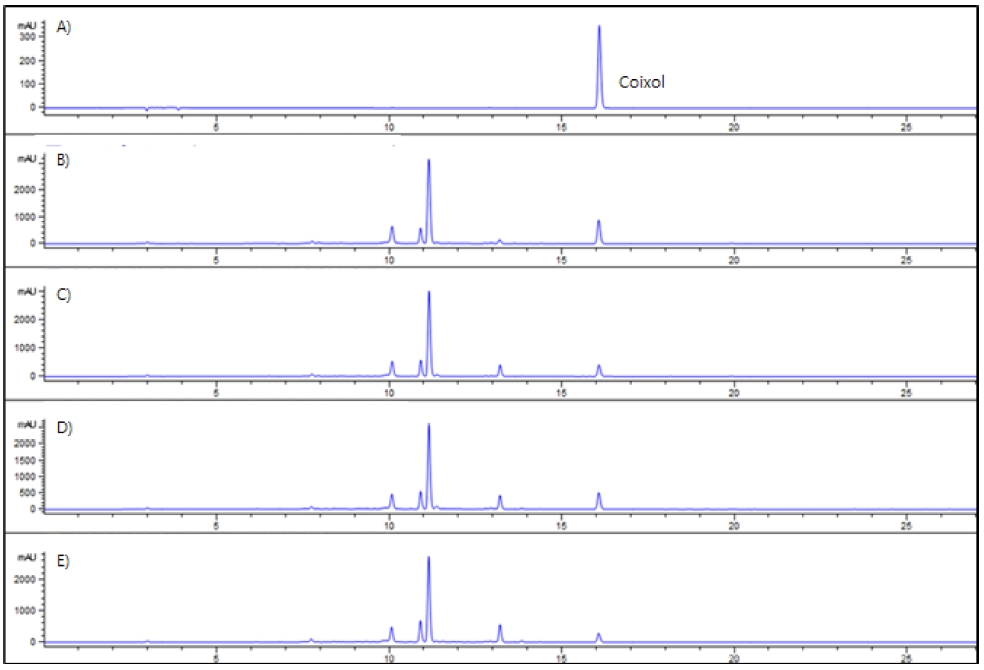
HPLC chromatogram of coixol from adlay sprouts. A); standard (coixol), B); germinated seeds for 3 days, C); germinated seeds for 5 days, D); germinated seeds for 7 days, E); germinated seeds for 9 days.
생육이 진전 될수록 지상부의 coixol 함량은 유의하게 감소하는 경향이 있었고 가장 높은 3 일차 (59.70 ± 0.01 ㎎/g)와 가장 낮은 9 일차 (17.76 ± 0.05 ㎎/g) 간 함량은 약 3 배 이상 차이가 났다. 지하부에 존재하는 coixol의 함량은 지상부와는 달리 생육이 진전될수록 증가하는 경향을 보이다가 9 일차에 감소하는 것으로 확인되었다. 지금까지 coixol은 주로 율무의 뿌리에 많이 함유되어 있는 것으로 보고되었으나 본 연구 결과 3 일차 새싹 (59.70 ± 0.01 ㎎/g)에 가장 많이 함유되어 있었다. 뿌리의 경우 7 일차 (1.87 ± 0.01 ㎎/g) 에서 가장 높은 함량을 보였으나 3 일차 새싹의 1/30 수준으로 존재하였다 (Table 4).
율무의 유용성분인 coixol은 alkaloids계 천연물로 알려져 있으며 항염, 항산화 및 항알러지에 효과가 탁월한 것으로 보고되고 있다 (Xi et al., 2016). 일반적으로 식물의 이차대사산물은 생물적 또는 비생물적 스트레스로부터 자신을 방어하는 물질로 알려져 있다 (Yu et al., 2018).
십자화과 식물은 생육초기에 필수영양소를 합성하고 곰팡이나 박테리아와 같은 외부환경으로부터 자신을 보호하기 위하여 glucosinolate와 같은 이차대사산물을 생산 한다 (Shin et al., 2014). 브로콜리의 경우 성엽 보다 새싹에서 항암물질인 sulforaphane이 약 40 배 이상 많이 함유되어 있는 것으로 알려져 있다 (Fahey et al., 1997). 새싹 율무 또한 엽초와 엽신이 신장하는 생육초기에 coixol의 생산이 활발히 진행되는 것으로 확인되었다.
율무 새싹의 항산화 물질 함량, 항산화 활성 및 지표성분의 함량을 비교한 결과, 발아일수에 따라 총 폴리페놀과 총 플라보노이드의 함량이 통계적으로 유의하게 변화되었으며 DPPH 라디컬 소거능과 지표성분의 함량도 유사한 결과를 보였다. 이는 총 폴리페놀, 총 플라보노이드, 및 coixol의 함량이 항산화 효과에 영향을 미치는 주요인자로 작용한 것으로 판단되었다. 또한 기존에 알려진 coixol은 조직 특이적인 물질로 알려져 있으나 본 연구결과 뿌리보다 새싹에 더 많이 함유되어 있었다. 이러한 현상을 규명하기 위하여 분자생물학적 수준에서의 추가적인 연구가 필요할 것으로 보인다.
율무새싹의 생산량, 유리당 함량, 항산화물질함량, 항산화활성 및 지표성분함량 등을 고려할 때 최적 재배일수는 3 일에서 5 일이 가장 적합한 것으로 판단되었다. 본 연구의 결과는 율무 새싹의 기능성 식품 및 의약품 소재 활용에 기초자료로 제공될 수 있을 것이다.
4. 항산화활성과 기능성성분과의 상관관계 분석
율무새싹의 항산화 활성과 총 폴리페놀, 총 플라보노이드, coixol 및 총 유리당의 상관관계를 알아보기 위하여 Pearson’s correlation coefficient 분석을 시행하였으며 그 결과는 Table 5와 같다. DPPH 라디컬 소거능은 ABTS 라디컬 소거능 (r = 0.843, p < 0.001), 총 폴리페놀 (r = 0.902, p < 0.001)함량 및 coixol (r = 0.813, p < 0.01)함량과 모두 양의 상관관계를 나타내었다. ABTS 라디컬 소거능의 상관관계는 DPPH 라디컬 소거능과 유사한 경향을 보였다. 총 폴리페놀 함량은 총 플라보노이드 함량과 상관관계가 나타나지 않았으나 coixol 함량과는 양의 상관관계 (r = 0.798, p < 0.01)를 보였다. 총 유리당 함량은 총 폴리페놀 함량 (r = -0.548, p < 0.05) 및 coixol 함량 (r = -0.614, p < 0.05)과 모두 음의 상관관계가 있는 것으로 확인되었다.
항산화 활성은 주로 폴리페놀 및 플라보노이드 등의 기능성 물질 함량과 밀접하게 연관되어 있는 것으로 알려져 있다. 본 연구결과 새싹 율무의 항산화활성은 총 폴리페놀과 coixol의 함량과 매우 밀접하게 연관되어 있음을 알 수 있었다. 그러나 총 플라보노이드 함량과 항산화 활성과는 상관관계를 찾기 어려운 것으로 나타났는데, 이는 플라보노이드 화합물 보다 폴리페놀 화합물의 종류 및 성분에 따라 항산화 활성의 차이가 있다는 Kim 등 (2012)의 연구 결과와 일치하였다. 따라서 율무 새싹의 항산화 활성은 지표성분인 coixol과 총 폴리페놀 함량에 기인하는 것으로 판단된다.
최근에 다양한 약용식물의 폴리페놀, 플라보노이드 함량 및 기능성물질 탐색에 대한 연구가 많이 진행되고 있지만, 아직까지 새싹에 관한 연구는 미진하다. 본 연구 결과, 그 동안 연구되지 않았던 율무 새싹이 기능성 식품소재로서 새롭게 조명 될 수 있을 것으로 기대된다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: PJ013638022019)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
REFERENCES
-
An TJ, Kim YG, Hur M, Lee JH, Lee YJ, Cha SW and Oh SK. (2015). Physicochemical treatment for the reduction of Fusarium spp. infested in adlay(Coix lacryma-jobi L.) seeds. Korean Journal Medicinal Crop Science. 23:460-467.
[https://doi.org/10.7783/KJMCS.2015.23.6.460]

- Chae KY and Hong JS. (2007). The quality characteristics of Jeolpyon with different amounts of Job's tears flour. Korean Journal of Food and Cookery Science. 23:770-776.
-
Choi MK, Chang MS, Eom SH, Min KS and Kang MH. (2015). Physicochemical composition of buckwheat microgreens grown under different light conditions. Journal of the Korean Society of Food Science and Nutrition. 44:709-715.
[https://doi.org/10.3746/jkfn.2015.44.5.709]

-
Chung CP, Hsu CY, Lin JH, Kuo YH, Chiang W and Lin YL. (2011). Antiproliferative lactams and spiroenone from adlay bran in human breast cancer cell lines. Journal of Agricultural and Food Chemistry. 59:1185-1194.
[https://doi.org/10.1021/jf104088x]

-
Davis WB. (1947). Determination of flavanones in citrus fruits. Analytical Chemistry. 19:476-478.
[https://doi.org/10.1021/ac60007a016]

-
Fahey JW, Zhang Y and Talalay P. (1997). Broccoli sprouts: An exceptionally rich source of inducers of enzymes that protect against chemical carcinogens. Proceedings of the National Academy of Sciences. 94:10367-10372.
[https://doi.org/10.1073/pnas.94.19.10367]

- Han SH, Jang JK, Ma KH, Kim YJ, Kim SM, Lee HJ and Hong CO. (2019). Selection of superior resources through analysis of growth characteristics and physiological activity of Schisandra chinensis collection. Korean Journal of Medicinal Crop Science. 27:9-16.
- Jang IB, Yu J, Suh SJ, Jang IB and Kwon KB. (2018). Growth and ginsenoside content in different parts of ginseng sprouts depending on harvest time. Korean Journal of Medicinal Crop Science. 26:205-213.
- Jothy SL, Zuraini Z and Sasidharan S. (2011). Phytochemicals screening, DPPH free radical scavenging and xanthine oxidase inhibitiory activities of Cassia fistula seeds extract. Journal of Medicinal Plants Research. 5:1941-1947.
-
Khalil AW, Zeb A, Mahmood F, Tariq S, Khattak AB and Shah H. (2007). Comparison of sprout quality characteristics of desi and kabuli type chickpea cultivars(Cicer arietinum L.). LWT-Food Science and Technology. 40:937-945.
[https://doi.org/10.1016/j.lwt.2006.05.009]

-
Kim EJ, Choi JY, Yu MR, Kim MY, Lee SH and Lee BH. (2012). Total polyphenols, total flavonoid contents, and antioxidant activity of Korean natural and medicinal plants. Korean Journal of Food Science and Technology. 44:337-342.
[https://doi.org/10.9721/KJFST.2012.44.3.337]

-
Kim HY, Hwang IG, Woo KS, Kim KH, Kim KJ, Lee CK, Lee JS and Jeong HS. (2010). Chemical components changes of winter cereal crops with germination. Journal of the Korean Society of Food Science and Nutrition. 39:1700-1704.
[https://doi.org/10.3746/jkfn.2010.39.11.1700]

- Kim JK and Lee HS. (2000). Tyrosinase-inhibitory and radical scavenging activities from the seeds of Coix lachryma-jobi L. var. ma-yuen[Roman.] Stapf. Korean Journal of Food Science and Technology. 32:1409-1413.
- Kim JY. (2008). Changes in chemical components of Korean rough rice during germination. Master Thesis. Chungbuk National University. p.33-38.
-
Kim MY, Lee SH, Jang GY, Park HJ, Yoon N, Lee YR, Lee JS and Jeong HS. (2015). Effects of high hydrostatic pressure treatment on the chemical composition of germinated rough rice(Oryza sativar L.). Korean Journal of Food Science and Technology. 47:198-203.
[https://doi.org/10.9721/KJFST.2015.47.2.198]

-
Kim YS. (2013). Bioactivity analysis of resveratrol from peanut sprouts using on-line screening HPLC-ABTS. Journal of the Korea Academia-Industrial Cooperation Society. 14:4100-4105.
[https://doi.org/10.5762/KAIS.2013.14.8.4100]

- Lee JE, Suh MH, Lee HG and Yang CB. (2002). Characteristics of Job’s tear gruel by various mixing ratio, particle size and soaking time of Job’s tear and rice flour. Korean Journal of Food and Cookery Science. 18:193-199.
-
Lee MH, Kim DK, Park SJ, Lee D, Choi D, Choi BK, Kim KM and Lee J. (2018). Effect of barley sprout(Hordeum vulgare L.) water extracts on blood flow improvement in vitro. Journal of the Korean Society of Food Science and Nutrition. 47:77-82.
[https://doi.org/10.3746/jkfn.2018.47.1.077]

- Lee MY, Shin SR, Chang YD and Lee CH. (2009). Environment factors for germination, growing and storage of sprout vegetables of Coreopsis tinctoria Nutt., Saussurea pulchella (Fisch.) Fisch. and Matricaria recurica L. Korean Journal of Plant Resources. 22:136-144.
- Paik JE and Chun HJ. (1989). A study on Ju-ak as affected by adlay flour. Journal of the Korean Society of Food Science and Nutrition. 23:19-25.
- Park GS and Lee SJ. (1999). Effects of Job's tears powder and green tea powder on the characteristics of quality of bread. Journal of the Korean Society of Food Science and Nutrition. 28:1244-1250.
-
Park JJ, Yang HJ, Han KJ and Lim JH. (2015). Comparison of the microbial and nutritional quality characteristics in radish sprouts by purchasing time. Korean Journal of Food Preservation. 22:232-240.
[https://doi.org/10.11002/kjfp.2015.22.2.232]

-
Park SM, Choi YM, Kim YW, Ham HM, Jeong HS and Lee JS. (2011). Antioxidant content and activity in methanolic extracts from colored barley. Journal of the Korean Society of Food Science and Nutrition. 40:1043-1047.
[https://doi.org/10.3746/jkfn.2011.40.7.1043]

-
Ramakrishna R, Sarkar D, Manduri A, Iyer SG and Shetty K. (2017). Improving phenolic bioactive-linked anti-hyperglycemic functions of dark germinated barley sprouts(Hordeum vulgare L.) using seed elicitation strategy. Journal of Food Science and Technology. 54:3666-3678.
[https://doi.org/10.1007/s13197-017-2828-9]

-
Re R, Pellegrini N, Proteggente A, Pannaia A and Yang M and Rice-Evans C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine. 26:1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Sato K and Osawa T. (2010). Dietary supplementation with pearl barley(Adlay, Coix lacryma-jobi L. var Ma-yuen Stapf) extract increases oxidation resistance in the liver of rats ex vivo. Food Science and Technology Research. 16:613-616.
[https://doi.org/10.3136/fstr.16.613]

-
Shi W, Wang Y, Li J, Zhang H and Ding L. (2007). Investigation of ginsenosides in different parts and ages of Panax ginseng. Food Chemistry. 102:664-668.
[https://doi.org/10.1016/j.foodchem.2006.05.053]

-
Shin GH, Lee YJ, Kim JH, Kim YH, Kim DB, Lee JS, Lim JH and Lee OH. (2014). Antioxidant activities of commonly used Brassica spp. sprout vegetables in Korea. Korean Journal of Food Preservation. 21:587-592.
[https://doi.org/10.11002/kjfp.2014.21.4.587]

- Shin S, Chang Y, Jeon A and Lee C. (2009). Effect of different greening periods on antioxidant activities of sprout vegetables of Coreopsis tinctoria Nutt. and Saussurea pulchella(Fisch.) Fisch. Korean Journal of Horticultural Science and Technology. 27:503-510.
-
Vale AP, Cidade H, Pinto M and Oliveira MBP. (2014). Effect of sprouting and light cycle on antioxidant activity of Brassica oleracea varieties. Food Chemistry. 165:379-387.
[https://doi.org/10.1016/j.foodchem.2014.05.122]

-
Wang KH, Lai YH, Chang JC, Ko TF, Shyu SL and Chiou RYY. (2005). Germination of peanut kernels to enhance resveratrol biosynthesis and prepare sprouts as a functional vegetable. Journal of Agricultural and Food Chemistry. 53:242-246.
[https://doi.org/10.1021/jf048804b]

-
Wang L, Sun J, Yi Q, Wang X and Ju X. (2012). Protective effect of polyphenols extract of adlay(Coix lachryma-jobi L. var. ma-yuen Stapf) on hypercholesterolemia-induced oxidative stress in rats. Molecules. 17:8886-8897.
[https://doi.org/10.3390/molecules17088886]

-
Xi XJ, Zhu YG, Tong YP, Yang XL, Tang NN, Ma SM, Li S and Cheng Z. (2016). Assessment of the genetic diversity of different Job's tears(Coix lacryma-jobi L.) accessions and the active composition and anticancer effect of its seed oil. PloS one. 11(4):e0153269. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0153269, (cited by 2019 July 5).
[https://doi.org/10.1371/journal.pone.0153269]

- Yoon WB, Kim BY and Shin DH. (1997). Viscosity and dynamic rheological properties of Job's-tears as a function of moisture content. Korean Journal of Food Science and Technology. 29:932-938.
- Yu J, Suh SJ, Jang IB, Jang IB, Moon JW, Kwon KB and Lee SW. (2018). Influence of sodium concentrations on growth, physiological disorder symptoms, and bed soil chemical properties of 2-year-old ginseng. Korean Journal of Medicinal Crop Science. 26:240-247.
- Zhang MC, Ma XP, Xu WF, Tian T and Jia XS. (2010). Determination of coixol in root, testa and stem of Coix lacryma-jobi L. var. ma-yuen(Roman.) Stapf by HPLC. Medicinal Plant. 1:95-97.
-
Zhang P, Meng X, Tang X, Ren L and Liang J. (2019). The effect of a coix seed oil injection on cancer pain relief. Supportive Care in Cancer. 27:461-465.
[https://doi.org/10.1007/s00520-018-4313-z]

