Phytophthora sansomeana에 의한 큰꽃삽주 역병 발생 보고
 ; Myung Soo Park2
; Myung Soo Park2 ; Jin Tae Jeong3
; Jin Tae Jeong3 ; Young Guk Kim4
; Young Guk Kim4 ; Yong Il Kim5
; Yong Il Kim5 ; Eun Song Lee6
; Eun Song Lee6 ; Jae Ki Chang7
; Jae Ki Chang7
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In September 2017, wilting and rhizome rot symptoms were observed on Atractylodes macrocephala Koidz. in Jecheon-si and Eumseong-gun. This study was carried out to isolate hitherto unidentified pathogenic fungi from A. macrocephala and to test the pathogenicity of isolated fungi against Atractylodes spp. genus such as A. macrocephala, A. japonica, and their interspecific hybrids.
The diseased plants were washed with running tap water, and the boundary between the healthy area and the diseased area was cut while the pathogens were isolated by growing cultures from the diseased areas on Phytophthora semi-selective medium. The internal transcribed spacer (ITS) region of the isolates was used in this study for identification. Test plants were cultivated in the glasshouse at 20℃ - 30℃ for 4 months and then used for pathogenicity test. The pots with plants inoculated with mycelial plugs and zoospores were placed at 25℃ for 48 h in a dew chamber where relative humidity was above 95%, and then moved into the glasshouse at 20℃ - 30℃. The presence or absence of pathogenicity of the strains was determined by evaluating the symptom of plant wilting. The inoculation test was performed in three replicates with a non-treated control.
On the basis of results of ITS sequence analysis, the strains isolated from the diseased plants was identified as Phytophthora sansomeana. Biological assay using test plants confirmed the pathogenicity of P. sansomeana against Atractylodes macrocephala. This is the first report of rhizome rot in A. macrocephala caused by P. sansomeana.
Keywords:
Atractylodes. japonica, Atractylodes macrocephala Koidz, Pathogenicity, Phytophthora sansomeana, Rhizome Rot서 언
국화과 (Compositae)에 속하는 삽주 속 (Atractypdes spp.) 식물은 다년생 초본으로 이 중 삽주 (Atractylodes japonica Koidz.) 또는 큰꽃삽주 (Atractylodes macrocephala Koidz.)의 뿌리줄기로서 그대로 또는 주피를 제거한 것을 한약재명으로 백출 (白朮)이라 부른다 (Lee et al., 2002; MFDS, 2019). 한국에 자생하는 삽주 (A. japonica)가 오랜 기간 약재로 사용되어져 왔지만 생산성이 좋은 큰꽃삽주 (A. macrocephala)가 중국으로부터 국내에 도입되어 재배가 늘어난 이후로는 삽주 (A. japonica)와 큰꽃삽주 (A. macrocephala) 모두 백출로 규정하여 사용하고 있다 (MFDS, 2000).
백출은 예로부터 소화능력 개선과 위장 보호의 용도로 이용되며 십전대보탕 (十全大補湯), 팔물탕 (八物湯) 등 대표적인 한의약 처방에 포함되는 한약재이지만 대표적인 수입 의존 약재로서 국내 재배면적은 경작지와 임야를 포함하여 31 ㏊로 82 톤을 생산하고 있다 (MAFRA, 2019). 백출은 효능에 관한 많은 연구가 수행되어 지고 있으며 Jerng (2015)은 국내외 논문에서 밝힌 백출의 효능에 관한 연구결과를 WHO-ATC guideline (WHO, 2014)에 따라 분석하였는데 소화기 및 대사계통 작용 효능을 보고한 연구가 23 건으로 가장 많았으며, 근골격계 효능 11 건, 항암 효능이 9 건으로 그 뒤를 이었다고 보고하고 있다. 이러한 결과는 대부분 한의학 문헌상에 존재하는 백출 처방 시 나타나는 효과와 일치하였으나 변비에 대한 잠재적 효능, 당뇨, 암 등의 질병치료와 관련된 효능과 항산화효능 등 기존 한의학 문헌에서는 명확히 기술되지 않았던 효능에 대해서도 새롭게 밝힌 연구들도 존재한다고 하였다.
하지만 백출의 기원식물인 삽주는 재배기간이 길고 수량성이 낮아 재배보다는 주로 야생채취에 의존하고 있으며 큰꽃삽주는 수량성이 높아 재배를 하나 장마로 인한 과습 조건에서 역병에 취약하므로 재배 시 위험요인이 되고 있다. (Cho et al., 2001a, 2001b). 이런 재배상의 취약성을 품종육성을 통해 해결하고자 삽주와 큰꽃삽주의 종간교잡종 (A. japonica × A. macrocephala) 9 품종이 육성되었으며 개발한 품종에 대한 생육 특성과 atractylenolide I, atractylenolide II, atractylenolide III 등 유효성분 비교 및 항염, 항산화 효과를 비교한 바 있다 (Jeong et al., 2018a, 2018b).
현재까지 삽주에 발생하는 병해로는 Colletotrichum gloeosporioides에 의한 탄저병, Sclerotium rolfsii에 의한 흰비단병, Phytophthora drechsleri에 의한 역병 등이 보고된 바 있으며 (NIAS 1991; Kim et al., 1997) 큰꽃삽주에 발생하는 병으로는 P. drechsleri에 의한 역병이 유일하게 보고되어 있다 (Kim et al., 1997). 큰꽃삽주는 농가 재배시 장마기에 과습한 포장에서 잎이 검게 썩거나 지상부가 시들어 뿌리를 포함한 식물체 전체가 썩는 피해로 수확량 감소가 많은 작물이다.
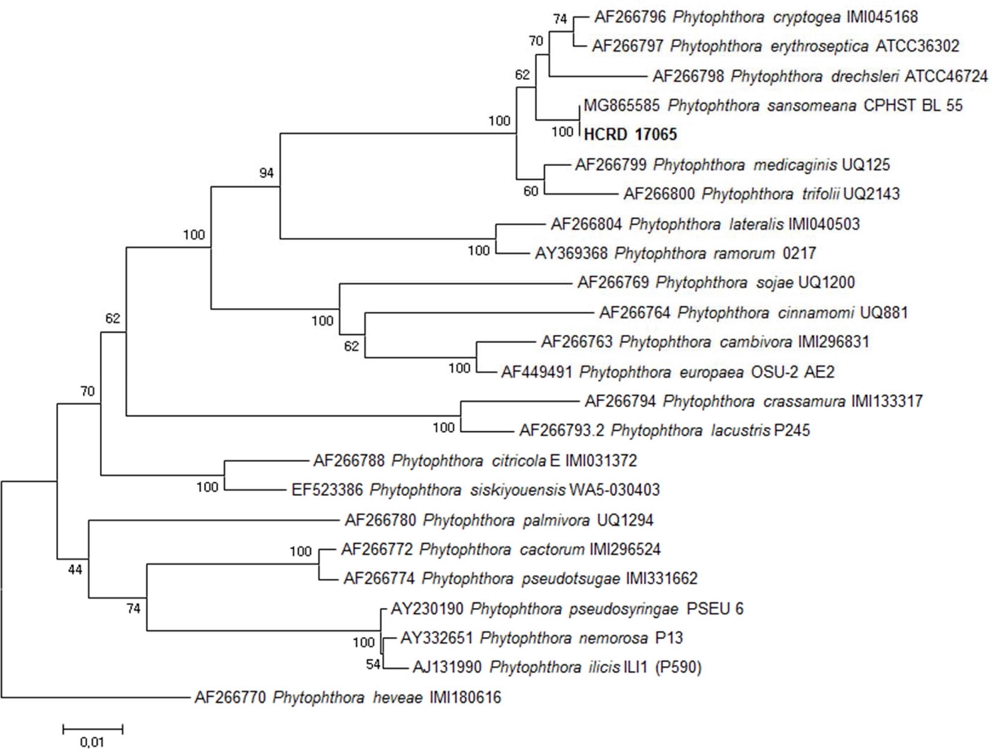
본 연구에서는 큰꽃삽주 재배 시 장마기 지상부가 시들고 뿌리까지 썩는 역병 증상이 농가에서 발생하여 (Fig. 1) 병든 부위로부터 균을 분리하였다. 그 원인균을 Cooke 등 (2000)이 제안한 Phytophthora 속의 분자 동정에 이용되는 ITS 영역의 염기서열을 바탕으로 기존에 보고된 역병균과는 다른 Phytophthora sansomeana로 동정하였고 삽주 속 식물인 삽주와 큰꽃삽주, 그리고 종간교잡종에 대한 병원성 차이를 구명하였기에 그 결과를 보고하고자 한다.
재료 및 방법
1. 역병 증상 원인균 분리
본 연구에서는 2017년 8월 충북 제천군 큰꽃삽주 (Atractylodes macrocephala Koidz.) 농가포장과 충북 음성군에 위치한 농촌진흥청 국립원예특작과학원 인삼특작부 시험포장에서 발생한 식물체 시듦 증상 후 식물체 전체가 고사하는 역병 증상에 대하여 발병도가 심하지 않은 초기 시듦 증상만을 보이는 식물체를 수거하여 병원균을 분리하였다.
균 분리를 위하여 갈변되어 있는 지제부 줄기를 흐르는 수돗물로 깨끗이 세척한 후 물기를 완전히 말리고 건전부와 이병부의 경계부위를 5 ㎜ × 5 ㎜ 크기로 자른 후 역병균 반선택배양기 (Phytophthora semi-selective medium)에 치상하고 (NIAS, 2000) 20℃ 배양기 (WIM-RL4, Daihan Scientific Co., Ltd., Wonju, Korea)에서 48 시간 배양 후 이병조직으로부터 자란 균총을 잘라 10% V8A 배지 (Campbell Soup Co., Camden, NJ, USA)에 올리고 20℃에서 균을 배양하였다. 이후 멸균 증류수가 담긴 10 ㎖ test tube 에 균사 절편을 넣고 15℃에 보관하면서 실험에 이용하였다.
2. 원인균 동정을 위한 PCR 및 염기서열 분석
분리된 균주를 10% V8A 배지에 접종하여 25℃에서 4 일간 암 상태로 배양하여 균사체를 얻었다. 균사체는 PCR 증폭을 위하여 동결건조한 후 소량을 1.5 ㎖ tube에 넣고 마쇄한 후 extraction buffer (200 mM Tris-HCl (pH 8.0), 200 mM NaCl, 30 mM EDTA, 0.5% SDS) 400 ㎕와 proteinase K 5 ㎕를 첨가한 후 37℃에서 1 시간 동안 방치한 다음 2 × CTAB solution (1 M, NaCl; 100 mM, Tris; 20 mM EDTA; 1% w/v polyvinyl polypyrolidone, PVPP) 400 ㎕를 첨가한 후 5 - 10 분 동안 잘 섞은 다음 chloroform : isoamylalcohol = 24 : 1 용액 700 ㎕를 첨가하고 원심분리기에서 20℃로 10 분간 12,000 rpm으로 원심분리 하였다. 침전물 600 ㎕를 새로운 1.5 ㎕ tube에 넣어 준 후 다시 chloroform : isoamylalcohol = 24 : 1 용액 700 ㎕를 첨가하고 같은 조건의 원심분리를 1 회 반복 실시하였다. 원심분리 하여 얻어진 침전물에 다시 isopropanol 420 ㎕를 첨가하고 실온에서 10 분간 방치한 후에 4℃에서 10 분 동안 12,000 rpm으로 원심분리를 하여 DNA pellet을 침전 시켰다. 그 후에 70%의 ethanol 500 ㎕로 DNA pellet을 세척한 후 12,000 rpm 4℃에서 10 분 동안 원심분리 한 뒤 vacuum pump로 30 분 동안 건조시킨 후 50 ㎕의 멸균수를 넣어 용해시키고, 0.7% agarose gel에 전기영동 하여 DNA를 정량하였다.
Phytophthora 속 균의 ITS 영역은 ITS 5 (GGAAGTAAAAGTCGTAACAAGG)와 ITS 4 (TCCTCCGCTTATTGATATGC) 프라이머를 이용하여 증폭하였다 (White et al., 1990). 각 프라이머 10 pmol 및 DNA 1 ㎕를 포함하는 20 ㎕의 최종 부피로 AccuPower PCR Premix (Bioneer Co., Daejeon, Korea)를 이용하는 C1000 thermal cycler (Bio-Rad Inc., Hercules, CA, USA)를 사용하여 PCR을 수행 하였다. PCR 조건은 94℃에서 initial denaturation 5분 후 94℃에서 denaturation 40초, 55℃에서 annealing 40초, 72℃에서 extraction 1분의 조건으로 35 cycle을 실시하고, final extension은 72℃에서 10 분간 실시하였다. PCR 산물은 1% agarose gel에서 전기영동 하여 DNA를 확인하였다.
PCR Clean-Up System (Promega Ltd., Madison, WI, USA)으로 정제하여, ㈜마크로젠 (Seoul, Korea)에 의뢰하여 염기서열 분석을 하였다. 염기서열 분석 결과는 MEGA ver. 5.0 (Tamura et al., 2011)을 이용하여 교정하고 NCBI (National Center for Biotechnology)의 BLAST (Basic Local Alignment Search Tool)를 이용하여 기존에 보고된 염기서열과 비교하였다. 얻은 염기서열은 GenBank로부터 reference 균주의 염기서열을 다운로드하여 MEGA ver. 5.0 (Tamura et al., 2011)을 이용하여 정렬하였다. Reference 균주는 ex-type 균주 및 신뢰도 높은 균주의 GenBank data를 참고하여 MAFFT v7 (Katoh and Standley, 2013)을 이용해 정렬하였다. 계통수는 Kimura 2-parameter model (Kimura, 1980)과 1,000 회 반복 bootstrapping으로 MEGA ver. 5.0 (Tamura et al., 2011)을 사용하여 작성하였다.
3. 분리균주의 균학적 특성 조사
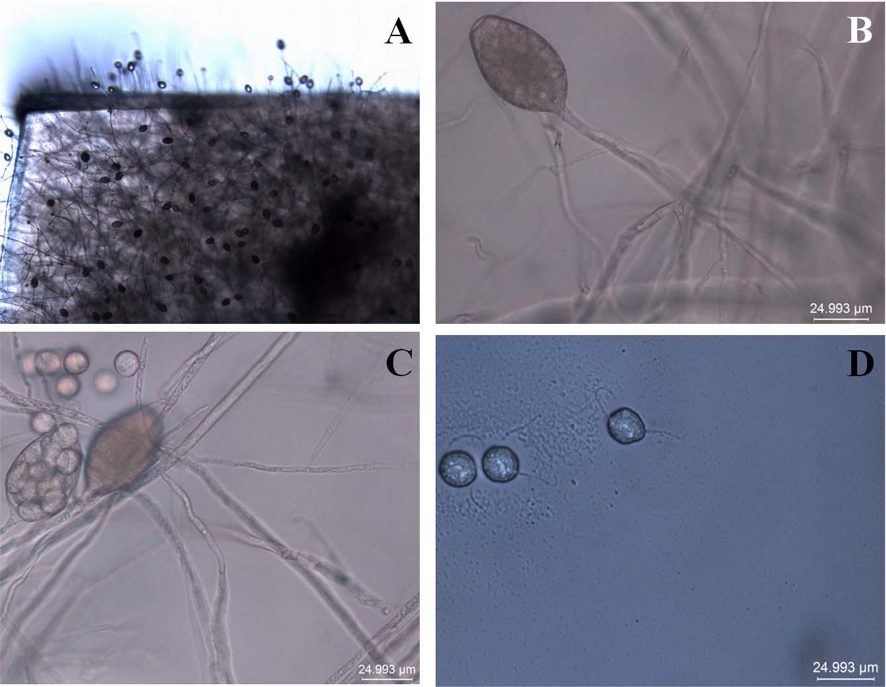
병든 식물에서 분리한 균주의 균학적 특성은 형광 현미경 (DM5000B, Leica Microsystems, Wetzlar, Germany)을 통해 검경하였다. 유주자낭의 형태를 조사하기 위해 분리균을 10% V8A 배지에서 2 일간 배양하였다. 균의 활성이 가장 좋은 균총의 가장자리를 1 ㎝ × 1 ㎝로 잘라 100 ㎜ × 15 ㎜ 규격의 페트리디시 (SPL Co., Ltd., Pocheon, Korea)에 옮기고 멸균증류수를 20 ㎖ 첨가하여 균사 절편이 완전히 물에 잠기게 하고 25℃ 형광 조건의 배양기 (WIM-RL4, Daihan Scientific Co., Ltd., Wonju, Korea)에서 24 시간 두고 형성된 유주자낭의 형태를 조사하였다. 이후 멸균증류수를 2 시간마다 지속적으로 갈아주는 과정을 통해 유주자낭으로부터 유주자를 유출시키고 104/㎖ 농도의 현탁액에서 5℃ 암 상태 보관 시 생존시간을 조사하였다.
4. 분리균주의 삽주 속 식물에 대한 병원성 검정
병원성 검정은 20℃ - 30℃가 유지되는 유리온실에서 플라스틱 화분 (Ø200 ㎜)에 종근을 파종하고 4 개월 동안 생육시킨 건전한 식물체를 대상으로 수행하였다. 검정방법은 균사 절편을 이용한 접종방법과 유주자낭으로부터 유도한 유주자를 지제부에 관주 접종하는 두 가지로 수행하였으며 두 방법 모두 병든 식물체에서 분리하여 보관중인 분리 균주 중 HCRD 17065 균주를 대표 균주로 하여 수행하였다.
균사 절편을 이용한 병원성 검정은 큰꽃삽주를 대상으로 하였으며 보관균주를 20℃에서 3 일간 V8A 배지에서 암 배양하여 균의 활성을 회복시킨 후 20℃ V8A 배지에 다시 3 일간 암 배양 하여 생장한 균총을 6 ㎜ cork borer (DH-KA0049, Daihan Scientific Co., Ltd., Wonju, Korea)로 균생장이 왕성한 균사 선단부위를 잘라 큰꽃삽주 지제부 흙을 제거하고 뿌리에 붙여 접종하였다. 이후 접종한 화분을 상대습도가 95% 이상 유지되는 25℃의 접종상 (DS-53C, Dasol Scientific Co., Ltd., Hwaseong, Korea)에 옮겨 48 시간 경과 후 다시 20℃ - 30℃ 유리온실로 옮겨 일주일 후 식물체의 시듦 증상의 유무를 관찰하였다. 또한 유주자를 접종원으로 사용한 실험에서는 균사 절편 접종실험과 마찬가지로 균의 활성을 회복시킨 후 20℃ V8A 배지에 다시 2 일간 암배양 하여 생장한 균총을 1 ㎝ × 1 ㎝ 로 잘라 페트리디시 2 개에 나누어 담고 20 ㎖ 멸균증류수를 첨가한 후 20℃에서 1 일간 명 배양하면서 유주자낭을 다량으로 생성시켰다. 접종원으로 쓰일 유주자는 명 배양 중 멸균증류수를 2 시간마다 지속적으로 갈아주는 과정을 통해 유주자낭으로부터 유출시켰다. 이후 유출된 유주자를 3 겹의 거즈로 거르고 Ko 등 (1973)의 microsyringae 방법에 따라 접종원으로 쓰일 유주자의 농도를 104/㎖로 조정하였다.
유주자 접종을 통한 병원성 검정에 사용한 삽주 속 식물은 농촌진흥청 인삼특작부에서 보유하고 있는 삽주 (A. japonica), 큰꽃삽주 (A. macrocephala), 그리고 이 두 종의 종간교잡종인 7 품종 (고원, 고출, 다출, 상원, 상출, 만출, 후출)으로 접종 3 시간 전 화분에 충분한 관수를 한 후 지제부줄기에 마이크로피펫으로 10 ㎖ 씩 관주 접종 하였다. 이후 접종한 화분은 균사 절편 접종과 동일한 방법에 의해 접종상 (DS-53C, Dasol Scientific Co., Ltd., Hwaseong, Korea) 배양으로 유주자의 식물체내로의 침입을 유도 하였으며 20℃ - 30℃ 유리온실로 옮겨 화분의 물이 마르지 않게 관수하면서 식물체의 시듦 증상 유무로 삽주, 큰꽃삽주, 고원 등 7 품종의 종간교잡종에 대한 분리균주의 병원성을 검정하였다. 병원성 검정은 각각 3 개의 개체씩 3 회 반복실험을 수행하였다.
결과 및 고찰
1. 큰꽃삽주 역병 증상 유발 원인균 동정
큰꽃삽주 (Atractylodes macrocephala Koidz.) 시듦 증상의 병반부로부터 분리된 균주의 ITS 영역 염기서열을 GenBank에 등록된 reference 균주와 함께 비교한 결과 P. sansomeana와 같은 그룹을 형성하였고 reference 균주로 사용한 P. sansomeana CPHST BL 55 균주와 염기서열이 일치하였다 (Fig. 2). P. sansomeana는 Hansen 등 (2009)이 ITS 영역의 염기서열 분석을 통해 기존 Cooke 등 (2000)이 제안한 Phytophthora 속 곰팡이의 8 개 계통군 분류체계에 새롭게 들어간 신종 병원균으로 P. drechsleri와 동일한 계통군에 속하지만 신종 균으로 구분될 수 있는 염기서열의 차이를 보인다. 본 연구를 통해 큰꽃삽주 병반부에서 분리한 균주는 2009년 이후 GenBank에 등록된 P. sansomeana 균주와 100%의 유전적 상동성을 확인할 수 있었다. 따라서 두 지역에서 분리한 균주를 P. sansomeana로 동정하였으며 기존에 역병 원인 균주로 보고된 P. drechsleri와는 유연관계는 가깝지만 다른 종임을 확인하였다.
2. 큰꽃삽주 역병 증상 원인균의 균학적 특성
10% V8A 배지에서 균을 2 일간 배양하고 균총 가장자리를 1 ㎝ × 1 ㎝ 로 잘라 페트리디시에 옮기고 멸균증류수를 20 ㎖ 첨가하여 25℃ 형광 조건에 두면 24 시간 내에 유주자낭이 형성되기 시작하였다. 이후 지속적으로 멸균증류수를 교체해주는 과정을 통해 유주자낭이 형성되었으며 4 번 정도의 멸균증류수 교체 과정 후 많은 양의 유주자가 유주자낭으로부터 유출되었다. 일반적으로 일시에 역병균의 유주자를 다량 생성하기 위해 흔히 사용하는 저온처리 (4℃ - 10℃) 후 실온 (24℃)으로 옮기는 과정이 없이도 가능하였는데 접종에 필요한 다량의 유주자 획득이 수회의 멸균증류수 교체 작업만으로도 가능함을 보여 주었으며 이는 큰꽃삽주의 병든 부위에서 분리한 P. sansomeana 균의 고유한 특성으로 보여 진다.
현미경 검경 결과 유주자낭의 모양은 난형으로 길이는 54 - 57 ㎛였고 길이 대 너비 비는 1.55 - 1.6이었는데 이는 Hansen 등 (2009)이 보고한 기존의 P. sansomeana의 균학적 특성과 일치하였다 (Fig. 3). 또한 유주자는 현탁액 상태에서 보관시간에 따라 생존률의 차이를 보였으며 24 시간 후 96%, 48시간 후 16%, 72 시간 후 8%, 96 시간 후 완전 사멸하였다. 이 결과를 통해 5℃의 저온보관에서도 현탁액 상태의 유주가 밀도가 시간의 경과에 따라 급격히 감소 하였는 바 유주자를 접종원으로 한 삽주 속 식물 병원성 검정은 유주자 획득 후 바로 수행하였다.
3. P. sansomeana의 삽주 속 식물에 대한 병원성 검정
큰꽃삽주에서 분리된 균주의 삽주 속 식물에 대한 병원성을 확인하기 위해 수행하였다. 병원균 분리 후 P. sansomeana로 동정된 HCRD 17065 균주를 이용하여 삽주, 큰꽃삽주, 그리고 두 종의 종간교잡으로 육성된 고원 등 7 개의 품종을 대상으로 병원성을 검정하였다. 균사 절편을 접종원으로 사용한 큰꽃삽주 병원성 검정 결과 접종상에서 48 시간 경과 및 유리온실로 옮겨진 후 하루가 지나 지제부 줄기가 갈변되고 잎과 줄기가 시드는 전형적인 역병 병징이 발생하였다 (Fig. 4).

Plant browning symptom in soil surface by mycelial agar plug inoculation in A. macrocephala. A; mycelial agar plug, B; plant inoculated by a piece of mycelial agar plug, white circle; browning symptom.
삽주, 큰꽃삽주, 7 종의 종간교잡종을 대상으로 한 유주자접종 실험에서는 큰꽃삽주만 병이 발생하였는데 (Fig. 5) 지제부 줄기가 갈변되면서 식물체가 시들기 시작하고 시듦 증상이 회복되지 않고 시간이 지나면 식물체가 갈변되며, 고사하고 뿌리까지 썩는 과정을 보였으며 이는 실제 농가포장에서의 병 발생 상황과 동일하였다. 균사 절편과 유주자를 사용한 접종시험 모두 접종 후 발생한 병든 부위에서 다시 P. sansomeana가 분리되었다. 하지만 실험에 사용한 삽주와 고원 등 7 품종의 종간교잡종에서는 지제부 갈변, 시듦 증상 등 어떠한 경미한 병징도 발생하지 않았다 (Fig. 6). 기존 문헌에 따르면 큰꽃삽주와 삽주에 P. drechsleri에 의한 역병이 보고되어 (Kim et al., 1997) 병원성이 확인된 바 있으며 본 실험을 통해 큰꽃삽주에 역병을 일으키는 또 다른 역병균인 P. sansomeana는 삽주와 종간교잡종에는 병원성을 보이지 않는 것을 확인할 수 있었다. 하지만 본 연구에서 병원성 검정에 사용한 삽주와 큰꽃삽주 자원은 모든 자원을 대표 할 수 없는 바 금후 자원별 병원성 검정이 필요하며 연구에 사용된 P. sansomeana 균주에 의해 발생하는 역병에 대한 삽주 속 식물의 분자수준의 저항성 기작연구 또한 추가로 수행되어져야 할 것으로 사료된다.

Wilting symptom by zoospores inoculation in A. macrocephala. A; non treated control, B; plant inoculated by zoospores, white circle: wilting symptom.

Nonoccurrence of wilting symptom in A. japonica and interspecific hybrid between A. macrocephala and A. japonica. A; inoculation with 10 ㎖ zoospores suspension (104/㎖) per one plant. B; A. japonica, C; Gowon, D; Gochul, E; Dachul, F; Sangwon, G; Sangchul, H; Manchul, I; Huchul, C, D, E, F, G, H and I are interspecific hybrid between A. macrocephala and A. japonica.
P. sansomeana는 Hansen 등 (2009)에 의해 Phytophthora 속 신종 균으로 보고된 이후 지금까지 미국에서 옥수수 (Zea mays L.), 중국에서 콩 [Glycine max (L.) Merr.], 캐나다에서 완두 (Pisum sativum L.) 등 식량작물에서 주로 역병을 일으키는 균으로 보고되어 있다 (Zelaya-Molina et al., 2010; Tang et al., 2010; Chang et al., 2017). 본 연구에서는 큰꽃삽주에는 기존에 보고된 P. drechsleri 뿐 아니라 P. sansomeana도 병원성을 나타내는 것을 확인하였으며 이에 P. sansomeana에 의한 큰꽃삽주의 역병 발생을 최초로 보고하고 자 한다.
Acknowledgments
본 연구는 농촌진흥청 시험연구사업(과제번호: PJ01266901)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Chang KF, Hwang SF, Ahmed HU, Fu H, Zhou Q, Strelkov SE and Turnbull GD. (2017). First report of Phytophthora sansomeana causing root rot in field pea in Alberta, Canada. Crop Protection. 101:1-4.
[https://doi.org/10.1016/j.cropro.2017.07.008]

- Cho JH, Kim YW, Park CG, Bang KH and Seong NS. (2001a). Genetic variation of Atractylodes macrocephala in morphological traits and Phytophthora root rot resistance. Korean Journal of Breeding Science. 33:191-198.
- Cho JH, Kim YW, Park CG, Bang KH and Seong NS. (2001b). Occurrence of phytophthora root rot of Atractylodes macrocephala in field contitions. Korean Journal of Medicinal Crop Science. 9:211-219.
-
Cooke DEL, Drenth A, Duncan JM, Wagels G and Brasier CM. (2000). A molecular phylogeny of Phytophthora and related oomycetes. Fungal Genetics and Biology. 30:17-32.
[https://doi.org/10.1006/fgbi.2000.1202]

-
Hansen EM, Wilcox WF, Reeser PW and Sutto W. (2009). Phytophthora rosacearum and P. sansomeana, new species segregated from the Phytophthora megasperma “complex”. Mycologia. 101:129-135.
[https://doi.org/10.3852/07-203]

- Jeong HS, Jeong JT, Lee JH, Park CG, Choi JH, Jang GY, Kim JW, Chang JK, Kim DH and Lee SE. (2018a). Comparison of anti-oxidative and anti-inflammatory effect of Atractylodes interspecific hybrid cultivar roots. Korean Journal of Medicinal Crop Science. 26:391-400.
- Jeong JT, Lee HJ, Lee JH, Hong CO, Lee YJ, Jeong YS, Lee DY, Lee SE, JK Chang, Ha BK and Park CG. (2018b). Comparison of growth characteristics and active ingredients in Atractylodes inter-specific hybrid cultivars. Korean Journal of Medicinal Crop Science. 26:220-226.
- Jerng U. (2015). Comparative study on efficacy of Atractylodes rhizome recorded in traditional medical literature and in recent pharmacological article. Korean Herbal Medicine Informatics. 3:1-16.
-
Katoh K and Standley DM. (2013). MAFFT multiple sequence alignment software version 7: Improvements in performance and usability. Molecular Biology and Evolution. 30:772-780.
[https://doi.org/10.1093/molbev/mst010]

- Kim HK, Jee HJ and Kim HK. (1997). Occurrence of rhizome rot of Atractylodes spp. caused by Phytophthora drechsleri. Korean Journal of Plant Pathology. 13:433-437.
-
Kimura M. (1980). A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences. Journal of Molecular Evolution. 16:111-120.
[https://doi.org/10.1007/BF01731581]

-
Ko WH, Chase LL and Kunimoto RK. (1973). A microsyringe method for determining concentration of fungal propagules. Phytopathology. 63:1206-1207.
[https://doi.org/10.1094/Phyto-63-1206]

- Lee JH, Kim YK, Hong SP and Kim CS. (2002). Studies of taxonomic origins of Atractylodis rhizoma Alba and Atractylodis rhizoma. Korean Journal of Oriental Medicine. 8:55-63.
- Ministry of Agriculture, Food and Rural Affairs(MAFRA). (2019). Production results of special crops. Ministry of Agriculture, Food and Rural Affairs. Sejong, Korea. p.41-60.
- Ministry of Food and Drug Safety(MFDS). (2000). The Korea pharmacopoeia. Ministry of Food and Drug Safety. Seoul, Korea. p.773-774.
- Ministry of Food and Drug Safety(MFDS). (2019). The Korea pharmacopoeia. Ministry of Food and Drug Safety. Seoul, Korea. p.44.
- National Institute of Agricultural Science(NIAS). (1991). Compendium of medicinal plant diseases with colour plates. National Institute of Agricultural Science and Technology. Suwon, Korea. p.68-70.
- National Institute of Agricultural Science(NIAS). (2000). Phytophthora diseases in Korea. National Institute of Agricultural Science. Suwon, Korea. p.41-45.
-
Tamura K, Peterson D, Peterson N, Stecher G, Nei M and Kumar S. (2011). MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution. 28:2731-2739.
[https://doi.org/10.1093/molbev/msr121]

-
Tang QH, Gao F, Li GY, Wang H, Zheng XB and Wang YC. (2010). First report of root rot caused by Phytophthora sansomeana on soybean in China. Plant Disease. 94:378-378.
[https://doi.org/10.1094/PDIS-94-3-0378A]

-
White TJ, Bruns T, Lee S and Taylor J. (1990). Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. Academic Press. San Diego, CA. USA. p.315-322.
[https://doi.org/10.1016/B978-0-12-372180-8.50042-1]

- World Health Organization(WHO). (2014). Guidelines for ATC classification and DDD assignment 2015. World Health Organization. Oslo, Norway. p.275.
-
Zelaya-Molina LX, Ellis ML, Berry SA and Dorrance AE. (2010). First report of Phytophthora sansomeana causing wilting and stunting on corn in Ohio. Plant Disease. 94:125-125.
[https://doi.org/10.1094/PDIS-94-1-0125C]