
인삼 품종별 뿌리 추출물의 NMDA 수용체 길항 효과 및 진세노사이드 함량
 ; Jang Uk Kim2
; Jang Uk Kim2 ; Hyeon Soo Jeong3
; Hyeon Soo Jeong3 ; Je Hun Choi4
; Je Hun Choi4 ; Yun Jeong Ji5
; Yun Jeong Ji5 ; Hyung Don Kim6
; Hyung Don Kim6 ; Gwi Yeong Jang7
; Gwi Yeong Jang7 ; Dong Yun Hyun8
; Dong Yun Hyun8 ; Dong Hwi Kim9
; Dong Hwi Kim9
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Although a number of Panax ginseng cultivars have been developed by Korean researchers in recent years, there has been insufficient analysis of their beneficial properties. In this study, we sought to identify useful ginseng varieties as functional materials.
We evaluated effects of root extracts of 10 ginseng cultivars (Cheongsun; CS, Chunpoong; CP, Gopoong; GP, Gumpoong; GMP, K1, Sunhyang; SH, Sunone; SO, Sunpoong; SP, Sunun; SU and Yunpoong; YP) against the inhibitory effects of nitric oxide (NO) and reactive oxygen species (ROS) production in mouse brain microglial BV2 cells, as well as the binding of N-methyl-D-aspartate receptor (NMDAR), a marker related to memory. Ginsenosides, such as 20 (S)-protopanaxadiols (PPDs), including ginsenoside-Rb1, -Rb2, -Rb3, -Rc, -Rd, and -Rg3 and 20 (S)-protopanaxatriols (PPTs) including -Re, -Rg1, and -Rg2 were analyzed by HPLC. We observed that the cultivar GMP showed the highest inhibitory effect (60.8%) against NO production at 20 ㎍/㎖. Those cultivars showing the significantly highest inhibition effects against ROS at 20 ㎍/㎖ were K1 (57.3%), SP (54.5%), YP (53.1%), CP (51.7%), CS (50.9%) and SH (49.6%). At 50 ㎍/㎖, K1 showed the most potent inhibitory effect (51.2%) on NMDAR binding. The total phenol content of SH (1.89 ㎎/g) and K1 (1.73 ㎎/g) were higher than those of the other cultivars, whereas in terms of PD/PT ratios, the values of CP (0.98), K1 (1.05) and SO (1.05) were lower than those of the other cultivars. On the basis of correlation coefficient (0.7064) between NMDAR inhibition and ONOO− scavenging activity.
The findings of this study indicate that the cultivars K1 and SH could be useful ginseng resources as functional materials with favorable cognition-improving and antioxidative properties.
Keywords:
Panax ginseng, Anti-oxidation, Anti-inflammation, N-methyl-D-aspartate Receptor, Total Phenol, Ginsenosides서 언
인삼 (Panax ginseng C. A. Mey.)은 두릅나무과 (Araliaceae)에 속하는 다년생 초목으로서 개화기는 4 - 5월, 결실기는 6 - 7월이며, 8 - 9월에 채종된 후 채취된 4 년 이상 된 뿌리인 수삼은 홍삼 또는 백삼 제조에 사용된다 (Jung and Shin, 1990).
인삼의 효능에 대하여 동의보감에서 정신과 혼백을 안정시키고 눈을 밝게 한다고 기술되어 있으며, Jung과 Shin (1990)은 신경계, 생체 반응성, 내분비계, 물질대사, 순환계 등에 영향을 준다고 하였다. 최근 보고된 자료에서는 인삼의 고혈압 완화 효과 (Chung et al., 2004), 혈당 감소 및 인지수행력 개선 (Reay et al., 2005), 항산화 (Choi et al., 2006), 항염 (Hofseth and Wargovich, 2007) 및 항스트레스 효능 (Jang et al., 2019)이 확인되었다. 인삼에 포함된 성분으로는 산성다당류 (Kim et al., 2008a), 휘발성분 (Cho, 2015), 페놀성분과 플라보노이드성분 (Kim, 2016) 그리고 진세노사이드 성분 (Kang and Kim, 2016)이 있다. 인삼의 성분 중에서도 진세노사이드는 발암억제 (Nag et al., 2012), 신경보호효과 (Rausch et al., 2006), 골다공증 완화 (Siddiqi et al., 2013), 항염 (Kim et al., 2017c) 및 신경퇴행성질환 억제 (Kim et al., 2018) 등의 생리적 효능을 나타낸다고 보고되었다. 또한, 인삼은 생약 또는 식품 등으로 뿌리가 주로 이용되지만 열매는 항당뇨 (Attele et al., 2002), 착색방지 및 항노화 (Kim et al., 2017b) 효과가 있고, 잎과 줄기는 항피로 및 항비만 (Wang et al., 2009) 효과가 있으므로 기능성 소재 개발 등의 원료로서 활용 범위가 넓다고 하겠다.
이처럼 우리의 건강 증진을 위한 원료로 이용되어온 인삼은 시장에서의 수요 증가에 따라 야생삼 보다는 재배삼이 약재의 주요원료가 되었는데, 16 세기부터 인삼의 재배를 시작한 우리나라는 수년간의 선발과 개량과정의 결과로서 고려인삼의 특성을 가지는 일련의 품종이 개발되었다 (Wang et al., 2016).
개발된 인삼 품종 중에서 천풍 등 5 개 품종 뿌리의 부위별 진세노사이드 함량 차이가 보고되었고 (Ahn et al., 2008), 연풍의 뿌리 부위별 직경과 진세노사이드 함량과의 관련성을 보고한 바 있다 (Li et al., 2009). 또한, 천풍 등 3 개 품종의 연근별 줄기 흔적수와 연근별 진세노사이드 함량 (Kim et al., 2017a)이 몇몇 인삼 품종에서 보고되었으나 본 연구에서와 같이 10 종에 이르는 많은 수의 인삼 품종에 대해 효능 및 진세노사이드 함량을 함께 평가한 연구는 부족하다.
한편, 국내외적으로 노령화 추세에 따라 알츠하이머성 치매 등 노화에 따른 신경퇴행성질환의 발병율이 증가함으로써 사회경제적으로 큰 부담이 되고 있으나 기 개발된 치료제는 증상 완화에만 효과를 보이고 증상 진전 억제는 불가능하므로 근본적인 치료약물이 필요하다 (KHIDI, 2018). 또한, 인삼 중 가공하지 않은 백삼은 건강기능식품원료로 개발되고 있으나 면역증진, 피로회복 및 뼈 건강 등 일부 기능성만이 인정되어 홍삼에 비해 연구 및 산업화 소재로의 개발이 미진하다.
따라서, 본 연구에서는 기 개발된 10 종의 인삼 품종 뿌리를 재료로 하여 신경퇴행성 질환 개선 또는 기억력 개선 소재로의 이용성을 평가하기 위해 생쥐 뇌 소교세포에서의 산화질소 저해 활성 및 항산화 활성을 분석하고 기억 관련 glutamate 수용체의 일종인 N-methyl-D-aspartate receptor (NMDAR)에 대한 제어능을 분석하였으며 총 페놀 함량과 진세노사이드 함량을 분석하였기에 그 결과를 보고하고자 한다.
재료 및 방법
1. 실험재료
본 연구에 사용된 실험재료로는 국내 연구기관들에서 개발한 인삼 (Panax ginseng C. A. Mey.) 10 품종의 뿌리가 이용되었으며, 이를 위해 2018년 9월 중순 충북 음성군 국립원예특작과학원 인삼특작부 시험포장에서 증식된 6년근을 채취하여 세척한 후 동결건조기 (Ilshin Lab Co., Ltd., Yangju, Korea)에서 5 일간 건조하였다.
뇌두를 제외한 건조된 각 인삼 품종별 뿌리 전체 (동체, 지근, 미삼)를 분쇄하고, 이중 50 g을 70% 에탄올 500 ㎖을 가해 상온에서 24 시간 추출 및 여과 (2 회 반복)한 후 얻어진 추출액을 감압농축기 (N-1200NB, Eyela Co., Ltd., Kesennuma, Japan)를 이용하여 50℃에서 용매를 제거하였다. 추출물 중에 남아 있는 미량의 수분은 동결건조기를 이용해 30℃의 선반에서 약 4 일간 제거하고 실험에 사용하였다. 실험에 사용된 인삼 품종 및 조제된 뿌리 추출물의 수율은 Table 1에 나타내었으며, 수율에 있어서 인삼 품종 뿌리 추출물 간에 유의적인 차이는 없었다.
2. 시약
본 연구를 위해 사용된 시약으로 Dulbecco’s minimum essential media (DMEM), fetal bovine serum (FBS)는 Thermo Fisher Scientific (Waltham, MA, USA)에서 구입하였고, NaCO3는 Kanto Chemical (Tokyo, Japan)에서 구입하였다. Folin-Ciocalteu reagent, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT), 2',7'-dichlorofluorescin diacetate (DCFDA), lipopolysaccharide (LPS), dimethyl sulfoxide (DMSO), penicillin & streptomycin (PEST), gallic acid, 3-morpholinosydnonimine (SIN-1), sodium phosphate, dihydrorhodamine 123 (DHR123), sulfanilamide, N-1-napthyl-ethylenediamine dihydrochloride (NED), L-glutamate, trizma base 및 ethylenediaminetetraacetic acid (EDTA)는 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하였다.
Phosphate buffered saline (PBS)는 WelGene (Gyeongsan, Korea)에서, [3H]CGP39653 및 scintillation cocktail은 Perkin Elmer (Boston, MA, USA)에서, HCl은 VWR international (Radnor, PA, USA)에서, NaCl은 Junsei Chemical (Tokyo, Japan)에서, KCl은 Yakuri Pure Chemical (Kyoto, Japan)에서 구입하였다. 진세노사이드 함량분석에 필요한 표준물질로서 ginsenoside -Rg1, -Re, -Rg2 (S), -Rg2 (R), -Rb1, -Rc, -Rb2, -Rb3, -Rd, -Rg3 (S) 및 -Rg3 (R)는 Biopurify Phytochemical (Chengdu, Sichuan, China)의 것을 사용하였고 water, methanol, acetonitrile은 Burdick & Jackson (Honeywell Research Chemicals Inc., Shanghai, China)의 제품을 구매하여 사용하였다.
3. 세포주 및 배양방법
세포에서 인삼 품종 뿌리 추출물의 세포증식율, 항염 활성 및 활성산소 저해능 분석을 위해 mouse brain 유래 microglial cells인 BV-2 세포주를 사용하였으며 37℃, 5%의 CO2 조건의 배양기에서 5% FBS, 1% PEST을 포함하는 DMEM 배지를 사용하여 배양하였다.
4. 세포에서의 산화질소 저해 활성 및 세포증식율에 대한 영향 분석
인삼 품종별 뿌리 추출물의 산화질소 저해활성을 평가하기 위해 Jeong 등 (2018)의 방법에 따라 lipopolysaccharide (LPS)에 의해 유도된 산화질소 (nitric oxide, NO) 생성에 대한 저해정도를 분석하였다.
BV-2 세포 (2 × 105 cells/㎖)를 48 well plate에 분주한 다음 24 시간 배양한 후 인삼 품종별 추출물 (최종농도 20 ㎍/㎖)을 serum free (SF) media에 녹여 2 시간동안 처리하였으며 정상실험 및 음성대조실험을 위해서는 시료를 녹인 용매인 dimethyl sulfoxide (DMSO)를 SF media에 녹여 2 시간동안 처리하고 배지를 제거한 후 0.5 ㎍/㎖ 농도의 LPS를 처리하였다. 24 시간 후 각 well로부터 상등액 (배지) 50 ㎕를 취해 96 well plate에 옮겨 담고, 1% sulfanilamide 50 ㎕와 0.1% N-1-napthyl-ethylenediamine dihydrochloride (NED) 50 ㎕를 각각 가하여 혼합한 후 520 ㎚에서의 흡광도를 microplate reader (BioTek Synergy HT, BioTek instruments Inc., Winooski, VT, USA)를 이용하여 측정하였다.
또한, 인삼 품종별 추출물의 세포증식률 분석을 위해서는 Jung 등 (2009)의 방법에 따라 앞서 언급한 BV-2 세포에서의 산화질소 저해능 분석실험과 동일한 과정에서 LPS 처리 후 24 시간째에 각 well로부터 배지를 제거한 후 0.6 ㎎/㎖ 농도의 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) 함유 배지를 처리하였다. 1 시간 후 각 well의 MTT 함유 배지를 제거하고 dimethyl sulfoxide (DMSO)를 가해 formazan을 용해한 후 540 ㎚ 파장에서의 흡광도를 microplate reader (BioTek Synergy HT, BioTek Instruments Inc., Winooski, VT, USA)를 사용하여 측정하였다.
5. 세포에서의 활성산소 (reactive oxygen species, ROS) 저해활성 분석
인삼 품종별 뿌리 추출물의 활성산소 저해능을 분석하기 위해서 BV-2 세포 (5 × 104 cells/well)를 96 black well plate에 분주하고 16 시간 동안 배양한 후 인삼 품종별 추출물 (최종농도 20 ㎍/㎖)을 serum free (SF) media에 녹여 24 시간동안 처리하였으며 정상실험 및 음성대조실험을 위해서는 시료를 녹인 용매인 dimethyl sulfoxide (DMSO)를 SF media에 녹여 24 시간동안 처리하고 0.5 ㎍/㎖ LPS를 12 시간 동안 순차적으로 처리하였다. 10 μM의 2',7'-dichlorofluorescin diacetate (DCFDA)를 30 분간 처리한 후 PBS로 세척하고 반응이 끝난 각 well은 microplate reader (BioTek Synergy HT, BioTek Instruments Inc., Winooski, VT, USA)를 사용하여 excitation 485 ㎚ 및 emission 530 ㎚ 조건에서 형광을 측정하였다 (Lau et al., 2007).
6. N-Methyl-D-aspartate (NMDA) 수용체 제어능 및 peroxynitrite (ONOO−) 소거능 분석
인삼 품종별 뿌리 추출물의 NMDA 수용체에 대한 제어능을 확인하기 위해 Sills 등 (1991) 및 Lee 등 (2019)의 방법에 따라 실험하였다. 먼저, 4℃에서 1 ㎎의 protein에 해당하는 랫드 뇌피질막 균질액을 5 nM [3H]CGP39653와 함께 5 mM Tris-HCl (pH 7.7), 10 mM EDTA-Tris와 함께 최종농도 50 ㎍/㎖의 인삼 추출물 포함 (대조실험은 미포함) 조건에서 60 분간 배양하면서 100 μM L-glutamate 존재 하에 시료의 NMDA 수용체에 대한 비특이적 결합을 결정하였다. 배양 후, 시료를 진공 하에 glass fiber filters (GF/B, Brandel Inc., Gaithersburg, MD, USA)로 신속히 여과하고, 48 sample cell harvester를 사용하여 ice-cold incubation buffer로 여러차례 세척하였으며, 여과액은 건조시킨 후 scintillation cocktail을 사용하여 scintillation counter (LS series, Beckman Instruments Inc., Fullerton CA, USA)를 이용하여 radioactivity를 계산하였다.
인삼 품종별 뿌리 추출물의 peroxynitrite (ONOO−)에 대한 소거능 분석을 위해서는 Lee 등 (2019)의 방법에 따라 96 well microplate (black)에 최종농도 70 ㎍/㎖이 되도록 조제한 시료 또는 시료를 녹인 dimethyl sulfoxide (DMSO)를 10 ㎕를 분주하고, 90 mM NaCl, 5 mM KCl 및 100 μM diethylenetriaminepenta acetic acid와 10 μM dihydrorhodamine123 (DHR123)을 함유하는 180 ㎕의 50 mM sodium phosphate 완충액 (pH 7.4)을 가했다. 순차적으로 각 well에 50 μM 농도의 3-morpholinosydnonimine hydrochloride (SIN-1)를 10 ㎕씩 처리하고 5 분간 상온에서 반응시킨 후 excitation 485 ㎚ 및 emission 530 ㎚에서의 형광정도를 microplate reader (BioTek Synergy HT, BioTek Instruments Inc., Winooski, VT, USA)를 사용하여 측정하였다.
7. 총 페놀 함량 및 진세노사이드 함량 분석
인삼 품종별 뿌리 추출물의 총 페놀 함량 분석을 위해 시료 100 ㎕와 2% Na2CO3 용액 2 ㎖을 혼합하고 2 분 후 50% Folin-Ciocalteu 용액 100 ㎕을 가하여 30 분간 반응시키고 얻어진 반응물의 750 ㎚ 파장에서의 흡광도를 분광광도계 (Cary-300, Agilent Technologies Inc., Santa Clara, CA, USA)를 이용하여 측정하였다. 각 시료의 총 페놀 함량은 gallic acid를 표준물질로 사용하여 농도별 흡광도로부터 도출된 검량선식 (y = 0.0226x + 0.0639, R2 = 0.9886)을 적용하여 계산하였다 (Lee et al., 2019).
인삼 품종별 뿌리 추출물의 진세노사이드 함량 분석을 위해 인삼 추출물 시료는 0.2 g를 정밀히 달아 50 ㎖ 원심분리관에 취한 후 70 % 메탄올 25 ㎖을 넣은 다음 15 분간 진탕하고 50 ㎖로 정용하였으며 4℃에서 1,600 × G로 10 분간 원심분리하여 얻어진 상등액을 0.2 ㎛ 멤브레인 필터로 여과한 후 시험용액으로 사용하였다. 또한, 진세노사이드 표준물질은 각각 70% 메탄올을 이용하여 먼저 1 ㎎/㎖로 제조한 후 70% 메탄올로 희석하여 2 ppm, 10 ppm, 50 ppm, 100 ppm, 200 ppm 표준용액으로 만든 후 분석에 사용하였다. 진세노사이드 분석 장비로는 UV detector (DAD)와 Accucore C18 column (3.0 ㎜ × 50 ㎜, 2.6 ㎛, Thermo Fisher Scientific Inc., Waltham, MA, USA)이 장착된 Agilent 1260 Infinity HPLC (Agilent Technologies Inc., Santa Clara, CA, USA)를 사용하였다. 이동상으로 water (A)와 acetonitrile (B)를 사용하여 gradient system을 적용하여 분석하였으며, 유속은 0.8 ㎖/min, 시료 주입량은 2 ㎕, 컬럼 온도는 30℃로 하였다 (Table 2).
8. 통계분석
인삼 품종별 뿌리 추출물의 활성 및 성분 분석 실험은 반복 실험으로 얻은 결과 (n = 3)로서 평균 ±표준편차로 나타내었으며, 통계적 유의성은 SAS program (version 9.4, SAS Institute Inc., Cary, NC, USA)에서 ANOVA 분석을 실시하여 유의성이 있을 경우 p < 0.05 수준에서 Duncan’s Multiple Range Test (DMRT)를 실시하였으며, 활성-성분 및 활성-활성간의 상관계수는 Pearson’s correlation coefficient 계산법을 이용하여 산출하였다.
결과 및 고찰
1. 인삼 품종별 뿌리 추출물의 microglia에서의 세포증식율
Microglia (소교세포)는 뇌와 척수에 널리 존재하는 neuroglia (glial cell, glial, 신경아교세포)의 한 형태로서 뇌 실질조직의 총 glial 세포의 10% - 15%에 해당 (Ginhoux et al., 2013) 되는 데 형태적, 면역표현형적 및 기능적으로는 monocyte/macrophage 계에 속하고 중추신경계 손상에 대해 최초로 반응하는 세포들이다 (Gehrmann et al., 1995).
Microglia가 활성화되면 L-arginine에서 비롯된 유리기인 산화질소 (NO)의 대사물질인 nitrite (Chao et al., 1992)가 대량으로 생성될 뿐만 아니라, 다양한 사이토카인들, 활성 산소종 (ROS) 및 질소종 (RNS)이 생성된다 (Hansen et al., 2010). 이렇게 microglia에서 생성된 NO와 반응성을 가진 질소산화물들은 신경퇴행성질환에서 신경독성물질이 되며 (Boje and Arora, 1992), microglia가 매개한 신경염증은 알츠하이머병, 파킨슨병, 다발성 경화증, human immunodeficiency virus (HIV) 관련 치매와 같은 신경퇴행성 질환의 발병에 중요한 역할을 한다 (Zhou et al., 2014). 또한, 활성화된 microglia에서 생성된 ROS는 향염증성 산화환원 활성 신호전달계에서 신호전달물질로서 작용한다 (Hansen et al., 2010).
따라서, microglia의 활성화를 저해하는 것은 신경염증조건에서 신경퇴행을 완화시킬 수 있으므로 본 연구에서는 mouse brain 유래 microglia인 BV2에 대해 microglia 활성화에 의한 신경염증을 유발하는데 사용되는 LPS를 이용 (Lee et al., 2013a) 하여 인삼 (Panax ginseng C. A. Mey.) 품종별 뿌리 추출물의 세포증식율, 염증 (NO 생성) 저해능 및 활성산소 (ROS) 저해능을 분석하였다.
실험 결과, 상온에서 조제된 인삼 품종별 뿌리 추출물이 BV2 세포의 증식에 미치는 영향을 확인하였을 때 시료를 녹인 용매 (DMSO)만 처리된 정상실험 (Nor)을 100%로 하였을 때, 인삼 품종 추출물 시료를 녹인 DMSO 및 LPS를 처리한 음성대조군 (NC)의 수치는 82.8%까지 유의하게 감소하였다. 또한, 최종농도 20 ㎍/㎖인 인삼 품종별 뿌리 추출물과 LPS를 처리한 시료처리실험에서는 97.5% - 105.3%의 세포증식율을 보여 음성대조실험에 비해 세포증식율이 유의하게 높았다 (Fig. 1). 하지만, 인삼 품종별 뿌리 추출물들 간에는 유의한 차이가 없었으며 이는 정상실험군의 결과와도 차이가 없었으므로 인삼 품종별 뿌리 추출물은 품종별로 차이가 없이 LPS에 의해 저해된 세포증식율을 회복시키는 것으로 사료되었다.
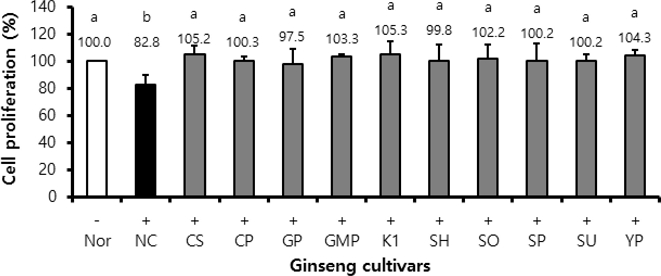
Effect on BV2 cell proliferation of ginseng cultivar extracts.BV-2 cells (2 × 105 cells/well) in 48-well plate were treated with sample extracts (at the final concentration of 20 ㎍/㎖) in serum free (SF) media for 2 hours and with DMSO in SF media as normal and negative control. The wells were followed by LPS (0.5 ㎍/㎖) treatment for 24 hours. After treatment with 0.6 ㎎/㎖ MTT, the optical density of formazan was measured at 540 ㎚. (-); LPS-untreated experiment, (+); LPS-treated experiment. LPS means lipopolysaccharide. Nor; normal, NC; negative control, CS; Cheongsun, CP; Chunpoong, GP; Gopoong, GMP; Gumpoong, SH; Sunhyang, SO; Sunone, SP; Sunpoong, SU; Sunun, YP; Yunpoong. Statistical analysis was performed by using SAS program. *Values with different alphabet (a - b) are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
2. 인삼 품종별 뿌리 추출물의 microglia에서의 산화질소 (NO) 저해능
BV2 세포에서의 항염증 활성을 평가하기 위해 진행된 산화질소 (NO) 생성 저해능 분석실험에서는 LPS는 처리하지 않고 시료를 녹인 용매 (DMSO)만 처리된 정상실험 (Nor)에 비해 DMSO 및 LPS를 처리한 음성대조실험 (NC)에서 NO 값은 증가하였으며 인삼 품종별 뿌리 추출물 (최종농도 20 ㎍/㎖)과 LPS를 병행하여 처리한 시료처리실험에서는 음성대조실험에 비해 NO 값이 유의하게 감소하였다. 한편, 각 실험에 대한 NO 생성 정도를 음성대조실험에 대한 저해율로 나타내었을 때, LPS 무처리된 정상실험은 76.7%이었으나 인삼 품종 뿌리 추출물은 28.4% - 60.8%의 저해율을 나타내 LPS 처리에 따라 무처리된 정상실험에 비해서는 활성이 다소 감소함을 알 수 있었다.
또한, 인삼 품종에 있어서는 금풍 (GMP)이 60.8%로 인삼 품종들 중에서는 가장 우수한 저해율을 보였으며, K1 (57.3%), 선풍 (SP, 54.5%), 연풍 (YP, 53.1%), 천풍 (CP, 51.7%), 청선 (CS, 50.9%), 선향 (SH, 49.6%)은 통계분석에서 같은 정도의 NO 생성 저해효과를 가지는 것으로 확인되었고, 다음으로 선운 (SU, 47.0%) > 고풍 (GP, 39.3%) > 선원 (SO, 28.4%)의 순으로 NO 생성 저해효과를 나타내었다 (Fig. 2).
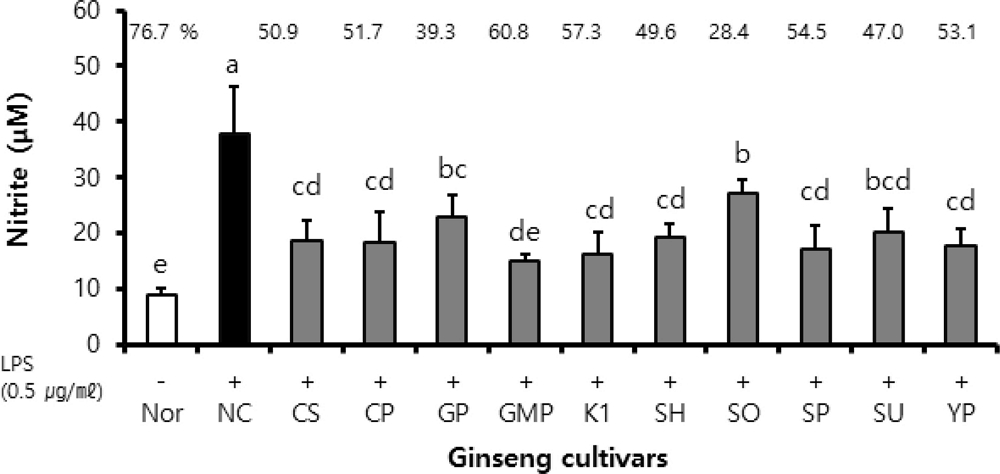
Inhibition activity on nitric oxide (NO) production of ginseng cultivar extracts. BV-2 cells (2 × 105 cells/well) in 48-well plate were treated with sample extracts (at the final concentration of 20 ㎍/㎖) in serum free (SF) media for 2 hours and with DMSO in SF media as normal and negative control. The wells were reacted with 0.5 ㎍/㎖ LPS for 24 hours. Optical density of the reaction supernatant was measured at 520 ㎚. (-); LPS-untreated experiment, (+); LPS-treated experiment. LPS means lipopolysaccharide. Nor; normal, NC; negative control, CS; Cheongsun, CP; Chunpoong, GP; Gopoong, GMP; Gumpoong, SH; Sunhyang, SO; Sunone, SP; Sunpoong, SU; Sunun, YP; Yunpoong. Statistical analysis was performed by using SAS program. *Values with different alphabet (a - e) are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
3. 인삼 품종별 뿌리 추출물의 microglia에서의 활성산소 (ROS) 저해능
인삼 품종별 뿌리 추출물의 항산화 활성을 평가하기 위해 BV2 세포에서 LPS 처리로 생성된 활성산소 (ROS)에 대한 소거 활성을 분석하였다. 실험결과, LPS를 처리하지 않고 시료를 녹인 용매만을 처리한 정상실험 (Nor)을 100으로 하여 나타낸 형광도에 비해 LPS와 시료를 녹인 용매만을 처리한 음성대조실험 (NC)의 상대형광도는 증가하였고, LPS와 시료 추출물을 처리한 인삼 품종 뿌리 추출물 처리실험들에서는 음성대조실험에 비해 상대형광도가 유의하게 감소하였다.
이렇게 나타난 인삼 품종 추출물들의 상대형광도를 음성대조실험의 상대형광도에 대한 저해율로 나타내었을 때, 천풍 (CP)이 31.8%, K1이 30.2%, 선향 (SH)이 26.9%, 선풍 (SP) 이 25.5% 및 연풍 (YP)이 24.9%, 청선 (CS)이 23.7%로 같은 정도로 우수한 ROS 저해효과를 나타내었고, 선원 (SO, 21.1%), 금풍 (GMP, 20.9%), 선운 (SU, 19.3%) 및 고풍 (GP, 18.3%)은 다소 낮은 활성을 보여, 인삼 품종 뿌리 추출물 중에서 천풍 (CP), K1, 선향 (SH), 선풍 (SP) 및 연풍 (YP) 및 청선 (CS)은 활성산소에 대해 유의하게 소거활성을 나타냄을 알 수 있었다 (Fig. 3).
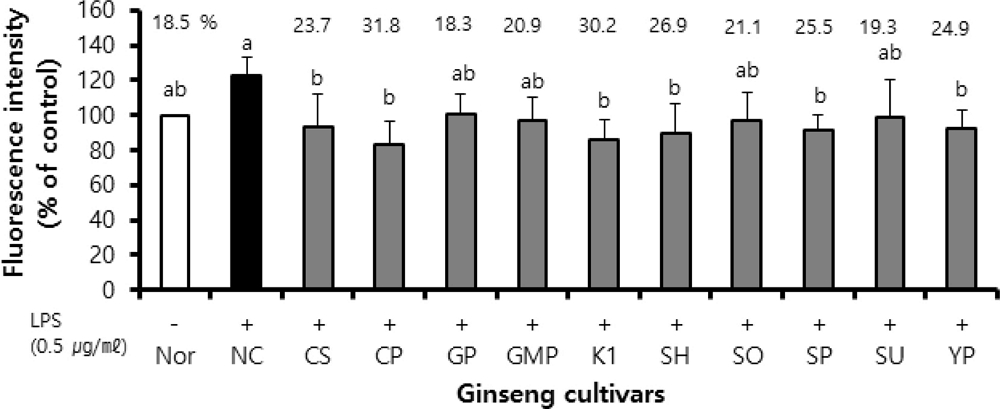
Inhibition activity on reactive oxygen species (ROS) of ginseng cultivar extracts. BV-2 cells (5 × 104 cells/well) in 96-well black plate were treated with the cultivar extract samples at the final concentration of 20 ㎍/㎖ in serum free (SF) media and with DMSO in SF media for normal and control experiment for 24 hours. The reaction wells were treated by LPS treatment (0.5 ㎍/㎖) for 12 hours. After all of the treatments, the fluorescence of the plate was measured via DCFDA staining. (-); LPS-untreated experiment, (+); LPS-treated experiment. LPS means lipopolysaccharide. Nor; normal, NC; negative control, CS; Cheongsun, CP; Chunpoong, GP; Gopoong, GMP; Gumpoong, SH; Sunhyang, SO; Sunone, SP; Sunpoong, SU; Sunun, YP; Yunpoong. Statistical analysis was performed by using SAS program. *Values with different alphabet (a - b) are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
4. 인삼 품종별 뿌리 추출물의 peroxynitrite (ONOO−) 소거능
Peroxynitrite (ONOO−)에 대한 인삼 품종별 뿌리 추출물의 소거활성을 분석하였으며 그 결과는 다음과 같다. 3-Morpholinosydnonimine (SIN-1)을 처리하지 않고 시료를 녹인 용매 (DMSO)만을 처리한 정상실험 (Nor)를 100으로 하였을 때 나타낸 상대형광도 값에 비해 Sin-1과 DMSO를 처리한 음성대조실험 (NC)의 상대형광도 값은 유의하게 증가하였으며, Sin-1과 시료를 처리한 인삼 품종 추출물 처리실험에서는 음성대조실험 (NC)의 상대형광도 값에 비해 모두 유의적으로 낮았다.
이러한 결과를 음성대조실험의 상대형광도 값에 대한 저해율로 계산하였을 때, 인삼 품종 뿌리 추출물들은 46.9% - 54.7%의 저해율을 보였으며, 인삼 품종들 사이의 ONOO−에 대한 소거 활성은 통계학적으로 유의미한 차이는 확인되지 않았다 (Fig. 4).
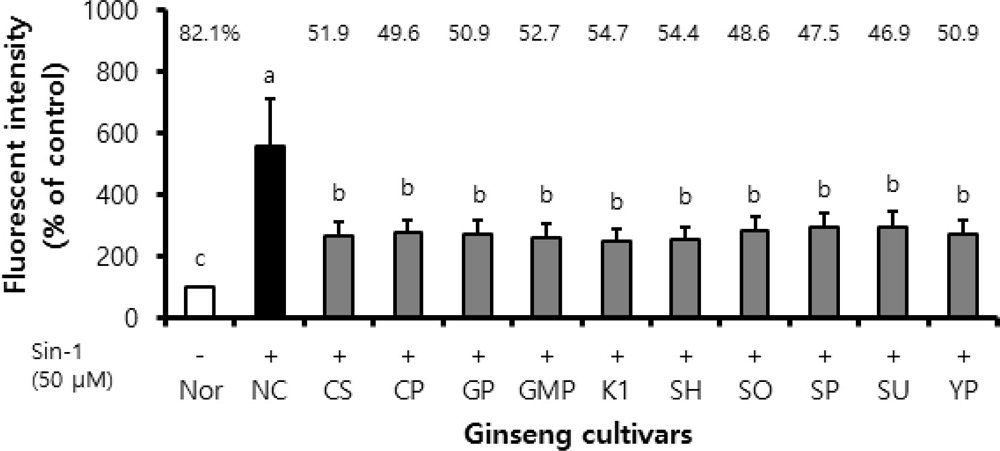
Inhibition activity on peroxynitrite (ONOO−) of ginseng cultivar extracts. Treatment of 10 ㎕ of ginseng extract or dimethyl sulfoxide (DMSO) in serum free (SF) media at the final concentration of 70 ㎍/㎖ was conducted on 96 black well plate. The reaction wells were treated with 180 ㎕ of 50 mM sodium phosphate buffer (pH 7.4, containing 90 mM NaCl, 5 mM KCl, 100 μM diethylenetriaminepenta acetic acid and 10 μM dihydrorhodamine 123 (DHR123), and were added with 10 ㎕ of 50 μM 3-morpholinosydnonimine (SIN-1) for 5 min. After all of the treatments, the fluorescence of the wells were measured at excitation 485 ㎚ and emission 530 ㎚. (-); Sin-1 untreated experiment, (+); Sin-1 treated experiment. Nor; normal, NC; negative control, CS; Cheongsun, CP; Chunpoong, GP; Gopoong, GMP; Gumpoong, SH; Sunhyang, SO; Sunone, SP; Sunpoong, SU; Sunun, YP; Yunpoong. Statistical analysis was performed by using SAS program. *Values with different alphabet (a - c) are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
5. 인삼 품종별 뿌리 추출물의 NMDA 수용체 (NMDAR) 제어능
N-Methyl-D-aspartate receptors (NMDAR)는 대뇌피질과 해마에 고밀도로 존재하면서 학습과 기억의 시작단계에서 중요한 역할을 하는 glutamate 수용체의 하나로서 공간, 판단, 작업 및 수동회피기억 등 많은 기억 수행 작업 및 기억 관련 장시간 강화 (long-term potentiation, LTP) 그리고 노화에 따른 NMDA 수용체의 변화와 기억 쇠퇴와 관련 된다 (Magnusson et al., 2010).
NMDA 수용체는 시냅스 구성과 시냅스성 가소성의 형성과 발달에서 중요한 일들을 조절하지만 신경퇴행적 조건에서는 NMDA 수용체의 과다한 발현이 신경사멸을 촉진하기도 한다 (Carvajal et al., 2016). 즉, 뇌에서 NMDAR 수용체는 상반된 역할 (Carvajal et al., 2016)을 가지는 데, NMDA 수용체에 대한 완전한 차단은 신경가소성에 손상을 주므로 glutamate 시스템의 활성부족이나 활성 과다 모두 기능장애로 진행 (Parsons et al., 2007) 되게 하며, NMDA 수용체의 지나친 활성화는 알츠하이머 (Alzheimer’s disease, AD)와 같은 신경퇴행성 질환에서 보고되는 glutamate 독성 및 신경사멸 (Lopes et al., 2013), 신경기능장애 (Mota et al., 2014)와 관련된다. 그러므로 알츠하이머병에 있어서 NMDAR에 대한 경쟁물질은 신경독성을 차단함으로써 인지기능의 소실을 늦출 것으로 기대할 수 있을 것이다.
본 연구에서는 인삼 품종별 뿌리 추출물의 NMDA 수용체 제어능을 확인함으로써 인지능 개선 효과를 비교, 평가하고자 하였으며 실험결과, 50 ㎍/㎖의 농도로 처리된 인삼 품종별 뿌리 추출물 중에서는 K1이 51.2%로 가장 우수한 NMDA 수용체 제어효과를 나타내었으며, 선향 (50.3%) > 금풍 47.4% > 고풍 44.5% > 선운 43.5% > 선원 42.4% > 청선 39.4% = 천풍 39.3% = 연풍 38.3% > 선풍 37.0%의 순으로 우수한 결과를 나타낸 것으로 확인되었다 (Table 3).
6. 인삼 품종별 뿌리 추출물의 총 페놀 함량
페놀 및 플라보노이드 성분은 식물에 풍부한 이차대사산물로서 항산화 활성뿐만 아니라 항염증, 면역 증진, 항균, 항암, 심장보호 등 다양한 생리적 활성을 가진다 (Ambriz-Pérez et al., 2016; Tungmunnithum et al., 2018). 인삼의 페놀 및 플라보노이드 성분은 열매, 잎에 비해 함량이 낮으나 뿌리에도 함유 되어 있으므로 (Chung et al., 2016), 인삼 품종별 뿌리추출물에 함유된 총 페놀 함량을 분석하였다.
총 페놀 함량 실험결과, Table 3에 나타낸 바와 같이 인삼 품종 뿌리 추출물의 총 페놀 함량을 인삼 품종 뿌리 분말 g 당 함량으로 환산한 값은 1.21 - 1.89 ㎎/g powder의 수치를 보였는데 선향이 1.89 ㎎/g으로 가장 높았고, 그 다음으로 K1 (1.73 ㎎/g)이 높았으며 선풍 (1.61 ㎎/g) > 고풍 1.51 ㎎/g = 선원 1.51 ㎎/g > 금풍 1.44 ㎎/g = 연풍 1.42 ㎎/g = 청선 1.38 ㎎/g > 선운 1.30 ㎎/g> 천풍 1.21 ㎎/g의 순으로 높았다 이러한 결과는 Lee 등 (2013b)이 백삼 추출물에서의 총 페놀 함량이 1.2/100 g이라고 보고한 것과는 차이가 있는 수치였으며 이는 Lee 등 (2013b)이 여러 단계에 걸쳐 다양한 용매를 적용하여 인삼추출물을 조제한 데 비해 본 실험에서는 70% 에탄올로만 추출하였으므로 추출물 제조방법의 차이가 매우 상이한 데에 기인한 것으로 사료되었다.
7. 인삼 품종별 뿌리 추출물의 진세노사이드 함량
진세노사이드는 인삼의 주요 활성성분 (Razgonova et al., 2019)이며 골다공증 완화 (Siddiqi et al., 2013), 신경보호 (Rausch et al., 2006; Zheng et al., 2018), 항염 (Kim et al., 2017c; Yu et al., 2017), 위점막보호 (Lee et al., 2014), 랫드 모델에서 알츠하이머 저해 (Wang et al., 2018) 및 신경퇴행성질환 억제 (Kim et al., 2018) 등의 생리적 활성을 나타낸다고 보고되어 있으나, 일부 품종에 대해서만 진세노사이드 함량 분석이 되어 있을 뿐 본 연구에서와 같이 많은 품종에서의 진세노사이드 함량을 비교한 실험은 보고되지 않고 있다 따라서, 청선 등 10 가지 인삼 품종별 뿌리 추출물에 함유된 진세노사이드 함량을 파악하기 위해 HPLC를 이용하여 분석하였다.
실험결과, 인삼 품종의 뿌리 추출물 중에서 진세노사이드 -Rg1, -Re 및 -Rb1에 있어서는 연풍이 각각 16.06 ㎎/g, 11.56 ㎎/g 및 21.64 ㎎/g으로 가장 높은 수치를 나타내었고, 진세노사이드 -Rg2 (S)에 있어서는 청선이 0.50 ㎎/g, 고풍이 0.48 ㎎/g으로 가장 높았으며 진세노사이드 -Rc, 진세노사이드 -Rb2, 진세노사이드 -Rb3에 있어서는 고풍이 7.22 ㎎/g, 6.71 ㎎/g 및 1.10 ㎎/g으로 가장 높았다. 또한 진세노사이드 -Rd에 있어서는 고풍 1.28 ㎎/g, 금풍 1.36 ㎎/g, 선향 1.26 ㎎/g 및 연풍 1.38 ㎎/g로 가장 높은 수치를 보였고 총 진세노사이드 함량에서는 연풍이 높았다. 진세노사이드 -Rg2 (R), 진세노사이드 -Rg3 (S) 및 진세노사이드 -Rg3 (R)는 모든 품종에서 검출되지 않았다 (Table 4).
또한, 인삼으로부터 밝혀진 진세노사이드는 30 여종으로 구조에 따라 20 (S)-protopanaxadiol (PPD)와 20 (S)-protopanaxatriol (PPT) 계열로 분류되며, 진세노사이드 -Rb1, -Rb2, -Rb3, -Rc, -Rd, -Rg3, -Rh2, -Rs1는 PPD계, 진세노사이드 -Re, -Rf, -Rg1, -Rg2, -Rh1는 PPT계에 포함된다 (Leung and Wong, 2010). 본 실험결과 PD/PT 비율에서는 0.98 - 1.43의 수치를 보여 천풍 (0.98)을 제외한 모든 인삼 품종 뿌리 추출물이 1 이상의 비율을 나타내었다.
이는 추출방법에 따라 PD/PT 비율이 0.696 - 0.945 라고한 Kim 등 (2008b)의 보고에 비해 높은 수치였는데, 이러한 차이는 백삼 분말로부터 직접 HPLC 분석용 시료를 조제한 Kim 등 (2008a)과는 달리 본 연구에서는 뇌두를 제거한 인삼 뿌리로부터 추출물을 조제한 후 일정량을 용매에 녹여 분석한 시료 조제방법의 차이에 따른 것으로 사료된다. 그런데, 인삼의 PD/PT 비율은 뇌두, 주근, 측근, 세근의 순으로 증가하며 (Han et al., 2013), 우리 고려인삼은 백삼과 홍삼이 각각 1.53, 1.68이고 미국삼 (Panax quinquefolium L.)의 1.59과 유사한 수준이나, 삼칠삼 (Panax notoginseng)의 0.58에 비해 높다는 Kim 등 (1982)의 연구결과를 고려할 때, 이번 실험에서 얻어진 PD/PT 비율 (0.98 - 1.43)은 비교적 낮은 수치였다 또한, PD/PT 비율이 높을 때보다는 낮은 값을 가질 때 학습과 기억에 대해 보다 유익하다는 Jin 등 (1999)의 보고를 고려할 때 실험된 인삼 품종 뿌리 중에서 PD/PT 값이 비교적 낮은 천풍 (0.98), 청선 (1.16), K1 (1.05), 선원 (1.05), 선운 (1.15) 등은 보다 우수한 기억력개선 활성을 기대할 수 있을 것으로 사료되었다.
한편, 실험된 인삼 품종별 뿌리 추출물의 in vitro 활성들과 총 페놀 함량, 진세노사이드 함량과의 상관관계 산출하였으며 그 결과를 Table 5에 나타내었다. 먼저, 진세노사이드 등 성분과 활성 간에는 대체적으로 상관계수가 낮은 수치를 보였으나, 진세노사이드와 NO 생성 저해능 간의 상관계수에 있어서는 진세노사이드 -Rb1과는 0.5268, -Rd와는 0.4860, Rg1과는 0.4254, -Re와는 0.4046의 비교적 높은 수치를 보여 이들 진세노사이드 함량이 높을수록 NO 소거능이 우수한 것으로 사료되었다. 또한, PD/PT 비율과의 활성 간의 상관계수에 있어서는 ROS 소거능과는 -0.4578의 수치를 보여 PD계 진세노사이드 보다 PT계 진세노사이드 함량이 높을수록 ROS 소거능이 우수할 것으로 생각되었다.

Correlation coefficients between total phenol, ginsenosides and activities in ginseng cultivar root extracts.
총 페놀 함량과 ONOO− 소거능 및 NMDAR 제어능 사이에는 각각 0.5778 및 0.6137의 비교적 높은 값을 보여 총 페놀 함량이 높을수록 이들 활성이 대체적으로 증가하는 경향을 보인다고 사료되었다. 끝으로 인삼 품종별 뿌리 추출물이 보인 활성-활성 간의 상관관계를 분석한 결과 활성-활성 간의 상관계수 값은 비교적 낮았으나 ONOO− 소거능과 NMDAR 제어능 사이에는 0.7064의 값을 보여 비교적 높은 상관성을 보이는 것으로 확인되었다 (Table 6).
이상과 같이 인삼 품종의 뿌리 추출물에 대해 mouse brain 유래 소교세포에서의 NO 저해능, ROS 소거능, chemical 수준에서의 NMDAR 제어능 및 총 페놀 함량 등 인삼 품종 간에 유의적인 차이가 확인된 실험항목과 인지능 개선에 효과적인 낮은 PD/PT 비율 등을 종합적으로 고려할 때, K1과 선향 (SH) 뿌리가 비교적 우수한 인지능 개선 및 항산화 기능성을 기대할 수 있는 인삼 품종이라고 사료되었다.
Acknowledgments
본 연구는 농촌진흥청 시험연구사업(과제번호: PJ01193302)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Ahn IO, Lee SS, Lee JH, Lee MJ and Jo BG. (2008). Comparison of ginsenoside contents and pattern similarity between root parts of new cultivars in Panax ginseng C. A. Meyer. Journal of Ginseng Research. 32:15-18.
[https://doi.org/10.5142/JGR.2008.32.1.015]

-
Ambriz-Pérez DL, Leyva-López N, Gutierrez-Grijalva EP and Heredia JB. (2016). Phenolic compounds: Natural alternative in inflammation treatment. a review. Cogent Food and Agriculture. 2: 1131412. (cited by 2019 Oct 13).
[https://doi.org/10.1080/23311932.2015.1131412]

-
Attele AS, Zhou YP, Xie JT, Wu JA, Zhang L, Dey L, Pugh W, Rue PA, Polonsky KS and Yuan CS. (2002). Antidiabetic effects of Panax ginseng berry extract and the identification of an effective component. Diabetes. 51:1851-1858.
[https://doi.org/10.2337/diabetes.51.6.1851]

-
Boje KM and Arora PK. (1992). Microglial-produced nitric oxide and reactive nitrogen oxides mediate neuronal cell death. Brain Research. 587:250-256.
[https://doi.org/10.1016/0006-8993(92)91004-X]

-
Carvajal FJ, Mattison HA and Cerpa W. (2016). Role of NMDA receptor-mediated glutamatergic signaling in chronic and acute neuropathologies. Neural Plasticity. 2701526. (cited by 2019 Nov 12).
[https://doi.org/10.1155/2016/2701526]

- Chao CC, Hu S, Molitor TW, Shaskan EG and Peterson PK. (1992). Activated microglia mediate neuronal cell injury via a nitric oxide mechanism. Journal of Immunology. 149:2736-2741.
-
Cho IH. (2015). Volatile compounds of ginseng(Panax sp.): A review. Journal of the Korean Society for Applied Biological Chemistry. 58:67-75.
[https://doi.org/10.1007/s13765-015-0007-0]

-
Choi CS, Kim KI, Hong HD, Choi SY, Lee YC, Kim KT, Rho JH, Kim SS and Kim YC. (2006). Phenolic acid composition and antioxidative activity of white ginseng(Panax ginseng, C. A. Meyer). Journal of Ginseng Research. 30:22-30.
[https://doi.org/10.5142/JGR.2006.30.1.022]

- Chung AS, Cho KJ, Oh JH and Park JD. (2004). Pharmacological and physiological effects of ginseng. Journal of Korean Association of Cancer Prevention. 9:125-138.
-
Chung IM, Lim JJ, Ahn MS, Jeong HN, An TJ and Kim SH. (2016). Comparative phenolic compound profiles and antioxidative activity of the fruit, leaves, and roots of Korean ginseng(Panax ginseng Meyer) according to cultivation years. Journal of Ginseng Research. 40:68-75.
[https://doi.org/10.1016/j.jgr.2015.05.006]

-
Gehrmann J, Matsumoto Y and Kreutzberg GW. (1995). Microglia: Intrinsic immuneffector cell of the brain. Brain Research Reviews. 20:269-287.
[https://doi.org/10.1016/0165-0173(94)00015-H]

-
Ginhoux F, Lim S, Hoeffel G, Low D and Huber T. (2013). Origin and differentiation of microglia. Frontiers in Cellular Neuroscience. (cited by 2019 Oct 11).
[https://doi.org/10.3389/fncel.2013.00045]

-
Han JS, Tak HS, Lee GS, Kim JS, Woo RJ and Choi JE. (2013). Comparison of ginsenoside content and ratio of root tissue according to root age and diameter in Panax ginseng C. A. Meyer. Korean Journal of Medicinal Crop Science. 21:342-347.
[https://doi.org/10.7783/KJMCS.2013.21.5.342]

-
Hansen E, Krautwald M, Maczureck A, Stuchbury G, Fromm P, Steele M, Schulz O, Benavente-Garcia O, Castillo J, Körner H and Münch G. (2010). A versatile high throughput screening system for the simultaneous identification of anti-inflammatory and neuroprotective compounds. Journal of Alzheimer's Disease. 19:451-464.
[https://doi.org/10.3233/JAD-2010-1233]

-
Hofseth LJ and Wargovich MJ. (2007). Inflammation, cancer and targets of ginseng1-3. Journal of Nutrition. 137:183-185.
[https://doi.org/10.1093/jn/137.1.183S]

-
Jang DH, Lee HJ, Lee KJ, Kim KR, Won R, Lee SE and Shim I. (2019). White ginseng ameliorates depressive behavior and increases hippocampal 5-HT level in the stressed ovariectomized rats. BioMed Research International. 5705232. (cited by 2019 Oct 1).
[https://doi.org/10.1155/2019/5705232]

- Jeong HS, Jeong JT, Lee JH, Park CG, Choi JH, Jang GY, Kim JW, Chang JK, Kim DH and Lee SE. (2018). Comparison of anti-oxidative and anti-inflammatory effect of atractylodes interspecific hybrid cultivar roots. Korean Journal of Medicinal Crop Science. 26:391-400.
-
Jin SH, Park JK, Nam KY, Park SN and Jung NP. (1999). Korean red ginseng saponins with low ratios of protopanaxadiol and protopanaxatriol saponin improve scopolamine-induced learning disability and spatial working memory in mice. Journal of Ethnopharmacology. 66:123-129.
[https://doi.org/10.1016/S0378-8741(98)00190-1]

- Jung BS and Shin MG. (1990). Hyangyak-seangyak great encyclopedia. Young-Lim Publishing Co. Seoul, Korea. p.439-443.
-
Jung HW, Yoon CH, Park KM, Han HS and Park YK. (2009). Hexane fraction of Zingiberis Rhizoma Crudus extract inhibits the production of nitric oxide and proinflammatory cytokines in LPS-stimulated BV2 microglial cells via the NF-kappaB pathway. Food and Chemical Toxicology. 47:1190-1197.
[https://doi.org/10.1016/j.fct.2009.02.012]

-
Kang OJ and Kim JS. (2016). Comparison of ginsenoside contents in different parts of Korean ginseng(Panax ginseng C. A. Meyer). Preventive Nutrition and Food Science. 21:389-392.
[https://doi.org/10.3746/pnf.2016.21.4.389]

- Kim DS, Park EJ, Song JY, Park CM, Son HY, Hwang KK and Jee YH. (2008a). Protective effects of an acidic polysaccharide of Panax ginseng on hematopoietic and immune systems of gamma-rays-irradiated mice. Laboratory Animal Research. 24:173-178.
- Kim GS, Hyun DY, Kim YO, Lee SW, Kim YC, Lee SE, Son YD, Lee MJ, Park CG, Park HK, Cha SW and Song KS. (2008b). Extraction and preprocessing methods for ginsenosides analysis of Panax ginseng C. A. Mayer. Korean Journal of Medicinal Crop Science. 16:446-454.
-
Kim JH, Yi YS, Kim MY and Cho JY. (2017a). Role of ginsenosides, the main active components of Panax ginseng, in inflammatory responses and diseases. Journal of Ginseng Research. 41:435-443.
[https://doi.org/10.1016/j.jgr.2016.08.004]

-
Kim JS. (2016). Investigation of phenolic, flavonoid, and vitamin contents in different parts of Korean ginseng(Panax ginseng C. A. Meyer). Preventive Nutrition and Food Science. 21:263-270.
[https://doi.org/10.3746/pnf.2016.21.3.263]

-
Kim JW, Cho SY, Kim SH, Cho DH, Kim SM, Park CW, Shimizu T, Cho JY, Seo DB and Shin SS. (2017b). Effects of Korean ginseng berry on skin antipigmentation and antiaging via FoxO3a activation. Journal of Ginseng Research. 41:277-283.
[https://doi.org/10.1016/j.jgr.2016.05.005]

-
Kim KH, Lee DH, Lee HL, Kim CE, Jung KW and Kang KS. (2018). Beneficial effects of Panax ginseng for the treatment and prevention of neurodegenerative diseases: Past findings and future directions. Journal of Ginseng Research. 42:239-247.
[https://doi.org/10.1016/j.jgr.2017.03.011]

- Kim MW, Lee JS and Choi KJ. (1982). Comparative studies on the chemical components in ginseng. Part Ⅰ. The ginsenosides and the free sugars content of various ginseng plants. Korean Journal of Ginseng Science. 6:138-142.
-
Kim YC, Kim JU, Bae BS, Kang JY, Kim DH, Hyun DY and Lee JS. (2017c). Distribution of stem vestige according to ginseng cultivars and determination of root age by ginsenoside types of red ginseng. Korean Journal of Medicinal Crop Science. 25:217-223.
[https://doi.org/10.7783/KJMCS.2017.25.4.217]

- Korea Health Industry Development Institute(KHIDI). (2018). U.S FDA recent draft guidance for drug development of early Alzheimer's disease. Korea Health Industry Development Institute. Cheongju, Korea. https://www.khidi.or.kr/board/view?linkId=48715916&menuId=MENU01819, . (cited by 2019 Aug 11).
-
Lau FC, Bielinski DF and Jeseph JA. (2007). Inhibitory effects of blueberry extract on the production of inflammatory mediators in lipopolysaccharide-activated BV2 microglia. Journal of Neuroscience Research. 85:1010-1017.
[https://doi.org/10.1002/jnr.21205]

-
Lee KW, Ji HM, Kim DW, Choi SM, Kim S and Yang EJ. (2013a). Effects of Hominis placenta on LPS-induced cell toxicity in BV2 microglial cells. Journal of Ethnopharmacology. 147:286-292.
[https://doi.org/10.1016/j.jep.2013.02.033]

-
Lee LS, Cho CW, Hong HD, Lee YC, Choi UK and Kim YC. (2013b). Hypolipidemic and antioxidant properties of phenolic compound-rich extracts from white ginseng(Panax ginseng) in cholesterol-fed rabbits. Molecules. 18:12548-12560.
[https://doi.org/10.3390/molecules181012548]

-
Lee S, Kim MG, Ko SK, Kim HK, Leem KH and Kim YJ. (2014). Protective effect of ginsenoside Re on acute gastric mucosal lesion induced by compound 48/80. Journal of Ginseng Research. 38:89-96.
[https://doi.org/10.1016/j.jgr.2013.10.001]

- Lee SE, Lee JH, Park CG, Kim HD, Lee YJ, Seo KH, Jeong HS, Chang JK and Kim DH. (2019). Evaluation of the in vitro activity of Glycyrrhiza cultivar roots. Korean Journal of Medicinal Crop Science. 27:115-125.
-
Leung KW and Wong AS. (2010). Pharmacology of ginsenosides: A literature review. Chinese Medicine. 5:20. http://www.cmjournal.org/content/5/1/20, (cited by 2019 Nov 13).
[https://doi.org/10.1186/1749-8546-5-20]

- Li XG, Kang SJ, Han JS, Kim JS and Choi JE. (2009). Effects of root diameter within different root parts on ginsenoside composition of Yunpoong cultivar in Panax ginseng C. A. Meyer. Journal of Medicinal Crop Science. 17:452-457.
-
Lopes JP, Tarozzo G, Reggiani A, Piomelli D and Cavalli A. (2013). Galantamine potentiates the neuroprotective effect of memantine against NMDA-induced excitotoxicity. Brain and Behavior. 3:67-74.
[https://doi.org/10.1002/brb3.118]

-
Magnusson KR, Brim BL and Das SR. (2010). Selective vulnerabilities of N-methyl-D-aspartate(NMDA) receptors during brain aging. Frontiers in Aging Neuroscience. Article 11. (cited by 2019 Dec 12).
[https://doi.org/10.3389/fnagi.2010.00011]

-
Mota SI, Ferreira IL and Rego AC. (2014). Dysfunctional synapse in Alzheimer’s disease-a focus on NMDA receptors. Neuropharmacology. 76:16-26.
[https://doi.org/10.1016/j.neuropharm.2013.08.013]

-
Nag SA, Qin JJ, Wang W, Wang MH, Wang H and Zhang R. (2012). Ginsenosides as anticancer agents: In vitro and in vivo activities, structure-activity relationships, and molecular mechanisms of action. Frontiers in Pharmacology. 3:25. https://www.frontiersin.org/articles/10.3389/fphar.2012.00025/full, . (cited by 2019 July 11)
[https://doi.org/10.3389/fphar.2012.00025]

-
Parsons CG, Stöffler A and Danysz W. (2007). Memantine: A NMDA receptor antagonist that improves memory by restoration of homeostasis in the glutamatergic system-too little activation is bad, too much is even worse. Neuropharmacology. 53:699-723.
[https://doi.org/10.1016/j.neuropharm.2007.07.013]

- Rausch WD, Liu S, Gille G and Radad K. (2006). Neuroprotective effects of ginsenosides. Acta Neurobiologiae Experimentalis. 66:369-375.
-
Razgonova MP, Veselov VV, Zakharenko AM, Golokhvast KS, Nosyrev AE, Cravotto G, Tsatsakis A and Spandidos DA. (2019). Panax ginseng components and the pathogenesis of Alzheimer's disease. Molecular Medicine Reports. 19:2975-2998.
[https://doi.org/10.3892/mmr.2019.9972]

-
Reay JL, Kennedy DO and Scholey AB. (2005). Single doses of Panax ginseng(G115) reduce blood glucose levels and improve cognitive performance during sustained mental activity. Journal of Psychopharmacology. 19:357-365.
[https://doi.org/10.1177/0269881105053286]

-
Siddiqi MH, Siddiqi MZ, Ahn S, Kang S, Kim YJ, Sathishmumar N, Yang DU and Yang DC. (2013). Ginseng saponins and the treatment of osteoporosis: Mini literature review. Journal of Ginseng Research. 37:261-268.
[https://doi.org/10.5142/jgr.2013.37.261]

-
Sills MA, Fagg G, Pozza M, Angst C, Brundish DE, Hurt SD, Wilusz EJ and Williams M. (1991). [3H]CGP 39653: A new N-methyl-D-aspartate antagonist radioligand with low nanomolar affinity in rat brain. European Journal of Pharmacology. 192:19-24.
[https://doi.org/10.1016/0014-2999(91)90063-V]

-
Tungmunnithum D, Thongboonyou A, Pholboon A and Yangsabai A. (2018). Flavonoids and other phenolic compounds from medicinal plants for pharmaceutical and medical aspects: An overview. Medicines. 5:93. (cited by 2019 Dec 14).
[https://doi.org/10.3390/medicines5030093]

-
Wang H, Peng D and Xie J. (2009). Ginseng leaf-stem: Bioactive constituents and pharmacological functions. Chinese Medicine. 4:20 (cited by 2019 Nov 5).
[https://doi.org/10.1186/1749-8546-4-20]

-
Wang H, Wang J and Li G. (2016). A simple real-time polymerase chain reaction(PCR)-based assay for authentication of the Chinese Panax ginseng cultivar Damaya from a local ginseng population. Genetics and Molecular Research. 15:15028801. (cited by 2019 Oct 1).
[https://doi.org/10.4238/gmr.15028801]

- Wang Y, Li Y, Yang W, Gao S, Lin J, Wang T, Zhou K and Hu H. (2018). Ginsenoside Rb1 inhibit apoptosis in rat model of Alzheimer’s disease induced by Aβ1-40. American Journal of Translational Research. 10:796-805.
-
Yu T, Yang Y, Kwak YS, Song GG, Kim MY, Rhee MH and Cho JY. (2017). Ginsenoside Rc from Panax ginseng exerts anti-inflammatory activity by targeting TANK-binding kinase 1/interferon regulatory factor-3 and p38/ATF-2. Journal of Ginseng Research. 41:127-133.
[https://doi.org/10.1016/j.jgr.2016.02.001]

-
Zheng M, Xin Y, Li Y, Xu F, Xi X, Guo H, Cui X, Cao H, Zhang X and Han C. (2018). Ginsenosides: A potential neuroprotective agent. BioMed Research International. 8174345. (cited by 2019 Nov 13).
[https://doi.org/10.1155/2018/8174345]

-
Zhou X, Gan P, Hao L, Tao L, Jia J, Gao B, Liu JY, Zheng LT and Zhen X. (2014). Antiinflammatory effects of orientin-2"-O-galactopyranoside on lipopolysaccharide-stimulated microglia. Biological and Pharmaceutical Bulletin. 37:1282-1294.
[https://doi.org/10.1248/bpb.b14-00083]
