
땅콩 속껍질 에탄올 추출물의 알파-글루코시데이즈 억제활성
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Owing to its high efficiency in lipid and protein production, peanut (Arachis hypogaea L.) is considered one of most important crops world-wide. The kernels of peanuts are undoubtedly the most important product this plant, whereas the skin is almost completely neglected in nutraceutical terms. However, peanut skin contains potentially health-promoting phenolics and dietary fiber, and there is considerable potential for commercial exploitation. In this study, we evaluated the α-glucosidase inhibitory activity of an extract of peanut skin (PS).
The α-glucosidase inhibitory effects of 80% ethanol extracts of peanut (A. hypogaea L. ‘Sinpalkwang’) skin were evaluated and found to have a half-maximal inhibitory concentration (IC50) value of 1.2 ㎍/㎖. Progress curves for enzyme reactions were recorded spectrophotometrically, and the inhibition kinetics revealed time-dependent inhibition with enzyme isomerization. Furthermore, using ultra-high performance liquid chromatography combined with quadrupole-orbitrap mass spectrometry, we identified 26 compounds in the peanut skin extract, namely, catechin, epicatechin, and 24 proanthocyanidins.
The results suggest that peanut skin can be utilized as an effective source of α-glucosidase inhibition in functional foods and nutraceuticals.
Keywords:
Arachis hypogaes, α-Glucosidase, Peanut Skin, Proanthocyanidin, Time-dependent Inhibition서 언
땅콩 (Arachis hypogaea L.)은 콩과 (Fabaceae)에 속하는 식물로 남아메리카가 원산지로 알려져 있으며 열대 및 아열대 지역에 걸쳐 세계적으로 재배되는 작물이다. 2019년 농림축산식품 주요통계 자료에 따르면 5 년간 우리나라 땅콩 재배면적은 2013년 44,000 ha에서 2017년 52,000 ha로 증가되었으며 이에 따른 생산량도 증가되어 2017년에는 14,900 ton에 달한다.
땅콩은 종실 중 지방 함량이 36% - 54%로 많아 식용기름으로 이용될 뿐만 아니라 단백질 함량도 16% - 36%로 높아 버터, 시럽, 사탕, 소스 등 다양한 가공식품으로 그 활용도가 높다 (Woodroof, 1983; Saavedra-Delgado, 1989; Knauft and Ozias-Akins, 1995). 또한 각종 비타민, 미네랄, 식이섬유, flavonoid, phytosterol, tocopherol 등 다양한 기능성 성분들이 함유되어 있다 (Francisco and Resurreccion, 2008; Limmongkon et al., 2017). 특히 땅콩 기름의 높은 불포화 지방산은 혈중 저밀도 지질단백질 콜레스테롤 함량을 낮추고 섭취 시 심혈관질환 위험을 15% 낮추어 준다고 보고되고 있으며 (Feldman, 1999; Sabaté et al., 2010), arachidin-1과 같은 stilbenoid 성분들은 인체 백혈병 세포에 항암활성이 있는 것으로 보고되었다 (Huang et al., 2010). 그리고 땅콩 단백질의 혈압조절 기능, phytosterol은 장에서 콜레스테롤 흡수를 저해하며, vitamin E는 체내 활성산소를 소거하여 유리 라디컬 및 지질산화를 억제하는 것으로 보고되었다 (Ricciarelli et al., 2001; Ostlund et al., 2002; Guo et al., 2019). 식용으로 먹는 종실과는 다르게 땅콩 속껍질은 대부분 버려지거나 동물 사료로 이용되고 있다. 하지만 이러한 속껍질에 pocyanidin 계열의 화합물들이 많아 항산화 (Dong et al., 2013), 항염증, 멜라닌 생성 억제 (Tatsuno et al., 2012) 및 전립선암 세포 억제 효능 (Chen et al., 2018) 등이 있다고 보고되면서 새로운 산업소재로 활용 가능성이 높아지고 있다.
당뇨병은 현대 사회에 있어 사망에 이르게 하는 중요한 만성 질환으로 모든 연령에 걸쳐 문제시 되고 있으며, 2000년에는 약 2.8%에 달하는 1 억 7,100 만 명에 달했으며 향후 2030년에는 세계인구의 4.4%인 3 억 6,600 만 명에 이를 것으로 추정하고 있다 (Wild et al., 2004). 따라서 지난 수십 년 동안 당뇨병 질환 개선을 위해 탄수화물 대사 및 당뇨병 치료에 중요한 역할을 하는 α-glucosidase 억제제에 많은 관심을 기울이고 있다 (Van De Laar et al., 2005; Yuk et al., 2011).
α-Glucosidase는 장세포 표면 막에 위치하고 있으며 탄수화물 분해과정의 마지막 단계를 촉매하는 효소로 (Caspary, 1978) α-D-glucopyranoside 결합을 특이적으로 가수분해 하여 α-D-glucose를 방출한다. 따라서 α-glucosidase 억제제는 탄수화물의 올리고당 및 이당류로부터 α-D-glucose의 유리를 지연시키는 억제제로 식후 혈장 glucose 수치를 감소시키는 역할을 한다 (Lebovitz, 1997). 이러한 이유로 많은 과학자들은 천연소재로부터 보다 안전하고 효과적인 당뇨병 치료제 선도물질 개발을 위해 α-glucosidase 억제제를 찾고 있다 (Park et al., 2009). 땅콩을 이용한 α-glucosidase 억제효과에 대한 연구는 땅콩 종실 및 탈지땅콩 80% 메탄올 추출물에 대한 활성을 본 결과로 10 ㎎/㎖ 농도에서 약 60% - 71% 억제 활성이 있는 것으로 보고된바 있다 (Kim et al., 2019). 하지만 땅콩 속껍질에 대한 α-glucosidase 억제활성에 대한 연구는 미진하였다.
따라서 본 연구는 땅콩 속껍질 추출물에 대한 α-glucosidase 억제활성 및 억제 kinetic을 평가하고, 추출물에 존재하는 성분을 Quadrupole-Orbitrap Mass Spectrometer (UPLC-Q-Orbitrap-MS)를 통해 분석하여 땅콩 속껍질의 건강기능성에 대한 기초 자료를 제공하고자 한다.
재료 및 방법
1. 실험재료
본 연구에 사용된 땅콩 (Arachis hypogaea L.)은 농촌진흥청 국립식량과학원에서 육성한 신팔광 (Pae et al., 2016) 품종을 사용하였으며, 2018년 국립식량과학원 남부작물부에서 기본실물로 생산되는 것을 실험재료로 사용하였다. 수확된 종자는 수분이 5% - 7% 정도 될 정도로 건조한 뒤 탈각하여 실험 전까지 4℃에 보관하였다.
실험에 사용한 신팔광 땅콩 속껍질은 분석 전 수작업으로 분리하고 Tube Mill (IKA®, Staufen, Germany)로 분쇄하였다. 분쇄한 땅콩 속껍질 2 g을 80% 에탄올 500 ㎖ 첨가하여 Digital orbital shaker (Daihan Scientific Co., Ltd., Wonju, Korea)를 이용하여 상온에서 250 rpm으로 24 시간 추출하였다 땅콩 속껍질 추출물은 Rotary Evaporator (EYELA, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)를 이용해 농축하고 동결건조장치 FDU-2100 (EYELA, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)로 건조하였다. 건조된 추출물 분말은 각종 활성 실험을 위한 시료로 이용하였다.
2. 시약
본 실험에 사용된 α-glucosidase (EC 3.2.1.20, from baker’s yeast), p-nitrophenyl-α-D-glycopyranoside (PNP-G), NaH2PO4, Na2HPO4·7H2O, dimethyl sulfoxide (DMSO), ethanol, formic acid, acetic acid, catechin 및 acarbose는 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하여 사용하였다 분석용 acetonitrile, methanol 및 물은 J. T. Baker (Phillipsburg, NJ, USA)에서 구매하였다.
3. α-Glucosidase 저해활성 측정
신팔광 땅콩 속껍질 추출물에 대한 α-glucosidase 저해활성은 Ha 등 (2012)이 수행한 방법을 다소 변형하여 효소-기질반응에 의한 초기 반응속도를 37℃ 조건에서 M2e spectrophotometer (SpectraMax®, Sunnyvale, CA, USA)로 측정하였다. 땅콩 속껍질 추출물은 1% DMSO 에탄올 용액에 녹여 최종 농도를 200 ㎍/㎖가 되도록 조제한 뒤 희석하여 사용하였다. α-Glucosidase 저해활성 측정은 시료 10 ㎕에 기질인 6.0 mM PNP-G 200 ㎕ 및 0.1 M phosphate buffer (pH 7.0) 2,780 ㎕ 첨가한 뒤 0.1 M phosphate buffer (pH 7.0)에 녹인 α-glucosidase 10 ㎕ 첨가하여 빠르게 교반 후 매 3 초 간격으로 1 분 동안 효소의 활성에 의해 기질로부터 유리되어 나오는 p-nitrophenol 함량을 400 ㎚에서 측정하였다. 실험에 사용된 추출물 농도는 단계별 희석을 통해 10 ㎍/㎖ 에서 0.2 ㎍/㎖ 농도범위에서 저해활성을 측정하였다.
α-Glucosidase의 1 unit은 분당 1.0 μ㏖의 p-nitrophenol (ε = 18.3 mM−1·㎝−1)을 유리시키는 효소의 량으로 정의된다. 양성 대조군으로는 α-glucosidase 저해제로 알려진 acarbose 및 catechin을 사용하여 그 저해효능을 평가하였다. α-Glucosidase 효소 활성을 50% 저해하는 화합물 농도는 IC50 값으로 계산하였으며, Langmuir 방정식 (Copeland, 2000)은 아래와 같으며 [I]는 저해제의 농도를 말한다.
| (1) |
4. Time-dependent 저해 평가
땅콩 속껍질 추출물에 대한 시간 의존성 저해 (time-dependent inhibition) 양상을 보이는 slow-binding 저해 kinetic 평가의 경우 매 5 초 간격으로 10 분 동안 저해제 농도를 달리하여 α-glucosidase에 의해 유리되는 p-nitrophenol 함량을 400 ㎚에서 측정하였다. 실험에 사용된 추출물 농도는 100, 80, 40, 20 및 10 ㎍/㎖로 하였고 기질 농도는 최종 400 μM로 하였다.
분석된 데이터는 Sigma Plot 13.0 (SPSS Inc., Chicago, IL, USA)의 비선형 회귀프로그램을 사용하여 각 곡선에 대한 매개변수 vi (초기속도), vs (정상상태 속도), kobs (vi에서 vs로 전이되는 겉보기 일차속도 상수), A (400 ㎚에서의 흡광도), A0 (베이스라인 편차 교정을 위한 상수) 및 Kiapp (겉보기 Ki)를 구하였다. 사용한 비선형 회기분석 식은 아래와 같다.
| (2) |
| (3) |
시간 의존성 저해제의 inhibition mode는 다양한 억제제 농도에 따른 kobs 값은 식 (2)에서 k5 및 k6는 식 (3)의 비선형 회기분석 식으로부터 계산하였다.
5. UPLC-Q-Orbitrap MS를 이용한 성분 분석
땅콩 속껍질 추출물에 함유된 기능성 성분 분석은 Q-Exactive Focus Hybrid quadrupole-orbitrap mass (Thermo Fisher Scientific Inc., Waltham, MA, USA)가 결합된 UPLC Ultimate 3000 (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 분석하였다.
시료는 80% 에탄올에 녹인 후 0.2 ㎛ syringe 필터를 하였다 분리 분석에 사용한 칼럼은 Acquity BEH C18 (100 ㎜ × 2.1 ㎜, 1.7 ㎛, Waters Co., MA, Milford, USA), 용매는 물 (0.1% formic acid, 용매 A)과 methanol (0.1% formic acid, 용매 B)을 이용한 기울기 용매 조건 (0 min, 2% B; 2 min, 2% B; 25 min, 18% B; 35 min, 28% B; 50 min, 35% B; 55 min, 35% B; post run, 5 min), 유속은 0.3 ㎖/min로 하여 설정하였다.
Orbitrap MS는 m/z 150 - 1,000 사이 양이온 스캔 모드로 sheath gas flow rate 50 arbitrary units (AU), auxiliary gas flow rate 15 AU, spray voltage 2.5 ㎸, capillary 온도 270℃, S-lens RF level 50, aux 가스 히터온도 400℃로 설정하였으며 auto MS2 분석은 분해능 17,500과 isolation window 3.0 m/z로 설정하여 분석하였다.
6. 통계처리
효소 저해 활성 실험은 3 반복으로 실험하였으며, 데이터 분석은 Sigma Plot 13.0 (SPSS Inc., Chicago, IL, USA)을 이용하여 분석하였다. 실험 결과 값은 평균 ± 표준편차로 나타내었다. 저해 모드 분석은 Sigma Plot의 Enzyme Kinetics Module을 이용하였으며, 통계적 유의수준은 p < 0.05에서 SAS EG (SAS Institute Inc., Cary, NC, USA) 프로그램으로 분석하였다.
결과 및 고찰
1. α-Glucosidase 저해활성
α-Glucosidase는 소장 상피세포에 존재하며 다당류나 이당류를 소화 흡수될 수 있는 상태인 단당류로 가수분해하는 효소로 섭취된 탄수화물 분해과정의 마지막 단계를 촉매 하는 효소이다. 따라서 α-glucosidase 억제제는 소장에서 glucose의 유리를 지연시킴으로 인해 식후 혈당 상승을 막을 수 있어 항당뇨 활성 측정에 많이 이용된다.
신팔광 땅콩 (Arachis hypogaea L.) 속껍질의 80% 에탄올 추출물에 대해 혈당 조절 및 당뇨병 치료제의 주요 target 효소인 α-glucosidase 저해활성을 측정하였다. 그 결과 Fig. 1에서와 같이 추출물 농도가 증가함에 따라 α-glucosidase 활성을 억제함을 알 수 있다. 그 결과 추출물 농도에 따른 효소 활성정도를 Langmuir 방정식에 적용하여 IC50 값은 1.3 ㎍/㎖으로 계산되었다. 양성 대조군으로 사용한 acarbose 및 catechin은 Table 1에 나타낸 바와 같이 IC50 값이 각각 400.4 ㎍/㎖ 및 36.4 ㎍/㎖으로 α-glucosidase 저해활성을 보였다. 특히 acarbose는 경구 혈당강하제로 시판되는 약제이며, catechin은 각종 식물 및 식품에 포함된 플라보노이드 성분이며 Kim 등 (2014)의 연구에서도 α-glucosidase 저해활성이 있음이 보고된바 있다. 따라서 땅콩 속껍질의 에탄올 추출물의 α-glucosidase 억제 활성이 양성 대조군인 acarbose의 300 배 및 catechin의 28 배 이상 강한 활성을 보임을 알 수 있었다.
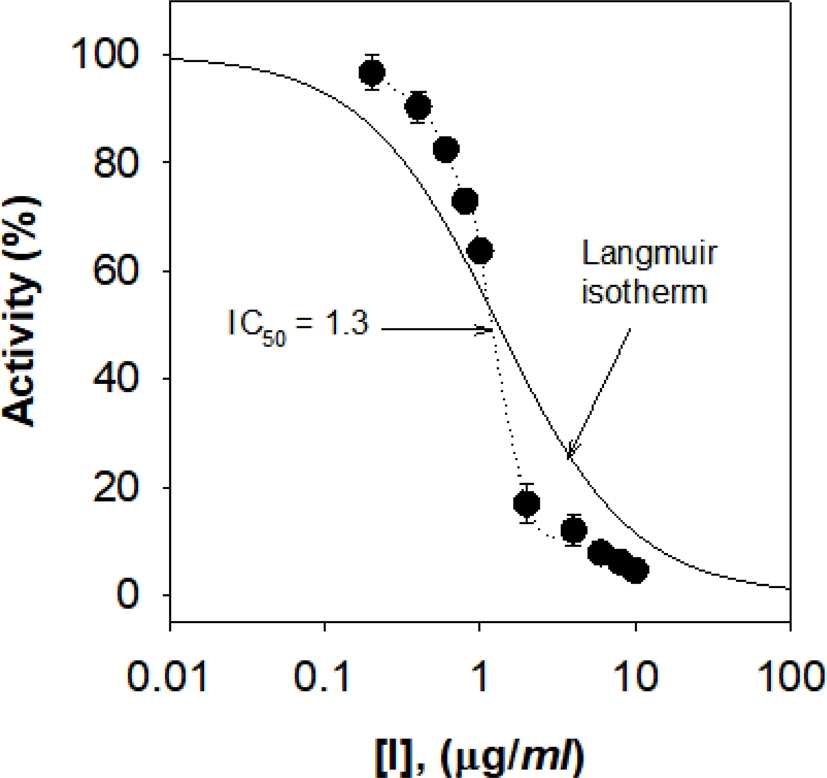
Inhibition of α-glucosidase activity by peanut skin extract. 400 μM PNP-G in 0.1 M phosphate buffer (pH 7.0) at 37℃ and recorded spectrophotometrically (UV 400 ㎚).
특히 Fig. 1에 보는바와 같이 땅콩 속껍질 추출물 농도가 증가함에 따라 α-glucosidase 억제 활성이 급격하게 증가로 인해 일반적인 Langmuir 방정식의 곡선과 다소 차이가 있음을 알 수 있다. 이러한 결과는 Ha 와 Kubo (2007) 및 Ha 등 (2019)의 연구 결과와 유사함으로 땅콩 속껍질 추출물의 α-glucosidase 억제 메커니즘은 slow-binding type의 저해제임을 예측할 수 있다.
2. Time-dependent 저해 kinetics
땅콩 속껍질 추출물에 대한 α-glucosidase 저해 모드를 분석하기 위해 steady state 상태에서 10 분간 효소 반응을 관측하였다. 모드 분석은 기질인 PNP-G 농도를 400 μM로 고정하고 추출물 농도별 (100, 80, 40, 20, 10 ㎍/㎖) 처리에 따른 α-glucosidase에 의한 p-nitrophenol로 가수분해 되는 속도를 400 ㎚에서 5 초 간격으로 10 분간 측정하였다.
땅콩 속껍질 추출물 농도가 증가함에 따라 반응시간이 경과됨에 따라 초기 속도 (vi) 뿐만 아니라 정상상태 속도 (vs)도 감소시키는 경향을 보였다 (Fig. 2). 특히 추출물 농도가 높을 수록 그 변화는 뚜렷하게 나타났다. 땅콩 속껍질 추출물 처리 농도별 시간 경과에 따른 p-nitrophenol 생성 정도에 대한 data 값을 식 (2)에 대입하여 vi, vs, 및 kobs (vi에서 vs로 전이되는 겉보기 일차속도 상수) 값을 측정하였다. 따라서 추출물 농도별 산출된 각각의 kobs 값은 식 (3)에 대입하여 그래프로 도식한 결과 농도 의존성 hyperbolic 상관을 보였다 (Fig. 3). 이처럼 시간경과에 따른 vi 및 vs의 변화와 농도별 kobs 값이 hyperbolic 커브를 보이는 결과는 Simithy 등 (2018), 및 Case 와 Stein (2007)의 연구 결과에서도 동일한 결과를 보임에 따라 땅콩 속껍질 추출물의 α-glucosidase 억제는 slow-binding type 억제 메카니즘을 간접적으로 추측할 수 있다. 따라서 식 (3)을 이용해 반응 메카니즘의 각 단계별 속도 상수를 계산 할 수 있으며, 그 결과 땅콩 속껍질 추출물의 α-glucosidase 저해 kinetic parameter를 산출한 결과 k5는 2.8 × 10−2 sec−1, k6은 1.6 × 10−13 · sec−1, Kiapp는 61.0 ㎍/㎖임을 알 수 있다.
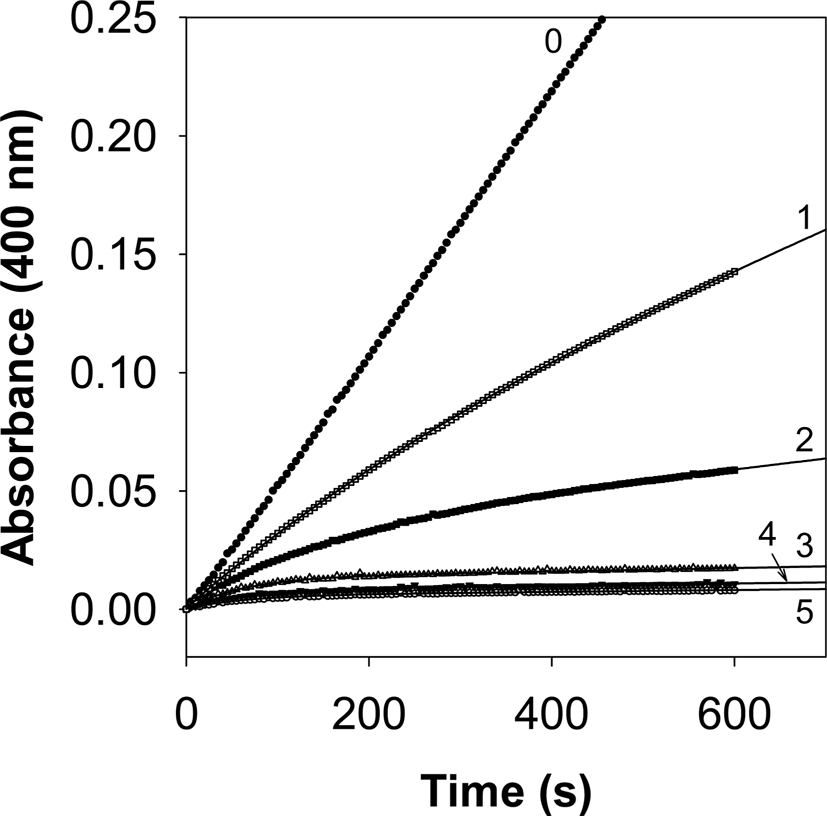
Time-dependent inhibition of α-glucosidase in the presence of peanut skin extract.Conditions were as follows: 400 μM p-nitrophenyl-α-D-glucopyranoside (PNP-G), 50 ng α-glucosidase, and concentrations of peanut skin extract for curves 0 - 5 were 0, 10, 20, 40, 80, and 100 μM, respectively.
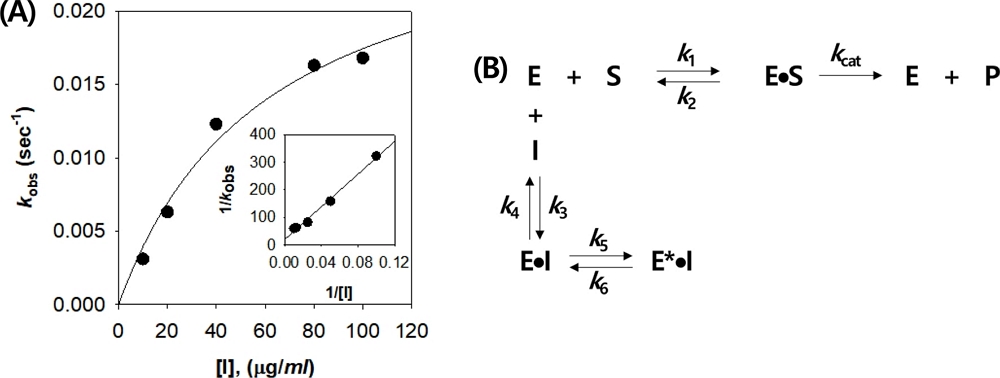
Dependence of the values for kobs on the concentration of peanut skin extract (A) and reversible slow-binding inhibition mechanism (B).
Fig. 3의 (B)에 제시한 slow binding inhibition 메카니즘의 E, S, I 및 P는 효소 (α-glucosidase), 기질 (PNP-G), 저해제 (땅콩 속껍질 추출물) 및 생성물 (p-nitrophenol)을 의미하며, ES 및 EI는 효소-기질 및 효소-저해제 결합을 의미한다. 상기 결과에서 k5가 k6에 비해 매우 큰 값을 보였다. 이는 효소-저해제가 결합된 이후 효소 활성부위에서 빠르게 이성질화 (isomerization)된 이후 다시 효소-저해제로 회복되는 속도 (k6)가 매우 느리게 진행됨을 의미한다. 즉 땅콩 속껍질 추출물은 α-glucosidase의 효소 활성부위에 결합하여 이성질화를 시킨 후 천천히 유리상태의 효소로 전환시킴으로 인해 저해 효과를 보이는 것으로 사료된다. 이러한 결과로 땅콩 속껍질에 존재하는 성분은 장내 α-glucosidase와 가역적인 slow-binding 결합을 통해 glucose의 유리를 지연시킴으로 혈장 glucose 수치를 감소시킬 것으로 사료된다.
3. UPLC-Q-Orbitrap MS2 분석
α-Glucosidase 저해 효과가 우수한 땅콩 속껍질 추출물에 대한 성분 분석은 초고성능 액체 크로마토그래피 (UPLC)를 이용해 분리된 성분에 대한 quadrupole-orbitrap mass를 분석하였다.
Fig. 4의 총 이온크로마토그래피 (TIC)에서 특정 성분이 분리되어 나오는 시간 (retention time, tR) 13.9 분 및 22.0 분의 m/z 291.1 [M + H] peak는 전형적인 catechin 및 epicatechin으로 확인되었다. 또한 MS 및 MS2 스펙트럼을 분석 한 결과 총 24 종류의 proanthocyanidin (PAC) 계열의 화합물이 있음을 확인하였다. PAC 화합물들은 catechin 또는 입체이성체 (stereoisomer)인 epicatechin unit이 dimers 또는 polymers 형태로 결합된 화합물이다. 이들 화합물은 flavan 구조의 2 번과 3 번 위치의 입체이성체로 인해 다양한 화합물로 존재한다.
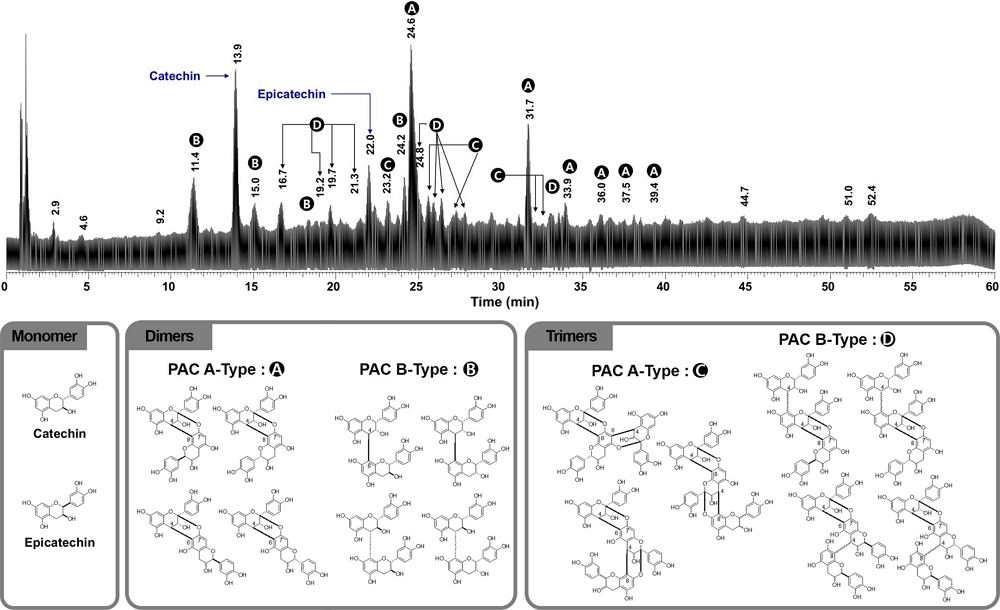
UPLC-Q-Orbitrap MS total ion chromatogram (up) and representative proanthocyanidin structures (down) of peanut skin extract.
먼저 tR 11.4 분에 보이는 m/z 579.1 [M + H] peak의 MS2 fragmentation ion 중 m/z 409.1 [M-170 (C8H8O4)]는 heterocyclic ring fission (HRF)에 의해 생성된 것이며 m/z 287.1은 quinone methide fission (QM)에 의해 생성된 단편 조각임으로 볼 때 PAC B-type의 dimers 화합물임을 알 수 있다. 이러한 PAC B-type dimer 화합물은 tR 15.0, 18.3 및 24.2 분에도 동일하게 확인되었다.
tR 16.7 분에 보이는 m/z 865.2 [M + H] peak의 MS2 fragmentation ion 중 m/z 713.1 [M-152.1 (C8H8O3)]는 retro-Diels-Alder fission (RDA)에 의해 생성된 것이며 m/z 287.1은 QM 분열에 의해 생성된 단편 조각임으로 볼 때 PAC B-type의 trimers 화합물임을 알 수 있다. 또한 이러한 PAC B-type trimer 화합물들은 tR 19.2, 19.7, 21.3, 24.8, 25.9, 26.4, 27.3 및 32.9 분에도 동일하게 확인되었다.
tR 24.6 분에 보이는 m/z 577.1 [M + H] peak의 MS2 fragmentation ion 중 m/z 287.1 [M - 290]는 QM 분열에 의해 생성된 것으로 PAC B-type과는 2 Da 차이를 보임에 따라 PAC A-type의 dimers 화합물임을 알 수 있고, tR 31.7, 33.9, 36.0, 37.5 및 39.4 분의 MS fragmentation 패턴도 동일하게 관찰되었다.
마지막으로 tR 23.2 분에 보이는 m/z 864.2 [M + H] peak의 MS2 fragmentation ion 중 m/z 287.1은 QM 분열에 의해 생성된 이온이며, HRF fragmentation에 의해 생성된 m/z 425.1 이온 피이크가 나타남에 따라 PAC A-type의 trimers 화합물임을 알 수 있으며, tR 25.6, 27.1, 32.1 및 32.5 분의 MS fragmentation 패턴도 동일하게 관찰되었다. PAC A 및 B-type의 dimers와 trimers의 주요 MS2 fragmentation은 Fig. 5와 같다.
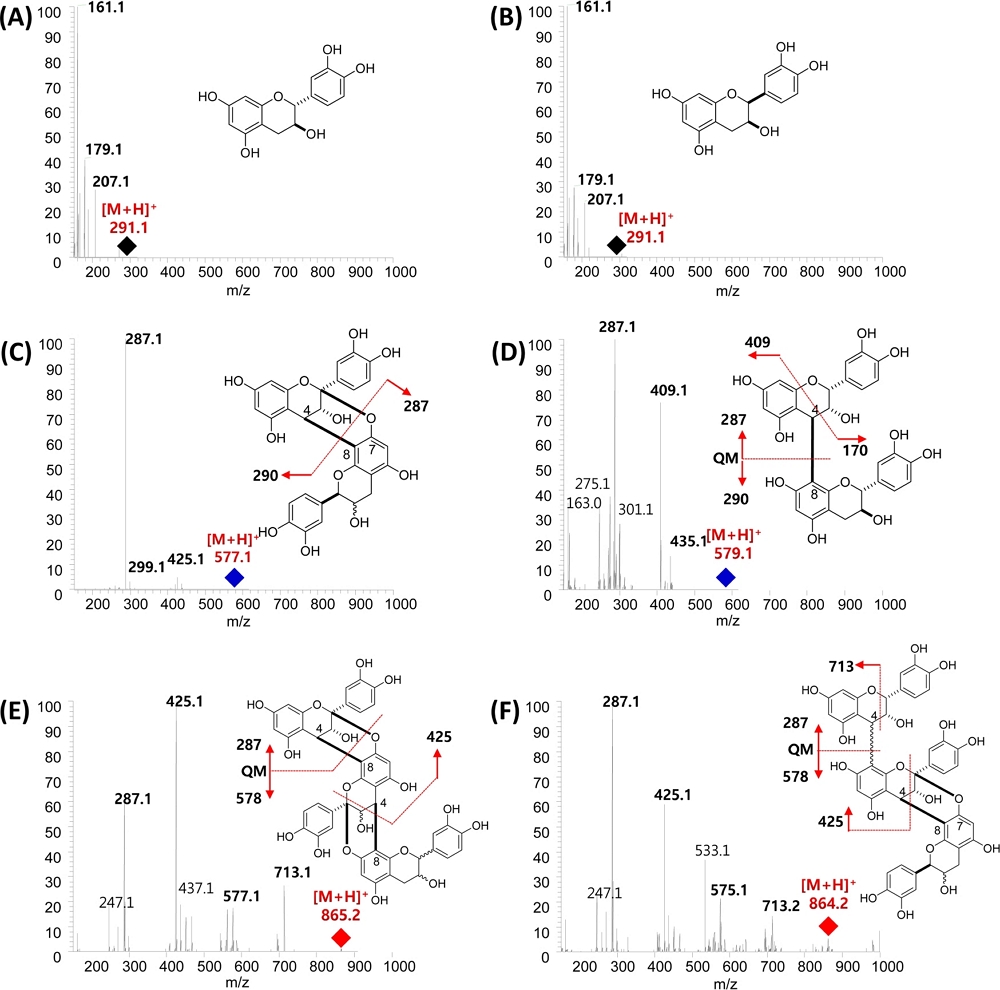
Tentative structures and MS2 fragmentation schemes of catechin, epicatechin, proanthocyanidin dimer and trimer.(A); catechin, (B); epicatechin, (C); PAC A-type dimer, (D); PAC B-type dimer, (E); PAC A-type trimer, (F); PAC B-type trimer.
이러한 결과를 종합하면 땅콩 속껍질 에탄올 추출물은 혈당 상승 및 당뇨병 질환 개선을 위한 주요 target 효소인 α-glucosidase에 강한 억제효과 (IC50 = 1.3 ㎍/㎖)를 보였다. 또한 추출물은 α-glucosidase의 활성부위에 결합한 이후 이성질화 시킨 후 천천히 해리되는 slow-binding 형태의 저해 메카니즘을 확인하였다. 또한 UPLC-Q-Orbitrap MS분석을 통해 땅콩 속껍질 추출물에는 catechin, epicatechin 및 24 종의 PAC 계열의 화합물들이 존재함을 밝혔다. 특히 Ha 등 (2018) 및 Kim 등 (2014)의 선행 연구에서도 catechin을 비롯한 proanthocyanidin 계열 화합물들이 강한 α-glucosidase 억제 활성을 보였고 PAC B-type dimer인 gambiriin D 성분 또한 억제 kinetic 연구 결과 slow binding type 저해제임을 밝혔다 따라서 땅콩 속껍질의 많은 PAC 계열 성분들이 장내 α-glucosidase 활성을 저해하고, 이로 인해 glucose의 유리를 지연시켜 혈장 당 수치를 감소시킴으로 인체에 긍정적인 영향을 미칠 것으로 사료된다. 하지만 일반적으로 땅콩은 종자를 삶거나 볶아서 대부분 섭취 하고 있으며 이러한 과정 중 땅콩 속껍질도 함께 섭취가 되고 있다. 따라서 열 가공 처리 후 땅콩 속껍질의 성분변화 및 α-glucosidase 저해활성에 대한 추가 연구가 필요할 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청 농업과학기술 연구개발사업(과제번호 : PJ01337801)의 지원에 의해 이루어진 것으로 이에 감사드립니다.
References
-
Case A and Stein RL. (2007). Kinetic analysis of the interaction of tissue transglutaminase with a nonpeptidic slow-binding inhibitor. Biochemistry. 46:1106-1115.
[https://doi.org/10.1021/bi061787u]

-
Caspary WF. (1978). Sucrose malabsorption in man after ingestion of α-glucosidehydrolase inhibitor. The Lancet. 311:1231-1233.
[https://doi.org/10.1016/S0140-6736(78)92466-2]

-
Chen L, Yan F, Chen W, Zhao L, Zhang J, Lu Q and Liu R. (2018). Procyanidin from peanut skin induces antiproliferative effect in human prostate carcinoma cell DU145. Chemico-Biological Interactions. 288:12-23.
[https://doi.org/10.1016/j.cbi.2018.04.008]

- Copeland RA. (2000). Enzyme: A practical introduction to structure, mechanism, and data analysis. Wiley-VCH. New York. NY, USA. p.266-304.
-
Dong XQ, Zou B, Zhang Y, Ge ZZ, Du J and Li CM. (2013). Preparation of A-type proanthocyanidin dimers from peanut skins and persimmon pulp and comparison of the antioxidant activity of A-type and B-type dimers. Fitoterapia. 91:128-139.
[https://doi.org/10.1016/j.fitote.2013.08.019]

-
Feldman EB. (1999). Assorted monounsaturated fatty acids promote healthy hearts. American Journal of Clinical Nutrition. 70:953-954.
[https://doi.org/10.1093/ajcn/70.6.953]

-
Francisco MLDL and Resurreccion AVA. (2008). Functional components in peanuts. Critical Reviews in Food Science and Nutrition. 48:715-746. (cited by 2019 Oct 12).
[https://doi.org/10.1080/10408390701640718]

-
Guo S, Ai M, Liu J, Luo Z, Yu J, Li Z and Jiang A. (2019). Physicochemical, conformational properties and ACE-inhibitory activity of peanut protein marinated by aged vinegar. LWT-Food Science and Technology. 101:469-475.
[https://doi.org/10.1016/j.lwt.2018.11.058]

-
Ha TJ and Kubo I. (2007). Slow-binding inhibition of soybean lipoxygenas-1 by dodecyl gallate. Journal of Agricultural and Food Chemistry. 55:446-451.
[https://doi.org/10.1021/jf0616457]

-
Ha TJ, Lee JH, Lee MH, Lee BW, Kwon HS, Park CH, Shin KB, Kim HT, Baek IY and Jang DS. (2012). Isolation and identification of phenolic compounds from the seeds of Perilla frutescens(L.) and their inhibitory activities against α-glucosidase and aldose reductase. Food Chemistry. 135:1397-1403.
[https://doi.org/10.1016/j.foodchem.2012.05.104]

-
Ha TJ, Park JE, Kang BK, Kim HS, Shin SO, Seo JH, Oh EY, Kim SU and Kwak DY. (2019). α-Glucosidase inhibitory activity of isoflavones and saponins from soybean(Glycine max L.) and comparisons of their constituents during heat treatments. Journal of Korean Society of Food Science and Nutrition. 48:953-960.
[https://doi.org/10.3746/jkfn.2019.48.9.953]

-
Ha TJ, Song SB, Ko JY, Park CH, Ko JM, Choe ME, Kwak DY and Lee JH. (2018). Isolation and identification of α-glucosidase inhibitory constituents from the seed of Vigna nakashimae: Enzyme kinetic study with active phytochemical. Food Chemistry. 266:483-489.
[https://doi.org/10.1016/j.foodchem.2018.06.039]

-
Huang CP, Au LC, Chiou RYY, Chung PC, Chen SY, Tang WC, Chang CL, Fang WH and Lin SB. (2010). Arachidin-1, a peanut stilbenoid, induces programmed cell death in human leukemia HL-60 cells. Journal of Agricultural and Food Chemistry. 58:12123-12129.
[https://doi.org/10.1021/jf102993j]

-
Kim MY, Kim HJ, Kim MH, Lee JY, Lee YY, Lee BK and Lee BW. (2019). Changes in the physiological activities of peanut and defatted peanut extracts according to cultivars. Journal of the Korean Society of Food Science and Nutrition. 48:847-855.
[https://doi.org/10.3746/jkfn.2019.48.8.847]

-
Kim TW, Choi HJ, Eom SH, Lee JM and Kim TH. (2014). Potential α-glucosidase inhibitors from thermal transformation of (+)-catechin. Bioorganic & Medicinal Chemistry Letters. 24:1621-1624.
[https://doi.org/10.1016/j.bmcl.2014.01.027]

- Knauft DA and Ozias-Akins P. (1995). Recent methodologies for germplasm enhancement and breeding. In Pattee HE and Stalker HT. (ed.). Advances in peanut science. American Peanut Research and Education Society. Still water. OK, USA. p.54-94.
-
Lebovitz HE. (1997). Alpha-glucosidase inhibitors. Endocrinology and Metabolism Clinics of North America. 26:539-551.
[https://doi.org/10.1016/S0889-8529(05)70266-8]

-
Limmongkon A, Janhom P, Amthong A, Kawpanuk M, Nopprang P, Poohadsuan J, Somboon T, Saijeen S, Surangkul D, Srikummool M and Boonsong T. (2017). Antioxidant activity, total phenolic, and resveratrol content in five cultivars of peanut sprouts. Asian Pacific Journal of Tropical Biomedicine. 7:332-338.
[https://doi.org/10.1016/j.apjtb.2017.01.002]

-
Ostlund RE, Racette SB and Stenson WF. (2002). Effects of trace components of dietary fat on cholesterol metabolism: Phytosterols, oxysterols, and squalene. Nutrition Reviews. 60:349-359.
[https://doi.org/10.1301/00296640260385793]

-
Pae SB, Hwang CD, Kim SU, Lee MH, Shim KB, Park CH, Lee CK, Baek LY and Lee JK. (2016). A new large grain and high-yielding virginia type peanut cultivar ‘Sinpalkwang’. Korean Journal of Breeding Science. 48:66-71.
[https://doi.org/10.9787/KJBS.2016.48.1.066]

- Park JH, Baek MR, Lee BH, Yon GH, Ryu SY, Kim YS, Park SU and Hong KS. (2009). α-Glucosidase and α-amylase inhibitory activity of compounds from roots extract of Pueraria thunbergiana. Korean Journal of Medicinal Crop Science. 17:357-362.
-
Ricciarelli R, Zingg JM and Azzi A. (2001). Vitamin E: Protective role of a Janus molecule. The FASEB Journal. 15:2314-2325.
[https://doi.org/10.1096/fj.01-0258rev]

-
Saavedra-Delgado AM. (1989). The many faces of the peanut. Allergy and Athma Proceedings. 10:291-294.
[https://doi.org/10.2500/108854189778959957]

-
Sabaté J, Oda K and Ros E. (2010). Nut consumption and blood lipid levels: A pooled analysis of 25 intervention trials. Archives of Internal Medicine. 170:821-827.
[https://doi.org/10.1001/archinternmed.2010.79]

-
Simithy J, Fuanta NR, Alturki M, Hobrath JV, Wahba AE, Pina I, Rath J, Hamann MT, DeRuiter J, Goodwin DC and Calderón AI. (2018). Slow-binding inhibition of Mycobacterium tuberculosis shikimate kinase by manzamine alkaloids. Biochemistry. 57:4923-4933.
[https://doi.org/10.1021/acs.biochem.8b00231]

-
Tatsuno T, Jinno M, Arima Y, Kawabata T, Hasegawa T, Yahagi N, Takano F and Ohta T. (2012). Anti-inflammatory and anti-melanogenic proanthocyanidin oligomers from peanut skin. Biological and Pharmaceutical Bulletin. 35:909-916.
[https://doi.org/10.1248/bpb.35.909]

-
Van De Laar FA, Lucassen PL, Akkermans RP, Van De Lisdonk EH, Rutten GE and Van Weel C. (2005). α-Glucosidase inhibitors for patients with type 2 diadetes. Diabetes Care. 28:154-162.
[https://doi.org/10.2337/diacare.28.1.154]

-
Wild S, Roglic G, Green A, Sicree R and King H. (2004). Global prevalence of diabetes: Estimates for the year 2000 and projections for 2030. Diabetes Care. 27:1047-1053.
[https://doi.org/10.2337/diacare.27.5.1047]

- Woodroof JP. (1983). Peanuts: Production, processing, products. AVI Publishing Company. Westport. CT, USA. p.1-50.
-
Yuk HJ, Curtis-Long MJ, Ryu HW, Jang KC, Seo WD, Kim JY, Kang KY and Park KH. (2011). Pterocarpan profiles for soybean leaves at different growth stages and investigation of their glycosidase inhibitions. Journal of Agricultural and Food Chemistry. 59:12683-12690.
[https://doi.org/10.1021/jf203326c]


