
잔대 종자 펠렛처리가 종자 발아에 미치는 영향
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Sowing seeds of Adenophora triphylla is known to be difficult owing to their small size and irregular seed shape. Therefore, this study was conducted to develop a seed pelleting technique to save labor during sowing.
To identify the optimal germination temperature for A. triphylla seeds, the temperature range was set from 17℃ to 32℃. Germination surveys were conducted in plastic greenhouse conditions in March, April, and May to determine the appropriate sowing time. The optimal germination temperature for A. triphylla seeds was 29℃ and May was the optimal sowing time in plastic greenhouse conditions. Covering materials for seed pelleting used talc (T), kaolin (K), calcium carbonate (C), and vermiculite (V). The pellet binder used agar (A), pectin, xanthan gum, polyvinyl alcohol (PVA), and sodium alginate (S). The best suited treatment mixture were the best suited in kaolin / calcium carbonate / vermiculite (KCV), talc / calcium carbonate / vermiculite (TCV) mixture treatment for covering material, and sodium alginate (S), agar (A) as pellet binder, respectively. The germination rate was the best in TCV mixed with S.
The mixture of TCV (2 : 1 : 3) + 1.5% S (TCVS), was found to be the best pelleting materials for A. triphylla seeds, and seed pelleting can be labor-saving during sowing.
Keywords:
Adenophora triphylla, Covering Material, Germination, Pellet Binder, Seed서 언
잔대 (Adenophora triphylla)는 초롱꽃과 다년생 초본식물로 한국을 비롯한 중국, 일본, 대만 등 동아시아 지역과 러시아 사할린 (Sakhalin) 등 극동 아시아 지역에 분포하는 것으로 알려져 있다 (Chen et al., 2001; Ohga et al., 2012). 중국에서는 식물명을 “Sha-shen”, 일본에서는 “Lady bell”, 한국에서는 “Jan-dae”로 각각 부르고 있다 (Lee et al., 2015).
잔대는 주로 뿌리를 약용으로 이용하는데 동양전통의학에서는 진해, 거담, 건위 및 강장제, 호흡기질환이나 만성기관지염치료제 등의 약제로 이용되어 왔고 (Ham et al., 2009; Liu et al., 2018) 최근에는 항염증, 항비만, 면역기능향상, 항산화기능 등에도 효과가 있는 것으로 알려져 있다 (Ahn and Oh, 2013; Lee et al., 2013).
잔대의 주요한 약리성분은 lupenone, β-sitoserol, taraxerone, octacosanoic, daucosterol, triphyllol, adenophoric acid methyl ester 등이 보고되었다 (Konno et al., 1981; Park et al., 2003; Ahn and Oh, 2013). 인삼을 비롯한 뿌리를 약용으로 이용하는 작물들은 일반적으로 연생이 높을수록 그 효과가 더 높은 것으로 알려져 있으나 잔대 뿌리도 고연령근 일수록 좋으나 경제적인 여건 등을 고려하여 파종 후 3년생 뿌리를 주로 약용으로 이용하고 있다 (Soldati and Tanaka, 1984; William et al., 1996).
잔대의 번식방법은 주로 종자 번식을 이용하는데 일반적으로 잔대 종자의 천립중은 0.26 g정도이고 종자의 길이는 1.35 ㎜, 폭 0.66 ㎜, 두께 0.46 ㎜로 아주 미세한 종자이다 (Kim et al., 1995). 잔대는 종자의 크기가 매우 작아 파종작업이 어렵고 파종 후 수분 관리가 힘들며 발아 기간도 길어 잔대 종자의 평균 발아율은 13.5% - 40% 내외로 낮은 편이다. 그러나 저온처리, 저온습윤처리, gibberellin 처리를 하였을 경우 60% - 90%까지 높아지는 것으로 알려져 있고 잔대 종자의 적정 발아 온도는 25℃ - 30℃내외에서 발아율이 가장 높다고 하였다 (Kim et al., 1995; Seo et al., 2018).
미세한 종자의 파종 효율을 향상시키기 위해 종자 처리 기술이 적용되고 있다. 종자 처리 기술은 프라이밍 (priming), 코팅 (coating), 펠렛팅 (pelleting) 등의 종자 처리 기술이 사용되고 있다 (Blunk et al., 2017). 프라이밍은 발아소요일수의 단축과 균일한 발아 등 발아력 향상을 목적으로 처리하는 기술이고 (Park et al., 2013; Kim et al., 2014), 종자 코팅은 종자의 모양이나 크기를 변화시키지 않는 정도에서 종자 표면 에 살균제, 살충제, 발아 촉진제 등 물질첨가, 부착 처리하는 것이다. 또한 펠렛팅은 소립종이거나 종자의 크기나 모양이 불균일하여 기계 파종에 적합하지 않거나, 손으로 다루기 힘든 종자를 대상으로 발아에 영향을 미치지 않는 불활성 재료를 이용하여 종자에 물질을 첨가, 부착시켜서 종자의 크기와 모양을 성형시키는 기술로 구분 할 수 있다 (Taylor and Harman, 1990; Kang et al., 2003; Blunk et al., 2017). 현재까지 종자코팅이나 펠렛팅 처리는 양파종자 병해충 방제를 위한 코팅 (Taylor et al., 2001), 당근, 토마토 종자의 발아율향상 (Yadachi et al., 2012; Dheeraj et al., 2018) 등 주로 채소 종자에 많이 사용되고 있다.
그러나 잔대 종자의 경우 펠렛팅 기술에 대한 연구는 전무하며, 발아온도 및 파종적기에 대한 연구도 미흡한 실정이다. 따라서 본 연구는 잔대 종자의 발아 온도 및 파종 적기를 구명하고 파종에 적합한 펠렛팅 처리 기술을 개발하여 잔대의 파종 효율을 증대시키고자 본 연구를 수행하였다.
재료 및 방법
1. 적정 발아온도 규명
본 실험에 사용된 공시재료는 잔대 (Adenophora triphylla) 종자 (Da-nong Co., Ltd., Namyangju, Korea)을 사용하였고 파종 전 10 일간 4℃에 냉장 보관한 종자를 흐르는 물에 3 일 동안 유수 처리를 한 뒤 적정 발아온도 시험에 이용하였다. 적정 발아온도 처리는 17℃, 20℃, 23℃, 26℃, 29℃, 32℃ 등 6 처리로 하였으며, petri-dish에 여과지 (90 ㎜, Advantec Inc., Tokyo, Japan)를 깔고 100 립씩 3 반복으로 치상하였고, 실험기간 중 건조하지 않도록 증류수를 보충해주었다. 모든 처리의 광주기는 광조건 16 시간, 암조건 8 시간으로 설정하였고 2 일 - 3 일 간격으로 발아율을 조사하였다.
발아율 (percent germination; PG)은 유아가 육안으로 보이는 것을 발아한 것으로 하였으며 파종한 종자 수에 대한 발아된 종자수의 백분율을 식 1에 따라 구하였고, 종자를 치상 후 중간 조사일 까지의 발아율을 구하여 발아세 (germinative energy; GE)로 정의를 하였다. 발아속도 (germination rate; GR)는 식 2에 따라 조사 당일의 발아수를 치상 후 조사일수를 나눈 값의 합으로 계산하였고, 평균 발아속도는 식 3에 따라 총 발아수를 총 조사일수로 나누어 구하였고 평균 발아일수 (mean germination time; MGT)는 식 4에 따라 치상 후 조사일수와 조사당일의 발아수를 곱한 값을 총 발아수로 나누어 계산하였다.
| (1) |
PG; percent germination, N; total number of germination, S; total number of seed.
| (2) |
GR; germination rate, Ti; days after sowing, Ni; number of germination at investigating day.
| (3) |
MDG; mean daily germination, N; total number of germination, T; total number of investigated days.
| (4) |
MGT; mean germination time, Ti; days after sowing, Ni; number of germination at investigating day, N; total number of germination.
2. 포장 조건에서 잔대종자의 파종적기 규명
포장 조건 (무가온 육묘 하우스)에서 잔대의 파종적기를 규명하기 위해서 3월 1일, 4월 3일, 5월 7일 등 한 달 간격으로 파종을 실시하였다. 파종은 육묘 트레이 (54 ㎝ × 28 ㎝, 50 구, Farm labs Co., Seoul, Korea)에 150 립 3 반복으로 파종하였고, 건조하지 않도록 2 일 - 3 일 간격으로 물을 주었다. 발아조사는 위와 동일하게 실시하였다.
3. 피복물질에 따른 펠렛의 물리·화학적 특성 비교
피복물질에 따른 펠렛의 물리·화학적 특성에 미치는 영향을 조사하기 위하여 vermiculite (V) 단용처리, calcium carbonate와 vermiculite를 1 : 2로 혼합 (CV, 1 : 2), kaolin과 calcium carbonate를 2 : 1로 혼합 (KC, 2 : 1), kaolin과 calcium carbonate와 vermiculite를 2 : 1 : 3으로 혼합 (KCV, 2 : 1 : 3), talc와 calcium carbonate를 2 : 1로 혼합 (TC, 2 : 1), talc와 calcium carbonate와 vermiculite를 2 : 1 : 3으로 혼합 (TCV, 2 : 1 : 3), talc와 kaolin과 vermiculite를 1 : 3 : 1로 혼합 (TKV, 1 : 3 : 1), talc와 kaolin과 vermiculite를 1 : 1 : 1로 혼합 (TKV, 1 : 1 : 1)한 처리들을 피복물질로 사용하고 1.5% agar를 접착제로 사용하여 펠렛팅을 하였다.
펠렛팅은 직접 만든 펠렛 제조기을 이용하여 원통 안에 피복물질을 첨가한 뒤 agar와 종자를 혼합하여 0.5 g씩 취하여 펠렛을 제조하였다. Vermiculite가 첨가된 혼합처리의 경우 먼저 vermiculite로 펠렛을 만든 후 2 차로 다른 피복물질을 첨가하여 덧씌워 주었다.
완성된 펠렛은 육안으로 펠렛의 외형이 아주 매끈한 것은 (very smooth), 매끈한 것은 (smooth), 거친 경우 (rough)로 나타내었고, 수분 흡수 후 열개성 정도 (breaking time of pellets after absorption)는 펠렛을 물에 1 분간 침지 했을 시 열개 시간 (초)을 기준으로 조사하였다. 열개 시간은 10 초 - 20 초, 20 초 - 30 초, 30 초 - 40 초, 40 초 - 60 초 등 4 범위로 나누어 나타내었다. 펠렛의 형성도는 직경 5 ㎜ 이하로 만들어지는 펠렛의 개수에 따라 구분하였으며, 직경 5 ㎜ 이하의 펠렛 개수가 10% 이하, 25% 이하, 40% 이하로 각각 나타내었다. pH 측정은 피복에 사용된 단용 및 혼합 피복물질을 5 배의 물을 가하여 희석한 후 추출하고 추출된 추출물을 여과지로 여과하여 얻은 여과액의 pH를 측정하였다. 펠렛 당 종자 수는 펠렛된 종자를 무작위로 5 개를 선정하여 종자수를 계산하였다.
4. 접착제에 따른 종자펠렛의 물리·화학적 특성 비교
잔대 종자 펠렛 시 접착제의 종류에 따른 물리·화학적 특성을 비교하기 위해 피복물질은 talc / calcium carbonate / vermiculite (TCV, 2 : 1 : 3)로 동일하게 하고 2.0% PVA, 2.0% pectin, 1.5% xanthan gum, 1.5% sodium alginate, 1.5% agar를 이용하여 종자 펠렛을 만들어 물리·화학적 특성분석을 실시하였다.
5. 펠렛종자의 발아조사
앞선 실험에서 가장 우수한 피복물질 및 접착제를 조합하여 4 처리의 펠렛을 만들어 발아실험을 진행하였다. 그 중 가장 발아율이 우수한 처리를 선발하기 위해 [kaolin / calcium carbonate / vermiculite (2 : 1 : 3) + 1.5% sodium alginate (KCVS)], [talc / calcium carbonate / vermiculite (2 : 1 : 3) + 1.5% sodium alginate (TCVS)], [kaolin / calcium carbonate / vermiculite (2 : 1 : 3) + 1.5% agar (KCVA)], [talc / calcium carbonate / vermiculite (2 : 1 : 3) + 1.5% agar (TCVA)] 등 4 처리를 이용하였으며 무처리 (control)는 펠렛이 아닌 일반 나종자를 이용하였다.
무처리의 발아조사는 petri-dish에 여과지를 깔고 100 립씩 3 반복을 진행하였으며 펠렛 종자의 경우 동일하게 제조된 샘플의 펠렛 당 종자수를 세어 약 100 립을 맞추어 실험에 이용하였다. 앞선 실험에서 29℃에서 발아율이 가장 우수하였으므로 배양기의 온도는 29℃로 하고 광주기는 광조건 16 시간, 암조건 8 시간으로 설정하여 2 일 - 3 일 간격으로 발아율을 조사하였다.
6. 통계분석
본 연구의 실험 데이터는 처리 당 3 반복으로 측정하였고, 수집된 데이터는 SPSS program (SPSS version 21, SPSS Inc., Chicago, IL, USA) 프로그램을 이용하여 일원배치 분산분석 (One-way ANOVA)을 실시한 후, Duncan’s Multiple Range Test (DMRT)을 통해 5% 수준에서 통계학적 유의성을 검정하였다 (p < 0.05).
결과 및 고찰
잔대 (Adenophora triphylla)의 적정 발아온도 규명을 위해 기내에서 온도 별 발아율을 조사한 결과 온도가 높아짐에 따라 발아율이 증가하여 29℃에서 발아율 (PG)이 가장 높았고 32℃에서는 오히려 감소하였다 (Table 1). 발아세 (GE)는 치상 후 15 일 까지의 발아율로 29℃에서 가장 높은 경향을 보였으며, 평균발아일수 (MGT)는 발아한 모든 종자의 평균적인 발아일수로 온도에 따른 유의적인 경향은 없었다. 그리고 발아속도 (GR)는 전체 종자에 대한 발아속도의 합으로 29℃에서 가장 높았으나 26℃와 유의한 차이는 없었다. 평균발아속도 (MDG)는 발아한 모든 종자의 평균적인 발아속도로 29℃ 에서 다른 처리 보다 매우 빠른 것을 확인할 수 있었다. 하지만 더 높은 온도인 32℃에서는 GE, GR, MDG는 감소하는 경향을 보였다. 따라서 잔대는 29℃에서 발아특성이 가장 우수하였으므로 적정 발아온도는 29℃로 보인다.
Kim 등 (1995)과 Kim 등 (1996)은 잔대 종자의 발아온도는 25℃ - 30℃ 내외라고 하였지만 본 실험에서 발아율 등 발아 관련 분석 결과 29℃가 최적의 발아온도로 나타났다.
잔대의 파종적기를 확립하기 위해 월별 잔대의 발아특성을 조사한 결과 발아율은 5월이 가장 높았고 그 다음은 4월, 3월순으로 포장 상태 (무가온 육묘 하우스)에서 온도가 높아질수록 발아율이 높아지는 경향을 나타내었다. 발아세 (GE)와 평균발아속도 (MDG)는 5월, 4월, 3월 순으로 높았고, 평균발아일수 (MGT)는 3월의 경우 약 24 일, 4월의 경우 15 일, 5월의 경우 14 일 정도 걸렸다. 이것은 월별 적산온도 (ST)가 올라감에 따라 평균발아일수가 줄어드는 것으로 나타나 기내실험과는 다소 차이가 있었다. 기내실험의 경우 광과 온도가 일정하기 유지되었지만 포장실험에서는 변온이나 일장이 발아에 영향을 미쳐 차이가 나는 것으로 판단된다. 발아속도 (GR)도 5월이 가장 높은 경향이었지만 월별 통계적 유의성 차이는 없었다 (Table 2).

Germination characteristics of A. triphylla seeds according with monthly from March to May at field condition.
앞선 기내발아 실험에서 온도가 높아짐에 따라 발아율이 높아져 29℃에서 발아율이 가장 높았는데 이것은 무가온 하우스에서 육묘 이식재배 시 5월의 온도와 유사하다고 볼 수 있다. 따라서 잔대의 파종적기는 육묘 이식재배 시 온도가 29℃ 가까이 되는 시기인 4월 말이나 5월경, 노지 직파는 이보다 좀 더 늦은 시기로 사료된다. 그러나 일반적으로 잔대 종자는 채취 시 미성숙 종자로 저온습윤처리와 휴면타파처리 (Seo et al., 2018)가 요구됨으로써 종자의 성숙도에 따라 발아율이 달라질 것으로 판단된다.
종자 펠렛 시 피복물질에 관한 선행연구를 살펴보면, Kang (2004)은 상추 종자 코팅에서 talc / calcium carbonate를 혼합하여 코팅했을 시 입단형성이 양호하고 적정 경도를 유지할 수 있다고 하였고 Li 등 (2004)은 tall fescue 종자에서 고형물질별 피복지수는 talc / vermiculite에서 우수한 편이라고 하였다. Kitamura 등 (1981)은 clay / kaolin 처리에서 펠렛의 경도가 우수하다고 하였고, Kang 등 (2007)은 kaolin, talc은 용적 밀도가 낮아 펠렛된 종자는 산소와 수분 투과율이 높고, calcium carbonate는 보수력이 낮은 피복물질, vermiculite 용적밀도가 낮은 편에 속한다고 하였다. 특히 Min 등 (1996)은 vermiculite로 만든 펠렛은 쉽게 부서져 펠렛이 형성되지 않는다고 하였으나 Burgesser (1951)은 vermiculite는 기공의 크기가 공기 유입을 하기에 충분히 커서 부풀려지거나 갈라질 필요가 없다고 하였다. Vermiculite는 펠렛 형성도는 떨어지지만 공극 크기가 크므로 종자와 공기유입측면에서 큰 효과가 있으므로 혼합제제로는 적합한 것으로 판단된다.
이러한 선행연구 결과를 바탕으로 피복물질 간 가장 적합한 조합을 선발하여 vermiculite 단용 처리, talc, kaolin, calcium carbonate, vermiculite를 혼합하여 총 8 가지 처리를 만들어 실험을 진행하였다. 그 결과 종자 펠렛 표면의 매끄러움 정도는 CV, KCV, TCV 처리에서 가장 높았고 V (vermiculite) 단용 처리, TKV (1 : 1 : 1) 처리가 가장 낮았다. TC의 경우 Kang (2004), Li 등 (2004)의 결과와 다르게 매끄러움 정도와 펠렛의 형성도가 낮은 것으로 나타났다. 수분 흡수 후 열개성 정도는 KCV, TKV (1 : 3 : 1) 처리가 가장 우수하였고 vermiculite (V) 단용 처리가 가장 낮았다. 펠렛의 형성도는 KCV과 TCV, TKV (1 : 3 : 1) 처리가 가장 우수 하였으며, vermiculite (V) 단용 처리의 경우 가장 낮았다. 일반적으로 열개성이 좋으면 산소와 수분공급이 원활하여 발아에 유리한 측면을 가진다 (Kang et al., 1999; Park et al., 2013).
따라서 KCV, TCV는 펠렛 형성도도 우수하지만 수분 흡수 후 열개성도 우수한 것으로 나타났다. pH의 경우 대부분 8에서 9.6 사이로 처리 간 유사한 경향을 보였고, 펠렛 당 종자 수도 12 개 - 15 개 사이로 처리 간 유사하였다 (Table 3). 따라서 본 실험에서는 KCV, TCV 처리가 피복물질로써 물리·화학적 특성이 가장 우수하여 발아조사 실험에 이용하였다.

Comparison of physicochemical properties of pelleted seeds by coating particulate matters in A. triphylla.
종자 펠렛 시 피복물질과 응집성을 향상시키기 위해 접착물질 선발을 실시하였다. 피복물질의 경우 가장 물리·화학적 특성이 우수하였던 TCV 처리를 기반으로 하여 5 가지의 접착물질을 사용했을 시 펠렛의 물리·화학적 특성을 알아보았다. 표면의 매끄러움 정도는 xanthan gum, sodium alginate, agar 처리가 우수했고 수분 흡수 후 열개성 정도는 PVA, agar 처리가 가장 우수 하였으며 sodium alginate, xanthan gum, pectin 처리 순으로 낮은 경향을 보였다. 펠렛 형성도의 경우 pectin, sodium alginate, agar 처리가 가장 우수 하였으며 잔대 펠렛 당 종자 수는 12 개 - 15 개 사이로 처리 간 차이가 없었다 (Table 4).
Kang 등 (1999)은 접착제 중 PVA가 발아율이 우수하다고 하였고 또한 Choi 등 (2006)도 PVA가 접착제 중 우수한 편에 속한다고 하였다. 본 실험에서는 PVA가 수분 흡수 후 열개성 정도는 가장 좋지만 표면이나 펠렛 형성도가 떨어지는 경향을 나타났다. Ruscoe 등 (2005)은 agar는 sodium alginate와 비교할 때 성능이 떨어진다고 하였는데 그에 반해 Caltagirone 등 (1992)은 sodium alginate와 agar를 비교할 때 agar에서 최상의 결합이 얻어진다고 하였다. 또한 Park 등 (1999)은 sodium alginate은 3%의 고농도일 때 점성이 강해져 발아율이 떨어지고 저농도인 2%에서 발아율이 가장 우수하다고 하였다.
따라서 본 실험에서도 sodium alginate, agar 농도 별 예비실험 결과 1.5%가 가장 우수하여 1.5% 처리를 선발하였고 물리·화학적 특성이 우수한 1.5% sodium alginate와 1.5% agar를 접착물질로 선발하여 펠렛 종자 발아 실험에 이용하였다.
잔대 펠렛에 있어서 가장 우수한 피복물질과 접착제 4 조합을 작성하여 발아율을 조사한 결과 TCVS 처리의 경우 control 보다 발아율이 높은 경향이었고 TCVA, KCVS, KCVA 처리는 Cont. 보다 발아율이 낮았다 (Fig. 1). 따라서 발아율이 가장 우수한 TCVS 처리가 잔대 종자의 펠렛팅을 위한 가장 우수한 피복물질이라고 생각된다 (Fig. 2).
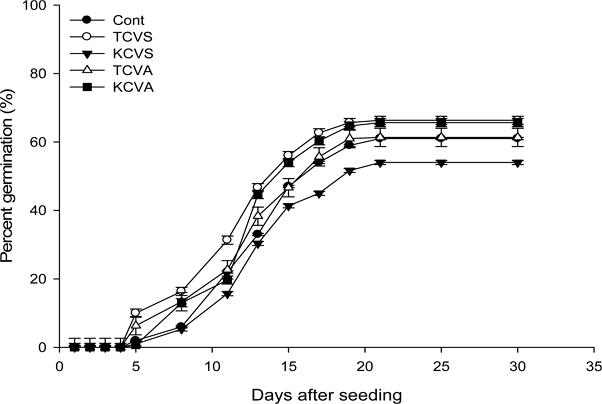
Germination rate test to select optimal pelleting materials according with mixture treatment between covering material and pellet binder in A. triphylla seed.TCVS; [talc / calcium carbonate / vermiculite (2 : 1 : 3) + 1.5% sodium alginate], KCVS; [kaolin / calcium carbonate / vermiculite (2 : 1 : 3)+ 1.5% sodium alginate], TCVA; [talc / calcium carbonate / vermiculite (2 : 1 : 3) + 1.5% agar], KCVA; [kaolin / calcium carbonate / vermiculite (2 : 1 : 3) + 1.5% agar, Cont; no pellet. Vertical bars represent standard error of the means (n = 3).
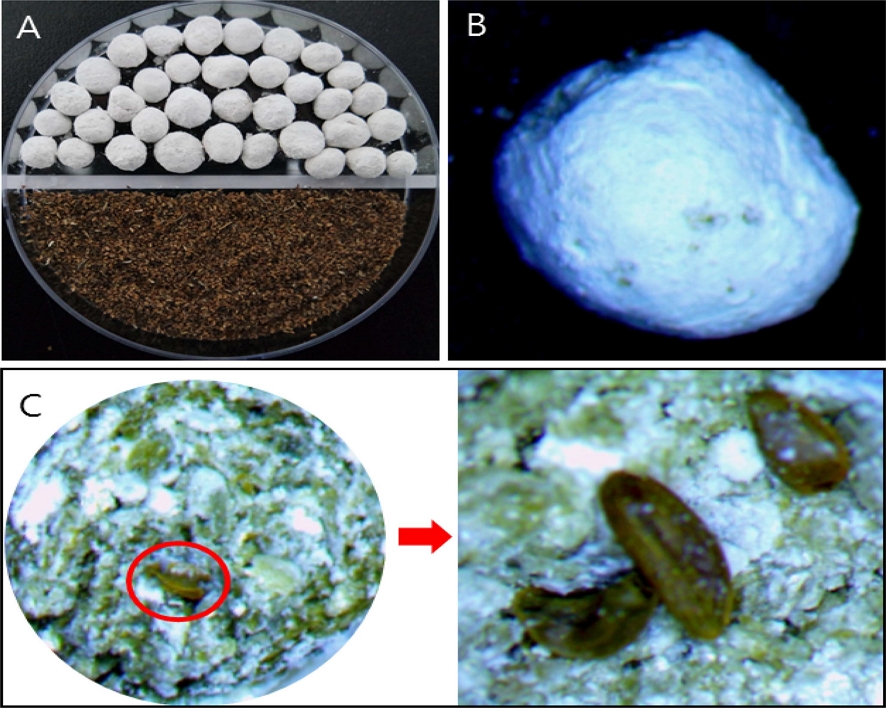
Various appearance of seed pellet [TCVS; talc / calcium carbonate / vermiculite (2 : 1 : 3), 1.5% sodium alginate] in A. triphylla seed.(A); seed pellet (up), seed (down), (B); shape of seed pellet, (C); seeds in cutting surface of seed pellet.
Kang 등 (1999)은 상추 종자에서 kaolin 단독 피복물질 처리가 발아율이 높은 편이 였는데 그와 유사하게 본 실험에서도 유사하게 kaolin을 첨가한 피복물질의 처리구인 TCVS, KCVA의 발아율이 높은 편이였다. 하지만 talc / calcium carbonate 처리의 경우 상추 종자에서는 발아율이 높고, 발아속도도 빠르다고 하였으나 본 실험에서는 이와 다르게 kaolin이 혼합되지 않은 TCVS 처리가 발아 특성이 우수한 것으로 보아 작물 별 적합한 피복물질이 다르다고 생각된다.
본 결과를 종합해 보면 잔대의 기내 적정 발아온도 실험의 결과 적정온도는 29℃이며 이와 유사하게 포장 상태 (무가온 육묘 하우스)에서의 잔대 발아실험결과 29℃와 유사한 5월이 파종적기로 판단되었다. 그리고 잔대의 피복물질 및 접착제 선발에서는 피복물질인 kaolin / calcium carbonate / vermiculite (KCV), talc / calcium carbonate / vermiculite (TCV) 처리가 가장 물리·화학적 특성이 우수하였고, 접착제는 sodium alginate (S), agar (A)가 물리·화학적 특성이 우수하였다. 따라서 종자 펠렛의 발아시험은 위의 우수한 피복물질과 접착제의 조합을 통해서 4 가지의 처리를 하였는데 그 중 TCVS [talc / calcium carbonate / vermiculite (2 : 1 : 3) + 1.5% sodium alginate] 처리가 발아특성이 가장 우수하였다. 그러므로 잔대 종자 펠렛팅을 할 경우 TCVS 처리를 이용하면 파종 효율은 증대되고 발아에는 영향을 미치지 않을 것이라고 사료된다.
Acknowledgments
본 연구는 2019년도 한국연구재단 기초연구사업(과제번호: 2019R1G1A1002425)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Ahn EK and Oh JS. (2013). Lupenone isolated from Adenophora triphylla var. japonica extract inhibits adipogenic differentiation through the downregulation of PPARγ in 3T3-L1 cells. Phytotherapy Research. 27:761-766.
[https://doi.org/10.1002/ptr.4779]

-
Blunk S, Malik AH, de Heer MI, Ekblad T, Fredlund K, Mooney SJ and Sturrock CJ. (2017). Quantification of differences in germination behaviour of pelleted and coated sugar beet seeds using x-ray computed tomography(x-ray CT). Biomedical Physics and Engineering Express. 3:044001. https://iopscience.iop.org/article/10.1088/2057-1976/aa7c3f/meta, (cited by 2020 Jan 18).
[https://doi.org/10.1088/2057-1976/aa7c3f]

-
Burgesser FW. (1951). Seed pellet. U.S.A. Patent. 2,579,734.
[https://doi.org/10.1136/bmj.2.4733.734]

- Caltagirone A, Francour P and Fernandez C. (1992). Formulation of an artificial diet for the rearing of the urchin Paracentrotus lividus: Part I. Comparison of different binding agents. In Scalera-Liaci L and Canicatti C(eds). Echinoderm Research. Balkema. Rotterdam, Netherlands. p.115-119.
- Chen CC, Chen SJ, Sagare AP and Tsay HS. (2001). Adventitious shoot regeneration from stem internode explants of Adenophora triphylla(Thunb.) A. DC.(Campanulaceae)-an important medicinal herb. Botanical Bulletin of Academia Sinica. 42:1-7.
- Choi KG, Lee YS and Cha KH. (2006). Selection and technical development for seed pelleting material of Codonopsis lanceolata Trautv. Korean Journal of Medicinal Crop Science. 14:130-133.
-
Dheeraj M, Dayal A, Neha Thomas and Ramteke PW. (2018). Effects of seed pelleting, polymer coating and packaging materials on seed quality characters of tomato(Lycopersicon esculentum L.) seeds after three months of ambient storage. International Journal of Pure and Applied Bioscience. 6:1511-1518.
[https://doi.org/10.18782/2320-7051.6595]

-
Ham YA, Choi HJ, Chung MJ, and Ham SS. (2009). Component analysis and antioxidant activity of Adenophora triphylla. Journal of the Korean Society of Food Science and Nutrition. 38:274-279.
[https://doi.org/10.3746/jkfn.2009.38.3.274]

- Kang JS, Ahn CK, Son BG and Choi YW. (1999). Development of a coating technique for Lettuce seeds aimed for mechanical planting and growth promotion. Agriculture Practice Research Series. 7:67-84.
-
Kang JS, Cho JL and Lim JM. (2003). Effect of seed pelleting on the precision planting and seedling emergence of carrot seeds. Korean Journal of Life Science. 13:428-432.
[https://doi.org/10.5352/JLS.2003.13.4.428]

-
Kang JS, Son BG, Choi YW, Lee YJ, Park YH and Choi IS. (2007). Effect of physical, chemical properties and of pelleting solid materials on the germination in pelleted carrot seeds. Journal of Life Science. 17:1701-1708.
[https://doi.org/10.5352/JLS.2007.17.12.1701]

- Kang JS. (2004). Identification of pelleting materials and effect of nutrient addition on the germination of pelleted lettuce seeds. Journal of Bio-Environment Control. 13:8-15.
-
Kim DH, Ahn BJ, An HJ, Ahn YS, Kim YG, Park CG, Park CB, Cha SW and Song BH. (2014). Studies on seed germination characteristics and patterns of protein expression of Lithospermum erythrorhizon by plant growth regulators and seed primings. Korean Journal of Medicinal Crop Science. 22:435-441.
[https://doi.org/10.7783/KJMCS.2014.22.6.435]

- Kim S, Park MS, Park HK and Jang YS. (1995). Studies on the seed development and germination of Adenophora triphylla DC. Korean Journal of Medicinal Crop Science. 3:66-70.
- Kim SD, Park SY, Kim TJ, Cheong IM and Kim SM. (1996). Studies on the promoting of seed germination of Adenophora triphylla var. Japonica Hara. Korean Journal of Plant Resources. 9:171-176.
- Kitamura S, Watanabe M and Nakatama M. (1981). Process for producing coated seed. U.S.A. Patent. 4,250,660.
-
Konno C, Saito T, Oshima Y, Hikino H and Kabuto C. (1981). Structure of methyl adenophorate and triphyllol, triterpenoids of Adenophora triphylla var. japonica roots. Journal of Medicinal Plant Research. 42:268-274.
[https://doi.org/10.1055/s-2007-971639]

-
Lee DR, Lee YS, Choi BK, Lee HJ, Park SB, Kim TM, Oh HJ, Yang SH and Suh JW. (2015). Roots extracts of Adenophora triphylla var. japonica improve obesity in 3T3-L1 adipocytes and high-fat diet-induced obese mice. Asian Pacific Journal of Tropical Medicine. 8:898-906.
[https://doi.org/10.1016/j.apjtm.2015.10.011]

-
Lee YM, Bae JH, Nam SY, Jang HH, Park MY, Kim JB, Park DS, and Kim HR. (2013). Estrogen-like activity of Adenophora triphylla var. japonica water extract in MCF-7 cells. Food Science and Biotechnology. 22:1735-1740.
[https://doi.org/10.1007/s10068-013-0274-7]

-
Li CY, Hur SN and Jin Z. (2004). Evaluation physical characteristics of coating materials for forage seed coating by coating index. Journal of the Korean Society of Grassland and Forage Science. 24:155-162.
[https://doi.org/10.5333/KGFS.2004.24.2.155]

-
Liu Y, Ren X, Jeong HK, Wei H and Jeong BR. (2018). Growth and physiological responses of Adenophora triphylla(Thunb.) A. DC. plug seedlings to day and night temperature regimes. Agronomy. 8:173. (cited by 2020 Jan 1)
[https://doi.org/10.3390/agronomy8090173]

- Min TG, Park MS and Lee SS. (1996). Physical characteristics and germination of pelleted tobacco seeds depending on moulding materials. Korean Journal of Crop Science. 41:535-541.
-
Ohga K, Muroi M, Hayakawa H, Yokoyama J, Ito K, Tebayashi S, Arakawa R and Fukuda T. (2012). Morphological and anatomical analyses of the serpentine ecotype of Adenophora triphylla var. japonica(Campanulaceae). Journal of Plant Studies. 1:180-187.
[https://doi.org/10.5539/jps.v1n2p180]

- Park CH, Shim KB, Kim MK, Park CG and Seong NS. (1999). Germination of pelleted seeds in Rehmannia glutinosa Libosch. Korean Journal of Medicinal Crop Science. 7:213-217.
-
Park HI, Shim HS, Choi LN, Jo HG, Han SH, Lee JG, Yu CY and Lim JD. (2013). Effect of priming and seed pellet technique for improved germination and growth in Fraxinus rhynchophylla and Alnus sibirica. Korean Journal of Medicinal Crop Science. 21:7-19.
[https://doi.org/10.7783/KJMCS.2013.21.1.7]

- Park YK, Yoo HH, Baek SH, Lee SH, Kim CM, Lee KS, Park MK and Park JH. (2003). Quality control of Adenophorae Radix. Korean Journal of Pharmacognosy. 34:10-13.
-
Ruscoe IM, Jones CM, Jones PL and Caley P. (2005). The effects of various binders and moisture content on pellet stability of research diets for freshwater crayfish. Aquaculture Nutrition. 11:87-93.
[https://doi.org/10.1111/j.1365-2095.2004.00324.x]

- Seo HT, Choi BK, Moon YG, Kim SW, Park KD and Kwon SB. (2018). Effect of light conditions and wet cold treatments on seed germination in several wild vegetables. Journal of Agricultural, Life and Environmental Sciences. 30:64-72.
-
Soldati F and Tanaka O. (1984). Panax ginseng: Relation between age of plant and content of ginsenosides. Planta Medica. 50:351-352.
[https://doi.org/10.1055/s-2007-969729]

-
Taylor AG and Harman GE. (1990). Concepts and technologies of selected seed treatments. Annual Reviews of Phytopathology. 28:321-339.
[https://doi.org/10.1146/annurev.py.28.090190.001541]

-
Taylor AG, Eckenrode CJ and Straub RW. (2001). Seed coating technologies and treatments for onion: challenges and progress. Journal of the American Society for Horticultural Science. 36:199-205.
[https://doi.org/10.21273/HORTSCI.36.2.199]

-
William AC, Reynolds LB and John GH. (1996). Influence of root age on the concentration of ginsenosides of American ginseng(Panax quinquefolium). Canadian Journal of Plant Science. 76:853-855.
[https://doi.org/10.4141/cjps96-144]

- Yadachi S, Mani I, Reddy M and Nagajjanavar K. (2012). Development of seed coating technology for carrot seed. Environment and Ecology. 30:798-801.
