
인삼 연작장해 유발토양과 억제토양의 화학성, 미생물상 및 뿌리썩음병 발생 특성
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Suppressive soil inhibits soil-borne diseases if pathogens are present, and ginseng does not show injury even if replanted in the same field.
Soil chemical properties and microbial community of soil were investigated in soil suppressive and conducive to ginseng root rot. Root rot disease in 2-year-old ginseng was tested by mixing conducive soil, with suppressive or sterilized suppressive soil. The root rot ratio in suppressive soil was 43.3% compared to 96.7% in conducive soil. Biological factors acted to inhibit the root rot because disease ratio was increased in the sterilized suppressive soil compared to that in non-suppressive soil. The suppressive soil had lower pH, nitrate nitrogen and sodium than the conducive soil. Dominat bacteria and fungi (more than 1.0%) were 3 and 17 species in conducive soil and 7 and 23 species in suppressive soil, respectively. The most predominant fungi were Pseudaleuria sp. HG936843 (28.70%) in conducive soil and Pseudogymnoascus roseus (7.52%) in suppressive soil.
Microbial diversity was more abundant in the suppressive soil than in the conducive soil, and the proportion of pathogens (Nectriaceae sp.) causing root rot was significantly lower in the suppressive soil than in the conducive soil.
Keywords:
Panax ginseng, Cylindrocarpon destructans, Microbial Community, Root Rot, Suppressive Soil서 언
인삼 (Panax ginseng)은 한국을 대표하는 약용작물로 2018년 재배면적은 15,452 ㏊, 농가수는 20,556 호로 가장 높은 비중을 차지하고 있으며, 수출액은 188 백만불로 약용작물 중 가장 많은 수출액을 보이고 있다. 2018년 3,209 ha의 면적에서 인삼이 새로 경작되고 있으나 연작장해로 인하여 초작지를 찾아 먼 거리를 이동함에 따라 경영비 상승의 원인이 되고 있다.
인삼의 연작장해 발생은 토양 전염성 병원균에 의한 결주 증가 (Rahman and Punja, 2005; Kang et al., 2007)가 가장 큰 원인이 되며, 그 외 타감물질 (allelochemicals)에 의한 인삼 생육억제 (Lee et al., 2018b; Li et al., 2018)와 뿌리썩음병원균의 생장 촉진 (Yousef and Bernards, 2006; Sun et al., 2013; Xu et al., 2016), 그리고 토양 이화학성 악화에 따른 양분흡수 장애와 생리장해 발생 등에 의해 연작장해를 가속화 시킨다 (Lee et al., 1989).
인삼의 연작장해를 경감하기 위해 대부분 10 년 이상 윤작을 하거나 (Kang et al., 2007; Lee et al., 2017) 벼를 4 - 5 년간 재배하며 (Jo et al., 1996; Park et al., 1997), 그 외 일부에서는 다조메 입제를 이용하여 훈증소독을 하거나 작토층을 깎아 내거나 50 ㎝ 이상 성토를 하는 방법을 쓰고 있다 (Lee et al., 2018a).
인삼의 뿌리썩음병 발병에는 많은 환경요인이 관여하고 있는데, 뿌리썩음병원균 밀도와 발병에 영향을 미치는 근권 토양의 환경 요인에는 토양산도, 유기물, 질소, 미량원소 함량 등의 화학적 요인과 토성, 점토함량, 공극율 등 물리적 요인, 그리고 길항균, 부생균, 선충 등 생물적 요인이 있으며, 길항 미생물을 이용한 생물적 방제는 현재 가장 널리 쓰이고 있다.
인삼 연생의 증가에 따라 Cylindrocarpon destructans의 밀도는 증가되고 이에 따라 인삼 뿌리썩음병 발생도 증가되는데 (Lee et al., 2014), 인삼 수확시 뿌리썩음병 발병율이 적은 토양이 있으며, 이를 뿌리썩음병 억제토양이라고 한다. 즉, 억제토양이란 병균이 존재하더라도 감수성인 기주식물의 발병이 억제되는 토양으로 인삼 수확 후 10 년 이내에 재경작하여도 초작지와 비슷한 수량을 보이는 토양이라고 말할 수 있다.
인삼 뿌리썩음병 억제토양에 관한 연구에서 Chung 등 (1983)은 결주율이 90% 이상인 3 개 지역 (유발토양)과 결주율이 10% 이하인 5 개 지역 (억제토양)에서 근권 토양의 추출액에 Fusarium solani 포자를 배양했을 때 후막포자의 형성과 균사 생장은 억제토양보다 유발토양에서 촉진되었으며, 분생포자와 발아관이 길항 미생물에 의해 분해되었다고 하였다. 또한 Chung 등 (1984)은 토양 추출액을 열처리하지 않았을 때 F. solani, Sclerotinia sp., Rhizoctonia solani, Phytophthora cactorum 등 4 가지 병원균 모두 억제토양의 추출액 배지에서 균사 생장이 더 억제되었으며, 토양 추출액을 100℃로 열처리하였을 때 R. solani, P. cactorum은 억제토양보다 유발토양에서 균사 생장이 더 촉진되어 인삼 뿌리썩음병 억제토양의 주요기작에는 생물적 요인이 크게 작용한다고 하였다.
토양 전염성 병원균에 대한 억제작용은 비병원성 미생물 군집 (saprophytic microflora)에서의 일부 미생물과 병원균 간의 상호작용에 따라 일어나며, 이러한 생물학적 상호작용은 토양의 비생물적 특성에 따라 달라진다. 시들음병 (Fusarium wilts) 억제 토양에서 pH와 점토의 특성은 시들음병 억제 미생물 군집과의 상호작용에 있어 중요한 비생물적 요소이며, 주로 탄소와 철분과 같은 영양분에 대한 비병원균과 병원균 간의 경쟁은 시들음병 억제 기작 중의 하나이다 (AIabouvette, 1999).
Peters 등 (2003)에 의하면 2 년 윤작 (보리-감자)보다 3 년 윤작 (보리-레드 클로버-감자)에서 역병균에 의한 감자의 뿌리썩음병 발생이 적었고 2 년과 3 년 윤작 토양에 역병균을 접종하고 감자를 재배했을 때 3 년 윤작 토양에서 병 발생이 현저히 감소되었는데, 2 년 윤작보다 3 년 윤작한 뒤 재배한 감자의 뿌리조직으로부터 분리된 내생 세균들에서 토양 병의 생육을 억제하는 가장 큰 항생작용 활성이 나타났다고 하였다.
Borneman과 Ole Becker (2007)에 의하면 특이하게 병원균을 억제하는 것과 관련이 되는 미생물들을 동정하기 위해 다양한 병원균의 억제력을 나타내는 토양에서 미생물 군집분석이 수행되고 있는데, 각 미생물들의 상대적인 밀도는 병원균 억제력의 크기와 관계가 있다고 하였다.
Lee 등 (2018b)은 인삼 세근 분말을 토양에 혼화처리하면 인삼 연작장해 발생이 증가되는데, 토양 미생물의 관점에서 그 원인은 뿌리썩음병과 직접 관련이 있는 Cylindrocarpon과 Fusarium species의 증가, 뿌리썩음병원균에 길항작용을 하는 곰팡이와 항생물질을 생산하는 세균의 감소, 진세노사이드를 전환하는 능력을 가진 세균들의 증가, 그리고 식물생장을 억제하는 독소를 분비하는 세균의 증가 때문이라고 하였다.
따라서 인삼 연작장해 발생이 적은 토양 (연작장해 억제토양)과 많은 토양 (연작장해 유발토양)에서 묘삼의 뿌리썩음병 발생정도를 조사하여 억제토양 여부를 확인하고 토양의 화학성, 미생물상을 비교 분석하여 뿌리썩음병 발생 억제에 미치는 화학적·생물적 요인을 구명하고자 본 연구를 실시하였다.
재료 및 방법
1. 인삼 연작장해 유발토양과 억제토양의 선정
인삼 (Panax ginseng) 재경작 후 연작장해 발생이 심한 포장을 연작장해 “유발토양 (conducive soil)”이라고 하고 연작장해 발생이 심하지 않은 포장을 연작장해 “억제토양 (suppressive soil)”이라고 하였으며, 유발토양과 억제토양을 각각 1 개소씩 선정하여 작토층의 토양을 채취한 다음 시험재료로 사용하였다.
유발토양은 선상지에 분포하는 식양질계 회색토로 분류된 지산통 (Jisan series, fine loamy, mixed)으로 경사도는 15% 내외이고 토성은 양토로 배수가 양호한 토양이었다. 6년근 인삼을 수확한 다음 3 년간 고구마, 땅콩, 고구마의 순으로 윤작한 포장이었다. 인삼 재경작을 위해 호밀과 수단그라스를 재배하여 2 년간 예정지 관리를 하였는데, 호밀 파종 전에 10 a 당 인삼 재배용 퇴비 (Samhyup Nongsan Co., Ltd., Goesan, Korea) 6,000 ㎏을 기비로 시용하였다. 인삼을 재경작 했을 때 뿌리썩음병 발생이 많아 4년근 인삼을 조기 수확하였는데 수량성은 3.3 ㎡ 당 0.43 ㎏으로 매우 적어 연작장해 발생이 심한 포장이었다.
억제토양은 산록경사지의 곡간에 분포하는 사양질계 충적토로 분류된 상주통 (Sangju series, coarse loamy, mixed)으로 경사도는 10% 내외고 토성은 양질사토로 배수가 양호한 포장이었다. 6년근 인삼을 수확한 다음 3 년간 고추, 콩, 고추의 순으로 윤작한 포장이었다. 인삼을 재경작하기 위해 호밀과 수단그라스를 재배하여 2 년간 예정지 관리를 하였는데 호밀 파종 전에 10 a 당 볏짚 600 ㎏, 인삼 재배용 퇴비 (Samhyup Nongsan Co., Ltd., Goesan, Korea) 6,000 ㎏, 소석회 160 ㎏를 기비로 시용하였다. 인삼을 재경작했을 때 6년근 인삼을 3.3 ㎡당 3.0 ㎏ 수확하여 연작장해 발생이 심하지 않은 포장이었다.
2. 묘삼을 이용한 뿌리썩음병 발생율 검정
작토층의 토양을 2019년 3월 하순에 일정량 채취한 다음 유리온실로 옮겨 토양 화학성, 미생물상 분석 및 생물검정용 토양시료로 사용하였다. 인삼 연작장해 유발토양과 억제토양에서 묘삼의 생육 및 뿌리썩음병 발생율을 조사하고 억제토양이 뿌리썩음병 억제에 미치는 영향을 구명하기 위해 유발토양, 억제토양, 유발토양과 억제토양을 동일부피로 혼합한 토양, 유발토양과 멸균된 억제토양을 동일부피로 혼합한 토양 등 4 처리를 하였다. 멸균토양 조제는 억제토양을 두꺼운 비닐봉투에 넣어 30 분간 120℃로 멸균하여 시료로 사용하였다.
토양시료를 2019년 4월 상순에 직경 25 ㎝ 높이 30 ㎝의 플라스틱 화분에 채운 다음 무게 0.75 g, 길이 15 ㎝ 내외의 묘삼을 포트당 15 주씩 정식하였다. 5 개월 정도의 단기재배로 묘삼의 뿌리썩음병 발생율을 검정하기 위해 밀식재배를 하였다. 반복은 처리당 4 포트씩 3 반복으로 하였다. 재배장소는 투광량과 온도가 조절되는 유리온실이었는데 알루미늄 커튼으로 투광율을 15% 내외로, 온도를 20℃ - 25℃ 내외로 조절하였다. 토양수분을 15% - 20% 정도로 조절하기 위해 2 주 간격으로 포트 당 1ℓ - 2ℓ씩 관주하였다.
지상부 생육특성인 초장, 경장, 엽장, 엽폭 등은 지상부 생장이 완성되는 6월 하순에 조사하였으며, 근중, 근장 등 지하부 생육특성과 뿌리썩음병 발생율은 7월 하순에 조사하였다. 뿌리썩음병 발병율은 [(주수 /재식거리) × 100]으로 계산하였으며, 뿌리썩음병 발병정도는 무병징 (X0), 병반 면적 10% 이하 (X1), 병반 면적 50% 이하 (X2), 병반 면적 70% 이하 (X3): 완전부패 (X4)로 구분하였고 뿌리썩음병 발병지수는 Lee 등 (2018b)의 방법에 따라 [(X0 × 0) + (X1 × 1) + (X2 × 2) + (X3 × 3) + (X4 × 4) / (X0 + X1 + X2 + X3 + X4)] 으로 구하였다.
3. 토양 화학성 분석
토양 화학성 분석은 생물검정용 묘삼을 심기 전에 하였는데 토양시료를 풍건하여 분쇄 후 10 mesh (2 ㎜)체를 통과한 다음 유발에 미세하게 갈아 분석용으로 사용했다. 토양화학성분 중 토양산도, 염류농도, 유기물, 유효인산 및 치환성 양이온인 칼륨, 칼슘, 마그네슘은 농촌진흥청 토양화학분석법에 준하였다 (NIAST, 2000).
치환성 양이온을 측정하기 위해 시료 10 g을 100 ㎖ 삼각플라스크에 평량하고 침출액 (1 N NH4OAc) 50 ㎖를 첨가한 다음 항온 수조 30℃에서 1 시간 진탕하였다. Toyo No. 5B로 여과하여 ICP-OES (Integra XMP, GBC Scientific Equipment, Braeside, Australia)로 분석했다. 인삼 재배에 적합한 토양 화학성 범위는 농촌진흥청 표준인삼경작방법 (RDA, 2014)에서 제시한 기준에 따라 정했다.
4. 인삼 뿌리썩음병원균 밀도 분석
생물검정용 묘삼을 정식하기 전에 토양시료를 채취하여 C. destructans 밀도를 분석하였다. 토양시료 5 g과 radicicol (Sigma-Aldrich Co., St. Louis, MO, USA) 50 ㎎/ℓ를 첨가 한 minimal mineral broth 5 ㎖을 50 ㎖ falcon tube에 넣고, 48 시간 동안 20℃ 조건에서 정치배양 하였다. 정치배양을 한 falcon tube를 1 분간, 5,000 rpm 으로 원심분리 하였다. 상등액을 제거하고 -70℃ 초저온냉동고에 2 시간 보관하여 동결 건조를 하였다.
동결건조된 토양 0.5 g을 토양 DNA 추출 kit (Nucleo-Spin® Soil, Macherey-Nagel GmbH & Co. KG, Düren, Germany)를 이용하여 DNA를 추출한 다음 DNA 시료와 인삼 뿌리썩음병원균 동정용 primer를 포함하는 혼합액으로 real-time PCR (CFX96 real-time system, Bio-Rad Inc., Hercules, CA, USA)을 수행하였고 그 결과를 병원균 밀도 정량곡선에 대입하여 토양 내 병원균의 밀도로 표시하였다.
5. 토양 미생물상 특성 분석
DNA 추출, PCR 증폭 및 염기서열 분석, 그리고 분석 데이터를 이용한 세균과 진균의 군집분석은 다음과 같다. 토양시료에 적합한 FastDNA SPIN Kit (MP Biomedicals, Santa Ana, CA, USA)를 사용하여 총 DNA를 추출 하였다. 추출된 DNA를 가진 16S rRNA 유전자의 V3 내지 V4 영역을 표적으로 하는 융합 프라이머를 사용하여 PCR 증폭을 수행하였다. 세균의 증폭을 위해, 341F (5' - AATGATACGGCGACCACCGAGATCTACAC – XXXXXXXX – TCGTCGGCAGCGTC – AGATGTGTATAAGAGACAG – CCTACGGGNGGCWGCAG - 3' 와 805R (5’ - CAAGCAGAAGACGGCATACGAGAT – XXXXXXXX – GTCTCGTGGGCTCGG – AGATGTGTATAAGAGACAG - GACTACHVGGGTATCTAATCC-3’)의 융합 프라이머 (Chunlab, Seoul, Korea)를 사용하였다. 융합 프라이머는 P5 (P7) graft binding, i5 (i7) index, nextera consensus, sequencing adaptor 및 target region sequence 순서로 구성된다.
증폭은 다음과 같은 조건에서 수행되었는데, 95℃에서 3 분 동안 초기 변성, 이어서 95℃에서 30 초 동안 변성, 55℃에서 30 초 동안 프라이머 annealing 및 72℃에서 30 초 동안 확장, 72℃에서 5 분 동안 최종 신장 과정을 수행하였다. PCR 산물은 1% agarose gel 전기영동을 이용하여 확인하였고 Gel Doc system (Bio-Rad Inc., Hercules, CA, USA)에서 시각화하였다. 증폭된 생성물을 CleanPCR (CleanNA, Omega BioTek Inc., Winooski, VT, USA)로 정제하였다.
동일한 농도의 정제된 생성물을 함께 모으고 CleanPCR로 짧은 단편 (비표적 생성물)을 제거하였다. 품질 및 제품 크기는 DNA 7500 칩을 사용하여 Bioanalyzer 2100 (Agilent Technologies Inc., Santa Clara, CA, USA)에서 측정하였다. 혼합된 amplicons을 모으고, 염기서열 분석은 Illumina MiSeq sequencing system (Illumina Inc., San Diego, CA, USA)으로 하였고 염기서열 분석과 데이터 분석은 Chunlab (Seoul, Korea)에서 수행하였다.
토양 미생물을 분류할 때 기준을 보면 첫째, taxonomic group은 서로 밀접히 유사하여 16S rRNA 염기서열만으로는 구분이 어려운 종들의 모임이며, 분석을 통해 얻은 염기서열이 특정 group에 속한 종들과 가장 유사할 때 group으로 표시를 하였다. 둘째, taxonomic name의 접미어 (_p, _c, _o, _f, _s)는 분석 대상 염기서열과 가장 유사한 database의 염기서열이 공식적인 taxonomic name을 가지고 있지 않은 경우에 사용하며, 염기서열으로만 존재하는 미배양 종을 표현하기 위해 사용하였다. 셋째, taxonomic name의 접미어 중 “uc”는 unclassified의 약자로 database에 종 수준까지 유사한 염기서열이 없어 신종으로 간주할 수 있는 염기서열의 모음이며, 이 경우 상위 계통의 이름에 “uc”붙여 임의의 계통을 만들어 결과를 표현하였다.
6. 통계분석
통계분석은 통계프로그램 SAS (Version 9.2, SAS Institute Inc., Cary, NC, USA)을 이용하여 5% 유의수준에서 Duncan’s Multiple Range Test (DMRT)로 처리간 유의성 검정을 하였다 (p < 0.05). 두 처리간 유의성 검정은 t-test (*p < 0.05; **p < 0.01; and ***p < 0.001)를 이용하였다.
결과 및 고찰
1. 연작장해 유발토양과 억제토양에서 인삼의 뿌리썩음병 발생율
억제토양으로 선정한 토양이 억제토양인지 확인하기 위해 포트에 묘삼을 단기간 재배하여 지상부 생육 및 뿌리썩음병 발생율을 연작장해 유발토양과 비교하였다 (Table 1). 초장, 엽장, 엽폭 등 지상부 생육은 유발토양보다 억제토양에서 매우 양호하였으며, 뿌리썩음병 발생율과 발병지수도 매우 낮아 본실험에서 선정한 억제토양은 뿌리썩음병 발생이 억제되는 토양이었다.

Growth and root rot disease of 2-year-old ginseng by mixing of suppressive soil and conducive soil causing root rot disease of ginseng.
일반적으로 뿌리썩음병 발생이 심해 연작장해를 유발하는 토양에서는 지상부 생육도 불량해지는데 (Lee et al., 2018b; Seo et al., 2019), 인삼 (Panax ginseng) 지상부가 발달하는 생육초기에 뿌리털이 뿌리썩음병원균에 감염되어 조기에 탈락되면 양·수분 흡수가 불량해져 지상부 생육이 억제된 것으로 보인다. 본시험에서, 인삼 재작 전 억제토양과 유발토양에서 3 년간 윤작한 작물이 서로 달랐는데 인삼 재배 전 윤작물의 종류가 토양미생물상에 영향을 미쳤을 수도 있으므로 금후 이에 대한 검토가 필요하다.
한편, 억제토양의 생물적 요인이 뿌리썩음병 발생 억제에 영향을 미치는지를 구명하기 위해 억제토양을 멸균 처리하여 유발토양과 혼합 처리한 다음 2년생 인삼의 지상부 생육 및 뿌리썩음병 발생율을 조사하였다 (Table 1). 유발토양 + 억제토양 혼합처리에 따른 지상부 생육 및 뿌리썩음병 발생율은 유발토양과 억제토양 단독처리의 중간 값을 보여 억제토양의 혼합에 의해 지상부 생육이 증가되고 뿌리썩음병 발생이 억제되었다.
유발토양 + 멸균 억제토양 혼합처리에 따라 지상부 생육 및 주당근중은 유발토양 + 억제토양 혼합처리보다 다소 증가되어 멸균된 토양이 혼합되었을 때 지상부 생육 및 근중이 향상되는 경향을 보였는데 이는 유발토양에 존재하는 생육억제물질 (타감물질)이 멸균토양의 혼합으로 인해 희석되었기 때문으로 보인다. Lee 등 (2018b)도 연작지 토양에 관수처리를 하면 생육억제물질의 희석으로 인해 2년생 인삼의 지상부 생육은 뚜렷이 증가되었다고 하였다. 유발토양 + 멸균 억제토양 혼합처리에 따라 뿌리썩음병 발생율은 유발토양 + 억제토양 혼합처리보다 뚜렷이 증가되어 멸균된 토양이 혼합되었을 때 뿌리썩음병 발생율이 증가되었는데 이는 억제토양에 존재하는 뿌리썩음병 길항 미생물들이 멸균으로 사멸되어 뿌리썩음병의 억제작용 (Chung et al., 1984; Kim et al., 2012)이 일어나지 못했기 때문으로 보이며, 추후 연구를 통해 자세한 검토가 필요하다.
2. 연작장해 유발토양과 억제토양의 화학적 특성 비교
유발토양과 억제토양의 이화학적 특성을 비교한 결과는 다음과 같다 (Table 2). 토양산도와 염류농도는 유발토양이 억제토양보다 높았는데, 유발토양은 모두 농촌진흥청에서 제시한 토양 화학성의 최적범위보다 다소 높았다.

Soil chemical properties of by mixing of suppressive soil and conducive soil causing root rot disease of ginseng.
유기물 함량은 유발토양과 억제토양 간에 유의적인 차이가 없었으며, 모두 최적범위보다 낮은 함량을 보였는데, 이는 우리나라 토양특성상 유기물 함량이 적을 뿐 아니라 인삼 재배 기간 중에 유기물을 추가로 투입할 수 없기 때문으로 보인다. 질산태 질소함량은 유발토양이 억제토양보다 높았으나 모두 최적범위 안에 있었다. 유효인산 함량은 유발토양이 억제토양보다 낮았는데, 억제토양은 최적범위를 초과하여 매우 높은 함량을 보였다. 칼륨, 칼슘, 마그네슘 함량은 유발토양과 억제토양 간에 유의적인 차이는 없었다. Chung 등 (1984)은 결주율이 10% 이하인 5 개 지역 (억제토양)과 50% 이상인 5개 지역 (유발토양)을 비교한 결과 다른 성분은 유의적인 차이가 없었으나 마그네슘과 나트륨 함량은 유발토양이 더 많았다고 하였는데, 본 시험에서도 유발토양이 다소 높은 특징을 보였다.
본 실험에서 선정한 유발토양과 억제토양이 우리나라 전체 토양의 특성을 대표하지는 못하지만 인삼 뿌리썩음병에 억제 효과를 보였던 토양 화학적 요인을 고찰해 보면 억제토양은 토양산도, 염류농도, 질산태 질소, 나트륨 함량이 낮았다. 염류농도는 질산태 질소와 가장 높은 정의상관을 보이며 (Hyun et al., 2009; Lee et al., 2017), 염류농도가 높으면 염류장해로 뿌리에 상처가 생겨 뿌리썩음병 발생이 증가한다 (Yang et al., 2000).
한편, 억제토양의 생물적 요인이 인삼 뿌리썩음병 발병에 영향을 미치는지 알아보기 위해 유발토양과 억제토양을 1 / 2씩 혼합처리하거나 또는 억제토양을 멸균처리하여 유발토양과 1 / 2 씩 혼합 처리한 토양의 화학성을 비교한 결과는 다음과 같다. 유발토양 + 억제토양 혼합처리의 토양 화학성은 유발토양과 억제토양의 중간 값을 나타냈으며, 유효인산 함량을 제외하고 모두 인삼 예정지 토양의 화학성 기준에 적합하였다. 유발토양 + 멸균 억제토양 혼합처리의 경우에도 마찬가지의 경향을 나타냈다. 뿌리썩음병 발생율은 유발토양 + 억제토양보다 유발토양 + 멸균 억제토양에서 높았으나 (Table 1) 두 처리 간에 토양 화학성의 유의적인 차이는 없어 뿌리썩음병 억제토양의 기작에는 토양 화학성 이외에 다른 요인이 작용한 것으로 판단되었다.
3. 연작장해 유발토양과 억제토양의 인삼 뿌리썩음병원균 밀도 비교
유발토양과 억제토양에서 인삼 뿌리썩음병원균, C. destructans의 밀도를 비교해 보면 다음과 같다 (Table 3). 유발토양의 C. destructans의 밀도는 토양 g당 79.0 ± 16.6 spore인데 반해 억제토양의 C. destructans 밀도는 62.6 ± 13.7 spore로 유발토양의 밀도가 다소 높았으나 억제토양과 유발토양 간에 유의적인 차이는 없었다. 억제토양은 재 경작 했을 때 정상적인 인삼 수량성을 보였을 뿐만 아니라 묘삼을 이용한 생물검정 (Table 1)에서도 병 발생율이 현저히 낮아 C. destructans의 밀도가 낮을 것으로 예상하였으나 실제 차이를 보이지 않았다.

Density of C. destructans in suppressive soil and conducive soil caused by root rot disease of ginseng.
이와 같은 결과를 고려했을 때 인삼뿌리썩음병의 발생에는 C. destructans의 밀도 이외에 토양 생태계를 구성하는 다른 미생물이 크게 영향을 미칠 수 있다고 예상할 수 있다. 토양생태계가 건전하여 토양 미생물상이 다양해지면 길항 미생물의 활동이 왕성하여 인삼 뿌리썩음병이 억제될 수 있다고 하였다 (Lee et al., 2018b). 따라서 C. destructans의 밀도 이외의 전체적인 토양 미생물상과 뿌리썩음병 발생과의 관계를 조사하는 것이 중요할 것으로 생각된다.
4. 연작장해 유발토양과 억제토양의 토양 미생물상 비교
유발토양과 억제토양에서 토양 미생물상의 특성을 종 (species) 단위에서 비교해 보면 다음과 같다. 유발토양에서 1.0% 이상 점유하는 세균들의 비율을 보면 (Fig. 1) Micrococcaceae과의 Arthrobacter globiformis group 3.03 ± 0.24%, Bradyrhizobiaceae과의 Pseudolabrys PAC001897 1.89 ± 0.02%, GQ396871 JF833502 1.10 ± 0.12%를 차지하여 1.0% 이상 점유하는 세균이 3 종에 불과해 그 비율이 낮았다.
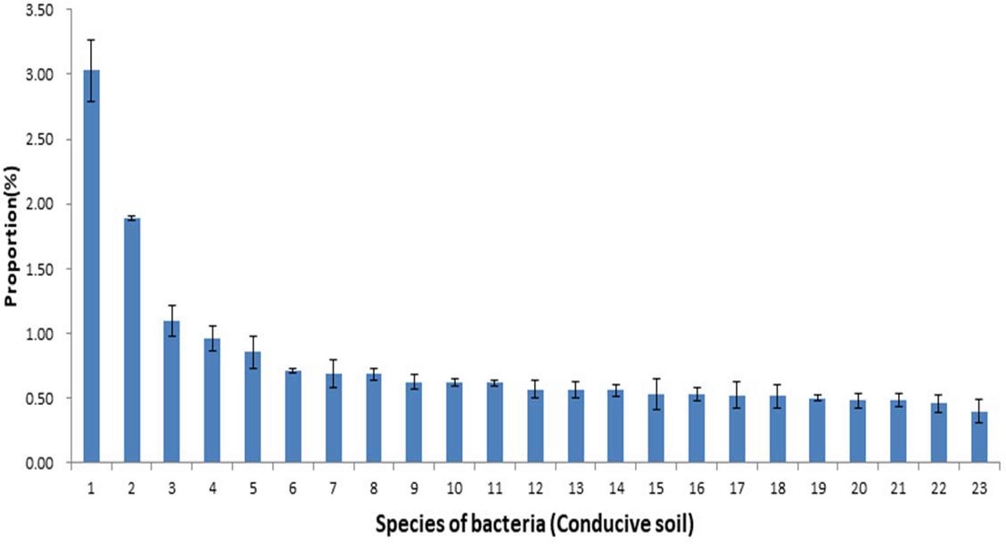
Composition ratio of microbial communities of the bacterial species in conducive soil caused by root rot disease of ginseng.1; Arthrobacter globiformis group, 2; Pseudolabrys PAC001897_s, 3; GQ396871_g JF833502_s, 4; PAC001907_g_uc, 5; Bacillus megaterium group, 6; Methyloceanibacter EF632942_s, 7; Sphingomonas sediminicola group, 8; AY673303_g AY673303_s group, 9; Sphingomonas GQ396809_s, 10; Bradyrhizobium japonicum group, 11; Streptomyces scabiei group, 12; Bacillus funiculus, 13; Nitrospira PAC001891_s, 14; PAC001932_g_uc, 15; AY281358_g_uc, 16; PAC001869_g_uc, 17; Pseudomonas fulva group, 18; PAC001907_g AY395397_s, 19; PAC000624_g GQ472385_s, 20; Pseudorhodoplanes CP007440_s group, 21; DQ984612_g DQ984612_s, 22; FJ810547_g FJ810547_s, 23; Thermoactinomyces vulgaris. Each value presents the means ± SD (n = 3).
반면 억제토양에서 1.0% 이상 점유하는 진균들의 비율을 보면 Ktedonobacteraceae과의 Ktedonobacteraceae uc (unclassified species) 4.34 ± 0.39%, PAC000121과의 PAC000030 AY913350 (uncultured species) 4.32 ± 0.41%, FR687426과의 JF429099 JF429099 2.21 ± 0.10%, Acidobacteriaceae과의 HM748754 HM062267 2.11 ± 0.22%, Bradyrhizobiaceae과의 Bradyrhizobium japonicum group 1.58 ± 0.21%, Acidobacteriaceae과의 HM748739 EU881286 1.21 ± 0.09%, PAC001907 uc 1.02 ± 0.13%를 차지하여 1.0% 이상 점유하는 세균이 7 종으로 유발토양의 3 종에 비해 현저히 많았다 (Fig. 2). 이와 같이 억제토양은 유발토양에 비해 1.0% 이상 점유하는 세균들이 더 많아 세균의 다양성이 더 풍부하였다.
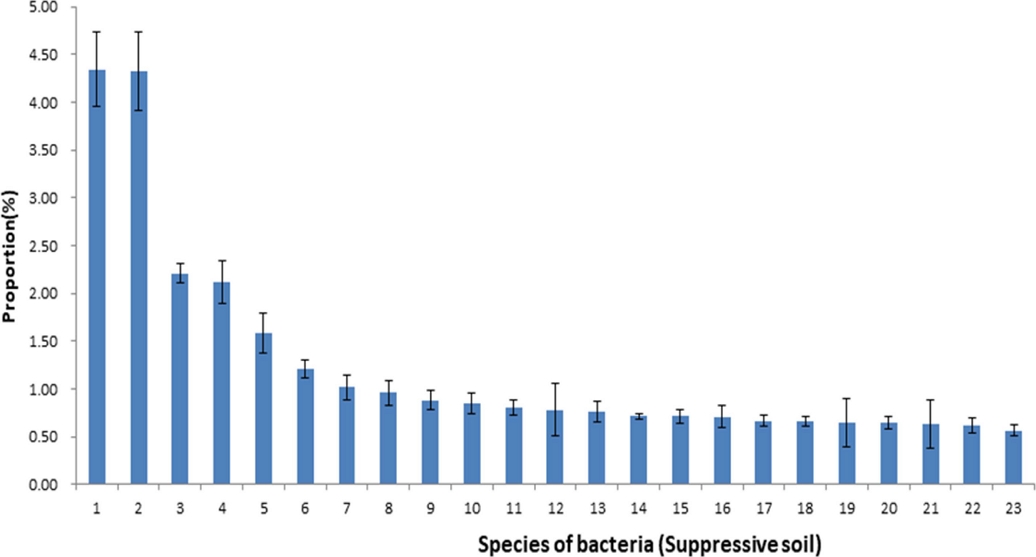
Composition ratio of microbial communities of the bacterial species in suppressive soil caused by root rot disease of ginseng.1; Ktedonobacteraceae_uc, 2; PAC000030_g AY913350_s, 3; JF429099_g JF429099_s, 4; HM748754_g HM062267_s, 5; Bradyrhizobium japonicum group, 6; HM748739_g EU881286_s, 7; PAC001907_g_uc, 8; PAC001907_g JQ978566_s, 9; PAC001817_g HM062444_s, 10; Gemmatimonadaceae_uc, 11; EU680443_f_uc, 12; PAC000016_f_uc, 13; HM748739_g PAC001826_s group, 14; GU113056_g JF429132_s, 15; PAC001907_g PAC002001_s, 16; FR687426_f_uc, 17; HM748739_g HM748739_s, 18; PAC002560_g FR749764_s, 19; PAC000016_g_uc, 20; AY673403_f_uc, 21; Pseudomonas fulva group, 22; JADL_g PAC001973_s, 23; Gaiella EF516257_s. Each value presents the means ± SD (n = 3).
Rosenzweig 등 (2012)에 의하면 Streptomyces spp.에 의해 발병하는 감자 반점병을 억제하는 억제토양과 인접한 유발토양의 미생물상을 분석한 결과 종 다양성은 유발토양보다 억제 토양에서 더 다양하였으며, 억제토양에서는 Lysobacter phylum의 비율이 높았고 유발토양에서는 Bacillus 속의 세균의 비율이 상대적으로 높았다고 하였다.
인삼 세근 분말을 인삼 연작지 토양에 혼화하면 Arthrobacter 속 세균 (A. oryzae, A. pascens, A. humicola, A. defluvii 등)이 2.2%에서 8.9%로 뚜렷이 증가되고 인삼뿌리썩음병 발생이 증가하였는데, 유발토양에서 Arthrobacter 속의 증가는 연작장해 발생과 관계가 있다고 하였다 (Lee et al., 2018b).
유발토양에서 우점하는 진균의 비율을 보면 Pyronemataceae과의 Pseudaleuria spp. HG936843 28.70 ± 6.08%, Chlorophyta과의 Chlorophyta uc 5.00 ± 0.76%, Ascobolaceae과의 Ascobolus spp. EU826901 4.84 ± 1.07%, Mortierellaceae과의 Mortierella elongata 4.65 ± 0.52%로 가장 많이 우점하는 Pseudaleuria spp. HG936843이 차지하는 비율은 28.7%로 매우 높았으며, 1.0% 이상 점유하는 진균의 수는 17 종이었다 (Fig. 3).
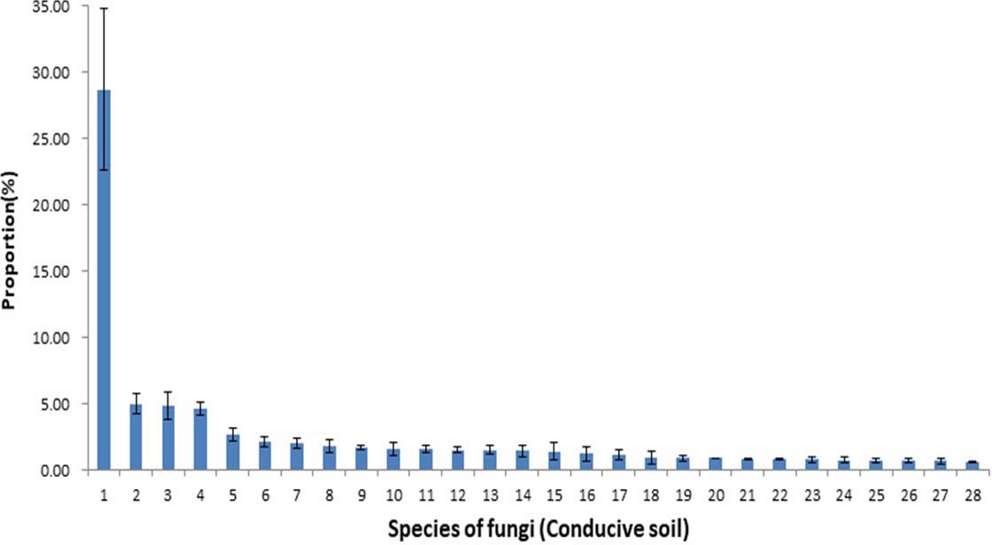
Composition ratio of microbial communities of the fungi species in conducive soil caused by root rot disease of ginseng.1; Pseudaleuria sp_HG936843, 2; Chlorophyta_f_uc, 3; Ascobolus sp_EU826901, 4; Mortierella elongata, 5; Sordariomycetes sp_LN714581, 6; Pseudogymnoascus roseus, 7; Chaetomiaceae sp_HG937129, 8; Nectriaceae sp_KM032335, 9; Humicola grisea, 10; Nectriaceae sp_JX985009, 11; Thermomyces lanuginosus, 12; Solicoccozyma terricola, 13; Solicoccozyma fuscescens, 14; Ascomycota sp_MF041866, 15; Hypomyces sp_KU582490, 16; Chrysosporium lobatum, 17; Fusarium oxysporum, 18; Chlorophyta_o_uc, 19; Pyronemataceae sp_EU826918, 20; Mortierella alpina, 21; Microascales sp_HG937025, 22; Mortierella sp_HM240131, 23; Sordariaceae sp_AF461639, 24; Trichosporon sp_FJ873440, 25; Fungi_g_uc, 26; Cercozoa_f_uc, 27; Hypocreales sp_KF493901, 28; Fungi_o_uc. Each value presents the means ± SD (n = 3).
반면 억제토양에서 우점하는 비율을 보면 Pseudeurotiaceae 과의 Pseudogymnoascus roseus 7.52 ± 1.45%, Cephalothecaceae 과의 Phialemonium inflatum 6.07 ± 1.04%, Mortierellaceae과의 Mortierella chlamydospora 3.90 ± 0.28%로 가장 많이 우점하는 Pseudogymnoascus roseus이 차지하는 비율은 7.52%로 매우 낮았으며, 1.0% 이상 점유하는 진균의 수는 23 종이었다 (Fig. 4).
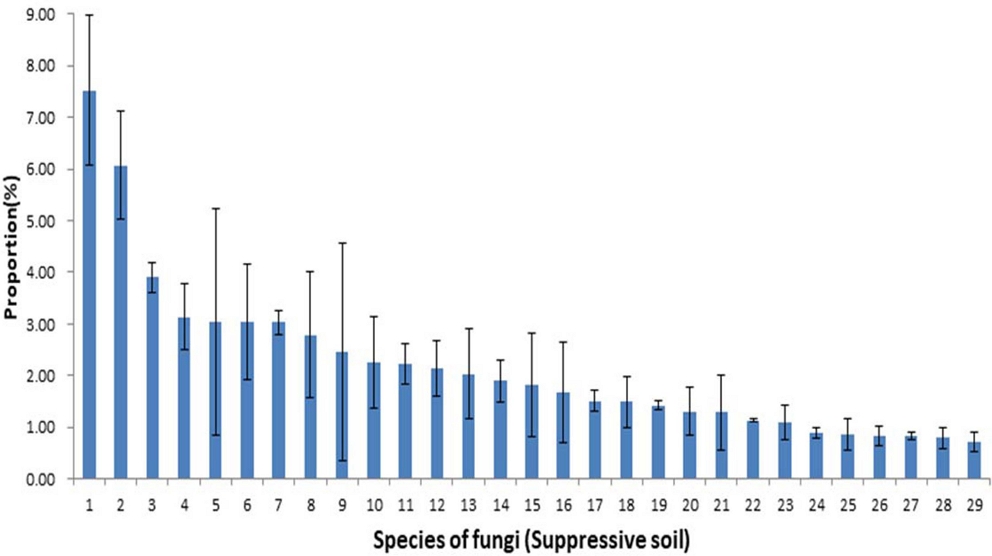
Composition ratio of microbial communities of the fungi species in suppressive soil caused by root rot disease of ginseng.1; Pseudogymnoascus roseus, 2; Phialemonium inflatum, 3; Mortierella chlamydospora, 4; Chaetomium rectangulare, 5; Leotiomycetes_g_uc, 6; Junewangia_uc, 7; Chaetomiaceae sp_HG328008, 8; Chaetomiaceae sp_HG937129, 9; Alternaria alternata, 10; Humicola grisea, 11; Umbelopsis sp_HQ630286, 12; Hyaloscyphaceae sp_KC222688, 13; Hymenoscyphus kathiae, 14; Fungi_f_uc, 15; Cadophora sp_KF428527, 16; Conlarium sp_JX489782, 17; Cercozoa_f_uc, 18; Sordariomycetes sp_KF675686, 19; Spizellomycetaceae_uc, 20; Chaetomiaceae sp_KM268653, 21; Chrysosporium sp_JX270594, 22; Penicillium sp_GU973625, 23; Mortierella sp_HM240131, 24; Talaromyces aculeatus, 25; Fungi_g_uc, 26; Solicoccozyma terricola, 27; Paraglomerales sp_KF849610, 28; Ascomycota sp_MF041866, 29; Fusarium oxysporum. Each value presents the means ± SD (n = 3).
이와 같이 가장 많이 우점하는 진균의 비율은 유발토양이 28.7%인 반면 억제토양은 7.5%로 현저히 낮고 1.0% 이상 차지하는 진균의 수도 유발토양이 17 종인 반면 억제토양은 23 종으로 뚜렷이 많았다.
Park 등 (2011)은 Fusarium spp.의 우점에 의해 토양미생물상이 단순하게 되어 작약의 연작장해 발생이 증가된다고 하였다. Li 등 (2018)은 인삼 재배토양에서 진균의 군집특성을 분석한 결과 연작토양에서 Fusarium, Gibberella, Nectriaceae 등과 같이 인삼 뿌리썩음병을 일으키는 병원균이 더 높은 비율로 존재하였으며, 연작토양에 존재하는 유기산 중 3-phenylpropionic acid가 곰팡이의 다양성을 크게 감소시키고 뿌리썩음병을 촉진시켰다고 하였다.
본 실험에서, 유발토양에서는 인삼 뿌리썩음병을 일으키는 병원균인 Nectriaceae sp. KM032335가 1.83 ± 0.47%, Nectriaceae spp. JX985009가 1.60 ± 0.48% 점유하였으나 억제토양에서는 Nectriaceae sp. KM032335가 0.42 ± 0.10%, Nectriaceae sp. JX985009가 0.17 ± 0.05% 점유하여 매우 낮은 비율로 존재하였다.
Dong 등 (2016)에 의하면 3 년 동안 연작된 전칠삼 재배토양에서 곰팡이 다양성은 감소하였고 뿌리썩음병 발생율과 곰팡이 다양성은 부의 상관이 있었는데 Fusarium oxysporum과 Phaeosphaeria rousseliana는 뿌리썩음병 발생율과 정의 상관을 보였다고 하였다. 본 실험에서도 F. oxysporum의 비율은 유발토양 1.19 ± 0.37%, 억제토양 0.71 ± 0.19%로 유발토양이 더 높았다.
Xiao 등 (2016)에 의하면 토양전염성 병인 F. oxysporum은 모든 인삼 재배토양에서 검출되었으며, 미생물 다양성은 인삼연생이 증가될수록 감소하였는데 인삼 연생이 증가할수록 세균의 다양성은 감소하고 진균의 다양성은 증가하였다고 하였다. Lee 등 (2018b)에 의하면 인삼 세근 분말을 인삼 연작지 토양에 혼화하면 Mortierella elongata가 0.2%에서 4.9%로 증가되고 인삼 뿌리썩음병 발생도 증가하였는데 본 실험의 연작장해 유발토양에서 M. elongata의 증가는 연작장해 발생과 관계가 있을 것으로 보인다.
본 연구결과를 종합해 보면 연작장해 억제토양의 뿌리썩음병 발생율은 묘삼을 이용한 생물검정을 했을 때 43.3%로 유발토양 96.7%에 비해 매우 낮아 억제토양으로 볼 수 있었으며, 억제토양을 멸균처리하면 뿌리썩음병 발생율이 증가하여 뿌리썩음병 억제작용에는 생물적 요인이 작용하였다. 억제토양을 멸균 처리하여도 토양 화학성에는 큰 변화가 없어 화학적 요인보다는 생물적 요인이 더 크게 작용함을 알 수 있었다. 억제토양은 유발토양에 비해 토양산도, 염류농도, 질산태질소, 나트륨 함량이 낮았다. 억제토양은 세균과 진균 군집의 다양성이 더 풍부하고 특정 진균의 우점비율이 낮고 뿌리썩음병을 일으키는 병원균 (Nectriaceae sp.)의 비율도 낮았다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: PJ01439801)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
AIabouvette C. (1999). Fusarium wilt suppressive soils: An example of disease-suppressive soils. Australasian Plant Pathology. 28:57-64.
[https://doi.org/10.1071/AP99008]

-
Borneman J and Ole Becker J. (2007). Identifying micro-organisms involved in specific pathogen suppression in soil. Phytopathology. 45:153-172.
[https://doi.org/10.1146/annurev.phyto.45.062806.094354]

- Chung YR, Kim HJ, Ohh SH and Lee IH. (1983). Properties of suppressive and conducive soils to ginseng root rot. Korean Journal of Plant Protection. 22:203-207.
- Chung YR, Kim HJ, Ohh SH and Park KJ. (1984). Comparison of rhizosphere environments in soils suppressive and conducive to ginseng root rot. Korean Journal of Plant Protection. 23:142-146.
-
Dong L, Xu J, Feng G, Li X and Chen S. (2016). Soil bacterial and fungal community dynamics in relation to Panax notoginseng death rate in a continuous cropping system. Scientific Reports. 6:31802. https://www.nature.com/articles/srep31802, (cited by 2020 Jan 3).
[https://doi.org/10.1038/srep31802]

- Hyun DY, Yeon BY, Lee SW, Kang SW, Hyun GS, Kim YC, Lee KW and Kim SM. (2009). Analysis of occurrence type of physiological disorder to soil chemical components in ginseng cultivated field. Korean Journal of Medicinal Crop Science. 17:439-444.
- Jo JS, Kim CS and Won JY. (1996). Crop rotation of the Korean ginseng(Panax ginseng C. A. Meyer) and the rice in paddy field. Korean Journal of Medicinal Crop Science. 4:19-26.
- Kang SW, Yeon BY, Hyeon GS, Bae YS, Lee SW and Seong NS. (2007). Changes of soil chemical properties and root injury ratio by progress years of post-harvest in continuous cropping soils of ginseng. Korean Journal of Medicinal Crop Science. 15:157-161.
-
Kim BY, Ahn JH, Weon HY, Song JK, Kim SI and Kim WG. (2012). Isolation and characterization of Bacillus species possessing antifungal activity against ginseng root rot pathogens. Korean Journal of Pesticide Science. 16:357-363.
[https://doi.org/10.7585/kjps.2012.16.4.357]

- Lee IH, Yuk CS and Park H. (1989). Yield and missing plant rate of Panax ginseng affected by the annual changes in physico-chemical properties of ginseng cultivated soil. Korean Journal of Soil Science and Fertilizer. 22:18-24.
-
Lee JS, Han KS, Lee SC, Soh JW and Kim DW. (2014). Environmental factors on the development of root rot on ginseng caused by Cylindrocarpon destructans. Research in Plant Disease. 20:87-94.
[https://doi.org/10.5423/RPD.2014.20.2.087]

-
Lee SW, Lee SH, Park KH, Jang IB, Jin ML and Seo MW. (2017). Effect of crop rotation system on soil chemical properties and ginseng root rot after harvesting ginseng. Korean Journal of Medicinal Crop Science. 25:244-251.
[https://doi.org/10.7783/KJMCS.2017.25.4.244]

- Lee SW, Lee SH, Seo MW, Jang IB, Jang IB, Yu J, Moon JW and Suh SJ. (2018a). Effect of soil fumigation and maize cultivation on reduction of replant failure in ginseng. Korean Journal of Medicinal Crop Science. 26:248-253.
- Lee SW, Lee SH, Seo MW, Park KH and Jang IB. (2018b). Effects of irrigation and ginseng root residue on root rot disease of 2-years-old ginseng and soil microbial community in the continuous cropping soil of ginseng. Korean Journal of Medicinal Crop Science. 26:345-353.
-
Li Z, Fu J, Zhou R and Wang D. (2018). Effects of phenolic acids from ginseng rhizosphere on soil fungi structure, richness and diversity in consecutive monoculturing of ginseng. Saudi Journal of Biological Sciences. 25:1788-1794.
[https://doi.org/10.1016/j.sjbs.2018.07.007]

- National Institute of Agricultural Science and Technology (NIAST). (2000). Methods of soil chemical analysis. National Institute of Agricultural Science and Technology. Suwon, Korea. p.89-93.
-
Park JH, Seo YJ, Choi SY, Zhang YS, Ha SK and Kim JE. (2011). Soil physico-chemical properties and characteristics of microbial distribution in the continuous cropped field with Paeonia lactiflora. Korean Journal of Soil Science and Fertilizer. 44:841-846.
[https://doi.org/10.7745/KJSSF.2011.44.5.841]

- Park KJ, Yu YH and Ohh SH. (1997). Population variations of Cylindrocarpon destructans causing root rot of ginseng and soil microbes in the soil with various moisture contents. Korean Journal of Plant Pathology. 13:100-104.
-
Peters RD, Sturz AV, Carter MR and Sanderson JB. (2003). Developing disease-suppressive soils through crop rotation and tillage management practices. Soil and Tillage Research. 72:181-192.
[https://doi.org/10.1016/S0167-1987(03)00087-4]

-
Rahman M and Punja ZK. (2005). Factors influencing development of root rot on ginseng caused by Cylindrocarpon destructans. Phytopathology. 95:1381-1390.
[https://doi.org/10.1094/PHYTO-95-1381]

-
Rosenzweig N, Tiedje JM, Quensen JF, Meng Q and Hao JJ. (2012). Microbial communities associated with potato common scab-suppressive soil determined by pyrosequencing analyses. Plant Disease. 96:718-725.
[https://doi.org/10.1094/PDIS-07-11-0571]

- Rural Development Adminstration(RDA). (2014). Ginseng standard cultivation textbook(Revised Edition). Rural Development Adminstration. Jeonju, Korea. p.92.
-
Seo MW, Lee SW, Lee SH, Jang IB and Heo HJ. (2019). Effect of green manure incorporation and solarization on root rot disease of 3-year-old ginseng in soil of continuous cropping ginseng. Korean Journal of Medicinal Crop Science. 27:284-291.
[https://doi.org/10.7783/KJMCS.2019.27.4.284]

-
Sun JM, Fu JF, Zhou RJ and Yan XR. (2013). Antibiotic effects of four exogenous phenolic acids on soilborne pathogen, Cylindrocarpon destructans. Applied Mechanics and Materials. 295-298:2294-2299.
[https://doi.org/10.4028/www.scientific.net/AMM.295-298.2294]

-
Xiao C, Yang L, Zhang L, Liu C and Han M. (2016). Effects of cultivation ages and modes on microbial diversity in the rhizosphere soil of Panax ginseng. Journal of Ginseng Research. 40:28-37.
[https://doi.org/10.1016/j.jgr.2015.04.004]

-
Xu YH, Chi K, Zhang A, Lei F, Yang H, Zhao Y, Li K, Wang E, Li Q, Kim JS, Lee SH and Kim YC. (2016). Chemotactic response study of Cylindrocarpon destructans towards ginseng root exudates. Korean Journal of Medicinal Crop Science. 24:360-369.
[https://doi.org/10.7783/KJMCS.2016.24.5.360]

- Yang SS, Kim CH and Nam KW. (2000). Effect of soil salinity on the root growth and Fusarium disease of tomato and cucumber. Research in Plant Disease. 6:71-75.
-
Yousef LF and Bernards MA. (2006). In vitro metabolism of ginsenosides by the ginseng root pathogen Pythium irrgulare. Phytochemistry. 67:1740-1749.
[https://doi.org/10.1016/j.phytochem.2005.06.030]

