
천궁 초작과 연작 재배지의 토양특성이 토양 곰팡이 군집에 미치는 영향
 ; Kyeung Min Han2
; Kyeung Min Han2 ; Hyun Jun Kim3
; Hyun Jun Kim3 ; Chung Woo Kim4
; Chung Woo Kim4 ; Kwon Seok Jeon5
; Kwon Seok Jeon5 ; Chung Ryul Jung6, †
; Chung Ryul Jung6, †
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study investigated the effects of soil properties on the soil fungal community in first and continuous cultivation areas of Cnidium officinale Makino.
The soil fungal community was analyzed for relative abundance and principal coordinate analysis (PCoA) was conducted using Illumina MiSeq sequencing. The correlation between the soil chemical properties and the soil fungal community was assessed with distance-based linear models (DISTLM). The soil fungal community showed distinct clusters consisting in the continuous cultivation area of C. officinale Makino. PCoA and DISTLM indicated that soil pH, calcium, and available P2O5 significantly affected the soil fungal community in the cultivation area of C. officinale Makino. In addition, considering 5 different pathogenic fungi the relative abundance of Fusarium in the continuous cultivation area was significantly higher compared to that in the first cultivation area of C. officinale Makino.
This study is important because it has determinined the effects of soil properties on the soil fungal community in both first and continuous cultivation areas of C. officinale Makino. Moreover, these results will be helpful to investigate the cause of continuous cropping obstacle in C. officinale Makino by examining the changes of soil fungal community.
Keywords:
Cnidium officinale Makino, Soil Fungal Community, Soil Properties, Correlation Analysis, First and Continuous Cultivation Area서 언
천궁 (Cnidium officinale Makino)은 산형과 (Umbelliferae)에 속하는 다년생 초본으로 지하부 근경을 건조한 후 세절하여 약재로 사용하고 있다. 천궁은 식품에 제한적 원료로 사용이 허가되어 있고, 혈관확장, 항염증, 항균 등의 효능이 있어, 한방에서는 사물탕, 십전대보탕, 교애귀궁탕으로 처방하여 보혈, 강장, 진정, 진통, 구어혈, 냉증, 월경장해 등의 치료를 목적으로 널리 사용되는 생약재이다 (Oh et al., 2010; BHHES, 2012).
웰니스 사회의 진입으로 한약재에 관한 관심과 함께 약용작물의 활용범위가 예전의 약재 위주에서 건강기능식품 및 기능성화장품 분야로 확대되면서 수요는 증가추세에 있다. 하지만 천궁의 재배면적 및 생산량은 1997년 789㏊, 2,294 M/T (metric ton)이었던 것이 2017년에는 185㏊, 1,290 M/T로 현저히 감소하였다 (MAFRA, 2018). 이러한 감소이유는 고온과 가뭄 등 기후변화에 따른 민감성과 연작장해에 따른 재배지 교체의 어려움에 있다 (Kim et al., 2015; Seo et al., 2018; Jung et al., 2019). 또한, 지속적이고 안정적인 재배기술 개발도 부족한 편이다. 현재 천궁 재배지는 영양, 봉화 등 경북 북부지역에서 점진적으로 태백, 삼척 등 강원 남부지역으로 이동하고 있다.
미생물의 다양성과 군집구성은 토양의 생산성, 식물생장 및 작물의 품질에 크게 영향을 끼치고 (Wu et al., 2011; Nayyar et al., 2012), 미생물 군집의 다양성과 구성의 변이는 작부체계, 식물 종, 생물 및 비생물 요인의 변화와 관련되어 있다 (Lauber et al., 2008; Bell et al., 2013). 토양미생물의 다양성과 구성의 변화는 생태계 기능, 균형과 건강성을 교란할 수 있고, 토양의 생산성에 부정적인 영향을 주며 결과적으로 식물체를 고사시킨다 (Chen et al., 2012; Mazzola and Manici, 2012).
토양미생물 군집의 다양성과 조성은 토양의 환경특성과 밀접하게 연결되어 있으며, 토양 건강의 민감한 bioindicator로써 역할이 가능하다 (Avidano et al., 2005). 또한, 세균과 곰팡이의 분류군 (taxa)은 경작과 관련되어 있으며 이러한 분류군은 잠재적으로 생태계의 물질대사과정과 큰 상관관계를 가진다 (Singh et al., 2006; Rousk et al., 2010; Yergeau et al., 2012).
연작장해는 동일토양에 동일작물을 연속적으로 재배함으로써 일반적인 재배방식과 비교하여 생산량과 품질이 감소하는 현상을 말한다 (Kang et al., 2007). 연작장해의 원인으로 병해충의 정착, 토양유래 식물병의 증가, 토양산성화, 2 차 염류화 (salinization), 토양 물리화학 특성의 불균형, 토양미생물, 자가독성과 전작물 뿌리나 작물유체의 분해과정에서 생성되는 독소물질의 토양 축적 및 pH 변화 등이 알려져 있다 (Jeong et al., 1991; Yao et al., 2006; Zhou et al., 2012; Manici et al., 2013; Mondal et al., 2013; Zhou et al., 2014).
토양미생물 중 곰팡이는 식물 잔재물의 분해자로서 토양생태계에 중요한 역할을 하며 식물병원균에 길항능을 가지는 종류가 있는 반면, 일부는 식물병을 일으켜 작물에 대규모 피해를 주기도 한다 (Bridge and Spooner, 2001; Gomes et al., 2003). 천궁은 병 피해가 심한 작물로 대표적으로 탄저병, 잎마름병, 갈색무늬병, 줄기썩음병, 시들음병 등이 발병하고, 병해 정도는 연작 시 지속적으로 증가한다고 하였다 (BHHES, 2012).
연작장해는 복합적인 원인으로 발생하기 때문에 연작장해를 방지하는 체계적인 재배기술은 아직까지 확립되어 있지 않다. 따라서 약용작물의 지속가능한 생산을 위해서는 효과적인 방안을 찾아야 한다. 연작재배는 토양미생물의 다양도와 군집 구성에 영향을 주며 토양 생산성과 건강성에 부정적인 영향을 크게 나타낸다 (Berg and Smalla, 2009; Nayyar et al., 2012). 따라서 연작체계에서 토양미생물 군집의 이해는 토양개량을 위해서 필요하지만, 세균 및 곰팡이 군집 변화에 관한 연구는 다소 부진한 편이다 (Dong et al., 2016). 약용작물의 연작장해와 관련한 토양 microflora의 변화 연구로 인삼 (Kang et al., 2007; Shin et al., 2012; Lee et al., 2018; Wei et al., 2020), 작약 (Park et al., 2011), 전칠삼 (P. notoginseng, Dong et al., 2016; Tan et al., 2017), 황련 (Coptis chinensis, Alami et al., 2020) 등에서 진행된 바 있다. 하지만 천궁의 연작 재배지의 미생물상 특히, 세균군집에 대한 연구는 최근에서야 이루어졌고 (Kim et al., 2020), 토양곰팡이 군집분석 연구는 아직 미흡한 실정이다.
따라서 본 연구에서는 천궁의 초작과 연작 재배지에서 토양곰팡이 군집을 분석하고, 재배지 토양특성이 토양곰팡이 군집에 미치는 영향을 구명하기 위해 수행하였다.
재료 및 방법
1. 천궁 재배지 선정 및 토양 시료 채취
경북 영양군 영양읍의 천궁 (Cnidium officinale Makino) 재배농가 중에서 2017년도부터 재배한 연작 재배지 (continuos cultivation, CC)와 2018년도에 천궁을 처음 재배하는 초작 재배지 (first cultivation, FC)를 선정하였다. 선정한 재배지의 비료 시비는 경상북도 농업기술원에서 제시한 천궁 비료 시비량에 따라 비료 (N-P-K : 12-10-15 ㎏/10a)와 퇴비 (2,000 ㎏/10a)를 시비하였다 (BHHES, 2012).
공시토양의 시료 채취는 2018년 8월에 수행하였고, 각 재배지 내 4 개의 구역을 선정하여 표토를 제거한 후 20 ㎝ 이내의 깊이에서 근권 토양 100 g 씩 채취하였다. 채취한 시료 중 Illumina MiSeq 분석에 사용할 시료는 아이스박스에 담아 이동 후 -20℃에서 보관하였고, 토양 이화학성 분석에 사용할 시료는 2 ㎜ 체를 이용하여 거른 후 풍건하여 보관하였다.
2. 토양 특성 분석
토양 이화학성 분석은 충청북도 농업기술원에서 “농촌진흥청 종합검정실 분석 매뉴얼”에 따라 수행하였다 (RDA, 2013). 토양 pH는 풍건한 토양시료를 증류수와 1 : 5의 비율로 희석하여 30 분 동안 진탕한 후 pH meter를 이용하여 측정하였고, 전기전도도 (electric conductivity, EC)는 동일한 방법으로 전처리 후 EC meter를 이용하여 측정하였다. 유기물 (organic matter, OM) 함량은 Walkley-Black 법에 따라 측정하였고 (Walkley and Black, 1934), 유효인산 (available phosphate, avail. P2O5) 함량은 토양시료액과 1-amino-2-naphtol-4-sulfanic acid를 잘 혼합하여 발색시킨 후 720 ㎚에서 흡광도를 측정하였다. 양이온치환용량 (cation exchange capacity, CEC)은 1 N-NH4OAc으로 침출 후 토양에 치환된 NH4+를 Kjeldhal 증류법으로 측정하였다. 치환성 양이온 (exchangeable cation)은 1 N-NH4OAc으로 침출하고 진탕하여 여과한 후, 유도 결합 플라즈마 분광 분석기 (Inductively coupled plasma optical emission spectrometer, ICP-OES, optima 5300DV, Perkin Elmer Inc., Waltham, MA, USA)를 이용하여 측정하였다.
3. 토양곰팡이 군집 분석
천궁 재배지의 토양곰팡이 군집을 분석하기 위해 PowersoilTM DNA isolation kit (MO BIO Laboratories, Inc., Carlsbad, CA, USA)를 통해 total DNA를 추출하였고, 염기서열 증폭 (polymerase chain reaction, PCR)은 internal transcribed spacer (ITS) region을 ITS3 (5′-GCATCGATGAAGAACGCAGC-3′)과 ITS4 (5′-TCCTCCGCTTATTGATATGC-3′) primer를 이용하여 initial denaturation: 95℃, 5 min, (30 cycles) denaturation: 95℃, 30 sec, annealing: 55℃, 30 sec, extension: 72℃, 30 sec, final extension: 72℃, 7 min 조건에 따라 증폭하였다 (Kim et al., 2019a).
증폭된 염기서열은 Illumina MiSeq sequencing system (Illumina Inc., San Diego, CA, USA)을 이용하여 분석하였다. Raw sequence data 분석은 mothur application (version 1.43.0, Schloss et al., 2009)을 이용하여 UNITE reference database를 통해 분류적 동일성을 확인하였다 (Kim et al., 2019b). 이어서 염기서열을 mothur application에서 distance based greedy clustering (DGC) 분석을 이용하여 97% 염기서열 유사수준의 operational taxonomic units (OTUs)로 군집화하였고, 다양성 오차를 줄이기 위해 10 개 미만의 염기서열을 가진 OTUs는 제외하였다. 토양곰팡이 군집의 계통수 (phylogenetic tree)는 Mothur application에서 tree.shared-function을 사용하여 구성하였고, MEGA7 software (version 7.0.26, Pennsylvania State University, University Park, PA, USA)를 이용하여 시각화하였다. 상대적 빈도수 (relative abundance)는 염기서열 수에 대한 phylotype 기반 분석을 통해 정량화하였다. 주좌표 분석 (principal coordinate analysis, PCoA)은 Bray-Curtis dissimilarity matrix를 기반으로 토양곰팡이 군집의 염기서열 간의 유사성을 ordination 하였고, 토양 특성 결과를 입력하여 각 축에 대한 상관계수를 통해 토양요인을 주좌표 분석의 좌표에 표시하였다.
토양병원성 곰팡이의 군집을 확인하기 위해 genus 수준에서 토양 감염으로 인해 병해를 일으키는 대표적인 병원성 곰팡이 5 종 (Colletotrichum, Fusarium, Phytophthora, Pseudocercospora, Rhizoctonia)의 상대적 빈도수를 확인하였다.
4. 상관관계 및 통계 분석
천궁 재배지의 토양곰팡이 군집과 토양 이화학성 간의 상관관계를 분석하기 위해 DISTLM 분석과 IBM SPSS Statistics (version 25, IBM Corp., Armonk, NY, USA)를 사용하여 유의적 관계를 확인하였다. 본 연구에서 도출된 정량적 실험 자료는 평균 ± 표준오차 (means ± standard error, S.E.)으로 나타냈다. 유의성 검정은 Statistical Analysis System (version 7.1, SAS Institute, Inc., Cary, NC, USA) software를 이용하여 토양곰팡이 군집의 상대적 빈도수를 T-검정을 통해 유의성을 검정하고, 최소유의차 (Least Significant Difference, LSD)는 p < 0.05 수준에서 통계 처리하였다.
결과 및 고찰
1. 천궁 재배지의 토양 이화학성
초작 및 연작 재배지에서 채취한 토양시료의 특성을 분석한 결과, 재배지의 토성은 사양토 (sandy loam)였고, 토양 평균 pH는 6.43 - 7.19로 약산성에서 약알칼리성 토양으로 나타났다 (Table 1).
전기전도도 (EC)는 0.71 - 1.30 ds·m−1, 유기물 함량 (OM)은 24.80 - 27.90 g·kg−1, 유효인산 (Ava. P2O5)은 589.70 - 946.90 ㎎·㎏−1, 칼륨 (potassium, K)은 1.45 - 1.66 cmolc·㎏−1, 칼슘 (calcium, Ca)은 6.28 - 13.10 cmolc·㎏−1, 마그네슘 (magnesium, Mg)은 2.52 - 3.35 cmolc·㎏−1, 나트륨 (sodium, Na)은 0.07 - 0.11 cmolc·㎏−1, 양이온치환용량 (CEC)은 13.30 - 17.50 cmolc·㎏−1으로 나타났다.
천궁 (Cnidium officinale Makino) 재배는 배수가 원활하나 토양 수분함량이 높고, 유기물 함량이 우수한 사양토나 양토 (loam soil)가 적합하다고 하였고, 사토 (sandy), 식양토 (clay loam) 및 식토 (clay)와 비교하여 천궁의 건물중과 종묘의 수가 높게 나타난다고 하였다 (BHHES, 2012). 천궁은 여름철 잎 전체가 말라죽는 고사증상이 나타나는데 이는 천궁 재배지의 토성에 의해 결정되는 만큼 천궁을 재배하기 이전에 토성에 대한 고려는 매우 중요하다고 할 수 있다.
2. 초작 및 연작 재배지의 토양 곰팡이 군집 분석
토양곰팡이 군집 염기서열 분석 데이터는 dataset을 최소 reads 수로 정규화 (normalize)하여 40,015 개의 염기서열 수를 확인하였고, OTUs 수는 초작과 연작 재배지에서 각각 평균 317.4 개, 378.7 개의 OTUs를 확인하였다 (Table 2). 각 시료의 염기서열이 미생물 다양성을 얼마나 대표하는지 나타내는 추정치 (estimator)인 good’s coverage는 두 시료 모두 99.8%로 나타났으며, 이는 시료의 염기서열 reads 수가 통계적으로 충분하다는 것을 의미한다.
초작 및 연작 재배지의 토양시료로부터 토양곰팡이 군집의 계통수를 확인한 결과, 초작과 연작에 따라 총 3 개의 그룹 (group 1: FC2, group 2: FC1, FC3, FC4, group 3: CC1, CC2, CC3, CC4)으로 군집화를 이루는 것을 확인하였고, 초작보다는 연작 재배지의 토양곰팡이 군집이 더 군집화 (clustering)를 이루는 것을 확인하였다 (Fig. 1).
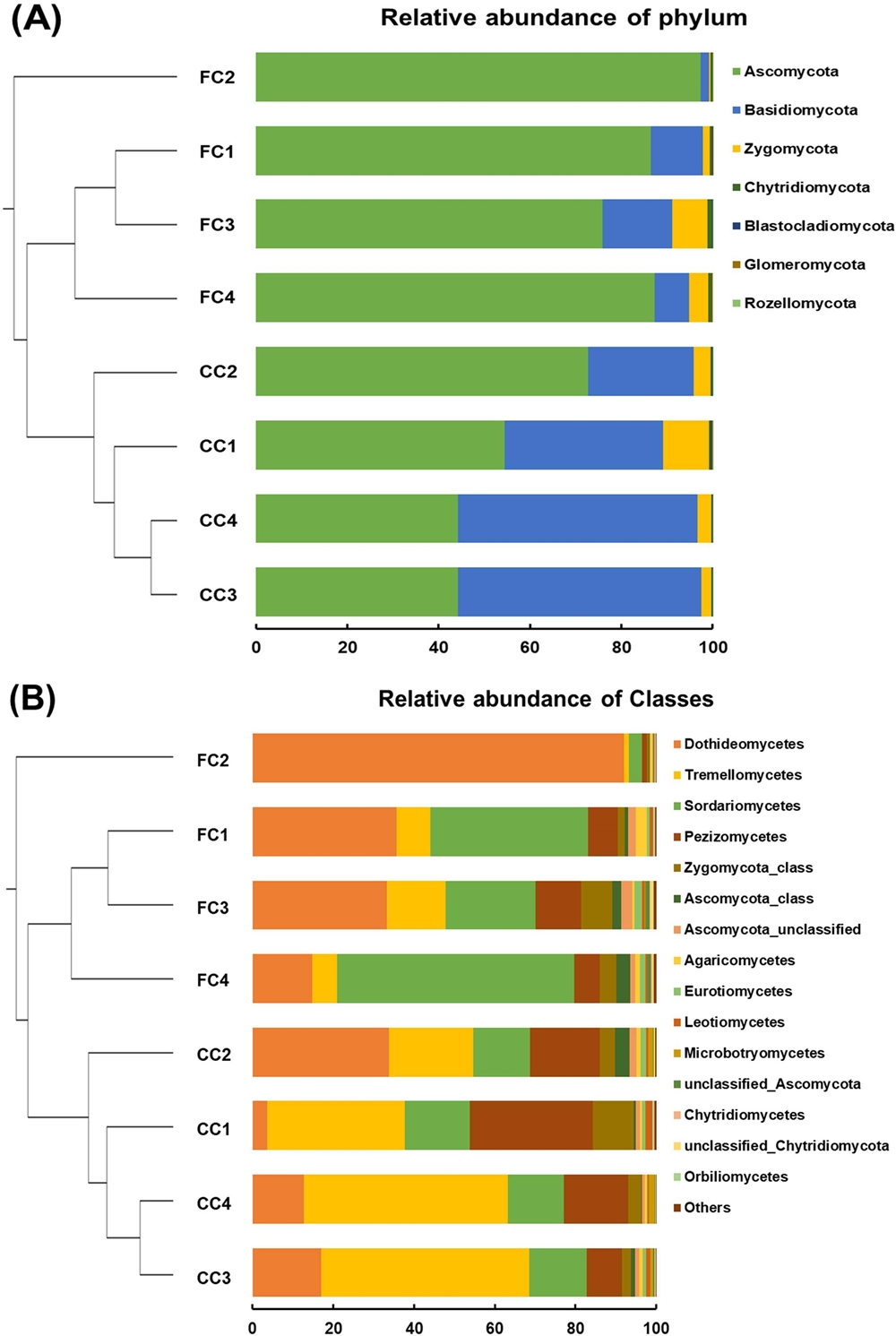
Clustering and relative abundance of fungal community in two different cultivation methods of C. officinale cultivation fields.(A); phylum, (B); class. FC; first cropping, CC; continuous cropping. Relative abundance of the phylum and top 15 classes in the first and continuous cultivation fields using phylotype-based analysis of taxonomy. Others indicate the sum of the relative abundance of all classes except the 15 classes on the figure.
동일작물을 연작재배할 때 양분의 과잉 축적과 결핍, 토양 물리성 악화 등에 의해 토양 미생물상이 변화하여 연작장해의 원인으로 작용하게 된다 (Lee et al., 2018). 본 연구에서도 초작보다는 연작 재배지에서 토양곰팡이 군집이 군집화를 이루는 것은 천궁의 연작재배에 따른 미생물 군집구조의 변화로 판단된다. Yao 등 (2006)은 오이의 시설재배지에서 연작과 윤작이 토양미생물 군집에 미치는 효과를 확인하였는데, 노지재배 토양과 윤작한 토양보다는 연작한 토양미생물 군집의 염기서열이 더 유사한 것으로 확인하였고, Wu 등 (2015)의 연구에서도 바닐라의 초작보다는 연작 재배지의 토양곰팡이 군집이 더 군집화를 이룬다고 보고하였다.
토양곰팡이 군집의 상대적 빈도수를 확인한 결과, Phylum 수준에서 Ascomycota가 전체 평균의 70.3%로 우점종임을 확인하였고, Basidiomycota (24.9%), Zygomycota (4.1%), Chytridiomycota (0.5%) 순으로 상대적 빈도수가 높게 나타났다. Class 수준에서는 Dothideomycetes가 우점종 (30.4%)이었고, Tremellomycetes (23.4%), Sordariomycetes (22.7%), Pezizomycetes (12.4%), Zygomycota_class (4.1%) 순으로 나타났다. 특히 초작 재배지 중 FC2 샘플에서는 Ascomycota와 Dothideomycetes의 상대적 빈도수가 각각 97.3%, 91.9%로 다른 샘플에 비해 높은 것으로 나타났다. 이와 같은 결과는 향후 샘플 반복수를 보다 보완하여 초작 재배지 중에서도 토양 곰팡이 우점종의 상대적 빈도수 차이를 구명하는 연구가 필요할 것으로 판단된다.
초작 및 연작 재배지에 따른 토양곰팡이 군집의 상대적 빈도수를 비교 분석한 결과, Ascomycota (p ≤ 0.001)와 Chytridiomycetes (p ≤ 0.05)는 연작 재배지보다 초작 재배지에서 상대적 빈도수가 유의적으로 높았고, Basidiomycota (p ≤ 0.001)와 Tremellomycetes (p ≤ 0.001)는 연작 재배지에서 유의적으로 높은 것으로 나타났다 (Table 3). 또한 이 중에서 Basidiomycota (담자균)의 속 (genus) 수준에서 초작과 연작에 따른 토양곰팡이 군집의 상위 10 개 속의 평균 OTUs 수를 확인한 결과, Masigobasidium (order: Leucosporidiales), Holtermannia (order: Tremellales), Lepiota (order: Agaricales)와 같은 Basidiomycota 속들이 연작 재배지에서 초작 재배지에 비해 높은 OTUs 수를 보였으며, Mycobank database (www.mycobank.org)로부터 식물병원균 여부를 확인한 결과, 이와 같은 속들은 식물병원성을 보이지 않는 것으로 확인되었다 (Table 4). 이는 재배연수가 증가함에 따라 천궁의 근권에 서식하는 토양곰팡이 군집이 변하는 것으로 판단된다.

Relative abundance of fungal Phylum and Classes between two different Cnidium officinale Makino cultivation fields.

The average OTUs number of top 10 genus of Basidiomycota in two different Cnidium officinale Makino cultivation fields.
Hannula 등 (2012)은 감자 (Solanum tuberosum L.)의 성장단계, 재배연수, 재배지에 따른 토양곰팡이 군집구조를 분석하여, 재배지의 토양곰팡이 군집구조는 감자의 재배연수와 매우 밀접한 관계가 있으며, 그중에서도 Ascomycota와 Basidiomycota는 재배연수와 유의적인 상관관계를 보였다고 하였다. Tang 등 (2015)은 꿀풀과 (Lamiaceae) 약재인 단삼 (Salvia Miltiorrhiza)의 연작 재배연수에 따라 토양곰팡이 군집의 변화를 확인하였는데, 재배연수에 따라 토양곰팡이 군집구조가 변했고, Basidiomycota 계열인 Rhizoctonia와 Psathyrella는 2 년 이상의 연작지에서 우점함을 확인하였다.
Wu 등 (2016) 또한 석죽과 (Caryophyllaceae) 약용식물인 개별꽃 (Pseudostellaria heterophylla)의 연작재배가 토양곰팡이 군집에 미치는 효과를 조사하였는데, 재배연수에 따라 토양곰팡이의 군집화가 뚜렷하게 구분됨을 확인하였고 Ascomycota의 상대적 빈도수가 모든 재배지에서 유의적으로 높아서 우점종이라고 하였다. 선행 연구결과와 본 연구는 유사하며 동일작물의 연작재배가 토양곰팡이 군집에 영향을 준다는 것을 뒷받침하고 있다.
연작에 따른 병원성 토양곰팡이 군집을 확인하기 위해 병해를 일으키는 대표적인 토양병원성 곰팡이인 Colletotrichum, Fusarium, Phytophthora, Pseudocercospora 및 Rhizoctonia의 상대적 빈도수를 확인하였다 (Table 5).

Relative abundance of 3 different pathogenic fungus (genus) between two different Cnidium officinale Makino cultivation fields.
재배지의 병원성 곰팡이 군집의 상대적 빈도수를 비교 분석한 결과, Phytophthora와 Pseudocercospora의 상대적 빈도수는 확인할 수 없었고 Colletotrichum, Fusarium 및 Rhizoctonia는 초작과 연작 재배지에서 모두 확인하였다. 하지만 Colletotrichum과 Rhizoctonia는 초작과 연작 재배지에서 유의적 차이가 없었고, Fusarium은 초작보다는 연작 재배지에서 상대적 빈도수가 유의적으로 높았다.
재배지에서 동일작물을 연작하면 양분의 불균형, 토양 물리성의 악화 및 식물의 독소물질 배출 등으로 인해 토양에 서식하는 미생물이 단순화되면서 병원균이 증식하게 된다 (Kim and Kim, 2002; Park et al., 2011; Lee et al., 2017). 최근까지 고추 (Kwon and Lee, 2002), 콩 (Bai et al., 2015), 생강 (Jung et al., 2015), 옥수수 (Lim et al., 2005), 보리 (Park et al., 2010) 및 인삼 (Shin et al., 2012) 등 다양한 작물의 연작재배에 따른 토양병원균 발병에 관한 연구가 활발히 수행 중이다.
Kim 등 (2010)은 고추의 연작재배에서 역병과 탄저병의 발병이 증가하여 생산량이 심각하게 감소하는 원인으로 보고하였다. 인삼은 연작재배에 따라 병충해가 많고 탄저병과 뿌리썩음병 등의 피해가 크다고 보고하였다 (Kim et al., 2011).
Fusarium은 대표적인 식물 병원균 중 하나로 바나나 (Xiong et al., 2015), 오이 (Zhou and Wu, 2012), 딸기 (Nam et al., 2011), 무 (Baik et al., 2011) 및 토마토 (Park et al., 2013)와 같은 시설작물의 시들음병, 고구마 (Moon et al., 2018)와 수박 (Yang et al., 2016)의 덩굴쪼김병, 약용작물인 작약 (Lee, 2004), 도라지와 더덕 (Kim et al., 2016), 인삼의 뿌리썩음병 (Dong et al., 2016)의 원인이 되는 병원균이고, 연작기간이 증가함에 따라 그 발병 정도도 증가하는 것으로 보고하고 있다. 천궁의 대표적인 병해 중 하나인 Fusarium에 의한 시들음병은 여름철 장마기에 발병하고, 아랫잎의 선단부에 황갈색의 병반이 생겨 지상부가 고사하는 병해이다.
천궁의 병해 연구는 아직 미미하지만, Fusarium 속 병원균의 상대적 빈도수가 연작 재배지에서 유의적으로 높음을 본 연구에서 확인하였다. 이 결과를 바탕으로 향후 천궁의 연작재배에 따른 시들음병 발병과 Fusarium 속 병원균의 상대적 빈도수 간의 상관관계에 관한 연구가 필요할 것으로 판단된다.
3. 천궁 재배지의 토양 곰팡이 군집과 토양 이화학성 간의 상관관계
토양미생물 군집은 서식지 환경요인의 영향을 받는다. 환경요인 중에서도 특히 토양특성은 토양미생물의 생장 및 다양성에 영향을 주는 것으로 알려져 있다 (Wu et al., 2018). 따라서 토양 이화학성과 같은 환경요인과 토양미생물 군집 간의 상관관계 분석은 서식지의 미생물 상을 연구하는 데 필수적이다 (Pettersson, 2004; Kim et al., 2019b).
본 연구에서는 천궁 재배지의 토양 이화학성이 토양곰팡이 군집의 군집화에 미치는 영향을 확인하기 위해 주좌표 분석 (PCoA analysis)과 DISTLM 분석을 통해 토양 이화학성과 토양곰팡이 군집 간의 상관관계를 확인하였다. 주좌표 분석에서는 Bray-Curtis similarity를 이용하여 토양곰팡이 군집의 염기서열 간의 유사성을 ordination하여 나타냈고, 토양 이화학성은 각 축에 대한 상관계수를 통해 표시하였다 (Fig. 2).
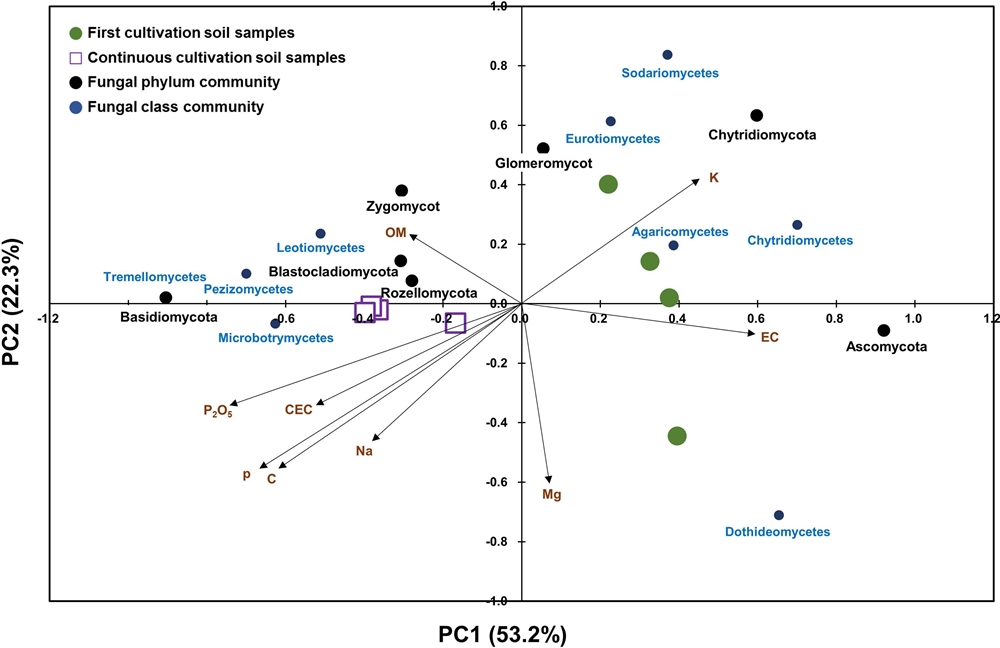
The ordination plot shown the soil samples, phylum an classes communities and soil parameters according to their fungal community composition obtained from principal coordinate analysis (PCoA analysis) based on Bray-Curtis dissimilarity matrix.The correlation between soil parameters and two axes are represented by the length and angle of the arrows.
토양곰팡이 군집은 초작과 연작 재배지에 따라 구분되어 나타났고, Ascomycota는 초작 재배지에서, Basidiomycota는 연작 재배지에서 우점하는 것으로 나타났다. 주좌표 분석의 각축 (PC1, PC2)에 대한 수치 (%)는 토양곰팡이 군집의 변화량 (variation)을 말하며, 좌표에 있는 토양 이화학성은 종 (ordinate) 또는 횡 (abscissa)으로 나누는 토양곰팡이 군집과의 연관성을 가진다. 따라서 PC1의 변화량 (53.2%)이 PC2의 변화량 (22.3%)보다 높다는 것은 종좌표에 위치한 토양 이화학성이 횡좌표에 위치한 요인보다 토양곰팡이 군집에 더 영향을 준다는 것을 의미한다. 본 연구에서는 종좌표에 위치한 유효인산, pH, 치환성 칼슘, 치환성 칼륨, 전기전도도가 횡좌표에 위치한 다른 토양 이화학성보다 토양곰팡이 군집에 영향을 주는 것으로 판단된다.
토양곰팡이 군집과 토양 이화학성 간의 유의적인 상관관계를 확인하기 위해 DISTILM 분석을 진행하였다 (Table 6). 토양곰팡이 군집과 토양 이화학성 각각의 유의적인 관계를 marginal test로 확인한 결과, 치환성 칼슘 (p = 0.0170), pH (p = 0.0221) 및 유효인산 (p = 0.0314)의 유의적인 상관관계를 확인하였다. 또한, 전체 토양 이화학성 중 어떤 요인이 토양곰팡이 군집에 영향을 주는지 sequential test를 통해 확인하였다. 치환성 칼슘 (p = 0.0170)이 토양곰팡이 군집에 가장 큰 유의적 영향을 주었고, 그다음은 pH (p = 0.0403)였다.

Marginal and sequential tests of DISTLM on relation of soil parameters variables to the fungal community of soil samples.
토양곰팡이 군집 중, 초작과 연작 재배지 간의 유의적인 차이를 Ascomycota, Chytridiomycetes 및 Basidiomycota 계통에서 확인하였고 Pearson 상관관계 분석을 통해 이들 계통의 군집과 토양 이화학성 간에 pH, 유효인산 및 치환성 칼슘이 유의적인 영향을 주는 것을 알 수 있었다 (Table 7). 토양 pH는 각 재배지 우점종과 유의적인 상관관계를 확인할 수 없었고, 유효인산은 Ascomycota와 Chtridiomycete 군집과 유의적인 부의 상관관계를 보인 반면, Basidiomycota 군집과는 유의적인 정의 상관관계를 보였다. 치환성 칼슘은 유효인산과 유사한 결과를 보였는데, Ascomycota (phylum)과는 유의적인 부의 상관관계, Cystofilobasidiaceae (Basidiomycota_family)와는 유의적인 정의 상관관계를 확인하였다.

Pearson’s correlation analysis between relative abundance of fungal communities (Ascomycota, Basidiomycota, Chytridiomycetes) and soil properties (pH, available P2O5, exchangeable Ca) in soil samples.
토양 이화학성이 토양곰팡이의 다양성과 군집에 중요한 역할을 한다는 연구는 최근까지도 활발히 진행되고 있다 (Ullah et al., 2019; Yao et al., 2019; Zhang et al., 2019a). 이 중에서 토양 유효인산은 ATP 생성, 핵산 및 인지질 합성 등에 관여하여 토양미생물 군집구조에 큰 영향을 주는 토양요인이다 (Atlas and Bartha, 1998; de Forest and Scott, 2010). Li 등 (2020)은 차나무 (Camellia sinensis L.)의 연작에 따른 토양 이화학성이 토양곰팡이 군집에 미치는 영향을 분석하였는데, Ascomycota와 토양 유효인산이 유의적인 부의 상관관계를 가진다고 하였다. Zhang 등 (2019b)은 토양곰팡이 군집중에서 Basidiomycota 계통의 군집이 토양 유효인산과 유의적인 양의 상관관계를 보인다고 하여 본 연구의 토양 유효인산과 우점종 간의 상관관계 결과를 뒷받침하고 있다.
토양 pH 또한 미생물의 서식에서 가장 중요한 요인 중의 하나로 (Wu et al., 2017), Rousk 등 (2010)은 토양 pH 수준에 따라 토양곰팡이의 다양성과 군집이 변화한다고 보고하였다. Yang 등 (2019)은 토양 pH, 칼슘, 탄소, 탄질비 (C/N ratio) 및 인산과 같은 토양특성이 곰팡이의 종 풍부도 (richness)에 영향을 준다고 보고하였고, 토양 내 치환성 칼슘은 대표적인 곰팡이인 외생균근 (ectomycorrhizae, ECM)의 군집 조성에 중요한 역할을 한다고 알려져 있다 (Gustafson and Casper, 2004; Põlme et al., 2013), Monfort-Salvador 등 (2015)은 토양 내 pH와 Ca 이온의 증가로 토양 내 서식하는 대표적인 곰팡이인 외생균근의 군집이 변화한다고 하였다. 이러한 선행연구는 천궁 재배지의 토양곰팡이 군집과 토양특성 간의 상관관계에 관한 결과를 뒷받침할 수 있을 것이다.
본 연구결과는 천궁 재배지의 토양곰팡이 군집 연구에 관한 기초연구 자료로 활용할 수 있을 것이고, 향후 천궁 외에도 약용작물 재배지의 연작에 따른 토양특성과 토양곰팡이 군집간의 상관관계를 구명하는 데 중요한 정보를 제공할 수 있을 것으로 판단된다.
Acknowledgments
본 연구는 산림청 국립산림과학원 연구개발사업(과제번호: FE0702-2018-02)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
REFERENCES
-
Alami MM, Xue J, Ma Y, Zhu D, Abbas A, Gong Z and Wang X. (2020). Structure, function, diversity and composition of fungal communities in rhizospheric soil of Coptis chinensis Franch under a successive cropping system. Plants. 9:244. https://www.mdpi.com/2223-7747/9/2/244/htm, (cited by 2020 March 18).
[https://doi.org/10.3390/plants9020244]

- Atlas R and Bartha R. (1998). Microbial ecology: Fundamentals and application. (4th ed.). Benjamin and Cummings Science Publishing. San Francisco, CA, USA. p.322-323.
-
Avidano L, Gamalero E, Cossa GP and Carraro E. (2005). Characterization of soil health in an Italian polluted site by using microorganisms as bioindicators. Applied Soil Ecology. 30:21-33.
[https://doi.org/10.1016/j.apsoil.2005.01.003]

-
Bai L, Cui J, Jie W and Cai B. (2015). Analysis of the community compositions of rhizosphere fungi in soybeans continuous cropping fields. Microbiological Research. 180:49-56.
[https://doi.org/10.1016/j.micres.2015.07.007]

- Baik SY, Jang KS, Choi YH, Kim JC and Choi GJ. (2011). Resistance degree of radish cultivars to Fusarium oxysporum f. sp. raphani according to several conditions. Korean Journal of Horticultural Science and Technology. 29:48-52.
-
Bell TH, Yergeau E, Maynard C, Juck D, Whyte LG and Greer CW. (2013). Predictable bacterial composition and hydrocarbon degradation in Arctic soils following diesel and nutrient disturbance. ISME Journal. 7:1200-1210.
[https://doi.org/10.1038/ismej.2013.1]

-
Berg G and Smalla K. (2009). Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere. FEMS Microbiology Ecology. 68:1-13.
[https://doi.org/10.1111/j.1574-6941.2009.00654.x]

- Bonghwa Highand Herbs Experimental Station(BHHES). (2012). The study on highland herbs. Bonghwa Highand Herbs Experimental Station. Bonghwa, Korea. p.26-27.
-
Bridge P and Spooner B. (2001). Soil fungi: Diversity and detection. Plant and Soil. 232:147-154.
[https://doi.org/10.1023/A:1010346305799]

-
Chen M, Li X, Yang Q, Chi X, Pan L, Chen N, Yang Z, Wang T, Wang M and Yu S. (2012). Soil eukaryotic microorganism succession as affected by continuous cropping of peanut-pathogenic and beneficial fungi were selected. PLoS One. 7:e40659. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3393692/, (cited by 2020 March 18).
[https://doi.org/10.1371/journal.pone.0040659]

-
de Forest JL and Scott LG. (2010). Available organic soil phosphorus has an important influence on microbial community composition. Soil Science Society in American Journal. 74: 2059-2066.
[https://doi.org/10.2136/sssaj2009.0426]

-
Dong L, Xu J, Feng G, Li X and Chen S. (2016). Soil bacterial and fungal community dynamics in relation to Panax notoginseng death rate in a continuous cropping system. Scientific Reports. 6:31802. https://www.nature.com/articles/srep31802, (cited by 2020 March 18).
[https://doi.org/10.1038/srep31802]

-
Gomes NCM, Fagbola O, Costa R, Rumjanek NG, Buchner A, Mendona-Hagler L and Smalla K. (2003). Dynamics of fungal communities in bulk and maize rhizosphere soil in the tropics. Applied and Environmental Microbiology. 69:3758-3766.
[https://doi.org/10.1128/AEM.69.7.3758-3766.2003]

-
Gustafson DJ and Casper BB. (2004). Nutrient addition affects AM fungal performance and expression of plant/fungal feedback in three serpentine grasses. Plant and Soil. 259:9-17.
[https://doi.org/10.1023/B:PLSO.0000020936.56786.a4]

-
Hannula SE, de Boer W and van Veen J. (2012). A 3-year study reveals that plant growth stage, season and field site affect soil fungal communities while cultivar and GM-trait have minor effects. PLoS ONE. 7:e33819. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3328480/, (cited by 2020 March 18).
[https://doi.org/10.1371/journal.pone.0033819]

- Jeong JH, Lee KS and So JD. (1991). Effects of phytotoxins on change of pH in the continuous cropping soil. Korean Journal of Soil Science and Fertilizer. 24:17-21.
-
Jung CR, Jeong DH, Park HW, Kim HJ, Jeon KS and Yoon JB. (2019). Molecular identification of thrips in two medicinal crops, Cnidium officinale Makino and Ligusticum chuanxiong Hort. Korean Journal of Medicinal Crop Science. 27:17-23.
[https://doi.org/10.7783/KJMCS.2019.27.1.17]

-
Jung YJ, Nou IS, Kim YK and Kang KK. (2015). Effect of green manure crops incorporation for reduction of Pythium zingiberum in ginger continuous cultivation. Korean Journal of Plant Resource. 28:271-278.
[https://doi.org/10.7732/kjpr.2015.28.2.271]

- Kang SW, Yeon BY, Hyeon GS, Bae YS, Lee SW and Seong NS. (2007). Changes of soil chemical properties and root injury ratio by progress years of post-harvest in continuous cropping soils of ginseng. Korean Journal of Medicinal Crop Science. 15:157-161.
-
Kim CH and Kim YK. (2002). Present status of soilborne disease incidence and scheme for its integrated management in Korea. Research in Plant Disease. 8:146-161.
[https://doi.org/10.5423/RPD.2002.8.3.146]

-
Kim DR, Gang GH, Jung HJ, Hong SW and Kwak YS. (2016). Effect of culture conditions on the chemical control efficacy of root rot disease of Platycodon grandiflorum and Codonopsis lanceolata. Korean Journal of Pesticide Science. 20:165-171.
[https://doi.org/10.7585/kjps.2016.20.2.165]

-
Kim JG, Park HR, Yang KW, Kim SS, Kwon CH, Jeong YH and Hur JH. (2011). Processing and reducing factors of difenoconazole during ginseng processing. Korean Journal of Food Science and Technology. 43:263-270.
[https://doi.org/10.9721/KJFST.2011.43.3.263]

-
Kim KY, Han KM, Kim HJ, Jeon KS, Kim CW and Jung CR. (2020). The study of soil chemical properties and soil bacterial communities on the cultivation systems of Cnididum officinale Makino. Korean Journal of Environmental Agriculture. 39:1-9.
[https://doi.org/10.5338/KJEA.2020.39.1.1]

-
Kim KY, Samaddar S, Chatterjee P, Krishnamoorthy R, Jeon SY and Sa TM. (2019a). Structural and functional responses of microbial community with respect to salinity levels in a coastal reclamation land. Applied Soil Ecology. 137:96-105.
[https://doi.org/10.1016/j.apsoil.2019.02.011]

-
Kim KY, Um YR, Jeong DH, Kim HJ, Kim MJ and Jeon KS. (2019b). Study on the correlation between the soil bacterial community and growth characteristics of wild-simulated ginseng (Panax ginseng C. A. Meyer). Korean Journal of Environmental Biology. 37:380-388.
[https://doi.org/10.11626/KJEB.2019.37.3.380]

-
Kim ST, Ahn MI and Yun SC. (2010). Evaluation of anthracnose forecaster of an integrated pest management system on hot pepper in the fields. Research in Plant Disease. 16:66-73.
[https://doi.org/10.5423/RPD.2010.16.1.066]

-
Kwon CS and Lee SG. (2002). Occurrence and ecological characteristics of red pepper Anthracnose. Research in Plant Disease. 8:120-123.
[https://doi.org/10.5423/RPD.2002.8.2.120]

-
Lauber CL, Strickland MS, Bradford MA and Fierer N. (2008). The influence of soil properties on the structure of bacterial and fungal communities across land-use types. Soil Biology and Biochemistry. 40:2407-2415.
[https://doi.org/10.1016/j.soilbio.2008.05.021]

-
Lee SG. (2004). Fusarium species associated with ginseng(Panax ginseng) and their role in the root-rot of ginseng plant. Research in Plant Disease. 10:248-259.
[https://doi.org/10.5423/RPD.2004.10.4.248]

- Lee SW, Lee SH, Seo MW, Park KH and Jang IB. (2018). Effects of irrigation and ginseng root residue on root rot disease of 2-years-old ginseng and soil microbial community in the continuous cropping soil of ginseng. Korean Journal of Medicinal Crop Science. 26:345-353.
-
Lee SW, Park KH, Lee SH, Jang IB and Jin ML. (2017). Effect of green manure crop cultivation on soil chemical properties and root rot disease in continuous cropping field of ginseng. Korean Journal of Medicinal Crop Science. 25:1-9.
[https://doi.org/10.7783/KJMCS.2017.25.1.1]

-
Li Y, Li Z, Arafat Y and Lin X. (2020). Studies on fungal communities and functional guilds shift in tea continuous cropping soils by high-throughput sequencing. Annals of Microbiology. 70:7. (cited by 2019 May 18).
[https://doi.org/10.1186/s13213-020-01555-y]

-
Lim KB, Lee HJ, Ahn BS, Sung BR and Shin JS. (2005). Introducing strip cropping for decreasing the damage of the continuous corn cultivation. Journal of the Korean Society of Grassland Science. 25:97-104.
[https://doi.org/10.5333/KGFS.2005.25.2.097]

-
Manici LM, Kelderer M, Franke-Whittel IH, Rühmer T, Baab G, Nicoletti F, Caputo F, Topp A, Insam H and Naef A. (2013). Relationship between root-endophytic microbial communities and replant disease in specialized apple growing areas in Europe. Applied Soil Ecology. 72:207-214.
[https://doi.org/10.1016/j.apsoil.2013.07.011]

-
Mazzola M and Manici LM. (2012). Apple replant disease: Role of microbial ecology in cause and control. Annual Review of Phytopathology. 50:45-65.
[https://doi.org/10.1146/annurev-phyto-081211-173005]

- Ministry of Agriculture, Food and Rural Affairs(MAFRA). (2018). Production performance of industrial drops. Ministry of Agriculture, Food and Rural Affairs. Sejong, Korea. p.8-22.
-
Mondal F, Asaduzzaman, Kobayashi Y, Ban T and Asao T. (2013). Recovery from autotoxicity in strawberry by supplementation of amino acids. Scientia Horticulturae. 164:137-144.
[https://doi.org/10.1016/j.scienta.2013.09.019]

-
Monfort-Salvador I, García-Montero LG and Grande MA. (2015). Impact of calcium associated to calcareous amendments on ectomycorrhizae in forests: A review. Journal of Soil Science and Plant Nutrition. 15:217-231.
[https://doi.org/10.4067/S0718-95162015005000018]

- Moon JY, Min BK, Shin JH, Choi YC, Cho HJ, Lee YH, Lee JG and Heo JY. (2018). Effect of curing treatments on the Fusarium Wilt(Fusarium oxysporum) of Sweet potato(Ipomoea batatas L.). Korean Journal of Soil Science and Fertilizer. 51:247-254.
- Nam MH, Kang YJ, Lee IH, Kim HG and Chun CH. (2011). Infection of daughter plants by Fusarium oxysporum f. sp. fragariae through runner propagation of strawberry. Korean Journal of Horticultural Science and Technology. 29:273-277.
-
Nayyar A, Harmel C, Lafond G, Gossen BD, Hason K and Germida J. (2012). Soil microbial quality associated with yield reduction in continuous-pea. Applied Soil Ecology. 43:115-121.
[https://doi.org/10.1016/j.apsoil.2009.06.008]

- Oh YJ, Seo HR, Choi YM and Jung DS. (2010). Evaluation of antioxidant activity of the extracts from the aerial parts of Cnidium officinale Makino. Korean Journal of Medicinal Crop Science. 18:373-378.
-
Park JC, Noh TH, Kim MJ, Lee SB, Park CS, Kang CS, Lee JJ and Kim TS. (2010). Effect of cropping system on disease incidence by soil-borne Bymovirus in barley and on density of the vector, Polymyxa graminis. Research in Plant Disease. 16:115-120.
[https://doi.org/10.5423/RPD.2010.16.2.115]

-
Park JH, Seo YJ, Choi SY, Zhang YS, Ha SK and Kim JE. (2011). Soil physico-chemical properties and characteristics of microbial distribution in the continuous cropped field with Paeonia lactiflora. Korean Journal of Soil Science and Fertilizer. 44:841-846.
[https://doi.org/10.7745/KJSSF.2011.44.5.841]

-
Park MS, Jang KS, Choi YH, Kim JC and Choi GJ. (2013). Simple mass-screening methods for resistance of tomato to Fusarium oxysporum f. sp. lycopersici. Korean Journal of Horticultural Science and Technology. 31:110-116.
[https://doi.org/10.7235/hort.2013.12134]

- Pettersson M. (2004). Factors affecting the rates of change in soil bacterial communities. Ph. D. Thesis. Lund University. Lund, Sweden. p.1-43.
-
Põlme S, Bahram M, Yamanaka T, Nara K, Dai YC, Grebenc T, Kraigher H, Toivonen M, Wang PH, Matsuda Y, Naadel T, Kennedy PG, Kõljalg U and Tedersoo L. (2013). Biogeography of ectomycorrhizal fungi associated with alders (Alnus spp.) in relation to biotic and abiotic variables at the global scale. New Phytologist. 198:1239-1249.
[https://doi.org/10.1111/nph.12170]

-
Rousk J, Bååth E, Brookes PC, Lauber CL, Lozupone C, Caporaso JG, Knight R and Fierer N. (2010). Soil bacterial and fungal communities across a pH gradient in an arable soil. The ISME Journal. 4:1340-1351.
[https://doi.org/10.1038/ismej.2010.58]

- Rural Development Administration(RDA). (2013). Analysis manual of comprehensive examination laboratory(soil, plant, water and liquid manure). Rural Development Administration. Suwon, Korea. p.31-53.
-
Schloss PD, Westcott SL, Ryabin T, Hall JR, Hartmann M, Hollister EB, Lesniewski RA, Oakley BB, Parks DH, Robinson CJ, Sahl JW, Stres B, Thallinger GG, Van Horn DJ and Weber CF. (2009). Introducing mothur: Open source, platform-independent, community-supported software for describing and comparing microbial communities. Applied and Environmental Microbiology. 75:7537-7541.
[https://doi.org/10.1128/AEM.01541-09]

- Seo YJ, Nam HH, Jang WC, Kim JS and Lee BY. (2018). Effect of meteorological factors on evapotranspiration change of Cnidium officinale Makino. Korean Journal of Agricultural and Forest Meteorology. 20:366-375.
-
Shin JH, Yun BD, Kim HJ, Kim SJ and Chung DY. (2012). Soil environment and soil-borne plant pathogen causing root rot disease of ginseng. Korean Journal of Soil Science and Fertilizer. 45:370-376.
[https://doi.org/10.7745/KJSSF.2012.45.3.370]

-
Singh BK, Munro S, Reid E, Ord B, Potts M, Paterson E and Millard P. (2006). Investigating microbial community structure in soils by physiological, biochemical and molecular fingerprinting methods. European Journal of Soil Science. 57:72-82.
[https://doi.org/10.1111/j.1365-2389.2005.00781.x]

-
Tan Y, Cui Y, Li H, Kuang A, Li X, Wei Y and Ji X. (2017). Rhizospheric soil and root endogenous fungal diversity and composition in response to continuous Panax notoginseng cropping practices. Microbiological Research. 194:10-19.
[https://doi.org/10.1016/j.micres.2016.09.009]

-
Tang J, Xue Z, Daroch M and Ma J. (2015). Impact of continuous Salvia miltiorrhiza cropping on rhizosphere actinomycetes and fungi communities. Annals of Microbiology. 65:1267-1275.
[https://doi.org/10.1007/s13213-014-0964-2]

-
Ullah S, Ai C, Ding W, Jiang R, Zhao S, Zhang J, Zhou W, Hou Y and He P. (2019). The response of soil fungal diversity and community composition to long-term fertilization. Applied Soil Ecology. 140:35-41.
[https://doi.org/10.1016/j.apsoil.2019.03.025]

-
Walkley A and Black IA. (1934). An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method. Soil Science. 37:29-38.
[https://doi.org/10.1097/00010694-193401000-00003]

-
Wei X, Wang X, Cao P, Gao Z, Chen AJ and Han J. (2020). Microbial community changes in the rhizosphere soil of healthy and rusty Panax ginseng and discovery of pivotal fungal genera associated with rusty roots. BioMed Research International. 2020:8018525. https://www.hindawi.com/journals/bmri/2020/8018525/, (cited by 2020 March 18).
[https://doi.org/10.1155/2020/8018525]

-
Wu L, Chen J, Wu H, Wang J, Wu Y, Lin S, Khan MU, Zhang Z and Lin W. (2016). Effects of consecutive monoculture of Pseudostellaria heterophylla on soil fungal community as determined by pyrosequencing. Scientific Reports. 6:26601. https://www.nature.com/articles/srep26601, (cited by 2020 Jan 7).
[https://doi.org/10.1038/srep26601]

-
Wu L, Wang H, Zhang Z, Lin R, Zhang Z and Lin W. (2011). Comparative metaproteomic analysis on consecutively Rehmannia glutinosa-monocultured rhizosphere soil. PLoS ONE. 6:e20611. (cited by 2020 Jan 22).
[https://doi.org/10.1371/journal.pone.0020611]

-
Wu Y, Zeng J, Zhu Q, Zhang Z and Lin X. (2017). pH is the primary determinant of the bacterial community structure in agricultural soils impacted by polycyclic aromatic hydrocarbon pollution. Scientific Reports. 7:40093. https://www.nature.com/articles/srep40093, (cited by 2020 Jan 2).
[https://doi.org/10.1038/srep40093]

-
Wu Z, Liu Q, Li Z, Cheng W, Sun J, Guo Z, Li Y, Zhou J, Meng D, Li H, Lei P and Yin H. (2018). Environmental factors shaping the diversity of bacterial communities that promote rice production. BMC Microbiology. 18:51. https://bmcmicrobiol.biomedcentral.com/articles/10.1186/s12866-018-1174-z, (cited by 2020 Feb 3).
[https://doi.org/10.1186/s12866-018-1174-z]

-
Xiong W, Zhao Q, Zhao J, Xun W, Li R, Zhang R, Wu H and Shen Q. (2015). Different continuous cropping spans significantly affect microbial community membership and structure in a vanilla-grown soil as revealed by deep pyrosequencing. Microbial Ecology. 70:209-218.
[https://doi.org/10.1007/s00248-014-0516-0]

-
Yang R, Mo Y, Liu C, Wang Y, Ma J, Zhang Y, Li H and Zhang X. (2016). The effects of cattle manure and garlic rotation on soil under continuous cropping of watermelon (Citrullus lanatus L.). PLoS ONE 11:e0156515. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4892587/, (cited by 2020 Jan 22).
[https://doi.org/10.1371/journal.pone.0156515]

-
Yang T, Tedersoo L, Soltis PS, Soltis DE, Gilbert JA, Sun M, Shi Y, Wang Y, Li Y, Zhang J, Chen Z, Lin H, Zhao H, Fu C and Chu H. (2019). Phylogenetic imprint of woody plants on the soil mycobiome in natural mountain forests of eastern China. ISME Journal. 13:686-697.
[https://doi.org/10.1038/s41396-018-0303-x]

-
Yao HY, Jiao XD and Wu FZ. (2006). Effects of continuous cucumber cropping and alternative rotations under protected cultivation on soil microbial community diversity. Plant and Soil. 284:195-203.
[https://doi.org/10.1007/s11104-006-0023-2]

-
Yao Q, Xu Y, Liu X, Liu J, Huang X, Yang W, Yang Z, Lan L, Zhou J and Wang G. (2019). Dynamics of soil properties and fungal community structure in continuous-cropped alfalfa fields in Northeast China. PeerJ. 7:e7127. https://peerj.com/articles/7127/, (cited by 2020 March 18).
[https://doi.org/10.7717/peerj.7127]

-
Yergeau E, Lawrence JR, Sanschagrin S, Walser MJ, Korber DR and Greer CW. (2012). Next-generation sequencing of microbial communities in the Athabasca River and its tributaries in relation to oil sands mining activities. Applied and Environmental Microbiology. 78:7626-7637.
[https://doi.org/10.1128/AEM.02036-12]

-
Zhang M, Wang N, Zhang J, Hu Y, Cai D, Guo J, Wu D and Sun G. (2019a). Soil physicochemical properties and the rhizosphere soil fungal community in a Mulberry(Morus alba L.) / Alfalfa(Medicago sativa L.) intercropping system. Forests. 10:167. https://www.mdpi.com/1999-4907/10/2/167, (cited by 2020 March 18).
[https://doi.org/10.3390/f10020167]

-
Zhang T, Wang Z, Lv X, Li Y and Zhuang L. (2019b). High-throughput sequencing reveals the diversity and community structure of rhizosphere fungi of Ferula Sinkiangensis at different soil depths. Scientific Reports. 9:6558. (cited by 2020 May 18).
[https://doi.org/10.1038/s41598-019-43110-z]

-
Zhou X and Wu F. (2012). Dynamics of the diversity of fungal and Fusarium communities during continuous cropping of cucumber in the greenhouse. FEMS Microbiology Ecology. 80:469-478.
[https://doi.org/10.1111/j.1574-6941.2012.01312.x]

-
Zhou X, Gao D, Liu J, Qiao P, Zhou X, Lu H, Wu X, Liu D, Jin X and Wu F. (2014). Changes in rhizosphere soil microbial communities in a continuously monocropped cucumber(Cucumis sativus L.) system. European Journal of Soil Biology. 60:1-8.
[https://doi.org/10.1016/j.ejsobi.2013.10.005]

-
Zhou X, Yu G and Wu F. (2012). Soil phenolics in a continuously mono-cropped cucumber(Cucumis sativus L.) system and their effects on cucumber seedling growth and soil microbial communities. European Journal of Soil Science. 63:332-340.
[https://doi.org/10.1111/j.1365-2389.2012.01442.x]
