
화장품 소재로서의 꽃 10 종 에탄올추출물 생리활성 특성연구
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
We investigated the antioxidant, anti-wrinkles, whitening, and moisturizing properties and amounts of phenolic compounds of ethanol extracts from flowers of 10 resource plants from Namwon and Mt. Jiri., Korea.
We measured antioxidant efficacy based on the total polyphenol, and total flavonoid content, and the 2,2-diphenyl-1-picrylhydrazyl (DPPH) assay. We evaluated the inhibitory effect on melanin synthesis and tyrosinase activity for the whitening effect. Furthermore, we analyzed the elastase and matrix metalloproteinase-1 (MMP-1) inhibition activity for anti-wrinkle capacity. To evaluate the moisturizing effect, we examined hyaluronan synthase (HAS) mRNA expression. In addition, the 19 phenolic compounds were detected using high performace liquid chromatography (HPLC). Among the 10 flowers, the antioxidant effect was high in the order of Rosa multiflora, Nelumbo nucifera, and Elsholtzia splendens. Whitening effect was high in the order of N. nucifera, R. multiflora, and Dendranthema zawadskii. As for the anti-wrinkle property, N. nucifera was the most effective followed by R. multiflora. Taraxacum coreanum was the best for moisturizing effect, followed by D. zawadskii, and E. splendens. Seven phenolic compounds were detected in the extracts of the 10 flowers.
Overall, the extracts of five flowers extracts showed strong potential as antioxidant, whitening, anti-wrinkle, and moisturizing functional cosmetic agents.
Keywords:
Flower, Antioxidant Activity, Whitening Effect, Anti-wrinkle Effect, Moisturizing Effect서 언
지리산국립공원은 1967년 12월 29일 우리나라 최초로 제 1호 국립공원으로 지정되었으며, 육상 국립공원 중 면적 (485 ㎢)이 가장 넓고 자연생태계, 경관, 역사와 문화자원의 가치가 뛰어난 곳이다. 지리산은 노고단 (1,507 m)에서 천왕봉 (1,915 m)까지 주능선이 동서로 길게 뻗어 있으며, 행정구역상으로는 전남 구례군, 전북 남원시, 경남 산청군, 함양군, 하동군 3 개의 도 1 개의 시 4 개의 군에 걸쳐 있다. 지리산국립공원은 천왕봉을 기점으로 난대림에서 한대림에 이르기까지 다양한 기후대를 나타내고 있어 다양한 식물 군집과 식생을 나타내고 있으며, 우리나라 전체 식물의 30%인 1,526 종의 식물이 서식하고 있다 (Jung et al., 2016). 본 연구는 남원 및 지리산 권역에서 재배하여 채취 및 수확된 자원식물을 대상으로 천연 화장품 소재로서의 특성 및 활용 가능성을 분석하였다.
최근 화장품 원료의 안전성과 건강에 대한 소비자 의식 증가로 인해 친환경적인 천연원료 화장품에 대한 욕구가 높아감에 따라 생물자원 유래 화장품 원료 개발이 활발히 추진되고 있다. 또한 나고야의정서가 발효됨에 따라 해외 자원 의존성이 높은 화장품 바이오소재 분야의 장기적 경쟁력 제고를 위하여 수입 의존도가 높은 화장품 기초소재의 국산화 및 나고야 의정서 대응 자생 천연 생물자원 화장품 소재 국산화가 시급한 실정이다.
현대인들의 피부 건강에 대한 관심과 욕구가 증가함에 따라 자연 발생에 의한 내인성 피부 노화뿐만 아니라 자외선, 공기 등 환경에 의한 외인성 피부 노화를 지연시키고 건강한 피부를 유지하기 위해 화장품 천연소재 개발 연구가 활발히 진행되고 있다 (Kim et al., 2018a).
피부는 미생물이나 물리화학적 외부환경으로부터 신체 내부를 보호하는 장벽으로서의 역할을 수행할 뿐만 아니라 주름형성과 색소침착에 연관되어 있으며 면역 기능을 수행하고 있다 (Ha et al., 2011). 또한 수분을 함유하고 있어 피부 보습을 증가시키고 수분의 증발을 막아 건강하고 탄력 있는 피부 유지 및 피부 노화를 방지한다 (Kim et al., 2011a). 하지만 과도한 자외선과 대기오염, 온도 등의 외부 환경은 피부 내 산화적 스트레스를 발생시키고 (Wlaschek et al., 2001), 이는 피부 조직을 손상시켜 외인성 노화 과정을 촉진하는 것으로 보고되어 있다 (Marchiori et al., 2017).
한편, 천연물에 포함되어있는 수많은 phenolic compounds 및 flavonoids 성분들은 항산화, 미백, 주름, 보습에 효과가 있다고 알려져 있다 (Garg et al., 2017; Panzella and Napolitano, 2019). 따라서, 피부조직의 손상 및 외인성 노화를 예방하기 위하여 항산화, 미백, 주름 개선, 보습 기능이 있는 천연 기능성 화장품에 대한 소비자의 요구가 증가하고 있으며, 이에 따라 천연물을 이용한 화장품 소재로서의 가능성에 대한 연구가 필요한 실정이다.
본 연구에서는 남원·지리산권 자원식물 중 화장품적 요소인 이미지가 아름다운 꽃 10 종의 항산화, 미백, 주름, 보습 활성 및 19 종의 phenolic compounds 성분 함량을 측정하여 화장품 소재 이용 가능성을 조사하였다.
재료 및 방법
1. 실험재료
본 연구에서 사용한 꽃 10 종은 2018년 4월에서 11월 사이에 전라북도 남원시 일대에서 채취하여 사용하였으며, 사용 부위는 꽃을 사용하였다. 채취한 꽃은 40℃에서 72 시간 건조 (LD9013, L’EQUIP, Seoul, Korea)한 후 4℃에서 보관하면서 실험에 사용하였다.
실험에 사용한 꽃 10 종의 시즌, 식물명, 학명, 사용부위, 채취시기 및 채취지역은 Table 1과 같다. 계절로 구분하면 봄은 왕벚나무 (Prunus yedoensis Matsum), 복사나무 [Prunus persica (L.) Batsch], 흰민들레 (Taraxacum coreanum Nakai), 저먼캐모마일 (Matricaria chamomilla L.), 찔레꽃 (Rosa multiflora Thunb.), 여름에는 연꽃 (Nelumbo nucifera Gaertn.), 가을은 꽃향유 (Elsholtzia splendens Nakai), 산구절초 [Dendranthema zawadskii (Herb.) Tzvelev], 감국 [Dendranthema indicum (L.) Des Moul.], 국화 (Chrysanthemum morifolium Ramat.)이다.
2. 에탄올 추출물 제조
건조된 꽃을 분쇄기 (HMF-3600TG, Hanil, Seoul, Korea)를 이용하여 분쇄한 후 100 g에 50% 에탄올 2ℓ를 혼합하고 80℃에서 4 시간동안 추출하였다. 추출물은 부직포와 종이 여과지를 이용하여 2 회 여과하였으며, 여과된 추출물은 감압 농축기 (R-100, BÜCHI, Flawil, Switzerland)를 이용하여 60 ℃에서 농축하고, 동결건조기 (MCFD8508, IlshinBiobase Co., Ltd., Dongducheon, Korea)를 이용하여 동결 건조하여 시험대상 시료로 사용하였다.
3. DPPH 라디칼 소거 활성 측정
2,2-diphenyl-1-picrylhydrazyl (DPPH) 라디칼 소거 활성은 Blois법 (Blois, 1958)을 변형하여 측정하였다. 일정 농도로 희석한 시료 100 ㎕에 0.2 mM DPPH (Sigma-Aldrich Co., St. Louis, MO, USA) 용액 400 ㎕와 에탄올 100 ㎕를 혼합하여 실온에서 30 분간 반응시킨 후 ELISA reader (Spark 10M, Tecan, Zürich, Switzerland)를 사용하여 517 ㎚에서 측정하였다.
DPPH의 흡광도가 50% 감소할 때 나타나는 시료의 농도 (SC50)를 구하였으며, 각 시료는 3 회 반복실험을 실시하였다. 이때 L-ascorbic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 양성대조군으로 사용하였다.
4. 총 polyphenol 및 총 flavonoid 함량 측정
가 10 종의 에탄올 추출물의 polyphenol 함량은 Folin-Denis의 방법 (Folin et al., 1912)을 변형하여 측정하였다. 일정 농도로 희석한 시료 80 ㎕에 1 N Folin-Ciocalteu’s phenol reagent (Sigma-Aldrich Co., St. Louis, MO, USA) 20 ㎕를 혼합하고 실온에서 5 분간 반응시켰다. 반응용액에 2% Na2CO3 (Daejung Chemical, Siheung, Korea) 100 ㎕를 혼합하여 실온에서 30 분간 반응시킨 후 750 ㎚에서 측정하였다. 표준물질로 tannic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였으며 시료와 동일한 방법으로 측정하여 얻은 검량선으로부터 총 polyphenol 함량을 산출하였다.
그리고 꽃 10 종의 에탄올 추출물의 총 flavonoid 함량은 Kang 등 (1996)의 방법을 변형하여 측정하였다. 일정 농도로 희석한 시료 10 ㎕에 diethylene glycol (Daejung Chemical, Siheung, Korea) 100 ㎕와 1 N NaOH 10 ㎕를 혼합하여 37 ℃에서 1 시간동안 반응시킨 후 ELISA reader를 사용하여 420 ㎚에서 측정하였다. 표준물질로 kaempferol (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였으며 시료와 동일한 방법으로 측정하여 얻은 검량선으로부터 총 flavonoid 함량을 산출하였다.
5. Phenolic compounds에 대한 HPLC 분석
꽃 10 종의 에탄올 추출물의 19 종 phenolic compounds 함량 분석은 high performance liquid chromatography (e2695, Waters Co., Milford, MA, USA)를 이용하여 함량을 분석하였다.
19 종 표준품은 1 ㎎ 취하여 50% 에탄올 1 ㎖에 용해하고 각 100 ㎕씩 분주하여 혼합하여 사용하였고, 시료는 10 ㎎ 취하여 50% 에탄올 1 ㎖에 용해하여 사용하였으며, 19 종 표준품과 시료는 10 ㎕를 HPLC에 주입하고 0.8 ㎖/min 속도로 분석하였다. 이동상으로는 (A) water (0.1% formic acid)와 (B) acetonitrile (0.1% formic acid)를 사용하였다 [HPLC gradient 조건: 0분 - 2분 (A: B = 100 : 0) → 2분 - 45분 (A : B = 50 : 50) → 45분 - 50분 (A: B = 5 : 95) → 50분 - 55분 (A: B = 5 : 95) → 55.0분 - 55.1분 (A: B = 100 : 0)]. column은 Shim-pack VP-ODS (4.6 ㎜ × 250 ㎜, 5 ㎛) (Shimadzu, Kyoto, Japan)를 이용하여 흡광도 280 ㎚에서 분석하였다.
19 종 phenolic compound 동시 함량 분석은 항산화, 미백, 주름, 보습, 항염증, 항균 등의 효과로 기존에 보고되었고 retention time 과 각 성분 peak를 HPLC를 이용하여 동시 검출 및 유효한 분석 데이터로 정량이 가능한 식물 내 존재하는 페놀성 화합물로 구성되었다.
분석에 사용된 표준품은 gallic acid, chlorogenic acid, methyl gallate, caffeic acid, EGCG, syringic acid, p-coumaric acid, rutin, ellagic acid, ferulic acid, astragalin, quercitrin hydrate, rosmarinic acid, myricetin, luteolin, quercetin, apigenin, kaempferol, hesperetin (Sigma-Aldrich Co., St. Louis, MO, USA)을 이용하였다. 19 종 페놀성 화합물의 retention time (RT)과 최대흡수파장은 Table 2와 같다.
6. 세포주 및 세포배양
마우스 흑색종세포주 (B16F10)은 한국세포주은행 (Korean Cell Line Bank, KCLB, Seoul, Korea)에서, 인간 피부섬유 아세포주 (HS27)는 American Type Culture Collection (ATCC, Manassas, VA, USA)으로부터 분양받아 사용하였고, 인간 피부각질형성세포주 (HaCaT)는 한국세포주은행 (KCLB, Seoul, Korea) 분양 받아 사용하였다.
각 세포를 56℃에서 30 분 동안 열처리된 fetal bovine serum (Merck Millipore, Burlington, MA, USA) 10%와 항생제 (penicillin/streptomycin, Gibco Life Technologies, Carlsbad, CA, USA)를 함유한 Dulbecco’s modified Eagle’s media (DMEM, Welgene, Daegu, Korea)를 사용하여 5% CO2, 37℃ 세포 배양기에서 배양하였다.
7. 세포독성검사
WST-1 assay를 이용하여 꽃 10 종의 에탄올 추출물의 세포 생존율을 측정하였다. 96 well plate에 B16F10 세포는 1 × 103 cells로 HS27과 HaCaT 세포는 5 × 103 cells로 분주한 후 24 시간 동안 5% CO2, 37℃ 조건에서 부착 및 안정화를 시킨 후, 에탄올 추출물을 농도별로 처리하여 B16F10 세포는 72 시간, HS27과 HaCaT 세포는 48 시간 동안 배양하였다.
WST-1 assay는 cell viability assay kit (EZ-Cytox, DoGenBio Co., Ltd., Seoul, Korea)를 이용하였고, 모든 well에 EZ-Cytox 용액 10 ㎕를 가해주고 다시 37℃, 5% CO2에서 2 시간 배양한 뒤 흡광도 측정을 위해 1 분 정도 부드럽게 shaking을 한 뒤 microplate reader (Tecan Ltd., Männedorf, Switzerland)를 이용하여 450 ㎚에서 흡광도를 측정하였다.
8. Mealnin 생성량 및 tyrosinase 활성
꽃 10 종의 에탄올 추출물의 melanin 생성량을 확인하기 위해 B16F10 세포를 6 well plate에 1 × 105 cells로 분주한 후 24 시간 동안 배양하고, phenol-red free 배지로 교환한 후 시료를 100 ㎍/㎖의 농도로 1 시간 전처리 후 200 nM α-melanocyte stimulating hormone (α-MSH, Sigma-Aldrich Co., Saint Louis, MO, USA)를 72 시간 동안 처리하였다.
세포내 멜라닌 생성량은 PBS로 세포를 수확한 후 13,000 rpm에서 10 분 동안 원심분리 한 후, 상층액은 버리고 세포 pellet 상태에 10% dimethyl sulfoxide가 함유된 1 N NaOH 용액 120 ㎕를 첨가한 후 60℃에서 30 분간 중탕하고 pellet을 용해시킨 후 405 ㎚에서 흡광도를 측정하였다. 그리고 꽃 10 종의 에탄올추출물의 tyrosinase 활성을 확인하기 위해 B16F10 세포를 6 well plate에 1 × 105 cells로 분주한 후 24 시간 동안 배양하고, phenol-red free 배지로 교환한 후 시료를 100 ㎍/㎖의 농도로 1 시간 전처리 다음 200 nM α-MSH를 72 시간 동안 처리하였다. 세포를 PBS로 수확한 후 13,000 rpm에서 10 분 동안 원심분리 한 다음 상층액을 제거한 후 세포 pellet에 1% Triton X-100이 함유된 PBS 용액 150 ㎕를 첨가한 후 vortex 한 다음 -70℃에 얼렸다가 녹인 후 13,000 rpm에서 10 분 동안 원심분리 하였다. 다시 상층액 80 ㎕에 5 mM L-DOPA 20 ㎕를 첨가한 후 37℃에서 1 시간 동안 반응시킨 후 475 ㎚에서 흡광도를 측정하였다. Melanin 생성량 및 tyrosinase 활성 억제 양성대조군으로 rucinol (4-n-butyiresorcinol, 4BR, Sigma-Aldrich Co., Saint Louis, MO, USA) 150 μM를 사용하였다.
9. Elastase 활성 및 matrix metalloproteinase-1 (MMP-1) 활성 측정
꽃 10 종의 에탄올추출물의 elastase 활성 억제능을 확인하기 위해 0.1 M Tris-HCl buffer (pH 8.0) 200 ㎕에 elastase (0.5 unit/㎖) 100 ㎕와 500 ㎍/㎖의 시료 50 ㎕를 넣은 혼합물을 실온에서 2 분간 대기한 후 2 mM N-succinyl-Ala-Ala-Ala-ρ-nitroanilide 200 ㎕를 첨가하고 25℃에서 10 분간 mix하여 반응시킨 뒤 410 ㎚에서 흡광도를 측정하였으며 양성대조군으로 ursolic acid 100 ㎍/㎖를 사용하였다.
꽃 10 종의 에탄올추출물의 MMP-1 활성 억제능을 측정하기 위해 섬유아세포주인 HS27 세포를 24 well plate에 2 × 105 cells로 분주한 후 24 시간 동안 배양하였다. 배양한 세포는 serum free DMEM 배지로 2 번 세척 후 serum free DMEM 배지로 교체한 뒤 시료를 100 ㎍/㎖의 농도로 48 시간 처리한 후, 배지를 수거하여 13,000 rpm에서 5 분 동안 원심분리하였다. ELISA는 시료를 1/40으로 희석한 후 MMP-1 ELISA (DY901B, Research And Diagnostic Systems Inc., Minneapolis, MN, USA)를 이용하였으며 제조사에서 제공한 방법에 의해 측정하였다. 양성대조군으로 retinyl palmitate (Sigma-Aldrich Co., Saint Louis, MO, USA) 100 ㎍/㎖를 사용하였다.
10. 실시간 중합효소연쇄반응 (qRT-PCR)을 통한 보습 유전자 발현
6 well plate에 HaCaT 세포를 8 × 105 cells로 분주한 후 24 시간 동안 배양하고, serum free DMEM 배지로 2 번 세척한 후 serum free DMEM 배지로 교체하고 꽃 10 종의 에탄올추출물을 100 ㎍/㎖의 농도로 48 시간 동안 처리하였다.
세포에서 RNA를 추출하기 위해 Tri-reagent (RNAiso PLUS, Takara, Ostu, Japan)를 사용하였으며 세포에 Tri-reagent 1㎖을 세포에 넣은 후 15 초 동안 vortex하고 15,000 rpm에서 15 분 동안 원심분리한 후 chloroform 200 ㎕를 넣고 20 초 동안 vortex한 후 다시 원심 분리하여 상층액을 획득하였다. 획득된 상층액과 동일한 양의 차가운 isopropanol을 첨가하고 상온에서 10 분 동안 방치하여두었으며 15,000 rpm에서 20 분 동안 원심 분리하여 RNA 침전물을 얻었다. RNA 침전물을 75% ethanol로 씻은 후, 침전물을 2분 - 3분 동안 실온에서 건조시켜 0.1% DEPC water에 녹였다.
RNA 농도는 Evloution 260 Bio UV-Vis spectrophotometer (Thermo Fisher Scientific Inc., Waltman, MA, USA)를 이용하여 260㎚에서 측정한 후, reverse transcription kit [RNA to cDNA EcoDry Premix (Oligo dT), Takara Bio Inc., Ostu, Japan]를 이용하여 1 ㎍ RNA로부터 cDNA를 합성하였다. 합성된 cDNA를 멸균된 3 차 증류수로 5 배 희석한 후 실시간 PCR은 Fast Start DNA MasterPLUS SYBR Green I kit (Roche, Mannheim, Germany)을 이용하여 Light Cycler 2.0 (Roche, Mannheim, Germany)에서 증폭하였다.
사용한 primer와 PCR 조건은 Table 3, 4와 같으며 (So et al., 2019), 유전자의 정량분석은 Light Cycler Software 4.0 (Roche, Mannheim, Germany)을 이용하였으며 피부보습에 대한 양성대조군은 all-trans Retinoic acid (ATRA, Sigma-Aldrich Co., Saint Louis, MO, USA) 1 μM을 사용하였다.
11. 통계학적 분석
모든 분석 자료는 평균 ± 표준편차 (means ± SD)로 나타내었으며 세포독성, 미백, 주름, 보습 실험결과는 GraphPad InStat (GraphPad Software Inc., SanDiego, CA, USA)를 이용하였다. 또한 각 군 간의 측정치 비교는 One-way analysis of variance (ANOVA)를 시행한 후 Tukey-Kramer Multiple Comparisons Test 방법을 이용하여 유의성을 5% 수준에서 검정하였다 (p < 0.05). 그리고 항산화, 미백, 주름, 보습의 각 기능성 항목에 대한 상관관계는 Pearson correlation 방법으로 분석하였다.
결과 및 고찰
1. 세포독성
꽃 10 종의 에탄올 추출물에 대한 세포독성을 알아보기 위하여 인간 피부섬유아세포주 (HS27), 인간 피부각질형성세포주 (HaCaT) 및 마우스 흑색종세포주 (B16F10) 세포에 각각 3.125 ㎍/㎖ - 100 ㎍/㎖ 농도로 처리한 후 세포독성을 관찰한 결과 모든 농도에서 큰 세포독성을 보이지 않았다 (Fig. 1).
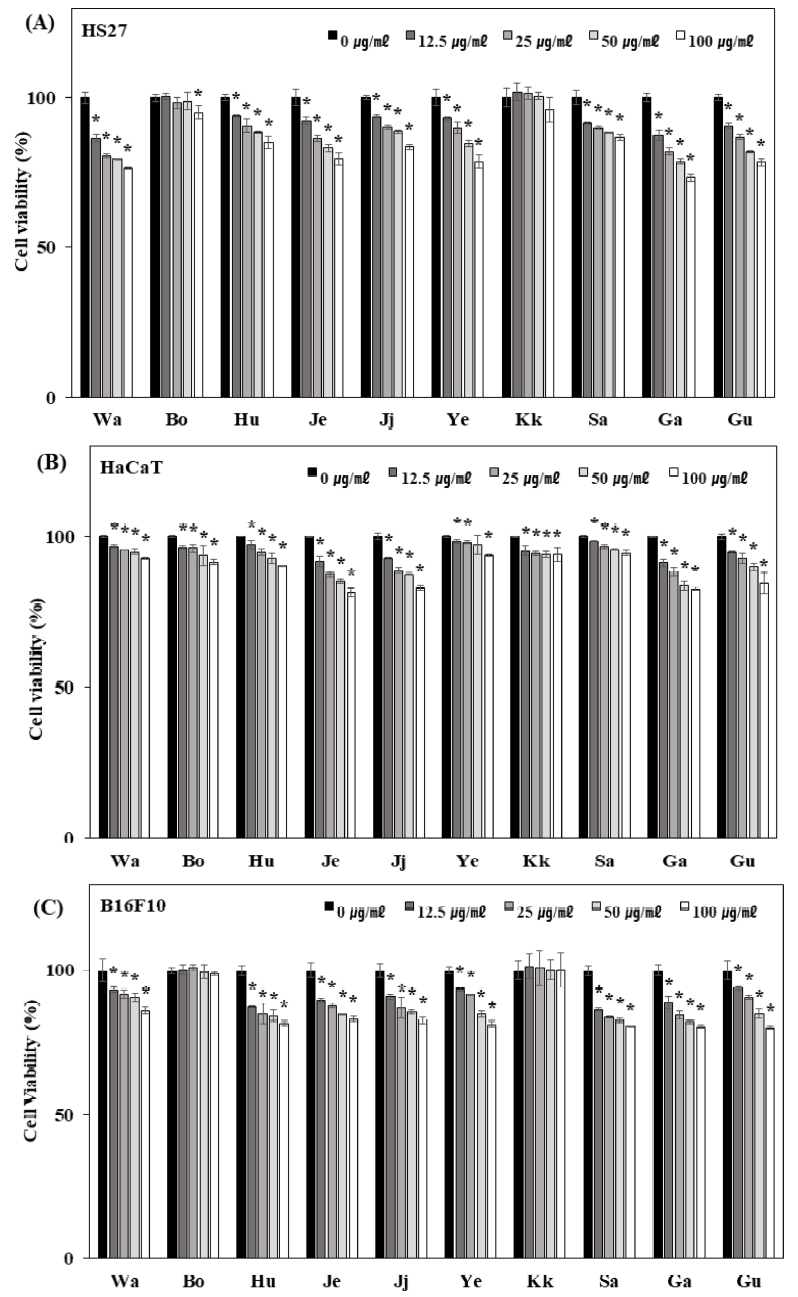
Cytotoxicity effect of ten kind of flower ethanol extracts in human fibroblast HS27 cells (A), human keratinocyte HaCaT cells (B) and mouse melanoma B16F10 cells (C). *Value of Pearson’s correlation coefficients is calculated by correlation option in data analysis tools using Tukey-Kramer multiple comparison test. significant at the 5 % levels of probability (p < 0.05). Wa; Wang-beot-na-mu, Bo; Bok-sa-na-mu, Hu; Huin-min-deul-re, Je; Jeo-meon-kae-mo-ma-il, Ji: Jjil-re-kkot, Ye; Yeon-kkot, Kk; Kkot-hyang-yu, Sa; San-gu-jeol-cho, Ga; Gam-guk, Gu; Guk-hwa.
2. 항산화 효과
꽃 10 종의 에탄올 추출물의 항산화 능력을 측정하기 위하여 총 폴리페놀과 총 플라보노이드 함량과 2,2-diphenyl-1-picrylhydrazyl (DPPH) 라디칼 소거능을 측정을 측정한 결과 꽃 10 종의 추출물 중에 총 폴리페놀 함량은 찔레꽃, 연꽃, 꽃향유 추출물에서 각각 224.1 ㎎/g, 177.4 ㎎/g, 91.6 ㎎/g으로 높았으며, 총 플라보이드 함량은 찔레꽃, 연꽃, 꽃향유, 산구절초 추출물에서 각각 109.0㎎/g, 87.4 ㎎/g, 84.3㎎/g, 79.9 ㎎/g으로 높은 수준을 나타내었다. DPPH 라디칼 소거능은 찔레꽃, 왕벚나무, 꽃향유, 연꽃이 우수하였는데 DPPH 라디칼 50% 소거활성 (SC50)이 양성대조군인 L-ascorbic acid는 37㎍/㎖을 나타낸 반면 찔레꽃, 왕벚나무, 꽃향유, 연꽃의 경우 각각 104.6㎍/㎖, 205.9㎍/㎖, 319.3㎍/㎖, 382.3㎍/㎖을 나타내었다. 종합적으로 항산화 지표인 총폴리페놀과 총플라보노이드 함량 및 DPPH 라디칼 소거능이 모두 우수한 소재는 찔레꽃, 연꽃, 꽃향유 추출물이었다 (Table 5).

Total polyphenol, total flavonoid, and DPPH radical scavenging activity in ten kind of flower ethanol extracts.
페놀 화합물과 플라보노이드 화합물은 다양한 식물계에 널리 분포되어 있는 대표적인 항산화 물질이며 (Kähkönen et al., 1999), 이들이 가진 phenolic hydroxyl(ㆍOH)기를 통한 수소공여와 페놀고리구조의 공명안정화에 의해 단백질 및 기타 거대 분자들과 쉽게 결합하여 항산화 및 항암 등의 다양한 생리작용을 나타낸다 (Kuhnau, 1976; Aruoma, 1994). 본 연구에서는 폴리페놀과 플라보노이드 함량이 높은 소재들이 DPPH 라디칼 소거능이 우수한 것으로 조사되었다.
Yeo 등 (2014)은 찔레꽃의 꽃 부위에 대한 물 추출물과 80% 에탄올 추출물을 비교한 결과 에탄올 추출물보다 물 추출물에서 총 폴리페놀함량, 총 플라보이드 함량이 높았으며, DPPH 및 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) 라디칼 소거능이 우수하다고 보고하였다. 그리고 연꽃의 4 개 부위별 (꽃, 잎, 씨, 뿌리)를 80% 메탄올로 추출한 후 DPPH 라디칼 소거능과 총폴리페놀 함량을 조사한 결과, DPPH 라디칼 소거능은 꽃, 잎, 씨, 뿌리 순이었고 각각 59.3%, 47.8%, 42.1%, 21.9%의 소거능을 나타내었다고 하였으며 총 폴리페놀 함량 또한 꽃, 잎, 씨, 뿌리 순으로 높았고 각각 139.7㎎/g, 68.9㎎/g, 32.2㎎/g, 6.3㎎/g의 함량을 나타내었다고 보고한 바 있다 (Jang et al., 2019). 또한 국내 자생식물 135 종의 80% 에탄올 추출물에 대한 DPPH 라디칼 소거능을 측정한 결과 꽃향유 추출물이 94.84% 라디칼 소거능을 나타내어 135 종 중 항산화능력이 가장 우수하다고 보고된 바 있다 (Kim et al., 2014).
또한, 흰민들레는 국화과 식물로 전 세계적으로 분포하고 있는 서양민들레와 비슷하지만 흰색 꽃이 피고, 잎이 서고, 끝에 돌기 및 털이 나있는 등 민들레와 다른 특징을 보이는 우리나라 대표 자생식물이다 (Choi et al., 2012). 흰민들레와 서양 민들레의 잎과 뿌리의 에탄올 추출물에 대한 항산화능력을 비교한 결과, 흰민들레 추출물에서 훨씬 높은 총폴리페놀함량, DPPH 라디칼 소거능 및 SOD activity를 나타내었다고 보고하였다 (Lee and Lee, 2008).
구절초 꽃, 잎/줄기, 뿌리 부위별 메탄올 추출물에 대한 항산화 능력을 측정한 결과에서 꽃이 가장 높았고 다음으로 잎/줄기, 뿌리 순이었다고 보고하였고 (Chung and Jeon, 2011), 꽃향유의 경우 총플라보노이드 함량이 꽃, 잎, 줄기, 뿌리 순으로 높다고 보고된 바 있다 (Um and Kim, 2007).
3. Phenolic compounds 분석
꽃 10 종의 에탄올 추출물에 대한 페놀성 화합물을 검출하기 위하여 HPLC를 이용한 동시 다분석을 실시하였다. 19 종의 표준물질을 이용한 동시 다성분 분석 HPLC 크로마토그램은 Fig. 2A와 같다 (So et al., 2019).
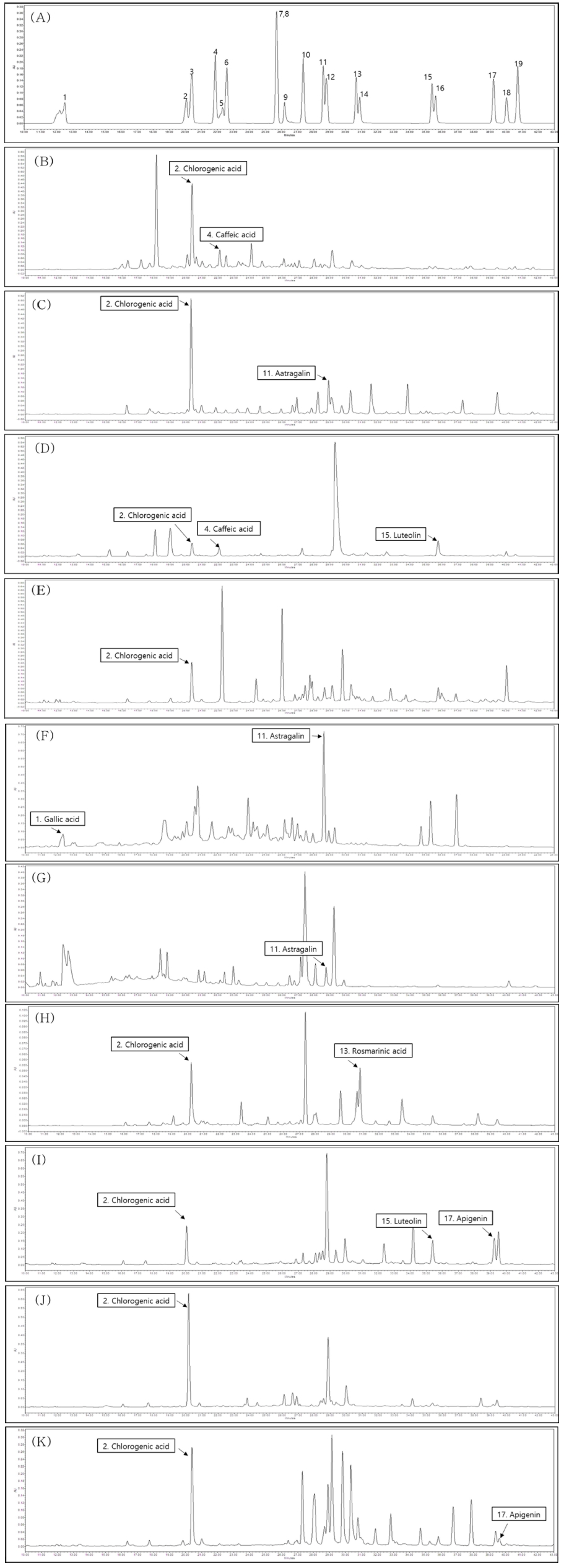
HPLC chromatogram of (A); 19 standard phenolic compounds (Refer to Table 1 for each number), (B); Wang-beot-na-mu, (C); Bok-sa-na-mu, (D); Huin-min-deul-re, (E); Jeo-meon-kae-mo-ma-il, (F); Jjil-re-kkot, (G); Yeon-kkot, (H); Kkot-hyang-yu, (I); San-gu-jeol-cho, (J); Gam-guk and (K); Guk-hwa flower ethanol extracts.
19 종의 표준물질과 각 시료와 retention time (R.T.)와 UV spectrum를 비교 분석하여 각 시료의 검출 peak에 대해 표준물질과의 일치 여부를 확인하였고, 19 종 표준물질을 이용하여 혼합 표준원액 (stock solution)을 조재하고 이를 단계별로 희석하여 표준용액 (working solution)의 농도를 달리해 분석한 후 표준검량선을 작성하였으며 이들의 상관계수 (R2, correlation coefficient) 값들은 모두 0.997 이상으로 양호한 직선성을 보였다 (Fig. 3).
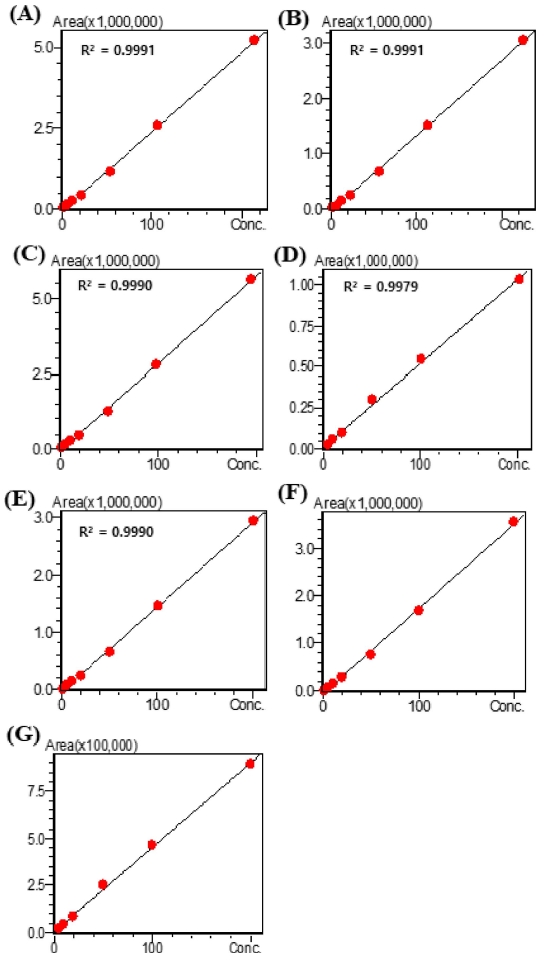
Calibration curve of (A); galic acid, (B); chlorogenic acid, (C); caffeic acid, (D); astragalin, (E); rosmarinic acid, (F); luteolin and (G); apigenin standard Phenolic Compounds used for HPLC analysis.
꽃 10 종 phenolic compounds에 대한 동시 다분석 결과, 왕벚나무, 복사나무, 흰민들레, 저먼캐모마일, 꽃향유, 산구절초, 감국, 국화 추출물에서 retention time (RT) 20.1 분에 chlorogenic acid가 검출되었으며 꽃향유, 감국, 복사나무에서 20 ㎎/g 이상의 높은 함량을 보였다. 그리고 왕벚나무, 흰민들레 추출물에서는 R.T. 21.9 분에 caffeic acid가 검출되었고 복사나무, 찔레꽃, 연꽃 추출물에서 R.T. 28.6 분에 astragalin이 검출되었으며, 특히 astragalin은 찔레꽃에서 30 ㎎/g 이상의 높은 함량을 나타내었다. 또한 흰민들레와 산구절초 추출물에서는 R.T. 35.4 분에 luteolin, 찔레꽃 추출물에서는 R.T. 12.5 분에 gallic acid, 꽃향유 추출물에서는 R.T. 30.7 분에 rosmarinic acid, 산구절초와 국화 추출물에서 R.T. 39.2 분에 apigenin이 검출되었다 (Table 6, Fig. 2).
복사나무 꽃은 chlorogenic acid, kaempferol 및 quercetin 유도체 성분은 함유하고 있다고 알려져 있으며 (Song et al., 2019), 흰민들레는 chlorogenic acid, caffeic acid, luteolin, chicoric acid, inulin, taraxacin 및 cartenoids 성분 등이 함유되어 있다고 보고된바 있다 (Mo, 2019). 그리고 저먼캐모마일은 herniarin, coumarin, chlorogenic acid, caffeic acid, apigenin, luteolin, quercetin, rutin 및 naringenin 성분들을 포함하며 (Singh et al., 2011), 찔레꽃은 astragalin과 gallic acid를 함유한다고 알려져 있다 (Kim et al., 2018b). 연꽃의 경우 다양한 부위에서 astragalin과 hyperoside를 함유한다고 알려져 있으며 (Jung et al., 2014), 꽃향유는 apigenin, luteolin 및 rosmarinic acid를 (Peng et al., 2014), 산구절초와 감국은 chlorogenic acid를 (Debnath et al., 2013; Kim et al., 2017), 국화는 chlorogenic acid와 apigenin을 함유하는 것으로 보고된 바 있다 (Gong et al., 2019).
페놀성 물질은 크게 phenolic acids, courmarins, flavonoids, tannins 그룹으로 분류 되는데 (Robbins and Bean, 2004), 10 종의 꽃 추출물에서는 동시분석에 이용한 19 종의 phenolic compounds 중 7 가지가 검출되었다. 이 중 chlorogenic acid는 찔레꽃과 연꽃 추출물을 제외한 나머지 8 개 꽃 추출물에서 검출되었다. Chlorogemic acid와 gallic acid는 항산화, 미백, 주름, 보습 효과가 있다고 알려져 있으며 (Park et al., 2003; Asnaashari et al., 2014, ; Hwang et al., 2014; Li et al., 2014; Cho et al., 2017), caffeic acid는 항산화, 주름, 보습개선에 효과를 나타내며 (Park et al., 2003; Lima et al., 2016; Pluemsamran et al., 2012), astragalin은 항산화, 미백에 효과가 있다고 알려져 있다 (Choi et al., 2013; Jung et al., 2014). 그리고 luteolin은 항산화, 미백, 주름 효과가 있고 (Kasala et al., 2016; Choi et al., 2008; Lim et al., 2013), rosmarinic acid는 항산화, 미백, 보습 효과가 있다고 보고된 바 있으며 (Oliveira et al., 2013; Muhit et al., 2016; Adomako-Bonsu et al., 2017), apigenin은 항산화와 주름 형성에도 효과가 있다고 보고되어 있다 (Madunić et al., 2018; Hwang et al., 2011).
4. 미백 효과
피부 표피의 기저층에 존재하는 melanocytes는 melanin 합성 조절 및 인접한 keratinocytes로의 전달 조절을 통해 피부의 색상을 결정한다고 알려져 있다 (Lin and Fisher, 2007). 또한, 사람의 피부에서 melanin 색소는 햇빛에 포함된 자외선 조사 및 환경내의 다양한 산화적 스트레스 요인으로부터 피부 손상을 방어하는 중요한 역할을 담당하고 있다 (Costin and Hearing, 2007; Lin and Fisher, 2007).
Melanin 생성은 복잡한 기전에 의해 조절되는 과정으로서, melanocyte 내부에 존재하는 melanosome 안에서 이루어진다 (Simon et al., 2009). Melanocytes에서 melanin 생성 과정의 첫 단계는 melanosome안에서 tyrosine이 tyrosinase 효소에 의해 3,4-dihydroxyphenylalanine (DOPA), DOPA quinone, DOPA chrome으로 전환되는 반응이다. 그 다음 과정으로 tyrosinase related protein-1 (TRP-1)과 tyrosinase related protein-2 (TRP-2)에 의해 melanin 합성이 이루어지며, 최종적으로 melanosome에서 합성된 melanin은 keratinocyte로 이동하여 피부색을 나타내게 된다 (Correia et al., 2018).
꽃 10 종의 에탄올 추출물의 미백 효과를 측정하기 위하여 흑색종 세포인 B16F10 세포에서 melanin 합성능과 tyrosinase 활성 억제능을 측정하였다. Melanin 합성능의 경우 melanogenesis를 유도하는 α-MSH를 처리하였을 때 α-MSH 처리구는 대조군에 비해 2.6 배 증가한 반면 α-MSH와 꽃 10 종 추출물을 동시에 처리한 결과, α-MSH를 단독으로 처리한 군과 비교하였을 때 양성대조군인 rucinol은 melanin 생성억제율이 약 67%를 나타내었고 연꽃, 찔레꽃, 산구절초 추출물을 처리한 경우 각각 71%, 66%, 49% melanin 생성을 억제율을 나타내어 억제효과가 우수하였다 (Fig. 4A). 또한, tyrosinase 활성 억제효과의 경우 α-MSH를 처리하였을 때 대조군에 비해 2.2 배 증가하였으나, α-MSH와 꽃 10 종 추출물을 동시에 처리한 결과, α-MSH를 단독으로 처리한 군과 비교하였을 때 양성대조군인 rucinol은 tyrosinase 활성을 57% 억제하였고 산구절초, 찔레꽃, 연꽃 추출물을 처리한 경우 각각 61%, 59%, 41% 수준으로 tyrosinase 활성을 억제하였다 (Fig. 4B). 결과적으로 melanin 합성과 tyrosinase 활성억제가 우수한 소재는 연꽃, 찔레꽃, 산구절초 추출물이었다.
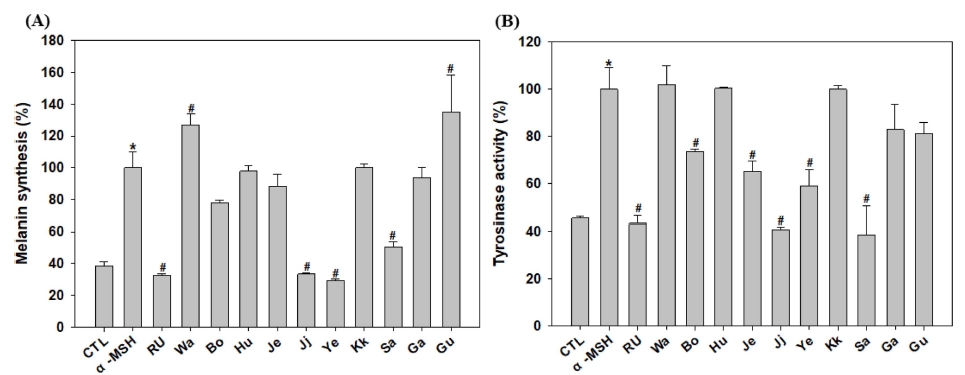
Melanin synthesis (A) and tyrosinase activity (B) in ten kind of flower ethanol extracts.Value of Pearson’s correlation coefficients is calculated by correlation option in data analysis tools using Tukey-Kramer multiple comparison test. significant at the 5 % levels of probability (*, # p < 0.05). CTL; control, α-MSH; α-melanocyte-stimulating hormone, RU; rucinol, Wa; Wang-beot-na-mu, Bo; Bok-sa-na-mu, Hu; Huin-min-deul-re, Je; Jeo-meon-kae-mo-ma-il, Ji; Jjil-re-kkot, Ye; Yeon-kkot, Kk; Kkot-hyang-yu, Sa; San-gu-jeol-cho, Ga; Gam-guk, Gu; Guk-hwa.
Ha 등 (2009)은 찔레꽃 잎과 뿌리의 에탄올 추출물에 대한 mealnin 합성억제와 tyrosinase 활성억제를 조사한 결과 200 ㎍/㎖의 농도에서 melanin 합성을 30% - 32% 억제하며, tyrosinase 활성을 20% - 25% 억제한다고 보고되었으며 구절초 꽃의 물 추출물 100㎍/㎖의 농도에서 melanin 생성을 16.7% 억제한다고 보고하였다 (You and Moon, 2016). Nakamura 등 (2013)은 연꽃의 꽃봉오리와 잎의 메탄올 추출물로부터 분리한 alkaloids 성분인 nuciferine, N-methylasimilobine 성분들이 tyrosinase, TRP-1, TRP-2 mRNA를 억제함으로써 melanogenesis을 억제한다고 보고하였다. 또한, 연꽃의 꽃, 뿌리, 씨, 꽃받침에 포함되어 있는 hyperoside와 astragalin 성분이 melanin 합성과 tyrosinase 활성억제를 한다고 보고된 바 있으며 (Jung et al., 2014) 연꽃의 꽃, 잎, 씨 부위의 물 추출물이 DOPA-oxidase 억제효과가 있다고 보고된바 있다 (Kim et al., 2011b).
5. 주름 개선 효과
피부가 노화하거나 자외선에 노출되면 피부섬유아세포에서 collagen과 elastin이 감소하게 돼 피부의 주름을 형성하고 피부탄력의 저하를 일으킴은 물론 다양한 염증을 유발시켜 피부를 손상시킨다 (Zhang and Duan, 2018). 그리고 노화나 자외선 노출에 의해 콜라겐이 분해되는데, 다양한 콜라겐분해 효소 중 가장 중요한 역할을 하는 것이 MMP-1 효소이다. MMP-1은 세포 사이에 존재하는 주요 콜라겐 분해효소로 피부에 가장 많이 존재하는 1 형과 3 형의 섬유성 콜라겐을 분해하기 때문에 그 영향력이 가장 크다고 볼 수 있다 (Kwak and Yang, 2016). 또한, elastin은 피부 및 혈관의 연결조직을 구성하는 중요한 요소이며 세포조직의 탄성력을 갖게 하는 단백질로써 elastase에 의해 분해된다 (Uitto et al., 2013). 그리고 elastin이 elastase에 의해 분해되어 피부의 그물망 구조 결합이 끊어지므로 elastase가 주름 생성에 작용하는 주요한 효소로 알려져 있다 (Mauviel et al., 1994).
꽃 10 종의 에탄올 추출물에 의한 주름개선 효과를 측정하기 위하여 elastase 활성억제와 피부섬유아세포인 HS27 세포에서 MMP-1 발현 감소 정도를 측정하였다. 꽃 10 종의 에탄올 추출물 중 elastase 활성 억제는 연꽃 추출물이 51%로 가장 우수하였고, 양성대조군인 urosolic acid는 55%의 elastase 억제효과를 나타내었다 (Fig. 5A). 그리고 콜라겐분해효소인 MMP-1의 발현은 연꽃, 찔레꽃, 흰민들레꽃, 산구절초꽃, 감국 추출물이 각각 97%, 73%, 62%, 55%, 41%로 우수한 억제 효과를 나타내었다. 양성대조군인 retinyl palmitate는 72%의 MMP-1 억제효과를 나타내었다 (Fig. 5B). 결과적으로 elastase 활성과 MMP-1 활성억제가 우수한 소재는 연꽃, 찔레꽃 에탄올 추출물이었다.
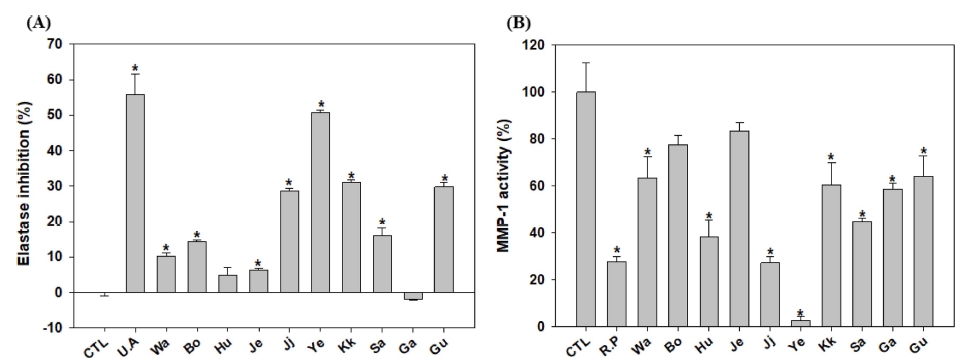
Elastase inhibition(A) and MMP-1 activity (B) in ten kind of flower ethanol extracts.Value of Pearson’s correlation coefficients is calculated by correlation option in data analysis tools using Tukey-Kramer multiple comparison test. significant at the 5 % levels of probability (*p < 0.05). CTL; control, U.A; ursolic acid, R.P; retinyl palmitate; Wa; Wang-beot-na-mu, Bo; Bok-sa-na-mu, Hu; Huin-min-deul-re, Je; Jeo-meon-kae-mo-ma-il, Ji; Jjil-re-kkot, Ye; Yeon-kkot, Kk; Kkot-hyang-yu, Sa; San-gu-jeol-cho, Ga; Gam-guk, Gu; Guk-hwa.
Park 등 (2016)은 연꽃잎의 dichloromethy 추출물이 UVB 자극에 의한 IL-6, IL-8, MCP3와 같은 cytokine들을 조절함으로써 주름을 예방한다고 보고하였다. 그리고 연꽃의 꽃, 잎, 씨 부위의 물 추출물이 elastase 활성억제 효과가 있다고 보고된 바 있다 (Kim et al., 2011b). 찔레꽃의 꽃 부위에 대한 주름 개선효과는 보고된 바 없으나 찔레꽃의 열매인 영실 메탄올 추출물이 UVB 자극에 의한 AP-1 전사인자의 억제를 통해 MMPs의 발현을 억제함으로써 콜라겐분해를 억제할 뿐 아니라 콜라겐 type 1과 4의 발현을 촉진함으로써 주름 개선 효과가 있다고 보고한 바 있다 (Park et al., 2015).
6. 보습효과
피부보습을 유지하는 히알루론산은 표피의 기저층과 유극층에서 활발한 합성이 일어나고 HAS에 의해 생성이 되는데 HAS1과 HAS2는 fibroblast에서 HAS3는 keratinocyte에서 과발현된다고 알려져 있다 (Saito et al., 2011).
꽃 10 종의 에탄올 추출물의 보습 효과를 측정하기 위하여 피부각질세포인 HaCaT 세포에서 히알루론산 생성효소 (hyaluronan synthase, HAS)인 HAS-2와 HAS-3 mRNA의 발현량을 측정하였다. HAS-2 mRNA의 발현은 흰민들레, 복사나무, 산구절초, 꽃향 추출물이 대조군에 비해 2 배 이상 증가하였으며, 각각 10.1, 2.7, 2.5, 2.2 배 증가하였다 (Fig. 6A). 그리고 HAS-3 mRNA 발현은 흰민들레, 국화, 감국, 저먼캐모마일, 산구절초, 꽃향유 추출물이 대조군에 비해 2 배 이상 증가하였고, 각각 8.0, 4.0, 3.5, 3.4, 2.5, 2.2 배 증가하였다 (Fig. 6B). 양성대조군인 ATRA는 HAS-2와 HAS-3 mRNA의 발현을 각각 8.7, 7.8 배 증가시켰다. 종합적으로 히알루론산 생성유전자인 HAS-2와 HAS-3 mRNA의 발현이 높은 소재는 흰민들레, 산구절초, 꽃향유 추출물이었다.
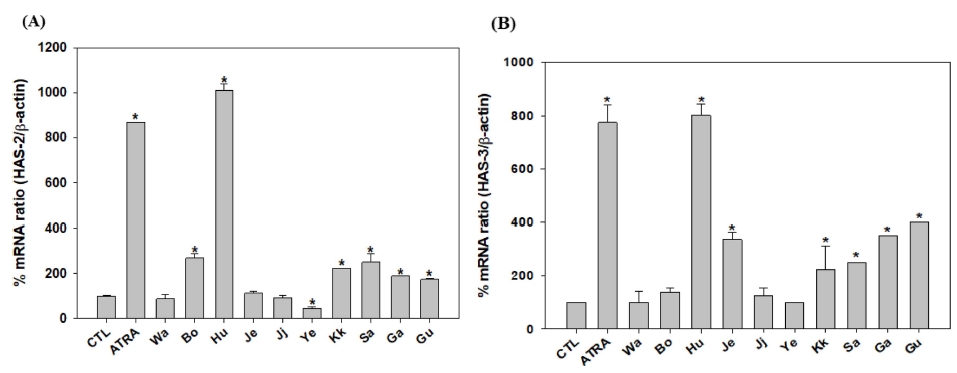
Expression of HAS-2 (A) and HAS-3 (B) mRNA in ten kind of flower ethanol extracts.Value of Pearson’s correlation coefficients is calculated by correlation option in data analysis tools using Tukey-Kramer multiple comparison test. significant at the 5 % levels of probability (*p < 0.05). CTL; control, ATRA; all-trans retinoic acid, Wa; Wang-beot-na-mu, Bo; Bok-sa-na-mu, Hu; Huin-min-deul-re, Je; Jeo-meon-kae-mo-ma-il, Ji; Jjil-re-kkot, Ye; Yeon-kkot, Kk; Kkot-hyang-yu, Sa; San-gu-jeol-cho, Ga; Gam-guk, Gu; Guk-hwa.
따라서 본 연구 결과를 통하여 흰민들레, 산구절초, 꽃향유 추출물이 피부각질세포의 히알루론산 합성 효소를 증가시켜 히알루론산의 생성에 도움을 줄 것으로 여겨진다.
7. 항산화, 미백, 주름, 보습 상관관계 분석
꽃 10 종의 에탄올 추출물에 대한 항산화, 미백, 주름, 보습 효능에 대한 상관관계를 분석하기 위하여 각각의 효능에 대한 상관 관계분석을 실시한 결과 항산화와 미백, 항산화와 주름, 미백과 주름 간에 상관관계가 있는 것으로 조사되었다.
세부적인 항목 첫 번째로 폴리페놀과 플라보노이드, melanin, elastase 및 MMP-1 간의 상관관계, 두 번째로 총 플라보노이드와 DPPH, melanin, elastase, MMP-1간의 상관관계, 세 번째로 melanin과 tyrosinase와 MMP-1간의 상관관계, 그리고 네 번째로 HAS-2와 HAS-3간의 상관관계가 있는 것으로 조사되었다 (Table 7).
이상의 결과의 결과를 종합해보면 꽃 10 종의 에탄올 추출물에 대한 항산화, 미백, 주름, 보습 개선효과를 측정한 결과, 항산화 능력은 찔레꽃, 연꽃, 꽃향유가 우수하며, 미백효과는 연꽃, 찔레꽃, 산구절초가 우수, 주름개선은 연꽃, 찔레꽃이 우수, 보습개선효과는 흰민들레, 산구절초, 꽃향유가 우수한 것으로 나타났다. 전체적으로 꽃 10 종 중에 5 종에 해당하는 찔레꽃, 연꽃, 산구절초, 꽃향유, 흰민들레가 화장품소재로써 우수한 효과를 나타내었다. 특히, 세 가지 기능 이상의 다기능소재는 찔레, 연꽃이었으며 항산화와 미백, 주름 그리고 미백과 주름 간에 상관관계가 있는 것으로 조사되었다. 또한, 10 종의 꽃 추출물에서 7 가지 (chlorogenic acid, gallic acid, caffeic acid, astragalin, luteolin, rosmaric acid, and apigenin)의 페놀성 화합물이 검출되었다.
결론적으로, 꽃 10 종의 에탄올 추출물에서 세 가지 이상의 다양한 기능을 가지는 다기능소재가 2 종 발굴되었고, 두 가지 이상의 기능을 가지는 소재는 2 종, 단일 기능성 소재는 1 종으로 절반에 해당하는 5 종이 기능성 화장품 소재로서 높은 가능성을 나타냈다. 꽃 10 종의 에탄올 추출물 중 5 종이라는 괄목한 만한 성과를 통하여 볼 때, 앞으로도 남원·지리산권 자원식물에서 기능성 화장품 소재로서의 가능성을 높게 평가할 수 있을 것이다. 따라서 추후에도 남원·지리산권 자원식물을 활용한 천연유래 화장품소재개발을 통해 자생 식물을 활용한 화장품 원료의 국산화에 도움이 되고자 한다.
Acknowledgments
본 연구는 농림축산식품부의 재원으로 농림수산식품기술기획평가원의 농생명산업기술개발사업(과제번호: 317024-5)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Adomako-Bonsu AG, Chan SL, Pratten M and Fry JR. (2017). Antioxidant activity of rosmarinic acid and its principal metabolites in chemical and cellular systems: Importance of physico-chemical characteristics. Toxicology In Vitro. 40:248-255.
[https://doi.org/10.1016/j.tiv.2017.01.016]

-
Aruoma OI. (1994). Nutrition and health aspects of free radicals and antioxidants. Food and Chemical Toxicology. 32:671-683.
[https://doi.org/10.1016/0278-6915(94)90011-6]

-
Asnaashari M, Farhoosh R and Sharif A. (2014). Antioxidant activity of gallic acid and methyl gallate in triacylglycerols of Kilka fish oil and its oil-in-water emulsion. Food Chemistry. 159:439-444.
[https://doi.org/10.1016/j.foodchem.2014.03.038]

-
Blois MS. (1958). Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Cho YH, Bahuguna A, Kim HH, Kim DI, Kim HJ, Yu JM, Jung HG, Jang JY, Kwak JH, Park GH, Kwon OJ, Cho YJ, An JY, Jo C, Kang SC and An BJ. (2017). Potential effect of compounds isolated from Coffea arabica against UV-B induced skin damage by protecting fibroblast cells. Journal of Photochemistry and Photobiology. B: Biology. 174:323-332.
[https://doi.org/10.1016/j.jphotobiol.2017.08.015]

-
Choi JW, Kang HJ, Kim SZ, Kwon TO, Jeong SI and Jang SI. (2013). Antioxidant effect of astragalin isolated from the leaves of Morus alba L. against free radical-induced oxidative hemolysis of human red blood cells. Archives of Pharmacal Research. 36:912-917.
[https://doi.org/10.1007/s12272-013-0090-x]

- Choi JM, Choi MJ, Lee SL, Yamabe N, Lee SH and Cho EJ. (2012). Protective effects of ethylacetate fraction from Taraxacum coreanum against peroxynitrite-induced oxidative damage under cellular system. Cancer Prevention Research. 17:251-256.
-
Choi MY, Song HS, Hur HS and Sim SS. (2008). Whitening activity of luteolin related to the inhibition of cAMP pathway in α-MSH-stimulated B16 melanoma cells. Archives of Pharmacal Research. 31:1166-1171.
[https://doi.org/10.1007/s12272-001-1284-4]

-
Chung HJ and Jeon IS. (2011). Antioxidative activities of methanol extracts from different parts of Chrysanthemum zawadskii. Korean Journal of Food Preservation. 18:739-745.
[https://doi.org/10.11002/kjfp.2011.18.5.739]

-
Correia MS, Moreiras H, Pereira FJC, Neto MV, Festas TC, Tarafder AK, Ramalho JS, Seabra MC and Barral DC. (2018). Melanin transferred to keratinocytes resides in nondegradative endocytic compartments. Journal of Investigative Dermatology. 138:637-646.
[https://doi.org/10.1016/j.jid.2017.09.042]

-
Costin GE and Hearing VJ. (2007). Human skin pigmentation: Melanocytes modulate skin color in response to stress. FASEB Journal. 21:976-994.
[https://doi.org/10.1096/fj.06-6649rev]

-
Debnath T, Jin H, Hasnat MA, Kim YS, NB Samad, Park PJ and Lim BO. (2013). Antioxidant potential and oxidative DNA damage preventive activity of Chrysanthemum indicum extracts. Journal of Food Biochemistry. 37:440-448
[https://doi.org/10.1111/j.1745-4514.2011.00644.x]

- Folin O and Denis W. (1912). On phosphotungstic-phosphomolybdic compounds as color reagents. Journal of Biological Chemistry. 12:239-243.
- Garg C, Khurana P and Garg M. (2017). Molecular mechanisms of skin photoaging and plant inhibitors. International Journal of Green Pharmacy. 11:217-232.
-
Gong J, Chu B, Gong L, Fang Z, Zhang X, Qiu S, Wang J, Xiang Y, Xiao G, Yuan H and Zheng F. (2019). Comparison of phenolic compounds and the antioxidant activities of fifteen Chrysanthemum morifolium Ramat cv. ‘Hangbaiju’ in China. Antioxidants. 8:325. https://www.mdpi.com/2076-3921/8/8/325, (cited by 2020 April 20).
[https://doi.org/10.3390/antiox8080325]

- Ha SE, Kim HD, Park JK, Chung YO, Kim HJ and Park NB. (2009). Melanogenesis inhibition effect of Rosa multiflora extracts in B16 melanoma cells. Korean Journal of Plant Resources. 22:317-322.
- Ha TK, Lee BK, Yoon JR, Mun YJ, Woo WH, Park SH and Lee JC. (2011). Inhibitory effect of Fritillaria verticillata willd. var. thunbergii bak ethanol extract on melanin biosynthesis. Korean Journal of Oriental Physiology and Pathology. 25:510-515.
-
Hwang ES, Park SY, Lee HJ, Lee TY, Sun ZW and Yi TH. (2014). Gallic acid regulates skin photoaging in UVB-exposed fibroblast and hairless mice. Phytotherapy Research. 28:1778-1788.
[https://doi.org/10.1002/ptr.5198]

-
Hwang YP, Oh KN, Yun HJ and Jeong HG. (2011). The flavonoids apigenin and luteolin suppress ultraviolet A-induced matrix metalloproteinase-1 expression via MAPKs and AP-1-dependent signaling in HaCaT cells. Journal of Dermatological Science. 61:23-31.
[https://doi.org/10.1016/j.jdermsci.2010.10.016]

-
Jang JY, Ahn JH, Jo YH, Hwang BY and Lee MK. (2019). Antioxidant activity and phenolic content of different parts of lotus and optimization of extraction condition using response surface methodology. Natural Product Sciences. 25:44-48.
[https://doi.org/10.20307/nps.2019.25.1.44]

-
Jung DH, Seo MH, Song DJ, Choi EH, Lee SH, Lee YH, Cho CU, Song BC and Yang DH. (2016). Analysis of asiatic black bear's foods by using scats in the Jirisan national park. Korean Journal of Environment and Ecology. 30:865-873.
[https://doi.org/10.13047/KJEE.2016.30.5.865]

- Jung SY, Jung WS, Jung HK, Lee GH, Cho JH, Cho HW and Choi IY. (2014). The mixture of different parts of Nelumbo nucifera and two bioactive components inhibited tyrosinase activity and melanogenesis. Journal of Cosmetic Science. 65:377-388.
- Kang YH, Park YK and Lee GD. (1996). The nitrite scavenging and electron donating ability of phenolic compounds. Korean Journal of Food Science and Technology. 28:232-239.
-
Kasala ER, Bodduluru LN, Barua CC and Gogoi R. (2016). Antioxidant and antitumor efficacy of Luteolin, a dietary flavone on benzo(a)pyrene-induced experimental lung carcinogenesis. Biomedicine and Pharmacotheraphy. 82:568-577.
[https://doi.org/10.1016/j.biopha.2016.05.042]

-
Kähkönen MP, Hopia AI, Vuorela HJ, Rauha JP, Pihlaja K, Kujala TS and Heinonen M. (1999). Antioxidant activity of plant extracts containing phenolic compounds. Journal of Agricultural and Food Chemistry. 47:3954-3962.
[https://doi.org/10.1021/jf990146l]

-
Kim BS, Gao G, Kim JY and Cho DW. (2019). 3D cell printing of perfusable vascularized human skin equivalent composed of epidermis, dermis, and hypodermis for better structural recapitulation of native skin. Advanced Healthcare Materials. 8:1801019. https://onlinelibrary.wiley.com/doi/epdf/10.1002/adhm.201801019, (cited by 2020 April 20).
[https://doi.org/10.1002/adhm.201801019]

- Kim DS, Jeon BK, Mun YJ, Kim YM, Lee YE and Woo WH. (2011a). Effect of Dioscorea aimadoimo on anti-aging and skin moisture capacity. Korean Journal of Oriental Physiology and Pathology. 25:425-430.
-
Kim EJ, Kim DH, Yoo SG, Hong YH, Han SY, Jeong SG, Jeong D, Kim JH, Cho JY and Park JS. (2018a). The skin protective effects of compound K, a metabolite of ginsenoside Rb1 from Panax ginseng. Journal of Ginseng Research. 42:218-224.
[https://doi.org/10.1016/j.jgr.2017.03.007]

-
Kim HS, Ahn JJ, Choi TH and Hwang TY. (2014). Screening of DPPH radical scavenging and antimicrobial activity of extracts from local some native plants. Korean Journal of Food Preservation. 21:593-599.
[https://doi.org/10.11002/kjfp.2014.21.4.593]

- Kim HW, Jo HN, Yoo BY, Kim JH and Lee TB. (2018b). Biological activity and cosmetic preservative effects of Rosa multiflora ethanol extracts. Korean Journal of Medicinal Crop Science. 26:308-316.
- Kim KM, Lee SY, Jo AR, Kang BM, Ham SH, Cho J and Lee GY. (2017). Quantitative analysis about phenolic compounds of Dendranthema species in Korean native plants. Korean Journal of Pharmacognosy. 48:70-76.
-
Kim TG, Kim HJ, Cho SK, Kang WY, Baek H, Jeon HY, Kim BY and Kim DG. (2011b). Nelumbo nucifera extracts as whitening and anti-wrinkle cosmetic agent. Korean Journal of Chemical Engineering. 28:424-427.
[https://doi.org/10.1007/s11814-010-0357-6]

-
Kuhnau J. (1976). The flavonoide. A calss of semi-essential food components: Their role in human nutrition. World Review of Nutrition and Dietetics. 24:117-191.
[https://doi.org/10.1159/000399407]

-
Kwak CH and Yang JW. (2016). Prevention effect of Prunus persica flos extract from reactive oxygen species generation and matrix metalloproteinases production induced by UVB irradiation in human skin cells. Asian Journal of Beauty and Cosmetology. 14:179-190.
[https://doi.org/10.20402/ajbc.2016.0043]

- Lee HH and Lee SY. (2008). Cytotoxic and antioxidant effects of Taraxacum coreanum Nakai. and T. officinale WEB. extracts. Korean Journal of Medicinal Crop Science. 16:79-85.
-
Li H, Habasi M, Xie L and Aisa HA. (2014). Effect of chlorogenic acid on melanogenesis of B16 melanoma cells. Molecules. 19:12940-12948. https://www.mdpi.com/1420-3049/19/9/12940, (cited by 2020 April 20).
[https://doi.org/10.3390/molecules190912940]

-
Lim SH, Jung SK, Byun SU, Lee EJ, Hwang JA, Seo SG, Kim YA, Yu JG, Lee KW and Lee HJ. (2013). Luteolin suppresses UVB-induced photoageing by targeting JNK1 and p90RSK2. Journal of Cellular and Molecular Medicine. 17:672-680.
[https://doi.org/10.1111/jcmm.12050]

-
Lima VN, Oliveira-Tintino CDM, Santos ES, Morais LP, Tintino SR, Freitas TS, Geraldo YS, Pereira RLS, Cruz RP, Menezes IRA and Coutinho HDM. (2016). Antimicrobial and enhancement of the antibiotic activity by phenolic compounds: Gallic acid, caffeic acid and pyrogallol. Microbial Pathogenesis. 99:56-61.
[https://doi.org/10.1016/j.micpath.2016.08.004]

-
Lin JY and Fisher DE. (2007). Melanocyte biology and skin pigmentation. Nature. 445:843-850.
[https://doi.org/10.1038/nature05660]

-
Madunić J, Madunić IV, Gajski G, Popić J, and Garaj-Vrhovac V. (2018). Apigenin: A dietary flavonoid with diverse anticancer properties. Cancer Letters. 413:11-22.
[https://doi.org/10.1016/j.canlet.2017.10.041]

-
Marchiori MCL, Rigon C, Camponogara C, Oliveira SM, and Cruz L. (2017). Hydrogel containing silibinin-loaded pomegranate oil based nanocapsules exhibits anti-inflammatory effects on skin damage UVB radiation-induced in mice. Journal of Photochemistry and Photobiology. B, Biology. 170:25-32.
[https://doi.org/10.1016/j.jphotobiol.2017.03.015]

-
Mauviel A, Halcin C, Vasiloudes P, Parks WC, Kurkinen M and Uitto J. (1994). Uncoordinate regulation of collagenase, stromelysin, and tissue inhibitor of metalloproteinases genes by prostaglandin E2: Selective enhancement of collagenase gene expression in human dermal fibroblasts in culture. Journal of Cellular Biochemistry. 54:465-472.
[https://doi.org/10.1002/jcb.240540413]

-
Mo SJ. (2019). Effect of increasing nitric oxide and dihydrotestosterone by Taraxacum coreanum extract. Journal of Applied Biological Chemistry. 62:305-313.
[https://doi.org/10.3839/jabc.2019.042]

-
Muhit MA, Izumikawa M, Umehara K and Noguchi H. (2016). Phenolic constituents of the Bangladeshi medicinal plant Pothos scandens and their anti-estrogenic, hyaluronidase inhibition, and histamine release inhibitory activities. Phytochemistry. 121:30-37.
[https://doi.org/10.1016/j.phytochem.2015.10.009]

-
Nakamura S, Nakashima S, Tanabe G, Oda Y, Yokota N, Fujimoto K, Matsumoto T, Sakuma R, Ohta T, Ogawa K, Nishida S, Miki H, Matsuda H, Muraoka O and Yoshikawa M. (2013). Alkaloid constituents from flower buds and leaves of sacred lotus(Nelumbo nucifera, Nymphaeaceae) with melanogenesis inhibitory activity in B16 melanoma cells. Bioorganic and Medicinal Chemistry. 21:779-787.
[https://doi.org/10.1016/j.bmc.2012.11.038]

-
Oliveira KB, Palú É. Weffort-Santos AM and Oliveira BH. (2013). Influence of rosmarinic acid and Salvia officinalis extracts on melanogenesis of B16F10 cells. Brazilian Journal of Pharmacognosy. 23:249-258.
[https://doi.org/10.1590/S0102-695X2012005000135]

-
Panzella L and Napolitano A. (2019). Natural and bioinspired phenolic compounds as tyrosinase inhibitors for the treatment of skin hyperpigmentation: Recent advances. Cosmetics. 6:57. https://www.mdpi.com/2079-9284/6/4/57, (cited by 2020 April 20).
[https://doi.org/10.3390/cosmetics6040057]

-
Park JE. Kim HJ. Kim SN. Kang SH and Kim YJ. (2015). Inhibitory effect of Rosa multiflora hip extract on UVB-induced skin photoaging in Hs68 fibroblasts. Journal of the Society of Cosmetic Scientists of Korea. 41:351-359.
[https://doi.org/10.15230/SCSK.2015.41.4.351]

-
Park KM, Yoo YJ, Ryu SJ and Lee SH. (2016). Nelumbo nucifera leaf protects against UVB-induced wrinkle formation and loss of subcutaneous fat through suppression of MCP3, IL-6 and IL-8 expression. Journal of Photochemistry and Photobiology, B: Biology. 161:211-216.
[https://doi.org/10.1016/j.jphotobiol.2016.04.006]

- Park YM, Yoon MY, Kim KW, Cho NY, Lim HW, Lee JY, Lee JH, Kim YJ, Kim CJ and Sim SS. (2003). Effects of phenylpropanoid compounds on melanin production in B16 melanoma cells. Yakhak Hoeji. 47:398-403.
-
Peng H, Xing Y, Gao L, Zhang L and Zhang G. (2014). Simultaneous separation of apigenin, luteolin and rosmarinic acid from the aerial parts of the copper-tolerant plant Elsholtzia splendens. Environmental Science and Pollution Research. 21:8124-8132.
[https://doi.org/10.1007/s11356-014-2747-5]

-
Pluemsamran T, Onkoksoong T and Panich U. (2012). Caffeic acid and ferulic acid inhibit UVA-induced matrix metalloproteinase-1 through regulation of antioxidant defense system in keratinocyte HaCaT cells. Photochemistry and Photobiology. 88:961-968.
[https://doi.org/10.1111/j.1751-1097.2012.01118.x]

-
Robbins RJ and Bean SR. (2004). Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of chromatography A. 1038:97-105.
[https://doi.org/10.1016/j.chroma.2004.03.009]

-
Saito S, Takayama Y, Mizumachi K and Suzuki C. (2011). Lactoferrin promotes hyaluronan synthesis in human dermal fibroblasts. Biotechnology Letters. 33:33-39.
[https://doi.org/10.1007/s10529-010-0389-3]

-
Simon DJ, Peles D, Wakamatsu K and Ito S. (2009). Current challenges in understanding melanogenesis: Bridging chemistry, biological control, morphology and function. Pigment Cell and Melanoma Research. 22:563-579.
[https://doi.org/10.1111/j.1755-148X.2009.00610.x]

-
Singh O, Khanam Z, Misra N and Srivastava MK. (2011). Chamomile(Matricaria chamomilla L.): An overview. Pharmacognosy Reviews. 5:82-95.
[https://doi.org/10.4103/0973-7847.79103]

- So YG, Hwang JY, Kim HY, Jo HN and Lee TB. (2019). Skin hydration and skin barrier effects of Cymbopogon citratus and Perilla frutescens extracts. Journal of the Society of Cosmetic Scientists of Korea. 45:225-235.
-
Song JB, Kim YS, Kim LN, Park HJ, Lee DH and Kim HC. (2019). Anti-obesity effects of the flower of Prunus persica in high-fat diet-induced obese mice. Nutrients. 11:2176. https://www.mdpi.com/2072-6643/11/9/2176, (cited by 2020 April 20).
[https://doi.org/10.3390/nu11092176]

-
Uitto J, Li Q and Urban Z. (2013). The complexity of elastic fibre biogenesis in the skin-a perspective to the clinical heterogeneity of cutis laxa. Experimental Dermatology. 22:88-92.
[https://doi.org/10.1111/exd.12025]

- Um HJ and Kim GH. (2007). Studies on the flavonoid compositions of Elsholtzia spp. Korean Journal of Food and Nutrition. 20:103-107.
-
Wlaschek M, Tantcheva-Poór I, Naderi L, Ma W, Schneider LA, Razi-Wolf Z, Schüller J and Scharffetter-Kochanek K. (2001). Solar UV irradiation and dermal photoaging. Journal of Photochemistry and Photobiology B: Biology. 63:41-51.
[https://doi.org/10.1016/S1011-1344(01)00201-9]

-
Yeo JS, Chun SS and Choi JH. (2014). Antioxidant activities of solvent extracts from Rosa multiflora. Journal of Life Science. 24:1217-1223.
[https://doi.org/10.5352/JLS.2014.24.11.1217]

-
You SH and Moon JS. (2016). A Study on anti-oxidative, anti-inflammatory, and melanin inhibitory effects of Chrysanthemum sibiricum extract. Journal of the Korean Oil Chemists Society. 33:762-770.
[https://doi.org/10.12925/jkocs.2016.33.4.762]

-
Zhang S and Duan E. (2018). Fighting against skin aging: The way from bench to bedside. Cell transplantation. 27:729-738.
[https://doi.org/10.1177/0963689717725755]

