
강황 추출물의 비알코올성 지방간 질환 개선 효과
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Non-alcoholic fatty liver disease (NAFLD) is a chronic liver disease associated with multiple metabolic disorders. The medicinal plant Curcuma longa L. is widely distributed in Asia and has been used to treat a spectrum diseases in clinical practice. To date, there are inadequate reports of the effects of C. longa 50% EtOH extract (CE) on NAFLD. Therefore, in this study, we evaluate the CE on an NAFLD animal and elucidate the mechanism of action.
C57BL/6J mice fed a methionine-choline deficient diet (MCD) were treated with CE or milk thistle, and changes in inflammation and stetosis were assessed. Experimental animals were divided into six group (n = 10); Normal, MCD, MCD + CE 50 ㎎/㎏/day (CE 50), MCD + CE 100 ㎎/㎏/day (CE 100), MCD + CE 150 ㎎/㎏/day (CE 150), and the Control, MCD + Milk thistle 150 ㎎/㎏/day (MT 150). Body weight, liver weight, liver function, and histological changes were assessed in experimental animals. Quantitative real-time polymerase chain reaction and western blot analyses were performed on samples collected after 4 weeks of treatment. We observed that CE administration improved MCD-diet-induced lipid accumulation, and triglyceride (TG) and total cholesterol (TC) levels in serum. Treatment with CE also decreased hepatic lipogenesis through modulation of the sterol regulatory element binding protein-1 (SREBP-1), CCAAT-enhancer binding protein α (C/EBPα), fatty acid synthase (FAS), and peroxisome proliferator-activated receptor γ (PPARγ) expresion. In addition, the use of CE increased adenosine monophosphate-activated protein kinase (AMPK) phosphorylation and inhibited the up-regulation of toll-like receptor (TLR)-2 and TLR-4 signaling and the production of inflammatory mediators.
In this report, we observed that CE regulated lipid accumulation in an MCD diet-induced NAFLD model by decreasing lipogenesis. These data suggeste that CE could effectively protect mice against MCD-induced NAFLD, by inhibiting the TLR-2 and TLR-4 signaling cascades.
Keywords:
Curcuma longa L. (C. longa), Non-alcoholic Fatty Liver Disease, Methionine Choline Deficient-diet, Adenosine Monophosphate-activated Protein Kinase, Toll-like Receptor-2, Toll-like Receptor-4서 언
강황 (Curcuma longa L.)은 생강과 다년생 초본으로 원산지는 인도이고 인도네시아, 대만 일본 등지에서 재배되며, 그 성질은 따뜻하고 쓴맛이 나며 황색의 색소를 가지고 있다 (Choi, 2004). 약용식물로서 강황의 사용은 고대 인도의 전통 의약품으로 거슬러 올라갈 수 있으며, 우리나라에서도「세종실록지리지」,「신증동국여지승람」,「완산지」등의 고문헌에 전라북도 완주, 임실, 순창 등지에서 토산품으로 재배되었다는 기록이 있다 (Lee et al., 2016).
전통적으로 소화 및 간 기능을 돕고, 관절염 통증을 완화하고, 월경을 조절하고, 습진 및 상처 치유를 위해 피부에 직접 적용되는 한방 치료제로 사용되었으며, 최근에는 항박테리아, 항돌연변이, 항암, 항산화, 항염증 및 다양한 면역결핍 바이러스 질환에 강황의 약리효능이 보고되고 있다 (Ammon and Wahl, 1991; Ahsan et al., 1999; Kim et al., 2001; Lee et al., 2020). 특히, curcuminoids (curcumin, demethoxycurcumin, bisdemethoxycurcumin)와 같은 생리활성물질을 다량 함유하고 있으며, curcuminoids에 대한 기능성 연구가 최근 활발히 진행되고 있다 (Ahsan et al., 1999).
이전 연구에서도 curcumin과 bisdemethoxycurcumin의 비알콜성 지방간 개선 효과를 확인하였다 (Kang et al., 2013; Kim et al., 2016). 그러나 강황 추출물을 이용한 비알콜성 지방간 개선 효과에 대한 연구는 아직 미흡한 실정이다.
비알코올성 지방간 질환 (non-alcoholic fatty liver disease, NAFLD)은 주로 고탄수화물 식이에서 체내 유리지방산이 급격하게 증가되어 간에서 유리지방산의 흡수 및 중성지방의 생합성이 증가되면서 발병하게 된다 (Musi, 2006). 결과적으로, 과도하게 축적된 간 지질은 유리지방산의 합성을 증가시키고, 독성지질로 변환되어 활성산소종 및 염증반응을 일으키게 되면서 결과적으로 NAFLD를 유발하게 된다. 따라서 NAFLD의 이상적인 치료법은 중성지방의 축적을 억제할 뿐만 아니라 간에서의 염증도 효과적으로 억제해야 한다 (Sahebkar et al., 2014).
Adenosine monophosphate-activated protein kinas (AMPK)는 serine/threonine kinase이며, AMPK 경로는 세포의 에너지 균형의 조절에 중요한 역할을 하는 것으로 알려지며, AMPK 조절을 통한 NAFLD의 치료 가능성이 주목받고 있다 (Herzig and Shaw, 2017). AMPK의 활성화는 지방산 합성을 억제하고 산화를 촉진하고, 간 성상 세포의 활성화를 감소시켜 염증을 유발하는 것으로 알려져 있다 (Weng and Schuppan, 2013; Herzig and Shaw, 2017).
또한, NAFLD는 간 손상, 지방증, 염증 및 섬유증을 특징으로 하는 만성 진행성 간 대사 질환으로 염증, 지방 독성, 산화 스트레스 및 미토콘드리아 기능 장애를 포함한 여러 병원성 원인이 NAFLD 개시와 진행에 밀접한 관련이 있다 (Tilg and Moschen, 2010). 이들 원인 중 염증 반응은 NAFLD의 진행에 중추적인 역할을 하며, 선천성 면역 활성화는 NAFLD에서 간 염증을 유발하고 증폭하는 주요 요인으로 여겨진다 (Arrese et al., 2016). 이는 선천성 면역 세포 표면의 Toll-like receptors (TLRs)가 손상된 간세포로부터 방출된 패턴 인식 수용체 (PRRs)를 인식하고 활성화되어 간 염증 반응을 매개하는 것으로 알려진다 (Bieghs and Trautwein, 2003; Akira and Takeda, 2004).
TLRs 패밀리의 중요한 구성원으로서 TLR-2와 TLR-4는 NAFLD 환자와 동물 모델 모두에서 상향 조절되는 것으로 밝혀졌으며 (Yang et al., 2013; Kiziltas et al., 2014), TLR-4 결손 마우스는 정상적인 마우스와 비교하여 MCD 식이로 유도된 지방증 및 섬유증을 약화시킬 수 있다고 보고되었다 (Csak et al., 2011). 결과적으로, TLR-2와 TLR-4 메커니즘의 중재는 NAFLD 진행의 예방을 위한 바람직한 표적일 수 있다.
따라서 본 연구에서는 강황추출물 (CE)을 이용하여 비알콜성 지방간 동물모델에서의 개선 효과와 그 작용 기전을 선천 면역을 매개로 연구하였다.
재료 및 방법
1. 시약 및 재료
본 실험에 사용된 강황 (Curcuma longa L.)은 전라남도 진도군에서 구입하여 백남인 교수 (경희대학교 한방생명공학과)가 감정하여 사용하였다.
RNeasy Mini kit와 QuantiTect Reverse Transcription kit는 Qiagen (Hilden, Germany)로부터, power SYBR® Green PCR master mix는 Applied Biosystems (Foster City, CA, USA)에서 구입하였다. Anti-β-actin, PPARγ, C/EBPα, SREBP, FAS, TLR2 그리고 TLR4 antibodies는 Santa Cruz Biotechnology (Santa Cruz, CA, USA)로부터 구매하였으며, Anti-pThr172-AMPK antibodies는 Cell Signaling Technology (Danvers, MA, USA)로부터 구입하였다.
2. CE의 제조
유효성분 함량 및 수율 등 선행연구를 바탕으로 강황 건조물을 50% 주정을 이용하여 시료 중량의 10 배 용량에서 60℃, 6 시간 추출한 후 시료 중량의 7 배 용량에서 60℃, 4 시간씩 총 2 회 환류 추출하였다. 이후 60℃, 600 mH - 700 mH로 감압농축 및 동결건조하고 파워밀을 이용하여 80 mesh, 1,000 rpm으로 분쇄하여 CE (강황 50% 주정추출 분말; NIHHS-18-42458)를 제조하였다.
3. NAFLD 유도 및 시료투여
NAFLD 실험을 위해 메티오닌 콜린 결핍 식이요법 (Methionine Choline Deficient-diet, MCD-diet)으로 지방증 (steatosis)과 염증 감소를 확인한 연구를 진행하였다. 실험동물은 6 군 (n = 10)으로 나누어 실험을 진행하였다. 정상군 (normal diet without any treatment, Normal group)에는 정상사료를 섭취하게 하고, 대조군 (MCD group)으로는 MCD-diet를 섭취하게 하였으며, 실험군은 CE 저농도군 (MCD-diet + CE50 ㎎/㎏/day, CE50 group), CE 중간농도군 (MCD-diet + CE100㎎/㎏/day, CE100 group), CE 고농도군 (MCD-diet + CE150 ㎎/㎏/day, CE150 group), 그리고 대조군으로 밀크시슬 추출물 (MCD-diet + 150 ㎎/㎏/day, MT150 group)으로 나누어 실험하였다.
즉, 동물은 20 g 내외의 생후 7주령 C57BL/6J 수컷 생쥐를 ㈜ 중앙실험동물 (Seoul, Korea)로부터 구입하여 실험에 사용하였다. NAFLD를 유도하기 위해 MCD-diet 사료를 ㈜중앙실험동물 (Seoul, Korea)로부터 구입하여 실험에 사용하였으며, 1 주 동안 적응시킨 후 본 실험을 시작하였다. 실험 기간 중 명암주기는 12 시간 간격, 온도 25 ± 2℃, 습도 55%로 실험실 환경을 유지하였다. 시판 고형사료와 MCD-diet 사료는 Dyets사 (Bethlehem, PA, USA)의 제품을 ㈜중앙실험동물로부터 구입하여 실험에 사용하였다. 7 일 동안 안정화시켰다.
실험은 4 주간 진행하였으며 CE group과 MT group은 각각의 그룹에 맞게 매일 1 회 경구로 투여하였고, MCD-diet를 4 주간 공급하였다. Normal군에는 동량의 생리식염를 투여하였고 일반식이를 공급하였다. 4 주간 실험동물의 체중을 주 2 회 간격으로 측정하였으며, 실험동물은 4 주의 실험이 끝난 후 CO2 마취 후 방혈을 통해 희생되었다. 이번 동물실험은 원광대학교 동물실험윤리위원회에서 동물보호법에 의거하여 검토하고 승인받았다 (승인번호; WKU18-34).
4. Biochemical 분석과 혈중 지질함량의 측정
4 주간의 약재 투여 후 동물을 희생하고 혈액을 채취하여 생화학검사를 시행하였다. 상업용 효소 키트 (Asan, Seoul, Korea)를 사용하여 혈청에서 triglyceride (TG), total cholesterol (TC), glutamic oxaloacetic transaminase (GOT), 그리고 glutamic-pyruvic transaminase (GPT)를 측정하였다.
5. Enzyme-linked immunosorbent assay (ELISA) 분석법
4 주간의 약재 투여 후 동물을 희생하고 혈액을 채취하여 혈청에 효소 결합 면역 흡착법을 적용하였다. IL-6 및 TNF-α kit는 BD Biosciences (San Jose, CA, USA)를 사용하여 ELISA 분석법을 사용하였다. 흡광도는 마이크로 플레이트 리더 (Biotec, Chicago, IL, USA)를 사용하여 450 ㎚에서 판독하였다. 모든 실험은 세 번 반복 실행했다 (n = 3).
6. Hematoxylin과 eosin stain
4 주간 MCD-diet 및 약재 투여 후 mice를 CO2 마취하에 채혈 및 방혈·치사시켰다. 간 조직을 적출하여 10% formaldehyde으로 고정시킨 다음 12 시간 이상 흐르는 물에서 formaldehyde를 세척한 후 60% ethanol에서 1 시간, 70% ethanol에서 1 시간, 80% ethanol에서 1 시간, 90% ethanol에서 1 시간, 100% ethanol에서 1 시간 간격으로 수세하였다. 그리고 xylene에 1 시간씩 3 회의 투명과정과 파라핀에 1 시간씩 2 회의 침투과정을 실시하였으며, 굳은 파라핀 블럭을 약 4 ㎛ 두께로 잘라 절편을 얻었다.
절편은 hematoxylin과 eosin (H&E) 염색법으로 염색 후 광학현미경으로 분석하였다. 사진은 Axio Observer Z1 microscope (Carl Zeiss MicroImaging GmbH, Göttingen, Germany)를 이용해 얻었다.
7. RNA분리 및 qRT-PCR
Easy-BLUETM total-RNA extraction kit (Intron Biotechnology Inc., Seongnam, Korea)를 사용하여 RNA를 분리하였다. 동물의 간 조직을 적당량 취하여 easy-BLUE solution에 넣은 후 균질화하였다. 여기에 chloroform 200 ㎕를 넣고 다시 교반하여 13,000 rpm, 4℃에서 10 분간 원심분리한 다음, 상등액 400 ㎕에 isopropanol을 가하여 다시 원심분리하여 RNA 펠렛을 얻었다.
여기서 얻어진 RNA에 MuLV 역전사효소 (reverse transcriptase), 1 mM dNTP 0.5㎍을 넣어 cDNA를 만들었다. qRT-PCR은 power SYBR® Green PCR master mix (Thermo Fisher Scienctific, Waltham, MA, USA)를 사용하여 StepOnePlus Real-Time RT-PCR System (Applied Biosystems, Foster City, CA, USA)을 통해 분석하였다. 프라이머는 Table 1에 나타내었다. 상대적인 gene 발현량은 StepOne software v2.3 (Applied Biosystems, Foster City, CA, USA)를 사용하여 상대적인 threshold cycle number (CT)값을 통해 계산하였다. β-actin을 기준값으로 사용하였다.
8. Western blot analysis
Western blot 분석을 위한 시료는 C57BL/6J 쥐의 간 조직을 lysis buffer (20 mM Tris, 1 mM Na3vo4, 1 mM phenymethylsufonyl fluoride, 50 mM NaF)를 처리하여 단백질을 추출한 다음 정량하였다.
간에서 추출한 동량의 단백질을 SDS PAGE gel에서 전기 영동하여 단백질은 크기 별로 분리한 후 polyvinylidene membrane (Millipore, Bedford, MA, USA)에 1 시간 동안 전이시켰다. 5% skim milk에 1 시간 동안 blocking 하였고, 1차 항체는 4℃에서 밤새 반응시켰다. 수 차례의 세척 과정을 거친 뒤 2차 항체를 상온에서 1 시간 반응시킨 다음 ECL prime Western blotting detection reagents (GE Healthcare, Piscataway, NJ, USA)와 ImageQuant LAS 4000 Mini Biomolecular Imager (GE Healthcare, Piscataway, NJ, USA)를 사용하여 단백질 발현을 확인하였다.
9. 통계분석
모든 실험값은 3 반복으로 수행하여 결과 값을 평균 ±표준편차 (means ± SD)로 표시했으며, 통계분석은 SPSS (Statistical Package for the Social Science, Chicago, IL, USA) 프로그램을 이용하여 각 결과로부터 ANOVA를 구한 후 Duncan’s Multiple Range Test (DMRT)를 이용하였고, 통계적 유의성을 5% 수준에서 분석하였다 (p < 0.05).
결과 및 고찰
1. CE가 MCD-식이로 유도한 쥐의 간중량 및 혈액학적 변화에 미치는 영향
실험을 시작한 날부터 주 2 회 간격으로 실험동물의 체중을 측정하였다. MCD-diet로 유도되는 비알코올성 지방간 모델은 HFD를 사용한 모델과 다르게 체중이 감소하는 경향이 나타나는 특징을 가지고 있다. 따라서 Normal군에 비해 MCD군은 체중 감소가 뚜렷하게 나타났으나, CE 투여군에서는 체중변화의 유의성은 나타나지 않았다. 또한 간무게 역시 실험군 간의 유의성은 나타나지 않았다 (Table. 2).
MCD-diet는 간에서 지질의 배출 장애를 동반하여 지방간을 유도한다. 따라서 MCD-diet에 의하여 유도되는 혈액학적 변화에 대한 CE의 영향을 알아보기 위하여 실험동물의 혈청에 포함된 지질 즉, TG, TC, HDL 및 LDL을 측정하였다. 그 결과, Normal군 (30.4 ± 10.7 ㎎/㎗) 대비 MCD군 (101.3 ± 14.4 ㎎/㎗) 에서 TG 함량이 확연히 증가하였으며, CE50군 (90.5 ± 11.1 ㎎/㎗), CE100군 (60.3 ± 2.3 ㎎/㎗), CE150군 (51.9 ± 5.2 ㎎/㎗)에서는 농도 의존적으로 TG 함량이 감소하였다. TC의 함량도 MCD군에서 증가하였다가 실험군 (CE50 군, CE100군, CE150군)에서는 감소하는 양상을 보였다 (Table. 3). 특히, CE150군에서는 양성대조군으로 사용한 MT150군 보다 TG 및 TC 함량이 더욱 감소하였다.

Effects of C. longa 50% ethanol extract on triglyceride, total cholesterol, high density lipoprotein and low density lipoprotein for the methionine-choline deficient diet mice.(㎎/㎏/day)
또한, GOT와 GPT level은 NAFLD에서 간세포 손상 지표이다. 실험군 (CE100군, CE150군)에서 GOT와 GPT level이 MCD군에 비교하여 감소하였다 (Fig. 1). 이러한 결과로 보아 CE100군과 CE150군의 투여는 MCD-diet로 인해 유발된 간의 기능 장애를 개선하는 효과가 있는 것으로 생각된다. CE50군은 통계적으로 유의한 효과를 나타내지 않았기에 다음 실험에서는 제외하고 진행하였다.
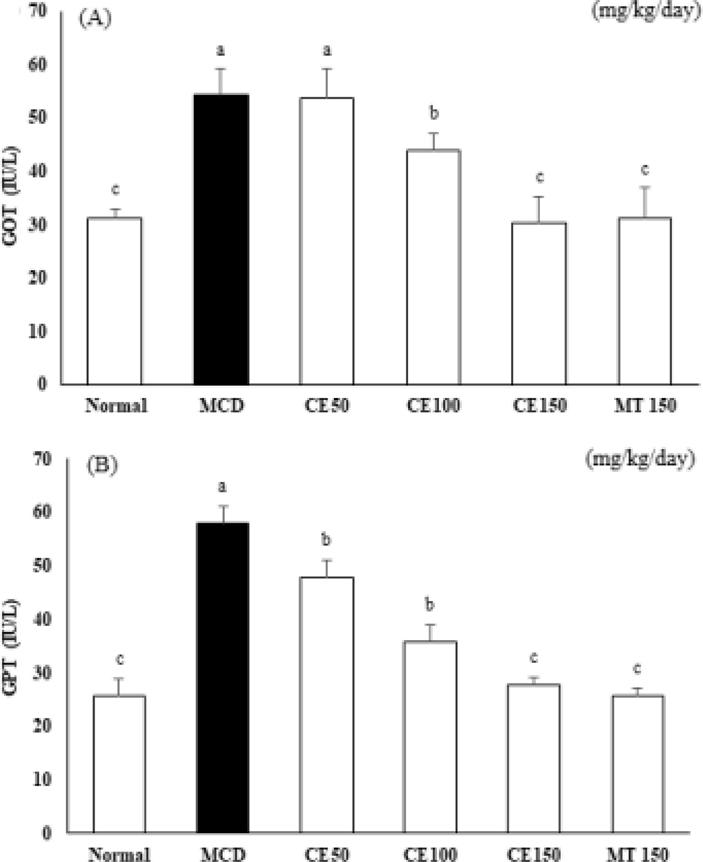
Effects of C. longa 50% ethanol extract on glutamic oxaloacetic transaminase (GOT) and glutamic-pyruvic transaminase (GPT) levels in mice.Mice were fed a control diet or the methionine choline deficient (MCD) diet for 4 weeks. Blood samples were collected, and plasma GOT (A) and GPT (B) levels were determined. Means ± SD from seven animals is presented (n = 10). Means with difference letters are significantly different at p < 0.05 by Duncan's Multiple Range Test (DMRT). MCD; methionine-choline deficient diet, CE50; 50 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE100; 100 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE150; 150 ㎎/㎏/day treatment of C. longa 50% ethanol extract, MT150; 150 ㎎/㎏/day treatment of milk thistle.
2. 병리조직학적 검사에서 CE의 영향
실험동물을 희생시킨 후 장기를 적출하여 간의 상태를 육안으로 확인할 결과 Normal군 대비 MCD군에서 간의 색상이 노랗게 변하여 지방축적이 이루어졌음을 확인할 수 있었으며, 실험군에서는 상대적으로 지방축적이 억제되었음을 확인할 수 있었다 (Fig. 2A).
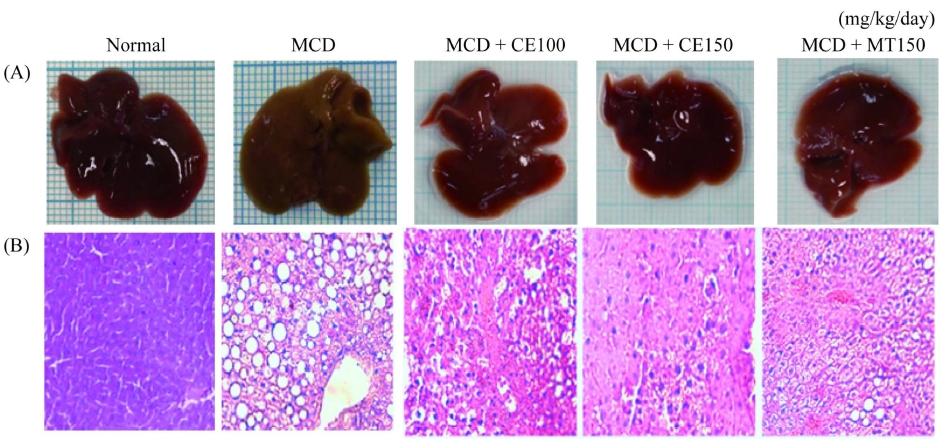
Histological analysis of liver steatosis and liver morphology.(A): Liver gross morphology, (B): Liver sections stained with hematoxylin and eosin (H&E). Original magnification, magnification; × 400. MCD; methionine-choline. deficient diet, CE50; 50 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE100; 100 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE150; 150 ㎎/㎏/day treatment of C. longa 50% ethanol extract, MT150; 150 ㎎/㎏/day treatment of milk thistle.
H&E 염색법을 사용하여 간의 병리조직학적 변화를 분석한 결과, Normal군에서는 간소엽의 입체구조가 잘 유지되어 있었으며, 이에 반해, MCD-diet군에서는 간소엽의 입체구조가 소실되며 많은 지방이 축적되었음이 관찰되었다. 그 결과 CE100군에서는 지방 입자의 크기와 수의 감소가 관찰되었고, CE150군에서는 지방 입자가 거의 관찰되지 않아 CE에 의해 지방간이 개선됨을 확인하였다 (Fig. 2B). MT150군은 양성대조군 사용하였다.
3. 간 조직 내 전사인자들의 발현에 대한 CE의 영향
SREBPs는 이러한 지방 생합성 과정과 인슐린을 매개하는 중요한 전사인자로서 지방산과 콜레스테롤의 합성을 조절한다 (Leevy, 1962; Wanless and Lentz, 1990). 이중 SREBP-1c는 지방산과 중성지방 합성에 관여하는 중요한 전사인자로서, 인슐린에 의해 활성화되어 간 조직 내 지방산과 중성지방의 농도를 높이고 중성지방을 간 조직 내에 저장하게 된다 (Lee 1989; Bacon et al., 1994).
C/EBPα 역시 중성지방의 대사를 조절하고 세포 내 중성지방의 축적을 유도하는 것으로 알려져 있다 (Farmer, 2006). 또한, FAS는 대사질환 등에서 나타나는 인슐린 저항성은 혈액 내 인슐린 농도를 높이고, 이로 인해 지방산 생합성 경로에 관여한다 (Brunt, 2002). 지방세포 분화과정 중 초기단계에서 발현되는 PPARγ는 C/EBPα와 상호작용으로 지질합성에 관련된 유전자의 발현에 관여하는 것으로 보고되어 있다 (Gervois et al., 2000).
따라서 MCD-diet에 의해 유도된 지방간 모델에서 CE가 간 조직 내 전사인자의 발현에 미치는 영향을 알아보기 위해 실험동물의 간 조직에서 SREBP-1c와 C/EBPα, FAS, PPARγ의 발현을 Western blot과 qRT-PCR 분석법을 이용해 살펴보았다 (Fig. 3, 4). Fig. 3의 결과에서 SREBP-1c와 C/EBPα, FAS, PPARγ의 protein 발현이 MCD군의 간 조직에서 증가하였고, 약물을 처리한 CE100군과 CE150군에서는 감소하였다. 또한 SREBP-1c와 C/EBPα, FAS, PPARγ의 유전자발현 역시 MCD군에서 증가하였다가 약물 처리 시 감소하는 것을 확인할 수 있었다 (Fig. 4).
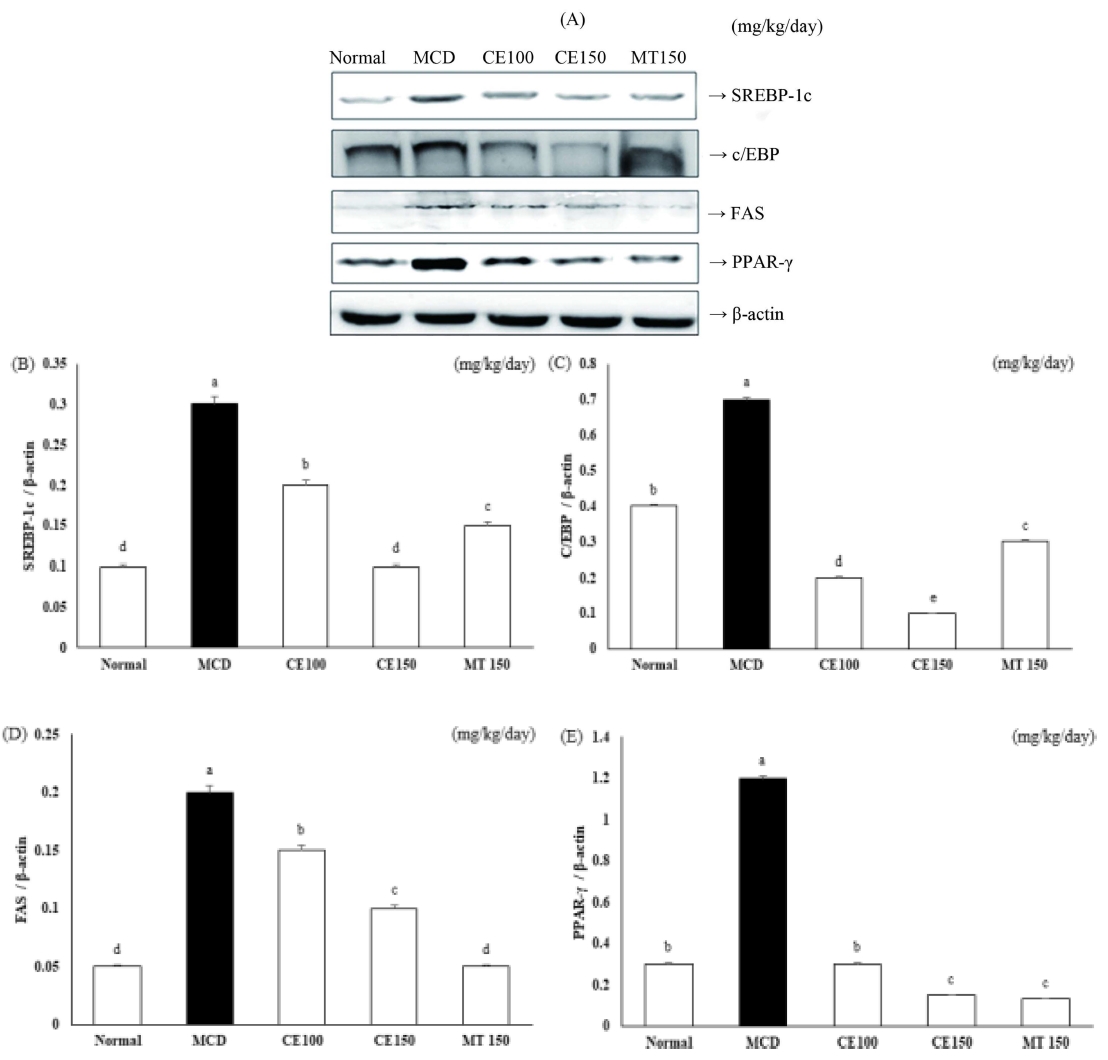
Effects of C. longa 50% ethanol extract on hepatic lipogenesis protein expression in methionine-choline deficient diet mice.Sterol regulatory element binding protein (SREBP)-1c, CCAAT/enhancer binding protein (C/EBP)α, fatty acid synthase (FAS), and peroxisome proliferator activated receptor (PPAR)-γ, protein expression levels were detected by Western blot analysis (A). Expression levels were normalized to those of the β-actin protein. Numbers below the panels represent quantification of the Western blot by densitometry (B - E). Means ± SD from seven animals is presented (n = 10). Means with difference letters are significantly different at p < 0.05 by Duncan's Multiple Range Test (DMRT). MCD; methionine-choline deficient diet, CE50; 50 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE100; 100 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE150; 150 ㎎/㎏/day treatment of C. longa 50% ethanol extract, MT150; 150 ㎎/㎏/day treatment of milk thistle.
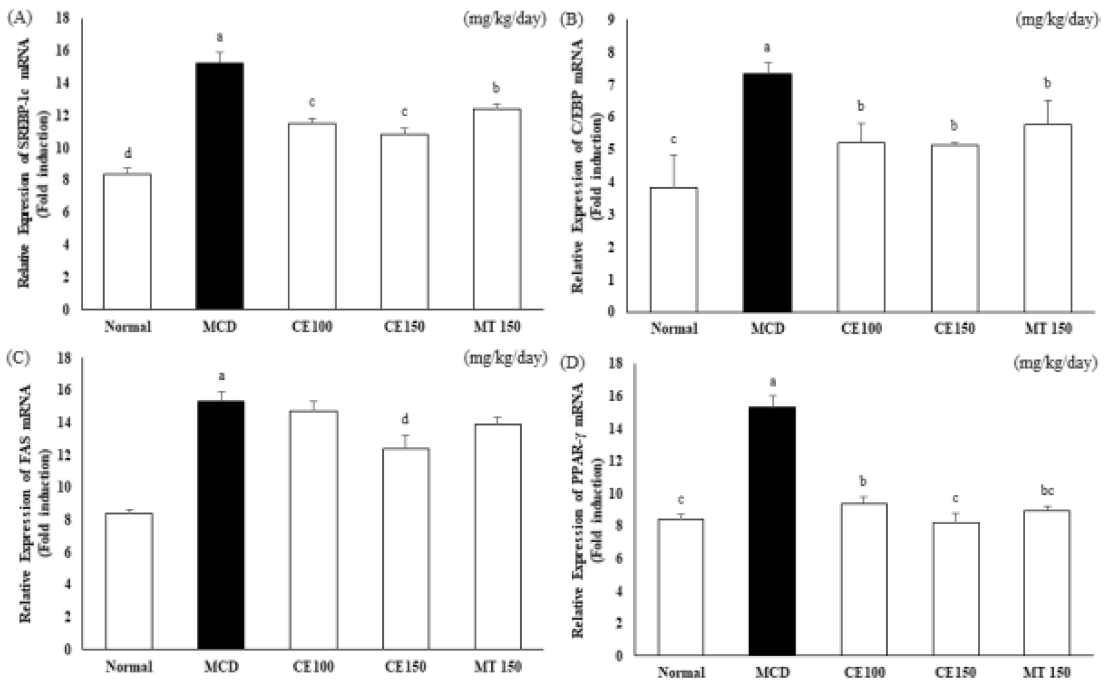
Effects of C. longa 50% ethanol extract on mRNA expression levels on hepatic lipogenesis gene in methionine-choline deficient diet mice.Data are representative of three independent experiments and quantified by densitometric analysis. mRNA expression levels were evaluated by real-time polymerase chain reaction and normalized to GAPDH levels. Means ± SD from seven animals is presented (n = 10). Means with difference letters are significantly different at p < 0.05 by Duncan's Multiple Range Test (DMRT). MCD; methionine-choline deficient diet, CE50; 50 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE100; 100 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE150; 150 ㎎/㎏/day treatment of C. longa 50% ethanol extract, MT150; 150 ㎎/㎏/day treatment of milk thistle.
특히 SREBP-1c와 C/EBPα 단백질 발현과 SREBP-1c와 C/EBPα, FAS mRNA발현에서는 대조군으로 사용한 MT150군에 비해 CE150군에서 유의적인 억제 양상을 보였다. 이러한 결과로 보아 앞에서 관찰된 간 조직 내 축적된 지질의 함량 변화에 대한 CE의 영향과 전사인자 발현 조절 사이에 밀접한 연관성이 있음을 알 수 있다. 또한, CE은 간 내에서 일어나는 지방산의 합성과 중성지방의 축적에 관여하는 단백질의 발현을 억제함으로서 지방의 축적과 지방세포로의 분화를 저해하는 것으로 생각된다.
4. AMPK 인산화에 대한 CE의 영향
AMPK는 에너지 대사를 조절하는 조절 센서로서 AMPK의 활성화는 지방산 산화를 촉진하고 지질의 생합성을 억제하는 것으로 알려져 있다. 활성화된 AMPK는 ATP를 소비하는 과정인 지방산 합성 및 콜레스테롤 합성을 억제하고, ATP를 생산하는 과정인 지방산 산화 및 해당과정을 촉진 시킨다 (Hardie, 2007).
SREBP-1c의 발현을 억제하여 지방산 생합성에 관여하는 유전자의 발현을 감소시킴으로써 지방산 생합성을 저해한다고 알려져 있다 (Viollet et al., 2009). 따라서 AMPK의 활성화에 대한 CE의 영향을 조사하기 위해 Western blot 분석법으로 AMPK의 인산화를 확인하였다. 그 결과 Normal군에 비해 MCD군에서 AMPK의 인산화가 감소되었으며 CE100군과 CE150군에서 유의성 있게 증가하였다 (Fig. 5).
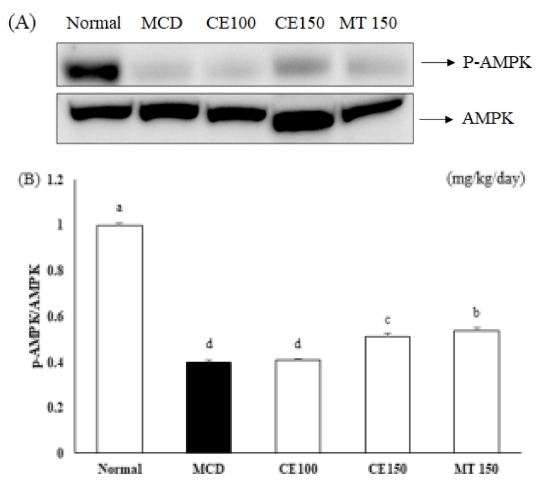
Effects of C. longa 50% ethanol extract on 5' AMP-activated protein kinase (AMPK) phosphorylation in methionine-choline deficient diet mice.AMPK phosphorylation (pThr-172-AMPK) by Western blot analysis. Expression levels were normalized to that of the AMPK protein (A). Numbers below the panels represent quantification of the Western blot by densitometry (B). Means ± SD are presented (n = 10). Means with difference letters are significantly different at p < 0.05 by Duncan's Multiple Range Test (DMRT). MCD; methionine-choline deficient diet, CE50; 50 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE100; 100 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE150; 150 ㎎/㎏/day treatment of C. longa 50% ethanol extract, MT150; 150 ㎎/㎏/day treatment of milk thistle.
5. 지방간염 대한 CE의 영향
TLR은 면역 세포 및 실질 간세포의 표면에서 발현되고, 간 염증 조절에 관여한다 (Seki and Brenner, 2008). 활성화된 TLR 신호 전달은 염증성 사이토카인 및 케모카인의 생성을 유도하고 이는 염증 신호의 유지 및 증폭에 필수이다 (Kesar and Odin, 2013).
만성 간 질환에서 가장 많이 연구된 TLR-4는 NAFLD의 진행에 관여하는 다중 신호 전달 경로를 매개한다. TLR-4 및 그의 하류 신호 전달 분자의 활성화는 다양한 전염증성 사이토카인의 생성을 증가시켜 염증 및 간 손상을 야기한다 (Kesar and Odin, 2013). NAFLD에서, 간에서의 과도한 축적된 지질은 간세포 손상을 유발하고, 손상된 간세포는 손상 관련 분자 패턴 (DAMP)을 방출하며, 이는 TLR4와 상호 작용함으로써 선천성 면역 반응을 유발할 수 있다 (Pessayre et al., 2001). TLR-4는 ND-κB 및 MAPK의 전사의 추가 활성화를 유도하기 위해 MyD88 (TLR-4의 어댑터 단백질)을 모으고, 활성화된 NF-κB 및 MAPK는 TNF-α, IL-1β 및 IL-6과 같은 전염증성 사이토카인의 생성을 촉진한다 (O'Neill and Bowie, 2007; Lu et al., 2008; Seki and Brenner, 2008).
결과적으로 이러한 전염증성 사이토카인은 더 많은 DAMP를 방출하여 간세포 손상을 야기하게 되고, DAMP는 TLR-4를 활성화시켜, 염증반응을 연속해서 증폭하게 된다.
간에서 MCD에 의해 증가된 전염증성 사이토카인이 CE에 의해 억제되는지 ELISA 실험법으로 실험하였다. 혈청에서 IL-6와 TNF-α level은 MCD군에서 증가하였으며, CE100군, CE150군에서 IL-6와 TNF-α level이 감소하였다 (Fig. 6). 또한 이러한 전염증성 사이토카인의 생성을 촉진하는 인자로 TLR-2와 TLR-4의 발현을 살펴본 결과 Fig. 7과 Fig. 8에 나타난 결과와 같아 TLR-2와 TLR-4의 단백질 발현과 mRNA 발현이 MCD군에서 증가하였고, CE100군, CE150군에서 농도 의존적으로 감소하였다. 특히, TLR-4의 발현은 대조군으로 사용한 MT150군에 비해 확연히 감소하였다. 이러한 결과는 CE가 TLR2와 TLR4 신호 전달 경로의 활성화를 차단하여 전염증성 사이토카인 IL-6와 TNF-α의 생산을 약화시킬 수 있음을 나타낸다.
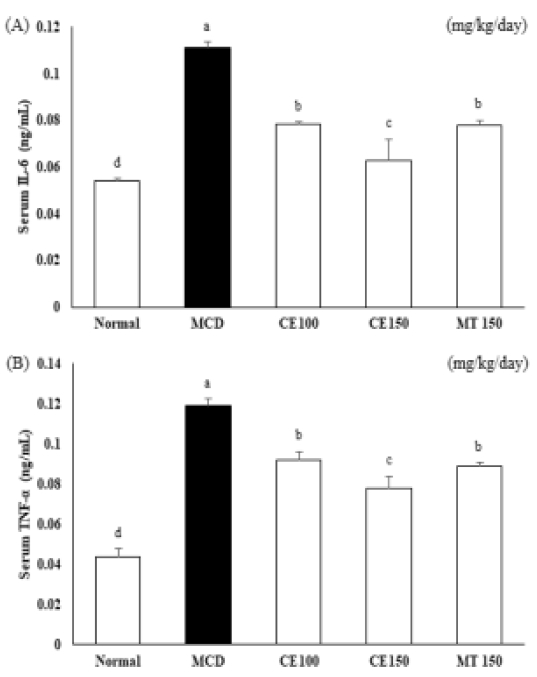
Effects of C. longa 50% ethanol extract on level of interleukin (IL)-6 and tumor necrosis factor (TNF)-α in methionine-choline deficient diet mice.Mice were fed a control diet or the methionine choline deficient (MCD) diet for 4 weeks. Blood samples were collected, and plasma IL-6 (A) and TNF-α (B) concentrations were determined. Means ± SD are presented (n = 10). Means with difference letters are significantly different at p < 0.05 by Duncan's Multiple Range Test (DMRT). MCD; methionine-choline deficient diet, CE50; 50 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE100; 100 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE150; 150 ㎎/㎏/day treatment of C. longa 50% ethanol extract, MT150; 150 ㎎/㎏/day treatment of milk thistle.
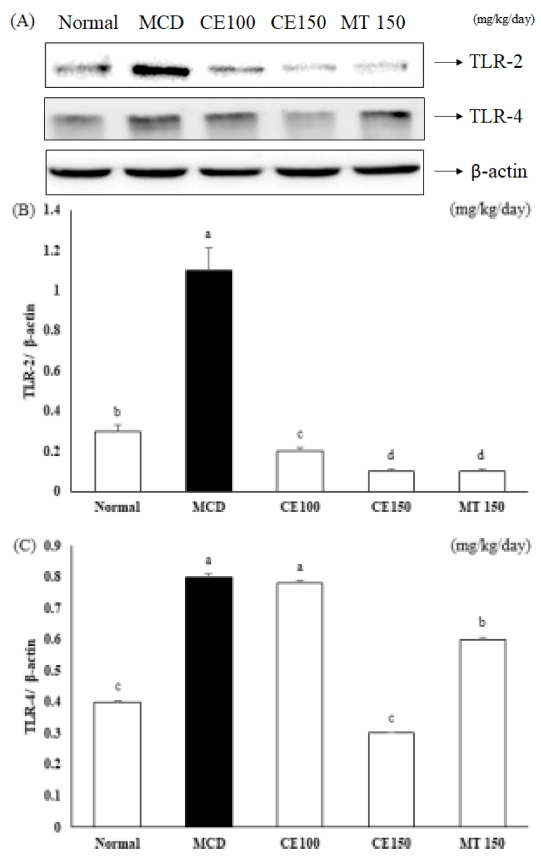
Effects of C. longa 50% ethanol extract on mRNA expression for toll-like receptors protein in methionine-choline deficient diet mice.Toll-like receptor-2 and toll-like receptor-4 protein expression levels were detected by Western blot analysis (A). Expression levels were normalized to those of the β-actin protein. Numbers below the panels represent quantification of the Western blot by densitometry (B - C). Means ± SD are presented (n = 10). *Means with difference letters are significantly different at p < 0.05 by Duncan's Multiple Range Test (DMRT). MCD; methionine-choline deficient diet, CE50; 50 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE100; 100 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE150; 150 ㎎/㎏/day treatment of C. longa 50% ethanol extract, MT150; 150 ㎎/㎏/day treatment of milk thistle.
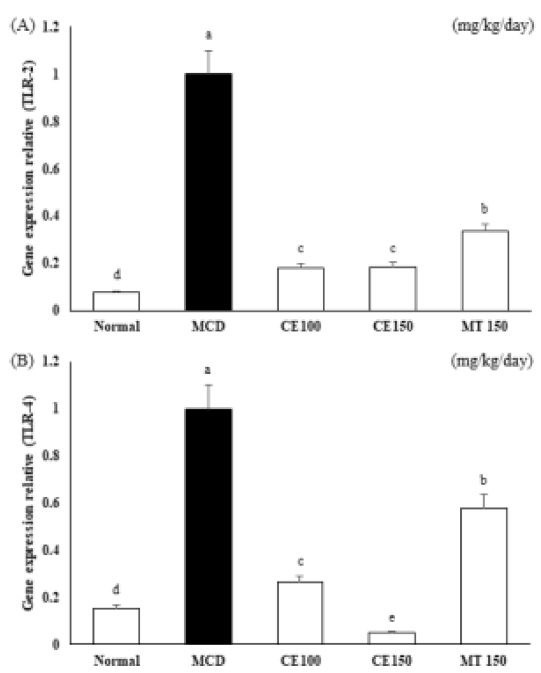
Effects of C. longa 50% ethanol extract on mRNA expression for toll-like receptors in methionine-choline deficient diet mice.Toll-like receptor-2 (A) and toll-like receptor-4 (B) mRNA expression levels were devaluated by real-time polymerase chain reaction and normalized to GAPDH levels. Means ± SD are presented (n = 10). Means with difference letters are significantly different at p < 0.05 by Duncan's Multiple Range Test (DMRT). MCD; methionine-choline deficient diet, CE50; 50 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE100; 100 ㎎/㎏/day treatment of C. longa 50% ethanol extract, CE150; 150 ㎎/㎏/day treatment of C. longa 50% ethanol extract, MT150; 150 ㎎/㎏/day treatment of milk thistle.
결론적으로 MCD-diet로 지방축적을 유도한 실험동물에서 CE은, 지방산과 중성지방의 대사과정에 간의 지방축적과 관련된 전사인자와 효소의 발현을 조절하고, 지질합성을 억제하며, 지질의 배출을 정상화하는 효과가 있음을 알 수 있다. 특히, AMPK 경로를 통해서 지방산 산화 촉진 작용을 나타내고 있으며, 지방산 합성 저해 작용도 나타내고 있음을 확인할 수 있었다. 또한, 지방간의 진행에 의하여 나타나는 지방간염에서도 CE는 TLR-2와 TLR-4 신호 전달 경로의 활성화를 차단하여 전 염증 매개체의 생산을 약화시킬 수 있음을 나타낸다.
추가적으로 국내산 강황 (Curcuma longa L.) 추출물과 그 유효성분을 활용한 비알콜성 지방간 동물모델을 이용한 효능 평가 연구 및 분자생물학적인 방법을 통한 기전 연구 등의 기초자료로 활용될 것으로 판단된다. 이러한 심도 있는 연구를 통해 강황 추출물은 간 건강에 대한 기능성 원료로 개발될 가능성이 높다고 사료된다.
Acknowledgments
본 연구는 농촌진흥청 차세대바이오그린21사업(과제번호: PJ01327501)의 지원에 의해 이루어진 것으로 이에 감사드립니다.
References
-
Ahsan H, Parveen N, Khan NU and Hadi SM. (1999). Pro-oxidant, anti-oxidant and cleavage activities on DNA of curcumin and its derivatives demethoxycurcumin and bisdemethoxycurcumin. Chemico-biological Interactions. 121:161-175.
[https://doi.org/10.1016/S0009-2797(99)00096-4]

-
Akira S and Takeda K. (2004). Toll-like receptor signalling. Nature Reviews Immunology. 4:499-511.
[https://doi.org/10.1038/nri1391]

-
Ammon HP and Wahl MA. (1991). Pharmacology of Curcuma longa. Planta Medica. 57:1-7.
[https://doi.org/10.1055/s-2006-960004]

-
Arrese M, Cabrera D, Kalergis AM and Feldstein AE. (2016). Innate immunity and inflammation in NAFLD/NASH. Digestive Diseases and Sciences. 61:1294-1303.
[https://doi.org/10.1007/s10620-016-4049-x]

-
Bacon BR, Farahvash MJ, Janney CG and Neuschwander-Tetri BA. (1994). Nonalcoholic steatohepatitis: An expanded clinical entity. Gastroenterology. 107:1103-1109.
[https://doi.org/10.1016/0016-5085(94)90235-6]

-
Bieghs V and Trautwein C. (2003). The innate immune response during liver inflammation and metabolic disease. Trends in Immunology. 34:446-452.
[https://doi.org/10.1016/j.it.2013.04.005]

-
Brunt EM. (2002). Alcoholic and nonalcoholic steatohepatitis. Clinics in Liver Disease. 6:399-420.
[https://doi.org/10.1016/S1089-3261(02)00002-8]

- Choi SK. (2004). Growth characteristics of Curcuma longa L. in southern part of Korea. Korean Journal of Medicinal Crop Science. 12:85-88.
-
Csak T, Velayudham A, Hritz I, Petrasek J, Levin I, Lippai D, Catalano D, Mandrekar P, Dolganiuc A, Kurt-Jones E and Szabo G. (2011). Deficiency in myeloid differentiation factor-2 and toll-like receptor 4 expression attenuates nonalcoholic steatohepatitis and fibrosis in mice. American Journal of Physiology. Gastrointestinal and Liver Physiology. 300:433-441.
[https://doi.org/10.1152/ajpgi.00163.2009]

-
Farmer SR. (2006). Transcriptional control of adipocyte formation. Cell Metabolism. 4:263-273.
[https://doi.org/10.1016/j.cmet.2006.07.001]

-
Gervois P, Torra IP, Fruchart JC and Staels B. (2000). Regulation of lipid and lipoprotein metabolism by PPAR activators. Clinical Chemistry and Laboratory Medicine. 38:3-11.
[https://doi.org/10.1515/CCLM.2000.002]

-
Hardie DG. (2007). AMP-activated/SNF1 protein kinases: Conserved guardians of cellular energy. Nature Reviews. Molecular Cell Biology 8:774-785.
[https://doi.org/10.1038/nrm2249]

-
Herzig S and Shaw RJ. (2017). AMPK: Guardian of metabolism and mitochondrial homeostasis. Nature Reviews Molecular Cell Biology. 19:121-135.
[https://doi.org/10.1038/nrm.2017.95]

- Kang OH, Kim SB, Seo YS, Joung DK, Mun SH, Choi JG, Lee YM, Kang DG, Lee HS and Kwon DY. (2013). Curcumin decreases oleic acid-induced lipid accumulation via AMPK phosphorylation in hepatocarcinoma cells. European Review for Medical and Pharmacological Sciences. 17:2578-2586.
-
Kesar V and Odin JA. (2013). Toll-like receptors and liver disease. Liver International. 34:184-196.
[https://doi.org/10.1111/liv.12315]

-
Kim DS, Park SY and Kim JY. (2001). Curcuminoids from Curcuma longa L.(Zingiberaceae) that protect PC12 rat pheochromocytoma and normal human umbilical vein endothelial cells from βA(1–42) insult. Neuroscience Letters. 303:57-61.
[https://doi.org/10.1016/S0304-3940(01)01677-9]

-
Kim SB, Kang OH, Lee YS, Han SH, Ahn YS, Cha SW, Seo YS, Kong R and Kwon DY. (2016). Hepatoprotective effect and synergism of bisdemethoycurcumin against MCD diet-induced nonalcoholic fatty liver disease in mice. PLoS One. 11:e0147745. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0147745, (cited by 2020 May 11).
[https://doi.org/10.1371/journal.pone.0147745]

-
Kiziltas S, Ata P, Colak Y, Mesçi B, Senates E, Enc F, Ulasoglu C, Tuncer I and Oguz A. (2014). TLR4 gene polymorphism in patients with nonalcoholic fatty liver disease in comparison to healthy controls. Metabolic Syndrome and Related Disorders. 12:165-170.
[https://doi.org/10.1089/met.2013.0120]

-
Lee JH, Oh MW, Jang HD, Lee YJ, Jeong JT and Park CG. (2020). Growth characteristics of turmeric(Curcuma longa L.) germplasms and storage conditions of seed rhizomes. Korean journal of Medicinal Crop Science. 28:47-55.
[https://doi.org/10.7783/KJMCS.2020.28.1.47]

-
Lee RG. (1989). Nonalcoholic steatohepatitis: A study of 49 patients. Human Pathology. 20:594-598.
[https://doi.org/10.1016/0046-8177(89)90249-9]

-
Lee YJ, Kim AK, Kim OH, Lee CY, Lee HK, Jung SO, Lee SR, Kim HS, Kim IY, Yu IS and Jung K. (2016). Sulfur dioxide, heavy metal and curcumin contents in market-available turmeric(Curcuma longa L.). Korean Journal of Medicinal Crop Science. 24:121-128.
[https://doi.org/10.7783/KJMCS.2016.24.2.121]

-
Leevy CM. (1962). Fatty liver: A study of 270 patients with biopsy proven fatty liver and a review of the literature. Medicine. 41:249-278.
[https://doi.org/10.1097/00005792-196209000-00003]

-
Lu YC, Yeh WC and Ohashi PS. (2008). LPS/TLR4 signal transduction pathway. Cytokine. 42:145-151.
[https://doi.org/10.1016/j.cyto.2008.01.006]

-
Musi N. (2006). AMP-activated protein kinase and type 2 diabetes. Current Medicinal Chemistry. 13:583-589.
[https://doi.org/10.2174/092986706776055724]

-
O'Neill LAJ and Bowie AG. (2007). The family of five: TIR-domain-containing adaptors in Toll-like receptor signalling. Nature Reviews. Immunology. 7:353-364.
[https://doi.org/10.1038/nri2079]

-
Pessayre D, Berson A, Fromenty B and Mansouri A. (2001). Mitochondria in steatohepatitis. Seminars in Liver Disease. 21:57-70.
[https://doi.org/10.1055/s-2001-12929]

-
Sahebkar A, Chew GT and Watts GF. (2014). New peroxisome proliferator-activated receptor agonists: Potential treatments for atherogenic dyslipidemia and non-alcoholic fatty liver disease. Expert Opinion on Pharmacotherapy. 15:493-503.
[https://doi.org/10.1517/14656566.2014.876992]

-
Seki E and Brenner DA. (2008). Toll-like receptors and adaptor molecules in liver disease: Update. Hepatology. 48:322-335.
[https://doi.org/10.1002/hep.22306]

-
Tilg H and Moschen AR. (2010). Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis. Hepatology. 52:1836-1846.
[https://doi.org/10.1002/hep.24001]

-
Viollet B, Guigas B, Leclerc J, Hébrard S, Lantier L, Mounier R, Andreelli F and Foretz M. (2009). AMP-activated protein kinase in there gulation of hepatic energy metabolism: From physiology to therapeutic perspectives. Acta Physiologica. 196:81-98.
[https://doi.org/10.1111/j.1748-1716.2009.01970.x]

-
Wanless IR and Lentz JS. (1990). Fatty liver hepatitis (steatohepatitis) and obesity: An autopsy study with analysis of risk factors. Hepatology. 12:1106-1110.
[https://doi.org/10.1002/hep.1840120505]

-
Weng SY and Schuppan D. (2013). AMPK regulates macrophage polarization in adipose tissue inflammation and NASH. Journal of Hepatology. 58:619-621.
[https://doi.org/10.1016/j.jhep.2012.09.031]

- Yang Q, Huang J, Zhang Y, Wang Q, He X, Feng G, Wang W and Li Z. (2013). Effects of soothing liver and invigorating spleen recipes on the mRNA and protein expression of TLR4 in hepatic tissues of rats with NASH. Journal of Chinese Medicinal Materials. 36:78-84.
