
천궁 돌연변이 유발을 위한 최적 감마선 조사량
 ; Bo Keun Ha2
; Bo Keun Ha2 ; Jong Won Han3
; Jong Won Han3 ; Jeong Hoon Lee4
; Jeong Hoon Lee4 ; Sang Hoon Lee5
; Sang Hoon Lee5 ; Myeong Won Oh6
; Myeong Won Oh6 ; Chun Geon Park7
; Chun Geon Park7 ; Kyung Ho Ma8
; Kyung Ho Ma8 ; Jae Ki Chang9
; Jae Ki Chang9 ; Sang Hoon Kim10 ; Jin Baek Kim11 ; Si Yong Kang12 ; Jai Hyunk Ryu13, †
; Sang Hoon Kim10 ; Jin Baek Kim11 ; Si Yong Kang12 ; Jai Hyunk Ryu13, †
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Cnidium officinale Makino have been used in traditional medicine in Northeast Asia. Although gamma-ray mutagenesis has been used to develop breeding resources with novel characteristics, research on the radiation sensitivity of C. officinale Makino is limited. Hence, the optimal gamma-ray dosage for mutation breeding in C. officinale Makino was investigated.
Seedstocks were exposed to doses of gamma rays (5 Gy - 50 Gy), and subsequently planted in a greenhouse. After 30 days of sowing, the survival rates and growth decreased rapidly at doses above 20 Gy, while all individuals died at 50 Gy. The median lethal dose (LD50) was 25.65 Gy, and the median reduction doses (RD50) for plant height, number of stems, and fresh weight were 12.81, 9.32, and 23.26 Gy, respectively. Post-irradiation levels of malondialdehyde (MDA), peroxidase (POD), and chlorophyll in the aerial parts of the plant were quantified using spectrophotometry. Relative to the controls, the levels of MDA and POD increased, while the level of chlorophyll decreased at doses ≥ 10 Gy, indicating cellular damage.
A dose of 20 Gy was found to be optimal for mutation breeding in C. officinale Makino.
Keywords:
Cnidium officinale Makino, Gamma Irradiation, Radiation Damage, Optimal Dose, Mutation Breeding서 언
천궁은 산형과 (Apiaceae)의 다년생 초본 식물로 한국, 중국, 일본에서 사용되는 중요한 약재이며, 우리나라에서는 천궁 (Cnidium officinale Makino)과 중국천궁 (Ligusticum chuanxiong Hort.)의 뿌리줄기를 그대로 또는 끓는 물에 데친 것을 이용한다 (MFDS, 2008). 천궁은 한방에서 쌍화탕 (雙和湯), 십전대보탕 (十全大補湯), 사물탕 (四物湯), 불수산 (佛手散) 등 다양한 처방에 활혈거어약 (活血祛瘀藥)으로 활용된다 (Kim et al., 2012).
천궁의 주요 성분으로는 ferulic acid, zligustilide, senkyunolide A, chlorogenic acid 등이 있으며 (Baek et al., 2016), 두통 (Peng et al., 2009), 빈혈과 부인병 (Lee et al., 2002), 항산화 (Jeong et al., 2009), 항염 (Cheng et al., 2008), 뇌신경보호 (Baek et al., 2003)등의 효과가 보고되어 있다.
국내 농가에서는 천궁과 중국천궁을 각각 일천궁과 토천궁으로 구분하며, 수량성이 높고 종근 생산이 쉬운 일천궁을 대부분 농가에서 재배하고 있다 (Kim et al., 2012). 천궁의 재배 특성으로 최고 기온이 30℃ 이상으로 올라가면 하고 (夏枯) 현상이 심하게 나타나기 때문에 전 국토의 3% 정도에서만 재배가 가능하며 경북 영양군 등 일부 고랭지 지역에서 주산지가 형성되어 있다 (Kim et al., 2012; RDA, 2014; Nam et al., 2020).
국내 생산량은 2014년도 기준 99 ㏊에서 712 톤 수준이었으나 수요가 지속적으로 증가하여 2018년 기준 116 ㏊에서 1,014 톤까지 생산규모가 증가하였다 (MAFRA, 2019). 그러나 고온과 연작에 약한 특성으로 인해 재배 가능 면적이 감소하고 있고, 보급이 가능한 육성품종이 없어 재배 안전성을 확보하기 위한 우량품종 개발이 시급한 상황이다.
천궁은 종자불임으로 종근이나 뇌두 번식만 가능한 영양번식 작물이며, 국내 유전자원이 매우 빈약한 실정이다 (Park, 1998; Park et al., 2004; Choi et al., 2005; Song et al., 2009). 돌연변이 육종법은 유전자원이 빈약한 작물에 형질개량에 유용하며 (Sidrak and Suess, 1973; Shikazono et al., 1998; Misra et al., 2003), 전통적인 교배육종법과 비교하여 우량 형질을 유지하면서 유전형질의 개량이 가능하고 다양한 종류의 식물조직과 식물종에 적용이 비교적 용이하다 (Kimura and Ohta, 1971; Sidrak and Suess, 1973; Misra et al., 2003).
돌연변이 육종에 이용되는 변이의 유발원으로는 물리적 유발원인 x선, 감마선, 이온빔, 중성자빔 등과 화학적 돌연변이 원으로 ethyl methanesulfonate (EMS), ethyleneimine (EI) 등이 사용되고 있으며, 돌연변이원은 처리 시 돌연변이 유도를 위한 적정 선량 및 처리 농도의 구명이 필요하다 (Misra et al., 2003; Sung et al., 2013). 적정선량은 M1 세대의 생존율과 생장율로 주로 결정하나 생육조사가 어렵거나 정밀한 조사를 위해서 생화학적 변화, DNA 손상정도 등도 조사지표에 활용되고 있다 (Yamaguchi et al., 2009; Cvejić et al., 2011; Kang et al., 2013; Abdullah et al., 2018).
방사선은 생화학적 수준에서 식물세포에 영향을 끼치는데 (Çelik et al., 2011), 식물이 방사선에 노출되면 식물체 내 산소분자가 활성산소종 (reactive oxygen species; ROS)으로 치환되어 노화 및 고사를 유발하며, ROS로부터 회복하기 위해 다양한 항산화 물질을 생산한다 (Wada et al., 1998; Im et al., 2018). malondialdehyde (MDA)와 Peroxidase (POD)는 이러한 ROS의 영향을 측정하여 식물체의 방사선에 의한 직·간접적인 영향을 판단할 수 있는 요소이다 (Kim et al., 2015; Oladosu et al., 2016; Im et al., 2018), 한편 엽록소는 식물체의 환경스트레스에 대한 중요한 요소이며, 동부 (Vina unguiculate) 등 작물에서는 방사선 처리에 의해 엽록소 함량이 증가한 사례가 존재하기는 하나, 일반적으로는 방사선에 노출된 식물의 백화 및 고사로 인해 감소한다 (El-Beltagi et al., 2011).
본 연구에서는 천궁의 종근에 감마선을 처리한 후 초기 생육특성과 생화학적 변화를 통하여 돌연변이 유도에 필요한 적정 방사선량을 구명하고, 돌연변이 육종을 통하여 천궁의 우량품종 개발을 위한 기초자료로 활용하고자 수행하였다.
재료 및 방법
1. 시험 재료 및 생육조사
본 실험에 사용된 재료는 경북 봉화 농가에서 수집한 천궁 (Cnidium officinale Makino)의 종근을 이용하였다. 방사선 처리는 한국원자력연구원 첨단방사선 연구소 (Korea Atomic Energy Reserach Institute, Advance Radiation Technology Institute, Jeongeup, Korea)의 감마선 (60Co) 저준위 처리 시설에서 0, 5, 10, 20, 30, 50 Gy의 선량으로 30 개체 씩 처리하였다. 원예용 상토 (Hongnong No.1, Hongnongjongmyo, Pyeongtaek, Korea)로 채워진 대형 화분 (50 ㎝ × 30 ㎝)에 15 ㎝ 간격으로 대조군 및 각 선량 별 20 개체 씩 3 회 반복하여 정식하였다. 생육조사는 식재 후 30 일 경 초장, 경수, 생체중을 측정하였다.
2. 생화학 처리 준비
생화학적 변화 분석을 위해 각 선량별로 감마선 처리된 개체와 대조구의 잎을 정식 후 20 일경에 채취하여 -80℃로 유지되는 냉장고에 보관하고 잎 시료를 액체질소에 침지하여 막자사발로 분말화 하였다.
3. Malondialdehyde 측정
지질 과산화 수준을 측정하기 위하여 MDA (malondialdehyde) 함량을 Zhang 등 (2011)의 연구를 변형하여 분석하였다. 분쇄된 시료를 5℃에서 30 분 동안 1.5 ㎖ 10% trichloroacetic acid (TCA)로 균질화 후, 시료를 강하게 vortexing하고, 4℃, 10,000 × g에서 20 분 동안 원심 분리하여 상등액을 취하여 동일한 부피의 0.67% 2-thiobabituric acid과 혼합한 후 95℃에서 30 분 동안 가열하였다.
가열된 시료를 얼음상에서 5 분 동안 냉각한 후, 샘플을 10,000 × g에서 4℃, 5 분 동안 원심 분리하여 상등액을 취하여 분광도계 분석을 실시하였다. MDA 농도는 마이크로플레이트 분광광도계 (Epoch, BioTek Inc., Winooski, VT, USA)를 사용하여 450 ㎚, 532 ㎚ 및 600 ㎚에서의 흡광도를 측정하였다.
4. 항산화 효소 활성 측정
항산화 효소 활성의 측정을 위해 분쇄된 시료를 1.2 ㎖의 0.2 M 인산칼륨 완충액 (pH 7.8 + 0.1 mM EDTA)에서 균질화 하여 4℃에서 10,000 rpm으로 20 분 동안 원심 분리한 후 상등액을 항산화 효소 활성 측정에 사용하였다. 가용성 단백질 함량은 Bradford 방법 (Bradford, 1976)을 사용하여 결정되었다. Peroxidase (POD) 활성은 Kim 등 (2012)의 방법을 응용하여 측정되었다.
5. 엽록소의 측정
엽록소는 Ni 등 (2009)의 방법을 변형하여 측정하였다. 분쇄된 시료를 암소에서 4℃로 유지하면서 아세톤 (80%)으로 균질화하여 상등액을 에포크 마이크로 플레이트 분광 광도계 (Bio Tek Instruments Inc., Winooski, VT, USA)로 측정하여 603 ㎚, 645 ㎚ 및 663 ㎚의 파장에서 클로로필 함량을 계산하였다.
6. 통계분석
통계 분석 결과는 SAS Enterprise Guide 4.2 (Statistical analysis system, SAS Inc., Cray, NC, USA)를 사용하여 분석하고, 3 반복한 결과를 나타내었다. Duncan’s Multiple Range Test (DMRT)로 유의수준 5% (p < 0.05)에서 유의적인 차이를 검증하였다.
반수치사 (LD50) 및 RD50 (median reduction dose) 선량 값의 결정은 생장 값의 단순선형회귀분석 (simple linear regression analysis)을 이용하여 추정하였으며, SPSS Ver. 25를 이용하여 각각의 회귀식에서 회귀계수에 대한 유의성을 검정 한 결과, 모두 통계적으로 유의하였다 (p < 0.05).
각 형질과 선량의 결정계수 (R2)는 생체중은 0.967, 생존률은 0.923, 초장은 0.748 그리고 경수는 0.766 이였다.
결과 및 고찰
1. 생육 특성조사
감마선 처리 30 일 후 천궁 (Cnidium officinale Makino)의 초기 생육특성의 차이와 생존율을 조사한 결과 (Table 1 and Fig. 1), 모든 방사선 처리구에 신초발생, 초장, 줄기수 및 생체중은 대조구와 비교하여 감소하는 경향이었다.

Whole plant profile of 4-week-old Cnidium officinale after different dose of gamma-ray.(A); Control, (B); 50 Gy, (C); 10 Gy, (D); 20 Gy, (E); 30 Gy, (F); 50Gy.
반수치사 (LD50) 선량은 25.65 Gy 였으며 (Fig. 2), 산형과의 병풀 (Centella asiatica) 종자에 감마선 처리하여 나타난 반수치사 선량 20 - 60 Gy와 유사하였다 (Moghaddam et al., 2011). 특히 20 Gy 이상의 선량에서 대조구와 비교하여 뚜렷한 생육 저해 및 고사현상이 나타났다. 생물체에 방사선의 영향으로 급격하게 생육장애 및 고사가 나타나는 발단선량 (threshold dose)으로 추정되며 (Orford, 1995; Ryu et al., 2016), 당근 (Daucus carota) 배양체에 감마선을 처리하여 20 Gy 이상 선량에서 신초 분화가 크게 저해된 결과와 유사하였다 (AL-Safadi and Simon, 1990).
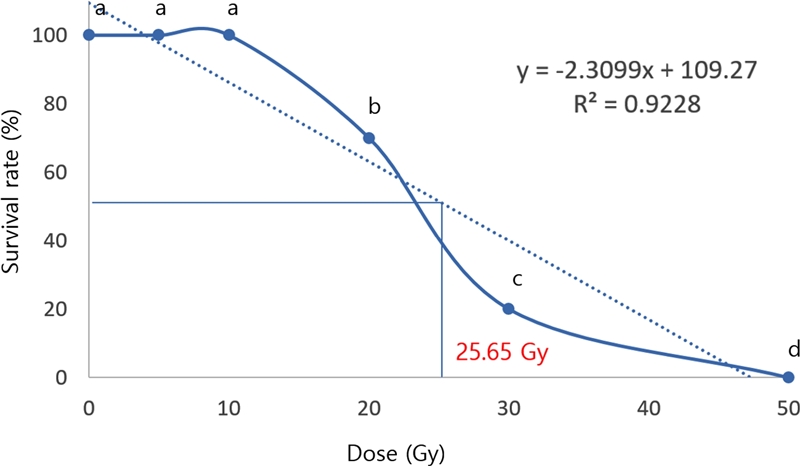
Survival rate of Cnidium officinale with different dose of gamma-ray.The median lethal dose (LD50) was 25.65 Gy. a,b,c,dMeans with different letters are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
50 Gy 이상의 선량을 처리한 개체에서는 신초발생이 되지 않고 모두 고사하였는데, 이처럼 식물세포에 일정 수준 이상의 방사선이 처리되면 수분이 분해되면서 생성되는 활성산소에 의해 비가역적인 손상을 유발하게 된다 (Nair and Netrawali, 1979; Wada et al., 1998). 이는 종근이나 식물체에 직접 방사선을 처리하여 연구한 사례는 드물어 비교가 어려우나 양란 심비디움 (Cymbidium spp.) 배양체에 전자빔을 처리하여 300 Gy 이상의 선량에도 기관분화가 나타난 결과 (Ryu et al., 2013)와 비교하여 방사선에 대한 감수성이 현저히 높은 수준으로 판단된다.
한편 대조구와 5 Gy - 10 Gy 감마선 처리 사이에 식물체 생체중의 유의적 차이 (p < 0.05)가 나타나지 않았으며, 이는 전체 중량의 70% 이상을 차지하는 종근의 생장이 모든 실험구에서 초기 생육조사 기간동안 크게 변화하지 않은 것이 영향을 끼친 것으로 보인다.
돌연변이 육종을 위한 적정 처리 선량을 구명하고자 초장, 줄기수, 생체중의 생육이 대조구와 비교하여 50% 감소된 선량 (RD50) 단순회귀분석으로 추정하였다 (Fig. 3). RD50 선량은 초장, 경수, 생체중에서 각각 12.81, 9.32, 23.26 Gy로 조사항목 별로 다르게 나타났다. 이를 바탕으로 천궁 종근의 방사선 돌연변이 처리 적정선량은 20 Gy 내외로 판단되며 이는 벼과 100 Gy - 600 Gy, 콩과 150 Gy - 500 Gy, 십자화과 500 Gy - 2000 Gy 등 다수의 작물군과 비교하여 낮은 선량이다 (Ryu et al., 2012; Ryu et al., 2014; Ryu et al., 2016; Im et al., 2018).
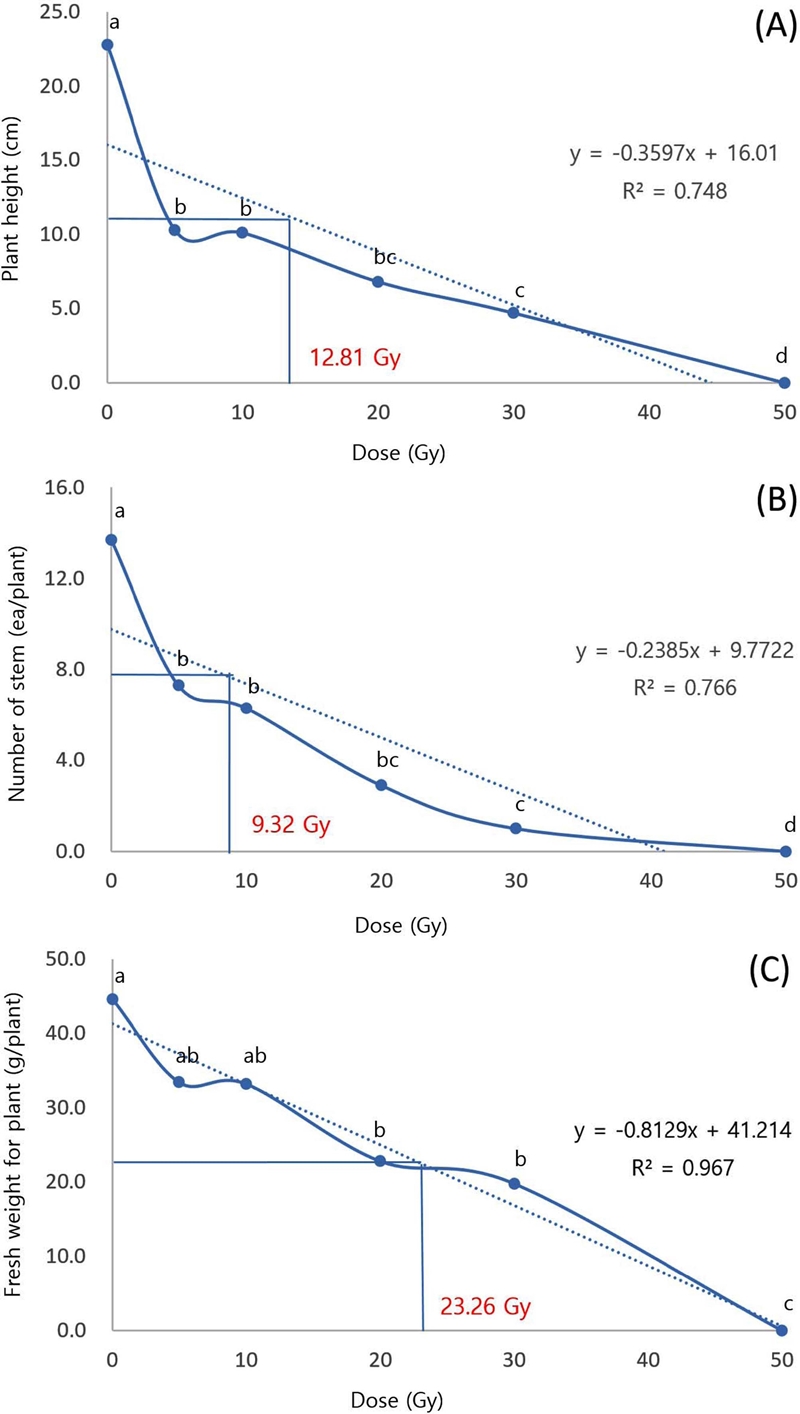
RD50 Values for growth characteristics of Cnidium officinale.(A); plant height, (B); number of leaf stalk, (C); fresh weight for whole plant. The median reduction dose (RD50) for plant height, the number of stems, fresh weight was 12.81, 9.32 and 23.26 Gy, respectively. a,b,c,dMeans with different letters are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
2. 생화학적 특성 분석
감마선을 처리한 천궁 종근을 정식한 후 지상부의 생화학적 특성을 분석한 결과는 Fig. 4과 같다. MDA 및 POD 성분은 대조구와 비교하여 감마선 처리구에서 증가하는 경향이었으며, 10 Gy - 30 Gy 감마선 처리구간에 유의적 차이는 없었다. 반면 엽록소 함량을 측정한 결과 대조구와 비교하여 방사선처리에서 감소하는 경향이었다.
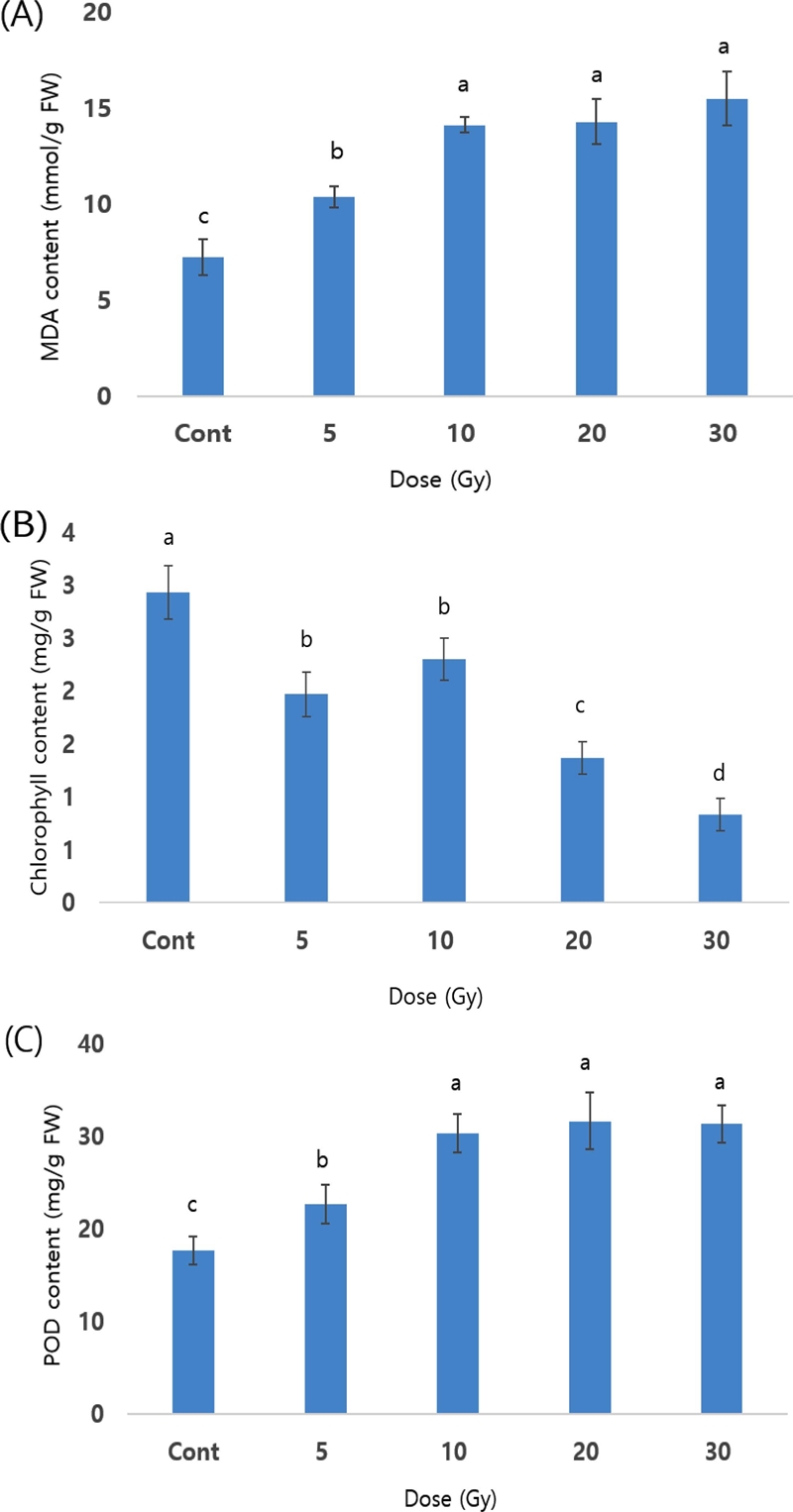
Effect of gamma-ray irradiation on the biological content of leaves from Cnidium officinale.A; MDA content, B; chlorophyll content, C; POD content. *Means with different letters are significantly different at p < 0.05 by Duncan’s Multiple Range Test (DMRT).
방사선에 의한 식물 세포수준의 손상 정도는 방사선 처리 선원, 방사선 처리 부위 (배양체, 식물체, 종자 등)와 처리 시간에 따라 다르게 발현되며, 돌연변이 육종을 위한 방사선 처리 최적화에 활용이 가능하다 (Ryu et al., 2013; Nwachukwu et al., 1994; Ryu et al., 2016; Kim et al., 2020). 종합적으로 보면, MDA 및 POD 성분은 대조구와 비교하여 감마선 10 Gy 이상의 처리구에서 뚜렷하게 증가하는 경향이었고, 엽록소 함량은 감소하였으며 이는 10 Gy 이상의 선량에서 세포수준의 손상에 의한 생화학적인 변화가 있음을 시사한다.
적정 선량인 20 Gy로 처리한 천궁을 생육후기까지 관찰한 결과, 초세가 약한 왜성화 개체를 다수 발견할 수 있었다 (Fig. 5). 지상부의 초세는 수량과 연관성이 있지만 과번무 할 경우 지상부 증발산량의 급격한 증가로 고온기에 하고 현상의 원인이 되기도 한다 (Chae et al., 2008). 천궁은 지상부가 번무한 편이므로 초세가 감소하면 증발산량을 줄일 수 있으며 밀식을 통해 수량성도 보완할 수 있어 내고온성 품종 개발을 위한 유전자원으로 활용 할 수 있을 것으로 사료된다.

The dwarfism mutant of Cnidium officinale observed in late growth by 20 Gy gamma irradiation.(A); 20 Gy (B); Control.
작목 또는 목표형질의 돌연변이율에 따라 적합한 육종규모는 다르지만 벼과식물의 경우 M1 개체수는 적어도 1,000 개에서 10,000 개의 개체를 조사하여야 할 정도로 돌연변이 육종에는 많은 개체수가 필요하다 (Kim et al., 2006). 따라서 본 연구 결과로 나타난 적정 선량을 처리하여 대규모 육종 집단을 구축한다면 천궁 육종에 필요한 다양한 형질을 지닌 유전자원을 확보 할 수 있을 것으로 사료된다.
천궁은 당귀와 함께 여성 질환에 기본 처방인 사물탕 (四物湯)의 주재료로 활용빈도가 높으나 (Baek et al., 2016) 육종에 관한 연구사례는 전무한 실정이다. 본 연구 결과는 천궁의 돌연변이 신품종 육성에 필요한 적정선량 결정에 중요한 정보로 판단되며, 방사선 처리 후 2 - 3 세대에서의 변이 양상에 관한 추가 연구가 요구된다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: PJ01437104)의 지원에 의해 이루어진 것으로 이에 감사드립니다.
References
-
Abdullah S, Kamaruddin NY and Harun AR. (2018). The effect of gamma radiation on plant morphological characteristics of Zingiber officinale Roscoe. Internaitional Journal on Advanced Science Engineering Information Technology. 8:2085-2091.
[https://doi.org/10.18517/ijaseit.8.5.4641]

-
Al-Safadi B and Simon PW. (1990). The effects of gamma irradiation on the growth and cytology of carrot(Daucus carota L.) tissue culture. Environmental and Experimental Botany. 30:361-371.
[https://doi.org/10.1016/0098-8472(90)90049-A]

- Baek IS, Park CS and Park CG. (2003). The effects of Cnidium Officinale extract on the ischemic stroke and oxidative neural damage in rats brain. Korea Journal of Herbology. 18:37-37.
-
Baek ME, Seong GU, Lee YJ and Won JH. (2016). Quantitative analysis for the quality evaluation of active ingredients in Cnidium Rhizome. Journal of Korean Medicine. 60:227-234.
[https://doi.org/10.17480/psk.2016.60.5.227]

-
Bradford MM. (1976). A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Analitycal Biochemistry. 72:248-254.
[https://doi.org/10.1016/0003-2697(76)90527-3]

- Çelik O, Atak C and Suludere Z. (2014). Response of soybean plants to gamma radiation: Biochemical analyses and expression patterns of trichome development. Plant Omics Journal. 7:382-391.
- Chae JC, Gang BH, Park SJ and Kim SH. (2008). Samgo Cultivation Principles. Hyangmunsa. Seoul, Korea. p.210-211.
-
Cheng CY, Ho TY, Lee EJ, Su SY, Tang NY and Hsieh CL. (2008). Ferulic acid reduces cerebral infarct through its antioxidative and anti-inflammatory effects following transient focal cerebral ischemia in rats. American Journal of Chinese Medicine. 36:1105-1119.
[https://doi.org/10.1142/S0192415X08006570]

- Choi JK, Lim DB and Lee YJ. (2005). A study on a morphological identification of Cnidium Rhizome and Ligusticum Rhizome. Korea Journal of Herbology. 20:95-101.
-
Cvejić S, Afza R, Jocić S, Prodanović S, Miklić V, Škorić D and Dragin S. (2011). Radiosensitivity of sunflower inbred lines to mutagenesis. Helia. 54:99-106.
[https://doi.org/10.2298/HEL1154099C]

-
El-Beltagi HS, Ahmed OK and El-Desouky W. (2011). Effect of low doses γ-irradiation on oxidative stress and secondary metabolites production of rosemary(Rosmarinus officinalis L.) callus culture. Radiation Physics and Chemistry. 80:968-976.
[https://doi.org/10.1016/j.radphyschem.2011.05.002]

-
Im JH, Ryu JH, Kim WJ, Kim SH, Kang SY and Ha BK. (2018). Growth characteristics and biological responses of Korean elite Soybean(Glycine max L. Merr.) cultivars exposed to gamma-rays. Plant Breeding and Biotechnology. 6:109-118.
[https://doi.org/10.9787/PBB.2018.6.2.109]

-
Jeong JB, Ju SY, Park JH, Lee JR, Yun KW, Kwon ST, Lim JH, Chung GY and Jeong HJ. (2009). Antioxidant activity in essential oils of Cnidium officinale makino and Ligusticum chuanxiong Hort and their inhibitory effects on DNA damage and apoptosis induced by ultraviolet B in mammalian cell. Cancer Epidemiology. 33:41-46.
[https://doi.org/10.1016/j.canep.2009.04.010]

-
Kang EJ, Lee YM, Sung SY, Ha BK, Kim SH, Kim DS, Kim JB and Kang SY. (2013). Analysis of the genetic relationship of gamma-irradiated in vitro mutants derived from standard-type chrysanthemum cv. Migok. Horticulture, Environment, and Biotechnology. 54:76-81.
[https://doi.org/10.1007/s13580-013-0124-9]

-
Kim DY, Hong MJ, Park CS and Seo YW. (2015). The effects of chronic radiation of gamma ray on protein expression and oxidative stress in Brachypodium distachyon. International Journal of Radiation Biology. 91:407-419.
[https://doi.org/10.3109/09553002.2015.1012307]

- Kim JC, Jang WC and Kim SH. (2012). Research of highland medicinal crop. Gyeongsangbuk-do Agricultural Research and Extension Services. Bonghwa, Korea. p.37.
- Kim KH, Kim SK, Park SJ, Park HK, Seo HS, Lee MS, Lee SS and Choi BH. (2006). Breeding Science. Hyangmunsa. Seoul, Korea. p.240-241.
-
Kim SH, Jo YD, Ryu JH, Hong MJ, Kang BC and Kim JB. (2020). Effects of the total dose and duration of γ-irradiation on the growth responses and induced SNPs of a Cymbidium hybrid. International Journal of Radiation Biology. 96:545-551.
[https://doi.org/10.1080/09553002.2020.1704303]

-
Kimura M and Ohta T. (1971). Protein polymorphism as a phase of molecular evolution. Nature. 229:467-469.
[https://doi.org/10.1038/229467a0]

- Lee JH, Choi HS, Chung MS and Lee MS. (2002). Volatile flavor components and free radical scavenging activity of Cnidium officinale. Korean Journal of Food Science Technology. 34:330-338.
- Ministry of Agriculture Food and Rural Affairs(MAFRA). (2019). Final results of the 2018 census of agriculture, forestry and fisheries. Ministry of Agriculture, Food and Rural Affairs. Sejong, Korea. p.335.
- Ministry of Food and Drug Safety(MFDS). (2008). The Korea pharmacopoeia. Ministry of Food and Drug Safety. Shinilbooks. Seoul, Korea. p.976.
-
Misra P, Datta SK and Chakrabarty D. (2003). Mutation in flower colour and shape of Chrysanthemum morifolium induced by γ-radiation. Biologia Plantarum. 47:153-156.
[https://doi.org/10.1023/A:1027365822769]

-
Moghaddam SS, Jaafar H, Ibrahim R, Rahmat A, Aziz MA and Philip E. (2011). Effects of acute gamma irradiation on physiological traits and flavonoid accumulation of Centella asiatica. Molecules. 16:4994-5007. (cited by 2020 June 2).
[https://doi.org/10.3390/molecules16064994]

-
Nair KAS and Netrawali MS. (1979). Sensitivity of light-grown and dark-grown euglena cells to gamma-irradiation. International Journal of Radiation Biology and Related Studies in Physics, Chemistry and Medicine. 36:223-231.
[https://doi.org/10.1080/09553007914550991]

-
Nam HH, Seo YJ and Jang WC. (2020). Effect of shading types and duration on alleviation of high temperature stress in Cnidium officinale Makino. Korean Journal of Medicinal Crop Science. 28:111-118.
[https://doi.org/10.7783/KJMCS.2020.28.2.111]

-
Ni Z, Kim ED and Chen ZJ. (2009). Chlorophyll and starch assays. Protocol Exchange. 10:1038-1038. https://protocols.scienceexchange.com/protocols/chlorophyll-and-starch-assays, (cited by 2020 May 1).
[https://doi.org/10.1038/nprot.2009.12]

- Nwachukwu EC, Ene LSO and Mbanaso ENA. (1994). Radiation sensitivity of two ginger varieties(Zingiber officinale Rosc.) to gamma irradiation. Der Tropenlandwirt. 95:99-103.
-
Oladosu Y, Rafii MY, Abdullah N, Hussin G, Ramli A, Rahim HA, Miah G and Usman M. (2016). Principle and application of plant mutagenesis in crop improvement: A review. Biotechnology and Biotechnological Equipment. 30:1-16. (cited by 2020 May 1).
[https://doi.org/10.1080/13102818.2015.1087333]

-
Orford KJ. (1995). Lower threshold energy gamma ray Cerenkov telescopes. Experimental Astronomy. 6:1-5.
[https://doi.org/10.1007/BF00421123]

- Park CH, Lee MS, Namkoong SB, Yu HS and Park HW. (2004). Embryological characteristics on seed sterility of Ligusticum chuanxiong Hoit. Korean Journal of Medicinal Crop Science. 12:209-213.
- Park YK. (1998). The study on antioxidative effects and quality comparison If Ligusticum chuanxiong and Cnidium officinale (1). Korea Journal of Herbology. 13:103-114.
-
Peng C, Xie X, Wang L, Guo L and Hu T. (2009). Pharmacodynamic action and mechanism of volatile oil from Rhizoma Ligustici Chuanxiong Hort. on treating headache. Phytomedicine. 16:25-34.
[https://doi.org/10.1016/j.phymed.2008.10.010]

- Rural Development Administration(RDA). (2014). Prediction map for major fruit and medicinal crops with future climate scenario. Rural Development Administration. Jeonju, Korea. p.85-94.
- Ryu JH, Im SB, Kim DS, Ahn JW, Kim JB, Kim SH and Kang SY. (2014). Effects of gamma-ray irradiation on growth characteristics and DNA damage in licorice(Glycyrrhiza uralensis). Radiation Industry. 8:89-95.
-
Ryu JH, Kwon SJ, Im SB, Jeong SW, Ahn JW, Kim JB, Choi KC, Kim WH and Kang SY. (2016). Effects of gamma-ray irradiation on radio sensitivity in oat (Avena sativa). Korean Journal of Plant Resources. 29:128-135.
[https://doi.org/10.7732/kjpr.2016.29.1.128]

-
Ryu JH, So HS, Bae SH, Kang HS, Lee BC, Kang SY, Lee HY and Bae CH. (2013). Genetic diversity of in vitro cultured Cymbidium spp. irradiated with electron beam. Korean Journal of Breeding Science. 45:8-18.
[https://doi.org/10.9787/KJBS.2013.45.1.008]

-
Ryu JH, So HS, Lyu JI, Kwon OD, Lee YI, Jin ID, Lee HY and Bae CH. (2012). Genetic variation analysis of early-heading plant(Oryza sativa L.) lines derived from gamma-ray irradiation. Korean Journal of Plant Resources. 25:142-151.
[https://doi.org/10.7732/kjpr.2012.25.1.142]

-
Shikazono N, Yokota Y, Tanaka A, Watanabe H and Tano S. (1998). Molecular analysis of carbon ion-induced mutations in Arabidopsis thaliana. Genes and Genetic Systems. 73:173-179.
[https://doi.org/10.1266/ggs.73.173]

-
Sidrak GH and Suess A. (1973). Effects of low doses of gamma radiation on the growth and yield of two varieties of tomato. Radiation Botany. 13:309-314.
[https://doi.org/10.1016/S0033-7560(73)90040-9]

- Song IG, An BR, Seo BI and Park SJ. (2009). Molecular marker to identify and origin of Cnidii rhizoma from Korea and China. Korea Journal of Herbology. 24:1-8.
-
Sung SY, Lee YM, Kim SH, Ha BG, Kang SY, Kim JB and Kim DS. (2013). Comparative analysis of growth and antioxidant enzyme activities from two Chrysanthemum varieties, ‘ARTI-purple’ and ‘ARTI-queen’ by chronic irradiation of gamma-ray. Korean Journal of Horticultural Science and Technology. 31:490-495.
[https://doi.org/10.7235/hort.2013.12220]

-
Wada H, Koshiba T, Matsui T and Satô M. (1998). Involvement of peroxidase in differential sensitivity to γ-radiation in seedlings of two Nicotiana species. Plant Science. 132:109-119.
[https://doi.org/10.1016/S0168-9452(98)00005-3]

-
Yamaguchi H, Hase Y, Tanaka A, Shikazono N, Degi K, Shimizu A and Morishita T. (2009). Mutagenic effects of ion beam irradiation on rice. Breeding Science. 59:169-177.
[https://doi.org/10.1270/jsbbs.59.169]

-
Zhang Y, Sun G, Yang M, Wu H, Zhang J, Song S and Guo Y. (2011). Chronic accumulation of cadmium and its effects on antioxidant enzymes and malondialdehyde in Oxya chinensis (Orthoptera: Acridoidea). Ecotoxicology and Environmental Safety. 74:1355-1362.
[https://doi.org/10.1016/j.ecoenv.2011.03.002]

