토양 수분 스트레스와 차광 처리가 천궁의 엽록소 형광반응 및 광합성에 미치는 영향
 ; Young Jin Seo2
; Young Jin Seo2 ; Dong Chun Kim3
; Dong Chun Kim3 ; Hyo Hoon Nam4 ; Bu Yong Lee5
; Hyo Hoon Nam4 ; Bu Yong Lee5 ; Jun hyung Kim6
; Jun hyung Kim6
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Measurement of chlorophyll fluorescence (CF) is useful for detection the ability of plants to tolerate environmental stresses such as drought, and excessive sunlight. Cnidium officinale Makino is highly sensitive to water stress and excessive sunlight. In this study, we evaluated the effect of soil water and shade treatment on the photosynthesis and leaf temperature change of C. officinale.
C. officinale was cultivated under uniform irrigation for 1 week drought stress (no watering) for 6 days. A significant decrease in CF was observed on the 5th day of with-holding water (approximately 6% of soil water content) regardless of shading. Notably, the Rfd_lss parameter (CF decrease rates) with and without shade treatment was reduced by 73.1% and 56.5% respectively, at 6 days compared with those at the initial stage (0 day). The patterns of the degree of CF parameters corresponded to those of the soil water content and difference between leaf temperature (Ts) and air temperature (Ta). Meanwhile, CF parameters recovered to the 3 - 4 days levels after re-watering, while the soil water potential was completely restored. The suitable soil water content for C. officinale optimal growth was between -5 ㎪ and -10 ㎪ in this experiment.
Lack of soil water in the cultivation of C. officinale, even with shading, decreased latent heat cooling through transpiration. As a result, heat dissipation declined, and the plant was subjected to drought stress. Soil water content plays a major role in photosynthesis and leaf temperature in C. officinale.
Keywords:
Cnidium officinale Makino, Chlorophyll Fluorescence, Photosynthetic Capacity, Soil Water서 언
한약재와 식품원료로 널리 이용되는 천궁 (Cnidium officinale Makino)은 약리활성이 높고 항산화 활성도 높아 건강기능식품, 화장품 소재 등 다양한 분야에서 그 수요가 증가하고 있는 추세이다 (Oh et al., 2010; Nam et al., 2020). 그러나 천궁의 재배면적은 2008년 237 ㏊, 생산량 1,470 M/T에서 2018년 116 ㏊, 생산량 1,014 M/T로 각각 51%, 31% 감소하고 있는데 (MAFRA, 2019), 기후 온난화에 따른 고온, 가뭄 등이 주원인으로 보고되고 있다 (Seo et al., 2018a). 천궁의 안정적인 생산을 위해서 생리특성 구명에 대한 연구가 필요하지만 최고기온 30℃ 이하의 서늘한 지역이 재배적지이며 (Nam et al., 2020), 외부 환경요인에 대한 저항성이 낮은 식물 (Kim et al., 2013)이라는 연구만 보고되고 있다. 수분 스트레스에 따른 수량성 (Kim et al., 1997)에 관한 연구도 수행되었지만 환경조건에 따른 광합성 및 엽록소 형광반응 등과 같은 생리반응에 대한 연구는 매우 미흡한 실정이다.
식물의 생육은 에너지 효율의 극대화 과정이다. 태양으로부터 에너지 유입, 식물체 내 에너지 축적 (탄소동화), 과잉 에너지의 유출이 원활하게 이루어질 때 건전한 생육이 가능하다. 이러한 에너지 흐름의 중심에 광합성 반응이 존재하며, 광합성 반응은 빛, 수분, 이산화탄소, 온도 등에 영향을 받는다. 특히 수분 부족은 광합성 활성을 제한하는 환경요인으로 알려져 있다 (Kim and Lee, 2001a; Kim and Lee, 2001b; Lee et al., 2006; Oh et al., 2010; Misra et al., 2012; Yoo et al., 2012; Lee et al., 2014; Lee, 2018; Shin et al., 2019). 최근 Seo 등 (2019)은 라이시미타를 이용한 배추의 증산량 계측을 통해 흡수한 수분의 약 96%가 증산에 의한 식물체 내열소산 반응으로 이용된다고 보고하여 식물 광합성 반응에서 수분의 역할을 강조하였다.
식물의 광합성 능력은 엽록소 형광반응을 통해 정량화 할 수 있으며, 식물의 건전성을 평가하는 대표적인 비파괴 분석법으로 이용되고 있다. 클로로필과 같은 엽록소에 의해 흡수된 에너지는 1) 광합성에 이용되거나, 2) 열적 소산에 의해 장파로 방출되고, 3) 나머지 소산된 에너지는 형광으로 방출된다 (Misra et al., 2012). 국내에서는 수박 접목묘 (Shin et al., 2019), 고추 (Yoo et al., 2012), 땃두릅나무 (Lee et al., 2014), 황칠나무 유묘 (Lee, 2018)에 대한 엽록소 형광반응 분석을 통한 수분 스트레스 등에 대한 연구가 활발히 이루어지고 있다.
식물은 수분 스트레스 조건에서 엽온이 변화하며, 수분 스트레스는 주로 복사에너지의 유입과 증산을 통한 잠열 방출 등 에너지 유·출입 수지에 의하여 결정된다 (Park, 2011; Seo et al., 2018b). Jackson 등 (1981)은 식물이 이용할 수 있는 수분이 부족하면 기공이 닫히고, 증산이 줄어서 엽온이 주위 기온보다 높아지는 현상을 나타낸다고 하였다. 따라서 식물이 정상적으로 증산하고 있을 때 엽온 (Ts)은 기온 (Ta)보다 낮으며, 증산이 원활하지 않을 경우는 반대 현상을 보인다. 그러나 엽온은 증산뿐만 아니라 일사, 기온, 바람, 증산 등 다양한 요소에 영향을 받기 때문에 주위의 환경과 함께 고려해야 한다.
따라서 본 연구는 토양수분 함량과 광조건에 따른 천궁의 엽록소 형광반응특성, 광합성 특성 및 엽온 변화를 분석하여 재배환경 조건이 천궁의 생리반응에 미치는 영향을 평가하였다. 이를 통해 가뭄 및 고온조건에서 천궁의 안정적인 생산을 위한 기초자료를 확보하고자 하였다.
재료 및 방법
1. 시험재료 양성 및 토양조건
본 연구는 수분 스트레스와 차광 조건이 천궁 (Cnidium officinale Makino)의 엽록소 형광특성에 미치는 영향을 구명하기 위한 시험과 토양수분 함량과 광 세기가 천궁의 광합성에 미치는 영향을 조사하는 시험으로 나누어 수행하였다. 두 시험 모두 경상북도농업기술원 봉화약용작물연구소 온실에서 포트시험으로 진행하였다. 천궁 종근은 영양 재래종으로 2020년 3월 30일 포트에 정식하여 5월 24일까지 재배한 천궁을 이용하였다. 이 때 초장이 20 ㎝ - 30 ㎝ 되는 균일한 개체를 선발하여 시험에 사용하였다.
시험에 사용된 토양은 상주통 (Sangju series)으로 분류되었으며, 토성은 사양토였다. 화학성은 토양 및 식물체 분석법 (NIAST, 2000)에 따라 분석하였고 분석 결과는 Table 1과 같았다.
2. 수분 스트레스 유발과 차광 조건에서 엽록소 형광반응 측정
수분 스트레스와 차광 조건이 천궁의 엽록소 형광특성에 미치는 영향을 평가하기 위하여 폴리프로필렌 재질의 저면관수 포트 (가로 17㎝ ×세로 17㎝ ×높이 16㎝)를 시험에 이용하였고, 55% 흑색 차광 처리구와 차광을 하지 않은 무처리구로 나누어 수행하였다.
천궁의 지상부 출현 후 34 일째 (5월 24일) 오후에 포장용 수량이 되도록 관수를 한 후 6 일 동안 수분공급을 완전히 차단하여 수분 스트레스 관련 시험을 수행하였다. 6 일차 엽록소 형광반응을 측정 한 후 18 시에 충분한 수분을 공급하여 (약 500 ㎖) 수분 스트레스 회복 능력을 조사하였다.
3. 수분 스트레스 유발과 차광 조건에서 엽온, 미기상, 광질 및 엽록소 형광반응 측정
수분공급 중단과 차광 처리가 천궁의 수분 스트레스에 미치는 영향을 구명하기 위한 엽온 조사는 적외선 열영상 분석기 (E40, FLIR System Inc., Wilsonville, OR, USA)를 이용하여 엽록소 형광 이미지 측정 전에 촬영하고 20 지점의 온도를 평균값으로 산출하였다.
재배기간 중 온실 내 기온과 상대습도는 HMP 155 센서 (Vaisala Inc., Vantaa, Finland)를 이용하였다. 차광 조건에 따른 광질은 분광광도계 (SpectraPen LM520, Photon Systems Instruments Co., Drasov, Czech)를 이용하여 시험기간 중 매일 13:00 - 14:00에 측정하였으며, 측정 파장 영역은 300 ㎚ - 900 ㎚이였다. 천궁재배 포트의 토양수분 함량은 동일한 조건에서 천궁 21 주를 재배하면서 매일 3 주씩 토양수분 함량을 조사하였고, 수분공급 차단 시험 6 일째는 본 재배시험에 사용한 포트의 토양수분 함량을 측정하였다.
천궁의 엽록소 형광 이미지 분석은 FluorCam 800-O/1010 (Photon System Instruments, Drasov, Czech)을 이용하여 13:00 - 14:00에 측정하였으며, 측정 전 챔버에서 20 분간 암적응 후 Quenching kinetics analysis 방법으로 측정하였다. 최소 형광값 (Fo)과 최대형광값 (Fm)을 유도하기 위한 광원은 각각 150 μ㏖·m−2·s−1와 1,250 μ㏖·m−2·s−1였으며, 이로부터 Fv/Fm, ΦPSII (QY_Lss), RFd_Lss, NPQ_Lss 등의 형광변수를 산출하였다 (Yoo et al., 2012).
ΦPSII (Steady-state PSⅡ quantum yield) = (Fm_Lss − Ft_Lss)/Fm_Lss
RFd_Lss (Fluorescence decline ration on steady-state) = (Fp − Ft_Lss)/Ft_Lss
NPQ_Lss (Steady-state non-photochemical quenching) = (Fm − Fm_Lss)/Fm_Lss
Fv (Maximum variable chlorophyll fluorescence) = Fm − Fo
Fm: Maximum fluorescence in dark-adapted state
Fo: Maximum fluorescence in dark-adapted state
Fm_Lss: Steady-state Maximum fluorescence in light
Ft_Lss: Steady-state fluorescence in light
Fp: Peak fluorescence during the initial phase of the Kautsky effect
형광 이미지는 위와 동일한 방법으로 암적응 시키고 빛을 조사한 후 방출되는 형광을 CCD 카메라로 포획하였다 (Nedbal et al., 2000).
4. 수분 스트레스 유발과 차광 조건에서 광합성 측정
토양수분 함량과 광 세기에 따른 천궁의 광합성 특성 조사를 위한 시험은 직경 36㎝ ×높이 44㎝의 플라스틱 포트에 토양 5㎏을 채우고 천궁 종근을 식재한 후 재배하였다. 토양수분 관리를 위하여 토양수분 장력계 (㎊ meter 02, Daiki Rika Kogyo Co., Ltd., Saitama, Japan)를 15㎝ 깊이에 묻어 토양수분 함량을 측정하였다. 관수 개시점은 -10 ㎪, -15 ㎪, -25 ㎪, -35 ㎪ 등 4 수준으로 하였고 관수 종말점이 -5 ㎪, -10 ㎪, -20 ㎪, -30 ㎪이 되도록 수분을 공급하였다. 광합성 측정은 천궁을 식물생장상 (JSPC-420C2, JS Research Inc., Gongju, Korea)을 이용하여 온도 25℃, 상대습도 65% (광조건 14 시간, 암조건 10 시간) 조건에서 하루 동안 적응시킨 후 조사하였다.
순광합성 속도 (Net photosynthesis rate), 기공 증산속도 (Transpiration rate)는 광합성측정기 (LI-6400XT, LI-COR Inc., Lincoln, NE, USA)를 이용하여 만개한 잎을 대상으로 공기 유량은 250 μ㏖·s−1, 챔버 내 온도 25℃, 광량 800 μ㏖·m−2·s−1, CO2 400 μ㏖·㏖−1 조건에서 오전 9시에서 12시까지 3 반복으로 측정하였다. 광-광합성 곡선을 측정하여 광보상점 (light compensation point, LCP), 암호흡 (dark respiration, DR), 순양자수율 (Net apparent quantum yield, NAQY), 최대광합성속도(maximum photosynthesis rate, MPR)을 구하였다 (Kim and Lee, 2001a). Photosynthetic photon density (PPFD)는 LED light source를 이용하여 0, 50, 100, 250, 500, 1000, 1500, 2000 μ㏖·m-2·s-1의 단계로 조절하였다.
5. 통계분석
실험 결과의 통계분석은 R (v3.4.4), Sigmaplot 14.0 (SYSTAT, San Jose, CA, USA)을 이용하여 5%의 유의수준에서 Duncan’s Multiple Range Test (DMRT, p < 0.05)를 이용하여 검정하였다. 차광 처리가 천궁의 수분 스트레스에 미치는 영향을 구명하기 위한 엽온 조사에서 차광 처리구와 무처리의 유의성 검정은 t-test (p < 0.05)를 이용하였다.
결과 및 고찰
1. 재배기간 중 온실의 기상 환경 특성
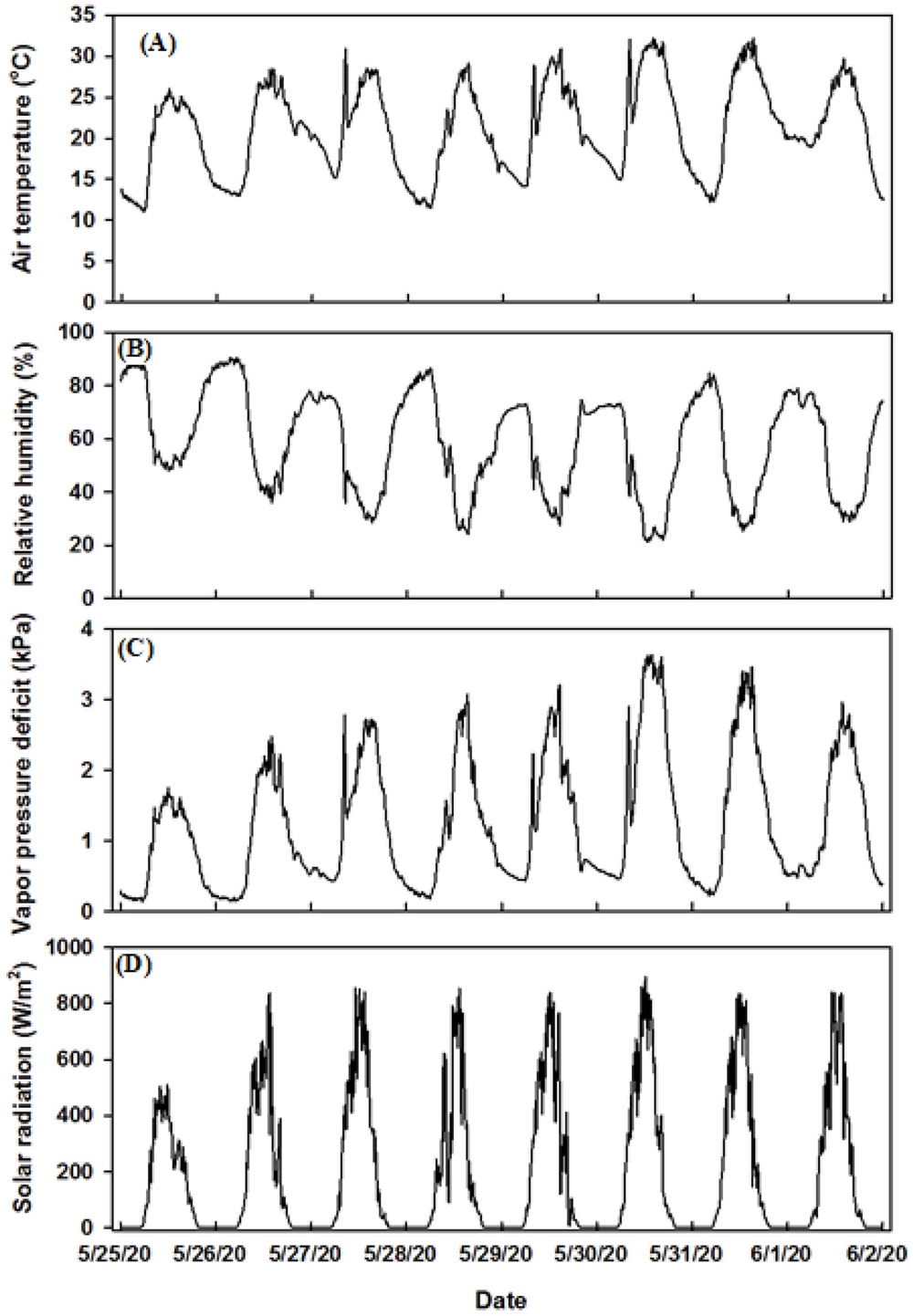
수분 스트레스와 차광 조건이 천궁 (Cnidium officinale Makino)의 엽록소 형광특성에 미치는 영향을 구명하기 위한 시험의 온실 기상환경 특성은 Fig. 1과 같았다.
Daily change of air temperature (A), relative humidity (B), vapor pressure deficit (C) and solar radiation (D) measured under plastic film house during the experiment periods.
평균기온은 21.1℃, 최고기온은 32.2℃, 최저기온은 11.1℃이였고, 5월 30일은 28.7℃, 5월 31일은 28.2℃로 낮 동안의 평균기온이 28℃보다 높은 고온을 나타내었으며, 재배기간 중 일교차는 평균 17.3℃ (14.9℃ - 20.0℃)로 비교적 큰 편이었다. 상대습도는 평균 58.4%, 수증기압 차이는 평균 1.25 ㎪로 대기 중으로 증산을 통한 수증기가 잘 확산되는 조건이었다. 일사량은 평균 623W·m−2, 최대 일사량은 5월 31일에 662 W·m−2를 나타났으며, 전형적인 맑은 날씨의 뾰족한 종모양의 일사 형태를 보였다.
Seo 등 (2018a)은 천궁의 증산량은 일사량이 600 W·m-2까지 선형적으로 증가하고 그 이후는 정체된다고 보고하였다. 따라서 본 연구 기간 동안의 일사조건은 천궁의 생육에 비교적 양호한 조건인 것으로 판단되었다.
2. 차광 조건에 따른 광질의 변화
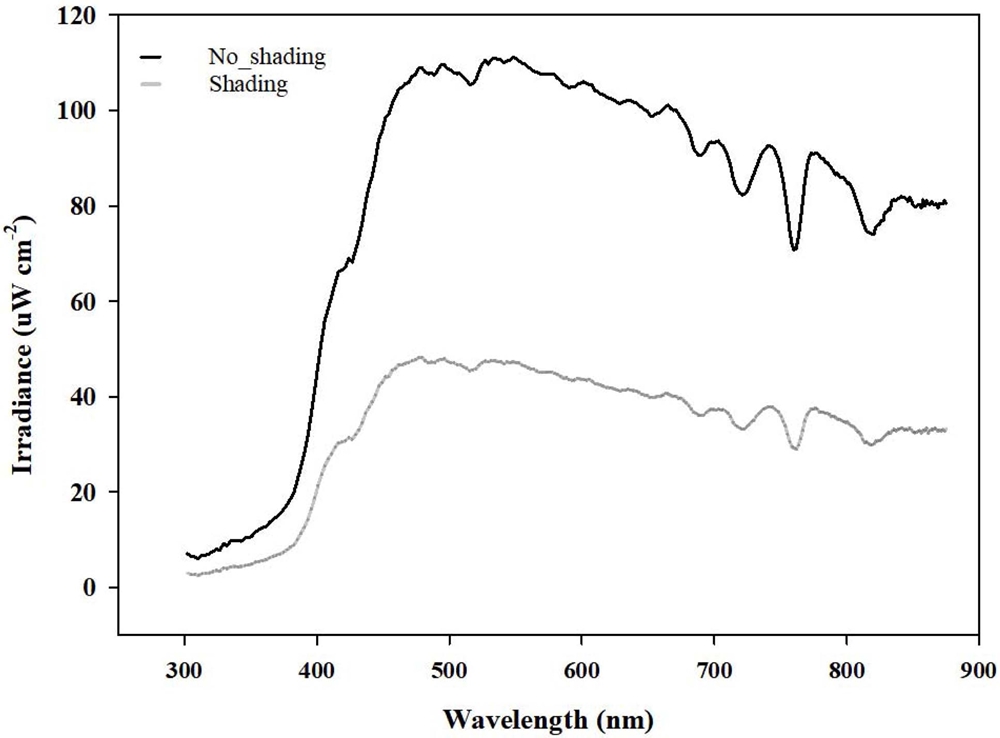
재배기간 중 차광 조건에 따른 광질의 특성은 Fig. 2와 같았다. 55% 흑색 차광 처리를 할 경우 평균 일사량은 56.4 W·m−2로 무차광 처리 133.4 W·m−2 대비 42.3% 감소하였다. 그러나 차광과 무차광 처리에서 광질의 특이적인 변화는 관찰할 수 없었다. 한편 가시광선의 파장비율은 적색광, 주황색광, 황색광, 녹색광, 청색광, 자주색광이 각각 26.1%, 10.9%, 7.6%, 29.5%, 13.8%, 12.1%였고, 파장비율 또한 차광 조건에 따른 차이를 관찰할 수 없었다.
3. 수분 공급 중단에 따른 토양수분 함량의 변화
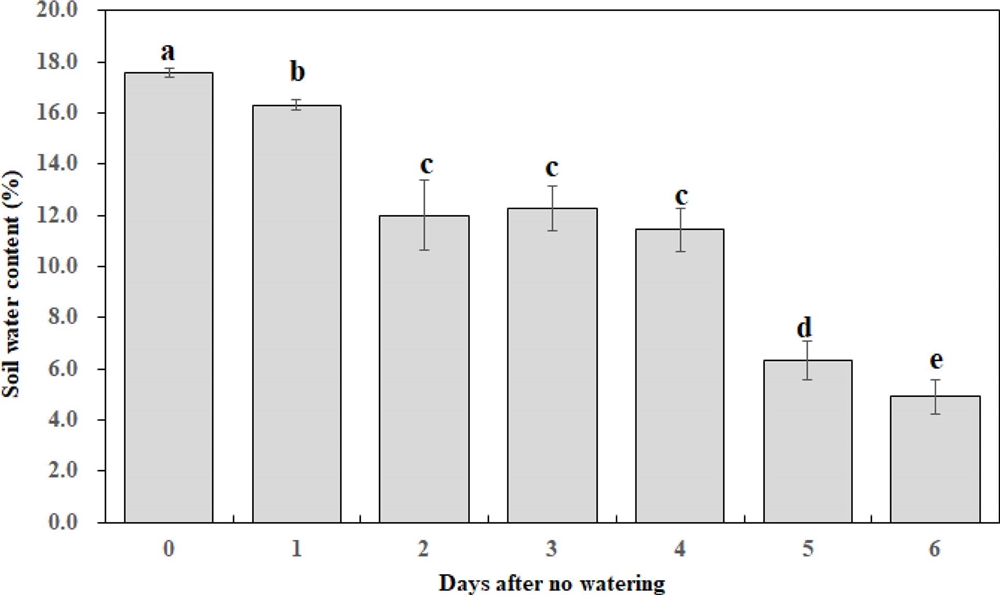
재배기간 중 토양수분 함량의 변화는 Fig. 3과 같았다. 토양수분 함량은 관수 처리 직후 17.6%였고, 수분 공급을 중단 후 1 일차에 16.3%, 2 일부터 4일 까지는 11.4% - 12.3%의 범위였고 5 일째 6.3%, 6 일째는 4.9%였다. 일반적으로 토양 수분장력 -10 ㎪ 이상에서 과습 시작, -50 ㎪ 이하에서 약간 건조, -100 ㎪ 이하는 건조 상태로 구분되며, 사양토의 경우 -10 ㎪은 토양 중량수분 함량으로 22.1%, -50 ㎪은 15.6%, -100 ㎪은 12.8%에 해당된다 (NIAST, 2010). 본 연구에서는 수분공급 중단 2 일부터 토양수분은 건조한 상태가 되고 5 일째에 위조가 시작되는 토양수분 조건에 해당되었다.
4. 토양수분과 차광 조건에 따른 엽록소 형광반응 특성
엽록소 형광은 식물의 광합성 반응 메카니즘 중 광계Ⅱ에서 엽록소에 흡수된 빛 에너지의 전자전달과 관련된 반응으로, 광화학반응에 쓰이지 못한 빛 에너지의 일부가 다시 빛으로 방출되는 현상이다 (Hopkins and Hüner, 2008).
천궁의 주요 엽록소 형광 지수의 변화는 Fig. 4와 같았다. 측정된 엽록소 형광반응 중 4 개 지수는 수분 스트레스 유발 조건 즉, 수분공급을 중단한 5 일째에 유의적인 차이를 보이기 시작하였으며, 6 일째는 급격한 감소를 보였다. 한편 무차광과 차광 처리간의 유의적인 차이는 없었지만, 그 차이는 커지는 경향을 나타내었다.
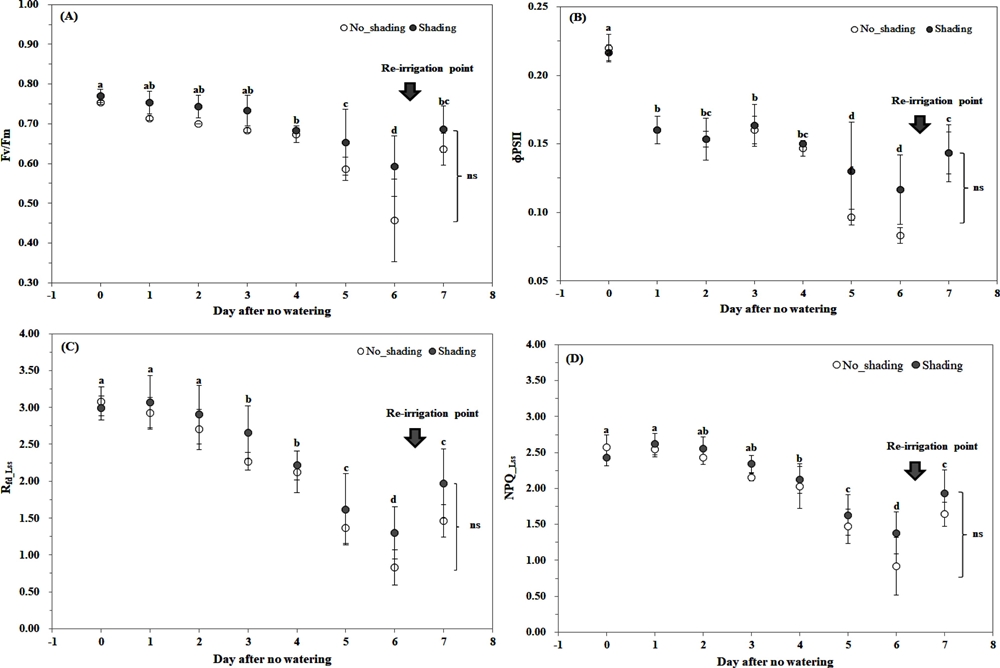
Changes in chlorophyll fluorescence parameters of Cnidium officinale Makino under different shading conditions.(A) maximum quantum yield (Fv/Fm), (B) Effective quantum yield of photochemical energy conversion in PSⅡ (ΦPSⅡ) (C) the ratio of fluorescence decrease (Rfd_Lss), (D) non-photochemical quenching (NPQ_Lss). Means with different letters above each bar indicate significant differences at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05). Vertical bars represent ± SD (n = 3). ns means no significant difference at 5% between shading and no shading treatment by Student’s t-test (p < 0.05).
형광 지수별 변화를 살펴보면, 암적응 상태에서 광계Ⅱ의 최대양자수율을 나타내는 Fv/Fm는 무차광과 차광 처리에서 각각 초기 0.75, 0.77이었고 6 일째는 0.46, 0.59로 각각 38.7%, 23.4% 감소하였다. 식물은 스트레스를 받으면, 암적응 상태에서 최대 형광값 (Fm)은 감소하고 기저상태 (ground state)의 형광값 (Fo)은 증가한다. 이 두 값은 엽록소 함량이 많으면 높아지는 특성을 가지며 일반적으로 건강한 식물 잎의 Fv/Fm 비는 0.8 정도이다. 본 연구에서 Fv/Fm의 감소는 광화학 반응 각 단계에 대한 에너지 전이 비율 및 형광 수율이 줄어든 것으로서 건조에 의한 수분 스트레스가 발생하였음을 의미하였다 (Strasser et al., 2000).
엽록소 형광 지수 ΦPSⅡ는 식물이 광합성을 하고 있는 동안에 포화광을 비추어 측정한 최대 형광값 (Fm_Lss)과 이 상태에서 actinic light (AL, 광합성이 일어나게 하는 빛)를 계속 비추면 형광이 감소하여 정류상태 (steady-state에 도달하게 되는데, 이 때의 형광값인 Ft_Lss으로 구성된다. ΦPSⅡ는 광계Ⅱ의 광화학 에너지 전환 효율을 나타내는데, 본 연구에서는 초기 0.22에서 무차광과 차광 처리 6 일째는 0.08, 0.12로 각각 63.6%, 45.5% 감소하였다. 이는 광계Ⅱ에서 전자흐름이 감소하고 있음을 의미하는 것으로 (Schreiber et al., 1986), 천궁은 급격한 수분감소 조건에서 광화학적 반응으로 전자를 보내기 보다는 형광으로 유실되는 양이 커졌음을 의미한다. 이 결과는 Jin 등 (2019)이 상록 활엽수에서 건조 스트레스가 증가함에 따라 ΦPSⅡ가 감소한 결과와 일치하였다.
엽록소 형광 감소율 (Rfd_Lss)는 형광반응 시험에서 최대 형광값을 나타내는 Fm 측정 후 AL을 비추면 일시적으로 증가하는 형광값 (Fp)과 Ft_Lss로 구성되어 있다. 본 연구에서는 무차광과 차광 처리 초기에 3.08, 2.99에서 6 일째는 0.83, 1.30으로 각각 73.1%, 56.5% 감소하여 수분 부족에 의한 스트레스에 민감하게 반응하였다. Rfd_Lss는 식물의 광합성에서 광학적 양자 전환 능력, CO2 고정률과 밀접한 관계를 가지는데 (Lichtenthaler et al., 2005), 수분스트레스가 증가했을 때감소하는 것으로 알려져 있다 (Méthy et al., 1994).
본 연구에서 천궁의 비광학적 형광 소멸 (NPQ_Lss)은 무차광과 차광 처리 초기 2.57, 2.43에서 수분공급 차단 6 일째 0.92, 1.38로 각각 64.2%, 43.2% 감소하였다. 광화학 에너지 전환 중 발생하는 광합성 기구에서 에너지의 열적 손실을 의미하는 NPQ_Lss는 스트레스 조건에서는 증가하는 것으로 알려져 있다 (Genty et al., 1990). 그러나 광합성 색소의 손상 등이 일어날 경우 엽록소 형광 반응이 감소하여 NPQ_Lss의 감소가 일어난다는 결과도 있다 (Jin et al., 2019). 전자는 Fm_Lss의 감소가, 후자는 Fm의 감소가 커진 것을 의미한다. 더욱이 NPQ_Lss는 잎의 열적 소산과 관련이 깊은 항목이므로 식물의 생육상태를 파악하기 위해서는 엽온을 고려하여 종합적으로 검토해야할 것으로 판단된다. 본 연구에서 수분공급 중단 5 일 이후의 급격한 감소는 토양수분 부족에 따른 건조에 의한 것으로 판단되었다.
이상의 결과로부터 천궁의 광합성에는 토양수분이 가장 큰 영향을 미치는 요인으로 판단되었다. 한편 Rfd_Lss 지수는 토양수분의 변화와 매우 유사하게 반응하고 변화의 정도가 다른 지수에 비해 큰 편이므로, 천궁의 수분 스트레스 지표로 유용할 것으로 판단되었다.
또한 수분 재공급에 따라 엽록소 형광반응을 측정하여 천궁의 광합성 능력 회복 정도를 조사하였다 (Fig. 4, Fig. 5). 수분 재공급에 따른 Fv/Fm는 무차광과 차광 처리에서 각각 0.64, 0.69로 수분공급 중단 후 Fv/Fm 3 일차 수준으로 회복하였고, ΦPSⅡ는 0.14, 0.14로 4 일차 수준, Rfd_Lss는 1.46, 1.64 그리고 NPQ_Lss는 1.97, 1.9로 5 일차 수준으로 회복하였다 (Fig. 4).

Changes in chlorophyll fluorescence imaging and photograph of Cnidium officinale Makino before and after rewatering in no shading treatment.(A); sixth day after no watering, (B); first day after rewatering.
엽록소형광 지수 중 회복력은 Fv/Fm>ΦPSⅡ > Rfd_Lss≒NPQ_Lss 순서를 보였다. 이러한 광합성 능력의 회복은 엽록소 형광 이미지와 외관상의 생육변화로도 관찰할 수 있었다 (Fig. 5).
5. 수분 공급 중단 후 엽온을 이용한 수분 스트레스 평가
엽록소 형광반응과 광합성률을 이용한 작물의 수분 스트레스 평가는 간접적인 방법이다. 직접적인 방법으로는 엽온 측정 방법을 이용한다. 엽온은 식물의 현재 생육상태를 판단하는 주요 지표로 태양 복사 등의 유입에너지와 식물의 증산에 따른 잠열형태의 에너지 유출 등 열수지에 의해 결정된다 (Park 2011; Seo et al., 2018b). Jackson 등 (1981)은 식물이 정상적으로 증산하고 있을 때 식물 엽온 (Ts)은 기온 (Ta)보다 낮으며, 증산이 원활하지 않을 경우 반대 현상을 보인다고 하였다.
천궁 재배기간 중 수분공급 중단에 의한 Ts - Ta의 변화를 조사한 결과는 Fig. 6과 같았다. 하루 중 태양고도가 가장 높아서 복사에너지 유입이 가장 많고 기온이 높은 13:00 - 14:00의 무차광과 차광 처리의 Ts - Ta 변화는 재배 일수가 경과함에 따라 차이가 커졌으며, 토양수분 함량 변화 (Fig. 3)와 동일한 경향을 보였다.
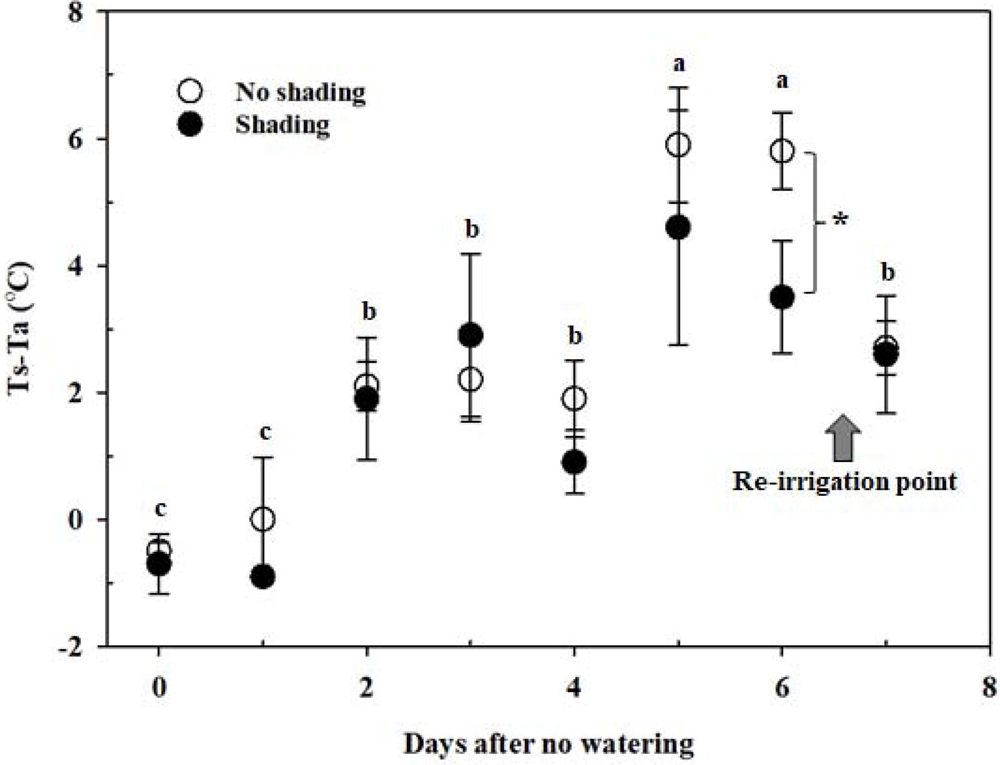
Change of Ts-Ta and vapor pressure deficit measured between 12:00 - 13:00 during the experiment periods.Tc; leaf temperature, Ta; air temperature. Vertical bars correspond to the standard error of observations. Means with different letters above each bar indicate significant differences at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05 ). Vertical bars represent ± SD (n = 3). *Means significant difference at 5% between shading and no shading treatment by Student’s t-test (p < 0.05).
토양수분 함량이 16% 이상일 때 Ts - Ta는 -0.7℃ - 0.0℃인 반면, 12% 정도일 때 0.9℃ - 2.2℃, 6% 이하일 때 3.5 - 5.9℃로 토양수분 부족 시 엽온이 크게 상승하였다. 건조 상태가 시작되는 -100 ㎪ 이하에서 엽온이 기온보다 높아지기 시작하여, 토양수분 부족이 심화됨에 따라 수분공급 중단 5 일, 6 일차에는 최고 5.9℃까지 차이를 보였다. 조사시점 (13:00 - 14:00)에서 수증기압 차이는 2 ㎪ 이상으로 (Fig. 1) 증산이 많이 일어날 수 있는 조건임에도 수분이 부족하여 광합성이 정상적으로 이루어지지 않아 증산을 통한 잠열냉각 효율이 크게 낮아지는 반면 잎을 통한 장파복사 방출이 증가하여 엽온이 높아지는 것으로 판단되었다. 이는 수분 스트레스를 받은 식물의 엽온이 기온보다 높았다는 다른 연구결과와도 일치하였다 (Jackson et al., 1981; Hashimoto et al., 1984; Yun et al., 2020).
한편, 차광 처리 조건에 따른 Ts - Ta는 관수 공급을 중단한 5 일까지는 유의적인 차이를 보이지 않은 반면 6 일차에서는 무차광 5.8℃과 차광 3.5℃로 유의적인 차이를 보였다. 그러나 수분 재공급 후 (7 일차)에는 차광 처리 조건에 따른 유의적인 차이를 관찰할 수 없었다. 수분 재공급에 의해 천궁의 Ts - Ta는 수분공급 중단 후 4 일차 수준으로 회복하였는데, 이는 엽록소 형광 분석의 결과 (Fig. 4)와도 같은 경향이었다.
위의 결과로부터 천궁은 토양수분 부족 시 증산 억제되고 잠열냉각이 감소하여 정상적인 식물체 내의 열소산이 완전히 이루어지지 않아 엽온 상승을 통한 장파복사 방출로 열소산 과정을 수행하는 것으로 판단되었다. 한편 수분의 재공급을 통해 건조 스트레스가 일부 해소되었지만 극심한 건조 조건에서 시듦, 고사 등으로 손상된 식물체의 광합성 메카니즘은 완전하게 회복되지 않은 것으로 판단되었다 (Shin et al., 2019).
6. 토양수분 함량과 광 세기에 따른 광합성 특성의 변화
광합성 반응의 두 번째 단계인 광비의존적 반응에서 토양수분 함량과 광의 세기가 천궁의 광합성 및 증산에 미치는 영향을 조사한 결과는 Fig. 7과 같았다. 광량에 따른 광합성률은 250 μ㏖·m−2·s−1까지 증가하였고 이후에 일정한 수준을 유지하였으며 토양수분 함량에 관계없이 동일한 경향을 나타내었다. 토양수분 함량에 따른 광합성률은 -5 ㎪에서 가장 높았고 토양수분 함량이 -10 ㎪ 이하부터 급격히 감소하는 결과를 보였다.
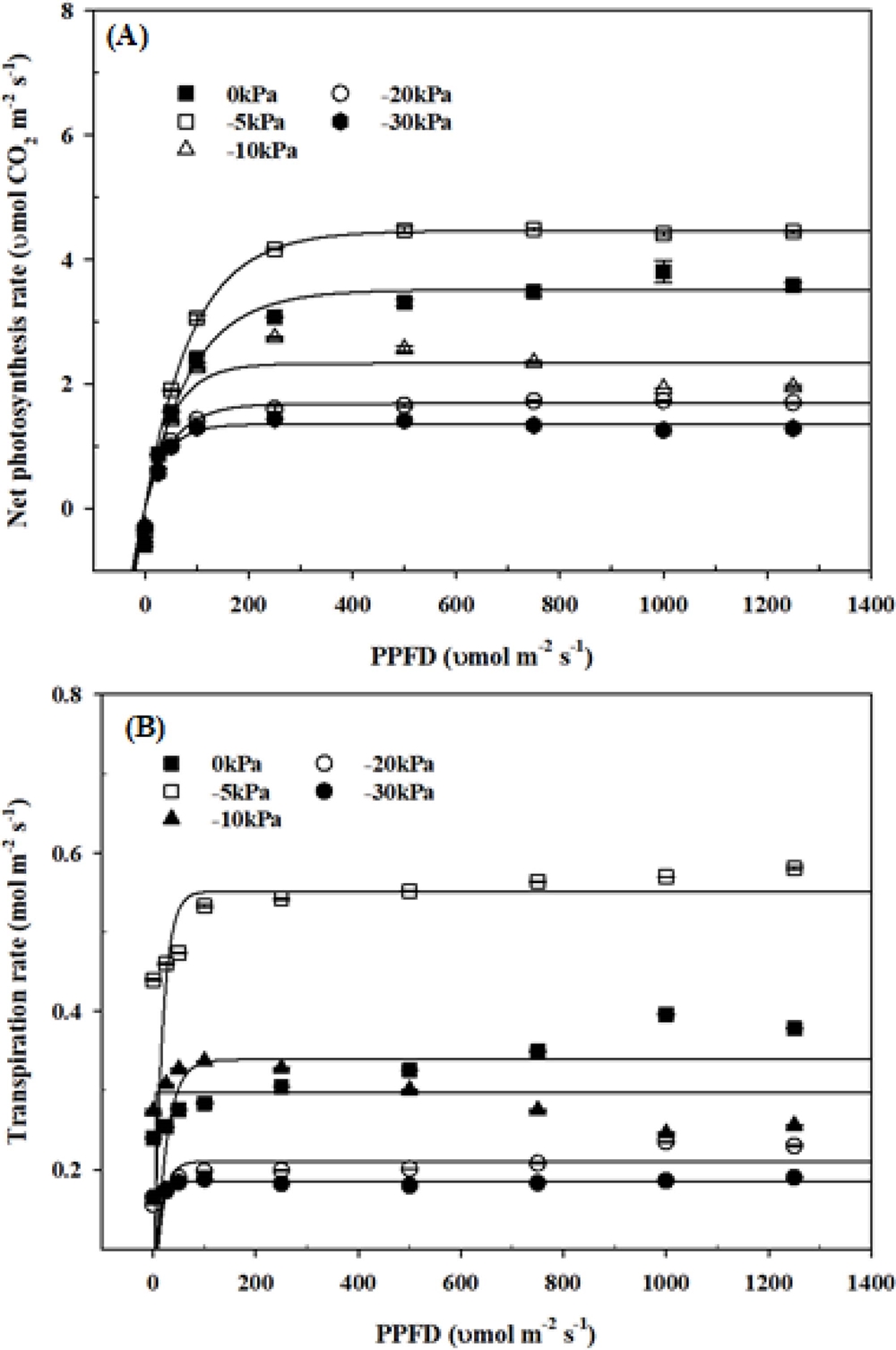
Effect of soil water potential on kinetics of net photosynthesis rate (A) and transpiration rate (B) depending upon photon flux density in Cnidium officinale Makino.
증산율 또한 광합성률과 동일한 경향을 보였으며 토양수분 함량에 따른 최대 증산율은 250 μ㏖·m−2·s−1의 광량과 -5 ㎪의 토양수분 조건에서 0.54 ㏖·m−2·s−1로 가장 높았고 -10 ㎪은 0.33 ㏖·m−2·s−1, -20 ㎪은 0.20 ㏖·m−2·s−1, -30 ㎪은 0.18 ㏖·m−2·s−1의 순으로 토양수분이 감소함에 따라 최대증산율 (광합성률)도 감소하였다.
천궁의 광보상점은 7.51 μ㏖·m−2·s−1- 9.07 μ㏖·m−2·s−1로 낮았는데 (Table 2), 이는 음지식물이 가지는 전형적인 특성으로 다른 연구자들의 결과와도 일치하였다 (Nam et al., 2020; Oh et al., 2010; Li et al., 2014).
-10 ㎪에서 광보상점이 7.51 μ㏖·m−2·s−1로 가장 낮았고 암상태의 호흡속도, 최대 광합성 속도, 순양자수율은 -5 ㎪에서 각각 0.37 μ㏖CO2·m−2·s−1, 4.48 μ㏖CO2·m−2·s−1, 0.046 μ㏖CO2·m−2·s−1로 가장 높았다. 특히 -20 ㎪ 이하의 토양수분 함량에서 최대 광합성 속도와 순 양자 수율이 40% 이상 감소하여 토양수분 함량이 천궁의 광합성과 증산에 미치는 영향이 매우 큰 것으로 분석되었다. 천궁은 일반적으로 식물이 이용가능한 수분함량의 범위인 -33 ㎪ - -50 ㎪ (Kirkham, 2004)보다 토양수분이 많은 곳에서 광합성과 증산이 높아지는 것으로 나타났다.
따라서 광보상점, 암상태의 호흡 속도, 최대 광합성 속도, 순양자수율을 고려하면 -5 ㎪ - -10 ㎪ 사이의 토양수분을 유지하는 것이 적절한 것으로 판단되었다.
이상의 결과로부터 천궁은 -5 ㎪ - -10 ㎪의 토양수분 함량과 250 μ㏖·m−2·s−1 정도의 약광 조건이 적합한 생육환경임을 확인하였다. 특히 차광 처리를 하더라도 토양수분이 부족하면 증산을 통한 잠열냉각이 저하되어 열 소산이 원활하지 않아 수분 스트레스를 받는 것으로 나타났다. 천궁의 건전한 생육을 위해서는 무엇보다도 적습 조건이 되도록 관수 관리를 하고 광량이 셀 경우 차광 처리 등의 제반 기술이 적용되어야 할 것으로 판단된다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: PJ0126422020)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
REFFERENCES
- Genty B, Harbinson J and Baker NR. (1990). Relative quantum efficiencies of the two photosystems of leaves in photorespiratory and non-respiratory conditions. Plant Physiology and Biochemistry. 28:1-10.
-
Hashimoto Y, Ino T, Kramer PJ, Naylor AW and Strain BR. (1984). Dynamic analysis of water stress of sunflower leaves by means of a thermal image processing system. Plant Physiology. 76:266-269.
[https://doi.org/10.1104/pp.76.1.266]

- Hopkins WG and Hüner NPA. (2008). Introduction to Plant Physiology. Chapter 7. Energy conservation in photosynthesis: Harvesting sunlight. John Wiley and Sons. Hoboken. NJ, USA. p.109-128.
-
Jackson RD, Idso SB, Reginato RJ and Pinter Jr PJ. (1981). Canopy temperatures as a crop water stress indicator. Water Resources Research. 17:1133-1138.
[https://doi.org/10.1029/WR017i004p01133]

- Jin EJ, Yoon JH, Bae EJ and Choi MS. (2019). Photosynthesis and chlorophyll fluorescence of evergreen hardwoods by drying stress. Korean Journal of Agricultural and Forest Meteorology. 21:196-207.
- Kim CG, Kang BH, Kim SD and Lee SB. (1997). Effect of water stress on yield and quality of Ligusticum Chuanxion Hort. Korean Journal of Medicinal Crop Science. 5:1-6.
- Kim JC, Jang WC, Son HR, Seo YJ, Lee JP and Park HR. (2013). Medicinal plants in living. Daechangsa. Daegu, Korea. p.360-361.
- Kim PG and Lee EJ. (2001a). Ecophysiology of photosynthesis. 1: Effect of light intensity and intercellular CO2 pressure on photosynthesis. Korean Journal of Agricultural and Forest Meteorology. 3:126-133.
- Kim PG and Lee EJ. (2001b). Ecophysiology of photosynthesis 2:Adaptation of photosynthetic apparatus to changing environment. Korean Journal of Agricultural and Forest Meteorology. 3:171-176.
-
Kirkham MB. (2004). Principles of soil and plant water relations. In Chapter 8. Field capacity, wilting point, available water, and the non-limiting water range. Elsevier Science and Technology. Amsterdam, Nederland. p.101-115.
[https://doi.org/10.1016/B978-012409751-3/50008-6]

-
Lee HY, Park YI, Kim CG and Hong YN. (2006). Photosynthetic responses and photoprotection in Korean hot pepper(Capsicum annuum L.) against high light stress. Korean Journal of Environmental Agriculture. 25:109-117.
[https://doi.org/10.5338/KJEA.2006.25.2.109]

-
Lee KC, Kim SH, Park WG and Kim YS. (2014). Effect of drough stress on photosynthetic capacity and photosystem Ⅱ activity in Oplopanax elatus. Korean Journal of Medicinal Crop Science. 22:38-45.
[https://doi.org/10.7783/KJMCS.2014.22.1.38]

- Lee KC. (2018). Changes in photosynthetic performance and water relation parameters in the seedlings of Korean Dendropanax subjected to drought stress. Korean Journal of Medicinal Crop Science. 26:181-187.
-
Li Q, Deng M, Xiong Y, Coombes A and Zhao W. (2014). Morphological and photosynthetic response to high and low irradiance of Aeshynanthus longicaulis. The Scientific World Journal. 2014:347461. https://www.hindawi.com/journals/tswj/2014/347461/, (cited by 2020 Oct 16).
[https://doi.org/10.1155/2014/347461]

-
Lichtenthaler HK, Langsdorf G, Lenk S and Buschmann C. (2005). Chlorophyll fluorescence imaging of photosynthetic activity with the flash-lamp fluorescence imaging system. Phtosynthetica. 43:355-369.
[https://doi.org/10.1007/s11099-005-0060-8]

-
Méthy M, Olioso A and Trabaud L. (1994). Chlorophyll fluorescence as a tool for management of plant resources. Remote Sensing of Environment. 47:2-9.
[https://doi.org/10.1016/0034-4257(94)90121-X]

- Ministry of Agriculture, Food and Rural Affairs(MAFRA). (2019). Production performance of industrial drops. Ministry of Agriculture, Food and Rural Affairs. Sejong, Korea. p.93-99.
- Misra AN, Misra M and Singh R. (2012). Chlorophyll fluorescence in plant biology. Biophysics. InTech Industries Manufacturing. Shanghai, China. p.171-192.
-
Nam HH, Seo YJ and Jang WC. (2020). Effect of shading types and duration on alleviation of high temperature stress in Cnidium officinale Makino. Korean Journal of Medicinal Crop Science. 28:111-118.
[https://doi.org/10.7783/KJMCS.2020.28.2.111]

- National Institute of Agricultural Science Technology(NIAST). (2000). Methods of analysis of soil and plant. National Institute of Agricultural Science Technology. Rural Development Administration. Suwon, Korea. p.103-147.
- National Institute of Agricultural Science Technology(NIAST). (2010). Manual of water management for the drought in crop lands. National Institute of Agricultural Science Technology. Rural Development Administration. Suwon, Korea. p.65.
-
Nedbal L, Soukupová J, Whitmarsh J and Trtílek M. (2000). Postharvest imaging of chlorophyll fluorescence from lemons can be used to predict fruit quality. Photosynthetica. 38:571-579.
[https://doi.org/10.1023/A:1012413524395]

- Oh DJ, Lee CY, Kim SM, Li GY, Lee SJ, Hwang DY, Son HJ and Won JY. (2010). Effects of chlorophyll fluorescence and photosynthesis characteristics by planting positions and growth stage in Panax ginseng C. A. Meyer. Korean Journal of Medicinal Crop Science. 18:65-69.
-
Park YM. (2011). Leaf temperature characteristics being affected by light regimes. Journal of the Environmental Sciences. 20:1599-1605.
[https://doi.org/10.5322/JES.2011.20.12.1599]

-
Schreiber U, Schliwa U and Bilger W. (1986). Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer. Photosynthesis Research. 10:51-62.
[https://doi.org/10.1007/BF00024185]

- Seo YJ, Nam HH, Jang WC and Lee BY. (2018b). Developing a model for estimating leaf temperature of Cnidium officinale Makino based on black globe temperature. Korean Journal of Medicinal Crop Science. 26:447-454.
- Seo YJ, Nam HH, Jang WC, Kim JS and Lee BY. (2018a). Effect of meteorological factors an evapotranspiration change of Cnidium officinale Makino. Korean Journal of Agricultural and Forest Meteorology. 20:366-375.
- Seo YJ, Nam HH, Jang WC, Kim JS and Lee BY. (2019). Lysimeteric evaluation for transpiration and carbon accumulation of Kimchi cabbage (Brassica rapa L. ssp. pekinensis). Korean Journal of Soil Science and Fertilizer. 52:235-248.
-
Shin YK, Kim YH and Lee JG. (2019). Application of chlorophyll fluorescence parameters for the detection of water stress ranges in grafted watermelon seedling. Protected Horticulture and Plant Factory. 28:461-470.
[https://doi.org/10.12791/KSBEC.2019.28.4.461]

- Strasser RJ, Srivastava A and Tsimilli-Michael M. (2000). The fluorescence transient as a tool to characterize and screen photosynthetic samples. In Yunus M et al., (eds.). Probing photosynthesis: Mechanism regulation and adaptation. Taylor and Francis. London, England. p.443-480.
-
Yoo SY, Eom KC, Park SH and Kim TW. (2012). Possibility of drought stress indexing by chlorophyll fluorescence imaging technique in red pepper(Capsicum annum L). Korean Journal of Soil Science and Fertilizer. 45:676-682.
[https://doi.org/10.7745/KJSSF.2012.45.5.676]

-
Yun SK, Kim SJ, Nam EY, Kwon JH, Do YS, Song SY, Kim MY, Choi YH, Kim GS and Shin HS. (2020). Evaluation of water stress using canopy temperature and crop water stress index(CWSI) in peach trees. Protected Horticulture and Plant Factory. 29:20-27.
[https://doi.org/10.12791/KSBEC.2020.29.1.20]