
매크로 다공성 흡착 수지를 이용하여 정제된 오디 안토시아닌의 지방세포 분화 억제 효과
 ; Eun Ji Go2, #
; Eun Ji Go2, # ; Byeong Ryeol Ryu3
; Byeong Ryeol Ryu3 ; Su Jin Yang4 ; Jong Suep Baek5 ; Su Ji Ryu6 ; Hyun Tai Lee7 ; Jin Woo Kwon8 ; Jung Dae Lim9, †
; Su Jin Yang4 ; Jong Suep Baek5 ; Su Ji Ryu6 ; Hyun Tai Lee7 ; Jin Woo Kwon8 ; Jung Dae Lim9, †
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The present study investigated the inhibitory effect of purified mulberry anthocyanin using PB-600 macroporous resin (RPA) in a 3T3-L1 preadipocyte differentiation model and a process for the industrial preparation of mulberry anthocyanins as a natural food and medicine materials.
Compared with the experimental purification using C18 Sep-Pak cartridges, RPA could yield a significantly higher amount of anthocyanins by an increased loading amount, the amount of purified anthocyanin, and cyanidin-3-glucoside (C3G) purified specifically, decreasing impurities containing cyanidin-3-rutinoside (C3R) in mulberry extract. To investigate the effect of RPA on cytotoxicity and adipogenesis in vitro, differentiating 3T3-L1 cells in adipocyte-induction media were treated with RPA at various concentrations (50 to 2,000 ㎍/㎖). We found that RPA inhibited 3T3-L1 adipocyte differentiation without affecting cell viability, while RPA (1,000 ㎍/㎖) treatment reduced the lipid accumulation inhibition rate to 46.44 ± 2.63%. Additionally, the triglyceride content of RPA (1,000 ㎍/㎖)-treated 3T3-L1 adipocytes decreased to 59.32 ± 1.36% compared to the control (100%). Measuring the anti-obesity effect and gene expression related to lipid metabolism through real-time PCR and experiments were performed at a concentration of less than 1,000 ㎍/㎖. RPA containing anthocyanin and non-anthocyanin fravonoid affects the gene expression of mRNA (SREBP-1c, PPAR, C/EBPα, FAS, and ACC). RPA containing both anthocyanin (C3G and C3R) and non-anthocyanin flavonoid decreased to a higher level than C3G alone in the gene expression of lipid metabolism-related genes, indicating that the lipid metabolism-related genes were significantly reduced.
The macroporus PB-600 resin was used to separate anthocyanin in the extract of mulberry, confirming it as an efficient potential method for the industrial production of mulberry anthocyanins. These results suggest that RPA could have a beneficial effect on the inhibition of adipogenesis, and that it may be used as effective anti-obesity agents.
Keywords:
Morus alba L., Adipocyte Differentiation, Anthocyanin, Lipid Metabolism, Macroporous Resin, Mulberry, Purification, 3T3-L1서 언
오디 (Mulberry)는 뽕나무과 (Moraceae)에 속하는 뽕나무 (Morus alba L.)의 열매로서 당뇨, 피로 회복, 빈혈, 고혈압, 관절 치료제로 널리 이용되어왔을 뿐만 아니라 (Son and Choi, 2013), 노화 억제, 망막 장애의 치료 및 시력개선 효과 (Scharrer and Ober, 1981), 흰쥐 대동맥의 수축·이완 작용 (Park et al., 1997) 등에 효능이 있다고 알려져 있다.
약용적 가치를 가진 과수로서 주목받기 전까지, 뽕나무의 열매, 오디는 잠상 (蠶桑)을 위한 재배 시 잎을 수확하고 남는 부산물로만 여겨졌으며, 열매의 크기가 작고 수분 함량이 매우 높아 수확 후 저장·유통 단계에서 부패가 잘 일어나 그 이용이 제한적이었으나 (Kim and Ryu, 2000) 오디와 그 안에 포함되어진 다양한 flavonoid와 anthocyanin 성분에 기인하여 현재는 약용작물의 일종으로 분류되고 있으며 식품 및 의약품의 원료물질의 소재로 상업적인 생산을 할 수 있는 작목으로 주목받고 있다 (Liu et al., 2004).
오디는 주로 anthocyanin 계통의 색소를 가지고 있고 cyanidin-3-glucoside (C3G)와 cyanidin-3-rutinoside (C3R)가 주요 성분으로 밝혀졌으며 (Suh et al., 2003), 오디에서 C3G의 분리동정 및 계통별 함량분석 (Pratt, 1992), 오디 색소 안정성에 대한 보고 (Babizhayev et al., 1994), 오디에 anthocyanin과 함께 다량 포함된 flavone 성분인 hydroxybenzoic acid와 quercetin-3-O-β-D-glucopyranoside가 copigmentation에 의해 anthocyanin과 공존함으로써 열처리나 자외선 조사에 대해 anthocyanin을 안정적으로 보존할 수 있음이 보고된 바 있다 (Bang et al., 2010).
전통적으로 원료로부터 단일의 성분을 정제하기 위해서 추출물을 제조하고 여기에 헥산, 물, 에틸아세테이트, 수포화 부탄올 등의 다양한 유기용매를 첨가한 후 액-액 분배로 분획층을 획득하여 농축·건조하는 방법을 단계적으로 사용하지만 이러한 과정을 통해 획득된 분획층은 여전히 많은 불순물을 포함하고 있다고 알려져 있다 (Kapasakalidis et al., 2006). 또한 분획을 위해 사용된 독성을 가진 유기용매는 쉽게 제거할 수 없기 때문에 정제를 위해 유기용매를 사용하는 방법을 통해 획득된 성분은 바로 식품이나 의약품 생산에 사용하기 적합하지 않다고 보고된다 (Zhang et al., 2013).
원료로부터 활성물질을 획득하기 위해 높은 수준의 기술과 장비가 요구되는 분리·정제 공정이 적용되어 고순도·고수율로 활성물질을 획득하고 이를 바탕으로 한 제품 제조에 관한 시도가 이루어지고 있으며 (Zhang et al., 2013), anthocyanin의 경우에서도, 분리·정제를 위해 paper chromatography, thin layer chromatography, column chromatography, countercurrent chromatography 및 high-performance liquid chromatography 등과 같은 chromatography법, capillary electrophoresis, solid-phase extraction (SPE) 등 다양한 방법이 적용되고 있다 (Takeoka and Dao, 2008).
SPE법은 분리·정제 공정에 있어 속도와 비용 효율성에 기인하여 복잡한 혼합물을 정제하는 가장 중요하고 자주 사용되는 시료 전처리 기술 중 하나이며 (Pavlović et al., 2010), 분할된 고체상과 액체상에서 원료가 가진 다양한 성분 중에서 분리·정제하고자 하는 성분이 고체상에 대해 더 높은 친화성을 가지는 특성과 액체상으로 다른 화합물을 효과적으로 제거하는 방식으로 운영되고 있으며 (Majors, 2008), 흡착성 cartridge, polymer, resin은 대표적인 SPE법의 matrix 중 하나이다.
SPE법에서 사용한 matrix 중 활성카본, Sepadex G, DEAE-Sepadex와 같은 polymer가 자주 이용되고 있으나 이들은 추출물로부터 성분 정제를 위하여 보통 유기용매의 분획 이후에 사용되는 정제방법으로 사용되는 점과 (Schwarz et al., 2003), 정제하고자 하는 성분의 분자량 등과 같은 크기에 의한 분류·분리의 특성을 이용하기 때문에 성분에 대한 특이 적인 정제가 어렵고 anthocyanin 등과 같은 색소 성분을 흡착하거나 용출시키기 어려운 단점을 가지고 있다.
흡착성 수지 (adsorbent resins)는 비극성 또는 약간의 친수성을 나타내는 polymer로서 매우 높은 흡착 능력을 가지고 있으며 흡착된 분자를 다시 회수할 수 있을 뿐 아니라 상대적으로 낮은 비용과 재사용이 가능하여 현재 많은 식물로부터 flavonoid는 기타 성분의 흡착 정제에 사용되고 있다 (Liu et al., 2004).
Di Mauro 등 (1999, 2000)은 비극성의 styrenedivinylbenzene (SDVB) resin을 이용하여 감귤류의 껍질에서 hesperidin을 회수할 수 있다고 하였으며 또한 같은 방법으로 가공 폐수와 유색 오렌지의 펄프 세척에서 anthocyanin을 회수하는데 사용할 수 있다고 보고하였다. 이 밖에도 resin은 다양한 식물 원료로부터 anthocyanin을 분리 정제하는 연구와 anthocyanin을 상업적으로 생산하기 위한 효과적인 흡착제로 널리 사용되고 있다 (Tsai et al., 2002; Schwarz et al., 2003).
이 밖에도 macroporous adsorbent resins (다공성 흡착수지)은 자연계에 존재하는 식물체로부터 활성성분을 추출하거나 의약품을 제조하는 경우 광범위하게 사용하고 있는데 Zhang 등 (2007)은 다공성 흡착 수지를 사용하여 약모밀 (Houttuynia cordatu Thunb.)에서부터 순도 93.3%의 flavonoid를 60% 이상 회수할 수 있다고 보고하였으며 감초의 licorice flavonoids를 과다섭취 시 고혈압을 유발할 수 있는 glycyrrhizic acid와 분리하기 위해 licorice flavonoids에 대하여 높은 흡착력을 가지는 다공성 흡착 수지, XDA-1를 선발하고 한 번의 정제과정을 통하여 glycyrrhizic acid가 없는 licorice flavonoids를 순도 21.9%로 분리·정제할 수 있음을 확인하여 보고한 바 있다 (Fu et al., 2005a).
비만은 과도한 지방세포의 증가와 분화, 비대와 과형성으로 초래되고, 그 외에도 환경의 변화, 신체 활동량의 감소뿐만 아니라 유전적인 요인 등으로 인하여 발생되는 대사성 질환이다 (Hwang et al., 2014). 비만 억제 소재의 효능 평가는 3T3-L1 지방전구세포를 대상으로 추출물이나 활성분리 물질의 처리에 따라 축적되어지는 지방구의 감소 정도를 측정함으로서 가능하다 (Kim and Chen, 2004).
지방이 생성된다는 것은 세포 분화과정의 한 부분으로, 지방전구세포의 지방구 축적, 세포 형태의 변화, 유전자 발현 및 다양한 전사인자에 의해 지방세포로 진행된다 (Ali et al., 2013). 지방전구세포에 지방구가 축적이 되면 insulin 반응을 일으켜 분화하게 되고 (Lefterova and Lazar, 2009), 또한 acyl-CoA oxidase (ACO), fatty acid synthase (FAS)의 유전자 발현은 지방 분화과정이 진행됨에 따라 증가하게 된다 (Skurk et al., 2007). CCAAT/Enhancer-binding Protein α (C/EBPα), peroxisome proliferator activated receptor γ (PPARγ) 등은 발현 시 지방전구세포를 자극하여 지방세포로 분화하도록 한다 (Lefterova et al., 2008). C/EBPα는 지방세포 유전자를 조절하는데, 과발현 시 지방구의 크기 및 수를 증가시키고 PPARγ은 지질 단백질 경로 조절인자로서 작용하며, sterol regulatory element-binding transcription factor-1 (SPEBP-1)는 지방전구세포의 분화를 촉진시켜 지방생성유전자의 발현을 증가시킨다 (Khalilpourfarshbafi et al., 2019).
비만 인구의 증가 추세에 있어 항비만 활성물질을 대량 추출하여 활성물질을 포함하는 식품개발이 요구되고 있는 시점에서, 오디에 포함된 anthocyanin이 지질대사 및 콜레스테롤 축적과 관련하여 약리적 효과를 나타낸다는 보고에 의해 항비만의 활성을 갖는 소재로의 개발이 가능할 것으로 판단되나 (Kim et al., 2001), 실제 지방세포의 분화와 축적을 억제하는 약리적 효과를 나타낼 수 있는 anthocyanin의 초기 복용량의 설정과 특정 농도로 적용된 경우 생체 내에서 anthocyanin이 어느 정도 흡수, 대사, 배설되어 생체 이용률을 나타내는지 정확히 파악할 수 없다.
실제 anthocyanin이 풍부하게 포함한 과일을 섭취한 후 체내에서 anthocyanin의 분포는 0.5 시간에서 2.0 시간 내에 혈장에서 최대농도에 도달하게 되나 anthocyanin의 전신생체 이용률 (systemic bioavailability)은 투여되는 양의 0.26% - 1.80%의 수준에 그치는 것으로 추정된다고 보고되었고 (Czank et al., 2013), 마우스 intestine section을 통해 소장 조직에서 anthocyanin의 가장 높은 흡수가 이루어지는 곳이 위장과 연결된 소장의 상위조직인 공장 (jejunum)에서 약 55.3 ± 7.6% 수준으로 확인되었고 (Matuschek et al., 2006), 위에서 소장이 시작되는 부위인 십이지장 조직 (duodenum)에서 약 10.4 ± 7.6%의 경미한 흡수가 이루어졌으며 공장 (jejunum)의 하부인 회장 (ileum)이나 결장 (colon)에서는 흡수가 이루어지지 않음을 확인된 바 있어 (Ichiyanagi et al., 2004), 위장 점막을 가로지르는 anthocyanin의 투과성은 상당히 높은 반면 소장을 비롯한 장관 내에서는 투과 및 흡수는 상대적으로 낮고 anthocyanin이 소장에서 흡수되어 전신 순환계로 들어가기 전에 간이나 콩밭에서 hydroxyation, glucuronidation, methylation, sulfation 등 매우 광범위한 대사 과정을 겪게 된다는 것을 알 수 있다.
따라서 오디의 anthocyanin을 활성본체로 하는 항비만 소재의 개발을 위해서는 anthocyanin에 대한 산업적 생산 수준의 대량 분리·정제와 지방 생성 또는 지방 생성 전사인자를 조절하는 anthocyanin의 효능에 대한 검토가 필요할 것으로 판단된다.
본 연구에서는 오디 추출물를 대상으로 다공성 흡착 수지를 이용하여 anthocyanin을 정제하여 획득하였고 (purified mulberry anthocyanin using PB-600 macroporous resin, RPA), 정제된 획득물에 포함되어진 활성물질인 anthocyanin의 함량 및 특성을 검정함으로써 오디 기원 정제 anthocyanin의 상업적 생산에 대한 가능성을 확인하였으며 활성물질로서 anthocyanin을 포함한 RPA를 대상으로 3T3-L1 지방세포의 분화에 미치는 영향과 전사인자 및 신호전달 pathway에 미치는 영향을 조사함으로서 오디 anthocyanin이 지방세포의 분화 및 지질대사에 미치는 효과를 검정하고자 하였다.
재료 및 방법
1. 실험재료
농촌진흥청 농업생물부에서 재배한 뽕나무 (Morus alba L.) 품종 ‘대심’의 열매인 오디 (mulberry)를 사용하였으며 anthocyanin 정제를 위하여 동결건조기 (FDS-5503, OPERON Freeze Dryer, Kimpo, Korea)를 이용하여 건조 시킨 후 분쇄기 (HMF-505, Hanil Scientific Inc., Seoul, Korea)로 분쇄하여 얻어진 분말을 추출 시료로 사용하였다.
동결건조가 완료된 오디 분말 100 g에 10 배에 해당하는 0.1% HCl을 함유한 80% ethanol을 넣고 38℃ - 40℃에서 초음파 추출하였으며, 5,000 g, 4℃, 15 분 조건으로 원심분리 후 상층액만 취하여 filter paper (No. 20, 300 ㎜, Hyundai micro Co., Ltd., Seoul, Korea)를 이용하여 여과하였으며 감압·농축하여 제조한 추출물 (mulberry extract, ME)을 대상으로 정제과정을 진행하였다.
2. 흡착수지 PB-600 macroporous resin을 이용한 anthocyanin의 정제
오디로부터 anthocyanin을 상업적 생산이 가능한 수준으로 대량 분리·정제하기 위하여 Liu 등 (2004)의 방법에 따라 PB-600 macroporous resin을 glass cloumn에 충진시킨 후 resin의 2 배 부피에 해당되는 95% ethanol로 resin을 고정시켰으며 색소를 resin에 흡착시키기 위해 증류수로 ethanol을 완벽하게 제거하였다. 물에 용해 시킨 오디 농축액을 미세한 불순물 제거하기 위해 5,000 g, 4℃, 15 min 동안 원심분리 후 상층액을 여과하여 여과액을 resin에 도입시켰다. 당, 유기산 및 수용성 물질을 제거하기 위해 증류수로 세척 후 0.5% HCl이 함유된 ethanol로 anthocyanin을 용출시킨 후 감압·농축하였다.
흡착 수지인 PB-600 macroporous resin을 이용하여 정제한 오디 anthocyanin의 특성을 확인하고 산업화 수준으로 생산할 수 있는 가능성을 확인하기 위하여 구조 동정, 함량 변이 등 고순도 소량 정제에 통상적으로 많이 사용하는 C18 Sep-Pak cartridges를 이용하여 정제한 anthocyanin과 비교하였다.
C18 Sep-Pak cartridges를 이용한 anthocyanin 정제과정은 우선 C18 Sep-Pak cartridges (Sep-Pak Vac 6㏄, 1 g, C18 catridge, Waters Co., Milford, MA, USA)에 ethyl acetate 20 ㎖, absolute methanol 10 ㎖, 0.01 N aqueous HCl 10 ㎖의 순서로 처리하여 활성화 시킨 다음 오디 추출물 1 ㎖을 넣고 0.01 N HCl 6 ㎖을 넣어 당, 유기산 및 수용성 물질 등을 제거하였고 high purity nitrogen gas로 15 분 건조시켰다. Ethyl acetate 20 ㎖를 넣어 non-anthocyanin을 제거하였으며 0.1% HCl이 함유된 methanol 20 ㎖를 넣어 용출시켜 얻은 anthocyanin을 38℃에서 감압·농축하였다.
각각의 방법으로 정제된 anthocyanin을 대상으로 하여 서로 다른 pH에서의 흡광도 스펙트럼, total monomeric anthocyanin pigment content, C3G, C3R의 함량을 통한 정제율, 1 회 정제 가능용량을 비교하기 위한 시료로 사용하였다.
3. PB-600 macroporous resin을 이용하여 정제한 anthocyanin의 정제 특성
Anthocyanin 정제율은 오디 추출물 (ME)로부터 PB-600 macroporous resin을 이용하여 정제한 anthocyanin (RPA)과 C18 Sep-Pak cartridges를 이용하여 정제된 anthocyanin (CPA)을 비교하였다. 정제율은 pH differential method를 이용한 total monomeric anthocyanin pigment content를 측정하여 비교하였고 (Lee et al., 2005)와 high performance liquid chromatography (HPLC)를 이용하여 오디의 주요 anthocyanin인 cyanidin-3-glucoside (C3G)와 cyanidin-3-rutinoside (C3R)를 정량 분석하여 비교하였다.
Total monomeric anthocyanin pigment contents 측정을 위하여 각각의 정제법에 의해 정제된 RPA와 CPA를 대상으로 두 개의 시험관에 anthocyanin 추출물을 각각 넣고 하나의 시험관에는 pH 1.0 buffer (0.025 M potassium chloride), 다른 하나의 시험관에는 pH 4.5 buffer (0.4 M sodium acetate)를 1 : 9 (v : v) 비율로 넣어 희석하였다. 희석한 RPA와 CPA를 20 분 동안 반응시킨 후 각각의 시료를 510 ㎚와 700 ㎚에서 흡광도를 측정하였다. 오랜 시간 방치는 흡광도 증가를 일으키므로, 모든 시료에 대하여 흡광도 측정을 20 분 - 50분 사이에서 완료하였다. 또한 pH 1.0 과 pH 4.5 환경에서 색 변화를 관찰하기 위해 220 ㎚에서 700 ㎚까지 10 ㎚ 파장별 흡광도를 측정하였다.
각 시료에 함유된 anthocyanin pigment content는 cyanidin-3-glucoside 당량 (cyanidin-3-glucoside equivalents)으로 다음 식에 의하여 산출하였고 오디 분말 1 g에 포함되어있는 cyanidin-3-glucoside 함량 (㎎)으로 나타내었다.
- A = (A510㎚-A700㎚)pH 1.0 − (A510㎚-A700㎚)pH 4.5
- MW (molecular weight) = 449.2 g/mol for cyanidin-3-glucoside, DF = a dilution factor (10)
- 103 = factor for conversion from g to ㎎
- ɛ = 26,900 molar extinction coefficient, ℓ ×㏖−1×㎝−1 for anidin-3-glucoside
- 1 = pathlength in ㎝
HPLC를 이용하여 오디의 주요 anthocyanin인 C3G와 C3R의 정량분석에서는 ME, CPA, RPA 시료를 농도 100, 500 ㎍/㎖로 제조하여 분석하였다.
분석 시 cyanidin-3-glucoside (C3G, kuromanin chloride ≥ 95.0%, Sigma-Aldrich Co., St. Louis, MO, USA)와 cyanidin-3-rutinoside (C3R, keracyanin chloride ≥ 98.0%, Sigma-Aldrich Co., St. Louis, MO, USA)를 이용하여 calibration curve을 작성하였으며, 오디 분말 1 g에 포함되어있는 각 anthocyanin을 ㎎ 단위로 산출하였으며 (C3G : R2 = 0.9953112, C3R : R2 = 0.9981661), HPLC 분석조건은 Table 1과 같다.
4. PB-600 macroporous resin을 이용하여 정제한 anthocyanin의 3T3-L1 adipocyte 세포분화 및 지방축적에 미치는 영향
오디로부터 상업적 생산이 가능한 수준으로 anthocyanin을 분리·정제 할 수 있는 것이 확인된 PB-600 macroporous resin을 이용하여 정제한 anthocyanin, RPA를 3T3-L1 preadipocyte에 처리하여 세포 분화 및 지방축적에 미치는 영향을 조사함으로써 오디의 anthocyanin이 비만 억제 소재로서 활용할 수 있는지 확인하였다.
3T3-L1 preadipocyte 세포배양은 10% fetal calf serum (FCS, Gibco BRL, Carlsbad, CA, USA), 1% penicillin/streptomycin을 함유한 Dulbecco's modified eagle's medium (DMEM, Gibco BRL, Carlsbad, CA, USA) 배지에 2 × 105 cells/㎖ 농도로 부유시켜 48 시간 동안 배양시켜 세포가 confluent 상태를 유지되도록 37℃의 CO2 incubator (Heraeus BB 15, Thermo Scientific Inc., Rockford, IL, USA)에서 배양하였다.
지방세포분화는 분화유도배지 [10% fetal bovine serum (FBS), 1% penicillin/streptomycin, 5 ㎍/㎖ insulin, (MDI treatment : 1 μM dexamethasone, 0.5 mM 3-isobutyl-1-methylxanthine)]를 사용하여 2 일 간격으로 계대하여 배양시켜 진행하였다. 2 일 동안 분화를 유도 시킨 후 1 ㎍/㎖의 insulin을 포함한 10% FBS-DMEM 배지로 2 일간 추가 배양하였고 2 일 주기로 4 회 10% FBS-DMEM 배지로 교체한 후 배양하였다. 시료 처리는 분화유도배지를 첨가한 시점부터 함께 처리하였다.
3T3-L1 preadipocyte 세포에 대한 RPA의 세포 독성은 탈수소효소의 작용에 의해 노란색의 수용성 기질인 [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide] (MTT) tetrazolium을 청자색의 비수용성 MTT formazan으로 환원시키는 미토콘드리아의 능력을 이용하여 생존하는 세포가 형성하는 formazan의 함량으로 세포독성을 간접적으로 측정하는 방법인 MTT assay를 이용하여 측정하였다 (Liu et al., 1997).
3T3-L1 preadipocyte 세포를 96 well culture plate에 100 ㎕의 배지와 함께 24 시간 배양한 다음, RPA을 농도별 (50, 100, 200, 500, 1,000, 2,000 ㎍/㎖)로 처리하고 48 시간 동안 추가 배양하였다. 각 well에 세포를 Dulbecco's phosphate-buffered saline (DPBS)로 2 회 세척한 후 DPBS에 용해시킨 10 ㎕의 MTT 용액 (50 ㎎/㎖)를 첨가한 후 37℃에서 2 시간 배양하면서 환원 반응을 유도하였으며, 100 ㎕의 DMSO를 첨가하여 형성된 formazan을 용출한 후 형성된 formazan 결정을 ELISA reader (Bio-Tek Inc., Winooski, VT, USA)를 이용하여 570 ㎚에서 흡광도를 측정하였다.
3T3-L1 preadipocyte를 대상으로 분화를 유도할 때 RPA 시료를 농도별 (100, 500, 1,000 ㎍/㎖)로 처리하고 분화가 끝난 세포를 대상으로 하여 Oil Red O staining을 수행하였다. 배지를 제거하고 DPBS를 이용하여 2 회 세척한 후, 10% formaldehyde를 첨가하여 상온에서 1 시간 이상 충분히 세포를 고정시켰다. Oil Red O (Sigma-Aldrich, St. Louis, MO, USA)는 0.7 g을 200 ㎖의 isopropanol (Sigma-Aldrich, St. Louis, MO, USA)에 녹여 stock solution을 만들어 사용하였다. Stock solution은 증류수를 가하여 60%로 희석한 후 filter paper (Thermo Scientific Inc., Waltham, MA, USA)로 여과하여 고정된 지방세포에 1 시간 반응하였다.
반응이 끝난 세포는 100% isopropanol을 첨가하여 세포로부터 lipid를 용출시킨 후 multilabel reader (VICTORTM X3, PerkinElmer, Waltham, MA, USA)로 510 ㎚에서 흡광도를 측정하였고, 측정된 흡광도를 대조군에 대한 백분율로 산출하였다
Intracellular 중성지방 함량 측정은 AdipoRedTM Kit (Cambrex bioscience, Walkersville, MA, USA)를 사용하였다. 3T3-L1 preadipocyte의 분화유도배지를 첨가할 때 100, 500, 1,000 ㎍/㎖의 농도로 RPA 시료를 처리하였고, 분화가 끝난 시점에 중성지방 함량을 측정하였다. 배지 제거 후 PBS를 이용하여 세척한 후 AdipoRedTM reagent를 처리하여 CO2 incubator에서 10 분간 추가 배양시킨 후 PBS를 이용하여 세척하였다. 세척 후에 excitiation 485 ㎚, emission 572 ㎚에서 흡광도를 측정하였고, 측정된 흡광도를 대조군에 대한 백분율로 산출하였다.
5. Adipocyte 세포분화에 있어 정제 anthocyanin처리에 따른 지방대사 관련 유전자 발현양상분석
RPA의 농도별 시료 (100, 500, 1,000 ㎍/㎖)를 세포분화가 진행된 세포에 첨가하였으며 RPA에서 지방 대사에 영향을 미치는 활성본체가 anthocyanin임을 확인하고 RPA와 순수 분리된 C3G의 지방대사 관련 유전자 발현에 미치는 영향의 차이를 확인하기 위하여 RPA에 함유되어진 것으로 정량분석으로 확인된 C3G와 C3R를 합한 anthocyanin 총함량을 C3G의 함량으로 환산하여 표준물질인 C3G를 농도별 (18.56, 92.80, 185.60 ㎍/㎖, kuromanin chloride ≥ 95.0%, Sigma-Aldrich Co., St. Louis, MO, USA)로 희석하여 시료로 제조하고 동일한 방법으로 첨가하였다. 각 시료가 첨가된 분화 과정의 세포에서 배지를 제거하여 PBS를 이용하여 세척시킨 후 trizol reagent를 처리하여 세포내의 total RNA를 분리하였다.
분리된 RNA에 각각의 primer (Genotech, Daejeon, Korea)와 One step SYBR PrimeScriptTM RT-PCR kit (Takara, Ohtsu, Japan)를 넣고 Real-time PCR Detection System (ECOTM, Illumina, CA, USA)을 이용하여 증폭하였다. 유전자 발현 분석에 사용된 primer의 서열은 Table 2와 같이 나타내었으며 PCR은 초기 변성 (Initial denaturation, 95℃, 30 sec), 변성 (denaturation, 95℃, 5 sec), 결합 (annealing, 57℃, 15 sec), 신장 (extension, 72℃, 10 sec), 최종 신장 (final extension, 72℃, 5 min)의 순서로 40 cycle 반응시켰다. 용해 곡선은 55℃ - 95℃를 0.5℃씩 증가시켜 80 번 반응 후 원하는 형광값으로 나타내었으며 mRNA의 상대적 발현량은 대조군에 대한 시료의 상대적인 유전자 발현값을 나타내었다.
6. 통계처리
각 처리구에 대한 결과를 평균 ± 오차로 표기하였으며 SPSS (Statistical Package for the Social Sciences, ver. 19.0, SPSS Inc., Chicago, IL, USA) 통계프로그램을 이용하여 통계분석을 하였고, post-hoc Duncan’s Multiple Range Tests (DMRT, p < 0.05)를 통해 각 처리구의 유의수준을 검정하였다.
결과 및 고찰
1. 흡착수지 PB-600 macroporous resin을 이용한 anthocyanin의 정제 특성
오디 추출물 (ME)로부터 anthocyanin 색소를 대량 분리 정제하기 위한 공정을 확립하기 위하여 PB-600 macroporous resin을 이용하여 anthocyanin을 정제하였으며 일반적으로 소량 정제 시 사용되는 C18 Sep-Pak cartridges를 이용하여 정제한 anthocyanin과 비교하였다.
PB-600 macroporous resin을 이용하여 정제한 anthocyanin (RPA)을 C18 Sep-Pak cartridges를 이용하여 정제한 anthocyanin (CPA)을 서로 다른 pH 환경에서 정치시켜 육안으로 확인한 결과 두 가지의 색소 정제방법으로 정제되어 얻어진 anthocyanin 정제물 (RPA, CPA) 모두에서 공통적으로 pH 1.0에서 오렌지색을 나타내었으며 pH 4.5에서는 무색 혹은 옅은 보라색을 나타내었다 (Fig. 1).

Observation of color change of mulberry extract (A) and purified mulberry anthocyanin by different purification methods, (B, purified mulberry anthocyanin using C18 Sep-Pak cartridges, CPA) and (C, purified mulberry anthocyanin using PB-600 macroporous resin, RPA) under different pH conditions (left, pH 1.0; right pH 4.5).
ME, RPA, CPA를 대상으로 UV-Vis spectrophotometer를 이용하여 각 파장별 흡광도를 측정한 결과에서 두 가지의 색소 정제방법으로 정제되어 얻어진 anthocyanin 정제물이 동일하게 pH 1.0의 경우 해당 pH에서 anthocyanin의 최대 흡광도 파장인 510 ㎚에서 높은 흡광도를 나타낸 반면 pH 4.5에서는 그 흡광도가 감소하였음을 보여주었다 (Fig. 2, Table 3).
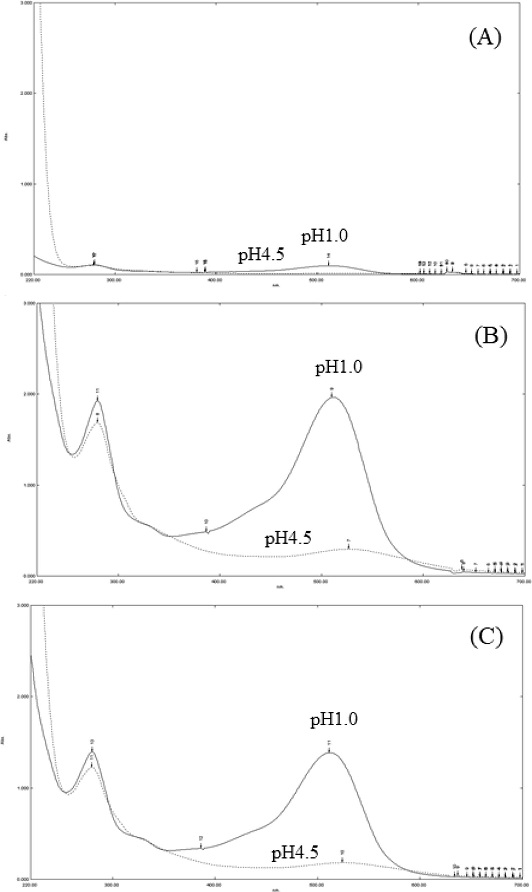
Spectral characteristics in mulberry extract and purified mulberry anthocyanin by different purification methods. (A); mulberry extract, (B); CPA (mulberry anthocyanin using C18 Sep-Pak cartridges), (C); RPA (purified mulberry anthocyanin using PB-600 macroporous resin). UV-Vis scanning spectrarum of purified anthocyanin under pH 1.0 (full line) and pH 4.5 conditions.

Spectral absorbance in different pH conditions and anthocyanin pigment content of mulberry extract and purified mulberry anthocyanin by different purification methods.
Anthocyanin 색소는 pH가 변함에 따라 흡광도 스펙트럼의 두드러지는 변화와 함께 구조적 변형을 일으킨다 (Fernandes et al., 2014). pH 1.0에서는 flavylium cation이 존재하는 옥소늄 형태 (oxonium form)가 대부분을 차지하기 때문에 오렌지에서 보라색을 나타내며 pH 4.5 에서는 무색의 헤미케탈 형태 (hemiketal form)로 변한다고 보고한 바 있다 (Fang, 2014). 이러한 결과는 pH에 따라 정제된 anthocyanin이 나타내는 색소의 변화는 산도 변화에 따라 발생하는 anthocyanin의 구조적 변형에 기인한다는 보고와 일치하였으며 (Fang, 2014), 이는 RPA처럼 흡착 수지를 이용한 anthocyanin의 정제방법이 anthocyanin의 구조적 변형에 영향을 미치지 않으며 일반적으로 통용되어 사용되고 있는 C18 Sep-Pak cartridges를 이용하여 정제된 anthocyanin, CPA와 동일하게 anthocyanin의 구조를 유지하고 있는 상태에서 정제될 수 있음을 의미한다고 할 수 있다.
ME, RPA, CPA의 anthocyanin pigment content를 pH differnet method를 이용하여 cyanidin-3-glucoside 당량으로 측정 비교한 결과, 오디 분말 1 g 당 ME는 10.14 ± 0.64㎎·C3G/g, CPA는 203.24 ± 0.92 ㎎·C3G/g 그리고 RPA의 경우 152.37 ± 1.18 ㎎·C3G/g의 함량으로 나타내었다 (Table 3).
오디와 같이 anthocyanin이 풍부하게 존재하는 원료로부터 착즙을 하거나 추출물을 제조, 농축하여 제품 원료로 사용할 수 있으나 이러한 단순 추출물의 경우 추출물 자체에 단당류, 이당류 및 다당류, 미네랄, 단백질 또는 유기산과 같은 불순물이 높은 비율로 존재하기 때문에 anthocyanin의 농도와 색상값이 낮다고 보고되어지고 있다 (Liu et al., 2004).
반면 추출된 anthocyanin 추출물을 흡착성 수지를 이용하여 정제하는 경우, 정제의 과정을 통해 대부분의 불순물이 제거되고 이러한 정제과정 중 이루어지는 불순물의 제거는 anthocyanin의 갈변을 유발하는 효소 및 비효소적 반응을 감소시켜 anthocyanin 첨가 제품의 안정성을 증가시킬 수 있다고 보고되었다 (Di Mauro et al., 2002). 특히 31 종의 mulberry 품종에서 6 개의 서로 다른 resin을 사용하여 anthocyanin을 분리정제 한 경우 pore radius (Å)와 surface area (㎡/g)가 높은 X-5 resin을 사용하는 경우 높은 흡착능력 (adsorbent capabilities)을 기반으로 우수한 정제능력을 나타내었다는 연구 결과를 고려하여 볼 때 (Liu et al., 2004), 750 ㎡/g의 높은 surface area을 가지고 있는 PB-600 macroporous resin은 anthocyanin의 정제에 효율적으로 사용되어질 수 있을 것으로 생각된다.
오디 추출물 (ME)과 anthocyanin 정제물 (CPA, RPA)의 anthocyanin 함량분석을 위해 HPLC를 통해 cyanidin-3-glucoside (C3G), cyanidin-3-rutinoside (C3R) 함량을 분석하였고 C3G, C3R의 함량을 합산하여 total anthocyanin의 함량을 산출하고 1 번의 정제과정에 적용할 수 있는 오디 추출물의 양 (LA), 1 번의 정제과정을 통해 정제할 수 있는 anthocyanin의 양 (APA). 그리고 정제율을 비교한 결과는 Table 4와 같다.

Comparison of contents of anthocyanin, loading amount (LA), amount of purified anthocyanin (APA) and purification rate (PR) by different purification methods.
각 정제방법에서 C3G, C3R의 함량을 합산하여 산출된 total anthocyanin의 함량은 ME가 44.36 ± 33.77 ㎎/g, CPA의 경우 242.18 ± 19.27 ㎎/g, RPA는 185.60 ± 27.37 ㎎/g를 나타내어 CPA가 더 순도가 높은 수준으로 anthocyanin을 정제할 수 있음을 확인하였으나 1 번의 정제과정에 적용할 수 있는 오디 추출물의 양은 CPA가 0.40 ± 0.03 g인 반면 RPA는 73.19 ± 0.12 g으로 나타나 정제과정에 적용할 수 있는 오디 추출물의 양이 RPA가 약 183 배 수준으로 더 높음을 확인할 수 있었으며 1 회 정제과정을 통해 획득할 수 있는 anthocyanin의 함량도 CPA는 0.10 ± 0.01 g인 반면 RPA는 13.58 ± 0.44 g을 나타내어 PB-600 macroporous resin을 이용한 정제방법이 C18 Sep-Pak cartridges를 이용한 정제방법보다 약 140 배 높은 anthocyanin 정제량을 나타내었다 (Table 4).
결과적으로 total anthocyanin, C3G 및 C3R 함량을 비교하였을 때 C18 Sep-Pak cartridges를 이용한 정제방법은 anthocyanin을 고순도로 정제하기에 적합하며 산업적 생산에 이용되기 어려운 반면 PB-600 macroporous resin을 이용한 정제방법은 정제되는 과정에서 anthocyanin의 구조적 변이 없이 높은 수율로 anthocyanin을 정제에 사용할 수 있는 방법으로 판단된다.
각각의 C3G, C3R의 함량을 비교하여 본 결과 CPA의 경우 C3G가 154.69 ± 8.78 ㎎/g, C3R이 87.50 ± 10.50 ㎎/g을 나타낸 반면 RPA에서는 C3G가 118.90 ± 13.54 ㎎/g, C3R이 6.67 ± 13.83 ㎎/g을 나타내었다. PB-600 macroporous resin을 이용하여 anthocyanin을 정제하는 경우 상대적으로 C3G의 선택적 흡착능력이 C3R을 흡착하는 능력보다 더 높은 것을 확인할 수 있었다 (Table 4 and Fig. 3).
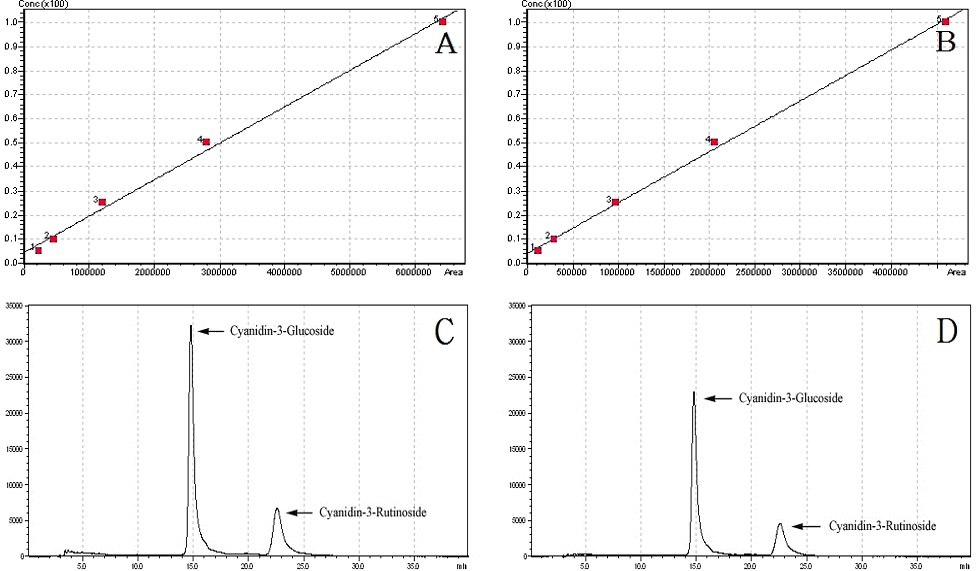
HPLC chromatogram of cyanidin-3-glucoside and cyanidin-3-rutinoside in purified mulberry anthocyanin by different purification procedures. (A); Calibration curve of cyanidin-3-glucoside standard (R2 = 0.9953112), (B); Calibration curve of cyanidin-3-rutinoside (R2 = 0.9981661), (C); CPA, purified mulberry anthocyanin using C18 Sep-Pak cartridges, (D); RPA, purified mulberry anthocyanin using PB-600 macroporous resin.
이러한 연구 결과는 macroporous resin을 이용하여 anthocyanin을 정제하는 경우 비록 순도는 높지 않지만 C3G를 선택적으로 정제하고 높은 수율과 많은 양의 anthocyanin을 분리·정제할 수 있는 방법이라는 것을 나타내며 생체이용률에 있어서도 flavonoid glucoside의 체내 흡수가 flavonoid rutinoside의 체내 흡수보다 우수하다고 보고한 결과와 (Hollman et al., 1999), rat에서 C3G의 흡수가 C3R의 흡수보다 더 높은 수준으로 나타난다는 결과 및 (Wu et al., 2005), 경구 투여 시 C3G와 C3R의 aglycone 형태인 cyanidin이 rat에서 낮은 흡수율을 보인 반면 C3G는 보다 짧은 시간에 혈장에서 검출됨으로써 빠른 흡수율을 나타낸다는 결과를 고려하여볼 때 (Tsuda et al., 2002), 의약품이나 식품의 제조 시 matrix에서 anthocyanin의 생체이용률을 높이기 위한 효과적인 정제방법으로 사용되어질 수 있을 것으로 생각된다.
2. 오디 추출물로부터 PB-600 macroporous resin을 이용하여 정제한 anthocyanin의 지질 축적 및 지방세포 분화 억제 효과
오디 추출물로부터 정제된 RPA (순도: 18.56% anthocyanins)을 농도별로 처리한 후 3T3-L1 preadipocyte 세포가 adipocyte로 분화하는 과정 중 나타나는 세포독성을 MTT assay를 이용하여 검정한 결과 정제된 RPA을 처리하지 않은 대조군의 세포 증식율을 100%로 하였을 때, 오디 추출물로부터 정제된 RPA를 50 ㎍/㎖의 수준으로 처리한 경우 세포의 생존률은 110.65%, 100 ㎍/㎖에서는 130.34%, 500 ㎍/㎖의 경우에서는 116.64%로 오히려 증가하였고 1,000 ㎍/㎖에서는 90% 이상의 세포증식이 유지되었으며, 2,000 ㎍/㎖ 농도에서 세포의 생존률이 81.23%로 나타나 세포독성이 유발되었다(Fig. 4).
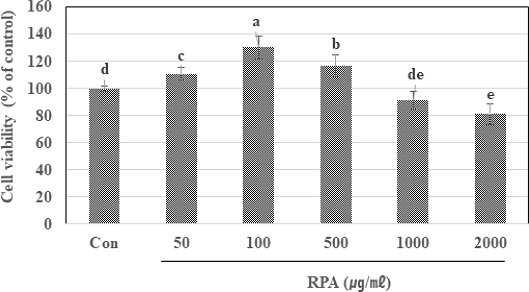
Cell viability of purified mulberry anthocyanin using PB-600 macroporous resin from mulberry extract in 3T3-L1 preadipocytes cell. 3T3-L1 cells were treated with purified mulberry anthocyanin using PB-600 macroporous resin (RPA) at various concentrations for 48 h. Cell viability was measured by the MTT assay. Each value is expressed as the means ± SD of three independent experiments. *Means within a column followed by the same letter are not significantly different based on the Duncan's Multiple Range Test (DMRT, p < 0.05).
이러한 연구 결과는 3T3-L1 지방세포의 분화과정에서 C3G를 0 μM (대조군), 50 μM 및 100 μM의 수준으로 처리함에 따라 용량 의존적으로 3T3-L1 preadipocyte가 지방세포로 분화되는 과정에서 preadipocyte의 세포증식을 유도할 수 있으며 C3G의 처리가 3T3-L1 preadipocyte의 분화에 있어 백색지방세포를 갈색지방세포와 베이지색지방세포로 전환시킬 수 있다는 보고와 유사하였다 (Matsukawa et al., 2017).
또한 갈색지방세포는 많은 수의 미토콘드리아를 보유하고 있으며, 세포 내 미토콘드리아에서 지방산의 산화적 인산화 과정을 uncoupling하는 uncoupling protein 1 (UCP1)과 같은 열 발생 조절 단백질들을 발현시키고 다방성 지방을 형성시킨다는 보고에 근거하여 (Bartelt and Heeren, 2014) 3T3-L1 지방세포의 분화과정에서 특정 농도 이하의 C3G의 처리는 preadipocyte의 증식을 촉진하지만 동시에 preadipocyte로 분화된 백색지방세포를 갈색지방세포로의 전환을 촉진함으로써 ATP 생성을 감소시키고 열 발생 (thermogenesis)을 통해 에너지를 소모시킴으로서 체지방을 감소시킬 수 있을 것으로 생각된다.
3T3-L1 preadipocyte가 분화되는 과정에서 RPA 시료를 독성을 나타내지 않는 범위로 처리하고 (100, 500, 1,000 ㎍/㎖) 지방세포로 분화가 완료된 후 Oil Red O staining을 수행하여 세포에 축적되어지는 lipid의 함량을 검정한 결과 100 ㎍/㎖을 처리한 경우, 대조구에 비하여 약 52.21%의 수준으로 지질 축적을 감소시켜 통계적으로 유의한 감소 결과를 나타냈으나 500 ㎍/㎖과 1,000 ㎍/㎖를 처리한 경우 지질 축적은 각각 49.32%, 46.44%를 나타내어 100 ㎍/㎖ 이상의 농도를 적용하는 경우에서는 지질 축적의 저해능은 큰 변화를 나타내지 않았다 (Table 5).

Inhibitory effect of purified mulberry anthocyanin using PB-600 macroporous resin from mulberry extract on the lipid accumulation and intercelluar triglyceride in 3T3-L1 adipocyte cells.
RPA 시료의 처리에 따라 지방구의 감소를 보다 직접적으로 확인하기 위해 세포 내의 중성지방 함량을 AipoRedTM assay kit를 이용하여 측정한 결과, RPA를 100 ㎍/㎖의 수준으로 처리한 경우에서는 77.23%, 500 ㎍/㎖에서는 63.22%, 1,000 ㎍/㎖에서는 59.32%로 중성지방 함량이 감소를 나타내었으나 농도 의존적으로 함량 감소를 나타내지는 못하였다 (Table 5).
이러한 결과는 포도껍질에서 분리·정제한 antohocyanin을 지방세포 분화 과정에 적용한 경우 3T3-L1 preadipocyte에 대하여 40.0 ㎍/㎖ 이상의 농도로 처리하였을 경우 독성을 나타내지 않았으며, 2.5 ㎍/㎖에서 20.0 ㎍/㎖를 처리한 경우 농도 의존적으로 세포에 축적되어지는 lipid의 함량을 감소시키고 지방구 내 중성지방의 축적으로 억제한다는 결과와 상이하게 나타났으며 (Lee et al., 2014), 이는 3T3-L1 preadipocyte의 분화에 있어 지질 축적 저해와 중성지방 함량 축적 저해에 적용되어지는 antohocyanin의 농도 범위의 차이또는 포도껍질과 오디와 같이 각각의 원료가 함유하고 있는 antohocyanin의 종류가 서로 다르기 때문인 것으로 판단된다.
3T3-L1 preadipocyte는 여러 호르몬과 다양한 전사인자들에 의해 지방세포로 분화하고 지방세포 내 지방구의 형성이 증가하면서 중성지방 생성량이 증가하고 지방축적에 관여하는 효소가 활성화되면서 점차적으로 지방세포 내 지방 축적이 일어나게 되는데 (Frayn et al., 2003), 대부분의 항비만 활성을 갖는 소재들은 adipogenesis 과정에서 지방세포의 분화를 억제하여 lipid accumulation의 감소에 효과가 나타나 항비만 효과를 나타낸다.
반면 이상의 결과로부터 antohocyanin의 처리는 농도에 따라 preadipocyte 전구지방세포 증식 및 분화 과정에 영향을 줄 뿐만 아니라 이미 분화된 지방세포의 형태적 기능적 전환을 발생시키고 분화가 완료된 이후에도 지방세포의 지방구에 지질 축적을 저해하고 세포 전체의 중성지방 함량을 감소시키는 효과가 있는 것으로 생각되어진다.
3. 오디 추출물로부터 PB-600 macroporous resin을 이용하여 정제한 anthocyanin 처리에 따른 지방세포 분화 및 지방산 생성 관련 유전자의 발현양상분석
지방전구세포가 지방세포로 분화하는 과정에서 세포 형태의 변화와 함께 지방세포 내 지방 합성과 축적에 관여하는 효소들이 분화 초기에 전사인자에 의해 발현이 조절되며 분화 후기에는 다양한 adipogenic 유전자들이 발현을 유도하며 그 발현양이 증가하게 된다 (Boney et al., 1994).
지방전구세포의 분화 초기 과정에서 insulin, dexamethasone, 3-isobutyl-1-methylxanthine (IBMX) 등의 유도인자에 의해 C/EBPβετα와 C/EBPδ가 발현되어지며 (Ailhaud et al., 1992), peroxisome proliferator activated receptor γ (PPAR-γ)와 CCAAT/Enhancer-binding Protein α (CEBP/α)는 분화 후기에 발현되면서 다양한 종류의 지방세포 특이성 mRNA 등의 전사가 활성화되는 것으로 알려져 있다 (Lehrke and Lazar, 2005; Lefterova et al., 2008; Lefterova and Lazar, 2009).
오디 추출물로부터 정제된 RPA에 대하여 지방세포 분화 전사인자인 SREBP-1c, C/EBPα 및 PPARγ와 이들의 표지 유전자인 fatty acid synthase (FAS) 및 acetyl coA carboxylase (ACC)의 발현에 미치는 영향을 quantitative real-time PCR를 통하여 확인하였다.
대조구 (control)에 비하여 분화 배지만 처리한 군 (MDI)에서 이들 전사인자 및 유전자의 발현은 현저하게 증가되는 양상을 나타낸 반면 오디 추출물로부터 정제된 RPA 시료 (100 ㎍/㎖, 500 ㎍/㎖, 1,000 ㎍/㎖)와 대조구로서 RPA에 함유된 C3G와 C3R를 합한 anthocyanin 총함량을 C3G의 함량으로 환산하여 표준물질인 C3G를 농도별 (18.56, 92.80, 185.60 ㎍/㎖)로 처리하여 지방생성과 관련된 유전자 mRNA의 발현 양상을 확인한 결과 (Fig. 5), RPA 시료 100 ㎍/㎖를 처리한 경우, SREBP-1c, PPARγ와 C/EBPα에 대한 mRNA 발현 억제율은 각각 82.63%, 92.63%, 77.69%로 나타났으며 RPA 시료를 500 ㎍/㎖의 수준으로 처리한 경우 억제율은 SREBP-1c, PPARγ과 C/EBPα에서 억제율은 66.36%, 81.66%, 45.32%로 더 높은 수준으로 억제율을 나타내었고 RPA 시료 1,000 ㎍/㎖를 처리한 경우 각각 52.36%, 72.36%, 21.61%로 나타나 RPA 시료의 농도가 높아질수록 농도의존적으로 지방세포 분화 전사인자인 SREBP-1c, PPARγ와 C/EBPα에 대한 mRNA 발현 억제율이 높게 나타나는 것을 확인할 수 있었다(Fig. 5).
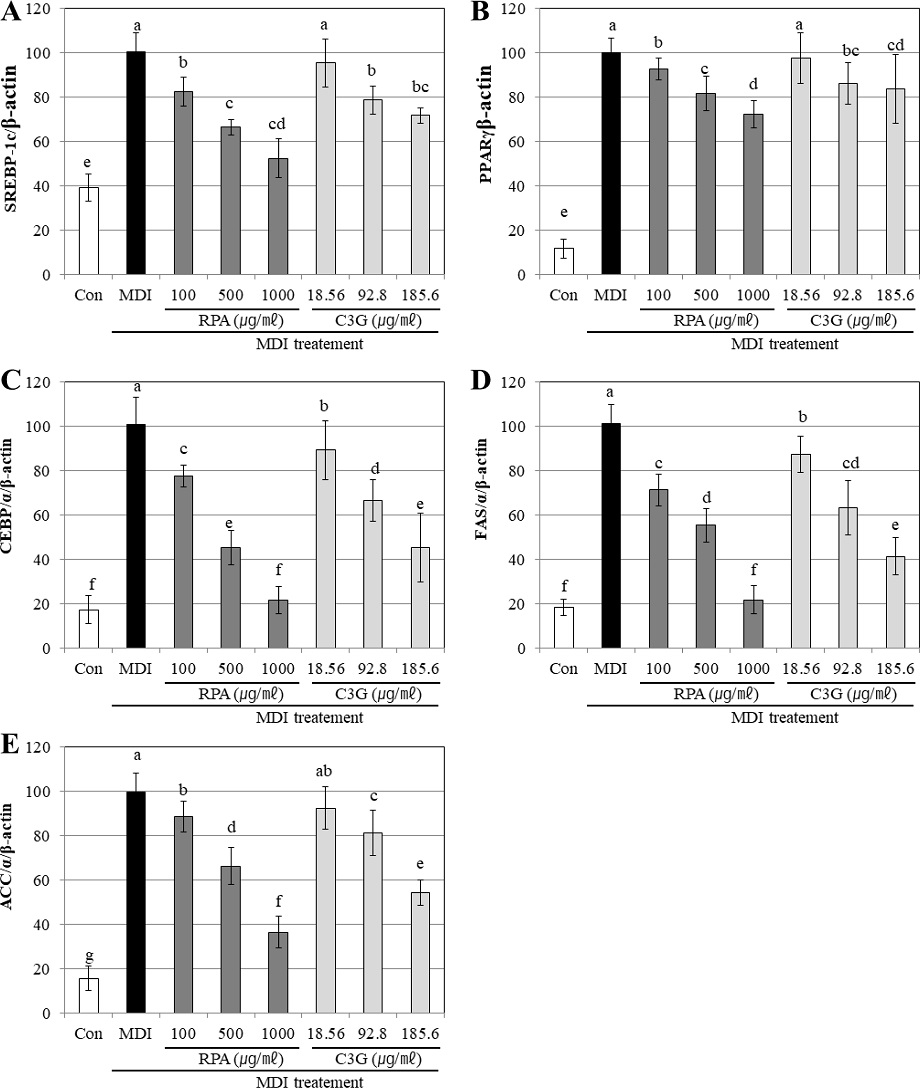
Gene expression effects of purified mulberry anthocyanin using PB-600 macroporous resin on adipocyte differentiation in 3T3-L1 cells confirmed RT-PCR. A; sterol regulatory elementbinding proteins-1c (SREBP-1c), B; peroxisome proliferator activated receptor γ (PPAR-γ), C; CCAAT/Enhancer-binding Protein α (CEBP/α), D; fatty acid synthase, E; acetyl coA carboxylase (ACC). Differentiation of confluent 3T3-L1 cells was initiated in DMEM containing differentiating culture mixture (MDI treatment: 0.5 mM 3-isobutyl-1-methylxanthine, 1 μM dexamethasone and 1 ㎍/㎖ insulin). Total RNA was extracted and cDNA was prepared from preadipocyte cell treated by purified mulberry anthocyanin using PB-600 macroporous resin (RPA). Equivalent amounts of cDNA were amplified using primers specific for SREBP-1c and β-actin. Each value is expressed as the means ± SD of three independent expriments. *Means within a column followed by the same letter are not significantly different based on the Duncan`s Multiple Range Test (DMRT, p < 0.05).
각 전사인자 별로 시료 처리에 따른 발현억제율을 분화유도전 발현율과 비교한 결과, SREBP-1c, PPARγ의 경우는 RPA 시료를 1,000 ㎍/㎖의 수준으로 처리하여도 MDI를 처리 대비 mRNA 발현 억제하기는 하였지만 분화유도 전 나타나는 발현율 수준으로 회복되지는 못하였으나 C/EBPα에 대해서는 RPA 시료를 1,000 ㎍/㎖의 수준으로 처리함에 따라 분화유도 처리에 의해 증가된 C/EBPα mRNA 발현을 분화유도 이전의 수준으로 억제할 수 있는 것으로 확인되었다 (Fig. 5).
또한 RPA 시료를 농도별로 처리한 것과 RPA에 함유되어져 있을 것으로 예측되는 C3G와 C3R를 합한 anthocyanin 총함량을 C3G의 함량으로 환산하여 표준물질인 C3G를 처리한 후 SREBP-1c, PPARγ와 C/EBPα에 대한 mRNA 발현 억제율을 비교한 결과 모든 농도에서 C3G와 C3R의 총량을 C3G로 환산하여 처리한 것 보다 RPA 시료가 지방세포 분화 전사인자인 SREBP-1c, PPARγ와 C/EBPα에 대한 mRNA 발현을 보다 높은 수준으로 억제할 수 있다는 것을 확인하였다 (Fig. 5).
이러한 결과는 오디로부터 PB-600 macroporous resin을 이용하여 anthocyanin을 정제하는 경우 상대적으로 C3G의 선택적 흡착능력이 C3R을 흡착하는 능력보다 더 높았다는 본 연구 결과와 (Table 5 and Fig. 3), 라즈베리로부터 AB-8 macroporous resin column chromatography를 이용하여 anthocyanin을 분리 정제하는 경우 파장 280 ㎚과 520 ㎚에서 전형적인 anthocyanin 흡광 특성을 나타내는 component II와 component III와는 별개로 component I (254 ㎚, 365 ㎚)과 component IV (245 ㎚, 370 ㎚)와 같은 non-anthocyanin flavonoid compounds가 함께 분리된다는 보고 (Xue et al., 2020), 링곤베리로부터 anthocyanin 분리 과정에 얻어진 non-anthocyanin 폴리페놀 분획이 비대화된 adipocyte에서 지질 축적과 triglyceride 함량을 감소시킬 뿐 아니라 지방산과 triglyceride 합성에 관여하는 지질 유전자인 adipocyte protein 2 (aP2), fatty acid synthase (FAS), 및 diacylglycerol acyltransferase-1 (DGAT1)의 발현을 감소시킬 수 있다는 보고에 근거하여 (Kowalska et al., 2021), 오디로부터 PB-600 macroporous resin을 이용하여 anthocyanin을 정제하여 RPA를 만드는 과정에서 anthocyanin에 포함된 non-anthocyanin 폴리페놀 성분들이 함께 anthocyanin 함께 상승적으로 작용하여 C3G를 단독으로 처리하는 것보다 더 높은 수준으로 지방세포 분화 전사인자의 mRNA 발현을 억제한 것으로 판단된다.
지방산 생성에 관여하는 효소인 FAS, ACC 등은 유전자 발현을 조절하고 지방 생성과 관련된 단백질 발현에도 영향을 끼침으로써 인슐린 의존적인 지방 합성을 유도한다 (Fu et al., 2005b; Skurk et al., 2007).
FAS는 지방 생성의 주요 효소이며 주로 지방 조직, 간 및 유선에서 발현되는데, 감소된 FAS 발현은 지방전구세포 분화 및 지질 축적을 억제한다 (Schmid et al., 2005). FAS, ACC의 유전자 발현에 있어서도 분화유도에 따라 각 유전자들의 발현량이 증가하였지만, RPA를 농도별로 처리하였을 경우 농도 의존적으로 발현이 감소함을 확인하였다. 특히 RPA를 시료를 1,000 ㎍/㎖의 수준으로 처리한 경우 FAS mRNA 발현은 분화 유도 전의 수준으로 발현을 감소시키는 것으로 확인되었고 RPA 시료 1,000 ㎍/㎖에 포함되어져 있을 것으로 예측되는 C3G의 함량인 185.6 ㎍/㎖로 처리하여 FAS와 ACC mRNA 발현의 억제 정도를 확인한 결과에서도 RPA 시료가 C3G 단독 처리보다 더 높은 수준으로 FAS와 ACC 유전자의 발현을 억제할 수 있는 것이 확인되었다.
SREBP-1c는 유전자 발현의 전이를 촉진하여 FAS를 조절하고 (Han et al., 2018), SREBP-1c, PPARγ, CEBP/α의 발현량이 줄어 ACC의 지방산 합성 및 신장을 억제한다는 보고와 같이 (Kim, 1997), 오디로부터 PB-600 macroporous resin을 이용하여 정제된 anthocyanin은 상위 발현 유전자인 SREBP-1c, PPARγ, CEBP/α의 mRNA 발현량을 감소시킴으로써 지질의 합성 수송, 저장에 관여하는 FAS와 ACC mRNA의 발현 (Jayarathne et al., 2017)에 영향을 미쳐 지방세포의 분화를 억제시키고 지방세포 내 중성지방의 생성과 축적을 현저히 감소시킨 것으로 확인되었다.
이상의 연구 결과를 통하여 오디로부터 anthocyanin을 분리·정제 시 매크로 다공성 흡착 수지를 이용하는 경우 anthocyanin의 구조를 유지하고 있는 상태에서 정제될 수 있을 뿐 아니라 하여 Sep-Pak cartridges를 이용하여 정제하는 방법보다 더 높은 수율의 anthocyanin을 분리·정제할 수 있어 상업적인 생산이 가능하다는 것을 확인하였다. 또한 매크로 다공성 흡착 수지를 이용하여 anthocyanin을 정제하는 경우 비록 순도는 높지 않지만 생체이용율과 체내 흡수가 우수한 C3G를 선택적으로 정제하고 높은 수율과 많은 양의 anthocyanin을 정제할 수 있는 방법이라는 것을 확인하였다.
오디로부터 매크로 다공성 흡착 수지를 이용하여 분리·정제한 anthocyanin 분획은 SREBP-1c의 발현을 억제 함으로써 하위인자인 PPARγ와 CEBP/α의 발현에 영향을 미치고 지방세포분화 전사인자인 C/EBPα와 PPARγ의 발현을 억제시킴으로써 FAS 및 LPL의 지방세포 표지 유전자 발현량을 감소시키고 최종 세포 내 중성지방의 생성 및 축적을 감소시킬 수 있다는 것을 확인하였고 오디로부터 매크로 다공성 흡착 수지를 이용하여 분리·정제한 anthocyanin 분획인 비만을 예방할 수 있는 우수한 기능성 식품 소재로서의 가능성이 확인됨과 동시에 제품화 또한 가능할 것으로 판단하였다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: PJ015740042021)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Ailhaud G, Grimaldi P and Négrel R. (1992). Cellular and molecular aspects of adipose tissue development. Annual Review of Nutrition. 12:207-233.
[https://doi.org/10.1146/annurev.nu.12.070192.001231]

-
Ali AT, Hochfeld WE, Myburgh R and Pepper MS. (2013). Adipocyte and adipogenesis. European Journal of Cell Biology. 92:229-236.
[https://doi.org/10.1016/j.ejcb.2013.06.001]

-
Babizhayev MA, Seguin MC, Gueyne J, Evstigneeva RP, Ageyeva EA and Zheltukhina GA. (1994). L-carnosine(β-alanyl-L-histidine) and carcinine(β-alanylhistamine) act as natural antioxidants with hydroxyl radical-scavening and lipid-peroxidase activities. Biochemical Journal. 304:509-516.
[https://doi.org/10.1042/bj3040509]

- Bang IS, Yu CY and Lim JD. (2010). Effect of temperature and UV irradiation on stability of anthocyanin-polyphenol compigmentation complex in mulberry fruits. Korean Journal of Medicinal Crop Science. 18:191-200.
-
Bartelt A and Heeren J. (2014). Adipose tissue browning and metabolic health. Nature Reviews Endocrinology. 10:24-36.
[https://doi.org/10.1038/nrendo.2013.204]

-
Boney CM, Moats-Staats BM, Stiles AD and D’Ercole AJ. (1994). Expression of insulin-like growth factor-I(IGF-1) and IGF-binding proteins during adipogenesis. Endocrinology. 135:1863-1868.
[https://doi.org/10.1210/endo.135.5.7525256]

-
Czank C, Cassidy A, Zhang Q, Morrison DJ, Preston T, Kroon PA, Botting NP and Kay CD. (2013). Human metabolism and elimination of the anthocyanin, cyanidin-3-glucoside: A 13C-tracer study. American Journal of Clinical Nutrition. 97:995-1003.
[https://doi.org/10.3945/ajcn.112.049247]

-
Di Mauro A, Arena E, Fallico B, Passerini A and Maccarone E. (2002). Recovery of anthocyanins from pulp wash of pigmented oranges by concentration on resins. Journal of Agriculture and Food Chemistry. 50:5968-5974.
[https://doi.org/10.1021/jf025645s]

-
Di Mauro A, Fallico B, Passerini A and Maccarone E. (2000). Waste water from citrus processing as a source of hesperidin by concentration on styrene-divinylbenzene resin. Journal of Agricultural and Food Chemistry. 48:2291-2295.
[https://doi.org/10.1021/jf990992w]

-
Di Mauro A, Fallico B, Passerini A, Rapisarda P and Maccarone E. (1999). Recovery of hesperidin from orange peel by concentration of extracts on styrene-divinylbenzene resin. Journal of Agricultural and Food Chemistry. 47:4391-4397.
[https://doi.org/10.1021/jf990038z]

-
Fang J. (2014). Bioavailability of anthocyanins. Drug Metabolism Reviews. 46:508-520.
[https://doi.org/10.3109/03602532.2014.978080]

-
Fernandes I, Faria A, Calhau C, de Freitas V and Mateus N. (2014). Bioavailability of anthocyanins and derivatives. Journal of Functional Foods. 7:54-66.
[https://doi.org/10.1016/j.jff.2013.05.010]

-
Frayn KN, Karpe F, Fielding BA, Macdonald IA and Coppack SW. (2003). Integrative physiology of human adipose tissue. International Journal of Obesity. 27:875-888.
[https://doi.org/10.1038/sj.ijo.0802326]

-
Fu B, Liu J, Li H, Li L, Lee FSC and Wang X. (2005a). The application of macroporous resins in the separation of licorice flavonoids and glycyrrhizic acid. Journal of Chromatography A. 1089:18-24.
[https://doi.org/10.1016/j.chroma.2005.06.051]

-
Fu Y, Luo N, Klein RL and Garvey WT. (2005b). Adiponectin promotes adipocyte differentiation, insulin sensitivity, and lipid accumulation. Journal of Lipid Research. 46:1369-1379.
[https://doi.org/10.1194/jlr.M400373-JLR200]

-
Han MH, Kim HJ, Jeong JW, Park C, Kim BW and Choi YH. (2018). Inhibition of adipocyte differentiation by anthocyanins isolated from the fruit of Vitis coignetiae Pulliat is associated with the activation of AMPK signaling pathway. Toxicological Research. 34:13-21.
[https://doi.org/10.5487/TR.2018.34.1.013]

-
Hollman PCH, Bijsman MNCP, van Gameren Y, Cnossen EPJ, de Vries JHM and Katan MB. (1999). The sugar moiety is a major determinant of the absorption of dietary flavonoid glycosides in man. Free Radical Research. 31:569-573.
[https://doi.org/10.1080/10715769900301141]

-
Hwang JY, Wu Y, Hwang D, Bae SJ and Kim TW. (2014). Anti-obesity effect of Polygala tenuifolia. Korean Journal of Food Preservation. 21:97-106.
[https://doi.org/10.11002/kjfp.2014.21.1.97]

-
Ichiyanagi T, Rahman MM, Kashiwada Y, Ikeshiro Y, Shida Y, Hatano Y, Matusumoto H, Hirayama M, Tsuda T and Konishi T. (2004). Absorption and metabolism of delphinidin 3-O-β-D-glucopyranoside in rats. Free Radical Biology and Medicine. 36:930-937.
[https://doi.org/10.1016/j.freeradbiomed.2004.01.005]

-
Jayarathne S, Koboziev I, Park OH, Oldewage-Theron W, Shen CL and Moustaid-Moussa N. (2017). Anti-inflammatory and anti-obesity properties of food bioactive components: Effects on adipose tissue. Preventive Nutrition and Food Science. 22:251-262.
[https://doi.org/10.3746/pnf.2017.22.4.251]

-
Kapasakalidis PG, Rastall RA and Gordon MH. (2006). Extraction of polyphenols from processed black currant(Ribes nigrum L.) residues. Journal of Agricultural and Food Chemistry. 54:4016-4021.
[https://doi.org/10.1021/jf052999l]

-
Khalilpourfarshbafi M, Gholami K, Murugan DD, Sattar MZA and Abdullah NA. (2019). Differential effects of dietary flavonoids on adipogenesis. European Journal of Nutrition. 58:5-25.
[https://doi.org/10.1007/s00394-018-1663-8]

- Kim HB and Ryu KS. (2000). Sensory characteristics of mulberry fruit jam and wine. Korean Journal of Sericultural Science. 42:73-77.
- Kim HB, Kim SY, Ryu KS, Lee WC and Moon JY. (2001). Effect of methanol extract from mulberry fruit on the lipid metabolism and liver function in cholesterol-induced hyperlipidemia rate. Korean Journal of Sericultural Science. 43:104-108.
-
Kim JE and Chen J. (2004). Regulation of peroxisome proliferator-activated receptor-γ activity by mammalian target of rapamycin and amino acids in adipogenesis. Diavetes. 53:2748-2756.
[https://doi.org/10.2337/diabetes.53.11.2748]

-
Kim KH. (1997). Regulation of mammalian acetyl-coenzyme a carboxylase. Annual Review of Nutrition. 17:77-99.
[https://doi.org/10.1146/annurev.nutr.17.1.77]

-
Kowalska K, Dembczyński R, Gołąbek A, Olkowicz M and Olejnik A. (2021). ROS modulating effects of lingonberry (Vaccinium vitis-idaea L.) polyphenols on obese adipocyte hypertrophy and vascular endothelial dysfunction. Nutrients. 13:885. https://www.mdpi.com/2072-6643/13/3/885, (cited by 2020 June 12).
[https://doi.org/10.3390/nu13030885]

-
Lee BG, Lee MS, Lefevre M and Kim HR. (2014). Anthocyanins inhibit lipogenesis during adipocyte differentiation of 3T3-L1 preadipocytes. Plant Foods for Human Nutrition. 69:137-141.
[https://doi.org/10.1007/s11130-014-0407-z]

-
Lee J, Durst RW and Wrolstad RE. (2005). Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method: Collaborative study. Journal of AOAC International. 88:1269-1278.
[https://doi.org/10.1093/jaoac/88.5.1269]

-
Lefterova MI and Lazar MA. (2009). New developments in adipogenesis. Trends in Endocrinology and Metabolism. 20:107-114.
[https://doi.org/10.1016/j.tem.2008.11.005]

-
Lefterova MI, Zhang Y, Steger DJ, Schupp M, Schug J, Cristancho A, Feng D, Zhuo D, Stoeckert Jr. CJ, Liu XS and Lazar MA. (2008). PPARγ and C/EBP factors orchestrate adipocyte biology via adjacent binding on a genome-wide scale. Genes and Development. 22:2941-2952.
[https://doi.org/10.1101/gad.1709008]

-
Lehrke M and Lazar MA. (2005). The many faces of PPARγ. Cell. 123:993-999.
[https://doi.org/10.1016/j.cell.2005.11.026]

-
Liu X, Xiao G, Chen W, Xu Y and Wu J. (2004). Quantification and purification of mulberry anthocyanins with macroporous resins. Journal of Biomedicine and Biotechnology. 5:326-331.
[https://doi.org/10.1155/S1110724304403052]

-
Liu Y, Peterson DA, Kimura H and Schubert D. (1997). Mechanism of cellular 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) reduction. Journal of Neurochemistry. 69:581-593.
[https://doi.org/10.1046/j.1471-4159.1997.69020581.x]

- Majors RE. (2008). The role of polymers in solid-phase extraction and sample preparation. LC GC North America. 26:1074-1090.
-
Matsukawa T, Villareal MO, Motojima H and Isoda H. (2017). Increasing cAMP levels of preadipocytes by cyanidin-3-glucoside treatment induces the formation of beige phenotypes in 3T3-L1 adipocytes. Journal of Nutritional Biochemistry. 40:77-85.
[https://doi.org/10.1016/j.jnutbio.2016.09.018]

-
Matuschek MC, Hendriks WH, McGhie TK and Reynolds GW. (2006). The jejunum is the main site of absorption for anthocyanins in mice. The Journal of Nutritional Biochemistry. 17:31-36.
[https://doi.org/10.1016/j.jnutbio.2005.04.005]

- Park SW, Jung YS and Ko KC. (1997). Quantitative analysis of anthocyanins among mulberry cultivars and their pharmacological screening. Journal of the Korean Society for Horticultural Science. 38:722-724.
-
Pavlović DM, Babić S, Dolar D, Ašperger D, Košutić K, Horvat AJM and Kaštelan-Macan M. (2010). Development and optimization of the SPE procedure for determination of pharmaceuticals in water samples by HPLC-diode array detection. Journal of Separation Science. 33:258-267.
[https://doi.org/10.1002/jssc.200900571]

-
Pratt DE. (1992). Natural antioxidants from plant materials. In Huang MT. et al. (eds.). Phenolic compounds in food their effects on health(Ⅱ). ACS Symposium Series 507, American Chemical Society. Washington DC, USA. p.54-71.
[https://doi.org/10.1021/bk-1992-0507.ch005]

-
Scharrer A and Ober M. (1981). Anthocyanosides in the treatment of retinopathies. Klinische Monatsblatter fur Augenheilkunde. 178:386-389.
[https://doi.org/10.1055/s-2008-1057228]

-
Schmid B, Rippmann JF, Tadayyon M and Hamilton BS. (2005). Inhibition of fatty acid synthase prevents preadipocyte differentiation. Biochemical and Biophysical Research Communications. 328:1073-1082.
[https://doi.org/10.1016/j.bbrc.2005.01.067]

-
Schwarz M, Hillebrand S, Habben S, Degenhardt A and Winterhalter P. (2003). Application of high-speed countercurrent chromatography to the large-scale isolation of anthocyanins. Biochemical Engineering Journal. 14:179-189.
[https://doi.org/10.1016/S1369-703X(02)00219-X]

-
Skurk T, Alberti-Huber C, Herder C and Hauner H. (2007). Relationship between adipocyte size and adipokine expression and secretion. Journal of Clinical Endocrinology and Metabolism. 92:1023-1033.
[https://doi.org/10.1210/jc.2006-1055]

-
Son WR and Choi SW. (2013). Biological activity and analysis of α-glucosidase inhibitor from mulberry(Morus alba L.) wine. Korean Journal of Food Preservation. 20:877-885.
[https://doi.org/10.11002/kjfp.2013.20.6.877]

-
Suh HJ, Noh DO, Kang CS, Kim JM and Lee SW. (2003). Thermal kinetics of color degradation of mulberry fruit extract. Nahrung/Food. 47:132-135.
[https://doi.org/10.1002/food.200390024]

- Takeoka G and Dao L. (2008). Anthocyanins. Methods of analysis for functional foods and nutraceuticals. In Hurst WJ. (eds.). CRC Press/Taylor and Francis Inc. Boca Raton. FL, USA. p.247-270.
-
Tsai PJ, Mclntosh J, Pearce P, Camden B and Jordan BR. (2002). Anthocyanin and antioxidant capacity in roselle(Hibiscus sabdariffa L.) extract. Food Research International. 35:351-356.
[https://doi.org/10.1016/S0963-9969(01)00129-6]

-
Tsuda T, Horio F and Osawa T. (2002). Cyanidin 3-O-β-Dglucoside suppresses nitric oxide production during a zymosan treatment in rats. Journal of Nutritional Science and Vitaminology. 48:305-310.
[https://doi.org/10.3177/jnsv.48.305]

-
Wu X, Pittman HE, Mckay S and Prior RL. (2005). Aglycones and sugar moieties alter anthocyanin absorption and metabolism after berry consumption in weanling pigs. Journal of Nutrition. 135: 2417-2424.
[https://doi.org/10.1093/jn/135.10.2417]

-
Xue H, Tan J, Li Q, Tang J and Cai X. (2020). Optimization ultrasound-assisted deep eutectic solvent extraction of anthocyanins from raspberry using response surface methodology coupled with genetic algorithm. Foods. 9:1409. https://www.mdpi.com/2304-8158/9/10/1409, (cited by 2021 June 5).
[https://doi.org/10.3390/foods9101409]

- Zhang H, Dong Y, Xu G, Li M, Du L, An LJ and Xiu Z. (2013). Extraction and purification of anthocyanins from the fruit resudues of Vaccunium uliginosum Linn. Journal of Chromatography and Separation Techniques. 4:1000167. https://www.longdom.org/open-access/extraction-and-purification-of-anthocyanins-from-the-fruit-residues-of-vaccinium-uliginosum-linn-2157-7064.1000167.pdf, (cited by 2021 May 12).
-
Zhang Y, Li S, Wu X and Zhao X. (2007). Macroporous resin adsorption for purification of flavonoids in Houttuynia cordatu Thunb. Chinese Journal of Chemical Engineering. 15:872-876.
[https://doi.org/10.1016/S1004-9541(08)60017-8]
