
다이옥신 유도 독성에 대한 홍삼 비사포닌 분획의 방어효과
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study has been carried out to investigate the protective effect of Korean Red Ginseng Non-Saponin Fraction (RGNSF) on clinical chemical parameters in male rats acutely exposed to 2,3,7,8-tetrachlorodibenzo-ρ-dioxin (TCDD).
RGNSF was prepared from red ginseng residues after ethanol extraction of red ginseng. The RGNSF was characterized by the saponin and free sugars of TLC. RGNSF did not contain saponin compounds and consisted of several sugars such as glucose, galactose, and sucrose. To investigate the protective effect of RGNSF on TCDD, forty male rats (Sprague Dawley, 180 ± 20 g) were divided into 4 groups. The normal control group (NC) received the vehicle (i.p.) and saline (p.o.) daily. The only TCDD treated group (TT) received a single dose of TCDD (40 ㎍/㎏, i.p.) and saline. The RGNSF receiving groups were administered p.o. at a daily dose of 100 ㎎/㎏ (RGNSF100) and 200 ㎎/㎏ (RGNSF200) for 3 weeks beginning a week before TCDD exposure. Body-weight gain of TT and RGNSF100 were inhibited after TCDD exposure. The body-weight of RGNSF200 was increased throughout the experimental period, although the increasing rate was slower than that of NC. A decrease in testis weights for the male rats due to TCDD exposure was significantly observed in the RGNSF200 group. Body-weight gain inhibition and the recovery of testis weight by RGNSF administration were dose dependent. Increases in WBC, RBC, hemoglobin, and hematocrit by TCDD intoxication were attenuated by RGNSF administration but were not significant. Increasing AST toxicity by TCDD was significantly inhibited by RGNSF administration with a dose-dependent manner.
These results suggest that RGNSF might be a useful protective agent against TCDD, an endocrine disruptor.
Keywords:
Korean Red Ginseng, Red Ginseng Non Saponin Fraction, 2,3,7,8-Tetrachlorodibenzo-ρ-dioxin서 언
Dioxin, polychlorinated biphenyls, dichlrodiphenyl trichloroethane (DDT), tributyltin, bisphenol A 등은 동·식물의 내분비계를 교란시킨다고 하여 내분비 교란성 화합물, 일명 환경호르몬으로 널리 알려져 있다 (Kang et al., 2006). 이중 2,3,7,8-tetrachlorodibenzo-ρ-dioxin (TCDD)은 polychlorinated aromatic hydrocarbon group에 속하는 다이옥신 계열의 유기화합물로 쓰레기 소각장, 자동차 매연, 펄프 제지공장 등에서 배출되고 있다. 이들은 매우 높은 지질친화성을 가지므로 생체에 쉽게 흡수되며 생분해가 거의 일어나지 않아 식품순환계 (food chain)를 통하여 지속적으로 순환되는 것이 특징이다 (Kang et al., 2006; Kwak et al., 2006a; Choi et al., 2008).
TCDD는 다이옥신 중 가장 맹독성 유기화합물로 생식독성, 간독성, 당뇨, 고지혈증, 체중감소, 성장억제, 암발생 등 매우 다양한 독성을 유발하는 것으로 보고되고 있다 (Matsumura et al., 1984; Jung et al., 1994; Manz et al., 1991; Bertazzi et al., 1998; Mocarelli et al., 2000; Choi et al., 2008).
고려인삼 (Panax ginseng C. A. Meyer)은 한국, 중국 및 일본을 포함한 극동아시아에서 광범위하게 사용되는 한국을 대표하는 약용작물이다. 한국식품의약품안전처에서 인삼과 면역증진, 피로회복, 뼈 건강개선 생리활성 기능을 인정하였고, 홍삼은 면역력 증진, 피로회복, 기억력개선, 혈행 개선, 항산화 및 여성갱년기 증상 개선의 생리활성 기능을 인정하고 있다 (MFDS, 2020a).
중국 약전에 홍삼은 일일 섭취량 3 g - 9 g의 기준으로 대보원기 (大補元氣), 복맥고탈 (復脈固脫), 익기섭혈 (益氣攝血)의 효능을 인정하고 있다. 유럽의약청 (European Medicine Agency)에서는 홍삼 일일 복용량 1,800 ㎎ 기준으로 피로회복, 무기력증개선의 기능을 인정하고 있다. 인삼의 대표적 효능으로 예전부터 7 가지 효능 (七效說)이 알려져 왔는데 이는 보기구탈 (補氣救脫), 익혈복맥 (益血復脈), 양심안신 (養心安神), 생진지갈 (生津止渴), 보폐정천 (補弊定喘), 건비지사 (建碑止瀉), 탁독합창 (托毒合瘡) 이다. 이러한 효능 중 탁독합창에서 암시한 바와 같이 인삼은 독성물질에 대한 해독작용이 탁월함을 알 수 있다.
비사포닌 성분의 연구는 적으나 산성 다당체에 대해서는 최근에 연구가 이루어져 면역증진, 항종양, 항고지혈 등의 생리활성이 있다고 보고되었다 (Byeon et al., 2012; Yayeh et al., 2012). 그러나 이외의 비사포닌 성분에 대해서는 연구가 전무한 실정이다.
최근에는 공업화, 도시화, 산업환경의 고도화에 따라 다양한 환경오염 물질의 발생이 증가하고 있으며 이들에 대한 독성방어 연구도 일부 이루어지고 있다. 최근에 생약재 (길경사포닌)의 환경호르몬 방어효과 연구가 진행되었으며 (Kwak et al., 2020), 홍삼의 경우도 다수의 환경호르몬 방어효과연구가 진행되었다. 이러한 연구에는 홍삼농축액 및 사포닌이 TCDD 투여로 독성이 유발된 기니픽의 고환 및 각종 장기손상을 방어한다는 연구가 있다 (Hwang and Lee, 2009). 또한 흰쥐를 대상으로 물로 추출한 홍삼에서 분리한 사포닌의 TCDD 독성예방효과에 대해서도 규명되었다 (Choi et al., 2008). 이렇듯 TCDD 독성에 관한 홍삼의 해독작용 연구는 홍삼추출물 또는 사포닌을 시료로 연구된 것으로 홍삼의 비사포닌 성분에 대한 연구는 전무한 실정이다.
따라서 홍삼 사포닌 이외 비사포닌 성분에 대한 신규 기능성 규명의 일환으로 TCDD 독성이 유도된 흰쥐에서 홍삼 비사포닌 분획의 방어효과를 연구하고자 하였다.
재료 및 방법
1. 실험동물 및 사육
실험동물은 샘타코 BIO KOREA (Osan, Korea)에서 구입한 흰쥐 (Sprague Dawley rat, male, 4 주령 – 5 주령, 180 ± 20 g)를 적응을 위해 동물사육실에서 1 주간 예비 사육한 다음 1 군에 10 마리씩 나누어 실험에 사용하였다.
실험동물의 사육은 온도 23 ± 1℃, 습도 40% - 60%, 명암주기는 12 시간의 조건으로 하였다. 사료는 일반 흰쥐용 고형사료 (Purina, Seongnam, Korea)를 사용하였고 식수는 제한 없이 공급하였다.
2. 홍삼 비사포닌 분획의 제조방법
홍삼 (6년근) 시료는 양삼 30 지를 정관장에서 구입하였다. 홍삼시료는 환류냉각관이 부착된 water bath (75℃)에서 5 배 - 8 배 (v/w)의 70% 에탄올로 3 시간 동안 3 회 반복 추출하였다. 추출액은 Whatman No.41 (GE Healthcare, Chicago, IL, USA)로 여과하여 70℃ 이하에서 감압농축 (R-100, BÜCHI, Flawil, Switzerland) 후 Kim 등 (1998)에서 제시한 인삼사포닌 분리방법인 Diaion HP 수지흡착법을 적용하여 홍삼 비사포닌 성분을 분리하였다. 즉, 감압농축한 홍삼농축물을 소량의 물로 용해한 후 Diaion HP-20 수지 (Mitsubishi Chemical Co., Tokyo, Japan)가 흡착된 칼럼에 분주하고 연속적으로 4 배 - 5 배 (v/v)의 증류수 및 25% 에탄올을 가하여 홍삼 에탄올 추출물의 비사포닌 분획을 분리하였다. 에탄올 추출 후 남은 잔사를 5 배 – 8 배 (v/w)의 정제수로 3 시간씩 3 회 반복 추출한 후 사포닌과 동일한 방법으로 여과, 농축 (70℃ 이하) 분획하여 정제수로 추출한 비사포닌 분획을 수득하였다. 에탄올 추출물과 정제수 추출물의 비사포닌 분획을 혼합 후 동결건조 (FDT-12020, Operon, Gimpo, Korea)하여 홍삼 비사포닌 분획 (RGNSF) 시료를 제조하였다.
3. 홍삼 비사포닌 분획 (RGNSF) 특성분석
홍삼 비사포닌 분획 (RGNSF)의 사포닌 유무를 확인하기 위하여 인삼 사포닌 thin layer chromatography (TLC) 분석방법에 따라 인삼 사포닌을 정성 분석하였다 (MFDS, 2020b).
즉, RGNSF을 소량의 물에 용해한 후 TLC plate (Silica gel 60 F254, Merck, Darmstadt, Germany)에 상기 비사포닌 용액과 진세노사이드 혼합 표준액을 2.5 ㎝ 간격으로 3 ㎕ 씩 점적한 후, chloroform : methanol : water (65 : 35 : 10)을 전개용매로 전개한 후 30% H2SO4 용액을 분무하고 110℃에서 5 분간 발색하였다. 진세노사이드 혼합 표준액은 ginsenoside-Rg1, -Rb2, -Rc, -Rd, -Re, -Rf, -Rg1 (Chromadex Co., Los Angeles, CF, USA) 의 혼합물을 사용하였다.
홍삼 비사포닌 분획의 당류 특성은 Chaplin와 Kennedy (1994)의 당류 TLC 분석방법에 준하여 실시하였다. TLC를 수행하기 위하여 sucrose, xylose, rhamnose, glucose, galactose, fructose, maltose (Merck, Darmstadt, Germany) 각각 2 ㎎을 증류수 1 ㎖로 정용하여 표준용액으로 하고, RGNSF 4 ㎎을 증류수로 1 ㎖이 되게 정용한 후 분석시료로 하였다. TLC plate (Silica gel 60 F254, Merck, Darmstadt, Germany)에 상기 제조된 표준용액과 분석시료를 2 ㎝ 간격으로 10 ㎕ 씩 점적한 후, butanol : ethanol : water (5 : 3 : 2)의 용액으로 전개 후 50% H2SO4를 분무하고, 110℃에서 5 분간 발색하였다.
4. TCDD 용액 제조
TCDD는 AccuStandard Inc. (New Haven, CT, USA)으로부터 순도 > 99.1%의 것을 구입한 후 Kim 등 (2000)의 방법에 준하여 소량의 dimethyl sulfoxide (DMSO), acetone 및 corn oil (Sigma-Aldrich Co., St. Louis, MO, USA)에 희석하여 제조하였다.
5. TCDD 및 홍삼 비사포닌 분획 투여
TCDD와 홍삼 비사포닌 분획의 투여 시기는 Fig. 1과 같다. 즉, 40 마리의 흰쥐를 각 10 마리씩 4 개 군으로 분류하고 정상대조군 (NC), TCDD 단독 투여군 (TT), TCDD와 홍삼 비사포닌 분획 투여군 (RGNSF100, RGNSF200)으로 구분하였다.
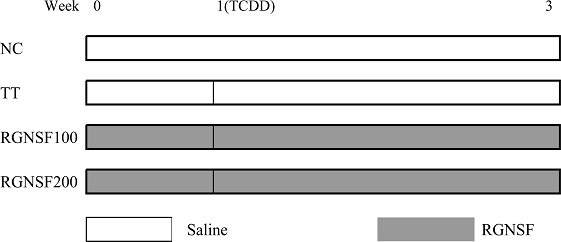
Treatment of 2,3,7,8-tetrachlorodibenzo-ρ-dioxin (TCDD) and Korean red ginseng non-saponin fraction (RGNSF). NC; normal control group received vehicle (corn oil and small amount of acetone containing trace amount of dimethylsulfoxide) and saline. TT; TCDD-treated group received TCDD and saline. RGNSF100; red ginseng non saponin fraction 100 group received TCDD and RGNSF 100 ㎎/㎏. RGNSF200; red ginseng non saponin fraction 200 group received TCDD and RGNSF 200 ㎎/㎏. Each group consists of 10 male rats. TCDD was injected i.p. at a single dose of 40 ㎍/㎏, b.w. after 1 week of RGNSF treatment. RGNSF groups were administered p.o. at a daily dose of 100 or 200 ㎎/㎏ for total 3 weeks. TCDD; 2,3,7,8-tetrachlorodibenzo-ρ-dioxin, RGNSF; red ginseng non saponin fraction.
정상대조군 (NC)에 대해서는 TCDD 운반체 [미량의 DMSO (50 ㎕)와 소량의 acetone (450 ㎕)을 함유한 corn oil (4.5 ㎖)]을 투여하였고, TCDD 단독투여군 (TT)에 대해서는 TCDD (40 ㎍/㎏, single dose, i.p.)을 투여하였다. 한편 홍삼 비사포닌 분획 100 ㎎ 투여군 (RGNSF100) 및 200 ㎎ 투여군 (RGNSF200)은 TCDD 투여 7 일 전부터 3 주간 경구로 투여하였으며 NC 및 TT군에 대해서는 생리식염수를 투여하였다.
모든 동물실험은 한국인삼공사 R&D본부 실험동물윤리위원회의 승인 (KT&G-14-005)을 받았으며 실험동물윤리를 준수하여 수행하였다.
6. 체중 및 장기 무게
실험군의 체중은 3 주 동안 일정한 시간 (오전 10시)에 총 5 회 (0 일, 7 일, 14 일, 17 일, 19 일, 21 일) 측정하였다. 장기의 무게는 검체를 도살한 후 각각의 장기를 분리하여 정제수로 혈액을 제거하고 페이퍼타월로 정제수를 제거하고 무게를 측정하였다.
7. 혈청의 생화학지수 측정
혈액학적 검사를 위해서는 혈액자동분석기 (Sysmex NE-8000, TOA medical Electronics Co., Ltd., Kobe, Japan), 임상화학적 검사를 위해서는 임상화학자동분석기 (Autoanalyzer Hitachii-7150, Hitachi Ltd., Tokyo, Japan)를 사용하여 실시하였다.
8. 통계처리
모든 실험결과는 means ± S.D.로 표기하였으며 정상대조군 (NC)과 TCDD 단독투여군 (TT) 및 홍삼 비사포닌 분획 투여군 (NGSNF100, NGSNF200)과의 비교는 Graphpad Prism version 7.00 (GraphPad Software Inc., San Diego, CA, USA)를 이용하여 One-Way ANOVA 방법으로 Dunnett’s post test를 사용하여 통계분석하였다. 정상대조군 혹은 TCDD 단독투여군 대비 홍삼 비사포닌 분획 투여군 간 유의차가 p < 0.05 혹은 p < 0.01 이하의 경우 통계적으로 유의한 것으로 판정하였다.
결과 및 고찰
1. 홍삼 비사포닌 분획의 특성
홍삼 (Korean red ginseng)의 에탄올 추출물과 정제수 추출물을 시료로 Diaion HP 수지 흡착법 (Kim et al., 1998)에 의해 사포닌 성분을 제거한 홍삼 비사포닌 분획과 진세노사이드 -Rg1, -Rb2, -Rc, -Rd, -Re, -Rf, -Rg1을 표준품으로 수행한 TLC 결과는 Fig. 2로 나타내었다. 홍삼 비사포닌 분획은 전개 성분이 확인 되지 않아 사포닌 성분이 제거된 분획임을 확인 하였다.

Thin layer chromatography (TLC) patterns of ginsenoside standard and Korean red ginseng non-saponin fraction (RGNSF). ST; ginsenoside standards, RGNSF; red ginseng non saponin fraction.
또한 홍삼 비사포닌 분획의 유리당 성분을 확인하기 위해 TLC로 7 종의 유리당 표준품과 비교한 결과 sucrose, glucose, galactose, fructose, malstose 표준품에 해당하는 넓은 스팟 (spot)이 확인되어 여러 유리당이 함유되어 있음을 알 수 있었다 (Fig. 3). 홍삼의 물추출물에 함유된 유리당은 sucrose, glucose, fructose, maltose, rhamnose, xylose로 알려져 있다 (Sung et al., 1985; Ann, 1997). 수삼과 백삼에 존재하지 않는 rhamnose와 xylose는 각각 ginsenoside -Re, -Rg2의 가열처리시 분해되어 생성된다고 추정된다 (Sung et al., 1985). 홍삼 비사포닌 분획 중 rhamnose와 xylose의 불검출은 사포닌 흡착에 따른 전구물질 제거에 따른 것으로 추정할 수 있다.
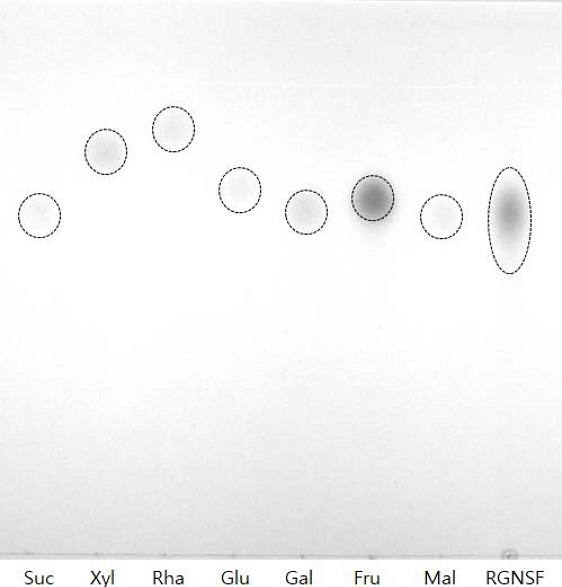
Thin layer chromatography (TLC) patterns of free sugar standards and Korean red ginseng non-saponin fraction (RGNSF). Suc; sucrose, Xyl; xylose, Rha; rhamnose, Glu; glucose, Gal; galactose, Fru; fructose, Mal; maltose, RGNSF; red ginseng non saponin fraction.
홍삼 산성 다당체는 galactuonic acid, glucuronic acid, mannuronic acid 등의 산성당이 다량 함유된 분자량 10 KDa 이상의 다당체 성분을 지칭하며, 일반적으로 홍삼 추출물을 한외여과 하여 얻는다 (Kwak et al., 2010). 그러나 본 연구시료인 홍삼 비사포닌 분획은 한외여과를 실시하지 않아 10 KDa 미만의 성분과 10 KDa 이상의 산성사당체가 복합적으로 함유되어 있을 것으로 추정된다. 향후 홍삼 비사포닌 분획의 분자량별 추가 연구를 통해 TCDD로 발생되는 독성의 예방에 효과적인 물질을 찾는 연구가 지속되어야 할 것으로 생각된다.
2. 체중변화에 미치는 영향
홍삼 비사포닌 분획을 투여한 후 TCDD 투여로 독성이 유도된 흰쥐의 체중변화는 Fig. 4와 같다.
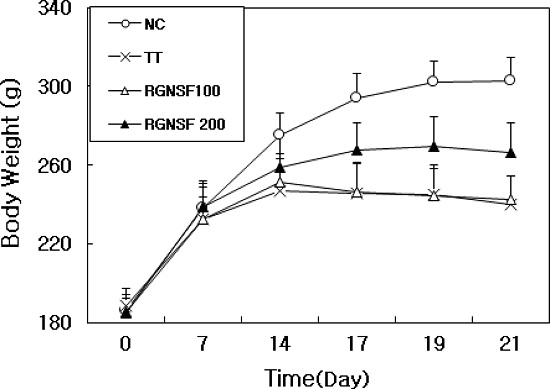
Effect of Korean red ginseng non-saponin fraction (RGNSF) on body weight for 2,3,7,8-tetrachlorodibenzo-ρ-dioxin (TCDD) exposed rats. NC; normal control group received vehicle (corn oil and small amount of acetone containing trace amount of dimethylsulfoxide) and saline. TT; TCDD-treated group received TCDD and saline. RGNSF100; red ginseng non saponin fraction 100 group received TCDD and RGNSF 100 ㎎/㎏. RGNSF200; red ginseng non saponin fraction 200 group received TCDD and RGNSF 200 ㎎/㎏. Each group consists of 10 male rats. TCDD was injected i.p. at a single dose of 40 ㎍/㎏, b.w. after 1 week of RGNSF treatment. RGNSF groups were administered p.o. at a daily dose of 100 or 200 ㎎/㎏ for total 3 weeks.
흰쥐 및 기니픽을 대상으로 수행한 기존 연구에서 TCDD 투여 시 체중이 감소하거나 성장기 동물의 체중이 증가하지 않는 현상이 공통적으로 발생 하였다 (Kwak et al., 2006a, b; Choi et al., 2008; Hwang and Lee, 2009). 본 실험에서도 TCDD 단독투여군 (TT)의 3 주 후 체중이 가장 낮았으며, 최종 체중에서 최초 체중을 뺀 증체량 (gain weight)은 51.6 g으로 정상대조군 (NC)의 116.5 g에 비하여 매우 낮았다. 홍삼 비사포닌 분획 저용량 투여군 (RGNSF100)의 증체량은 57.0 g으로 TCDD투여군 (TT) 보다 약간 높았다. 반면 홍삼 비사포닌 분획 고용량 투여군 (RGNSF200)은 증체량이 81.7 g으로 TCDD투여군 (TT)에 비해서 체중감소 독성에 방어효과를 나타내었다. 따라서 홍삼 비사포닌 분획의 체중회복효과는 용량의존적인 것이 확인 되었다. 이러한 결과는 비사포닌 분획물의 급여는 TCDD의 독성에 의해 발생되는 체중감소를 방어한다는 사실을 시사한다.
TCDD에 의한 감수성은 동물의 종에 따라 차이가 있으나 일반적으로 TCDD에 노출된 동물의 사망 시 체중은 정상동물의 약 50%에 달하며 (Poland and Knutson, 1982), 그 원인으로는 glucose transport 저하 및 지방세포 (adipocyte)에 존재하는 LPL (lipoprotein lipase)의 활성저하 등이 원인으로 알려져 있다 (Brewster and Matsumura, 1989). 또한 LPL 활성저하는 protein kinae C, tyrosine kinase 등과 같은 각종 protein kinase activity 활성증가에 기인하는 것으로 보고되고 있다 (Enan et al., 1992).
한편 홍삼은 lipolysis 를 억제함으로써 당뇨병환자의 체중감소를 방지하고 지방합성을 촉진하며 TCDD에 의한 체중감소를 억제한다고 보고된 바 있다 (Kim et al., 2000). 본 실험에서도 홍삼 비사포닌 분획이 TCDD에 의한 체중감소를 억제하는 것으로 나타났다. TCDD에 의한 체중감소 효과는 기존의 실험에서 홍삼농축액 (Hwang et al., 2001; Choi et al., 2008)과 사포닌분획 (Kim et al, 2000; Kwak et al., 2006a, b)에서 효과를 나타낸다고 보고된 바 있다.
따라서 본 실험의 결과로부터 홍삼 비사포닌 분획도 TCDD 노출에 의해 발생되는 체중감소 억제에 중요한 역할을 하는 활성성분으로 생각되어진다.
2. 장기변화에 미치는 영향
TCDD 투여가 장기무게 변화에 미치는 영향을 조사하였다 (Table 1). 흰쥐의 고환 (testis) 무게는 정상대조군 3.56 ± 0.25 g에서 TCDD 투여군 (TT)에서는 3.14 ± 0.20 g으로 감소하였고 (p < 0.01), 홍삼 비사포닌 분획 투여군 (RGSNF100, 200)에서는 각각 3.23 ± 0.21 g, 3.36 ± 0.20 g으로 증가하여 (p < 0.05) 홍삼 비사포닌 분획은 TCDD 노출에 의한 고환의 무게감소를 유의적으로 억제하는 것으로 나타났다.

Effect of Korean red ginseng non-saponin fraction (RGNSF) on liver, kidney, spleen, lung and testis weight for 2,3,7,8-tetrachlorodibenzo-ρ-dioxin (TCDD) exposed rats.
또한 신장 (kidney) 무게는 정상대조군 2.08 ± 0.18 g에서 TCDD 투여군은 1.89 ± 0.14 g으로 감소하였고, 홍삼 비사포닌 분획 투여군 (RGSNF100, 200)은 각각 1.98 ± 0.22 g, 2.02 ± 0.23 g으로 감소가 억제되는 경향을 보였으나 통계적 유의성은 관찰되지 않았다. 그 밖의 장기인 비장 (spleen), 폐 (lung)의 경우는 TCDD 투여에 의한 독성이나, 독성방어 효과가 관찰되지 않았다.
기존의 TCDD에 대한 홍삼 사포닌의 방어효과 연구결과를 살펴보면 기니픽에 TCDD투여로 독성을 유도한 후 홍삼사포닌을 투여한 결과에서도 감소한 고환무게를 회복시킨다고 알려져 있다 (Kim et al., 2000). 또한 흰쥐를 이용한 실험 결과에서도 TCDD에 의해 감소된 고환 무게를 홍삼사포닌이 회복시킨다고 보고된 바 있다 (Kwak et al., 2006a).
본 실험의 결과에 따라 홍삼 비사포닌 분획은 맹독성 환경호르몬인 TCDD 노출에 의해 고환에 발생되는 생식독성을 방어하는 활성성분 중의 하나로 추정해 볼 수 있다.
3. 혈액 생리학적 변화에 미치는 영향
혈소판 (platelet)수는 정상대조군 1043.8 ± 130.5 (× 103/㎕), TCDD투여군 506.5 ± 100.5 (× 103/㎕)으로 약 51.5% 감소하였다 (p < 0.05). 그러나 홍삼 비사포닌 분획 투여군 (RGNSG100, RGNSG200)에서는 710.7 ± 121.4 (× 103/㎕) (p < 0.05), 820.4 ± 95.6 (× 103/㎕) (p < 0.01)으로 각각 31.9%, 21.4% 감소하여 TCDD 투여로 발생되는 혈소판 수 감소 독성을 억제하였다. 그 외의 항목인 백혈구 (WBC), 적혈구 (RBC), 헤모글로빈 (hemoglobin), 헤마토크리트 (hematocrit) 수에 있어서는 TCDD 투여군과 홍삼 비사포닌 분획 투여군 사이에 유의적인 차이가 관찰되지 않았다. 즉, 홍삼 비사포닌 분획은 TCDD 투여로 발생되는 다양한 혈액학적 독성 중 혈소판 감소증상에 대해서만 특정적인 독성 방어효과가 있는 것으로 사료된다 (Table 2).

Effect of Korean red ginseng non-saponin fraction on white blood cell, red blood cell, hemoglobin, hematocrit and platelet for 2,3,7,8-tetrachlorodibenzo-ρ-dioxin exposed rats.
TCDD는 조혈장기에 작용하여 혈소판 장애를 유도한다고 알려져 있다 (Poland and Knutson, 1982). 흰쥐 및 기니픽에 TCDD를 투여한 후 홍삼추출물 및 사포닌의 효과를 살펴본 기존의 연구에서 혈액학적 지수 변화에 대한 유의적인 개선효과가 확인되었다 (Hwang et al., 1999b; Hwang et al., 2001; Kwak et al., 2006a; Lee et al., 2013). TCDD는 체내 이입된 후 생체내 자유라디칼 (free radical)을 생성시켜 조혈기능 또는 조혈에 필요한 인자들의 부족을 발생 시키는데, 사포닌은 TCDD 투여로 발생된 혈소판 수 감소를 회복시키는 것으로 보고 된 바 있다 (Hwang et al., 1999b).
본 실험에서도 흰쥐을 대상으로 홍삼 비사포닌 분획의 효과를 조사한 결과 감소된 혈소판의 수를 회복시켜 TCDD 독성에 대한 방어효과가 있는 것으로 나타났다. 이는 홍삼의 free radical 소거에 의한 항산화 효능에 의한 작용으로 혈소판 수 감소를 억제하는 것으로 추정할 수 있으나 향후 자세한 작용기전에 관한 연구가 필요할 것으로 생각된다.
4. 지질관련 인삼화학 지수에 미치는 영향
TCDD 투여는 혈중 지질 함량의 현저한 증가를 초래한다. Table 3에 나타낸 바와 같이 정상대조군의 중성지방 (triglyceride, TG)은 76.6 ± 18.9 ㎎/㎗이었으며 TCDD 투여군은 99.8 ± 19.5 ㎎/㎗로 정상대조군 대비 30.3% 증가하였다 (p < 0.05). 반면 홍삼 비사포닌 분획 투여군 (RGNSF100, RGNSF200)의 중성지방은 79.9 ± 29.2 ㎎/㎗, 78.8 ± 12.8 ㎎/㎗로 각각 4.3%, 2.8% 증가에 그쳐 정상 수준으로 회복되는 것으로 나타났다 (p < 0.05).

Effect of Korean red ginseng non-saponin fraction on total cholesterol, triglyceride, high density lipoprotein cholesterol and low density lipoprotein cholesterol for 2,3,7,8-tetrachlorodibenzo-ρ-dioxin exposed rats.
그러나 총콜레스테롤 (total cholesterol, TC)의 함량에는 변화가 관찰되지 않았으며 고밀도지질당단백 (high density lipoprotein cholresterol, HDL-C) 및 저밀도지질당단백 (low density lipoprotein cholesterol, LDL-C) 함량역시 차이가 관찰되지 않았다. TCDD의 투여는 기니픽 및 흰쥐에 있어 혈중 중성지방 (TG), 총콜레스테롤 (TC)의 증가를 초래한다고 보고되고 있다 (Poland and Knutson, 1982; Kim et al., 1999; Kwak et al., 2006a, b). 이와 같이 TCDD 노출에 의한 독성유도 시 모든 동물에서 공통적으로 나타나는 특징 중의 하나가 고지혈증 (hyperglycemia)이며 실험동물의 혈청에서 중성지방과 및 총콜레스테롤 함량이 증가한다고 보고된 바 있다 (Bombick et al., 1984; Brewster and Matsumura, 1989; Enan et al., 1992).
인삼의 사포닌 성분은 혈중 콜레스테롤 감소와 고콜레스테롤혈증에 의해 유도되는 혈관의 병변을 예방하는 효과가 있다고 알려져 있다 (Yoon and Joo, 1993). 인삼사포닌의 작용기전은 간장 내 콜레스테롤 대사항진과 이들 콜레스테롤 운반물질 수용체 (LDL-cholesterol receptor)의 활성화 작용 및 혈중 지단백질 가수분해효소의 활성증가 작용이 관련 있는 것으로 알려져 있다 (Bombick et al., 1984). 그러나 홍삼 비사포닌 분획은 사포닌과 달리 콜레스테롤에서는 효과가 없었고, 중성지방 (TG) 감소의 효과가 관찰되었다. 홍삼 비사포닌 분획의 경우 자세한 기전은 연구되지 않았으므로 추가적인 연구가 필요할 것으로 생각된다.
5. 당 대사에 미치는 영향
TCDD 투여에 의해 혈당 (glucose)은 정상대조군 대비 유의하게 증가하였다. Table 4에 나타낸 바와 같이 정상군은 96.6 ± 9.9 ㎎/㎗ 이었으나 TCDD투여군 132.7 ± 11.3 ㎎/㎗로 증가하는 것이 확인되었다 (p < 0.05). 그러나 홍삼 비사포닌 분획 투여군의 혈당이 용량 의존적으로 감소하는 경향을 보인 각각 110.5 ± 22.8 ㎎/㎗, 100.1 ± 8.7 ㎎/㎗ 이었다. 특히, 홍삼 비사포닌 분획 200 ㎎/㎏을 투여한 RGNSF200의 혈당은 TCDD를 단독 투여한 TT에 비하여 혈당 감소의 통계적 유의성이 확인 되었다 (p < 0.05).

Effect of Korean red ginseng non-saponin fraction on glucose and amylase for 2,3,7,8-tetrachlorodibenzo-ρ-dioxin exposed rats.
혈청 amylase 경우 정상군은 4003.3 ± 521.3 IU/ℓ이었으나 TCDD 투여군에서는 2668.1 ± 648.5 IU/ℓ로 급격히 감소하였고, 홍삼 비사포닌 분획 투여군 (RGNSF100, RGNSF200)에서는 3577.5 ± 636.5 IU/ℓ, 3881.1 ± 628.6 IU/ℓ로 활성감소를 억제하는 경향을 나타내었다. 혈당과 마찬가지로 홍삼 비사포닌 분획 200 ㎎/㎏을 투여한 RGNSF200의 amylase는 TCDD를 단독 투여한 TT에 비하여 통계적으로 유의하게 증가하였다 (p < 0.05).
흰쥐를 대상으로 한 유사한 연구 에서 홍삼 사포닌을 사용한 경우 혈당은 정상군대비 유의하게 증가하였으나 홍삼 사포닌 20 ㎎, 40 ㎎ 투여군에서는 혈당증가를 억제하였다 (Kwak et al., 2006a). 1990년대 다이옥신이 내분비 교란물질 (환경호르몬)로 생식기능 장애, 체중감소, 간독성, 발암성유발, 면역기능 저하, 고지혈증, 고혈당 등을 유도 한다고 알려져 있으며 홍삼이외 녹용 등 다양한 생약을 활용하여 방어효과를 연구하고 있다 (Hwang et al., 1999a).
인삼사포닌은 고혈당을 저하시키는 효능 및 췌장 랑겔한스섬의 당뇨병성 병변을 감소시키는 효과가 있으며 (Woo et al., 1982), ginsenoside-Rb2는 당뇨유발 물질인 streptozotocin 처리에 의해 유도된 고혈당의 저하, 당뇨증상의 개선, 단백질 합성촉진 등의 개선 효과를 나타낸다고 보고되었다 (Yokozawa et al., 1985). 기존의 사포닌 연구결과와 홍삼 비사포닌 분획의 연구결과를 종합해 보면 홍삼의 사포닌 및 비사포닌 성분 모두 혈당에 관여하는 췌장기능을 개선시키는 것으로 생각되나 향후 자세한 작용기전에 관한 연구가 필요할 것으로 생각된다.
6. 간기능 및 신장 대사에 미치는 영향
TCDD 투여에 의해 aspartate aminotransferase (AST) 활성은 증가하고 alanine aminotransferase (ALT) 활성은 감소하는 경향을 나타내었다 (Table 5). 즉, AST 활성은 정상대조군 121.9 ± 14.8 IU/ℓ에서 TCDD 투여군에서는 248.6 ± 99.1 IU/ℓ로 103.9% 증가하였으나, 홍삼 비사포닌 분획 투여군 (RGSNF100, RGSNF200)에서는 223.5 ± 78.5 IU/ℓ, 166.0 ± 63.3 IU/ℓ (p < 0.05)으로 각각 83.3%, 36.2% 증가에 그쳐 홍삼 비사포닌 분획은 TCDD의 간독성으로 발생된 AST 활성 증가를 억제하는 것으로 나타났다. 반면 간기능 효소인 ALT의 경우에는 정상대조군 55.1 ± 4.8 IU/ℓ에서 TCDD 투여군에서는 40.6 ± 9.5 IU/ℓ로 감소되었지만 홍삼 비사포닌 분획 투여군 (RGSNF100, RGSNF200)에서는 41.4 ± 9.8 IU/ℓ, 42.6 ± 11.4 IU/ℓ로 미미한 증가에 그쳤으며 통계적인 유의성도 관찰되지 않았다.

Effect of Korean red ginseng non-saponin fraction on blood urea nitrogen, creatinine, uric acid, aspartate aminotransferase and alanine aminotransferase for 2,3,7,8-tetrachlorodibenzo-ρ-dioxin exposed rats.
흰쥐를 대상으로 TCDD 독성에 관한 홍삼추출물의 방어효과를 관찰한 기존의 연구 결과를 보면 홍삼추출물은 혈청의 AST와 ALT 활성에 모두 효과가 있는 것으로 나타났으나 (Choi et al., 2008), 홍삼 비사포닌 분획을 적용한 본 실험의 경우 AST 활성 개선 효과는 관찰되었고, ALT 활성에는 영향이 없는 것으로 확인되었다. 이러한 홍삼추출물과 홍삼 비사포닌 분획의 간기능 개선 효과 차이는 추후 자세한 기전 연구가 필요할 것으로 생각된다.
TCDD 투여에 의해 요소질소 (blood urea nitrogen, BUN)는 증가하였고, 크레아티닌 (creatinine)의 변화는 없었다. TCDD 투여로 요산은 1.2 ± 0.8 ㎎/㎗로 정상대조군 (NC) 1.9 ± 0.3 ㎎/㎗ 대비 63.2% 수준으로 감소하였으나 RGNSF100은 1.6 ± 0.7 ㎎/㎗, RGNSF200은 1.9 ± 0.6 ㎎/㎗으로 각각 NC 대비 84.2%, 100.0%로 회복되는 경향을 보였다. 한편 TCDD로 유발된 요소질소 및 크레아티닌에 관한 홍삼 비사포닌 분획의 개선효과는 확인되지 않았다. 정상보다 낮은 요산은 일부 간질환, 신장질환, 독성물질 노출 등에 의해 발생될 수 있는 가능성이 존재하며, 만성신부전 실험모델을 이용한 실험에서 고려홍삼의 물추출물 및 사포닌 성분은 신장 기능과 관련된 각종 임상화학적 지수의 악화를 개선한다고 보고되고 있다 (Han, 1978).
본 연구결과에 따라 홍삼 비사포닌 분획은 TCDD 독성에 의한 요산 (uric acid) 감소 개선에 관여하는 것으로 생각되나 요소질소, 크레아티닌 등과 같은 신장 임상 화학적 지수에는 효과가 없었으므로 이에 대한 자세한 연구도 필요할 것으로 생각된다.
References
- Ann YG. (1997). Sugars in Korean ginseng(Panax ginseng C. A Meyer). Korean Journal Food and Nutrition. 10:480-484.
-
Bertazzi PA, Bernucci I, Brambilla G, Consonni D and Pesatori AC. (1998). The seveso studies on early and long-term effects of dioxin exposure: A review. Environmental Health Perspectives. 106:625-633.
[https://doi.org/10.1289/ehp.98106625]

-
Bombick DW, Mastumura F and Madhukar BV. (1984). TCDD(2,3,7,8-tetrachlorodibenzo-p-dioxin) causes reduction in the low density lipoprotein(LDL) receptor activities in the hepatic plasma membrane of the guinea pig and rat. Biochemical and Biophysical Research Communications. 118:548-554.
[https://doi.org/10.1016/0006-291X(84)91337-8]

-
Brewster DW and Matsumura F. (1989). Differential effect of 2,3,7,8-tetrachlorodibenzo-p-dioxin on adipose tissue lipoprotein lipase activity in the guinea pig, rat, hamster, rabbit and mink. Comparative Biochemistry and Physiology. Part C. Comparative Pharmacology. 93:49-53.
[https://doi.org/10.1016/0742-8413(89)90009-1]

-
Byeon SE, Lee JH, Kim JH, Yang WS, Kwak YS, Kim SY, Choung ES, Rhee MH and Cho JY. (2012). Molecular mechanism of macrophage activation by red ginseng acidic polysaccharide from Korean red ginseng. Mediators of Inflammation. 732860. https://www.hindawi.com/journals/mi/2012/732860, (cited by 2012 Aug 20).
[https://doi.org/10.1155/2012/732860]

- Chaplin MF and Kennedy JF. (1994). Carbohydrate analysis a practical approach second edition. Oxford University Press. New York. NY, USA. p.48-50.
-
Choi SJ, Sohn HO, Shin HJ, Hyun HC, Lee DW, Song YB, Lee SH, Kang DH, Lim HS, Lee CW and Moon JY. (2008). Protective effects of Korean Panax ginseng extracts against TCDD-induced toxicities in rat. Journal of Ginseng Research. 32:382-389.
[https://doi.org/10.5142/JGR.2008.32.4.382]

-
Enan E, Liu P and Matsumura F. (1992). 2,3,7,8-tetrachlorodibenzo-p-dioxin causes reduction of glucose transporting activities in the plasma membranes of adipose tissue and pancreas from the guinea pig. Journal of Biological Chemistry. 267:19785-19791.
[https://doi.org/10.1016/S0021-9258(19)88622-2]

- Han DR. (1978). Pharmaco-biological action of ginsenoside Rb1 and Re Pro. 2nd International Ginseng Symposium. Korea Ginseng and Tobacco Research Institute. Seoul, Korea. p.135-140.
- Hwang SY, Jeong HS, Wee JJ, Sung R and Kim SK. (1999a). Histopathological study on the protective effect of Korean red ginseng on TCDD-induced acute toxicity in male guinea pig. Journal of Ginseng Research. 23:222-229.
- Hwang SY, Kim SK, Kim SH, Kwak YS and Jeong YJ. (1999b). Effect of Korean red ginseng on clinical chemical parameters in male guinea pigs exposed acutely to 2,3,7,8-tetrachlorodibenzo-ρ-dioxin. Journal of Food Science and Nutrition. 28:1349-1354.
- Hwang SY, Yang JB, Song TW, Lee KJ, Min JK and Park TK. (2001). Effect of crude ginseng saponin on body weight and hematological change of the guinea pigs exposed to 2,3,7,8-tetrachlorodibenzo-ρ-dioxin. Korean Journal of Clinical Laboratory Science. 33:38-43.
-
Hwang SY and Lee CY. (2009). Protective effects of red ginseng saponins against to 2,3,7,8-tetrachlorodibenzo-ρ-dioxin(TCDD) induced toxicity in guinea pigs. Journal Environment Health Science. 35:259-268.
[https://doi.org/10.5668/JEHS.2009.35.4.259]

-
Jung D, Konietzko J, Reill-Konietzko G, Muttray A, Zimmermann-Hölz HJ, Doss M, Beck H, Edler L and Kopp-Schneider A. (1994). Porphyrin studies in TCDD-exposed workers. Archives of Toxicology. 68:595-598.
[https://doi.org/10.1007/s002040050120]

- Kang DY, Park MI, Na SY and Wee JJ. (2006). Pathologic comparative studies on the protective effects by Panax ginseng and Panax Quinquefolium for treating 2,3,7,8-tetrachlorodibenzo-ρ-dioxin-induced toxicity in male rats. Korean Journal of Pathology. 40:118-127.
- Kim SK, Kwak YS, Kim SW, Hwang SY, Ko YS and Yoo CM. (1998). Improved method for the preparation of crude ginseng saponin. Journal of Ginseng Research. 22:155-160.
-
Kim WJ, Hwang SY, Lee H, Song H and Kim SK. (1999). Panax ginseng protects the testis against 2,3,7,8-tetrachlorodibenzo-p-dioxin induced testicular damage in guinea pigs. British Journal of Urology International. 83:842-849.
[https://doi.org/10.1046/j.1464-410x.1999.00046.x]

- Kim SK, Hwang SY, Wee JJ, Kwak YS, Kyung JS and Nam KY. (2000). Protective effect of crude saponin from Korean red ginseng on dioxin-induced testicular toxicity. The Ginseng Review. 28:70-77.
-
Kwak YS, Kyung JS, Song YB, Wee JJ and Park JD. (2006a). Effect of crude saponin from red-ginseng efflux on blood biochemical parameters in rats acutely exposed to 2,3,7,8-tetrachlorodibenzo-ρ-dioxin(TCDD). Journal of Ginseng Research. 30:8-14.
[https://doi.org/10.5142/JGR.2006.30.1.008]

-
Kwak YS, Kyung JS, Song YB, Wee JJ, Park JD, Kim SK, Hwang MS, Kim SC, Park CK and Do JH. (2006b). Protective effect of red ginseng saponin on decrease of femur weight in female guinea pigs acutely exposed to 2,3,7,8-tetrachlorodibenzo-ρ-dioxin(TCDD). Journal of Ginseng Research. 30:112-116.
[https://doi.org/10.5142/JGR.2006.30.3.112]

-
Kwak YS, Kyung JS, Kim JS, Cho JY and Rhee MH. (2010). Anti-hyperlipidemic effects of red ginseng acidic polysaccharide from korean red ginseng. Biological and Pharmaceutical Bulletin. 33:468-472.
[https://doi.org/10.1248/bpb.33.468]

-
Kwak YS, Moon YJ, Kyung JS, Kim TH and Rhee MH. (2020). Effect of saponin fraction from Platycodon grandiflorum on clinical chemical changes in TCDD(2,3,7,8-tetrachlorodibenzo-p-dioxin)-induced rat toxicity. Biomedical Science Letters. 26:66-74.
[https://doi.org/10.15616/BSL.2020.26.2.66]

- Lee YB, Bae SJ, Lee DK, Park SJ, Park JW, Kim BW and Whang SY. (2013). The effect of mulberry leaf extract on blood biochemical parameters in white rats exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD). Journal of Digital Convergence. 11:299-308.
-
Manz A, Berger J, Dwyer JH, Flesch-Janys D, Nagel S and Waltsgott H. (1991). Cancer mortality among workers in chemical plant contaminated with dioxin. The Lancet. 338:959-964.
[https://doi.org/10.1016/0140-6736(91)91835-I]

-
Matsumura F, Brewster DW, Madhukar BV and Bombick DW. (1984). Alteration of rat hepatic plasma membrane functions by 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD). Archives of Environmental Contamination and Toxicology. 13:509-515.
[https://doi.org/10.1007/BF01056330]

- Ministry of Food and Drug Safety(MFDS). (2020a). Health Functional Food Code 2020. Ministry of Food and Drug Safety. Cheongju, Korea. p.48-50
- Ministry of Food and Drug Safety(MFDS). (2020b). Food code 2020. Ministry of Food and Drug Safety No.8 general test method. Cheongju, Korea. p287-290.
-
Mocarelli P, Gerthoux PM, Ferrari E, Patterson Jr. DG, Kieszak SM, Brambilla P, Vincoli N, Signorini S, Tramacere P, Carreri V, Sampson EJ, Tumer WE and Needham LL. (2000). Paternal concentrations of dioxin and sex ratio of offspring. The Lancet 355:1858-1863.
[https://doi.org/10.1016/S0140-6736(00)02290-X]

-
Poland A and Knutson JC. (1982). 2,3,7,8-tetrachlorodibenzo-p-dioxin and related halogenated aromatic hydrocarbons: Examnination of the mechanism of toxicity. Annual Review of Pharmacology and Toxicology. 22:517-554.
[https://doi.org/10.1146/annurev.pa.22.040182.002505]

- Sung HS, Kim NM, Park MH, Yoon SK and Yang CB. (1985). Effect of extracting conditions on some factors affecting the sugar composition of red ginseng extract. Journal of Ginseng Research. 9:104-111.
- Woo KS, Kim CM and Koo KH. (1982). An experimental study on the effect of ginseng saponin upon diabetes mellitus. Journal of Hanyang Medical College. 2:47-57.
-
Yayeh T, Jung KH, Jeong HY, Park JH, Song YB, Kwak YS, Kang HS, Cho JY, Oh JW, Kim SK and Rhee MH. (2012). Korean red ginseng saponin fraction downregulates proinflammatory mediators in LPS stimulated RAW264.7 cells and protects mice against endotoxic shock. Journal of Ginseng Research. 36:263-269.
[https://doi.org/10.5142/jgr.2012.36.3.263]

-
Yokozawa T, Kobayashi T, Oura H and Kawashima Y. (1985). Studies on the mechanism of the hypoglycemic activity of ginsenoside-Rb2 on streptozotocin-diabetic rats. Chemical and Pharmaceutical Bulletin. 33:869-872.
[https://doi.org/10.1248/cpb.33.869]

- Yoon S and Joo C. (1993). Study on the preventive effect of ginsenosides against hypercholesterolemia and its mechanism. Jounal of Ginseng Reserch. 17:1-12.
