저분자 진세노사이드를 함유한 산삼배양근 증숙 추출물의 Acetylcholinesterase 억제 및 신경세포 보호효과
 ; Ji Hyeong Jeon2, #
; Ji Hyeong Jeon2, # ; Eun Soo Seong3
; Eun Soo Seong3 ; Seon Kang Choi4
; Seon Kang Choi4 ; Jung Dae Lim5
; Jung Dae Lim5 ; Chang Yeon Yu6
; Chang Yeon Yu6 ; Jae Geun Lee7, †
; Jae Geun Lee7, †
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Ginsenosides are known to have anti-cancer, anti-inflammatory, and antioxidant effects. Additionally, they are known to improve cognitive ability and memory, and prevent dementia. In this study, the physiological activity of cultured wild ginseng adventitious root (ginseng root, GS) containing low molecular weight ginsenosides was investigated in vitro.
This experiment was conducted to confirm the acetylcolinesterase (AChE) inhibitory activity, neuroprotectivie effect, and antioxidant effect of GS steam treatment. Through the steaming process, a GS steam treatment containing low molecular weight ginsenosides was prepared and evaluated. The results showed that AChE inhibitory activity, neuroprotective effect, reactive oxygen species (ROS) inhibitory effect, and catalase (CAT) activity effect by H2O2 were concentration-dependent in the group treated with GS steam treatment compared to those in the control group.
In this study, it was demonstrated that the GS steam treatment influenced the AChE inhibitory activity, the neuroprotective effect, and the oxidative stress protective effect of GS.
Keywords:
Panax ginseng C. A. Meyer, Acetylcholinesterase, Alzheimer's Disease, Cell Viability, Cultured Wild Ginseng Adventitious Root, Low Molecular Weight Ginsenosides, Oxidative Stress, Neuroprotective서 언
신경 퇴행성 질환은 신경계에 존재하는 신경세포의 사멸을 통칭하는 질병으로 세계보건기구에 따르면 2019년 총 사회적 비용은 1조 4천억 원 달러로 추산되고 (WHO, 2020), 알츠하이머, 파킨슨병, 루게릭병, 헌팅턴병 등으로 구분된다. 이중 알츠하이머 환자는 60% - 70%의 비율을 차지하며, 2050년에는 1억 3900 만 명으로 기하급수적으로 증가될 것으로 예상되고 있다 (Nichols and Theo, 2020).
알츠하이머의 주요 원인으로는 산화 스트레스에 의한 세포막과 DNA 손상, 과도한 아세틸콜린 에스테라아제 (acetylcholinseterase, AChE) 작용에 의한 신경전달물질 억제, 타우단백질에 의한 신경세포사멸, 베타 아밀로이드 단백질에 의한 노인반 생성으로 보고되고 있다 (Kihara and Shimohama, 2004; Vetrivel and Thinakaran, 2006; Kim, 2018). 이중 산화 스트레스는 신체 기관, 조직 및 세포에서 불안정하게 생성된 활성산소종 (reactive oxygen species, ROS)의 활성과 이를 제거하는 항산화 방어 시스템의 불균형 때문에 유발되며 (Manton et al., 2004), 단백질, 지질, DNA 및 당의 산화는 신경세포 노화로 이어져 알츠하이머 발병에 기인하는 것으로 알려져 있다 (Luchsinger et al., 2003).
AChE는 신경전달물질 아세틸콜린 (acetylcholine, ACh)을 특이적으로 분해하는 효소로 시냅스에서 ACh을 acetate와 choline으로 가수분해하여 신경전달을 정지시키고, 뉴런이 새로운 자극을 받을 수 있게 한다 (Volle and Koelle, 1961). 하지만 AChE의 과다한 활성은 ACh의 활성을 억제하여 알츠하이머를 유발하는 것으로 알려져 있다 (Kása et al., 1997). 현재 알츠하이머 치료제로 AChE 억제제인 갈란타민과 리바스티그민이 사용되고 있으나, 오심, 구토 및 식욕감퇴 등의 소화기계 부작용이 초래되어 (Suh, 2007), 부작용을 대체할 수 있는 천연물 유래 콜린성 효소 저해제의 연구개발이 활발히 이루어지고 있다 (Hahn and Paik, 2015).
Panax ginseng C . A. M e yer는 식품의약품안전처 『식품의 기준 및 규격』에 수삼, 백삼, 홍삼, 흑삼, 야산삼, 별직삼, 산양삼, 태극삼, ginseng, Korean ginseng 및 조직배양삼으로 분류되어 있고 (MFDS, 2021), 일반식품과 건강기능식품의 원료로 활용되고 있다.
P. ginseng의 주요성분 진세노사이드는 트리테르페노이드에 수산기와 단당류가 결합한 배당체 형태이며, 부착된 수산기와 단당류에 따라 분자량의 차이를 나타내고, 약리적인 활성이 다른 것으로 보고되고 있다 (Rao and Gurfinkel, 2000; Seong et al., 2019).
진세노사이드에 관한 연구는 1950년대 - 1970년대에 조사포닌 물질규명 (Farmer and Campbell, 1950; Shibata et al., 1966; Sanada et al., 1974), 1980년대 - 1990년대에는 인삼의 진세노사이드 기능성이 검증되었고 (Yamaguchi et al., 1988; Lim et al., 2005), 2000년에서 현재까지는 홍삼의 특정 기능성 규명을 위해 제조공정에 의한 저분자 진세노사이드 변환, 분리·정제 분야의 연구가 활발히 이루어지고 있다 (Xie et al., 2005; Ahmed et al., 2016; Li et al., 2019; Moon et al., 2019; Tang et al., 2021).
공정에 의해 변환된 저분자 진세노사이드는 Rh1, Rg3, Rk1, Rg5, compound K 등이 있으며, 이러한 저분자 진세노사이드는 인지능력 (Lu et al., 2018), 기억력 개선 ( Fei et al., 2020), 치매 예방 (Zong et al., 2019), 항암 (Wang et al., 2006; Li et al., 2020), 면역증강 (Shin et al., 2018) 등의 약리작용이 보고되고 있다.
P. ginseng 중 조직배양삼 (산삼배양근)은 야산삼 조직세포를 무균조건으로 기내 (in vitro)에서 대량 배양하는 방법으로 생장조건을 조절하여 생산수율과 2차 대사산물 함량을 최대로 높일 수 있는 장점과 스마트 팜의 생명공학 기술이 적용된 그린바이오 분야의 소재로 알려져 있다.
본 연구에서는 산삼배양근의 증숙 처리에 의해 변화하는 고분자와 저분자 진세노사이드 함량과 산화 스트레스, 신경전달물질 억제의 생리활성을 비교하여, 산삼배양근의 기능성 원료로서의 가치를 평가하고자 시험을 수행하였다.
재료 및 방법
1. 실험재료
식물재료 산삼 (Panax ginseng C. A. Meyer) 배양근은 ㈜화진바이오코스메틱 생명공학연구소 (Chuncheon, Korea)에서 제공받은 것을 사용하였다. 산삼배양근 건조물 5 ㎏ 을 70% EtOH 100ℓ에 50℃, 180 분, 5 회 추출한 후, 농축, 동결건조 한 분말을 non-steam 처리군으로 사용하였다. 이후, 산삼배양근 분말 500 g을 증류수 100 ℓ에 희석하여 120℃, 210분 열처리한 후, 동결건조 한 분말을 steam 처리군으로 사용하였다 (Kim et al., 2020).
추출에 사용된 EtOH은 95% 발효주정 (Daehan Ethanol Life Co., Ltd., Hwasung, Korea), 추출기는 COSMOS-660 (Kyungseo Co., Incheon, Korea), 감압농축기는 R-220 pro set (Büchi, Flawil, Switzerland), 동결건조기는 PVTFD 300R (Ilshinbiobase Co., Ltd., Dongducheon, Korea), 증숙기는 HK-LHC180-RS (Hankuk S&I Co., Hwasung, Korea)를 사용하였다.
2. 진세노사이드 분석
진세노사이드의 함량 및 변화량을 확인하기 위해 HPLC 분석을 실시하였다.
분석에는 UltiMate 3000 HPLC system (Thermo Fisher Scientific Inc., San Jose, CA, USA)을 사용하였고, 컬럼은 Capce ll p ak C 18 ( 5㎛, 250 × 4.6㎜, Osaka Soda Co., Ltd., Nishi, Osaka, Japan)을 사용하였다. 이동상은 water (A)와 acetonitrile (B)로 농도 구배에 따른 기울기 조건 (0-5 min: 80 - 80% A, 5 - 20 min: 80 - 77% A, 20 - 25 min: 77 - 70% A, 25 - 30 min: 70 - 60% A, 30 - 35 min: 60 - 50% A, 35 - 60 min: 50 - 15% A, 60 - 65 min: 15 - 15%, 65 - 66 min: 15 - 80% A, 66 - 75 min: 80 - 80% A)을 설정한 후, 컬럼 온도 30℃, 유속 1.0 ㎖/min, 주입량 10 ㎕, 검출파장 203 ㎚로 분석하였다.
표준물질은 sigma-aldrich의 진세노사이드 Rb1, Rc, Rb2, Rb3, Rd, Rg3 (S), Rk1, Rg5를 사용하였고, 농도 범위에서 표준곡선을 작성한 후, 얻은 회귀식에 값을 대입하여 정량값을 산출하였다.
3. Acetylchoinesterase (AChE) 억제효과
AChE 억제율 측정은 acetylchoinesterase assay kit (ab138871, Abcam, Cambridge, England) 제조사에서 제공하는 프로토콜을 변형하여 수행하였다.
농도별로 희석한 시료를 96-well plate에 50 ㎕씩 3 반복으로 분주한 후, AChE reaction mixture 50 ㎕와 AChE 0.2 U/㎖를 혼합하여 반응 (암반응, 30 분) 하였다. 이후, 410 ㎚에서 흡광도를 측정하고, optical density (O.D.) 값을 아래와 같은 식에 대입하여 억제율을 산출하였고, UV/Vis Spectrophotometer는 Micro plate reader UMBS0300-3040 (Molecular Device, San Jose, CA, USA), 양성대조군은 donepezil hydrochloride (Donepezil, Aurobindo Pharma. Ltd., Hyderabad, India)를 사용하였다.
O.D.a: 효소와 기질과 시료 반응 후 흡광도 - 대조군 흡광도
O.D.b: 효소와 기질의 반응 후 흡광도 - 대조군 흡광도
4. 신경세포 보호효과
세포시험에 사용되는 human 유래 신경아종 세포주 SH-SY5Y (KCLB No. 22266)는 한국세포주은행 (KCLB, Seoul, Korea)에서 구입하여 사용하였다.
SH-SY5Y는 10% fetal bovine serum (FBS, Gibco, Grand Island, NE, USA), 2 mM L-glutamine, 100 U/㎖ penicilline (Gibco, Grand Island, NE, USA)과 100 ㎍/㎖ sterptomycin (Gibco, Grand Island, NE, USA)이 포함된 Dulbecco's modified Eagle's medium (DMEM, Gibco, Grand Island, NE, USA) 배양 배지를 사용하여 CO2 배양기 (MCO-230AIC-PK, Panasonic, Kadoma, Osaka, Japan)에서 배양하였다 (37℃, 5% CO2). 세포가 배양접시의 80% 정도 차면 phosphate-buffered saline (PBS, pH 7.4, Gibco, Grand Island, NE, USA)으로 세포를 씻어내고, 0.25% trypsin-2.65mM EDTA (Gibco, Grand Island, NE, USA)를 처리하여 계대배양 하였으며, 배양 배지는 2 일마다 교체하였다.
세포 생존율 측정은 CCK-8 assay (Dojindo Molecular Technologies Inc., Rockville, MD, USA)의 제조사에서 제공하는 프로토콜을 변형하여 수행하였다.
SH-SY5Y 세포 현탁액을 준비하고, 혈구계수기를 이용하여 세포를 계수하였다. 현탁시킨 SH-SY5Y 세포를 96-well plate 5 × 104 cell/well로 분주하여 37℃, 24 시간 동안 CO2 배양하였다. 배양 배지를 제거한 후, 시료를 첨가하여 24 시간 배양하였고, well 당 배양 배지 100 ㎕, CCD-8 용액 10 ㎕을 첨가하여 2 시간 추가배양 하였다. 이후, 450 ㎚에서 흡광도를 측정하고, O.D. 값을 아래와 같은 식에 대입하여 세포 생존율을 수치화하여 세포 독성을 판단하였다.
손상된 신경세포의 보호효과는 Tan과 Kim (2016)의 프로토콜을 변형하여 측정하였다.
현탁시킨 SH-SY5Y 세포를 96-well plate 5 ×104 cell/well로 분주하여 37℃에서 24 시간 동안 CO2 배양하였다. 배양배지를 제거한 후, 5 μM amyloid β-protein fragment 25-35 (Aβ25-35, Sigma-Aldrich Co., St. Louis, MO, USA)와 시료 및 양성대조군 (50 μM ascorbic acid, Sigma-Aldrich Co., St. Louis, MO, USA)을 첨가하여 24 시간 배양하였다. 이후 well당 배양 배지 100 ㎕, CCD-8 용액 10 ㎕을 첨가하여 2 시간 동안 추가배양 하였다. 이후, 450 ㎚에서 흡광도를 측정하여 신경세포 손상에 대한 보호율을 비교하였다.
5. 산화스트레스 억제효과
ROS 억제 활성은 DCFDA cellular ROS detection assay kit (ab113851, Abcam, Cambridge, England)의 제조사에서 제공하는 프로토콜을 변형하여 수행하였다.
현탁시킨 SH-SY5Y 세포를 96-well plate 5 ×104 cell/well로 분주하여 37℃에서, 24 시간 동안 CO2 배양하였다. 배양 배지를 제거한 후, 시료 및 양성 대조군 (50 μM ascorbic acid)을 첨가하여 24 시간 동안 배양하였다. 이후, well에 300μM hydrogen peroxide (H2O2, Samchun Chemicals, Seoul, Korea)를 3 시간 처리 후, 세포를 원심분리하고 PBS로 세척하였다. 25 μM DCFDA solution을 첨가하여 빛을 차단하고 상온에서 45 분간 반응시킨 후, PBS로 세포를 세척하고 1× supplemented buffer로 세포를 부유시켜 dark clear bottom 96-well plate에 seeding 하여 형광도를 측정하였다 (Excitation/Emission = 485/535 ㎚).
Catalase (CAT) 활성은 catalase assay kit (Cayman Chemical, Ann Arbor, MI, USA)의 제조사에서 제공하는 프로토콜을 변형하여 수행하였다.
위의 ROS Assay와 동일한 방법으로 처리한 세포를 원심분리하고 PBS로 세척하였다. 이후, 0.5% triton X-100과 5mM β-mercaptoethanol을 포함하는 ice cold 0.1 M Tris/HCl (pH 7.4)을 이용하여 세포를 용해시킨 후, 450 ㎚에서 흡광도를 측정하였다.
6. 통계처리
데이터를 평균 및 표준편차로 나타내었으며 통계검정은 대조군 (정상군)과 음성대조군은 Student’s t-test 방법, 음성대조군과 처리군 간의 변화는 일원 배치 분산분석 (One-way ANOVA test)을 통하여 유의성을 확인하고 등분산을 검정하였다.
일원배치 분산분석에서 유의성이 인정되고 등분산이 인정되면 DMRT (Duncan's Multiple Range Test), 등분산이 인정되지 않으면 Dunnett’s T3-test를 사용하였으며 5% 수준에서 유의성을 검정하였다 (p < 0.05).
모든 통계학적 분석은 Statistical Package for Social Science 12.0 K program (SPSS, IBM, Armonk, NY, USA)을 이용하였다.
결과 및 고찰
1. 진세노사이드 함량
산삼 (Panax ginseng C. A. Meyer)배양근 non-steam, steam 처리군의 총 진세노사이드 (8 종) 함량을 비교하였다. Non-steam 처리군에서는 총 진세노사이드 120.27 ± 1.60 ㎎/g이 검출되었다. 이중 Rb1 35.03 ± 1.12 ㎎/g, Rc 18.45 ± 1.14 ㎎/g, Rb2 22.94 ± 2.07 ㎎/g, Rb3 4.58 ± 0.16 ㎎/g, Rd 39.27 ± 1.32 ㎎/g의 함량이 정량되었고, Rg3 (S), Rk1, Rg5는 불검출 되었다.
Steam 처리군에서는 총 진세노사이드 94.00 ± 4.42 ㎎/g이 검출되었다. Rb1 7.90 ± 0.59 ㎎/g, Rc 3.31 ± 0.23 ㎎/g, Rb2 4.29 ± 0.30 ㎎/g, Rd 12.96 ± 0.62 ㎎/g, Rg3 (S) 33.54 ± 1.55 ㎎/g, Rk1 16.59 ± 0.84 ㎎/g, Rg5 15.40 ± 0.77 ㎎/g의 함량이 정량되었고, Rb3는 불검출 되었다.
진세노사이드의 함량은 non-steam 대비 steam 처리군에서 Rb1, Rc, Rb2, Rb3, Rd는 감소한 반면, Rg3 (S), Rk1, Rg5의 함량이 증가하는 것을 확인하였다 (Table 1 and Fig. 1).
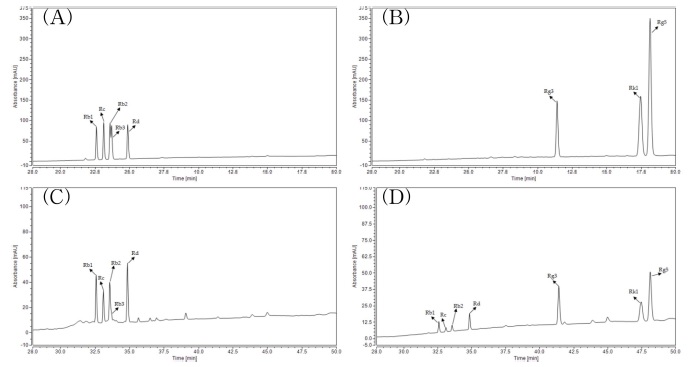
Representative HPLC chromatograms of ginsenosides non-steam treatment and steam treatment.(A): Ginsenoside Rb1, Rc, Rb2, Rb3, Rd reference standard, (B): Ginsenoside Rg3 (S), Rk1, Rg5 reference standard, (C): Non-steam treatment, (D): Steam treatment.
Yang 등 (2006)은 인삼을 140℃, 3 시간 증숙 하였을 때, 진세노사이드 Rg1, Re, Rb2, Rb3 감소한 후, Rf, Rg3 (S)로 변환되었고, 이때에 총 진세노사이드 중 Rg3 (S)의 비율은 23.7%를 차지한다고 보고하였다. Lee 등 (2018)은 산삼을 고온으로 증숙 하였을 때, 고분자 진세노사이드 (Rg1, Rg2, Rb1, Rb2, Rd)의 비율은 감소하였고, 저분자 진세노사이드 (Rg6, Rh4, Rg3, Rh2, Rh3) 비율이 최대 17.52% 이상 증가되었으며, 이는 고온 작용으로 고분자 진세노사이드에 결합된 단당류들의 결합이 분해되는 것으로 보고하였다. 본 시험에서는 Rb1, Rb2, Rb3, Rc, Rd가 감소한 반면, Rg3, Rk1, Rg5가 각각 일정량 증가하였으며 이는 선행연구 결과와 일치하였다.
2. AChE 억제효과
AChE assay는 신경전달물질 ACh을 분해하는 AChE의 활성을 측정하는 시험으로 0.1 μM donepezil을 양성대조군으로 하여 대조군에 대한 억제율로 환산하였다. Non-steam 처리군의 경우, 18.8 ㎍/㎖, 37.5 ㎍/㎖, 75.0 ㎍/㎖, 150.0 ㎍/㎖ 및 300.0 ㎍/㎖의 농도에서 대조군 (100.0 ± 0.5%) 대비 각각 6.96 ± 0.17%, 17.90 ± 0.24%, 26.86 ± 5.29%, 88.06 ± 3.84%, 122.64 ± 1.72%의 AChE의 저해율을 나타내었으며 steam 처리군은 각각 동일 농도에서 25.86 ± 0.62%, 86.70 ± 1.19%, 102.50 ± 2.38%, 116.24 ± 3.97%, 130.68 ± 5.55%의 억제율을 보였다 (p < 0.01). 전체적으로 non-steam 대비 steam 처리군에서 높은 억제율을 나타내었으며, 75.0 ㎍/㎖ - 300.0 ㎍/㎖ 농도에서는 양성대조군보다 높은 억제율을 나타내었다 (Fig. 2).
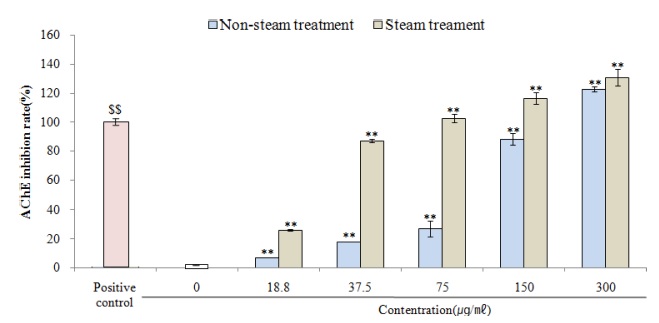
AChE inhibition rate of cultured wild ginseng adventitious root by steam treatment.Positive control; 0.1 μM donepezil. Data are presented as means ± standard deviation. Significant difference compared with control by Student’s t-test ($$p < 0.01). Significant difference compared with positive control using One-way ANOVA by Duncan’s Multiple Range Test (**p < 0.01).
Lee 등 (2009)은 ICR mice를 대상으로 한 경구 투여 시험에서 진세노사이드 Rg3 (S)가 6.73 ㎎/g 함유된 흑삼 추출물 200 ㎎/㎏을 투여 하였을 때, 대조군 (100%) 대비 뇌에서의 AChE의 활성이 82% 감소하였고, Kim 등 (2013)은 스코폴라민 처리에 의해 기억력을 상실시킨 mice에 홍삼의 주요성분 Rg5, Rh3를 경구 투여하였을 때, AChE의 활성 억제와 BDNF (brain derived neurotrpphic factor), CREB (cAMP response element binding protein)의 활성이 증가하여 기억상실을 개선한다고 보고하였다.
신경계 질환은 인지기능 저하, 뉴런 세포사멸, 도파민성 세포손실, 미토콘드리아 기능장애로 구분된다. 이중 인지기능 저하는 ACh, BDNF의 불활성화에 의해 발생한다 (Hou et al., 2020). ACh은 신경전달물질로 학습과 기억에 중요한 역할을 하며, 알츠하이머 환자 뇌에서 ACh의 양은 정상인에 비해 상대적으로 적은 것으로 알려져 있다 (Kihara and Shimohama, 2004). ACh은 AChE에 의해 acetate와 choline으로 분해되며, 베타 아밀로이드 축적을 촉진하고 불용성 원섬유를 형성하여 인지기능과 기억력 저하를 유발시킨다 (Musial et al., 2007; Han, 2009).
Tachikawa 등 (1995)은 진세노사이드 Rg3가 nicotinic acetylcholine과 GABA 수용체에 선택적인 억제 작용을 한다고 보고하였으며, 진세노사이드 Rg3, Rg5, Rh3는 다른 진세노사이드와 다르게 ACh을 분해하는 AChE에 직접적으로 작용하여 ACh의 분해를 억제하는 것으로 알려져 있다 (Hou et al., 2020). 본 시험 결과 산삼배양근 steam 처리군에서 농도 의존적으로 AChE를 억제하는 것이 확인되었으며, 저분자 진세노사이드에 의해 억제효과가 증가한 것으로 생각되어진다.
3. 신경세포 보호효과
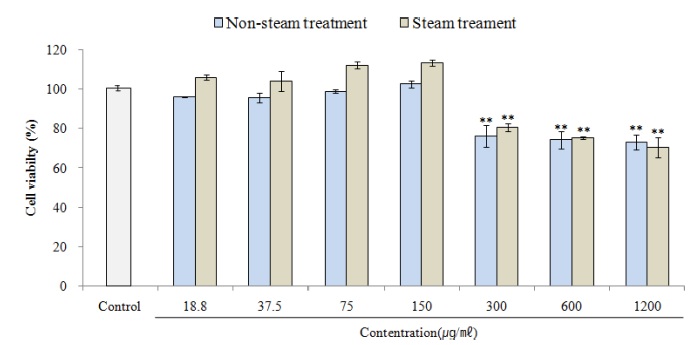
시료의 농도를 18.8 ㎍/㎖ 37.5 ㎍/㎖, 75.0 ㎍/㎖, 150.0 ㎍/㎖ 및 300.0 ㎍/㎖, 600.0 ㎍/㎖ 및 1,200.0 ㎍/㎖의 수준으로 처리하고 CCK-8 assay로 세포의 생존율을 측정한 결과, 대조군 세포 생존율을 100.00 ± 0.55%로 하였을 때, non-steam 처리군은 각각 95.97 ± 0.23%, 95.70 ± 2.38%, 98.86 ± 0.86%, 102.69 ± 1.78%, 76.27 ± 5.48%, 74.30 ± 4.53%, 73.06 ± 3.15%, steam 처리군은 106.05 ± 1.39%, 104.01 ± 5.07%, 112.31 ± 1.62%, 113.60 ± 1.61%, 80.79 ± 2.06%, 75.32 ± 0.86%, 70.46 ± 5.06%의 세포생존율을 나타내었다. 이중, 80% 이상의 세포 생존율을 나타낸 18.8 ㎍/㎖ - 300.0 ㎍/㎖의 농도에서 신경세포 보호활성을 측정하였다 (Fig. 3).
신경세포 보호활성을 측정한 결과, 대조군 100.01 ± 1.79% 대비 음성대조군에서 73.25 ± 0.61%로 신경세포 생존율이 감소하였고 (p < 0.01),
50 μM ascorbic acid를 처리한 양성대조군은 89.29 ± 5.62%로 생존율이 증가하였다 (p < 0.01).
시료의 농도를 18.8 ㎍/㎖, 37.5 ㎍/㎖, 75.0 ㎍/㎖, 150.0 ㎍/㎖ 및 300.0 ㎍/㎖의 수준으로 처리한 경우 non-steam 처리군의 신경세포 생존률은 각각 75.32 ± 0.95%, 81.58 ± 1.53%, 84.62 ± 2.47%, 81.30 ± 1.00%, 81.95 ± 2.07%로 나타났고, steam 처리군의 경우 79.91 ± 2.89%, 80.68 ± 3.63%, 83.22 ± 4.13% (p < 0.01), 86.48 ± 3.77% (p < 0.01), 82.76 ± 1.78% (p < 0.01)를 나타내었고, steam 처리군 중 75.0 ㎍/㎖ - 300.0 ㎍/㎖ 농도에서는 80% 이상의 통계적으로 유의한 활성이 확인되었다 (Fig. 4).
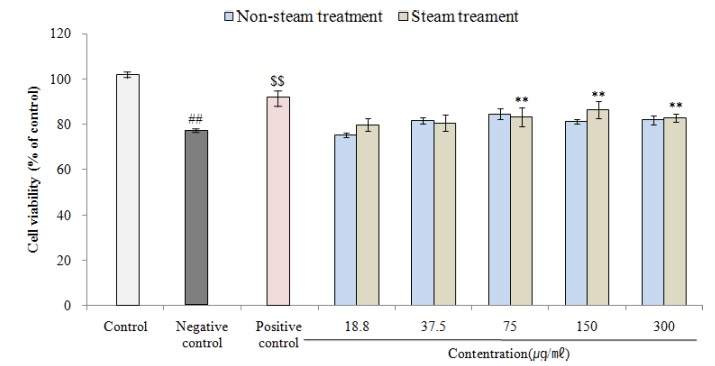
Neuroprotection rate against Aβ25-35 of cultured wild ginseng adventitious root by steam treatment.Control; not treatment (neuroprotection rate in SH-SY5Y cell), Negative control; SH-SY5Y cell treated of 5 μM Aβ25-35, Positive control; SH-SY5Y cell treated of 5 μM Aβ25-35 and 50 μM ascorbic acid). Data are presented as means ± standard deviation. Significant difference compared with control (##p < 0.01) and negative control ($$p < 0.01) by Student’s t-test. Significant difference compared with negative control using One-way ANOVA by Duncan’s Multiple Range Test (**p < 0.01).
Aβ25-35는 신경세포에 축적되는 아밀로이드 섬유 덩어리로 신경돌기 및 성상세포 등에 침착하여 노인성 반점을 형성시키고, 세포사멸은 인지기능 및 기억력 장애를 유발하는 것으로 알려져 있다 (Thal et al., 2015).
Park 등 (2007)은 Aβ25-35에 의해 세포 사멸이 유도된 SH-SY5Y 세포에 해바라기 추출물 5 ㎕ 처리하였을 때, 세포 생존율이 80%로 증가하였고, Jang 등 (2019)은 Aβ42를 처리하여 알츠하이머를 유발시킨 mice에 인삼 열매 추출물 100 ㎎/㎏ - 500 ㎎/㎏을 3 주간 경구 투여하였을 때, 고농도 500 ㎎/㎏ 처리군에서 Aβ42 축적에 의해 생성된 성상세포수가 감소하는 것을 확인하였다.
Xie 등 (2010)은 진세노사이드 Rb1이 Aβ25-35에 의한 세포손상 및 세포사멸을 억제한다고 하였으며, Chu 등 (2014)은 진세노사이드 Rg5가 BDNF 및 IGF-1의 발현을 증가시켜, Aβ 침착을 감소시킨다고 보고하였다.
본 연구에서는 산삼배양근 steam 처리군을 150 ㎍/㎖ 농도로 처리한 군에서 86.48 ± 3.77%의 신경세포 보호 효과가 확인되었고, 75.0 ㎍/㎖ - 300.0 ㎍/㎖ 농도에서 통계적으로 유의한 활성을 나타내어 (p < 0.01), 산삼배양근 steam 처리군이 신경세포 손상을 억제하는 것으로 사료되어지며, 본 연구에 사용된 시료는 Aβ 독성을 억제하여 고농도의 시료에서 세포 생존율이 유사하거나 증가한 것으로 사료된다.
4. 산화스트레스 억제효과
신경세포에 H2O2를 처리하여 생성되는 활성산소를 측정한 결과, 대조군 48.70 ± 2.08% 대비 300 μM의 H2O2를 처리한 음성대조군에서 100.00 ± 3.71%로 활성산소종이 증가하였고 (p < 0.01), 50 μM ascorbic acid를 처리한 양성대조군의 경우 62.52 ± 0.32%로 생성율이 감소하였다 (p < 0.01).
Non-steam 처리군은 18.8 ㎍/㎖ - 300.0 ㎍/㎖ 농도에서 각각 102.04 ± 1.51%, 97.47 ± 0.84%, 90.81 ± 0.89%, 80.03 ± 1.07%, 54.62 ± 1.62%, steam 처리군은 97.26 ± 0.30%, 79.69 ± 4.78%, 77.05 ± 0.65% (p < 0.01), 38.61 ± 0.62% (p < 0.01), 26.63 ± 0.27% (p < 0.01)를 나타내었고, steam 처리군 75.0 ㎍/㎖ - 300.0 ㎍/㎖ 농도에서 통계적으로 유의한 활성산소 생성억제의 효과가 확인되었다 (Fig. 5).
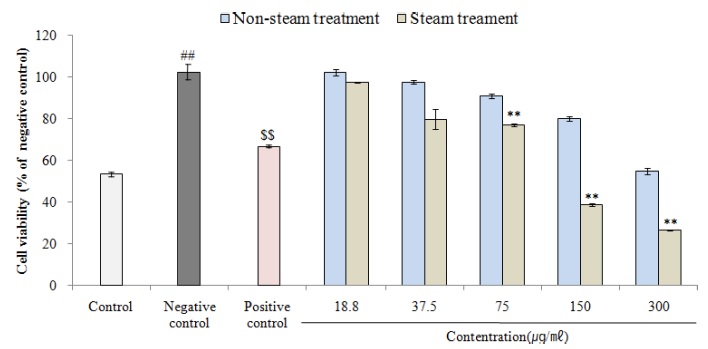
ROS generation inhibitory rate against H2O2 of cultured wild ginseng adventitious root by steam treatment.Control; not treatment (ROS generation rate in SH-SY5Y cell), Negative control; ROS generation rate of SH-SY5Y cell treated of 300 μM H2O2, Positive control; SH-SY5Y cell treated of 300 μM H2O2 and 50 μM ascorbic acid. Data are presented as means ± standard deviation. Significant difference compared with control (##p < 0.01) and negative control ($$p < 0.01) by Student’s t-test. Significant difference compared with negative control using One-way ANOVA by Duncan’s Multiple Range Test (**p < 0.01).
Xiong 등 (2003)은 진세노사이드 Rk1이 p-AKT, Nrf2 및 HO-1 단백질 발현을 촉진하여 세포질에서 핵으로 Nrf2 전위를 증가시켜 ROS로부터 세포를 보호하고 PI3K/AKT 신호전달을 촉진시킨다고 보고하였으며, Ahn 등 (2015)은 진세노사이드 Rg5, Rk1이 세포의 케모카인과 사이토카인 생성을 억제하여 ROS를 감소시킨다고 보고하였다.
신경세포에 H2O2를 처리하여 생성되는 카탈라제를 측정한 결과, 대조군 100.15 ± 2.95% 대비 300 μM의 H2O2를 처리한 음성대조군에서 66.36 ± 5.18%로 카탈라제 활성이 감소하였고 (p < 0.01), 50 μM ascorbic acid를 처리한 양성대조군의 경우 102.42 ± 1.20%로 활성이 증가하였다 (p < 0.01).
Non-steam 처리군은 18.8 ㎍/㎖ - 300.0 ㎍/㎖ 농도에서 각각 42.35 ± 1.00%, 57.16 ± 0.84%, 63.35 ± 1.00%, 70.39 ± 0.89%, 74.31 ± 2.70%, 증숙 처리군은 52.99 ± 1.58%, 68.40 ± 3.05%, 76.38 ± 5.26% (p < 0.01), 85.66 ± 3.04% (p < 0.01), 88.12 ± 6.16% (p < 0.01)를 나타내었고, steam 처리군 75 ㎍/㎖ - 300 ㎍/㎖ 농도에서 통계적으로 유의한 카탈라제 활성효과가 확인되었다 (Fig. 6).
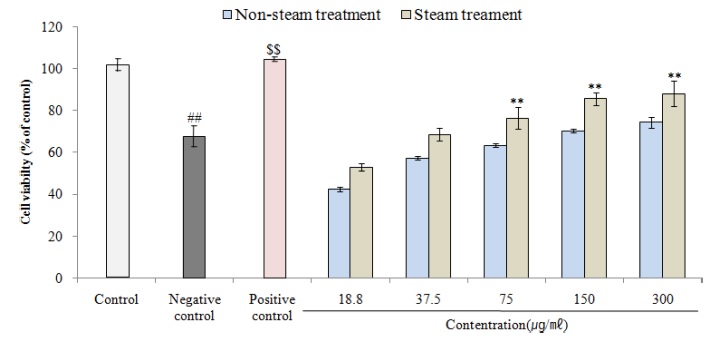
CAT stimulatory rate against H2O2 of cultured wild ginseng adventitious root by steam treatment.Control; not treatment (CAT stimulatory rate in SH-SY5Y cell), Negative control; CAT stimulatory rate of SH-SY5Y cell treated of 300 μM H2O2, Positive control; SH-SY5Y cell treated of 300 μM H2O2 and 50 μM ascorbic acid. Data are presented as means ± standard deviation. Significant difference compared with control (##p < 0.01) and negative control ($$p < 0.01) by Student’s t-test. Significant difference compared with negative control using One-way ANOVA by Duncan’s Multiple Range Test (**p < 0.01).
생물체 내에서 생성되는 활성산소종은 생체 조직을 공격하고 세포를 손상시키는 산화력이 강한 산소이며, 이러한 활성 산소종은 DNA, 핵 단백질과 반응하여 세포의 노화와 사멸을 유발시키고, 주요한 질병의 주요 원인으로 알려져 있다 (Kang, 2013).
카탈라제는 세포신호에 의해 H2O2를 H2O와 O2로 분해 과정을 담당하며 (Nandi et al., 2019), 체내 활성산소 제거와 관련된 항산화계 효소 중 하나로 생체내의 활성산소에 의한 노화와 질병을 억제하는 방어기구로 알려져 있으며 (Bukowska et al., 2000), 활성산소종의 억제와 카탈라제 촉매작용에 의한 활성산소의 제거는 산화 스트레스를 감소시키고, 체내 기관, 조직, 세포를 보호할 수 있는 생리적 기작이다 (Lloyd, 2013).
본 시험에서도 저분자 진세노사이드 함량이 증가된 steam 처리군을 반응시킬 경우 H2O2 처리에 의해 증가되는 활성산소종의 생성을 억제할 수 있으며, H2O2 처리에 의해 감소하는 카탈라제 효소 활성이 농도 의존적으로 회복되는 것을 확인하였다.
본 시험에서는 산삼배양근의 고분자와 저분자 진세노사이드의 함량이 변화하는 것을 착안하여 증숙 처리 전후의 생리활성을 비교하였다. Steam 처리군의 경우 ACh을 분해하는 AChE 억제효과가 n on-ste am 처리군 대비 증가하였다. 또한, Aβ25-35에 의한 세포손상 보호와 과산화수소에 의해 발생된 활성산소의 억제효과를 확인하였다. 본 시험결과를 토대로 임상시험을 통한 기능성 기전의 규명이 이루어진다면, 저분자 진세노사이드의 기억력 개선 및 항산화와 관련된 기능성 물질로서의 활용 가치가 높아질 것으로 생각되어진다.
References
-
Ahmed T, Raza SH, Maryam A, Setzer WN, Braidy N, Nabavi SF, de Oliveira MR and Nabavi SM. (2016). Ginsenoside Rb1 as a neuroprotective agent: A review. Brain Research Bulletin. 125:30-43.
[https://doi.org/10.1016/j.brainresbull.2016.04.002]

-
Ahn SG, Siddiqi MH, Aceituno VC, Simu SY, Zhang J, Jimenez Perez ZE, Kim YJ and Yang DC. (2016). Ginsenoside Rg5:Rk1 attenuates TNF-α/IFN-γ-induced production of thymus- and activation-regulated chemokine(TARC/CCL17) and LPS-induced NO production via downregulation of NF-κB/p38 MAPK/STAT1 signaling in human keratinocytes and macrophages. In Vitro Cellular and Developmental Biology-Animal. 52:287-295.
[https://doi.org/10.1007/s11626-015-9983-y]

-
Bukowska B, Chajdys A, Duda W and Duchnowicz P. (2000). Catalase activity in human erythrocytes: Effect of phenoxyherbicides and their metabolites. Cell Biology International. 24:705-711.
[https://doi.org/10.1006/cbir.2000.0553]

-
Chu S, Gu J, Feng L, Liu J, Zhang M, Jia X and Yao D. (2014). Ginsenoside Rg5 improves cognitive dysfunction and beta-amyloid deposition in STZ-induced memory impaired rats via attenuating neuroinflammatory responses. International Immunopharmacology. 19:317-326.
[https://doi.org/10.1016/j.intimp.2014.01.018]

-
Farmer RH and Campbell WG. (1950). Isolation of a saponin from the heart-wood of the Mora tree and of a related species, Morabukea. Nature. 165:237-237.
[https://doi.org/10.1038/165237a0]

-
Fei F, Su N, Li X and Fei Z. (2020). Neuroprotection mediated by natural products and their chemical derivatives. Neural Regeneration Research. 15:2008-2015.
[https://doi.org/10.4103/1673-5374.282240]

-
Hahn SJ and Paik NJ. (2015). Pharmacological treatment of dementia. Brain and Neurorehabilitation. 8:19-23.
[https://doi.org/10.12786/bn.2015.8.1.19]

-
Han SH. (2009). Novel pharmacotherapies for alzheimer’s disease. Journal of the Korean Medical Association. 52:1059-1068.
[https://doi.org/10.5124/jkma.2009.52.11.1059]

-
Hou W, Wang Y, Zheng P and Cui R. (2020). Effects of ginseng on neurological disorders. Frontiers in Cellular Neuroscience. 14:55. https://www.frontiersin.org/articles/10.3389/fncel.2020.00055/full, (cited by 2021 July 14).
[https://doi.org/10.3389/fncel.2020.00055]

- Jang SK, Ahn JW, Jo BR, Kim HS, Kim SJ, Sung EA, Lee DI, Park HY, Jin DH and Joo SS. (2019). Double-processed ginseng berry extracts enhance learning and memory in an Aβ42-induced Alzheimer‘s mouse model. Korean Journal of Food Science and Technology. 51:160-168.
-
Kang SJ, Woo JH and Kim AJ. (2013). The effect of Korean ginseng on memory loss in a rat models. Journal of the Korean Society of Food Science and Nutrition. 42:1190-1196.
[https://doi.org/10.3746/jkfn.2013.42.8.1190]

-
Kása P, Rakonczay Z and Gulya K. (1997). The cholinergic system in Alzheimer's disease. Progress in Neurobiology. 52: 511-535.
[https://doi.org/10.1016/S0301-0082(97)00028-2]

- Kihara T and Shimohama S. (2004). Alzheimer's disease and acetylcholine receptors. Acta Neurobiologiae Experimentalis. 64:99-105.
-
Kim CJ, Choi JH, OH YS, Seong ES, Lim JD, Yu CY and Lee JG. (2020). Enhancement and conversion of ginsenoside contents in cultured wild ginseng adventitious root. Korean Journal of Medicinal Crop Science. 28:445-454.
[https://doi.org/10.7783/KJMCS.2020.28.6.445]

-
Kim EJ, Jung IH, Van Le TK, Jeong JJ, Kim NJ and Kim DH. (2013). Ginsenosides Rg5 and Rh3 protect scopolamine-induced memory deficits in mice. Journal of Ethnopharmacology. 146:294-299.
[https://doi.org/10.1016/j.jep.2012.12.047]

-
Kim SY. (2018) Past and future of drug treatments for Alzheimer’s disease. Journal of Korean Neuropsychiatric Association. 57:30- 42.
[https://doi.org/10.4306/jknpa.2018.57.1.30]

-
Lee MR, Yun BS, Sun BS, Liu L, Zhang D, Wang C, Ly SY, MO EK and Sung CK. (2009). Change of ginsenoside Rg3 and acetylcholinesterase inhibition of black ginseng manufactured by grape juice soaking. Journal of Ginseng Research. 33:349-354.
[https://doi.org/10.5142/JGR.2009.33.4.349]

-
Lee YJ, Kim HK, Go EJ, Choi JH, Jo AR, Kim CJ, Lee JG, Lim JD, Choi SK and Yu CY. (2018). Extraction of low molecular weight ginsenosides from adventitious roots culture of wild mountain ginseng by steam processing. Korean Journal of Medicinal Crop Science. 26:148-156.
[https://doi.org/10.7783/KJMCS.2018.26.2.148]

-
Li M, Lan J, Li X, Xin M, Wang H, Zhang F and Wu X. (2019). Novel ultra-small micelles based on ginsenoside Rb1: A potential nanoplatform for ocular drug delivery. Drug delivery. 26:481-489.
[https://doi.org/10.1080/10717544.2019.1600077]

-
Li X, Chu S, Lin M, Gao Y, Liu Y, Yang S, Zhou X, Zhang Y, Hu Y, Wang H and Chen N. (2020). Anticancer property of ginsenoside Rh2 from ginseng. European Journal of Medicinal Chemistry. 203:112627. https://www.sciencedirect.com/science/article/abs/pii/S0223523420305997, (cited by cited by 2021 July 14).
[https://doi.org/10.1016/j.ejmech.2020.112627]

-
Lim W, Mudge KW and Vermeylen F. (2005). Effects of population, age, and cultivation methods on ginsenoside content of wild American ginseng(Panax quinquefolium). Journal of Agricultural and Food chemistry. 53:8498-8505.
[https://doi.org/10.1021/jf051070y]

-
Lloyd KA. (2013). A scientific review: Mechanisms of valproate-mediated teratogenesis. Bioscience Horizons: The International Journal of Student's Research. 6:hzt003 https://academic.oup.com/biohorizons/article/doi/10.1093/biohorizons/hzt003/302011?login=true, (cited by 2021 July 14).
[https://doi.org/10.1093/biohorizons/hzt003]

-
Lu C, Wang Y, Lv J, Jiang N, Fan B, Qu L, Li Y, Chen S, Wang F and Liu X. (2018). Ginsenoside Rh2 reverses sleep deprivation-induced cognitive deficit in mice. Behavioural Brain Research. 349:109-115.
[https://doi.org/10.1016/j.bbr.2018.03.005]

-
Luchsinger JA, Tang M, Shea S, and Mayeux R. (2003). Antioxidant vitamin intake and risk of Alzheimer disease. Archives of Neurology. 60:203-208.
[https://doi.org/10.1001/archneur.60.2.203]

-
Manton KG, Volovik S and Kulminski A. (2004). ROS effects on neurodegeneration in Alzheimer's disease and related disorders: On environmental stresses of ionizing radiation. Current Alzheimer Research. 1:277-293.
[https://doi.org/10.2174/1567205043332036]

- Ministry of Food and Drug Safety(MFDS). Food code 2021. Ministry of Food and Drug Safety asterisk 1. Cheongju, Korea. p.138-144.
-
Moon JW, Jang IB, Yu J, Jang IB, Seo SJ and Lee SW. (2019). Changes in growth characteristics, biological activity and active compound contents in ginseng of different ages. Korean Journal of Medicinal Crop Science. 27:383-389.
[https://doi.org/10.7783/KJMCS.2019.27.6.383]

-
Musial A, Bajda M and Malawska B. (2007). Recent developments in cholinesterases inhibitors for Alzheimer‘s disease treatment. Current Medicinal Chemistry. 14:2654-2679.
[https://doi.org/10.2174/092986707782023217]

-
Nandi A, Yan LJ, Jana CK and Das N. (2019). Role of catalase in oxidative stress- and age-associated degenerative diseases. Oxidative Medicine and Cellular Longevity. 2019:9613090. https://www.hindawi.com/journals/omcl/2019/9613090/, (cited by 2021 July 14).
[https://doi.org/10.1155/2019/9613090]

-
Nichols E and Theo V. (2020). The burden of dementia and dementia due to Down syndrome, Parkinson’s disease, stroke, TBI, and HIV: An analysis for the Global Burden of Disease study 2019. Alzheimer's and Dementia. 16:e042280. https://alzjournals.onlinelibrary.wiley.com/doi/full/10.1002/alz.042280, (cited by 2021 July 14).
[https://doi.org/10.1002/alz.042280]

- Park JY, Woo SU, Heo JC and Lee SH. (2007). Protective effects of Helianthus annuus seed extract against chemicalinduced neuronal cell death. Korean Journal of Food Preservation. 14:213-219.
-
Rao ΑV and Gurfinkel DM. (2000). The bioactivity of saponins: Triterpenoid and steroidal glycosides. Drug Metabolism and Drug Interactions. 17:211-236.
[https://doi.org/10.1515/DMDI.2000.17.1-4.211]

-
Sanada S, Kondo N, Shoji J, Tanaka O and Shibata S. (1974). Studies on the saponins of ginseng. I. Structures of ginsenoside- Ro, -Rb1, -Rb2, -Rc and -Rd. Chemical and Pharmaceutical Bulletin. 22:421-428.
[https://doi.org/10.1248/cpb.22.421]

-
Seong BJ, Kim SI, Jee MG, Lee HC, Kwon AR, Kim HH Won JY and Lee KS. (2019). Changes in growth, active ingredients, and rheological properties of greenhouse-cultivated ginseng sprout during its growth period. Korean Journal of Medicinal Crop Science. 27:126-135.
[https://doi.org/10.7783/KJMCS.2019.27.2.126]

-
Shibata S, Tanaka O, Ando T, Sado M, Tsushima S and Ohsawa T. (1966). Chemical studies on oriental plant drugs. XIV. Protopanaxadiol, a genuine sapogenin of ginseng saponins. Chemical and Pharmaceutical Bulletin. 14:595-600.
[https://doi.org/10.1248/cpb.14.595]

-
Shin MS, Song JH, Choi P, Lee JH, Kim SY, Shin KS, Ham JY and Kang KS. (2018). Stimulation of innate immune function by Panax ginseng after heat processing. Journal of Agricultural and Food Chemistry. 66:4652-4659.
[https://doi.org/10.1021/acs.jafc.8b00152]

-
Suh GH. (2007). Drug therapy for Alzheimer's disease. Journal of the Korean Medical Association. 50:369-374.
[https://doi.org/10.5124/jkma.2007.50.4.369]

- Tachikawa E, Kudo K, Kashimoto T and Takahashi E. (1995). Ginseng saponins reduce acetylcholine-evoked Na+ influx and catecholamine secretion in bovine adrenal chromaffin cells. Journal of Pharmacology and Experimental Therapeutics. 273: 629-636.
-
Tang M, Xie X, Yang Y and Li F. (2021). Ginsenoside compound K- a potential drug for rheumatoid arthritis. Pharmacological Research. 166:105498. https://www.sciencedirect.com/science/article/abs/pii/S1043661821000827, (cited by 2021 July 14).
[https://doi.org/10.1016/j.phrs.2021.105498]

-
Thal DR, Walter J, Saido TC and Fändrich M. (2015). Neuropathology and biochemistry of Aβ and its aggregates in alzheimer’s disease. Acta Neuropathologica. 129:167-182.
[https://doi.org/10.1007/s00401-014-1375-y]

-
Vetrivel KS and Thinakaran G. (2006). Amyloidogenic processing of β-amyloid precursor protein in intracellular compartments. Neurology. 66:69-73.
[https://doi.org/10.1212/01.wnl.0000192107.17175.39]

-
Wang C, Zhang B, Song W, Wang A, Ni M, Luo X, Aung HH, Xie, J, Tong R, He T and Yuan C. (2006). Steamed American ginseng berry: Ginsenoside analyses and anticancer activities. Journal of Agricultural and Food Chemistry. 54:9936- 9942.
[https://doi.org/10.1021/jf062467k]

- World Health Organization(WHO). (2021). Dementia fact sheet. World Health Organization. https://www.who.int/en/news-room/fact-sheets/detail/dementia, (cited by 2021 July 10).
-
Xie J, Mehendale SR, Li X, Quigg R, Wang X, Wang C, Wu JA, Aung HH, Rue PA, Bell GI and Yuan CS. (2005). Anti-diabetic effect of ginsenoside Re in ob/ob mice. Biochimica et Biophysica Acta(BBA) - Molecular Basis of Disease. 1740:319-325.
[https://doi.org/10.1016/j.bbadis.2004.10.010]

-
Xie X, Wang H, Li C, Gao X, Ding J, Zhao H and Lu Y. (2010). Ginsenoside Rb1 protects PC12 cells against β-amyloid-induced cell injury. Molecular Medicine Reports. 3:635-639.
[https://doi.org/10.3892/mmr_00000308]

-
Xiong J, Yang J, Yan K and Guo J. (2021). Ginsenoside Rk1 protects human melanocytes from H2O2-induced oxidative injury via regulation of the PI3K/AKT/Nrf2/HO-1 pathway. Molecular Medicine Reports. 24:821. https://www.spandidospublications.com/10.3892/mmr.2021.12462, (cited by July 14).
[https://doi.org/10.3892/mmr.2021.12462]

-
Yamaguchi H, Matsuura H, Kasai R, Tanaka O, Satake M, Kohda H, Izumi H, Nuno M, Katsuki S, Isoda S, Shoji J and Goto K. (1988). Analysis of saponins of wild Panax ginseng. Chemical and Pharmaceutical Bulletin. 36:4177-4181.
[https://doi.org/10.1248/cpb.36.4177]

- Yang SJ, Woo KS, Yoo JS, Kang TS, Noh YH, Lee JS and Jeong HS. (2006). Change of Korean ginseng components with high temperature and pressure treatment. Korean Journal of Food Science and Technology. 38:521-525.
-
Zong W, Zeng X, Chen S, Chen L, Zhou L, Wang X, Gao Q, Zeng G, Hu K and Ouyang D. (2019). Ginsenoside compound K attenuates cognitive deficits in vascular dementia rats by reducing the Aβ deposition. Journal of Pharmacological Sciences. 139:223-230.
[https://doi.org/10.1016/j.jphs.2019.01.013]