의성지역 개나리 수집자원의 이형화주성과 결실 습성에 따른 잎의 형태 및 리그난 성분 차이
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Forsythia species is used as an herbal medicine and landscape plant. The fruit setting rate, floral morph (distyly), and morphological characteristics and lignan components of leaves in Uiseong local Forsythia germplasm were investigated to select the elite lines for fruit setting.
A total of 23 Forsythia germplasm were collected in Uiseong area, Korea. Each germplasm planted in Uiseong was investigated for the rate of fruit set in March and October, floral distyly; pin (long-styled morph) and thrum (short-styled morph), in March, and stem color, leaf length, leaf width, petiole length and leaf serration in July. Additionall, lignan components (matairesinol, pinoresinol, arctigenin, phillygenin and their glycosides) in leaves of each germplasm were analyzed using HPLC-MS. Two leaf types, Leaf I and Leaf II of Forsythia germplasm, were grouped based on fruit set, distyly, leaf shape, chromatogram of lignan components and stem color. Leaf II germplasm had longer ovate leaves with lesser serration and more lignan components than Leaf I germplasm. Most of Leaf II plants had successful fruit set, a pin flower, and green stem.
We confirm that Leaf I germplasm is Forsythia koreana (Rehder) Nakai and Leaf II germplasm is Forsythia viridissima Lindl., consistent with previous results.
Keywords:
Forsythia spp., Distyly, Fruiting Habit, Leaf Shape, Lignan Component, Uiseong Local Germplasm서 언
개나리속 (Forsythia) 식물은 물푸레나무과 (Oleaceae)에 속하는 낙엽관목이며 조경용이나 약용으로 사용되고 있다. 국내에는 개나리 [Forsythia koreana (Rehder) Nakai], 산개나리 [F. saxatilis (Nakai) Nakai], 만리화 (F. ovata Nakai), 장수만리화 [F. nakaii (Uyeki) T.B.Lee], 의성개나리 (F. viridissima Lindl.) 등이 주로 분포하고 있고, 기타 당개나리 [F. suspensa (Thunb.) Vahl], 일본개나리 (F. japonica Makino) 등이 식재되어 있는 것으로 알려져 있다 (Chung and Lee, 1962; Lee, 1984).
의성개나리와 당개나리는 한약재 연교 (連翹)의 기원 식물이며, 열매를 열을 내리는 청열약 (淸熱藥)으로 사용하고 있다. 의성개나리의 열매에 함유된 리그난 성분은 주로 항염, 항산화, 항균, 골다공증 억제 등의 효과가 있는 것으로 보고되고 있다 (Rho, 1975; Lee and Keum, 1988; Yang and Choe, 2011; Eom et al., 2019).
개나리속 식물은 줄기가 직립하거나 늘어지는 습성을 가지며, 일반적으로 4월경에 꽃이 잎보다 먼저 개화한다. 개나리속 식물은 보통 암술 (화주)의 길이가 다른 이형화주성 (異形花柱性, heterostyly)을 나타내고, 이화주성 (二花柱性, distyly)인 장주화와 단주화 개체들로 구분되며, 우리나라에는 장주화보다는 꽃색이 진하고 크기가 더 큰 단주화가 더 많이 분포하는 것으로 알려져 있다 (Han and Kim, 1999; Kim and Kim, 2004).
전국적으로 재식되어 있는 개나리속 식물은 주로 조경용인 개나리 (F. koreana)이며, 약용으로 사용하는 개나리속 식물은 의성개나리 (F. viridissima)이다. 개나리는 열매를 맺지 못하나 의성개나리는 열매가 달리며, 주로 경상북도 의성군 지역에서 의성개나리를 재배하고 9월에서부터 10월까지 열매를 수확 및 건조하여 한약재로 유통되기도 하였으나 최근에는 거의 생산되지 않는 것으로 알려져 있다 (MAFRA, 2021).
의성개나리에 대한 품종으로 열매 수량이 높은 신품종 ‘연정’이 개발되었으나 (Kim et al., 1999), 품종보호출원이 되지 않았으며 품종보존이 되지 않은 실정이다.
의성개나리, 개나리, 당개나리 등의 열매나 잎에는 리그난 (lignan) 성분으로 matairesinol, pinoresinol, arctigenin, phillygenin 등과 리그난 배당체 성분으로 matairesinoside (matairesinol glucoside), pinoresinol glucoside, arctiin, phillyrin 등이 포함되어 있고, flavonoid 성분으로 rutin과 phenylethanoid 배당체인 forsythiaside, acteoside 등이 함유되어 있으며 의성개나리와 당개나리의 잎의 리그난 성분 조성에 차이가 있다고 보고되었다 (Kitagawa et al., 1984; Kitagawa et al., 1988).
의성개나리와 당개나리의 열매의 성분분석 연구에서 forsythiaside, lariciresinol, phillyrin, pinoresinol, phillygenin, arctiin, matairesinol, arctigenin 등을 분리 및 동정하고 HPLC-DAD 분석이나 HPLC-ESI-MS 분석을 통해 각 성분을 정량한 보고가 있으며 (Cho et al., 2011; Won et al., 2011), 개나리의 잎, 열매, 줄기 등에서 HPLC를 통해 분리된 성분들을 ESI-MS 분석하여 forsythoside F, forsythoside A (forsythiaside), forsythoside G, matairesinoside, phillyrin, arctiin, matairesinol, arctigenin 등으로 동정한 보고가 있다 (Choi et al., 2003). 또한 의성개나리, 우엉 (Arctium lappa L.), 스카비오사수레국화 (Centaurea scabiosa L.)의 열매로부터 matairesinoside, arctiin, pinoresinol, matairesinol, phillygenin, arctigenin, methylarctigenin 등을 HPLC-ESI-MS 분석으로 분리․동정하였으며 (Boldizsár et al., 2010), 아마 (flaxseed), 차 (tea), 브로콜리 (broccoli)와 같은 식품에서 lariciresinol, secoisolariciresinol, pinoresinol, matairesinol 등의 리그난 성분을 분리 및 동정하고 HPLC-MS 분석을 통해 정량한 결과가 보고된 바 있다 (Milder et al., 2004).
열매를 기원으로 하는 한약재 연교의 지표성분은 의성개나리에서는 arctigenin 0.4%, 당개나리에서는 forsythiaside 0.25% 이상으로 대한민국약전에서 규정하고 있다 (MFDS, 2019).
본 연구는 경상북도 의성지역에 재식되어 있는 개나리 수집자원의 이형화주성과 결실 특성을 조사하였으며, 수집집단 (계통)별로 잎을 채취하여 잎의 형태를 조사하고 잎에 함유된 리그난 성분을 분석하여 개나리 계통들의 특성 차이를 파악하고 의성개나리 우량계통 육성을 위한 기초자료로 이용하고자 수행하였다.
재료 및 방법
1. 실험재료 및 특성조사
본 시험에 사용된 개나리는 의성군 지역의 일정 장소에 재식되어 있는 23 개 집단 (군락)이며, 같은 장소의 개나리 군락을 개별 집단으로 구분하여 이형화주성, 결실 습성, 잎의 형태적 특성, 잎 함유 리그난 함량 등을 조사하였다.
이형화주성 및 결실 습성에 대한 조사는 2021년 3월 27일에 집단 내 80 ㎝ – 90 ㎝ 간격으로 무작위로 개체를 선택하고 이형화주성과 착과 정도 (결실량)를 육안으로 판단하였다.
이형화주성 (heterostyly) 조사를 위해서 암술대 (화주, style)가 수술보다 긴 장주화 (pin; long-styled morph)와 암술대가 짧은 단주화 (thrum; short-styled morph)를 확인하였으며 (Fig. 1), 결실 습성에서 결실된 개체가 거의 없는 집단은 무결실 (None) 집단, 비교적 적은 수의 열매가 관찰된 집단은 소결실 (Low) 집단, 그리고 상대적으로 많은 수의 열매가 관찰된 집단은 다결실 (High) 집단으로 구분하였다. 조사된 각 집단의 결실 습성은 2021년 10월 1일에 다시 확인하고 계통명 (FV)을 부여하였다.

Distyly in Forsythia flowers.A; thrum (short-styled morph), B; pin (long-styled morph). Style in thrum (A) is not seen because the style is short and under the anther.
잎의 형태적 특성을 조사하기 위해 집단별로 개체가 다르고 당년 생장한 줄기 10 개 정도를 2021년 7월 2일에 채취하였으며, 줄기마다 중간부분의 1 개 잎을 따서 식물체 표본으로 만들어 보관한 후 11월에 조사하였다.
조사된 잎의 형태적 특성은 엽병길이 (P), 엽장 (L), 엽폭 (W), 거치길이 (LS), 톱니 (거치) (T) 등이며, 엽폭은 잎의 상단 1/3 부위와 하단 2/3 부위의 너비를 조사하고 평균을 산출하였다. 엽면적은 잎의 길이와 너비를 곱하여 2로 나눈 값으로 나타냈고, 엽장폭비 (W/L ratio)는 잎 길이에 대한 잎 너비의 비로 값을 나타냈으며, 엽상하부비 (U/L ratio)는 잎의 2/3 하부 너비 (WL)에 대한 1/3 상부 너비 (WU)의 비율로 나타냈다. 거치길이 (LS)는 엽연 (葉緣, 잎 가장자리) 중 거치부위 길이를 측정하였고, 거치길이비 (LS ratio)는 엽장에 대한 거치길이의 비로 나타냈으며, 톱니수 (NT)는 엽연 1 cm 거치부위 중 톱니 (T, 거치)의 수를 조사하였다 (Fig. 2).
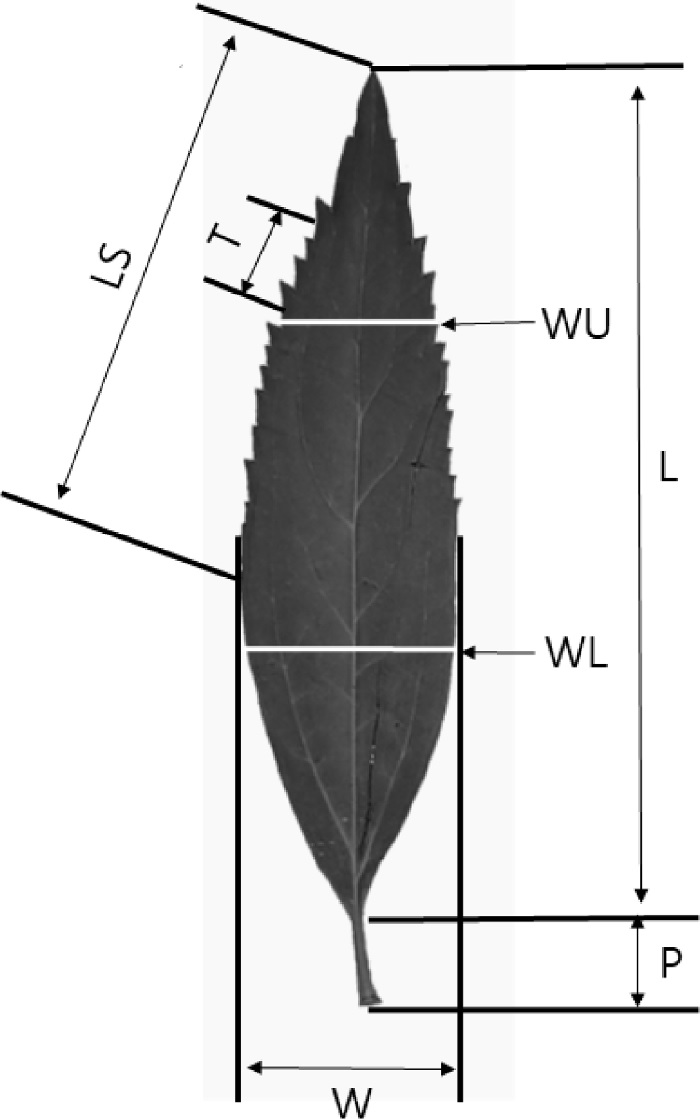
Measurements of leaf morphological characteristics.LS; length of serrated part of leaf margin, T; teeth on 1 cm of serrated leaf margin, WU; width of upper part of leaf, WL; width of lower part of leaf, P; petiole length, L; leaf length, W; leaf width.
채취된 줄기는 녹색 (green)과 갈색 (brown)으로 구분하고 수를 세어 비율로 환산하여 나타냈다.
2. 리그난 분석
의성지역 개나리 수집자원의 이형화주성이나 결실 습성의 차이가 리그난 성분과 관련이 있는지를 알아보기 위하여 2021년 7월 2일에 채취된 계통별 잎에 함유된 주요 리그난 성분들인 matairesinoside, matairesinol, pinoresinol glucoside, pinoresinol, arctiin, arctigenin, phillyrin, phillygenin 등을 분석하고 비교하였다. 기존의 문헌 (Kitagawa et al., 1988)에서 의성개나리와 개나리의 잎에 함유된 리그난 성분 조성에는 차이가 있다는 결과를 바탕으로 두 종의 개나리를 구별하는 기준이 될 수 있을 것으로 추정하고 잎을 대상으로 리그난 성분 분석 시험을 실시하였다.
의성개나리의 지표성분 arctigenin의 함량은 high performance liquid chromatography (HPLC)를 이용하여 정량하였다. 정량을 위한 표준물질 arctigenin은 Avention Co., Ltd. (Incheon, Korea)에서 구입하였으며, 나머지 성분들은 HPLC-ESI-MS 스펙트럼과 HPLC -DAD 크로마토그램에 대한 기존 문헌의 결과 (Choi et al., 2003; Milder et al., 2004; Boldizsár et al., 2010; Cho et al., 2011; Won et al., 2011)들을 참조하여 동정하였다.
분석 시료인 잎은 반복 당 3 개를 잘게 쪼개어 추출에 사용하였고 세절된 잎 시료의 추출은 3 회 반복하여 시험하였다. 세절된 잎 시료는 반복 당 0.2 g 정도를 75% 메탄올 40 ㎖로 상온에서 1 일 동안 80 rpm 정도로 진탕 추출하였다. 추출액은 1 일 동안 냉동실에 저장한 후 상등액 1 ㎖를 취하여 HPLC 분석 시료액으로 사용하였다.
분석시험에 사용된 HPLC (Agilent 1100 Series, Agilent Technologies Inc., Santa Clara, CA, USA)의 기기 조건은 역상 칼럼인 Sunfire C18 (5 ㎛, 4.5 ㎜ × 150 ㎜, Waters Co., Milford, MA, USA)을 실온에서 사용하였고, UV 검출기 (Agilent 1100 Series, Diode Array Detector)는 280 ㎚에서 측정하는 조건이었다. 이동상은 30% methanol 용액을 30 분 동안 70% methanol 용액으로 증가시키는 조건이며, 사용된 이동상은 0.5% acetic acid가 포함된 용액이었다. 이동상 유속은 0.7 ㎖/min이었고 분석 시료액 10 ㎕를 HPLC에 주입하였으며, 시료 당 분석 시간은 칼럼 세척 시간을 포함하여 총 60 분으로 하였다.
HPLC-MS 분석에는 Dionex UltiMate 3000 UHPLC (Thermo Fisher Scientific Inc., Sunnyvale, CA, USA)와 LTQ XL Orbitrap Mass Spectrometer (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 사용하였다. 기기에 장착된 칼럼은 역상인 Kinetex (1.7 ㎛, 2.1 ㎜ × 100 ㎜, Phenomenex Inc., Torrance, CA, USA)이고 실온에서 사용하였다. 이동상은 30% methanol 용액을 30 분 동안 70% methanol 용액으로 증가시키는 조건이고, 사용된 이동상은 0.1% formic acid가 포함된 용액이었다. 이동상 유속은 0.15 ㎖/min으로 설정하였다. 분석 물질은 electrospray 방법으로 이온화시킨 m/z 300 - m/z 800 범위에서 양이온 모드로 검출하여 mass spectrum을 얻었다.
3. 통계분석
의성지역 개나리 집단들의 측정값은 평균과 표준편차 (means ± SD)로 나타냈고, 실험군 간의 통계분석은 SPSS 프로그램 (IBM SPSS Statistics, Ver. 27, IBM Co., Armonk, NY, USA)을 사용하였다. 실험군 간의 측정치 비교는 Duncan’s Multiple Range Test (DMRT) 방법으로 5% 유의 수준에서 통계적 유의성을 검정하였다 (p < 0.05).
결과 및 고찰
1. 의성지역 개나리 수집자원의 결실 습성에 따른 잎의 형태적 특성 차이
의성지역에서 수집된 23 개 계통의 결실 습성을 관찰하고 잎의 형태적 특성을 계통별로 조사하였다. 엽장은 9.8 ㎝, 엽폭은 2.6 ㎝, 엽장폭비 (W/L ratio)는 0.27, 엽상하부비 (U/L ratio)는 0.88로 나타나 대체적으로 긴 도란형이며 상부가 하부 부위보다 좁은 모양을 나타냈다. 엽면적은 12.8 ㎠, 엽병길이는 1.59 ㎝, 엽장에 대한 거치부위의 길이 비율 (LS ratio)은 0.49, 그리고 엽연 1 ㎝ 거치부위 중 톱니 (거치)의 수는 2.8 개 정도로 나타났다 (Table 1).

Fruiting habits and morphological characteristics of leaves in Forsythia lines (n = 23) collected from Uiseong area.
조사된 계통의 결실 여부 및 결실량에 따라 무결실 (None), 소결실 (Low), 다결실 (High)로 구분하여 잎의 형태적 특성을 비교하였다 (Table 2). 전반적으로 결실 계통 (소결실과 다결실)은 비슷한 특성을 보였고 무결실 계통과는 차이가 있었다.

Differences of morphological characteristics of leaves by fruit set characteristics in Forsythia lines collected from Uiseong area.
무결실 계통은 결실 계통보다 엽장이 더 짧고, 엽폭이 더 넓으며, 엽장폭비가 더 크게 나타났는데, 무결실 계통의 잎이 결실 계통보다 더 짧고 둥근 도란형으로 타원형에 좀 더 가까웠다. 그러나 엽상하부비는 무결실 계통이 결실 계통보다 더 작게 나타났는데, 무결실 계통이 짧은 도란형이지만 잎 끝은 더 뾰족한 모양을 나타내는 것을 알 수 있었다 (Fig. 3). 엽면적은 비슷하였으며 엽병길이는 무결실 계통이 결실 계통보다 더 길게 나타났다. 엽장에 대한 거치부위의 길이 비율은 무결실 계통이 더 높았으며 일정 길이 (1 ㎝)의 거치부위 중 거치 (톱니) 수는 무결실 계통이 3.2 개이고 결실 계통이 2.5 개 - 2.6 개를 보이고 있는데, 결실 계통의 거치부위는 더 짧으며 톱니 수도 더 적었음을 알 수 있었다.

Leaf shapes of Leaf I type (A) and Leaf II type (B) among Forsythia lines collected from Uiseong area.Leaf I type; FV26 line with no fruit set, Leaf II; FV6 line with low fruit set.
따라서 결실여부에 따라 잎 모양이나 거치 특성의 차이가 있었으며, 결실 계통의 잎은 긴 도란형이면서 엽병은 짧으며 거치부위의 길이는 엽장의 절반보다 짧았고 거치밀도도 낮았음을 알 수 있었다. 조사된 의성지역 개나리 수집자원들은 결실 습성과 잎의 형태적 특성, 그리고 추가로 이형화주성 조사와 잎 함유 리그난 분석을 통해 두 유형의 엽형 (leaf type)으로 구분할 수 있었기 때문에 무결실 계통은 Leaf I 유형이라 하고 결실 계통은 Leaf II 유형으로 명명하였다 (Fig. 3).
국내 개나리속 식물의 분류 연구를 통해 개나리 (F. koreana)와 의성개나리 (F. viridissima)의 형태적 형질을 비교하였는데, 개나리의 잎은 난형 (卵形)이나 장타원형 (長楕圓形)이며 의성개나리의 잎은 장도란형 (長倒卵形)이나 장란형 (長卵形)이라고 구분하였으며 의성개나리 잎의 거치는 변이가 심하였다고 보고하였다 (Lee, 1984). 따라서 본 연구에서 조사된 의성지역 개나리 수집자원의 Leaf I 유형은 개나리이고 Leaf II 유형은 의성개나리로 추정할 수 있었다.
2. 의성지역 개나리 수집자원의 HPLC 크로마토그램 유형 및 리그난 성분 차이
의성지역 개나리 수집집단의 리그난 성분을 조사하기 위해 HPLC 분석을 하고 수집계통별 크로마토그램을 비교하였다.
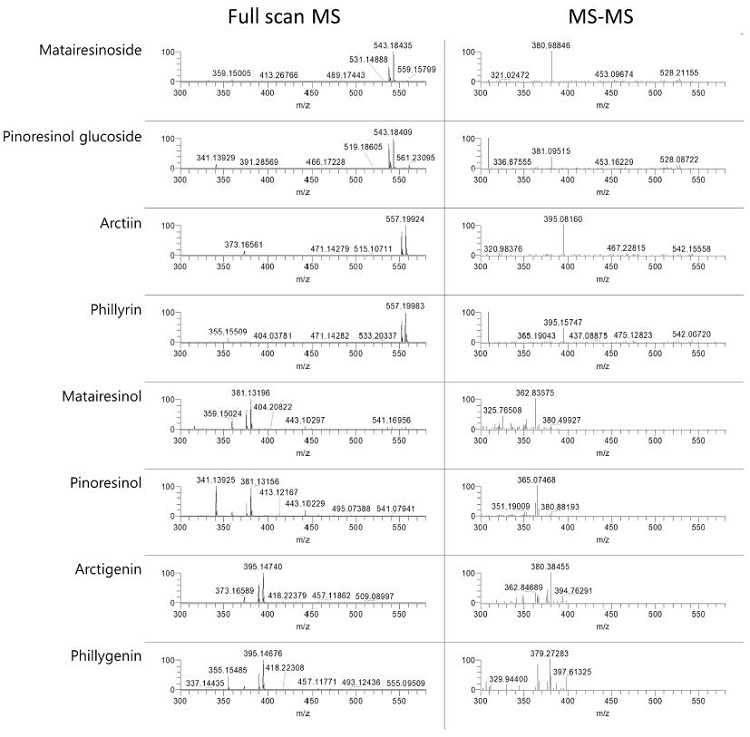
분석된 HPLC 피크들은 MS 분석과 HPLC 크로마토그램을 기존 보고들 (Choi et al., 2003; Cho et al., 2011; Won et al., 2011)과 비교하여 각 리그난과 그 배당체 성분을 동정하였다. Matairesinoside와 pinoresinol glucoside의 화학식은 C26H32O11로 분자량이 동일한 구조이성질체이며 정확한 nominal mass는 520.1939이고 양이온 모드의 mass spectrum에서는 [M+Na]+ 형태로 m/z 543.1848에서 검출되었다 (Fig. 4A-1).
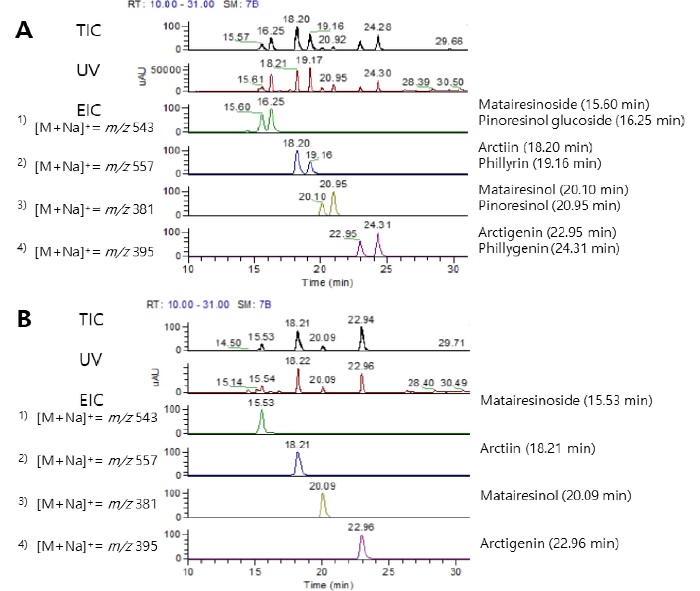
Total ion chromatograms (TIC), UV chromatograms and extracted ion chromatograms (EIC) obtained from Forsythia leaves.A; Leaf I type, B; Leaf II type. Matairesinoside, pinoresinol glucoside, arctiin, phillyrin, matairesinol, pinoresinol, arctigenin and phillygenin were identified by MS-MS spectra of HPLC peaks (280 ㎚).
Arctiin과 phillyrin의 화학식은 C27H34O11로 nominal mass는 534.2096이며 [M+Na]+ 형태로 m/z 557.1997에서 검출되었다 (Fig. 4A-2). Matairesinol과 pinoresinol의 화학식은 C20H22O6으로 nominal mass는 358.1411이고 mass spectrum에서는 Na과 adduct를 이룬 m/z 381.1322에서 검출되었다 (Fig. 4A-3).
Arctigenin과 phillygenin의 화학식은 C21H24O6으로 nominal mass는 372.1567이고 mass spectrum에서는 m/z 395.1473에서 검출되었다 (Fig. 4A-4). 같은 화학식을 가지는 리그난 성분들은 표준품과 비교하거나 문헌에 보고된 크로마토그램의 검출된 순서와 ESI-MS 스펙트럼을 비교 및 확인하여 동정하였다 (Fig. 5).
HPLC 분석 조건에서 검출된 리그난 성분들의 머무름 시간을 보면, 리그난 배당체인 matairesinoside, pinoresinol glucoside, arctiin, phillyrin은 각각 15.2 분, 15.7 분, 18.2 분, 19.4 분이었으며, 리그난인 matairesinol, pinoresinol, arctigenin, phillygenin은 각각 21.4 분, 22.7 분, 24.9 분, 26.8 분이었다 (Fig. 6).
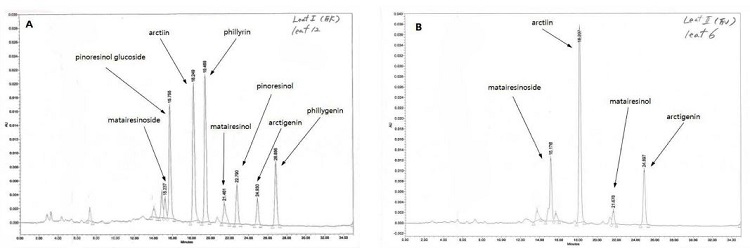
Two types of HPLC chromatogram pattern in 75% methanol extract of leaves of Forsythia lines collected from Uiseong area.A; Leaf I type (FV12 line), B; Leaf II type (FV6 line).
총 23 개 계통의 분석 결과, 크로마토그램의 유형은 결실 습성과 잎의 형태적 특성 (Table 1, Table 2 and Fig. 3)과 동일하게 Leaf I 유형과 Leaf II 유형으로 구분할 수 있었다. 의성지역 개나리 수집자원의 결실 습성을 보면, Leaf I 유형은 열매를 맺지 않는 집단이고 Leaf II는 열매를 맺는 집단으로 구분되었다. 두 유형은 공통으로 arctiin, arctigenin, matairesinoside, matairesinol 등을 함유하였고, Leaf I 유형은 pinoresinol glucoside, pinoresinol, phillyrin, phillygenin 등의 성분이 추가로 검출되어 Leaf II 유형과는 구별되었다 (Fig. 6).
또한 개나리 (F. koreana)의 잎에 함유된 리그난 성분 조성이 의성개나리 (F. viridissima)의 잎보다 더 많다고 보고한 기존의 결과 (Kitagawa et al., 1988)와 결실 습성 등을 종합할 때, Leaf I 유형을 나타내는 계통은 개나리 (Forsythia koreana (Rehder) Nakai)이며 Leaf II 유형 계통은 결실하여 열매를 한약재 연교로 사용하는 의성개나리 (Forsythia viridissima Lindl.)로 판단할 수 있었다. 앞으로 식물분류학적 동정 및 유전적 판별을 위해서는 두 종의 교배, 자식 등을 통한 유전적 특성을 좀 더 조사할 필요가 있는 것으로 생각된다.
3. 의성지역 개나리 수집자원의 결실 습성에 따른 arctigenin 함량, 이형화주성, 엽형 (leaf type)의 차이
의성지역에서 수집된 23 개 계통의 결실 습성을 관찰하고 잎에 함유된 arctigenin 함량, 이형화주성, 그리고 줄기 색깔을 조사하였다.
지표성분 arctigenin 함량을 조사하기 위해 HPLC 분석을 하였고 시료 추출물과 표준물질의 크로마토그램을 비교하여 정량하였다. 표준물질 arctigenin의 검량선은 0.137 - 1.095㎎/㎖의 농도 범위에서 작성하고 직선회귀식 (y = 728808.2x- 8278.8)의 유의성 (r2 = 0.9998***)을 확인하여 정량을 하였다. HPLC 크로마토그램에서 arctigenin의 머무름 시간 (retention time, RT)은 24.9 분이었다 (Fig. 6 and Fig. 7).
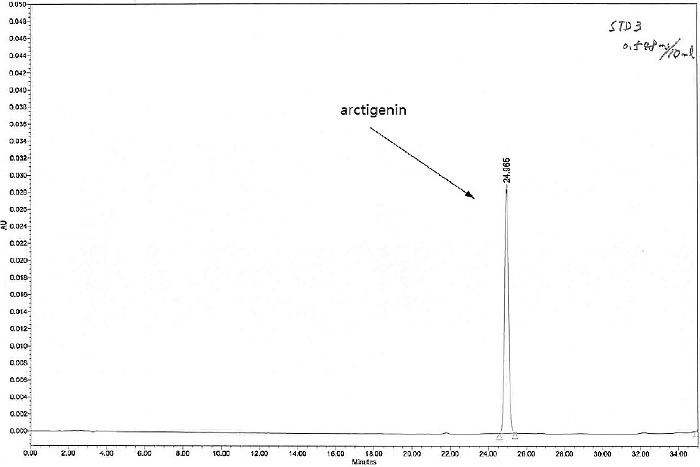
HPLC chromatogram of arctigenin.Chromatogram of 75% methanol extract of leaves of Forsythia lines is shown in Fig. 5.
의성지역 개나리 수집자원의 잎에 함유된 arctigenin 함량은 평균 4.01 ㎎/g이었으나 조사된 개별 계통들의 표준편차가 비교적 높게 나타났으며 계통별 함량 차이에 대한 통계적 유의성은 거의 나타나지 않았다. 계통별 리그난 유형은 뚜렷하게 구분되었으나 리그난 함량은 개체별 차이가 크다는 것을 알 수 있었는데, 리그난 성분의 안전성, 채취 지역이나 시기별 함량 변화, 계통 (집단) 내 이형 및 이종 개체의 혼재 확인 등에 대한 추가적인 시험이 필요한 것으로 생각된다 (Table 3).

Fruiting habits, arctigenin contents, distyly, leaf types, and stem color in Forsythia lines (n = 23) collected from Uiseong area.
총 23 개 계통 중 17 개 계통의 이형화주성은 확실하게 구분되었고 나머지는 장주화 (pin)와 단주화 (thrum)가 혼재하였으며, 줄기 색깔에서도 19 개 계통은 뚜렷이 구분되었으나 나머지는 두 가지 색깔이 동시에 존재하기도 하였다. 조사된 계통에서는 이형화주성이 장주화이고, 줄기 색깔은 녹색인 계통인 Leaf II 유형이 더 많았다.
조사된 계통의 결실 여부 및 결실량에 따라 무결실 (None), 소결실 (Low), 다결실 (High)로 구분하여 arctigenin 함량, 이형화주성, 줄기 색깔을 비교하였다 (Table 4).

Differences of arctigenin contents, distyly, leaf types, and stem color by fruit set characteristics in Forsythia lines (n = 23) collected from Uiseong area.
결실 계통 중 결실량이 다른 소결실과 다결실 계통 간 특성들은 전반적으로 비슷하였고 무결실 계통과 결실 계통 간에는 유의한 차이를 보였다. 결실 계통의 잎 함유 arctigenin 함량이 무결실 계통보다 더 높은 경향을 보였으며, 결실 계통의 이형화주성은 대부분 장주화였고 무결실 계통에서는 보통 단주화를 보였다. 줄기 색깔에서 결실 계통은 녹색이었고 무결실 계통은 갈색을 주로 나타냈다.
본 연구에서 개나리 수집자원들의 엽형은 무결실 계통인 Leaf I 유형과 결실 계통인 Leaf II 유형으로 구분할 수 있었다 (Fig. 3 – Fig. 6). 개나리속 식물의 분류연구에서 잎의 형태적 차이 이외에 개나리는 종자 (열매)를 맺지 못하는 자가불화합성이며 의성개나리는 장주화만 관찰되었지만 상당량의 종자 (열매)를 맺는 것으로 보아 자가화합성이라고 판단하기도 하였고, 의성개나리의 어린 줄기는 녹색을 띄고 개나리의 어린 줄기 (小枝)는 갈색이라고 보고하였다 (Lee, 1984). 따라서 Leaf I 유형인 개나리 (F. koreana)는 Leaf II 유형인 의성개나리 (F. viridissima)보다 잎의 arctigenin 함량이 높은 편이고, 의성개나리의 꽃은 대부분 장주화였으며 줄기는 녹색을 띄고 있는 것으로 구별할 수 있었다. 그러나 FV26은 무결실인 Leaf I 유형이면서 장주화 집단이었고, FV20, FV30-2 등 여러 개의 계통에서 장주화와 단주화, 녹색과 갈색 줄기 색깔이 혼재하기도 하였으며, 리그난 성분 조성에서도 반복 간 서로 다르게 나타난 계통 (FV 27)도 있었는데, 개별 집단 내 의성개나리와 개나리가 섞여 재식되어 있는 것으로 생각된다.
의성지역에서 수집된 23 개 계통의 잎 함유 리그난 성분, 잎의 형태적 특성, 줄기 색깔 등을 조사한 결과, 결실 습성과 이형화주성과 관련하여 Leaf I과 Leaf II 유형으로 구분할 수 있었다. Leaf I 유형을 나타낸 계통은 무결실이며 잎 모양이 타원형에 가까운 짧은 도란형이고 거치가 많으며, arctigenin 함량이 적은 경향이고 주로 단주화인 개나리 (F. koreana) 집단이었으며, Leaf II 유형을 나타낸 계통은 결실이 되며 잎 모양이 긴 도란형이고 거치가 적으며, 잎에 함유된 리그난 성분의 종류가 적은 편이고 주로 장주화인 의성개나리 (F. viridissima) 집단으로 판단할 수 있었다. 따라서 잎 모양, 리그난 성분, 줄기 색깔, 이형화주성 그리고 결실 습성을 파악하여 개나리와 의성개나리를 구분할 수 있을 것이다.
앞으로 의성개나리와 개나리, 두 종의 유전적 차이와 식물종 동정을 위한 유전 및 식물분류 측면의 분석이 필요하며, 특히 수집된 의성개나리 계통을 삽목 증식하고 후대 검정을 통한 종 동정과 결실량이 많은 계통을 선발하여 의성개나리 (연교)의 신품종을 개발하기 위한 지속적인 연구가 필요한 것으로 생각된다.
References
-
Boldizsár I, Füzfai Z, Tóth F, Sedlák É, Borsodi L and Molnár-Perl I. (2010). Mass fragmentation study of the trimethylsilyl derivatives of arctiin, matairesinoside, arctigenin, phylligenin, matairesinol, pinoresinol and methylarctigenin: Their gas and liquid chromatographic analysis in plant extracts. Journal of Chromatography A. 1217:1674-1682.
[https://doi.org/10.1016/j.chroma.2010.01.019]

- Cho HE, Ahn SY, Son IS, Hwang GH, Kim SC, Woo MH, Lee SH, Son JK, Hong JT and Moon DC. (2011). HPLC-tandem mass spectrometric analysis of the marker compounds in Forsythiae fructus and multivariate analysis. Natural Product Sciences. 17:147-159.
-
Choi YH, Kim J and Yoo KP. (2003). High performance liquid chromatography-electrospray ionization MS-MS analysis of Forsythia koreana fruits, leaves, and stems. Enhancement of the efficiency of extraction of arctigenin by use of supercritical-fluid extraction. Chromatographia. 57:73-79.
[https://doi.org/10.1007/BF02497480]

- Chung TH and Lee WC. (1962). On the Forsythia in Wui-seong. Korean Journal of Botany. 3:37-38.
-
Eom JW, Kim JH, Kim MS, Kim SW, Shin HJ, Jung HS and Sohn YJ. (2019). Forsythiae fructus extract inhibits RANKL-induced osteoclast differentiation and prevent bone loss in OVX-induced osteoporosis rat. Korean Journal of Acupuncture. 36:115-126.
[https://doi.org/10.14406/acu.2019.008]

- Han IS and Kim JG. (1999). Characteristics of flowers and flowering between distyly in Korean golden-bells(Forsythia koreana Nak.). Horticulture Environment and Biotechnology. 40:769-771.
-
Kim DK and Kim JH. (2004). Numerical taxonomy of tribe Forsythieae(Oleaceae) in Korea. Korean Journal of Plant Taxonomy. 34:189-203.
[https://doi.org/10.11110/kjpt.2004.34.3.189]

- Kim JC, Park SD, Kim JH, Park JH, Kim SJ, Kim JK, Choi BS and Kim T. (1999). New cultivar “Yeonjeong” of medicinal Forsythia. Korean Journal of Medicinal Crop Science. 7:314-315.
-
Kitagawa S, Hisada S and Nishibe S. (1984). Phenolic compounds from Forsythia leaves. Phytochemistry. 23:1635-1636.
[https://doi.org/10.1016/S0031-9422(00)83456-1]

-
Kitagawa S, Nishibe S, Benecke R and Thieme H. (1988). Phenolic compounds from Forsythia leaves. II. Chemical and Pharmaceutical Bulletin. 36:3667-3670.
[https://doi.org/10.1248/cpb.36.3667]

- Lee EB and Keum HJ. (1988). Pharmacological studies on Forsythiae fructus. Korean Journal of Pharmacognosy. 19:262-269.
-
Lee ST. (1984). A systematic study of Korean Forsythia species. Korean Journal of Plant Taxonomy. 14:87-107.
[https://doi.org/10.11110/kjpt.1984.14.2.087]

-
Milder IE, Arts IC, Venema DP, Lasaroms JJ, Wähälä K and Hollman PC. (2004). Optimization of a liquid chromatography-tandem mass spectrometry method for quantification of the plant lignans secoisolariciresinol, matairesinol, lariciresinol, and pinoresinol in foods. Journal of Agricultural and Food Chemistry. 52:4643-4651.
[https://doi.org/10.1021/jf0497556]

- Ministry of Agriculture, Food and Rural Affairs(MAFRA). (2021). Industrial crop production statistics 2020. Ministry of Agriculture, Food and Rural Affairs. Sejong, Korea. p.21-23.
- Ministry of Food and Drug Safety(MFDS). (2019). The Korean Pharmacopoeia. Ministry of Food and Drug Safety. Cheongju, Korea. p.74.
- Rho YS. (1975). Antifungal studies on components from the pericarp of Forsythia viridissima(I). Korean Journal of Pharmacognosy. 6:143-147.
- Won TH, Liao L, Lee SH, Son JK and Shin JH. (2011). Comparative analyses of bioactive constituents from Forsythia suspensa and Forsythia viridissima by HPLC-DAD. Natural Product Sciences. 17:328-336.
-
Yang SJ and Choe TB. (2011). Antioxidant activity and whitening effect of Forsythiae fructus extracts. Korean Journal of Medicinal Crop Science. 19:472-477.
[https://doi.org/10.7783/KJMCS.2011.19.6.472]