
pH 변화 및 균질화 처리에 따른 백삼 추출물의 물리화학적 특성 및 항산화활성
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The main useful components of ginseng are ginsenosides, acidic polysaccharides, and proteins. The aim of this study was to increase the extraction efficiency of thease useful components by changing the pH and homogenizing using a buffer solution.
White ginseng powder (WGP) was first extracted with a 20 fold solution of citric acid-phosphate buffer (pH 3.0, 3.5, 4.0, 4.5, and 5.0) and distilled water at 80℃ for 5 hours by stirring in 550 rpm, and then each extract was homogenized with speed (0 to 15,000 rpm) and time (0 to 25 min). Total ginsenosides, acidic polysaccharide crude protein content and transmittance of WGP extract homogenized (12,500 rpm, 15 min) at pH 4.0 - pH 4.5 were 1.07 ㎎/㎖ - 1.10 ㎎/㎖, 0.85% - 0.87%, 0.96% - 0.99% and 36.53% - 40.21%, respectively, and were increased due to pH control and homogenization treatment compared to the untreated (distilled water extraction and no homogenization). The antioxidant activity such as 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical scavenging activity, 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) radical scavenging activity, and ferric reducing/antioxidant power (FRAP) assay of the homogenized (12,500 rpm, 15 min) extract in the pH 4.0 - pH 4.5 was also increased compared to the untreated.
As a result, the extraction efficiency of useful components in White ginseng was simultaneously enhanced due to pH adjustment and homogenization treatment along with an increase in antioxidant activity.
Keywords:
White Ginseng, pH, Homogenization, Ginsenosides, Acidic Polysaccharides, Protein Content, Antioxidant Activity서 언
인삼 (Panax ginseng C. A. Meyer)은 오갈피나무과 (Araliaceae) 인삼 속 (Panax)에 속하는 다년생 초본류로서, 수천 년 동안 사용되어 온 대표적인 약용식물로서 (Son and Ryu, 2009), 현재 국내에서는 건강기능성 식품 중 매출액이 1조원이 넘는 제 1위의 자리매김을 하게 만든 작물이다 (MFDS, 2020).
그러나 인삼은 백삼이 한방의학적 산물로 이용되어왔지만 주로 홍삼 제품이 거의 90% 이상을 차지하고 있게 되는데 이는 수삼은 저장성이 떨어지는 점을 보완하기 위하여 수삼을 증숙 후 건조하여 만든 홍삼이라는 제품이 1796년부터 시작하여 1853년도에는 홍삼 제조량이 25,000 근에 이르렀다고 전해질 정도로 홍삼 제조에 초점이 이루어져 오다가, 1996년 홍삼 전매법이 폐지된 이후로 민간기업체에서도 홍삼 제품을 제조 판매하기 시작하였다 (Kwak, 2019). 이러한 결과로 국내에서 2019년도를 기준으로 홍삼을 제외한 인삼제조 품목이 356개인 반면, 홍삼 제조 품목이 3,602 개에 이를 정도로 대부분 홍삼을 이용한 제품개발에만 집중되어져 오고 있다 (MFDS, 2020).
홍삼의 경우 수삼을 증숙하는 과정에서 백삼에 함유되어있는 주된 진세노사이드인 Rg1 및 Re가 열처리에 의하여 일정량 소실됨과 동시에 진세노사이드 Rg2, Rk3 및 Rh4로 전환, 또는 진세노사이드 Rb1, Rb2, Rc 및 Rd가 진세노사이드 Rg3, Rk1 및 Rg5로 전환되어 신생사포닌을 형성한다고 보고되어지고 있다 (Oh et al., 2016; Bae et al., 2021).
또한 홍삼 내 주요성분의 추출률을 높이기 위하여 고온 및 고압의 기능을 가진 extrusion 기술을 이용하여 진세노사이드 및 산성다당체 등 수용성 물질의 추출 수율을 높이는 연구 (Han et al., 2006; Jee et al., 2006; Chang and Ng, 2009) 등 물리적 공법으로 추출 수율을 높이는 연구 등이 보고되어 있다.
그러나, 수삼, 백삼 및 홍삼 추출물에 대한 항당뇨 효과 (Kim et al., 1989), 항염증 효과 (Hyun et al., 2009), 항산화 활성 (Jeon et al., 2005), 암세포에 대한 독성 (Jung et al., 2000), 간보호 효과 (Seong et al., 2005) 등에 대한 비교 연구 결과 들을 보면 대부분 열수 추출이나 주정 추출물을 이용하여 비교 검토되고 있음을 볼 수 있다 (Nam, 1996).
또한 백삼은 홍삼과 비교하여 증숙과 건조처리와 같은 가공 공정이 없기 때문에 생체 이용률이 높은 진세노사이드 조성 및 함량의 차이, 증숙 과정에서 생기는 maltol 성분이나 갈색화 물질 등이 존재하지 않아 홍삼보다 낮은 생리활성을 가지는 부분이 있다고 보고되고 있지만 (Seong et al., 2005; Jang et al., 2016), 인삼이 가지고 있는 고유의 성분들을 그대로 포함하고 있고 기타 말로닐기 진세노사이드, arginine과 같은 유리아미노산 같은 성분들은 홍삼에 함유되어 있는 성분보다 더 많은 함량을 가지고 있기 것으로 보고되고 있어 (Oh et al., 2016; Bae et al., 2021) 백삼 및 홍삼 모두가 각각 독특한 성분 조성적 특성과 생리활성 측면에서의 장점을 가지고 있다고 생각된다.
따라서 백삼의 효율적 가치를 규명하고자 백삼에 대한 연구도 보고되고 있는데, 백삼 내 페놀산 성분의 분획 후 항산화 활성 효과 (Choi et al., 2006), 가공 방법을 따른 사포닌 및 유리당의 조성 변화 (Lee et al., 1996), 백삼 분말 압출성형물의 항산화 활성 증가 (Son and Ryu, 2009), trimetyltin으로 유도된 기억장애 휜쥐에서 백삼 분말의 신경보호 효과 (Lee et al., 2011), 백삼의 초고압 추출과 폴리올 추출에 의한 항염증 효과 및 항노화 효과 (Hong and Lyu, 2019), 백삼 추출물 조제에 의한 인지능 개선 효과 증진 (Lee et al., 2016) 등의 연구를 볼 수 있다.
인삼은 대부분의 제품이 추출액 유형의 제품이 가장 비중을 많이 차지하고 있으며 (Park et al., 2007; MFDS, 2020), 이러한 추출액은 대부분 열수 추출과 주정 추출을 중심으로 이루어지고 있다. 또한 연구에 있어서도 인삼의 유효성분인 사포닌을 효율적으로 추출할 수 있는 주정을 이용한 추출 방법에 대한 연구가 많이 이루어져 있는 실정이다 (Choi et al., 2016).
따라서, 인삼의 기능성 효과를 구명하기 위하여 각 용매별 분획물에 의한 기능성 효과를 보고 가장 효과 있는 분획물에 대하여 기능성 물질을 찾는 연구도 있지만 대부분 백삼이나 홍삼 추출물을 가지고 기능성 효과를 보는 연구들은 대부분 열수 추출이나 주정 농도별 추출을 하여 그 기능성을 보고 있다 (Choi et al., 1983; Jin et al., 2015; Lee et al., 2016).
이러한 인삼의 유효성분에 관한 효율적인 추출 방법에 관한 연구는 사포닌 뿐만 아니라 비사포닌 계열의 유효성분 추출에 관한 연구로 확대되고 있는 바, 백삼이나 홍삼의 주정 추출박으로부터 산성다당체 등을 추출하여 주정 추출액과 혼합하여 품질을 향상시키고자 하는 연구 (Kang, 2001; Choi et al., 2016; Lee et al., 2016)와 인삼 내 비사포닌 성분들에 대한 연구 (Choi et al., 1985; Kwak and Kim, 1996; Kwak et al., 2005; Yang et al., 2006)도 보고되고 있어 사포닌 외에 비사포닌 계열의 유용성 물질을 함께 추출하는 방법이 필요하다고 생각된다.
본 연구에서는 백삼의 이용가치를 향상시키기 위하여 분말 형태로 시료에 buffer를 이용하여 pH별로 추출한 후 균질화 처리할 경우 추출 시 소요되는 시간을 줄이는 반면에 진세노사이드 이외에 산성다당체나 단백질의 추출 효율을 동시에 높이고자 하였다.
재료 및 방법
1. 시험 재료
실험에 사용된 백삼 (P. ginseng C. A. Meyer) 시료는 충청남도농업기술원 인삼약초연구소에서 재배한 4년근 수삼을 2019년 10월에 수확하여 세척, 동결건조 및 분쇄 과정을 거쳐 분말 형태로 가공한 것을 사용하였다.
2. pH 및 균질화 처리조건에 의한 백삼 추출물의 조제
0.01 M citric acid-phosphate buffer를 이용하여 pH를 3.0, 3.5, 4.0, 4.5 및 5.0으로 조제한 후 백삼 분말 10 g에 20 배량을 가하여 1차적으로 80℃에서 5 시간 동안 550 rpm의 속도로 교반하여 1차 추출액으로 제조하였으며, 대조구로는 pH 조절 없이 1차 증류수를 만을 이용하여 추출한 추출액을 비교하였다.
서로 다른 pH를 가지는 buffer를 이용하여 제조한 1차 추출액을 대상으로 하여 균질화 처리가 추출물에 특성에 미치는 효과를 검정하기 위하여 1차 추출액에 서로 다른 균질속도와 균질시간을 적용하였으며 균질화 처리는 homogenizer (POLYTRON SYSTEM PT3100D, Kinematica. AG. Luzern, Swiss)를 이용하였고 균질속도는 0, 5,000, 7,500, 10,000, 12,500 및 15,000 rpm으로, 균질시간은 0, 5, 10, 15, 20 및 25 분으로 균질 처리하고 하룻밤 동안 정치한 후 상등액을 회수한 시료를 균질화 추출액으로 사용하였다.
3. 색도 및 투과도 측정
증류수 및 pH별로 추출한 1차 추출액 및 균질화 처리조건을 달리한 균질화 추출액의 색도 및 투과도는 색차계 (CM-3600d, Konica Minolta Inc., Osaka, Japan)를 이용하여 L값 (lightness), a값 (redness) 및 b값 (yellowness)으로 색도를 측정하였고, 균질화 처리조건에 따라 무처리에 대한 시료의 색도 변화는 dL, da, db 및 dE*ab (delta-E) 값으로 측정하였으며, 또 균질화처리에 따른 투과도는 660 ㎚에서 측정하여 1차 추출액 및 균질화 추출액의 투과도를 비교하였다.
4. 진세노사이드 함량 측정
증류수 및 pH별로 추출한 1차 추출액 및 균질화 처리조건을 달리한 균질화 추출액에서의 진세노사이드 함량을 비교 검정하기 위하여 각 추출액 10 ㎖에 HPLC용 메탄올 10 ㎖를 가하여 충분히 혼합한 후 산성다당체를 침전시키고 다시 상등액을 각각 membrane filter (0.20 ㎛ pore size, Whatman Co., Kent, UK)로 여과한 후, HPLC (Agilent 1200, Agilent technologies Inc., Santa Clara, CA, USA)에 10 ㎕씩 주입하여 진세노사이드를 분석하였다.
분석에 사용한 칼럼은 YMC Pro C18 RS (YMC Co., Ltd., Kyoto, Japan)이었으며, 검출기는 DAD detector (at 203㎚, Agilent 1200, Agilent technologies Inc., Santa Clara, CA, USA)를 이용하여 분석하였고, 분석조건은 이동상으로 용매 A (water)와 용매 B (acetonitrile)를 사용하였으며 용매 B를 0분 (20%), 10분 (20%), 25분 (24%), 30분 (33%), 42분 (37%), 57분 (80%), 58분 (100%), 68분 (60%), 70분 (20%)의 조건으로 조정하였고 유속은 1.0 ㎖/min으로 고정하여 사용하였다.
진세노사이드 표준시약으로는 백삼에서 많이 검출되는 Rg1을 포함하여 Rb1, Rb2, Rb3, Rc, Rd, Re, Rf 및 Rg2(Chengdu Biopurify Biochemicals Ltd., Chengdu, Sichuan, China) 등 9 종의 진세노사이드를 이용하였다 (Jo et al., 2011).
5. 산성다당체 함량 측정
산성다당체 함량 측정은 carbazole-sulfuric acid 방법으로 측정하였다 (Kwak and Kim, 1996).
즉, 각 1차 추출액 및 균질화 추출액에 증류수를 가하여 50배로 희석시킨 용액 0.5 ㎖에 carbazole (0.1% in ethanol) 0.25 ㎖을 가해 잘 혼합하고, 진한 황산 3 ㎖을 가하였다. 수욕 상에서 85℃에서, 5 분간 가열한 다음 상온에서 15 분동안 방냉한 후 UV/Vis-spectrophotomether (X-ma 1200, Human Co., Ltd., Seoul, Korea)를 이용하여 525 ㎚에서 흡광도를 측정하여 함량을 결정하였다. 이때 blank는 carbazole 대신 ethanol을 사용하였다.
6. 단백질 함량 측정
pH별로 추출한 1차 추출액 및 균질화 추출액에 대한 단백질 함량은 Lowry법 (Lowry et al., 1951; 22. Yang et al., 2006)에 준하여 측정하였다.
즉, 1차 추출액 및 균질화 추출액 0.5 ㎖에 0.5%의 CuSO4·5H2O와 1% Na3C6H5O7·2H2O가 함유된 용액과 0.1M NaOH에 2% Na2CO3가 함유된 용액을 1 : 50의 비율로 혼합 제조한 혼합액을 2.5 ㎖을 가하고 잘 혼화시킨 다음 실온에서 10 분간 방치하였다. 다시 이 혼합액에 1 N의 Folin-ciocalteu 시약 0.25 ㎖를 가하여 혼화시킨 다음 UV/Vis-spectrophotomether (X-ma 1200, Human Co., Ltd., Seoul, Korea)를 이용하여 750 ㎚에서 흡광도를 측정하여 단백질 함량을 측정하였다. 이때 단백질 정량을 위한 표준품으로는 bovine serum albumin을 이용하여 5 ㎍/㎖ - 100 ㎍/㎖의 농도로 조제한 후 검량선을 작성하여 시료 추출액의 단백질량을 측정하였다.
7. DPPH radical 소거능 측정
pH별로 추출한 1차 추출액 및 균질화 추출액의 2,2-dipheny-1-picryl hydrazyl (DPPH) 라디칼 소거능은 DPPH free radical 소거법을 변형하여 측정하였다 (Brand-Williams et al., 1995).
1.5 × 10-4 M의 DPPH 용액 1 ㎖에 pH별로 추출한 1차 추출액 및 균질화 추출액을 0.01 ㎖의 액량 구배 기준으로 비첨가에서부터 1 ㎖까지 첨가하여 30 분간 방치한 후 517 ㎚에서 흡광도를 측정하여 초기 흡광도의 값에서 50%를 감소시키는데 필요한 추출액량으로 RC50을 구하여 추출액 사이의 DPPH radical 소거능을 비교하였다.
8. ABTS radical 소거능 측정
ABTS [2,2-azino-bis-(3-ethylbenzo-thiazoline-6-sulfonic acid)] radical 소거능은 ABTS radical cation decolorization 분석법을 이용하여 측정하였다 (Re et al., 1999).
즉, 7.4 mM ABTS 용액과 2.6 mM potassium persulfate (Daejung, Siheung, Korea)을 1 : 1 (v/v)로 혼합하여 실온의 암소에서 15 시간 방치하여 양이온 (ABTS․+)을 형성시킨 다음, 732 ㎚에서 흡광도가 1.0 이하가 되도록 phosphate saline buffer (PBS, pH 7.4)을 이용하여 희석한 것을 측정용 시약으로 이용하였다.
희석된 ABTS․+용액 1 ㎖에 각 조건별로 추출한 1차 추출액 및 균질화 추출액을 0.01 ㎖의 액량 구배 기준으로 비 첨가에서부터 1 ㎖까지 첨가하여 30 분간 방치한 후 732 ㎚에서 흡광도를 측정하여 초기 흡광도의 값에서 50%를 감소시키는데 필요한 추출액량으로 RC50을 구하여 추출액 사이의 ABTS radical 소거능을 비교하였다.
9. Ferric reducing antioxidant power (FRAP) 측정
FRAP법에 의한 항산화활성은 Benizie와 Strain (1996)의 방법에 따라 pH 3.6의 0.3 M acetate buffer, 0.04 M HCl에 용해한 10 mM 2,4,6-tripyridyl-s-triazine (TPTZ) 용액 및 0.02 M FeCl3·6H2O를 각각 10 : 1 : 1 (v/v/v)의 비율로 미리 혼합한 후 37℃의 수용액에서 5 분 동안 가온한 다음 FRAP 측정용 기질로 사용하였다.
FRAP용액 2 ㎖에 각 조건별로 추출한 백삼 추출물 0.5 ㎖ 및 증류수 2.5 ㎖을 가한 후 30℃의 항온기에서 10 분간 반응시킨 후 593 ㎚서 흡광도를 측정하였다. 추출액에 대한 환원력은 FeSO4·7H2O 시약을 이용하여 0.00 mM - 1.25 mM 범위의 표준액에 대한 흡광도를 측정하여 검량곡선을 만든 후 각 추출액의 흡광도를 FeSO4·7H2O μM로 환산한 값으로 환원력을 나타내었다.
10. 통계분석
본 실험에서 얻어진 결과는 자료 처리는 SAS EG (SAS Institute Inc., Cary, NC, USA) 프로그램을 이용하여 각 측정군의 평균과 표준편차를 산출하고, 5%과 1% 수준에서 Duncan’s Multiple Range Test (DMRT)로 유의성을 검정하였으며 (p < 0.05과 p < 0.01), 상관관계는 Pearson의 적률 상관계수 (Pearson’s correlation coefficient)를 이용하여 유의성을 표기하였다.
결과 및 고찰
1. pH 처리별에 따른 백삼 추출물의 색도 및 투과도
서로 다른 pH를 가지는 buffer를 이용하여 제조한 1차 추출액에 대한 색도 및 투과도는 Table 1과 같다.
백삼 (P. ginseng C. A. Meyer)의 유효성분인 사포닌을 포함하여 산성다당체 및 단백질의 추출효율을 높이기 위하여 추출액을 pH를 달리하여 추출한 결과, pH 4.0의 buffer로 추출하였을 경우 L 값이 가장 낮았고 a 값과 b 값이 가장 높게 나타남을 볼 수 있었으며, pH 5.0의 buffer로 추출한 경우는 증류수로 추출한 액과 색도가 거의 비슷한 결과를 보여주었으며 투과도도 유의적인 차이가 크게 나지 않았음을 확인할 수 있었다 (Fig. 1).

Color and turbidity of White ginseng extracts treated under different pH conditions.(A); Stirrer (550 rpm) extraction with added 20 fold of distilled water (DW) and 0.01 M citric acid-phosphate buffer from pH 3.0 to pH 5.0 for 5 hours at 80℃. (B); Extracts before and after homogenization treatment to White ginseng extracts under different pH conditions. 1)H; homogenized for 15 min at 12,500 rpm. 2)None-H; not homogenized.
이는 buffer로 pH를 달리하여 백삼을 추출할 경우 대조구인 증류수로 추출하였을 경우보다 백삼 내 산성다당체와 같은 유용물질이 pH가 낮은 조건에서 용출되는 특성이 있으므로 (Cavdaroglu and Yemenicioglu, 2022) pH 조절 및 가열 처리에 의한 추출액에서 이러한 산성다당체가 탁도에 영향을 끼치는 것으로 생각되어진다. 이러한 결과는 Kim 등 (1995)이 보고한 바에 의하면 년근이 증가할수록 인삼 내 조단백질 및 산성다당체 등의 함량이 높아져서 추출액으로 제조하였을 경우 탁도가 증가한다고 보고한 것과 일치하는 경향을 보여주었다. 이와 같이 pH 처리에 따른 추출액의 현탁도의 차이가 나타나는 것은 추출액 내에 가지는 단백질과 인삼 중에 함유되어 있는 산성다당체 및 진세노사이드 등이 추출 시 가교결합을 하여 탁도가 형성되어 유화현상이 나타남을 볼 수 있었고 이는 산도가 높아지면 유화안정성이 저하된다고 보고한 것 (Baik et al., 2005; You et al., 2017)등을 보면 인삼 내 유효성분을 추출할 때 산성다당체와 단백질을 동시에 추출하고자 할 경우에는 pH 조절이 중요할 것으로 판단된다.
2. pH 처리별에 따른 백삼 추출물의 총사포닌, 산당체 및 조단백질 함량
서로 다른 pH를 가지는 buffer를 이용하여 제조한 1차 추출액를 대상으로 사포닌을 포함한 산성다당체 및 조단백질의 함량을 측정한 결과 총 진세노사이드함량은 pH 4.5에서, 산성다당체 함량은 pH 4.0 - pH 4.5에서, 조단백질 함량은 pH 4.0에서 가장 많은 함량을 보여 각각 20 배 추출액에 1.068 ㎎/㎖, 0.81% 및 0.84%를 함유하고 있음을 보여주었다 (Fig. 2).
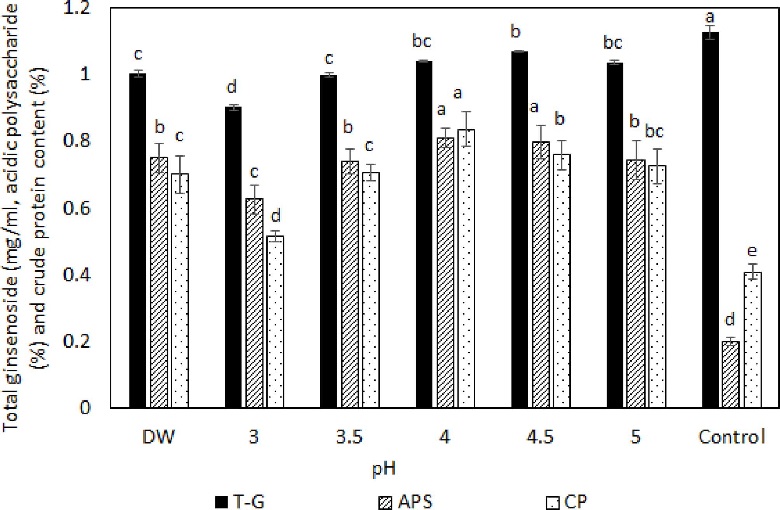
Total ginsenoside, acidic polysaccharide and crude protein content of White ginseng extracts under different pH conditions.Stirrer (550 rpm) extraction with added 20 fold of distilled water (DW) and 0.01 M citric acid-phosphate buffer from pH 3.0 to pH 5.0 for 5 hours at 80 ℃. Control; extracted with 50% ethanol at same condition. T - G; total ginsenoside content, ASP; acidic polysaccharide content, CP; crude protein content of extracts extracted by 20 times, respectively. Each value presents the means ± SD (n = 3), *Means within a row followed by the different letters indicate a significant difference by Duncan’s Multiple Range Test (DMRT) (p < 0.05).
이는 일반적으로 증류수로 추출한 경우와 비교할 경우 총 진세노사이드, 산당체 및 조단백질 함량이 각각 1.00 ㎎/㎖, 0.75% 및 0.70%보다 높게 추출됨을 볼 수 있었으며 산도가 가장 낮게 추출한 pH 3.0에서의 추출액에서는 3 종의 유효성분 모두 가장 낮은 추출률을 보여주었다. 또한 사포닌 추출에 많이 애용되고 있는 주정 추출을 대조하기 위하여 50% 주정 추출을 같은 조건으로 추출하여 비교한 결과 사포닌은 1.125 ± 0.004 ㎎/㎖, 산성다당체는 0.201 ± 0.014% 및 조단백질은 0.409 ± 0.024%의 함량을 보였다.
총 진세노사이드 함량은 증류수 및 pH 조절에 의한 추출보다 높았으나 산성다당체 및 조단백질 함량은 훨씬 낮은 함량을 보였다. 일반적으로 인삼은 열수 추출이나 주정 추출을 하게 되는데 이 때, 주정 추출을 하게 되면 지용성 물질의 추출 효율은 높아지나 (Choi et al., 1983) 기타 산성다당체와 같은 물질은 추출액에 함께 추출되어져 나오지 않기 때문에 (Lee and Do, 2002; Choi and Hwang, 2011) 여러 가지 유효물질을 동시에 추출하는 효율은 낮아지는 결과를 가져온다.
따라서 본 실험에서 추출 시 pH를 달리하여 추출하여 본 결과 pH에 따라 사포닌을 포함한 산당체 및 조단백질의 함량에 차이가 나는 것을 볼 수 있었으며 주정 추출에 의한 것이 총 진세노사이드 추출은 우수한 결과를 보여주었으나 산성다당체 및 조단백질 함량은 추출 효율이 낮음을 나타내는 경향을 보여주어 pH 처리에 의하여 추출함으로서 총 진세노사이드 추출은 다소 낮은 추출율을 보여주었으나 산성다당체 및 조단백질 성분의 추출은 효율적임을 볼 수 있었다.
3. 균질화 처리에 따른 백삼 추출물의 이화학적 특성
서로 다른 pH를 가지는 buffer를 이용하여 제조한 백삼의 1차 추출액 중 일반적인 증류수로 추출한 시료 (DW) 보다 총 진세노사이드, 산성다당체 및 조단백질 함량이 높았던 처리구인 pH 4.0과 pH 4.5의 백삼 1차 추출액을 대상으로 균질화 속도를 달리하여 10 분간 처리하여 얻어진 균질화 추출액에 대하여 이화학적 특성을 분석한 결과, 총 진세노사이드 함량은 pH 4.5 백삼 1차 추출액에서 균질화 속도 7,500 rpm 까지는 함량이 약간 증가하는 경향이었지만 균질화 속도 처리에 따른 유의적인 차이는 보이지 않았고, pH 4.0 백삼 1차 추출액에서는 균질화 속도 12,500 rpm까지 증가하는 경향을 보이다가 균질화 속도 15,000 rpm에서는 약간 감소하는 경향을 보였다.
산성다당체 함량은 균질화 속도 처리 유무에 따라 그 함량에 유의적인 차이를 보였으며 pH 4.0과 4.5 처리구에서 7,500 rpm 이상의 속도로 10 분간 처리함으로서 함량이 증가하는 것을 볼 수 있었다.
조단백질 함량은 pH 4.0의 백삼 1차 추출액은 균질 처리에 의하여 추출 함량이 높아지는 경향을 보였으며 12,500 rpm 처리 시 추출 함량이 가장 높아지는 것을 볼 수 있었다. 또 투과도는 1차 추출 처리 시 pH의 영향을 많이 받는 것을 볼 수 있었으며, pH 4.0과 pH 4.5 백삼 1차 추출액에서 12,500 rpm 이상 처리 시 가장 낮은 값을 보였다 (Fig. 3).
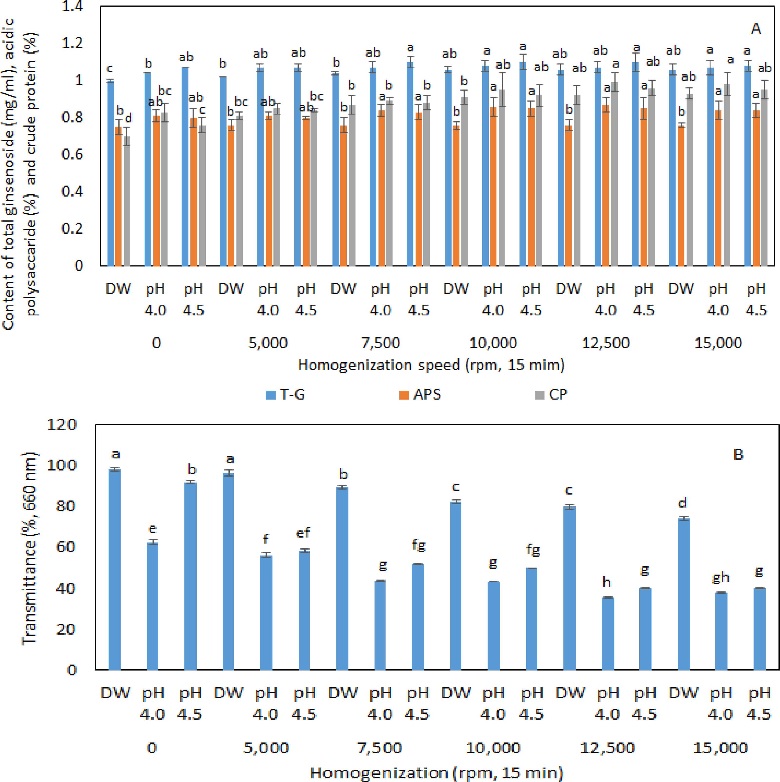
Total ginsenoside, acidic polysaccharide, crude protein content (A) and transmittance (B) of White ginseng extract according to the homogenization speed.DW, pH 4.0 and pH 4.5 were extracted by stirrer (550 rpm) with added 20 fold of distilled water and 0.01 M citric acid-phosphate buffer pH 4.0 and pH 4.5 before homogenization. T - G; total ginsenoside content (㎎/㎖), ASP; acidic polysaccharide content (%), CP; crude protein content of extracts extracted by 20 times (%), TM; Transmittance at 660 ㎚ (%). Mean value ± SD from triplicate separated experiments are shown (n = 3). *Means within a row followed by different letters indicate a significant difference by Duncan’s Multiple Range Test (DMRT) (p < 0.05).
Cavdaroglu와 Yemenicioglu (2022)에 의하면 산성다당체와 단백질의 함량에 차이로 의하여 에멀젼이 생기는 정도가 달라 투과도에 차이를 보인다고 한 결과와 같이 본 연구에서도 pH 처리와 균질화 처리에 의하여 조단백질 함량이 높아지는 것을 볼 수 있었으며, 또 산성다당체와 조단백질이 균질화 처리에 의하여 추출 시 에멀젼이 형성되어 탁도가 높아진다는 것을 투과도가 낮아지는 결과로 확인하였다. 또 1차적으로 80℃에서 550 rpm으로 stirring하여 추출한 백삼 1차 추출액의 경우 산도가 낮을수록 탁도가 증가하는 것을 볼 수 있었으며 (Fig. 1) 백삼 1차 추출액을 균질화한 경우도 pH 4.0 및 4.5에서 탁도가 증가하여 에멀젼이 형성되는 것을 볼 수 있었다.
각 pH 처리 별로 추출한 백삼 1차 추출액을 대상으로 균질화 속도를 달리하여 10 분간 처리하여 얻어진 균질화 추출액을 대상으로 총 진세노사이드, 산성다당체 및 조단백질 함량과 투과도에 대한 상관관계를 분석해본 결과 유용성분의 함량과 투과도가 상관관계로 나타남을 볼 수 있었으며 특히 투과도에 더 밀접한 상관관계를 보였고, 대조구인 증류수로만 추출한 액에서는 균질화 속도가 모든 유용성분 추출에 더욱 높은 상관관계를 나타내었으며 pH 4.5에서는 특히 조단백질 함량에 대하여 높은 상관관계 (r = 0.97, p < 0.01)를 나타내었고 조단백질 함량과 투과도가 밀접한 관계를 나타내고 있음을 확인하였다 (Table 2).
pH 4.0과 pH 4.5의 백삼 1차 추출액을 대상으로 균질화 속도를 달리하여 10 분간 처리하여 얻어진 균질화 추출액 중 유의적으로 총 진세노사이드, 산성다당체 및 조단백질 함량이 높았던 12,500 rpm의 균질화 속도에서 균질화 시간을 달리하여 추출한 추출액에 대하여 이화학적 특성을 분석한 결과, 균질화 처리 시간이 15 분 이상에서는 모든 함량 및 투과도에 유의적인 차이를 나타내지 않고 있어 12,500 rpm에서 15 분 정도의 균질 처리로 백삼 내의 총 진세노사이드 및 기타 성분들이 거의 추출되어짐을 확인하였다 (Fig. 4).
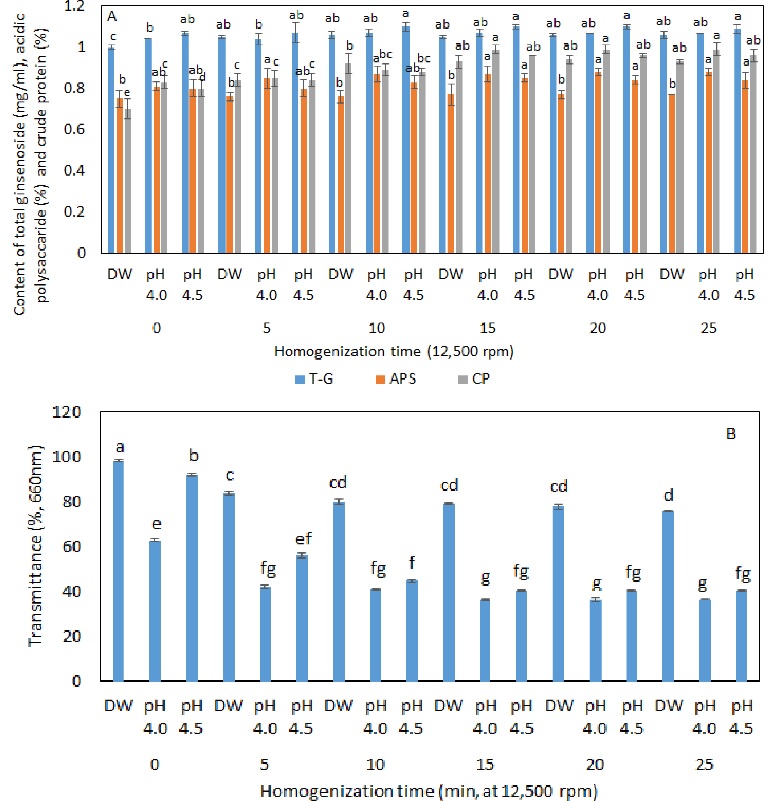
Total ginsenoside, acidic polysaccharide, crude protein content (A) and transmittance (B) of White ginseng extract according to the homogenization time.DW, pH 4.0 and pH 4.5 were extracted by stirrer (550 rpm) with added 20 fold of distilled water and 0.01 M citric acid-phosphate buffer pH 4.0 and pH 4.5 before homogenization. T - G; total ginsenoside content (㎎/㎖), ASP; acidic polysaccharide content (%), CP; crude protein content of extracts extracted (%), TM; Transmittance at 660 ㎚ (%). Mean value ± SD from triplicate separated experiments are shown (n = 3). *Means within a row followed by different letters indicate a significant difference by Duncan’s Multiple Range Test (DMRT) (p < 0.05).
또, 12,500 rpm의 균질화 속도에서 균질화 처리 시간에 따른 유용성분과 투과도에 대한 상관관계를 본 결과, 증류수 추출액에서는 균질화 시간에 따라 총 진세노사이드 및 조단백질 함량에 밀접한 상관관계를 보였으며 탁도에는 산성다당체와 조단백질 함량이 상관관계를 보여주었다. 따라서 pH 처리에 관계없이 조단백질 함량에 가장 밀접한 관계 (r = 0.93 - r = 0.95, p < 0.01)를 보였고, 산성다당체와 투과도에 밀접한 관계 (r = 0.98 - r = 0.99, p < 0.01)를 보여주었다 (Table 3). pH 4.0과 pH 4.5의 백삼 1차 추출액에서는 균질화 처리 시간과 조단백질 함량에 밀접한 관계를 보였고 특히 pH 4.5의 백삼 1차 추출액에서는 탁도가 산성다당체 뿐만(r = 0.99, p < 0.01)이 아니라 조단백질 함량에도 밀접한 관계(r = 0.94, p < 0.01)를 보였다.
4. pH 및 균질화 처리에 의한 백삼 추출물의 진세노사이드 조성 및 함량 비교
Buffer를 이용하여 pH별로 제조한 백삼의 1차 추출액을 대상으로 최적화된 균질화 속도와 시간 (12,500 rpm, 15 min)을 적용하여 얻어진 백삼 추출액에 대한 진세노사이드 조성 및 함량을 분석한 결과 진세노사이드의 종류에 따라 함량이 미미하게 차이가 나는 것을 볼 수 있었다.
백삼에서 ginsnoside Rb1, Rg1, Re 및 Rc가 주로 많이 함유되어있는데 pH 및 최적화된 균질화 처리조건에 의해 더 많이 추출되어지는 진세노사이드는 사포닌 구조에 당이 많이 붙어있는 것을 특징을 가진 Rb1과 Rc로 나타났다. Kim 등 (2011)에 의하면 홍삼에 malic acid를 0.1 M를 첨가하여 추출하는 경우 triol계 사포닌인 Rb1, Rg2, Rf 및 Rg3 등이 더 높은 수준으로 추출되었다고 보고한 것과 비슷한 경향을 보여 사포닌 구조에 따라 pH 변화가 유용성분 추출에 영향을 끼치는 것을 확인할 수 있었다 (Table 4).
5. pH 및 균질화 처리에 의한 백삼 추출물의 항산화활성
Buffer를 이용하여 pH별로 제조한 백삼의 1차 추출액의 경우 pH의 변화 없이 증류수로 추출한 추출액과 비교하여, DPPH 및 ABTS 라디칼 50% 감소시키는 데 요구되는 양이 절반 이하로 감소하여 라디칼 소거활성이 증가된 것을 확인할 수 있었으며 FRAP 활성도 증가되는 것을 확인하였다. 또 최적화된 균질화 속도와 시간 (12,500 rpm, 15 min)을 적용하는 경우 pH의 변화 없이 증류수로 추출한 추출액에서도 균질화 처리에 의해서 항산화 활성이 증가되는 것을 확인할 수 있었을 뿐 아니라 서로 다른 pH를 가지는 buffer를 이용하여 제조한 백삼의 1차 추출액을 대상으로 최적화된 균질화 속도와 시간 (12,500 rpm, 15 min)을 적용하는 경우 더 유의적인 차이로 항산화 활성이 증가되는 결과를 나타내었다.
DPPH라디칼 소거능은 pH 4.0과 pH 4.5의 백삼 1차 추출액에 최적화된 균질화 속도와 시간 (12,500 rpm, 15 min)을 적용하는 경우 항산화 활성이 유의적인 증가하였고, ABTS 라디칼 활성은 pH 4.0의 백삼 1차 추출액에 균질화 처리를 하는 것보다 pH의 변화 없이 증류수 추출한 추출액에 균질화 처리를 하는 것과 pH 4.5의 백삼 1차 추출액에 균질화 처리를 하는 경우 활성이 유의적으로 증가하였다. 또한 FRAP의 경우 pH 4.0의 백삼 1차 추출액에 균질화 처리를 하는 것에서 유의적으로 활성이 증가하는 것을 확인할 수 있었다 (Table 5).
이상의 결과를 통하여 pH 조절 및 균질화 처리를 적절히 할 경우 백삼이 가지고 있는 항산화 활성을 향상되어짐을 확인하였으며 또한 추출되는 유용물질인 진세노사이드, 산당체 및 조단백질도 그 함량이 증대됨을 확인할 수 있었다 (Fig. 1, Fig. 2 and Fig. 3).
반면 대부분 항산화 활성의 증대는 추출물이 가지고 있는 총 폴리페놀 함량과 총 플라보노이드 함량과 연관성을 나타낸다고 보고되어지고 있어 (Decker, 1995.; Urquiaga and Leighton, 2000; Choi et al., 2006; Son and Ryu, 2009; Dai and Mumpe, 2010) 향후 이러한 pH 조절 및 균질화 처리에 따른 총 폴리페놀 함량과 총 플라보노이드 함량의 변화를 확인할 필요성이 있다고 생각되어지며, 특히 산성다당체의 경우 면역 활성과 같은 기능성을 주로 나타내고 있어 ( Kim et al., 1997; Park et al., 2000; Park et al., 2001) 앞으로 이러한 pH 조절 및 균질화 처리에 의해 추출된 추출물에 대한 항염 활성 등을 검정할 필요가 있을 것으로 생각된다.
Acknowledgments
본 연구는 농촌진흥청 지역농업 연구기반 고도화 사업 (과제번호: PJ016151)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Bae BS, Lee MW, Lee JS, Park CS and Han MW. (2021). Comparison of the constituents of processed Korean and American ginseng grown in Korean for six years. Korean Journal of Medicinal Crop Science. 29:35-44.
[https://doi.org/10.7783/KJMCS.2021.29.1.35]

- Baik EK, Seo YK, Lee G, Lee DU, Park SJ, Lee JH, Lee KP, Kim DS, Hur NY and Baik MY. (2005). Quality factor determination and shelf prediction of emulsified ginseng drink. Korean Journal of Food Science and Technology. 37:597-602.
-
Benzie IF and Strain JJ. (1996). The ferric reducing ability of plasma(FRAP) as a measure of “antioxidant powder”: The FRAP assay. Analytical Biochemistry. 239:70-76.
[https://doi.org/10.1006/abio.1996.0292]

-
Brand-Williams W, Cuvelier ME and Berset C. (1995). Use of a free radical method to evaluate antioxidant activity. LWT-Food Science Technology. 28:25-30.
[https://doi.org/10.1016/S0023-6438(95)80008-5]

-
Cavdaroglu E and Yemenicioglu A. (2022). Utilization of stalk waste separated during processing of sun-dried figs(Ficus carca) as a source of pectin: Extraction and determination of molecular and functional properties. LWT-food Science and Technology. 154:112624. https://www.sciencedirect.com/science/article/pii/S0023643821017771, (cited by 2022 Jan 3).
[https://doi.org/10.1016/j.lwt.2021.112624]

-
Chang YH and Ng PKW. (2009). Effects of extrusion process variables on extractable ginsenosides in Wheat-Ginseng extrudates. Journal of Agricultural and Food Chemistry. 57:2356-2362.
[https://doi.org/10.1021/jf8031827]

- Choi C, Yoon SH, Bae MJ and An BJ. (1985). Proteins and amino acid composition of Korean ginseng classified by years. Korean Journal of Food Science and Technology. 17:1-4.
-
Choi CS, Kim KI , Hong HD, Choi SY, Lee YC, Kim KT, Rho JH, Kim SS and Kim YC. (2006). Phenolic acid composition and antioxidative activity of White ginseng(Panax ginseng C. A. Meyer). Journal of Ginseng Research. 30:22-30.
[https://doi.org/10.5142/JGR.2006.30.1.022]

-
Choi JW, Oh MJ, Ha SK, Park YK and Park HY. (2016). Characterization and optimization for beverage manufacture using Korean red ginseng extract. Korean Journal of Food Preservation. 23: 319-325.
[https://doi.org/10.11002/kjfp.2016.23.3.319]

- Choi KJ, Kim MW, Hong SK and Kim DH. (1983). Effect of solvents on the yield, brown color intensity, UV absorbance, reducing and antioxidant activities of extracts from White and Red ginseng. Journal of Korean Agricultural Chemistry Society. 26:8-18.
- Choi YJ and Hwang KH. (2011). Analysis of the extraction condition of soluble acidic polysaccharides from ginseng marc. Korean Journal of Pharmacognosy. 42:82-88.
-
Dai J and Mumper RJ. (2010). Plant phenolics: Extraction, analysis, and their antioxidant and anticancer properties. Molecules. 15:7313-7352. https://www.mdpi.com/1420-3049/15/10/7313, (cited by 2022 Jan 3).
[https://doi.org/10.3390/molecules15107313]

-
Decker EA. (1995). The role of phenolics, conjugated linoleic acid, carnosine, and Pyrroloquinoline quinone as nonessential dietary antioxidants. Nutrition Reviews. 53:49-58.
[https://doi.org/10.1111/j.1753-4887.1995.tb01502.x]

-
Han JY, Kim MH, Tie J, Solihin BW and Ryu GH. (2006). Extrusion of ginseng root in twin screw extruder: Pretreatment for hydrolysis and saccharification of ginseng extrudate. Journal of Food Science and Nutrition. 11:318-322.
[https://doi.org/10.3746/jfn.2006.11.4.318]

- Hong CE and Lyu SY. (2019). Effects of three Korean white ginseng extracts on atopic dermatitis-related cytokines, and antioxidant and anti-aging activities. Korean Journal of Pharmacognosy. 50:102-111.
-
Hyun MS, Hur JM, Shin YS, Song BJ, Mun YJ and Woo WH. (2009). Comparison study of White ginseng, Red ginseng, and fermented Red ginseng on the protective effect of LPS-induced inflammation in RAW264.7 cells. Journal of Applied Biological Chemistry. 52:21-27.
[https://doi.org/10.3839/jabc.2009.004]

-
Jang AY, Sueng YC and Ji JG. (2016). The comparative study on physiological activity of White ginseng, Red ginseng and blank ginseng extract. Journal of Digital Convergence. 14:459-471.
[https://doi.org/10.14400/JDC.2016.14.5.459]

- Jee HK, Cho YJ, Kim CT, Jang YS and Kim CJ. (2006). Increase of solubility of ginseng radix by extrusion cooking. Korean Journal of Food Science and Technology. 38:361-368.
-
Jeon BH, Seong GS, Chun SG, Sung JH and Chang CC. (2005). Antioxidative effects of White ginseng and Red ginseng on liver of high fat diet-treated mice. Journal of Ginseng Research. 29:138-144.
[https://doi.org/10.5142/JGR.2005.29.3.138]

-
Jin Y, Kim YJ, Jeon JN, Wang C, Min JW, Noh HY and Yang DC. (2015). Effect of White, Red and Black ginseng on physicochemical properties and ginsenosides. Plant Foods Human Nutrition. 70:141-145.
[https://doi.org/10.1007/s11130-015-0470-0]

- Jo HK, Sung MC and Ko SK. (2011). The comparison of ginseng prosapogenin composition and contents in Red and Black ginseng. Korean Journal of Pharmacognosy. 42:361-365.
- Jung NP, Song SO and Choi SU. (2000). Cytotoxicity of White and Red ginseng against cancer cells and their effects on the cell cycle. Journal of Ginseng Research. 24:183-187.
- Kang TH. (2001). Preparation of ginseng extract rich in acidic polysaccharide from ginseng marc produce after extraction with 50% ethyl alcohol. MS Thesis. Seoul National University. p.13-37.
- Kim DC, Chang SM and Choi J. (1995). Variation of effective constituents contents, physical properties and color intensities of extracts from White ginseng roots of different cultivating years. Agricultural Chemistry and Biotechnology. 38:67-71.
- Kim KH, Jung IS, Chung HY and Yun YS. (1997). Preclinical evaluation of polysaccharides extracted from Korean red-ginseng as an antineoplastic immunostimulator. Korean Journal of Ginseng Science. 21:78-84.
-
Kim MH, Lee YC, Choi SY, Cho CW, Rho JH and Lee KW. (2011). The changes of ginsenoside patterns in Red ginseng processed by organic acid impregnation pretreatment. Journal of Ginseng Research. 35:497-503.
[https://doi.org/10.5142/jgr.2011.35.4.497]

- Kim US, Koh HK and Kang SK. (1989). Study of the effects of different products of ginseng radix aqua-acupuncture on the alloxan-induced diabetic rats. Journal of Korean Acupuncture and Moxibustion Society. 6:1-13.
- Kwak YS and Kim EM. (1996). The physicochemical properties of crude polysaccharide fraction isolated from Korean ginseng (Panax ginseng C. A. Meyer). Korean Journal of Food Science and Technology. 28:389-392.
-
Kwak YS, Shin HJ, Song YB, Kyung JS, Wee JJ and Park JD. (2005). Effect of oral administration of Red ginseng acidic polysaccharide(RGAP) on the tumor growth inhibition. Journal of Ginseng Research. 29:176-181.
[https://doi.org/10.5142/JGR.2005.29.4.176]

- Lee BY, Kim EJ, Park DJ, Hong SI and Chun HS. (1996). Composition of saponin and free sugar of some White ginsengs with processing conditions. Korean Journal of Food Science and Technology. 28:922-927.
-
Lee JW and Do JH. (2002). Extraction condition of acidic polysaccharide from Korean red ginseng marc. Journal of Ginseng Research. 26:202-205.
[https://doi.org/10.5142/JGR.2002.26.4.202]

-
Lee SE, Kim GS, Lee DY, Kim HD, Lee JW, Lee YS, Park CG and Ahn YS. (2016). Study on White ginseng extract preparation for cognition improvement. Korean Journal of Medicinal Crop Science. 24:375-385.
[https://doi.org/10.7783/KJMCS.2016.24.5.375]

-
Lee SE, Shim IS, Kim GS, Yim SV, Park HJ, Shim HS, Ye MS and Kim SY. (2011). The neuroprotective effect of White ginseng(Panax ginseng C. A. Meyer) on the trimetyltin(TMT)-induced memory deficit rats. Korean Journal of Medicinal Crop Science. 19:456-463.
[https://doi.org/10.7783/KJMCS.2011.19.6.456]

-
Lowry OH, Rosebrough NJ, Farr AL and Randall. (1951). Protein measurement with the folin-phenol reagent. Journal of Biological Chemistry. 193:265-275.
[https://doi.org/10.1016/S0021-9258(19)52451-6]

- Ministry of Food and Drug Safety(MFDS). (2020). 2020 Food and Drug statistical year book. Ministry of Food and Drug Safety. Cheongju, Korea. p.108-109.
- Nam KY. (1996). The new Korean ginseng(constituent and its pharmacological efficacy. Korea Ginseng and Tabacco Research Institute. Daejeon, Korea. p.225-252.
- Oh MH, Park YS, Lee H, Kim NY, Jang YB, Park JH, Kwak JY, Park YS, Park JD and Pyo MK. (2016). Comparison of physicochemical properties and malonyl ginsenoside contents between White and Red ginseng. Korean Journal of Pharmacognosy. 47:84-91.
- Park CK, Kwak YS, Hwang MS, Kim SC and Do JH. (2007). Current status of ginseng(Red ginseng) products in market of health functional food. The Korean Ginseng Research and Industry. 1:9-16.
- Park KM, Jeong TC, Kim YS, Shin HJ, Nam KY and Park JD. (2000). Immunomodulatory effect of acidic polysaccharide fraction from Korean red ginseng(Panax ginseng). Natural Product Science. 6:31-35.
-
Park KM, Kim YS, Jeong TC, Joe CO, Shin HJ, Lee YH, Nam KY and Park JD. (2001). Nitric oxide is involved in the immunomodulating activities of acidic polysaccharide from Panax ginseng. Plant Medicine. 67:122-126.
[https://doi.org/10.1055/s-2001-11508]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M and Rice-Evans C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine. 26:1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Seong GS, Chun SG and Chang CC. (2005). Hepatoprotective effects of White and Red ginseng extracts on acetaminophen induced hepatotoxicity in mice. Journal of Ginseng Research. 29:131-137.
[https://doi.org/10.5142/JGR.2005.29.3.131]

-
Son HJ and Ryu GH. (2009). Chemical compositions and antioxidant activity of extract from a extruded White ginseng. Journal of the Korean Society of Food Science Nutrition. 38:946-950.
[https://doi.org/10.3746/jkfn.2009.38.7.946]

-
Urquiaga I and Leighton F. (2000). Plant polyphenol antioxidants and oxidative stress. Biology Research. 33:55-64.
[https://doi.org/10.4067/S0716-97602000000200004]

- Yang BW, Im BO and Ko SK. (2006). Comparison of non-saponin composition and contents in fresh ginseng roots cultivated in different areas and at various ages. Yakhak Hoeji. 50:215-219.
- You KM, Jang HH, Lee ES, Lee KT and Hong ST. (2017). Emulsifying properties of concentrated Red ginseng extract: Influence of concentration, pH, NaCl. Journal of Oil and Applied Science. 34:504-515.
