
지황 종자의 형태 및 발아 특성
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study was conducted to determine the effect of temperature, light, hormones, and after-ripening treatment on Rehmannia glutinosa seed germination to provide valuable information for its breeding and cultivation.
The seeds used in this study were harvested from the ‘Jihwang-1-ho’ cultivar. The seed length and width were 1.13 ± 0.03 ㎜ and 0.86 ± 0.02 ㎜, respectively, with a seed coat characterized by polygonal cells. The germination efficiency was evaluated at various temperatures (15, 20, 25, and 30℃) and light conditions (light/dark). The optimal germination condition was found to be 25℃ with light (91% germination). Pre-soaking the seeds with gibberellic acid (GA3) increased germination, and the highest germination (72%) was observed with 1,000 ㎎/ℓ GA3. Additionally, this also increased the mean germination time , germination uniformity, and germination index. The seeds that matured at 45% and 70% relative humidity showed the highest germination rates at 32 and 24 weeks, respectively.
The best method for R. glutinosa seed germination is maintaining 25℃ under light conditions with after-ripening treatment for over 16 weeks. Pre-soaking the seeds in 1,000 ㎎/ℓ GA3 for 24 h further improved their germination. Rehmannia glutinosa seeds were classified under non-deep physiological dormancy.
Keywords:
Rehmannia glutinosa, Seed, Morphological Characteristics, Germination, Dormancy서 언
지황 [Rehmannia glutinosa (Gaertn.) Libosch. ex Steud.]은 국내 연간 생산량이 2000년 598 톤에서 2020년에는 1,005 톤으로 크게 증가할 정도로 주요 약용작물 중 하나이다 (MAFRA, 2021). 지황은 전통적으로 현삼과 (Scrophulariaceae)에 속하는 중국 특산식물이며, 중국에 총 6 종의 분류군이 분포하는 것으로 알려져 있다 (Hong et al., 1998).
우리나라에서는 조선왕조실록에 지황 재배에 관련하여 기록되어 있을 정도로 오래전부터 전통적으로 재배해 온 한약재로 이용 시 지하경 (일반적으로 뿌리로 지칭)을 가공하지 않은 생지황, 건조한 건지황, 쪄서 말린 숙지황으로 구분한다 (Chang et al., 2011). 최근 건강기능식품의 관심이 높아지면서 지황의 기능성에 관한 연구가 다양하게 이루어지고 있어 (Huang et al., 2016; Li et al., 2017) 향후 국내 건강기능식품 개발 및 원료 사용의 증가가 기대되는 작물이다.
지황은 일반적으로 지하경을 나누는 영양번식 방법으로 증식하기 때문에 주로 지하경 출아 조건 연구 (Lee et al., 2019a), 재배 생리 (Lee et al., 2019b), 수확물 저장 및 가공 (Lee et al., 2018, Kim et al., 2020) 등의 연구가 활발하게 이루어지고 있으나 종자의 발아 조건에 관한 연구는 부족한 실정이다.
Park 등 (1999)은 피막 처리된 지황 종자의 발아 연구를 수행한 바 있으나, 종자의 발아 온도 정도만 연구하여 지황 종자 발아의 전반적인 특성을 알기에는 한계가 있었다. 한편 지황 지하경을 통한 영양번식 방법은 증식 배율이 낮아 품종의 농가 보급 속도가 늦으므로, 향후 순계 육성을 통한 품종의 개발이 필요한 실정이며, 신품종 육성 및 육묘, 재배를 위해서는 종자 발아특성 등 기초 연구가 필요하다.
따라서 본 연구에서는 지황 종자의 외부 형태 및 종자 발아 특성 연구와 온도, 광, 호르몬, 후숙 처리가 발아율 향상에 미치는 영향을 연구하여 지황 육종, 재배 분야 등에 기초자료를 제공하고자 수행하였다.
재료 및 방법
1. 실험재료
실험에 사용된 종자는 충청북도 음성군에 위치한 국립원예특작과학원 약용작물과 시험포장에서 재배한 ‘지황1호’ (R. glutinosa ‘Jihwang-1-ho’) 종자를 채종하여 사용하였으며, 종자 기본 특성조사와 종자발아시험은 2018년 7월 24일 채종 종자를 이용하였고, GA3처리 및 후숙처리가 발아에 미치는 영향은 2019년 7월 30일 채종 종자를 사용하였다. 기본 특성조사를 위한 재료는 채종한 종자를 잘 건조한 후 사용하였고, 초기 발아율은 채종한 종자를 바로 이용하였다.
2. 종자 기본 특성 조사
지황 [Rehmannia glutinosa (Gaertn.) Libosch. ex Steud.] 종자 외부 형태 특성조사를 위하여 채종한 종자를 무작위로 20 립씩 3 반복으로 선발한 후 실측현미경 (SZ61, Olympus Co., Ltd., Tokyo, Japan) DP-manager program을 이용해 종자 형태, 크기, 색 등의 형질을 측정하였다. 천립중은 각각의 종자 1,000 립의 무게를 전자저울로 측정하여 3 반복 평균값을 적용하였다.
미세형질 관찰은 완전히 건조된 시료를 gold-palladium으로 2 분간 이온 증착을 하여 (Ion-Sputter, MC 1000, Hitachi Ltd., Tokyo, Japan) 코팅 후, 주사전자현미경 (Scanning Electron Microscope; SEM, SU-3500, Hitachi Ltd., Tokyo, Japan)을 이용하여 관찰하였다.
종자 수분흡수율은 지황 종자 1 g을 2.0 ㎖의 마이크로튜브에 넣고 1 차 증류수에 침지하여 실온에 보관하였다. 이후 24 시간 간격으로 종자를 꺼내어 필터페이퍼 (Whatman No. 2, Whatman, London, England)로 종피의 수분을 제거하여 무게 측정 후 다시 새 증류수로 침지하였으며, 7 일간 조사하였다 (Cho and Lee, 2016).
(Ws: 종자 수분 흡수율, Wn: 침수일별 종자 무게, Wi: 초기 종자 무게)
3. 종자 발아시험
온도 및 광조건에 따른 종자 발아 실험은 채종한 종자를 정선하여 후숙 처리를 위해 알루미늄 종자 봉투에 약 6 개월 정도 실온 저장한 후 사용하였다.
발아 실험에 사용한 종자는 실험 전 소독제 500 ㎎/ℓ (Benomyl, FarmHannong, Seoul, Korea)에 30 분간 침지 후 증류수로 3 회 이상 수세한 후 사용하였다. 종자 치상은 50 립씩 3 반복 무작위로 추출하여 90 ㎜ × 15 ㎜ 페트리디시에 여과지 (Whatman No. 2, Whatman, London, England) 2 장을 깔고 증류수 약 7 ㎖를 첨가하였고, 명조건 (광 12 시간/암 12 시간), 암조건, 온도별로 생장상에서 (Multi Room Incubator, Vision Scientific Ltd., Bucheon, Korea) 임의배치하여 처리하였다.
발아 기준은 유근이 1 ㎜ 이상 돌출되었을 때를 기준으로 하였고, 1 일 간격으로 총 14 일간 조사하였다.
4. GA3처리 및 후숙처리가 발아에 미치는 영향
GA3 처리는 농도별로 24 시간 동안 침지하였으며, 25 ± 1℃, 명조건에서 발아율을 조사하였다. 후숙처리 (after-ripening)는 채종한 종자를 빛이 통과하지 않는 종이봉투에 넣은 후 25 ± 1℃에서 상대습도 0%, 45%, 70%의 3 가지 조건으로 보관하였으며 (DS-55GP, Dasol, Seoul, Korea), 채종 즉시 초기 발아율을 조사하였고, 이후 2, 4, 8, 16, 24, 32, 40, 48 주에 종자 발아율을 조사하였으며, 그 이외에는 상기 방법과 동일하게 진행하였다.
5. 발아 특성 조사
발아 특성 조사는 최종 발아율 (GP), 평균발아일수 (MT), 발아균일도 (GU), 발아지수 (GI), RLG (relative light germination, ΔGlight) 등을 분석하였다.
(N: 총 발아수, Tx: 치상 후 조사일수, Nx: 조사 당일의 발아수, S: 총 공시 종자 수, Glight: 광발아율, Gdark: 암발아율)
6. 통계처리
실험결과는 SAS Enterprise Guide 4.2 (Statistical Analysis System, 2009, Cray, NC, USA)로 분석하였고, 3 반복으로 측정한 결과값을 평균치 ±표준편차 (means ± SD)로 나타내었다. 시료 간의 유의적인 차이는 Duncan’s Multiple Range Test (DMRT)로 유의수준 5%에서 검증하였다 (p < 0.05).
결과 및 고찰
1. 종자 외부형태 특성
지황 [Rehmannia glutinosa (Gaertn.) Libosch. ex Steud.] 종자의 형태 특성 관찰 결과 크기는 길이 1.13 ± 0.03 ㎜, 너비 0.86 ± 0.02 ㎜로 측정되었으며, 길이/너비의 비율은 1.35 ± 0.11를 나타내었다. 천립중은 101.4 ± 5.3 ㎎으로 크기가 매우 작은 미세 종자로 확인되었으며, 기존 연구 결과 (Park et al., 1999)와 유사하였다 (Table 1).
종자의 외부 형태는 종피 색깔로 갈색을 띄었으며, 모양은 난형에서 타원형으로 다양하게 나타났다. 종자 표면은 독특한 구조를 관찰할 수 있었는데 다각형으로 이루어진 그물모양의 격벽 형태 (grid wall) 부속물이 존재하였고, 격벽에는 작은 유두상의 돌기가 분포하고 있었다 (Fig. 1).
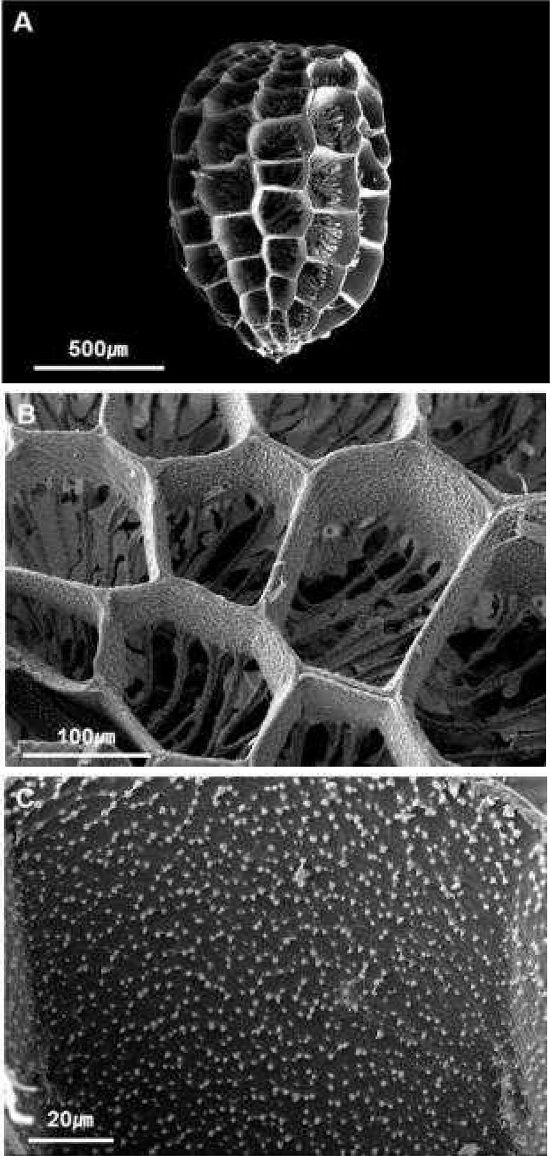
Scanning electron microscope micrographs of R. glutinosa seed.A, seed characteristics; B, grid wall of seed coat; C, surface of grid wall. Bar = 500 ㎛ for A, 100 ㎛ for B, 20 ㎛ for C.
종자의 크기, 형태, 종피의 구조는 종자의 산포와 관련될 수 있는데 지황의 작은 종자 크기와 종피의 구조는 종자가 바람이나 물에 의해 멀리까지 산포할 수 있는 방법으로 진화한 결과물 중 하나이다. 지황과 유사한 종피 구조를 가지고 있는 열당과 (Orobanchaceae) 분류군의 종자 형태 연구에서 Pedicuralis 속 등 몇몇 분류군에서 종자의 표피세포가 다각형 능각을 형성하는 그물구조의 형태를 이루었는데, 이러한 종피의 형태는 종자가 물에 떠서 멀리까지 이동할 수 있는데 적합한 구조라고 보고한 바 있으며 (Dong et al., 2015), 이를 바탕으로 볼 때 지황의 종자 형태도 물에 의해 멀리 산포할 수 있는 구조로 진화한 것으로 생각된다.
Li 등 (2018)은 주사전자현미경 (Scanning Electron Microscope, SEM) 관찰을 통한 중국 지황 품종 연구에서 종자의 특성을 품종 간 구분할 수 있는 주요 형질로 언급하였는데, 연구 결과에 나타난 종자의 모양, 종피 구조 등 품종 내에서 나타나는 특징과 본 연구 결과가 일치하였으며, 향후 국내 육성된 지황 품종에 관한 연구 시 종자 특성이 품종을 구분할 수 있는 주요 특징으로 활용될 수 있을 것으로 판단된다.
지황 종자의 물리적 휴면 여부를 확인하기 위해 침지 기간에 따른 종자의 수분함량을 조사한 결과, 처음 수분함량은 4.8%를 나타내었다 침지한 후 1 일 (24 시간) 만에 62.5%의 수준에 도달하였고 이후 유의적인 차이는 없었다.
종자 수분 흡수율에 관한 선행 연구에서 각시괴물나무의 경우 종자수분 흡수율이 48 시간 후 최종 수분 흡수율은 49.2%를 나타내었으며 (Park et al., 2019), 끈끈이주걱의 경우 24 시간 이후 75.0% 이상을 나타내어 (Cho and Lee, 2016) 물리적 휴면이 없는 종자로 구분하였으며, 지황도 유사한 결과를 보여 종피에 의한 수분 흡수 장해요인이 없는 것으로 판단되었다 (Table 2).
2. 종자 발아 특성
지황 종자의 최적 발아 조건 구명을 위한 실험에서 온도와 광조건에 따라 발아율의 차이가 명확했다. 명반응에서 온도에 따른 발아율은 15℃에서 20.7%, 20℃에서 89.3%, 25℃에서 91.3%를 나타내었고 30℃에서는 실험 기간 동안 발아가 되지 않았다.
암반응에서 온도에 따른 발아율은 15℃에서 16.7%, 20℃에서 44.7%, 25℃에서 70.0%, 30℃에서는 명반응과 마찬가지로 발아하지 않았으나 명조건이 암조건에 비해 전체적으로 높은 발아율을 나타냈다. 명조건 20℃와 25℃에서 가장 높은 발아율을 기록했으며, 두 처리 간 통계적 유의성이 없었으나 25℃에서 91.0%의 가장 높은 발아율을 보였다 (Fig. 2).
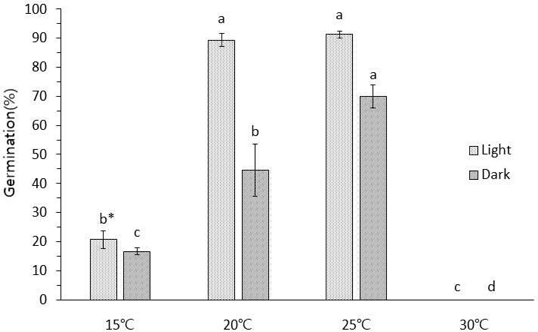
Effect of temperature and light on germination percentage of R. glutinosa.Each value is means ± SD from triplicate separated experiments. *Means with difference letters in column are significantly different at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05).
Park 등 (1999)은 피막 처리된 지황 종자의 발아 연구에서 광조건 언급 없이 지황 종자의 발아율이 15℃에서는 발아가 되지 않고, 30℃에서 당년에 채종한 종자가 29.1%의 가장 높은 발아율을 나타냈다고 발표하였으나, 본 연구에서는 30℃에서 발아가 되지 않는 상이한 결과가 나타났다.
종자 발아는 채종 환경, 저장 온도, 품종 차이 등에 따라 다양하게 나타날 수 있으며, 실험 조건 및 기기 등으로 인한 영향도 있을 수 있다. 기존 연구에서는 이러한 실험 환경 및 조건을 정확하게 명시하지 않아 본 연구 결과를 바탕으로 차이를 추정하기는 어렵다. 따라서 정확한 발아적온을 확인하기 위해 종자다온도발아기 (thermogradient table) 등을 통한 정밀한 추가 실험이 필요할 것으로 사료된다.
RLG (relative light germination, ΔGlight) 지수는 종자가 발아할 때 명발아 대비 암발아의 비율을 수치로 나타낸 값으로, 명발아 종자는 0부터 +100% 사이의 값이 위치하고, 암발아 종자는 0부터 -100%의 값에 위치한다 (Saatkamp et al., 2011). 지황의 경우 발아율이 가장 높은 25℃의 조건에서 RLG (ΔGlight) 값은 13.26 ± 1.16%로 종자 발아에 빛이 필요한 광발아성 종자로 확인되었다 (Table 3).
휴면이 없는 식물들의 종자 (non-dormant seeds)는 명조건과 암조건에서 모두 발아가 잘 되며, 이들 중 많은 수가 암조건 보다 명조건에서 발아율이 높은 경향을 보인다. 또한 발아에 빛이 필요한 종은 겨울에 낮은 온도에 노출된 후 봄에 발아하거나, 가을에 발아하는 종의 경우 여름의 높은 온도에 노출되는 경향이 있다 (Baskin and Baskin, 1998).
지황은 중국에 자생하는 식물로 정확한 생육 특성을 알기는 어려우나 국내에서 재배되고 있는 지황의 생육 특성을 살펴보면 보통 5월에서 7월까지 열매를 맺은 후 8 월경에 포장에 떨어져 산포하며, 9월에서 10월경 어린 유묘를 확인할 수 있는 점과 본 실험 결과에서 명발아가 암발아보다 약 13% 정도 발아율이 높아 명발아 종자이나, 명/암조건에서 발아율이 크게 차이 나지 않는 점 등을 미루어볼 때 지황은 휴면이 거의 없는 종자 특성을 갖는 것으로 판단된다.
GA3처리로 인한 지황 종자는 발아율 (GP), 평균발아일수 (MT) 등 여러 실험 결과가 농도에 비례하여 증가했다. 발아율 (GP)의 경우 무처리가 26.0 ± 6.0%로 가장 낮았으며, GA3 처리 농도에 따라, 0 ㎎/ℓ, 10 ㎎/ℓ, 100 ㎎/ℓ, 1,000 ㎎/ℓ를 처리한 경우 각각 47%, 45%, 57%, 73%를 나타내어 GA3의 농도가 높아질수록 발아율이 점점 높아지는 경향을 나타내었으나 GA3 0 ㎎/ℓ와 GA3 10 ㎎/ℓ의 처리에서 발아율의 차이는 통계적으로 유의성이 없었다 (Table 4 and Fig. 3).
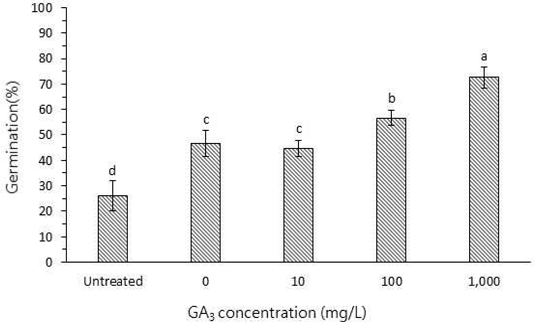
Effect of GA3 on germination percentage in Rehmannia glutinosa.Each value is means ± SD from triplicate separated experiments. *Means with difference letters in column are significantly different at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05).
GA3 0 ㎎/ℓ가 무처리에 비해 발아율이 높았는데 그 원인은 24 시간 침지 효과로 인해 무처리에 비해 종피 내 수분 흡수가 잘 이루어졌기 때문으로 판단되었다. 따라서 GA3 10 ㎎/ℓ의 농도는 지황 발아율에 영향을 주지 않는 것으로 확인되었으며, 가장 높은 농도인 GA3 1,000 ㎎/ℓ 처리에서는 72.7 ± 4.2%로 다른 농도와 비교하여 통계적으로 유의하게 가장 높은 발아율을 보였다.
평균발아일수 (MGT)는 발아한 모든 종자의 평균적인 발아 일수로 무처리가 6.9 ± 1.1 일로 가장 길었으며, GA3 1,000 ㎎/ℓ의 경우 3.6 ± 0.2 일로 다른 처리와 비교하여 통계적으로 유의하게 가장 짧은 일수를 나타냈다. 발아 속도를 지수로 표시한 발아지수 (GI) 역시 마찬가지로 무처리가 2.5 ± 0.8로 가장 작았고, GA3 1,000 ㎎/ℓ 처리가 11.2 ± 1.1로 가장 높았다. 발아균일도 (GU)는 발아의 균일성을 나타낸 수로 균일도가 최고일 경우 -1.0이며, 수치가 높을수록 균일도가 감소하는데 무처리 9.7 ± 1.8에 비해 GA3 1,000 ㎎/ℓ를 처리한 경우가 0.9 ± 0.5로 가장 높았다 (Table 4).
결론적으로 GA3를 1,000 ㎎/ℓ 수준으로 전처리하는 경우 지황 종자 발아율을 무처리에 비해 46.7% 수준으로 향상시켰고, 평균발아일수 (MGT)는 3.3 일 단축시켰으며, 발아지수 (GI), 발아균일도 (GU) 향상에도 효과적이었다.
GA3 처리는 종자발아 촉진 또는 휴면타파에 많이 이용되는 방법 중 하나이다 (Mello et al., 2009; Lee et al., 2015; Cho et al., 2016). Baskin과 Baskin (2004)은 종자의 휴면을 생리적 휴면 (physiological dormancy, PD), 형태적 휴면 (morphological dormancy, MD), 형태·생리적 휴면 (morphophysiological dormancy, MPD), 물리적 휴면 (physical dormancy, PY), 조합 휴면 (combinational dormancy, PY + PD)으로 구분하였는데, PD를 갖는 종자들은 대부분 ABA (abscisic acid)와 GA의 균형에 의해 발아가 조절된다고 하였다.
또한 PD는 휴면 정도에 따라 낮은 생리적 휴면 (non-deep PD), 중간 생리적 휴면 (intermediate PD), 깊은 생리적 휴면 (deep PD)으로 나누는데 일반적으로 낮은 생리적 휴면의 경우 GA처리로 대부분 휴면이 쉽게 타파된다 (Baskin and Baskin, 1998; White et al., 2000).
본 연구에서 GA3 처리가 발아율과 발아일수 등을 향상시키는데 효과적으로 작용했으며, 낮은 생리적 휴면 종자로 구분할 수 있었다. 이러한 결과는 Ryu 등 (2016)이 제비동자꽃 종자를 대상으로 GA3를 처리하여 종자 발아에 미치는 영향을 조사한 연구에서 GA3를 1,000 ㎎/ℓ의 수준으로 24 시간동안 처리하는 경우 제비동자꽃 종자의 발아율을 증가하고 평균 발아일수를 감소시킬 수 있으며 이를 통해 제비동자꽃이 낮은 생리적 휴면을 갖는 종자로 구분한 연구와 유사하였다.
지황 종자 습도별 후숙 처리 기간에 따른 발아 변화 연구를 위하여 2019년 7월 채종한 종자를 상대습도를 0%, 45%, 70%의 3 가지 조건으로 2, 4, 8, 16, 24, 32, 40, 48 주의 후숙 처리 기간 나누어 종자 발아율을 조사하였다.
상대습도의 모든 조건에서 24 주 까지는 후숙 처리 기간이 경과함에 따라 종자 발아율이 모두 향상되었다. 0%의 상대습도 조건에서는 처음 26.0 ± 6.0%였으나 후숙 처리 기간이 32 주를 경과한 후 발아율은 74.7 ± 11.0%로 증가하였으며, 상대습도 0% 습도 조건에서 통계적으로 유의하게 가장 높은 발아율을 나타내었다. 상대습도 45%에서도 0%와 마찬가지로 32 주 후에 80.0 ± 4.0%로 기간 내에 가장 높은 발아율을 나타내었다. 상대습도 70%의 경우 24 주 경과 후에 73.3 ± 14.0%로 가장 단기간에 최고 발아율을 보였으며 16 주에서 40 주까지 유의적인 차이는 없었다. 3 가지의 상대습도 조건 모두에서 최고의 발아율을 나타낸 이후에는 후숙 처리 기간이 증가하여도 통계적으로 차이 없이 발아율이 유지되었다 (Table 5 and Fig. 4).
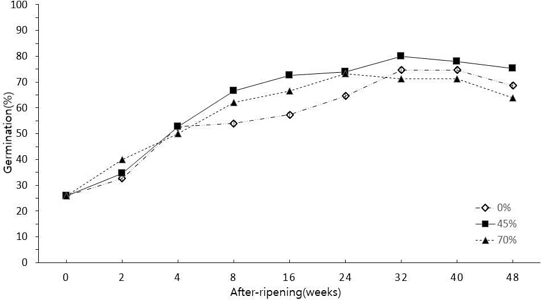
Germination percentage of after-ripening period over a range of relative humidity in R. glutinosa.Each value is means from triplicate separated experiments.
Park 등 (1999)은 1 년 동안 후숙한 지황 종자가 발아율 높아 휴면 현상이 있음을 시사하였는데 본 연구에서 상대습도에 따른 지황 종자의 후숙 최적 시기를 명확히 하였다.
후숙은 갓 수확한 종자를 건조 저장하여 휴면타파 하는데 사용하는 일반적인 방법이며, 종자의 성숙도가 비슷하게 하여 발아율과 속도 및 종자 수명을 좋게 만든다고 알려져 있다 (William and Gerhard, 2006; Chae et al., 2012).
종자 후숙에 미치는 습도의 영향에 관한 선행 연구에서 Baldos와 DeFrank (2014)는 Heteropogon contortus 종자를 상대습도 12%의 낮은 습도에서 후숙 처리할 경우 종자 발아율이 가장 높으며 상대습도 75%에서 종자를 후숙 처리할 경우 종자의 활력 손실이 가장 크다고 보고한 바 있다.
Quail과 Carter (1969)는 Avena ludoviciana와 A. fatua 종자의 후숙과 생존력에 대한 온도와 상대습도의 영향연구에서 고온 (25℃, 30℃, 35℃)에서 상대습도 90%에 저장된 종자는 상대습도 43%에서 저장 종자보다 더 빨리 후숙되었다고 하였다. 또한 Baskin과 Baskin (1979)는 Draba verna의 종자를 후숙 처리하는 경우 70%, 80%, 90%의 높은 상대습도 조건하에서 후숙처리를 실시하는 것이 0%, 10%, 20%의 낮은 상대습도의 조건보다 발아율이 높다고 보고하였다.
선행 연구결과에 따르면 종자의 후숙과 관련된 상대습도의 조건은 작물별로 다양하게 나타났으며, 지황의 경우 45% 상대습도 조건에서는 약 32 주 후숙하는 것이 발아율을 가장 높이는 처리 방법으로 나타났다.
그러나 일반적으로 종자는 고온과 높은 상대습도에서 저장하면 빠르게 생존력을 잃고 저온과 낮은 상대습도에서 저장하면 장기적 생존하는 것으로 알려져 있다 (Pritchard and Dickie, 2003). 따라서 장기저장이 필요할 경우 습도가 낮은 조건에서 저장할 필요가 있을 것으로 판단되며 향후 추가적인 저장실험이 필요하다고 생각된다.
한편 종자 발아시험과 GA3 및 후숙처리가 발아에 미치는 영향 실험에 사용한 종자는 재료 및 방법에 상술하였다시피 채종시기가 다르며 이에 따라 최고 발아율은 다소 차이가 있었다. 이는 2019년에 채종한 종자와 달리 2018년에 채종한 종자는 채종 직전 2 주 간의 상당히 낮은 강수량과 2018년 당시 고온으로 인한 폭염 피해가 영향을 끼친 것으로 보이며 (RDA, 2019), 이에 따라 추후에 종자 성숙과 기후환경에 따른 종자 성숙도에 따른 추가 연구 또한 필요하다.
본 연구는 지황 종자의 외부 형태적 특성과 종자 발아에 영향을 미치는 온도, 광, 호르몬, 후숙 처리를 통해 종자 발아의 특성을 파악하고자 수행하였다. 연구 결과를 종합하면 지황은 길이 1.13 ± 0.03 ㎜, 너비 0.86 ± 0.02 ㎜의 매우 작은 미세 종자로, 종피에 다각형의 격벽이 존재하는 독특한 구조를 가지고 있었다. 수분 흡수율은 종자를 침지한지 1 일 이후 62.5%였으며, 물리적 휴면은 없는 것으로 확인되었다.
또한 70%의 상대습도에서 16 주 이상 후숙 처리 후 광조건 25℃에서 지황 발아가 가장 좋았으며, 후숙 처리를 하지 않을 경우 GA3를 1,000 ㎎/ℓ의 수준으로 24 시간 침지하여 발아율을 크게 향상시킬 수 있음을 확인하였다.
지황 종자가 GA3에 의해 발아가 촉진되고, 건조 저장 시 후숙 처리가 되는 점 등의 특징을 비추어 볼 때 낮은 생리적 휴면을 갖는 종자로 구분할 수 있는 것이 확인되었다. 한편 본 실험에서는 GA3를 1,000 ㎎/ℓ의 수준까지 발아율이 높아졌으며 향후 더 높은 GA3처리에 대한 실험 결과가 필요하다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: PJ01491401)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Baldos OC, DeFrank J, Kramer M and Sakamoto GS. (2014). Storage humidity and temperature affect dormancy loss and viability of Tanglehead(Heteropogon contortus) seeds. Hort-Science. 49:1328-1334.
[https://doi.org/10.21273/HORTSCI.49.10.1328]

- Baskin CC and Baskin JM. (1998). Seeds: Ecology, biogeography, and evolution of dormancy and germination. Academic Press. San Diago. CA, USA. p.13-16.
-
Baskin JM and Baskin CC. (1979). Effect of relative humidity on afterripening and viability in seed of the winter annual Draba verna. Botanical Gazette. 140:284-287.
[https://doi.org/10.1086/337087]

-
Baskin JM and Baskin CC. (2004). A classification system for seed dormancy. Seed Science Research. 14:1. https://www.cambridge.org/core/journals/seed-science-research/article/classification-system-forseeddormancy/024181C2EEE1FC55B9D7578660A5CB66, (cited by 2022 April 12).
[https://doi.org/10.1079/SSR2003150]

- Chae JC, Park SJ, Kang BH and Kim SH. (2012). Principles of cultivation. IX. Hyangmunsa. Seoul, Korea. p.281.
-
Chang JP, Kil GJ, Lee GH, Ji YS, Kim BR, Kang KH, Kim MR, Song MR, Park JY and Doh ES. (2011). Change of inorganic component, reducing sugar, catalpol and benzo[α] pyrene contents of Rehmannia glutinosa Libosch. var. purpurea Makino by drying methods. Korean Journal of Medicinal Crop Science. 19:501-507.
[https://doi.org/10.7783/KJMCS.2011.19.6.501]

-
Cho JS and Lee CH. (2016). Dormancy and germination characteristics of round-leaved Sundew(Drosera rotundifolia L.) seeds native to Korea. Korean Journal of Plant Resources. 29:564-573.
[https://doi.org/10.7732/kjpr.2016.29.5.564]

-
Dong LN, Wang H, Wortley AH, Li DZ, Lu L. (2015). Fruit and seed morphology in some representative genera of tribe Rhinantheae sensu lato(Orobanchaceae) and related taxa. Plant Systematics and Evolution. 301:479-500.
[https://doi.org/10.1007/s00606-014-1087-8]

- Hong DY , Yang HB and CL Chin. (1998). Rehmannia. In Wu ZY et al. (ed.). Flora of China. Science Press and Missouri Botanical Garden Press. Beijing and St. Louis, China and USA. p.53-55.
-
Huang Y, Qin T, Huang Y, Liu Z, Bo R, Hu Y, Liu J, Wu Y and Wang D. (2016). Rehmannia glutinosa polysaccharide liposome as a novel strategy for stimulating an efficient immune response and their effects on dendritic cells. International Journal of Nanomedicine. 11:6795-6808.
[https://doi.org/10.2147/IJN.S119108]

-
Kim YJ, Ma KH, Han JW, Lee SH, Chang JK and Han SH. (2020). Quality characteristics of Rehmannia glutinosa dried at different drying temperature. Korean Journal of Food Preservation. 27:17-24.
[https://doi.org/10.11002/kjfp.2020.27.1.17]

-
Lee SH, Hong CO, Lee SH, Koo SC, Hur M, Lee WM, Chang JK and Han JW. (2019b). Investigation of rhizome enlargement stage and harvest time in Rehmannia glutinosa(Gaertn.) Libosch. ex Steud. Korean Journal of Medicinal Crop Science. 27:315-321.
[https://doi.org/10.7783/KJMCS.2019.27.5.315]

-
Lee SH, Kang SU, Lee SH, Koo SC, Hur M, Jin MR, Lee WM, Park MS, Kim YB and Han JW. (2019a). Appropriateness evaluation of plug seedling cultivation for replanting of Rehmannia glutinosa(Gaertn.) Libosch. ex Steud. Korean Journal of Medicinal Crop Science. 27:202-207.
[https://doi.org/10.7783/KJMCS.2019.27.3.202]

-
Lee SH, Yun HM, Koo SC, Hur M, Han JW, Lee WM, Chang JK and Kim YB. (2018). Effects on the storability enhancement and root yield by air curing of the seed rhizome of Rehmannia glutinosa Liboschitz ex Steudel. Korean Journal of Medicinal Crop Science. 26:291-295.
[https://doi.org/10.7783/KJMCS.2018.26.4.291]

-
Lee SY, Rhie YH and Kim KS. (2015). Non-deep simple morphophysiological dormancy in seeds of Thalictrum rochebrunianum, an endemic perennial herb in the Korean peninsula. Horticulture, Environment, and Biotechnology. 56:366-375.
[https://doi.org/10.1007/s13580-015-0150-x]

-
Li Xj, Jiang C, Xu N, Li JX, Meng FY and Zhai HQ. (2018). Sorting and identification of Rehmannia glutinosa germplasm resources based on EST-SSR, scanning electron microscopy micromorphology, and quantitative taxonomy. Industrial Crops and Products. 123:303-314.
[https://doi.org/10.1016/j.indcrop.2018.06.088]

-
Mello AM, Steck NA, Blankenship EE and Paparozzi ET. (2009). Gibberellic acid promotes seed germination in Penstemon digitalis cv. Husker Red. HortScience. 44:870-873.
[https://doi.org/10.21273/HORTSCI.44.3.870]

- Ministry of Agriculture, Food and Rural Affairs(MAFRA). (2021). 2020 an actual output of crop for a special purpose. Ministry of Agriculture, Food and Rural Affairs. Sejong, Korea. p.7.
- Park CH, Shim KB, Kim MK, Park CG and Seong NS. (1999). Germination of pelleted seeds in Rehmannia glutinosa Libosch. Korean Journal of Medicinal Crop Science. 7:213-217.
- Park HB, Ko CH, Kim SY, Lee KC, Kim JH and Chung JM. (2019). Dormancy type and germination characteristics of seeds of Lonicera chrytsantha Turcz. Ex Ledeb(Caprifoliaceae). Korean Journal of Plant Resources. 32:457-462.
- Pritchard HW and Dickie JB. (2003). Predicting seed longevity: The use and abuse of seed viability equations In Smith RD et al. (ed.). Seed conservation: Turning science into practice. Royal Botanic Gardens. Kew, England. p.653-721.
-
Quail PH and Carter OG. (1969). Dormancy in seeds of Avena ludoviciana and A. fatua. Australian Journal of Agricultural and Resource Economics. 20:1-11.
[https://doi.org/10.1071/AR9690001]

- Rural Development Administration(RDA). (2019). Data by period of agricultural meteorology. http://weather.rda.go.kr/w/analysis/inquiry.do, (cited by 2022 Jan 13).
-
Ryu SH, Rhie YH, Lee SY, Ko CH, Lee JH, Lee HJ and Lee KC. (2017). Effect of after-ripening, cold stratification, and GA3 treatment on Lychnis wilfordii(Regel) maxim seed germination. Horticultural Science and Technology. 35:525-533.
[https://doi.org/10.12972/kjhst.20170057]

-
Saatkamp A, Affre L, Dutoit T and Poschlod P. (2011). Germination traits explain soil seed persistence across species: The case of mediterranean annual plants in cereal fields. Annals of Botany. 107:415-426.
[https://doi.org/10.1093/aob/mcq255]

-
White CN, Proebsting WM, Hedden P, Rivin CJ. (2000). Gibberellins and seed development in maize. I. Evidence that gibberellineal/abscisic acid balance governs germination versus maturation pathways. Plant Physiology. 122:1081-1088.
[https://doi.org/10.1104/pp.122.4.1081]

-
William EFS and Gerhard LM. (2006). Seed dormancy and the control of germination. New Phytologist. 171:501-523.
[https://doi.org/10.1111/j.1469-8137.2006.01787.x]

