
감잎, 녹차, 회화나무 열매 추출 복합물 (BLH308)의 탈모 개선 효과
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Persimmon leaf (Diospyros kaki), green tea (Camellia sinensis), and sophora fruit (Sophora japonica) are traditional food sources known to prevent oxidative stress and inflammation. However, research on their effect in reducing hair loss is lacking. The purpose of this study was to determine whether an extract mading using these plants, BLH308 could help reduce hair loss.
The antioxidant activity of BLH308 in vitro was investigated as well as its anti-inflammatory effect in RAW 264.7 cells and its effect on the expression of 5-alpha reductase Ⅱ in human dermal papilla cells. BLH308 showed significant antioxidant activity owing to its ability to scavenge 2,2-diphenyl-1-picrylhydrazyl and 2,2'-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid) radicals. Moreover, BLH308 effectively inhibited the lipopolysaccharide-induced production of interleukin-6 and tumor necrosis factor-α in RAW 264.7 cells, and downregulated the expression of 5-alpha reductase Ⅱ in human dermal papilla cells. In vivo, the hair growth promoting effect was evaluated using hair growth visual scoring. BLH308 reduced hair loss in testosterone propionate-induced hair loss C57BL/6N mice by promoting the onset of growing phase of the hair growth cycle.
Our results showed that BLH308 can promote hair regeneration and repair hair loss, and is a potential novel candidate for the treatment of androgenetic alopecia.
Keywords:
Camellia sinensis L., Diospyros kaki Thunb., Sophora japonica L., Androgenetic Alopecia, Green Tea Extract, Persimmon Leaf Extract, Sophora Fruit Extract, Hair Loss서 언
안드로겐성 탈모증 (androgenetic alopecia, AGA)은 사춘기 이후의 남녀 모두에서 발생하는 가장 흔한 유형의 탈모증으로 일반적으로 탈모가 진행되면 탈모 부위의 모발이 점차 가늘어지고 짧아지는 증상을 나타낸다 (Lee and Lee, 2012).
대체로 모발의 성장과 단계별 주기는 여러 호르몬에 의해 조절되는데 흥미롭게도 남성 호르몬은 수염의 성장을 자극하지만, 모발의 성장은 억제하는 것으로 알려져 있다 (Inui and Itami, 2013). 특히, AGA는 테스토스테론 (testosterone, TST) 및 디히드로테스토스테론 (dihydrotestosterone, DHT) 등 남성 호르몬 (androgenic hormone)에 의해 야기되는 모낭수축과 비정상적인 모낭 세포주기 (hair follicle cycling)가 주요 원인으로 알려져 있다 (Cotsarelis and Millar, 2001; Dawber, 1987; Stough et al., 2005).
DHT는 TST가 5알파-환원효소 (5α-reductase)에 의해 전환되어 생성되는 물질로, 이 효소를 억제하여 DHT의 혈중 농도를 낮춰주면 남성 호르몬으로 인한 효과 (androgenic effect)를 줄여주어 탈모를 개선할 수 있다. 따라서, 5알파-환원효소의 발현 혹은 활성을 억제하거나, DHT가 결합하는 안드로겐수용체 (androgen receptor)에 길항적으로 결합할 수 있는 항안드로겐성 약물 (anti-androgenic drug)은 AGA에 유용하게 작용할 수 있다 (Matsuda et al., 2001).
실제로, 미국의 머크 (Merck)사가 개발한 피나스테리드 (finasteride)라는 약물은 현재 안드로겐성 탈모증 치료제로 가장 널리 처방되고 있는데, 매우 낮은 농도에서 테스토스테론과 경쟁적으로 5알파-환원효소의 활성화 부위에 결합하여 효소의 활성을 억제하는 경쟁적 억제 기전을 갖고 있다 (Kaufman et al., 1998). 그러나, 피나스테리드는 남성 성기능 장애를 유발할 뿐만 아니라 (Kim et al., 2012; Jin et al., 2017), 임신부의 복중 남성 태아의 성기발달에 영향을 미칠 수 있으며, 간혹 우울증을 초래하는 등 여러 부작용이 보고되어 있다 (MFDS, 2022). 더구나, 복용을 중단했을 경우 3 개월 - 5 개월 내에 다시 탈모 증상이 재발하는 양상을 보여 상대적으로 젊은 연령층의 안드로겐성 탈모증 치료제로 강하게 추천하기 어려운 점이 있다. 현재까지 피나스테리드의 단점을 보완하는 약물이 개발되어 있지 않고 있을 뿐만 아니라, 효능적인 측면에서 남녀와 성별에 상관없이 장기간 섭취해도 부작용없이 비교적 안전하게 안드로겐성 탈모증을 개선할 수 있는 천연물을 확인하여 건강기능식품 원료로서 개발하는 것이 필요하다.
안드로겐성 탈모증의 개선을 위한 소재의 활성 평가에 있어 주요한 평가항목을 항산화, 항염증, 그리고 TST로부터 DHT의 생성을 촉매하는 5알파-환원효소의 활성을 저하시키거나 그 발현을 감소시키는 능력으로 선정하였고 문헌 조사를 통해 이들 기능이 매우 우수하면서 식용이 가능한 천연물을 탐색하였다.
최종적으로 3 종 식물추출물 후보물질 (감잎, 녹차, 회화나무 열매)을 선택하였고 각 후보 소재 추출물의 생리활성과 유효성분을 분석하였다. 이후 이들 각 추출물의 상호 보완성을 위해 3 종 식물추출물의 혼합물인 감잎 추출물 등 복합물 (BLH308)을 제조하고, 복합물을 대상으로 하여 항산화, 항염증, 그리고 5알파-환원효소Ⅱ의 발현 억제의 활성을 검정함으로써 3 종 소재의 복합물 소재인 BLH308의 탈모 개선 효과의 가능성을 확인하였고 동물실험을 통해 최종적으로 유효성을 검증하였다.
재료 및 방법
1. 실험재료 및 지표성분 함량 분석
본 연구에 사용된 3 종 추출 분말인 감잎 (Diospyros kaki Thunb.) 추출물, 녹차 (Camellia sinensis L.) 추출물 및 회화나무 (Sophora japonica L.) 열매 추출물은 모두 openmarket을 통해 식품 원료용으로 구매하였고 각 추출물의 정보는 Table 1에 나타내었다.
각 추출물의 지표 (유효) 성분의 함량은 HPLC를 사용하여 분석하였으며 감잎 추출물 중 tannic acid (ca. 12.5%) 함량, 녹차 추출물 중 epigallocatechin-3-gallate (EGCG, ca. 50%) 함량 및 회화나무 열매 추출물 중 sophoricoside (ca. 3%)의 함량을 고려하여 감잎 추출물, 녹차 추출물 및 회화나무 열매 추출물을 각각 2 : 1 : 1의 배합비로 혼합한 후 감잎 추출물 등 복합물 (BLH308)이라 명명하였다.
1.2.1. 시료의 전처리
BLH308의 지표성분 분석에 사용된 표준품 즉 tannic acid, EGCG, sophoricoside는 모두 순도 95% 이상의 HPLC 분석용 시약 (Sigma-Aldrich Co., St. Louis, CA, USA)을 사용하였다. Tannic aid는 Durgawale 등 (2016)의 방법을 참고하여 분석하였고, EGCG와 sophoricoside는 건강기능식품의 기준 및 규격 (MFDS, 2021)의 시험법에 근거하여 분석하였다.
시료 (BLH308)에 methanol을 가하여 60 분간 초음파로 추출한 후 0.45 μm polytetrafluoroethylene (PTFE) syringe filter로 여과하여 tannic acid 및 sophoricoside 분석용 시료로 사용하였고, 시료에 methanol이 함유된 20 mM potassium dihydrogen phosphate (pH 2.1)를 가하여 20 분간 초음파 추출한 후 0.45 μm polyvinylidene fluoride (PVDF) syringe filter로 여과하여 EGCG 분석용 시료로 사용하였다.
1.2.2. 지표성분의 함량 분석
각 지표성분은 C18 column [Phenomenex Luna(2) 250 mm × 4.6 mm, 5 μm]을 사용하여 Agilent 1260 Infinity Ⅱ HPLC (Agilent technologies Inc., Santa Clara, CA, USA)에서 유속을 1 ㎖/min으로 설정한 후 Table 2에 나타낸 이동상 조건대로 분석하였다.
기기의 column oven 온도는 각각 25℃ (tannic acid), 35℃ (EGCG), 30℃ (sophoricoside)로 설정하였고 시료를 각각 10㎕ (tannic acid), 10㎕ (EGCG), 5㎕ (sophoricoside) 주입한 후 270 nm (tannic acid), 275 nm (EGCG) 및 260nm (sophoricoside)에서 지표성분의 함량을 분석하였다.
2. 항산화 활성 측정
시료의 DPPH 라디칼 소거능은 Blois (1958)와 Brand-Williams 등 (1995)의 방법을 참고하여 다음과 같이 변형하여 측정하였다.
우선 DPPH를 에탄올에 녹여 167 μM의 농도가 되도록 제조한 후 이 DPPH 용액 180 ㎕와 에탄올에 녹인 시료 20 ㎕를 혼합하여 암소에서 30 분간 반응시킨 후 microplate reader (Epoch, BIOTEK instruments Inc., Winooski, VT, USA)를 사용하여 520 nm에서 흡광도를 측정하였다. 각 시료의 DPPH 라디칼 소거능은 다음 식을 이용하여 계산하였고 각 시료가 50%의 DPPH 라디칼을 소거하는 농도인 SC50 (concentration for 50% DPPH radical scavenging) 값을 구하여 항산화 효과를 비교하였다.
DPPH 라디칼 소거능 비율 (%)을 에탄올이 첨가된 대조군의 흡광도 대비 시료가 첨가된 시험구의 흡광도에 대한 상대적 비율로 계산하였으며 산출 공식은 다음과 같다. 모든 실험은 3 회 반복으로 진행하였으며 양성대조군으로 비타민C를 사용하였다.
A; 시료 + DPPH 흡광도, B; 에탄올 + DPPH 흡광도, C; 시료 + 에탄올 흡광도
ABTS 라디칼 소거능은 Re 등 (1999)과 Ozgen 등 (2006)의 방법을 참고하여 다음과 같이 변형하여 측정하였다.
우선 정제수에 ABTS를 7mM이 되도록 녹인 후 정제수에 녹인 2.45mM potassium persulfate (K2S2O8)와 1 : 1로 혼합한 다음 암소에 16 시간 방치하여 ABTS 양이온을 생성시켰다. 이후 정제수로 이 용액의 흡광도가 734 nm에서 0.70 ± 0.05가 되도록 미리 희석하여 ABTS reagent로 실험에 사용하였다.
시료 20 ㎕에 ABTS reagent 180 ㎕를 혼합하여 암소에서 10 분 동안 반응시킨 후 microplate reader (Epoch, BIOTEK instruments Inc., Winooski, VT, USA)를 사용하여 동일 파장에서 흡광도를 측정하였다. 시료의 ABTS 라디칼 소거능은 다음 식을 이용하여 계산하였고 ABTS 라디칼을 50% 소거하는 농도인 SC50 (concentration for 50% ABTS radical scavenging) 값을 구하여 항산화 효과를 비교하였다. 모든 실험은 3 회 반복으로 진행하였으며 양성대조군으로 비타민C를 사용하였다.
A; 시료 + DPPH 흡광도, B; 에탄올 + DPPH 흡광도, C; 시료 + 에탄올 흡광도
3. 항염증 활성 측정
항염증 활성 측정을 위해 사용한 마우스 대식세포 RAW 264.7 cell은 한국세포주은행 (Seoul, Korea)에서 분양받았고 세포배양을 위해 Dulbecco's Modified Eagle Medium (DMEM, Gibco BRL, Grand Island, NY, USA)에 10% Fetal Bovine Serum (FBS, Capricorn Scientific, Ebsdorfergrund, Germany), 100 units penicillin (Gibco BRL, Grand Island, NY, USA) 및 100 μg/㎖의 streptomycin (Gibco BRL, Grand Island, NY, USA)을 첨가하여 배양 배지로 사용하였으며 37℃, 5% CO2 배양기 (SANYO, Osaka, Japan)에서 배양하였다.
RAW 264.7 cell에 대한 cell viability는 Byeon 등 (2008)의 방법을 참고하여 다음과 같이 변형하여 측정하였다.
세포를 2×105 cells/well의 농도로 24 well plate에 분주한 후 10% FBS 함유 DMEM을 사용하여 37℃, 5% CO2 배양기에서 24 시간 배양하였다. 배지를 제거하고 새로운 DMEM으로 교체한 후 dimethyl sulfoxide (DMSO)에 녹인 시료를 첨가하여 20 시간 배양하였고, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazodiumbromide (MTT)를 최종 농도가 0.5 mg/㎖이 되도록 첨가한 후 4 시간 추가로 배양하였다. 배지를 제거한 후 DMSO로 생존 세포에 존재하는 색소를 용해시켜 microplate reader (Epoch, BIOTEK instruments Inc., Winooski, VT, USA)를 사용하여 570 nm에서 흡광도를 측정하였고 다음 식에 의해 세포 생존율을 계산하였다. Cell viability (%) = (시료 첨가군의 흡광도/시료 무첨가군의 흡광도) × 100
RAW 264.7 cell을 2 × 105 cells/well의 농도로 24 well plate에 분주한 후 10% FBS를 함유한 DMEM을 사용하여 24 시간 동안 배양하였다. 배지를 제거하고 FBS 미함유 DMEM으로 교체한 후 시료를 첨가하여 1 시간 배양하였다. 이후 lipopolysaccharide (LPS, 최종 농도 100 ng/㎖)를 첨가하여 24 시간 배양하였다.
전염증성 사이토카인 interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α)의 생성량을 측정하기 위해 세포 배양액을 각각 Invitrogen Mouse IL-6 ELISA kit (Thermo Fisher Scientific Korea Ltd., Seoul, Korea)와 Invitrogen Mouse TNF-α ELISA kit (Thermo Fisher Scientific Korea Ltd., Seoul, Korea)를 사용하여 제조사가 제시하는 방법에 따라 측정하였다.
LPS로 염증이 유도된 RAW 264.7 cell에서 NO 생성에 대한 저해활성은 다음과 같이 변형하여 측정하였다 (Kwak et al., 2008).
RAW 264.7 cell을 5 × 105 cells/well의 농도로 24 well plate에 분주한 후 DMEM을 사용하여 24 시간 동안 배양하였다. 배지를 제거하고 새로운 DMEM으로 교체한 후 시료를 첨가하여 1 시간 배양한 후 LPS (최종 농도 1 μg/㎖)를 첨가하여 18 시간 동안 추가 배양하였다.
세포 배양액 중 방출된 NO의 안정화된 형태인 [NO2-],[NO3-]를 검출하기 위하여 세포 배양액을 회수하여 세포 배양액 100 ㎕에 Griess 시약 (1% sulfanilamide, 0.1% naphylethylenediamine, 2.5% phosphoric acid) 100 ㎕를 혼합하여 5 분간 반응시킨 후 microplate reader (Epoch, BIOTEK instruments Inc., Winooski, VT, USA)를 사용하여 540 nm에서 흡광도를 측정하였다. 표준용액으로 아질산나트륨 (NaNO2)을 사용하였고 검량선 작성 후 NO의 생성량을 계산하였다.
RAW 264.7 cell을 2×106 cells/dish의 농도로 직경 6 cm dish에 분주한 후 10% FBS 함유 DMEM을 사용하여 24 시간 동안 배양하였다. 배지를 제거하고 새로운 DMEM으로 교체한 후 시료를 첨가하여 1 시간 동안 더 배양한 후 LPS (최종 농도 1 μg/㎖)를 첨가하여 18 시간 동안 배양하였다.
세포 배양액을 제거하고 PBS (pH 7.4)로 2 회 세척한 후 cell scraper를 사용하여 세포를 수거하였다. 세포에 단백질분해효소의 억제를 위해 1% protease inhibitor cocktail (Sigma-Aldrich Co., St. Louis CA, USA)을 함유한 Radio-Immunoprecipitation Assay buffer (RIPA, 150 mM sodium chloride, 1.0% IGEPAL® CA-630, 0.5% sodium deoxycholate, 0.1% sodium dodecyl sulfate, 50 mM Tris, pH 8.0, Sigma-Aldrich Co., St. Louis, CA, USA)를 첨가하여 단백질을 추출하고 14,000 rpm, 4℃에서 15 분간 원심분리한 후 상등액을 취하여 단백질 용액을 얻었다.
적절한 농도로 희석시킨 단백질 용액 20 ㎕와 Bio-Rad protein assay reagent (Bio-Rad Laboratories Inc., Hercules, CA, USA) 200 ㎕를 혼합하여 상온에서 5 분간 반응시킨 후 595 nm에서 흡광도를 측정하여 단백질을 정량하였는데 이때 표준품으로 bovine serum albumin (BSA, Sigma-Aldrich Co., St. Louis, CA, USA)을 사용하였다.
각 well에 30μg의 단백질을 얹어 8% SDS polyacrylamide gel을 사용하여 분리하였고, polyvinylidenedifluoride (PVDF) membrane (Diagnostic Technology, Belrose, NSW, Australia)에 전이시킨 후 5% skim milk (BD Difco, Spark, MD, USA)로 상온에서 1 시간 동안 blocking 하였다.
각각의 1차 항체 Anti-iNOS (1 : 1000, Abcam, Cambridge, England), Anti-COX2 (1 : 1000, Abcam, Cambridge, England), Anti-β-actin (1 : 10000, Novus Biologicals, Littleton, CO, USA)을 5% skim milk로 희석한 후 4℃에서 overnight으로 반응시켰다. 2차 항체로는 goat anti-mouse IgG-HRP (1 : 10000, GenDEPOT, Katy, TX, USA), goat anti-rabbit IgG-HRP (1 : 10000, GenDEPOT, Katy, TX, USA)를 5% skim milk로 희석한 후 사용했으며 90 분간 반응시킨 후 Western Blotting Luminol Reagent (Santa Cruz Biotechnology, Santa Cruz, CA, USA), AmershamTM ECLTM Prime Western Blotting Detection Reagents (Cytiva, Marlborough, MA, USA)로 inducible nitric oxide synthase (iNOS), cyclooxygenase-2 (COX-2)의 발현을 측정하였다.
4. 5알파-환원효소Ⅱ의 단백질 발현량 측정
실험에 사용한 인간모유두세포 (Human Follicle Dermal Papilla Cell, HFDPC)는 Promocell (Heidelberg, Germany)에서 구입하였고 HFDPC의 배양을 위해 DMEM (Gibco BRL, Grand Island, NY, USA)에 10% FBS (Capricorn scientific, Ebsdorfergrund, Germany), 100 units penicillin (Gibco BRL, Grand Island, NY, USA) 및 100μg/㎖의 streptomycin (Gibco BRL, Grand Island, NY, USA)을 첨가하여 배양 배지로 사용하였으며 37℃, 5% CO2 배양기 (SANYO, Osaka, Japan)에서 배양하였다.
HFDPC에 대한 cell viability는 다음과 같이 측정되었다. HFDPC를 2×104 cells/well의 농도로 24 well plate에 분주한 후 10% FBS를 함유한 DMEM을 사용하여 37℃, 5% CO2 배양기에서 24 시간 동안 배양하였다.
배지를 제거하고 새로운 DMEM으로 교체한 후 DMSO에 녹인 시료를 첨가하여 20 시간 배양하였다. PBS에 녹인 MTT를 최종 농도가 0.5 mg/㎖이 되도록 첨가한 후 4 시간 추가로 배양하였다. 배지를 제거하고 DMSO로 생존 세포에 존재하는 색소를 용해시킨 후 microplater reader (Epoch, BIOTEK instruments Inc., Winooski, VT, USA)를 사용하여 570 nm에서 흡광도를 측정하였고 다음 식에 의해 세포 생존율을 계산하였다.
HFDPC를 3×105 cells/well의 농도로 6-well plate에 분주한 후 10% FBS를 함유한 DMEM을 사용하여 24 시간 동안 배양하였다.
배지를 제거하고 새로운 DMEM으로 교체한 후 시료를 농도별로 첨가하여 1 시간 배양한 후 TST를 최종 농도가 10 μM이 되게 각 well에 첨가하고 72 시간 동안 추가로 배양하였다. 배지를 제거하고 PBS (pH 7.4)로 세포를 2 회 세척한 후 세포를 수거하고 iNOS, COX-2의 단백질 발현량 측정에 기재한 바와 동일하게 단백질을 추출한 후 각 well에 30 μg의 단백질을 얹어 12% SDS polyacrylamide gel을 사용하여 분리하였다. 이후 PVDF membrane에 전이시킨 후 10% skim milk로 1 시간 동안 상온에서 blocking 하였다.
5알파-환원효소Ⅱ와 결합하는 1차 항체 Anti-SRD5A2 (1 : 1000, Abcam, Cambridge, England), 비교군으로 β-actin에 결합하는 Anti-β-actin (1 : 10000, Novus Biologicals, Littleton, CO, USA)을 각각 5% skim milk로 희석한 후 4℃에서 overnight으로 반응시켰고 2차 항체로는 goat anti-mouse IgG-HRP (1 : 10000, GenDEPOT, Katy, TX, USA), goat anti-rabbit IgG-HRP (1 : 10000, GenDEPOT, Katy, TX, USA)를 5% skim milk로 희석한 후 사용했으며 90 분간 반응시킨 후 Western Blotting Luminol Reagent (Santa Cruz Biotechnology, Santa Cruz, CA, USA), AmershamTM ECLTM Prime Western Blotting Detection Reagents (Cytiva, Marlborough, MA, USA)로 5알파-환원효소Ⅱ의 발현을 측정하였다.
5. 실험동물 식이를 통한 탈모 개선 효과 측정
실험동물을 이용한 BLH308의 탈모 개선 효과를 측정하기 위해 수원대학교 동물실험윤리위원회의 승인 (USW-IACUC-2022-003)을 받은 후 다음과 같이 진행하였다.
C57BL/6N 6주령 암컷 마우스를 ㈜샘타코 (Osan, Korea)에서 구입한 후, 사료 (Sajo Dongaone Co., Ltd., Seoul, Korea)와 물은 자유롭게 섭취할 수 있도록 공급하였고 환경 조건 [온도 22±2℃, 습도 50±10%, 명암 12 시간 주기 (9시 - 19시, 명/ 19시 - 9시, 암)]을 일정하게 하여 사육하였다.
마우스는 7 일간의 순응 과정을 거친 후 반려동물용 hair clipper (AC-03, Akitz, Incheon, Korea)로 등 피부의 털을 제거하고 제모 크림 (niclean, Ildong Pharmaceutical Co., ltd., Seoul, Korea)을 도포하였다. 제모 크림 적용 1 분 후 멸균솜에 미온수를 적셔 나머지 털과 크림을 제거하였다.
실험동물은 군당 6 마리로 하였고 정상 대조군 (Normal control)을 제외한 모든 군에게 마우스 당 100㎕의 testosterone propionate (TP, 1 mg/㎖ in corn oil)를 피하 주사하였고, 정상 대조군에는 TP 대신 100 ㎕의 corn oil을 피하 주사하였다. 정상 대조군과 음성대조군 (testosterone propionate control, TP control)에는 멸균된 정제수를 경구투여하였고, 양성대조군으로 피나스테리드 (finasteride, Enzo Life Sciences, Farmingdale, NY, USA)를 1 mg/kg·BW의 농도 수준으로 매일 멸균된 정제수에 녹여 제조한 후 경구투여하였다.
BLH308의 경우 매일 멸균된 정제수를 첨가하여 제조한 후 (10 mg/㎖), 50 mg/kg·BW (Low)와 100 mg/kg·BW (High)의 2 가지 농도로 경구투여하였다.
모든 군에 대해 TP 혹은 corn oil을 매일 피하 주사하였으며, 피하 주사한 직후 5 주간 매일 오전 같은 시각에 정해진 용량으로 정제수 및 시료 (finasteride or BLH308)를 경구투여하였다.
제모 크림을 사용하여 제모를 수행한 당일 (Day 0)의 다음날 (Day 1)부터 즉 1 일, 11 일, 16 일, 21 일, 28 일, 35 일에 디지털카메라 (D90, Nikon Tokyo, Japan)로 마우스 등 피부를 촬영하여 발모의 속도를 비교하였다.
발모의 면적 계산은 Park 등 (2012)의 방법을 참고하여 해당 사진의 pixel수를 (재생면적/제모면적 × 100)의 식에 대입하여 백분율로 계산한 후 육안점수에 적용시켰다 (Fig. 7A). 실험이 종료된 35 일째에, 디지털카메라로 촬영을 마친 후 발모된 가운데 부분의 모를 모두 hair clipper로 제거한 후 개체별 무게를 측정하여 각 그룹의 평균을 비교하였다.
6. 통계처리
모든 실험 결과는 3 반복으로 측정하여 평균 및 표준편차 (means ± S.D.)로 나타냈다. 각 실험군 간 유의성을 검증하기 위하여 SPSS 18.0 프로그램 (SPSS Inc., Chicago, IL, USA)을 사용하여 One-way analysis of variance (ANOVA)를 실행하였다 (p < 0.05 or p < 0.01 or p < 0.001).
결 과
1. BLH308의 tannic acid, EGCG 및 sophoricoside 함량
BLH308 중 tannic acid, EGCG 및 sophoricoside의 함량을 분석한 결과 tannic acid는 66.65 ± 0.33 mg/g, EGCG는 113.96 ± 0.04 mg/g, sophoricoside는 8.18 ± 0.10 mg/g으로 검출되었다 (Table 3 and Fig. 1).
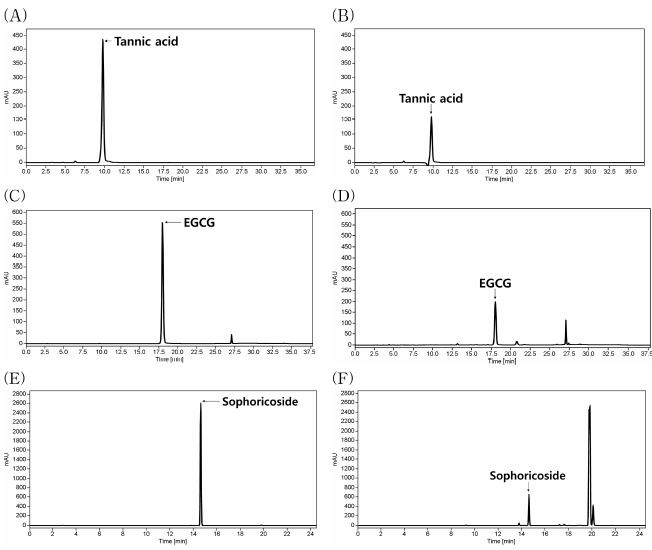
HPLC chromatograms of tannic acid, EGCG and sophoricoside in BLH308 complex composed of raw materials extract.Standard compound (A) and tannic acid in persimmon leaf extract (B), standard compound (C) and epigallocatechin gallate (EGCG) in green tea extract (D), standard compound (E) and sophoricoside in sophora fruit extract (F).
2. DPPH, ABTS 라디칼 소거능 결과
감잎 (Diospyros kaki Thunb.) 추출물, 녹차 (Camellia sinensis L.) 추출물, 회화나무 (Sophora japonica L.) 열매 추출물, 그리고 이들의 복합물인 BLH308의 DPPH 라디칼 소거능을 측정하여 Table 4에 나타내었다. 녹차 추출물은 4.43 μg/㎖에서 DPPH 라디칼을 50% 소거하는 것으로 나타났고 감잎 추출물은 18.48 μg/㎖에서 DPPH 라디칼을 50% 소거하는 것으로 나타났다. 반면 회화나무 열매 추출물은 250 μg/㎖에서 20%의 DPPH 라디칼 소거능을 나타냈다. 마지막으로 BLH308은 14.63 μg/㎖에서 50%의 DPPH 라디칼 소거능을 나타냈다.

Anti-oxidative activities of persimmon leaf extract, green tea extract, sophora fruit extract and BLH308 measured by DPPH and ABTS radical scavenging activities.
항산화능을 측정하는 또 다른 방법인 ABTS 라디칼 소거능을 측정한 결과, 녹차 추출물은 3.23 μg/㎖에서 50%의 ABTS 라디칼 소거능을 나타냈고 감잎 추출물과 BLH308은 각각 10.86 μg/㎖과 9.05 μg/㎖에서 ABTS 라디칼을 50% 소거하는 것으로 나타났다.
일반적으로 강력한 항산화제로 알려진 비타민C의 경우 6.49 μg/㎖과 4.50 μg/㎖에서 각각 DPPH 라디칼과 ABTS 라디칼을 50% 소거하는 것으로 나타나 BLH308의 전체적인 항산화력은 비타민C의 약 절반 수준으로 확인되었다.
3. BLH308의 세포생존율
BLH308의 RAW 264.7 cell과 HFDPC에 대한 세포 생존율을 확인한 결과, BLH308은 50 μg/㎖의 농도에서 RAW 264.7 cell에 대해 86.2%의 세포생존율을 나타냈다. BLH308은 HFDPC에 대해 5, 10, 20, 50 μg/㎖의 농도에서 각각 95.5%, 90.1%, 88.7%, 83.2%의 세포생존율을 나타냈다 (Fig. 2). BLH308은 50 μg/㎖ 이하의 농도에서 RAW 264.7 cell과 HFDPC에 대해 모두 80.0% 이상의 세포생존율을 나타냈다.
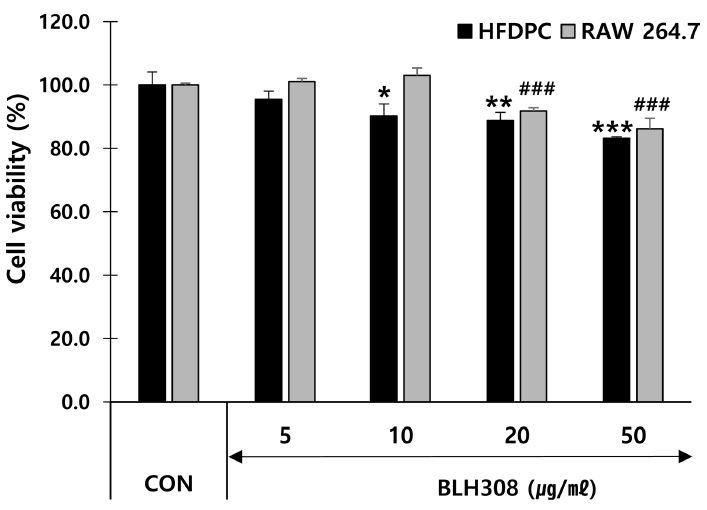
Effects of BLH308 on cell viability in Human Follicle Dermal Papilla Cells (HFDPCs) and RAW 264.7 cells.HFDPCs and RAW 264.7 cells were treated with various concentration of BLH308 for 24 h. *p < 0.05, **p < 0.01 and ***p < 0.001 vs. control (CON, HFDPCs). #p < 0.05, ##p < 0.01 and ###p < 0.001 vs. control (CON, RAW 264.7 cells).
4. IL-6, TNF-α 생성 억제
RAW 264.7 cell에 LPS를 처리하여 염증을 유도한 후 감잎 추출물, 녹차 추출물, 회화나무 열매 추출물 및 BLH308의 IL-6, TNF-α 생성에 대한 억제효과를 측정하여 Fig. 3에 나타냈다.
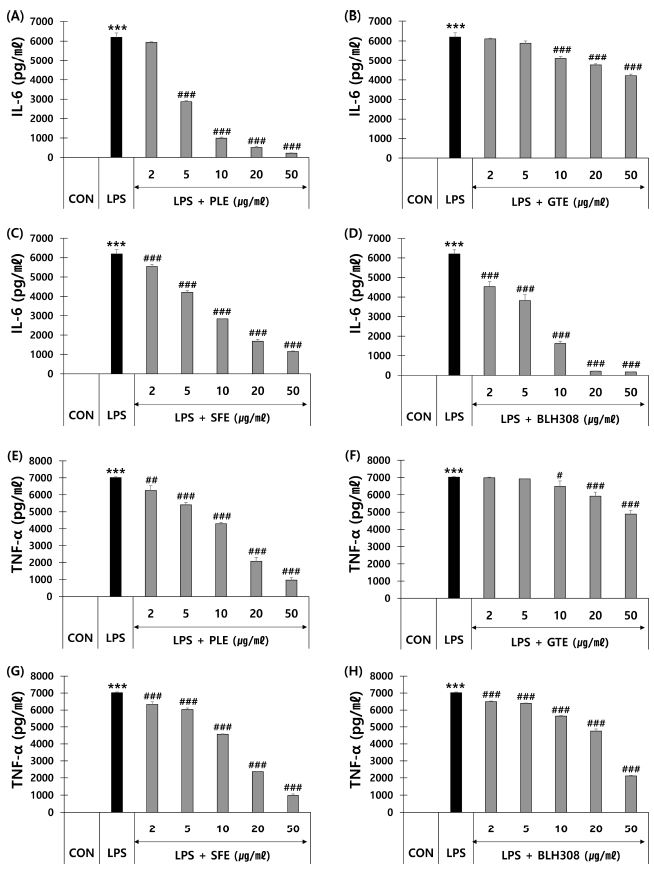
Effects of persimmon leaf extract (PLE), green tea extract (GTE), sophora fruit extract (SFE) and BLH308 on IL-6 and TNF-α production in LPS-induced RAW 264.7 cells.Inhibitory effects on interleukin-6 (IL-6) production of (A) PLE, (B) GTE, (C) SFE, and (D) BLH308. Inhibitory effects on tumor necrosis factor-α (TNF-α) production of (E) PLE, (F) GTE, (G) SFE, and (H) BLH308. RAW 264.7 cells were treated with various concentration of four samples for 24 h in the absence or presence of LPS (100 ng/㎖). Cells were pre-treated with each sample 1 h prior to treatment with LPS. ***p < 0.001 vs. control (CON); #p < 0.05, ##p < 0.01 and ###p < 0.001 vs. LPS.
IL-6, TNF-α에 대한 생성 억제효과는 감잎 추출물이 가장 우수한 것으로 나타났는데 5 μg/㎖의 농도에서 IL-6의 생성을 54% 억제하였고, 50 μg/㎖의 농도에서는 TNF-α의 생성을 약 86% 억제하였다. 녹차 추출물은 50 μg/㎖의 농도에서 IL-6와 TNF-α의 생성을 각각 32%, 30% 억제하여 4 종 시료 중 가장 낮은 항염증 활성을 나타냈다. BLH308은 50 μg/㎖의 농도에서 IL-6의 생성을 97% 억제하였고, 같은 농도에서 TNF-α의 생성을 70% 억제하여 4 종 시료 중 가장 높은 항염증 활성을 나타냈다.
5. Nitric oxide (NO) 생성 억제
감잎 추출물, 녹차 추출물, 회화나무 열매 추출물 및 BLH308을 각각 LPS로 염증이 유도된 RAW 264.7 cell에 처리하여 NO 생성에 대한 억제효과를 측정하였다 (Fig. 4).
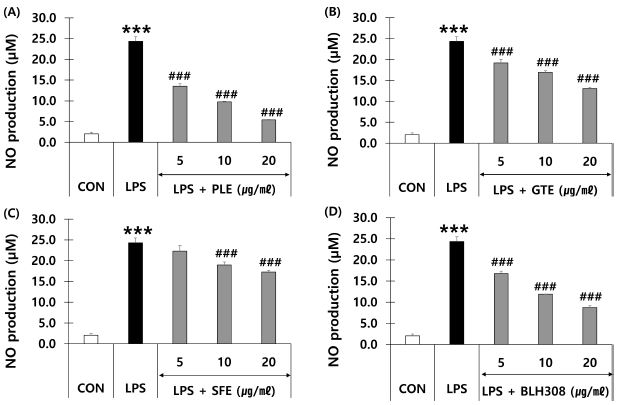
Effects of persimmon leaf extract (PLE), green tea extract (GTE), sophora fruit extract (SFE) and BLH308 on nitric oxide (NO) production in RAW 264.7 cells.Inhibitory effects on NO production of (A) PLE, (B) GTE, (C) SFE, and (D) BLH308. RAW 264.7 cells were treated with various concentration of four samples for 24 h in the absence or presence of LPS (1 μg/㎖). Cells were pre-treated with each sample 1 h prior to treatment with LPS. ***p < 0.001 vs. control (CON); #p < 0.05, ##p < 0.01 and ###p < 0.001 vs. LPS.
LPS 비처리군의 NO 생성량은 2.0 μM이었고 LPS 처리군은 24.3 μM이었다. 감잎 추출물, 녹차 추출물, 회화나무 열매 추출물 및 BLH308은 모두 5, 10, 20 μg/㎖에서 농도 의존적으로 NO의 생성을 억제하였다. 감잎 추출물은 20 μg/㎖의 농도에서 84.8%의 NO 생성을 억제하였고, 같은 농도에서 녹차 추출물과 회화나무 열매 추출물은 NO의 생성을 각각 50.6%, 31.7% 억제하였다. BLH308은 5, 10, 20 μg/㎖의 농도에서 LPS에 의한 NO의 생성을 각각 33.7%, 55.7%, 70.1% 억제하였다.
6. iNOS, COX-2 발현 억제
감잎 추출물, 녹차 추출물, 회화나무 열매 추출물 및 BLH308을 각각 LPS로 염증이 유도된 RAW 264.7 세포에 처리하여 iNOS, COX-2의 단백질 발현 억제에 대한 효과를 western blot 방법으로 측정하였다 (Fig. 5).
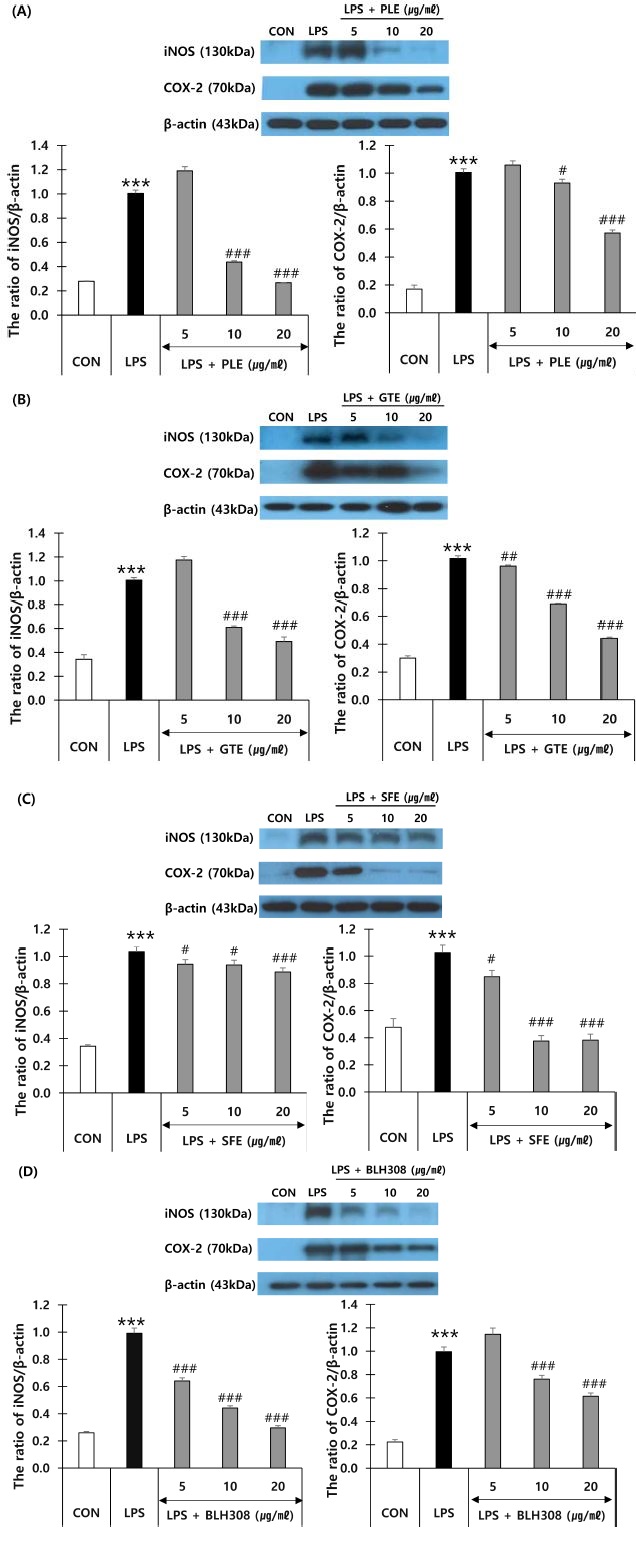
Effects of persimmon leaf extract (PLE), green tea extract (GTE), sophora fruit extract (SFE) and BLH308 on iNOS and COX- 2 protein expression in RAW 264.7 cells.Representative western blots of iNOS and COX-2 treated by PLE (A), GTE (B), SFE (C) and BLH308 (D). RAW 264.7 cells were treated with various concentration of four samples for 24 h in the absence or presence of LPS (1 μg/㎖). Cells were pre-treated with each sample 1 h prior to treatment with LPS. ***p < 0.001 vs. control (CON); #p < 0.05, ##p < 0.01 and ###p < 0.001 vs. LPS.
감잎 추출물 (Lee, 2014), 녹차 추출물 (Chen et al., 2017), 회화나무 추출물 (Ko et al., 2013)은 마우스 대식세포에서 iNOS 발현과 NO의 생성을 감소시켰다고 보고된 바 있는데 본 연구에서도 감잎 추출물, 녹차 추출물, 회화나무 열매 추출물 및 BLH308은 5, 10, 20 μg/㎖의 농도에서 모두 농도 의존적으로 iNOS의 단백질 발현을 억제하였다. 녹차 추출물과 감잎 추출물은 10, 20 μg/㎖의 농도에서 시료를 처리하지 않은 LPS 단독 처리군에 비해 iNOS의 발현을 유의하게 억제하였고 회화나무 열매 추출물은 모든 농도에서 iNOS의 발현을 유의하게 억제하였다. BLH308은 5, 10, 20 μg/㎖의 농도에서 모두 LPS 단독 처리군에 비해 iNOS의 발현을 유의하게 억제하였다.
또한 감잎 추출물, 녹차 추출물, 회화나무 열매 추출물 및 BLH308은 5, 10, 20 μg/㎖의 농도에서 모두 농도 의존적으로 COX-2의 단백질 발현을 억제하였다. 녹차 추출물과 회화나무 열매 추출물은 5, 10, 20 μg/㎖의 농도에서 모두 LPS 단독 처리군에 비해 COX-2의 발현을 유의하게 억제하였다. 감잎 추출물과 BLH308은 10, 20 μg/㎖의 농도에서 COX-2의 발현을 유의하게 억제하였다.
7. 인간모유두세포에서 5알파-환원효소Ⅱ의 발현 억제
감잎 추출물, 녹차 추출물, 회화나무 열매 추출물 및 BLH308이 인간모유두세포 (HFDPC)에서 5알파-환원효소Ⅱ의 발현에 미치는 영향을 조사하기 위해 HFDPC에 TST를 시료와 함께 처리한 후 western blot방법으로 5알파-환원효소Ⅱ의 발현을 측정하였다 (Fig. 6).
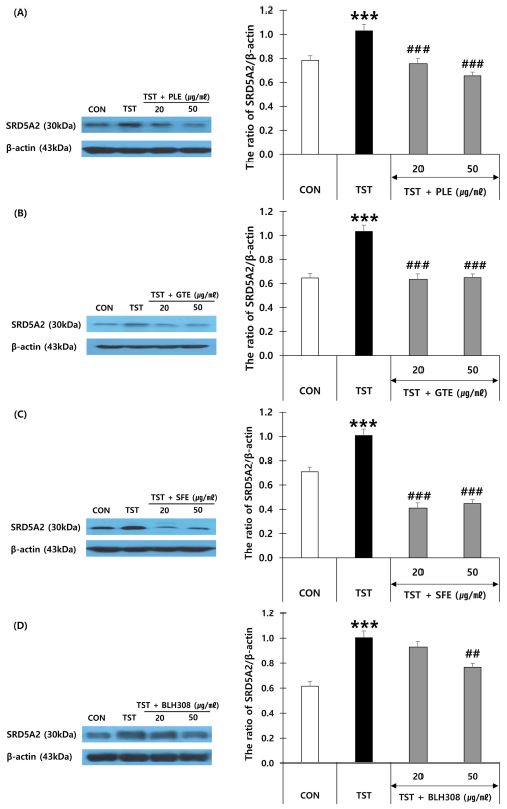
Effects of persimmon leaf extract (PLE), green tea extract (GTE), sophora fruit extract (SFE) and BLH308 on steroid 5α-reductase Ⅱ (SRD5A2) protein expression in HFDPCs.Representative western blot of SRD5A2 treated by PLE (A), GTE (B), SFE (C) and BLH308 (D). HFDPCs were treated with various concentration of four samples for 72 h in the absence or presence of testosterone (TST, 10 μM). Cells were pre-treated with each sample 1 h prior to treatment with TST. ***p < 0.001 vs. control (CON); #p < 0.05, ##p < 0.01 and ###p < 0.001 vs. TST.
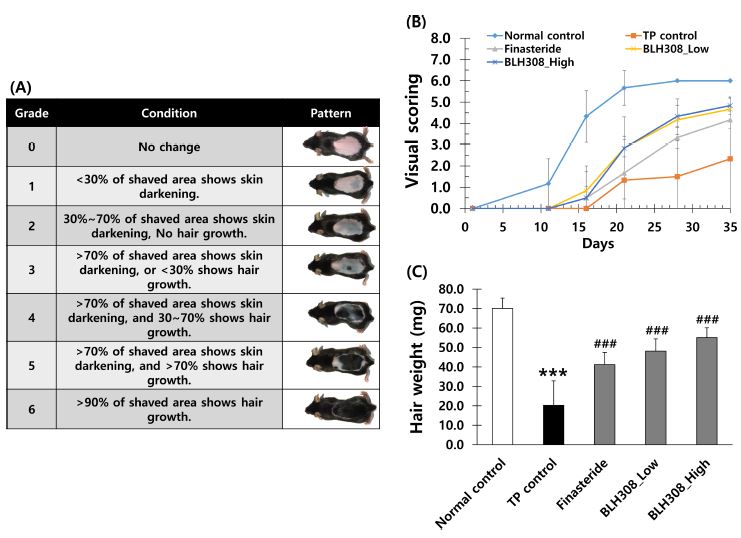
Effect of finasteride and BLH308 on hair growth in C57BL/6N mice.A; Index of hair growth visual scoring guide in C57BL/6N mice, B; Visual scoring of hair growth by the scoring guideline shown in A, C; Hair weight at day 35. ***p < 0.001 vs. normal control; #p < 0.05, ##p < 0.01 and ###p < 0.001 vs. TP control.
TST (10 μM)를 HFDPC에 72 시간 처리했을 때 5알파-환원효소Ⅱ의 발현이 40%가량 증가하는 것으로 나타났다. 감잎 추출물, 녹차 추출물, 회화나무 열매 추출물 모두 20, 50 μg/㎖의 첨가군에서 5알파-환원효소Ⅱ의 발현이 시료를 첨가하지 않은 TST 처리군에 비해 유의적으로 감소되었다. BLH308은 50 μg/㎖의 농도에서 5알파-환원효소Ⅱ의 발현이 대조군에 비해 유의적으로 감소되었다.
8. Testosteone propionate로 탈모가 유발된 C57BL/6N 마우스에 대한 BLH308의 발모 회복력 평가
Testosterone propionate (TP)-induced AGA 마우스에 BLH308을 경구투여하여 탈모 전문의약품인 피나스테리드와의 효능을 비교하였다.
C57BL/6N 마우스는 모발 재생에 따라 나타나는 색상 변화로 모발 성장 정도를 구분할 수 있으며, 정상 대조군 (Normal control)은 11 일 시점에 1 마리를 제외하고 모두 모근이 형성되어 회색-검은색 피부 부위를 관찰할 수 있었다 (Fig. 8). 반면, 음성대조군 (TP control)은 21일에 전체 3 분의 1의 개체에서만 발모 부위를 관찰할 수 있어 testosterone propionate에 의해 발모가 억제되고 있음을 확인하였다.
촬영된 모든 사진을 (Fig. 7A)에 나타낸 Park 등 (2012)의 방법을 참고하여 육안점수로 나타냈고, 실험이 종료된 35 일 후에는 BLH308 high group만이 정상 대조군과 거의 동등한 회복양상을 나타내었으며, 양성대조군 (finasteride)과 BLH308 low group은 정상 대조군 대비 각각 약 70%, 80% 수준의 회복양상을 나타내었다 (Fig. 7B). 재생된 모의 총 무게는 정상 대조군 대비 BLH308 high group이 통계적으로 유의적인 차이를 보이지 않아 가장 근접하게 회복되었음을 확인하였다 (Fig. 7C).
고 찰
감나무 (D. kaki Thunb.)는 한국, 중국, 일본, 인도 등에 널리 분포되어있는 나무로서 감나무의 잎에는 quercetin, kaempferol, isoquercetin, myricetin, rutin 등 플라보노이드 (flavonoid)가 다량 함유되어 있으며 일반 식품 및 생약으로 사용되고 있다. 감잎은 풍부한 비타민 C 때문에 특히 일본에서는 영양공급 및 노화 방지차로 알려져 있다 (Xie et al., 2015).
녹차 (Camellia sinensis L.)는 플라바놀 (flavanol) 종류의 화합물인 카테킨 (catechin)을 풍부하게 함유하고 있어 오랜 역사를 거쳐 단순한 기호식품일 뿐만 아니라 여러 가지 질병 치료제에도 적용되어왔다 (Lim et al., 2015). 녹차에는 카테킨 종류인 Epicatechin (EC), Epigallocatechin (EGC), Epicatechin-3-gallate (ECG) 및 Epigallocatechin Gallate (EGCG)이 풍부하게 함유되어 있는데 (Chacko et al., 2010), 그 중 EGCG는 녹차에 함유된 카테킨 중 가장 강력한 효능을 지닌 것으로 알려져 있다 (Lim et al., 2015). 회화나무 (S. japonica L.)는 한국, 중국, 일본, 베트남 등 국가에서 흔히 볼 수 있는 중형 낙엽수로서 꽃과 열매는 한국, 중국, 일본에서 생약으로 사용되고 있고 그중 열매는 한국에서 식품용으로도 사용되고 있다. 특히, 한국에서는 회화나무의 꽃과 열매가 지혈 작용이 있는 것으로 알려져 있고 잎은 지혈, 혈압강하 및 항염증 작용이 있는 것으로 알려져 있다 (He et al., 2016). 또한 회화나무 열매에는 catechin, rutin, quercetin 등 다양한 생리활성 물질들이 함유되어 있어 (Choi et al., 2008) 이상 3 종 식물추출물을 최종 후보물질로 사용하였다.
활성산소는 모유두세포의 형태, 이동 및 증식을 변화시키며, 산화적스트레스 (oxidative stress)는 탈모를 유발하는 중요한 인자이다 (Trueb, 2009). 인체는 정상적인 생리적 기능을 위해 체내 자유라디칼과 항산화제의 균형 유지가 필요하며, 체내 생성 자유라디칼과 항산화제의 불균형으로 인해 발생하는 현상을 산화적스트레스라고 한다 (Lobo et al., 2010). 또한 자유라디칼은 짝을 이루지 않은 전자를 가진 반응성 높은 분자로서 다양한 세포의 구조막, 지질, 단백질 및 DNA를 손상시킨다. 신체는 항산화 효소 (superoxide dismutase, catalase, glutathione peroxidase) 및 항산화 분자 (비타민 C, 비타민 E, glutathione, ubiquinone)를 이용한 방어기전을 통해 자유라디칼을 환원시켜 자신을 보호한다.
산화적스트레스로 인해 체내 자유라디칼 생성이 증가하여 세포 구조의 점진적 손상을 초래하게 되면 탈모 증상으로 나타날 수 있으며 (Trueb, 2009) 탈모 부위의 모유두세포는 정상세포에 비해 산화적스트레스에 더 민감하게 반응하여 모발의 성장을 억제하는 transforming growth factor-β1 (TGF-β1), β2를 분비한다 (Lolli et al., 2017). 따라서 항산화 효능은 탈모 예방 및 개선 효과를 나타냄에 있어서 매우 중요한 지표이다. 본 연구 결과에서 감잎 추출물, 녹차 추출물은 DPPH 및 ABTS 라디칼에 대해 높은 소거 효과를 나타냈으며 이들의 복합물인 BLH308은 녹차 추출물보다는 낮지만, 감잎 추출물보다 더 우수한 항산화 효능을 보였다.
Lee 등 (2021)이 보고하였던 바와 같이 녹차 추출물은 DPPH와 ABTS 라디칼을 소거하는 항산화활성이 높으며, 항산화 활성은 페놀화합물 및 플라보노이드의 함량과 상관관계가 높다고 보고한 연구 결과에 따라 (Bae et al., 2019), BLH308의 높은 항산화 활성은 감잎 추출물 중 탄닌산, 녹차 추출물중 카테킨 등 페놀화합물에 의한 것으로 생각된다. 또한 감잎에 풍부하다고 알려진 비타민C도 BLH308의 뛰어난 항산화 활성에 영향을 주었을 것으로 보인다.
IL-6는 다양한 자가면역질환 혹은 만성 염증 상태에서 매우 중요한 역할을 하는 전염증성 사이토카인으로 많은 연구 결과에 의하면 원형탈모 환자의 혈중 IL-6의 농도는 건강한 사람에 비해 유의적으로 높았다 (Torkestani et al., 2021). 또한, IL-6는 탈모 부위에서 채취한 모유두세포에서 정상 모유두세포에 비해 그 발현이 증가하였으며 농도 의존적으로 모간의 성장을 억제하는 것으로 보고되었다 (Kwak et al., 2012).
한편, TNF-α는 면역세포 혹은 비면역세포 모두에서 분비되는 전염증성 사이토카인으로 류마티스 관절염, 건선과 같은 염증성 질병에서 중요한 작용을 한다. TNF-α는 in vitro 실험에서 모발의 성장을 중단시키고 모낭 기질세포의 액포 형성 (vacuolation)을 유발하며 matrix의 크기를 감소시킨다고 보고된 바 있으며 (Torkestani et al., 2021), 건강한 사람에 비해 원형탈모 환자에서 혈중 TNF-α의 농도가 유의적으로 높다는 보고가 있다 (Torkestani et al., 2021).
감잎 추출물 (Lee, 2014), 녹차 추출물 (Chen et al., 2017), 회화나무 추출물 (Ko et al., 2013)은 LPS로 유도된 마우스 대식세포에서 IL-6, TNF-α의 생성을 감소시킨다고 보고된 바 있다. 본 연구에서도 이들 연구 결과와 유사하게 감잎 추출물, 녹차 추출물, 회화나무 열매 추출물 및 BLH308은 IL-6와 TNF-α의 생성을 농도 의존적으로 억제하였으므로, BLH308은 이들 사이토카인의 발현을 조절하여 탈모 개선에 좋은 효과를 보일 수 있을 것으로 예상된다.
DHT의 과다 축적은 안드로겐성 탈모증 경향이 있는 모낭에서 모낭의 축소를 촉진하며 DHT외에도 TGF-β, dickkopf-1, IL-6, iNOS는 모낭의 생물학적 활성에 부정적 영향을 주어 탈모를 유발한다 (Khantham et al., 2022). iNOS는 L-arginine으로부터 NO가 생성되게 촉매하는 효소로서 이때 생성된 NO는 아민류와 반응하여 발암물질인 nitrosamine을 생성한다. 이 물질은 LPS로 염증이 유도된 염증반응계에서 생성되며 superoxide (O2-)와 반응하게 되면 매우 강력한 산화제인 peroxynitrite (ONOO-)를 생성하게 되므로 (Yang et al., 2012), NO의 생성 및 iNOS의 발현 억제는 탈모 개선에 매우 중요하다. 실험 결과 (Fig. 4 and Fig. 5)에서 보인 것과 같이 감잎 추출물, 녹차 추출물, 회화나무 열매 추출물 및 BLH308은 iNOS의 발현 및 NO의 생성을 모두 농도 의존적으로 억제하였으며, 이러한 연구 결과는 BLH308이 모낭의 생물학적 활성에 부정적 영향을 주는 인자들을 효과적으로 억제하여 탈모의 진행을 억제할 수 있음을 의미한다.
TST는 5알파-환원효소Ⅱ에 의해 DHT로 전환되고 이 DHT가 두피에 과다하게 축적되면 모낭을 자극하여 탈모가 유발된다 (Lolli et al., 2017). 본 연구에서는 모유두세포가 과량의 TST에 노출되면 5알파-환원효소Ⅱ의 발현이 증가하는 것을 확인하였고 BLH308은 TST에 의해 증가하는 5알파-환원효소Ⅱ의 발현을 억제하였다.
탈모는 5알파-환원효소Ⅱ에 의해 촉매되는 DHT의 과다 생성이 주요 원인이므로 5알파-환원효소Ⅱ의 발현 억제는 DHT의 과다 생성을 억제하게 되며 이는 탈모 개선에 도움을 줄 것이라 예상된다.
Kang 등 (2019)에 의하면 모유두세포에서 5알파-환원효소Ⅱ는 DHT에 의해서도 그 발현이 증가하는데 BLH308은 모유두세포에서 TST에 의해 증가하는 5알파-환원효소Ⅱ의 발현을 감소시키므로 5알파-환원효소Ⅱ에 의해 생성되는 DHT의 양도 감소시킬 수 있을 것으로 예상되며 이는 추후 연구를 통해 확인이 필요하다.
또한 모발 휴지기 (telogen) 마우스의 등 피부에 testosterone을 지속적으로 적용하면 마우스의 피부에서 5알파-환원효소Ⅱ의 발현이 증가 되며 (Lao et al., 2022), 이로 인해 telogen이 지속되면서 모발 성장기 (anagen)의 도래가 지연된다. 본 연구에서도 testosterone propionate의 지속적인 투여로 인해 마우스의 anagen 도래가 지연되었으며, BLH308은 이로 인한 anagen의 도래 지연을 억제하여 모발의 생장을 돕는 것으로 나타났다. 이러한 결과는 BLH308은 모유두세포의 5알파-환원효소Ⅱ의 발현을 효과적으로 억제하여 남성 호르몬에 의한 탈모 즉 안드로겐성 탈모의 진행을 개선 시킬 수 있음을 의미한다.
본 연구에서 녹차 추출물은 3 종 시료 중 가장 낮은 IL-6와 TNF-α의 생성 억제능을 나타냈지만, 그에 반해 월등한 DPPH와 ABTS 라디칼 소거능을 보여주었고 또한 3 종 시료 중 가장 낮은 라디칼 소거능을 나타냈던 회화나무 열매 추출물은 COX-2와 5알파-환원효소Ⅱ의 발현을 가장 효과적으로 억제하였다. 녹차 추출물과 회화나무 열매 추출물의 이러한 상호보완작용으로 인해 감잎 추출물과 혼합하여 복합물로 제조하였고, 이렇게 제조된 BLH308은 우수한 항산화, 항염증 효과가 있을 뿐만 아니라 TST에 의해 증가하는 5알파-환원효소Ⅱ의 발현을 억제하며, testosterone propionate로 탈모가 유발된 마우스의 발모를 촉진 시킨다는 결과를 얻었다.
본 연구를 통해 BLH308은 산화적 스트레스, 만성 염증 및 5알파-환원효소Ⅱ의 과다 발현 등 탈모를 유발하는 복합적 원인을 다방면으로 제거하여 효과적으로 탈모를 개선할 수 있는 천연 식품소재인 것을 확인하였으며 모발건강 식품원료로서의 사용 가능성을 시사하였다.
References
-
Bae MJ, Kim EN, Choi HK, Byun MS, Chung KH, Yoon JA and An JH. (2019). Quality characteristics and antioxidant activities of strawberries according to various extraction methods. Journal of the Korean Society of Food Science and Nutrition. 48:728-738.
[https://doi.org/10.3746/jkfn.2019.48.7.728]

-
Blois MS. (1958). Antioxidant determination by the use of a stable free radical. Nature. 181:1198-2000.
[https://doi.org/10.1038/1811199a0]

-
Brand-Williams W, Cuvelier ME and Berset C. (1995). Use of a free radical method to evaluate antioxidant activity. LWT-Food Science and Technology. 28:25-30.
[https://doi.org/10.1016/S0023-6438(95)80008-5]

-
Byeon SE, Chung JY, Lee YG, Kim BH, Kim KH and Cho JY. (2008). In vitro and In vivo anti-inflammatory effects of taheebo, a water extract from the inner bark of Tabebuia avellanedae. Journal of Ethnopharmacology. 119:145-152.
[https://doi.org/10.1016/j.jep.2008.06.016]

-
Chacko SM, Thambi PT, Kuttan R and Nishigaki I. (2010). Beneficial effects of green tea: A literature review. Chinese medicine. 5:13. https://cmjournal.biomedcentral.com/articles/10.1186/1749-8546-5-13, (cited by 2022 April 18).
[https://doi.org/10.1186/1749-8546-5-13]

-
Chen XM, Kitts DD and Ma Z. (2017). Demonstrating the relationship between the phytochemical profile of different teas with relative antioxidant and anti-inflammatory capacities. Functional Foods in Health and Disease. 7:375-395.
[https://doi.org/10.31989/ffhd.v7i6.342]

-
Choi YS, Shin EH, Park SJ and Kim JD. (2008). National characteristics and some bioactive components contents of Sophorae fructus. Journal of Korean Society of Food Science and Nutrition. 37:1154-1161.
[https://doi.org/10.3746/jkfn.2008.37.9.1154]

-
Cotsarelis G and Millar SE. (2001). Towards a molecular understanding of hair loss and its treatment. Trends in Molecular Medicine. 7:293-301.
[https://doi.org/10.1016/S1471-4914(01)02027-5]

-
Dawber RPR. (1987). Aetiology and pathophysiology of hair loss. Dermatology. 175:23-28.
[https://doi.org/10.1159/000248896]

- Durgawale TP, Durgawale PP and Khanwelkar CC. (2016). Quantitative estimation of tannins by HPLC. Der Pharmacia Lettre. 8:123-126.
-
He XR, Bai Y, Zhao Z, Wang X, Fang J, Huang L, Zeng M, Zhang Q, Zhang Y and Zheng X. (2016). Local and traditional uses, phytochemistry, and pharmacology of Sophora japonica L.: A review. Journal of Ethnopharmacology. 187:160-182.
[https://doi.org/10.1016/j.jep.2016.04.014]

-
Inui S and Itami S. (2013). Androgen actions on the human hair follicle: Perspectives. Experimental Dermatology 22:168-171.
[https://doi.org/10.1111/exd.12024]

-
Jin SW, Koh YW, Yun KW, Kim KJ, Je HS, Im SB, Kim KS, Kim MS, Yu BJ and Seo KS. (2017). Cell viability and hair growth effect on 3T3-L1 cells of ethanol extract from Calendula officinalis L. flower, Phellinus linteus fruit body and Houttuynia cordata Thunb. whole plant. Korean Journal of Medicinal Crop Science. 25:404-410.
[https://doi.org/10.7783/KJMCS.2017.25.6.404]

-
Kang MG, Park DU, Han HY, Shim HE, Hong YJ, Moon JY, Yoon SJ and Kwon BS. (2019). RE-ORGA, a Korean herb extract, can prevent hair loss induced by dihydrotestosterone in human dermal papilla cells. Annals of Dermatology. 31:530-537.
[https://doi.org/10.5021/ad.2019.31.5.530]

-
Kaufman KD, Olsen EA, Whiting D, Savin R, DeVillez R, Bergfeld W, Price VH, Van Neste D, Roberts JL, Hordinsky M, Shapiro J, Binkwitz B, Gormley GJ and The Finasteride Male Pattern Hair Loss Study Group. (1998). Finasteride in the treatment of men with androgenetic alopecia. Journal of the American Academy of Dermatology. 39:578-589.
[https://doi.org/10.1016/S0190-9622(98)70007-6]

-
Khantham C, Linsaenkart P, Chaitep Tanakarn, Jantrawut P, Chittasupho C, Rachtanapun P, Jantanasakulwong K, Phimolsiripol Y, Sommano SR, Prom-u-thai C, Jamjod S, Arjin C, Sringarm K, Berrada H, Barba FJ, Carmona FD, Nimlamool W and Ruksiriwanich W. (2022). Antioxidation, anti-inflammation, and regulation of SRD5A gene expression of Oryza sativa cv. Bue Bang 3 CMU husk and bran extracts as androgenetic alopecia molecular treatment substances. Plants. 11:330. https://www.mdpi.com/2223-7747/11/3/330, (cited by 2022 May 23).
[https://doi.org/10.3390/plants11030330]

-
Kim JH, Hong SK, Hwang SJ, Son SW and Choi YS. (2012). The preclinical and clinical effects of herbal product containing Rosa mutiflora root extracts as a main component on the hair growth promotion. Korean Journal of Medicinal Crop Science. 20:108-116.
[https://doi.org/10.7783/KJMCS.2012.20.2.108]

- Ko WM, Lee DS, Jang M, Kim KS Lee HS, Baek HY, Oh HC and Kim YC. (2013). A comparison of anti-inflammatory effects of Sophorae flos EtOH extracts at the different flowering stages on LPS-induced inflammation in RAW264.7 cells. Korean Journal of Pharmacognosy. 44:291-297.
- Kwak HY, Lee SJ, Lee DY, Jung L, Bae NH, Hong SY, Kim GW and Baek NI. (2008). Cytotoxic and anti-inflammatory activities of lipids from the Nuruk(Rhizopus oryzae KSD-815). Journal of the Korean Society for Applied Biological Chemistry. 51:142-147.
-
Kwak MH, Ahn JS, Kim MK, Kim JC, Sung YK. (2012). Dihydrotestosterone-inducible IL-6 inhibits elongation of human hair shafts by supressing matrix cell proliferation and promotes regression of hair follicles in mice. Journal of Investigative Dermatology. 132:43-49.
[https://doi.org/10.1038/jid.2011.274]

-
Lao ZZ, Fan YH, Huo YH, Liao F, Zhang RW, Zhang B, Kong ZY, Long HS, Xie JL, Sang CL, Fu LD, Lin J, W YN, Yu LW and Li G. (2022). Physcion, a novel inhibitor of 5α-reductase that promotes hair growth in vitro and in vivo. Archives of Dermatological Research. 314:41-51.
[https://doi.org/10.1007/s00403-021-02195-1]

- Lee JH. (2014). Anti-oxidant and anti-inflammatory effects of Diospyros kaki Thunb leaves extracts. Asian Journal of Beauty and Cosmetology. 12:719-724.
-
Lee WS and Lee HJ. (2012). Characteristics of androgenetic alopecia in Asian. Annals of Dermatology. 24:243-252.
[https://doi.org/10.5021/ad.2012.24.3.243]

-
Lee YR, Moon GH, Chung KH, Lee KJ, Shim DB, Kim JC and An JH. (2021). Antioxidant and anti-inflammatory effects of semi-fermented tea. Journal of Korean Society of Food Science and Nutrition. 50:927-935.
[https://doi.org/10.3746/jkfn.2021.50.9.927]

- Lim KH, Jeon SE and Choi MN. (2015). Review of effectiveness of green tea epigallocatechin gallate(EGCG) on the inside and outside of human body. Korean Journal of Aesthetics and Cosmetology. 13:701-711.
-
Lobo V, Patil A, Phatak A, Chandra N. (2010). Free radicals, antioxidants and functional foods: Impact on human health. Pharmacognosy Reviews. 4:118-126.
[https://doi.org/10.4103/0973-7847.70902]

-
Lolli F, Pallotti F, Rossi A, Fortuna MC, Caro G, Lenzi A, Sansone A and Lombardo F. (2017). Androgenetic alopecia: A review. Endocrine. 57:9-17.
[https://doi.org/10.1007/s12020-017-1280-y]

-
Matsuda H, Yamazaki M, Matsuo K, Asanuma Y and Kubo M. (2001). Anti-androgenic activity of Myricae cortex-isolation of active constituents from bark of Myrica rubra. Biological and Pharmaceutical Bulletin. 24:259-263.
[https://doi.org/10.1248/bpb.24.259]

- Ministry of Food and Drug(MFDS). (2021). Health functional food act. MFDS notification 2021-95. Ministry of Food and Drug. Cheongju, Korea. https://www.mfds.go.kr/brd/m_211/list.do, (cited by 2022 June 1).
- Ministry of Food and Drug(MFDS). (2022). Regulation on the registration of active pharmaceutical ingredient. Ministry of Food and Drug. Cheongju, Korea. https://nedrug.mfds.go.kr/search?keyword=finasteride, (cited by 2022 June 1).
-
Ozgen M, Reese RN, Tulio Jr AZ, Scheerens JC and Miller AR. (2006). Modified 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS) method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power(FRAP) and 2,2′-diphenyl-1-picrylhydrazyl(DPPH) methods. Journal of Agricultural and Food Chemistry. 54:1151-1157.
[https://doi.org/10.1021/jf051960d]

-
Park PJ, Moon BS, Lee SH, Kim SN, Kim AR, Kim HJ, Park WS, Choi KY, Cho EG and Lee TR. (2012). Hair growth-promoting effect of Aconiti ciliare tuber extract mediated by the activation of Wnt/β-catenin signaling. Life Sciences. 91: 935-943.
[https://doi.org/10.1016/j.lfs.2012.09.008]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M and Rice-Evans C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine. 26:1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Stough D, Stenn K, Haber R, Parsley WM, Vogel JE, Whiting DA and Washenik K. (2005). Psychological effect, pathophysiology, and management of androgenetic alopecia in men. Mayo Clinic Proceedings. 80:1316-1322.
[https://doi.org/10.4065/80.10.1316]

-
Torkestani S, Moghimi H, Farsiabi R, Khazaei S, Eftekharian MM and Dalvand E. (2021). Evaluation of serum levels of IL-6, IL-10, and TNF-α in alopecia areata patients: A systematic review and meta-analysis. Biomedical Research and Therapy. 8:4668-4678.
[https://doi.org/10.15419/bmrat.v8i10.702]

-
Trueb RM. (2009). Oxidative stress in ageing of hair. International Journal of Trichology. 1:6-14.
[https://doi.org/10.4103/0974-7753.51923]

-
Xie C, Xie Z, Xu X and Yang D. (2015). Persimmon(Diospyros kaki L.) leaves: A review on traditional uses, phytochemistry and pharmacological properties. Journal of Ethnopharmacology. 163:229-240.
[https://doi.org/10.1016/j.jep.2015.01.007]

-
Yang SA, Pyo BS, Kim SM and Lee KI. (2012). Antibacterial activity and nitric oxide production inhibitory activity of the extract and its fractions from the leaves of Prunus sargentii. Korean Journal of Medicinal Crop Science. 20:308-314.
[https://doi.org/10.7783/KJMCS.2012.20.4.308]

