커피나무 잎 추출물의 라디칼 소거 활성 성분 탐색
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Coffee tree leaves contain bio-active compounds that exhibit various functions. Recently, coffee trees have been cultivated in Korea, mainly in the south. We analytically investigated the antioxidant activity of coffee tree leaves grown in Korea.
We prepared hot water extracts with a specific extraction time (10 min - 120 min) and ethanol extracts using specific concentration levels (5% - 80%). 1,1-Diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity was investigated using liquid chromatography (LC) analysis. We performed a mass spectrometry (MS) using the identified radical scavenging active compound peaks. We confirmed 7 compounds, including 5-caffeoyl quinic acid, 3-caffeoyl quinic acid, cinnamtannin B-1, mangiferin, 3,4-dicaffeoyl quinic acid, 3,5-dicaffeoyl quinic acid, and 4,5-dicaffeoyl quinic acid. The MS with multiple reaction monitoring (MRM) mode analysis provided a method for analyzing radical scavenging active compounds in coffee tree leaf extracts using LC-MS/MS.
The comparative analysis revealed, ethanol extraction had a higher extraction efficiency of the antioxidant active compounds than the hot water extraction. The optimum thechnique used over 40% ethanol for extracting the highest levels of antioxidant activity from coffee leaves.
Keywords:
Coffea arabica, Coffee leaves, Antioxidant, 1,1-Diphenyl-2-picrylhydrazyl Radical, Liquid Chromatography, Mass spectrometry서 언
커피나무는 꼭두서니과 (Rubiaceae)의 Coffea 속으로 전 세계적으로 70 여종이 있으며, 대표적인 품종으로서 아라비카종 (Coffea arabica), 카네포라종 (Coffea canephora)과 리베리카종 (Coffea liberica) 등이 있다 (Davis et al., 2006). 커피는 북위 22 도에서 남위 26 도 사이에 위치하는 커피 존 (Coffee zone) 이라고 불리는 적도를 중심으로 한 열대 및 아열대 기후에서 재배되는 작물로서 우리나라의 자연적 환경에서는 생산이 어렵지만 제주도, 전남, 경남 지역 등에서 시설재배 방식을 활용하여 재배가 점차 늘어나고 있다 (Moon et al., 2019).
커피나무 잎은 주로 이용되는 커피 콩이 가지고 있는 가치로 인해 그 가치가 무시되거나 관심이 낮지만, 주요 산지가 있는 지역을 중심으로 다양한 질환 치료나 증상의 완화를 위해 전통적으로 이용되어왔으며 (Ngamsuk et al., 2019), 유럽 연합 (European Union)의 새로운 식품 규정에 따라 2020년에 이용이 공식적으로 승인되었다 (Tritsch et al., 2022).
커피 콩에 대한 연구에 비해서는 적은 편이지만 해외의 커피 주요 산지를 중심으로 커피나무의 잎에 존재하는 다양한 성분 연구와 함께 활용도를 높이기 위한 연구가 지속적으로 이루어지고 있다 (Chen et al., 2018; Chen et al., 2019; de Almeida et al., 2019; Hariyadi et al., 2020; Monteiro et al., 2020; Maxiselly et al., 2022). 국내에서도 관련 제품 개발에 커피나무 잎 추출물의 기능성을 활용하기 위한 기초 활성 연구가 진행되고 있으나 (Im and Doo, 2021a; Im and Doo, 2021b), 커피 콩의 성분 및 활성 등에 대한 다양한 연구들에 비해서는 아직 까지는 부족한 실정이다 (Nam and Kang, 2015; Lee et al., 2016; Kim and Lee, 2018; Lee et al., 2018; Shin, 2019).
여러 가지 생리활성 중에서도 항염증이나 미백 활성 등 다양한 활성과 연관성이 높은 것으로 알려진 항산화 활성 소재의 개발에 대한 연구가 지속적으로 수행되고 있다 (Song and Lee, 2015; Yoo et al., 2019; Im and Lee, 2020; Kim et al., 2020).
항산화 활성 관련 연구들에서 대상이 되고 있는 활성산소 (reactive oxygen species)에는 hydroxyl radical, superoxide anion 등의 free radical들이 있으며, 활성산소의 작용으로 나타나는 DNA 변성, 세포막 손상, 단백질 변성 등으로 인해 피부노화나 염증반응, 암 등의 각종 질환을 일으키는 원인이 된다 (Devasagayam et al., 2004; Valko et al., 2007; Lee et al., 2015). 이러한 활성산소에 대응하기 위해 외부에서 공급할 수 있는 항산화제로서 butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT)와 같은 합성 항산화제가 식품첨가물 등으로 사용되고 있으나 화학적 합성 성분에 대한 거부감 등으로 인해 식물 추출물과 같은 천연물로부터 항산화 소재를 찾기 위한 연구와 개발이 지속적으로 이루어지고 있다 (Kim et al., 2018; Kim et al., 2019).
한편, 식물 추출물은 최소 수 백가지 이상의 성분이 혼합된 형태로서 분리 방법을 최적화한다고 하더라도 추출물에 존재하는 모든 성분을 완벽하게 분리하는 것은 일반적인 액체크로마토그래피 (liquiud chromatography; LC) 시스템에서는 한계가 있다. 또한 성분 특성에 따라서 검출 또한 다양하여 가장 보편적으로 사용되는 자외선이나 형광 검출기, 굴절률 검출기 등으로 확인이 어려운 경우가 빈번히 발생하게 되며, 분석에 필수적인 모든 성분에 대한 표준품 역시 현실적으로는 어렵다.
이러한 부분을 보완할 수 있는 검출장비로서 활용도가 높아지고 있는 질량분석기 (mass spectrometry; MS)는 구성 성분이 다양하여 일반적인 LC 조건에서 완벽한 분리가 쉽지 않고 미지의 성분에 대한 사전적인 표준품 확보가 어려운 식물 추출물 연구에서 기초적이며, 예비적인 정성분석의 도구로서 유용하게 활용될 수 있다.
MS 장비 중에서도 정성 및 정량분석 목적으로 triple quadrupole 구조를 가지고 있는 LC-MS/MS는 일반적인 LC-MS에서 수행될 수 있는 scan 및 selected ion monitoring (SIM) mode 분석과 함께 특정한 모분자 (molecular ion)로부터 생성되는 특정한 조각 이온 (product ion)을 선택적으로 검출하는 multiple reaction monitoring (MRM) 또는 selected reaction monitoring (SRM) mode 분석이 가능한 질량분석 장비로서 (Na et al., 2020), MRM이나 SRM mode 분석을 수행하면 설정된 조건을 만족하는 product ion만을 검출하는 특성으로 인해 일반적인 LC 분석에서 나타나는 인접한 방해성분의 영향을 최소화할 수 있으며, 머무름 시간 (retention time)이 겹치는 성분에 대해서도 분석이 가능하게 된다 (Im and Lee, 2020).
국내에서 재배된 커피나무 잎의 조건별 추출물을 대상으로 항산화 활성과 caffeine을 포함한 3 가지 성분의 비교에 관한 연구는 있었으나 각 성분과 항산화 활성 관련성에 대한 내용은 포함되지 않았다 (Im and Doo, 2021a). 또한 LC 분석에서 나타날 수 있는 인접 성분과의 간섭이나 겹침으로 인한 오류를 확인하기 위한 MS 분석 등 추가적인 검증이 이루어지지 않았었다.
본 연구에서는 커피나무 잎 추출물에 존재하는 항산화 활성 성분에 대한 탐색을 위해 커피나무 잎 추출물을 대상으로 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical 소거 활성을 LC분석과 동시에 측정한 후 확인된 radical 소거 활성 성분 peak의 질량분석을 실시하고, MRM mode 분석 조건을 설정하여 LC-MS/MS를 활용한 커피나무 잎 추출물 중 radical 소거 활성 성분 분석 방법을 검토하였다.
재료 및 방법
1. 식물재료
커피나무 잎은 제주 지역에서 재배되고 있는 아라비카 (Coffea arabica L.) 종에서 2020년에 채취한 것을 60℃에서 48 시간 동안 건조시킨 후 진공포장하여 보관하면서 사용하였으며, 분쇄기를 사용하여 60 mesh 이하의 크기로 균일하게 분쇄한 것을 추출에 사용하였다.
2. 추출물 제조
커피나무 잎 열수 추출물은 분쇄 시료 15 g에 정제수 250 ㎖를 혼합한 후 100℃로 환류 추출을 실시하였다. 가열을 시작한 후 최초 100℃에 도달한 시각부터 10 분, 20 분, 30 분, 60 분, 120 분까지 5 종의 열수 추출을 제조하였으며, 상온으로 냉각시킨 후 여과를 실시한 후 4℃ 이하로 냉장 보관하면서 실험에 사용하였다.
커피나무 잎 에탄올 추출물은 분쇄 시료 15 g에 5%, 10%, 20%, 40%, 80% 에탄올 250 ㎖를 혼합한 후 상온에서 진탕 추출을 실시하였다. 진탕 추출은 분당 180 회의 속도를 적용하여 24 시간 동안 실시하였으며, 추출 후 여과를 실시한 후 4℃ 이하로 냉장 보관하면서 실험에 사용하였다.
3. Online-LC-DPPH radical 소거능 측정
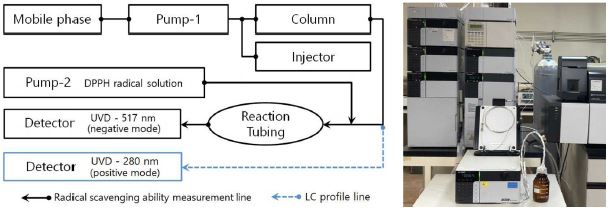
커피나무 잎 추출물 시료의 LC 분리 및 radical 소거능 동시 측정을 위해 LC-30A (Shimadzu Co., Kyoto, Japan) 액체크로마토그래피와 column으로서 Kinetex C18 (2.1 mm × 150 mm, 2.6 μm, Phenomenex, Torrance, CA, USA)을 기본 장비 구성으로 하여 분석을 실시하였다.
시료 주입량은 5 ㎕, column oven은 40℃를 유지하였으며, 이동상으로 0.1% formic acid (A)와 methanol (B)을 사용하여 유속은 0.25 ㎖/min으로 유지하였다. 이동상은 초기 5 분까지 2% B, 5 분에서 47 분까지 40% B가 되도록 하였고, 47 분에서 48 분까지 100% B가 되도록 하여 54 분까지 유지한 후 다시 2% B로 낮춰서 60 분간 측정 및 분석을 실시하였다.
전체적인 시스템의 구성은 Fig. 1과 같이 구성하였으며, 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical 용액을 공급하기 위해 추가로 LC-20AD pump (Shimadzu Co., Kyoto, Japan)를 설치하였다. Column에서 분리된 시료액과 radical 용액이 혼합된 이후 radical 소거 반응을 위해 길이 1 m의 reaction tubing을 설치하였다. Methanol에 50 μM로 용해시킨 DPPH 용액을 사용하였으며, 유속은 0.15 ㎖/min으로 유지하면서 검출기 (SPD-10Avp, Shimadzu Co., Kyoto, Japan) 파장은 517 nm로 설정하였다. DPPH radical 소거 반응 특성으로 인해 활성 성분과 radical 용액이 반응하여 흡광도가 낮아지는 것을 검출해야 하므로 측정 후 결과 판독 용이성을 위해 검출기의 polarity를 반대 (negative mode)로 설정하였다. 활성 성분의 정성 분석을 위한 LC profile 분석은 DPPH radical 용액을 정지한 상태에서 검출기를 정상 (positive mode)으로 재설정한 후 280 nm에서 실시하였다.
4. 활성 성분의 LC-MS/MS 분석
DPPH radical 소거 활성 성분에 대한 질량분석에는 LC-30A (Shimadzu Co., Kyoto, Japan) 액체크로마토그래피와 연동된 LCMS-8050 (Shimadzu Co., Kyoto, Japan) 삼중사중극자 질량분석기 (triple quadrupole mass spectroscopy)를 사용하였으며, LC profile과 radical 소거 활성 동시 측정 조건과 동일한 분리 조건을 적용하였으며, Table 1과 같은 세부 조건을 적용하여 분석을 실시하였다.
모분자 이온 (molecular ion)과 생성 이온 (product ion) 확인 분석 결과를 바탕으로 활성 성분의 신속하고 정확한 분석을 위한 multiple reaction monitoring (MRM) mode 조건적용을 위한 분석에는 이동상과 유속은 동일하게 유지하였으며, 시료 주입량은 1 ㎕로 설정하였다. 이동상은 초기 5 분까지 2% B, 2 분에서 19 분까지 40% B가 되도록 하였고, 19 분에서 20 분까지 100% B가 되도록 하여 25분까지 유지한 후 다시 2% B로 낮춰서 30 분간 분석을 실시하였다.
결과 및 고찰
1. Online-LC-DPPH radical 소거능
항산화 활성을 측정하는 다양한 방법 중 식물 추출물 시료의 항산화 활성 측정에 가장 일반적으로 활용되고 있는 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical 소거능은 radical의 환원에 따른 색상 변화를 측정하여 결과의 비교가 용이한 장점을 가지고 있다 (Blois, 1958; Cha, 2015; Im et al., 2017).
일반적으로 spectrophotometer 기반의 분광학적 장비를 이용하는 DPPH radical 소거능 측정 실험법에서 식물 추출물과 같이 매우 많은 성분이 혼합되어 있는 시료일 경우 실험 결과로 확인할 수 있는 활성이 특정 성분의 활성이라기보다는 여러 성분의 병합적인 활성일 수밖에 없다. 따라서 항산화 활성 성분에 대한 탐색 효율을 증진시키기 위해 액체크로마토그래피 (liquid chromatography; LC)를 이용하여 성분 분리한 후 연속적으로 분리된 성분의 항산화 활성을 검토하기 위한 연구가 다양하게 진행되고 있다 (Hong et al., 2014; Zhang et al., 2015; Im et al., 2017).
Online-LC-DPPH radical 소거능 측정 시스템에서는 column 분리 이후 검출기로 연결되는 중간에 radical 용액을 일정하게 공급하게 되므로 항산화 활성 성분이 분리되어 나오는 시간에만 radical 소거 반응이 나타나게 된다. DPPH radical은 자색을 나타내지만 항산화 활성을 가지는 성분과 반응하면 탈색되어 흡광도가 감소하게 된다. 따라서 검출기의 polarity를 반대 (negative mode)로 설정하여 일반적인 LC 분석 결과 chromatogram과 동일한 형태로 변환함으로써 판독을 용이하게 할 수 있다. 이와 관련된 세부 조건들은 선행 연구들에서 검토된 내용을 반영하였다 (Im et al., 2017; Kim et al., 2019; Im and Lee, 2020).
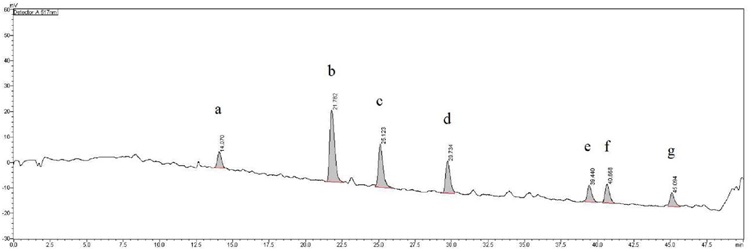
사전 연구를 통해 가장 항산화 활성이 우수한 것으로 확인된 커피나무 (Coffea arabica L.) 잎 80% 에탄올 추출물을 대상으로 Fig. 1과 같은 시스템을 활용한 online-LC-DPPH radical 소거능을 측정한 결과에서 Fig. 2와 같이 a부터 g까지 7 개의 주요 radical 소거 활성 peak를 확인할 수 있었다. 본 연구에서 활용된 측정 시스템의 결과에서 peak를 나타낸 것은 해당 머무름 시간에 항산화 활성을 가지는 성분이 분리되어 나왔음을 의미하며, peak의 면적이 클수록 항산화 활성이 상대적으로 강한 성분이거나 함량이 높을 수 있음을 나타낸다.
2. 주요 활성 peak의 LC-MS 분석
Fig. 1에 제시한 측정 시스템 중 DPPH radical 용액의 공급을 정지한 상태에서 동일한 LC 분리 조건을 적용하여 positive mode의 280 nm 검출 조건에서 Fig. 3과 같은 성분 profile 결과를 얻을 수 있었으며, a부터 g까지의 각 활성 peak 머무름 시간을 기준으로 질량분석을 실시하였다.
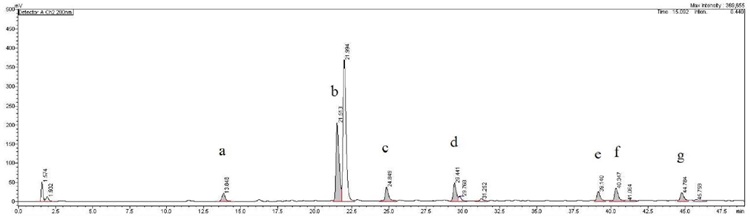
LC profile of the extract of Coffea arabica leaves.Different superscripts (a - g) are major active peaks.
질량분석은 online-DPPH-radical 소거능 측정 및 LC profile 분석과 동일한 분리 조건을 적용하였으며, 이에 따라 머무름 시간을 기준으로 각 활성 peak의 질량분석 결과를 검토하였다. 일반적으로 electrospray ionization (ESI) 이온화 장치를 기반으로 하는 질량분석기에서는 positive mode에서 나타나는 모분자량 패턴인 [M+H]+, [M+Na]+와 negative mode 에서 나타나는 모분자의 형태 [M-H]-를 상호 대조하여 모분자량을 추정할 수 있다.
한편, 열수나 에탄올 추출물처럼 다른 용매에 비해 극성도가 높은 식물 추출물 중에 존재하는 radical 소거 활성 성분은 phenolic acid 계열의 분자처럼 구조 내에 hydroxyl group(-OH)을 포함하는 경우가 많아서 negative mode 질량분석 결과에서 positive mode보다 단순한 모분자량 패턴을 가진다.
커피나무 잎 80% 에탄올 추출물을 분석하여 Fig. 4와 같은 질량분석 결과를 얻을 수 있었으며, LC profile 분석과 DPPH radical 소거능 측정 결과의 활성 peak 머무름 시간 대조를 통해 해당하는 a - g의 모분자량을 Fig. 5(A, B) - Fig. 11(A, B)과 같이 확인할 수 있었다.
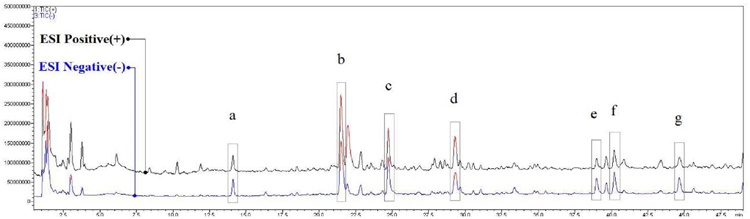
LC-MS total ion chromatograms of the extract of Coffea arabica leaves.Different superscripts (a - g) are major active peaks.
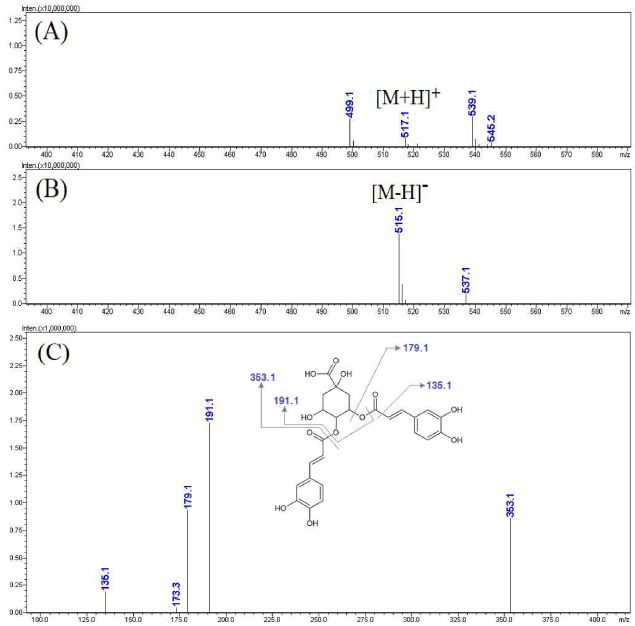
Fig. 5에 제시한 활성 peak a의 MS spectra를 보면 negative mode에서 [M-H]- 형태로 볼 수 있는 353.1 m/z와 positive mode에서 [M+H]+ 형태로 볼 수 있는 355.1 m/z가 확인됨에 따라 모분자량이 354인 성분임을 확인할 수 있었다. 상대적으로 molecular ion이 강하게 나타난 negative mode에서 353.1 m/z로부터 생성된 MS2 spectra를 보면 특징적으로 191.1, 179.1, 135.1 m/z 등의 ion이 생성됨을 알 수 있었는데 이와 같은 MS spectra는 기존의 문헌을 참고하여 caffeoyl quinic acid 계열의 성분에서 나타나는 전형적인 형태임을 알 수 있었다 (Bajko et al., 2016).
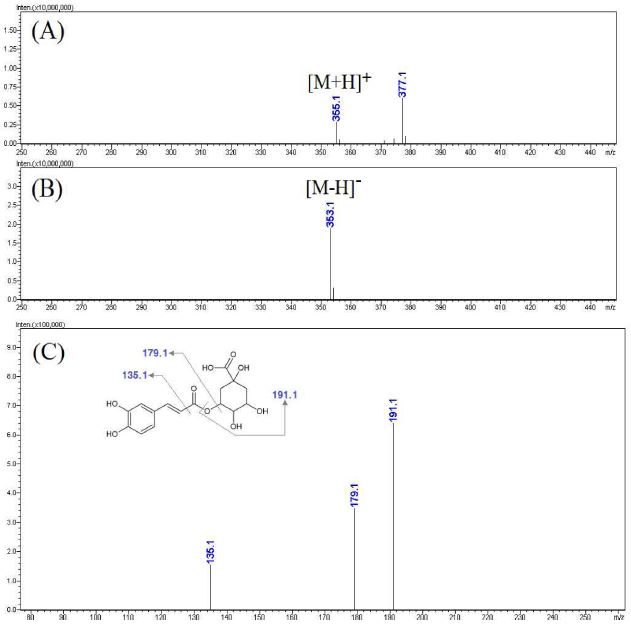
LC-MS analysis results of the major active peak a.(A) positive mode MS spectra of the major peak a, (B) negative mode MS spectra of the major peak A, (C) MS2 spectra of m/z 353.1([M-H]-).
Fig. 6에 나타낸 활성 peak b의 MS spectra에서도 활성 peak a와 유사한 패턴의 MS 및 MS2 spectra를 나타냄에 따라 caffeoyl quinic acid 계열의 성분임을 추정할 수 있었다. Caffeoyl quinic acid 계열에서 일반적으로 나타날 수 있는 화학구조와 기존 연구 보고를 검토하여 3-, 5- 위치에 caffeoyl 기를 포함하는 caffeoyl quinic acid임을 확인할 수 있었으며, 활성 peak a, b가 각각 5-caffeoylquinic acid, 3-caffeoylquinic acid임을 확인하였다 (Zhang et al., 2015; Chen et al., 2018).
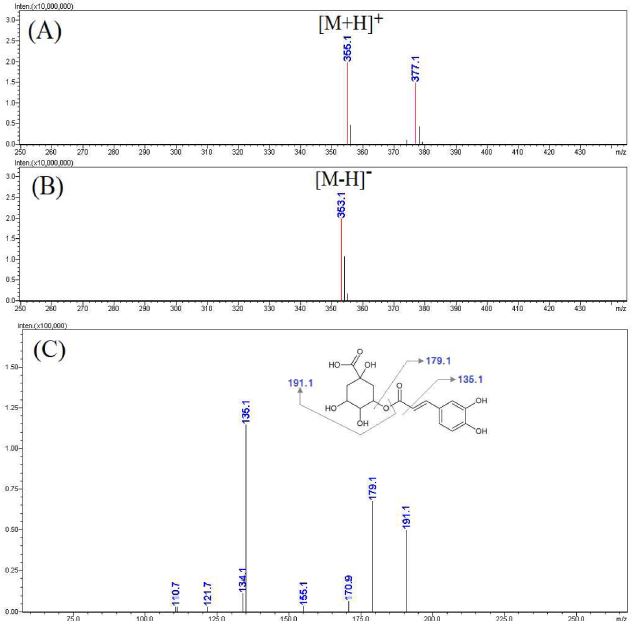
LC-MS analysis results of the major active peak b.(A) positive mode MS spectra of the major peak b, (B) negative mode MS spectra of the major peak B, (C) MS2 spectra of m/z 353.1 ([M-H]-).
Fig. 7에 제시한 활성 peak c의 MS spectra를 보면 negative mode에서 [M-H]- 형태로 볼 수 있는 863.1 m/z와 positive mode에서 [M+H]+ 형태로 볼 수 있는 865.1 m/z가 확인됨에 따라 모분자량이 864인 성분임을 알 수 있었다. 상대적으로 molecular ion이 강하게 나타난 negative mode에서 863.1 m/z로부터 생성된 MS2 spectra를 보면 특징적으로 711.1, 411.1, 451.1, 573.1 m/z 등의 ion이 생성됨을 알 수 있었는데 이와 같은 MS spectra는 catechin이나 epicatechin의 trimer 형태에서 파생된 분자 구조에서 나타나는 형태임을 알 수 있었으며, procyanidin 화합물에 대한 질량분석 연구에 관한 기존 문헌과 비교하여 cinnamtannin B-1임을 확인하였다 (Rue et al., 2018; Rush et al., 2018).
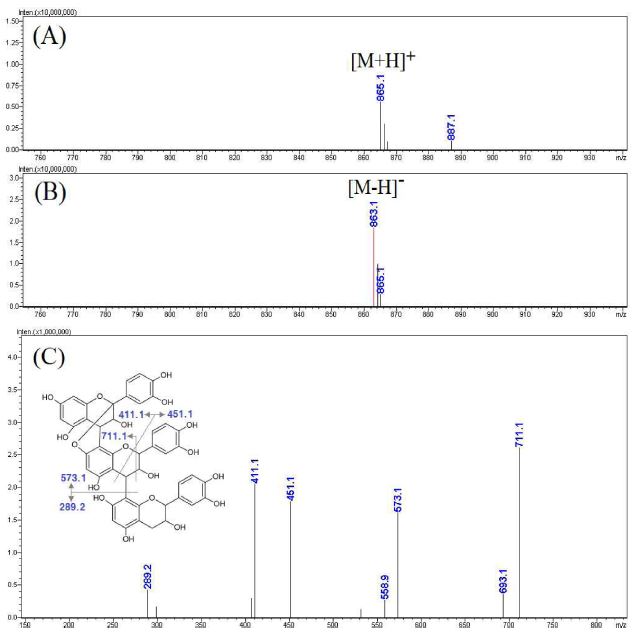
LC-MS analysis results of the major active peak c.(A) positive mode MS spectra of the major peak c, (B) negative mode MS spectra of the major peak C, (C) MS2 spectra of m/z 863.1 ([M-H]-).
Cinnamtannin B-1은 A형 proanthocyanidin으로서 기존 연구에서는 B형 proanthocyanidin의 일종인 procyanidin C가 커피나무 잎에 존재하는 것으로 보고되었었다 (Ngamsuk et al., 2019). Cinnamtannin B-1은 고비 (Osmunda japonica)와 같은 식물에 존재하는 것으로 보고되었으며, 높은 항산화 활성을 가지는 것으로 확인되었으나 (Kim et al., 2016; Woo et al., 2017), 아직 국내에서 재배된 커피나무 잎에서 확인된 바는 없었다.
Fig. 8에 제시한 활성 peak d의 MS spectra를 보면 negative mode에서 [M-H]- 형태로 볼 수 있는 421.1 m/z와 positive mode에서 [M+H]+ 형태로 볼 수 있는 423.1 m/z가 확인됨에 따라 모분자량이 422인 성분임을 알 수 있었다. 상대적으로 molecular ion이 강하게 나타난 negative mode에서 421.1 m/z로부터 생성된 MS2 spectra를 보면 특징적으로 301.1, 271.1, 331.1 m/z 등의 ion이 생성됨을 알 수 있었는데 이와 같은 MS spectra는 커피나무 잎 등에 존재하는 mangiferin에서 나타나는 형태임을 알 수 있었으며, 다양한 연구에서 커피나무의 잎에 존재하는 항산화 활성 성분 중 하나로 보고하고 있다 (Campa et al., 2012; Chen et al., 2019; Ngamsuk et al., 2019; Monteiro et al., 2020).
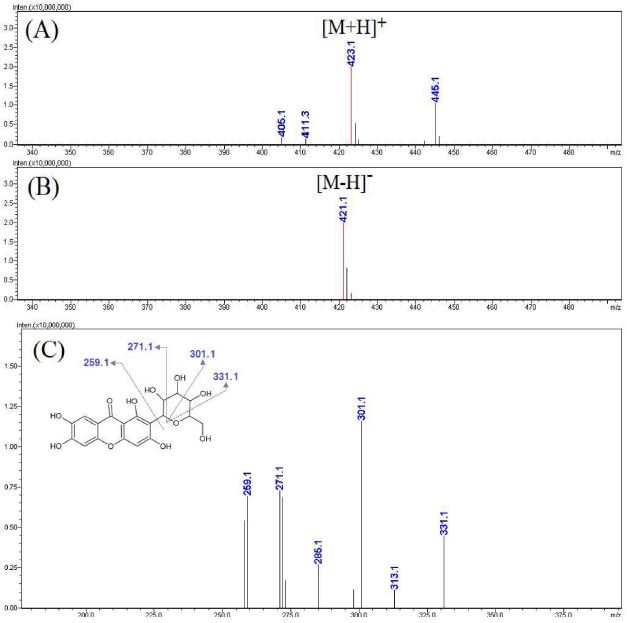
LC-MS analysis results of the major active peak d.(A) positive mode MS spectra of the major peak d, (B) negative mode MS spectra of the major peak D, (C) MS2 spectra of m/z 421.1 ([M-H]-).
Mangiferin은 국내에서 생약으로 사용되는 지모 (Anemarrhena asphodeloides) 뿌리 추출물의 지표 성분으로서 항균 및 항산화 작용과 세포보호 효과 등이 있는 것으로 보고되고 있다 (Lee et al., 2018).
Fig. 9에 제시한 활성 peak e의 MS spectra를 보면 negative mode에서 [M-H]- 형태로 볼 수 있는 515.1 m/z와 positive mode에서 [M+H]+ 형태로 볼 수 있는 517.1 m/z가 확인됨에 따라 모분자량이 516인 성분임을 확인할 수 있었다. 상대적으로 molecular ion이 강하게 나타난 negative mode에서 515.1 m/z로부터 생성된 MS2 spectra를 측정한 결과에서 353.1, 179.1, 191.1 m/z 등의 ion이 생성되었으며, 이와 같은 MS spectra는 기존의 문헌을 참고하여 caffeoyl group 2개와 quinic acid가 결합된 형태의 dicaffeoyl quinic acid 구조를 가지는 성분에서 나타나는 형태임을 알 수 있었다 (Clifford et al., 2005).
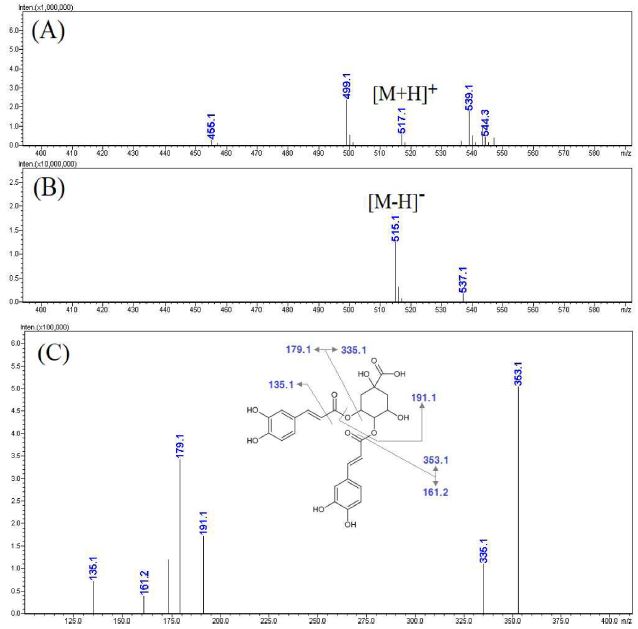
LC-MS analysis results of the major active peak e.(A) positive mode MS spectra of the major peak e, (B) negative mode MS spectra of the major peak E, (C) MS2 spectra of m/z 515.1 ([M-H]-).
Fig. 10과 11에 나타낸 활성 peak f와 g의 MS spectra에서도 활성 peak e와 동일한 패턴의 MS 및 MS2 spectra를 나타냄에 따라 dicaffeoyl quinic acid 구조를 가지는 성분들임을 알 수 있었다. 커피나무 잎의 성분에 관한 기존 연구들을 검토하여 활성 peak e, f, g가 각각 3,4-dicaffeoyl quinic acid, 3,5-dicaffeoyl quinic acid, 4,5-dicaffeoyl quinic acid임을 확인하였다 (Campa et al., 2012; Chen et al., 2018; Monteiro et al., 2020).
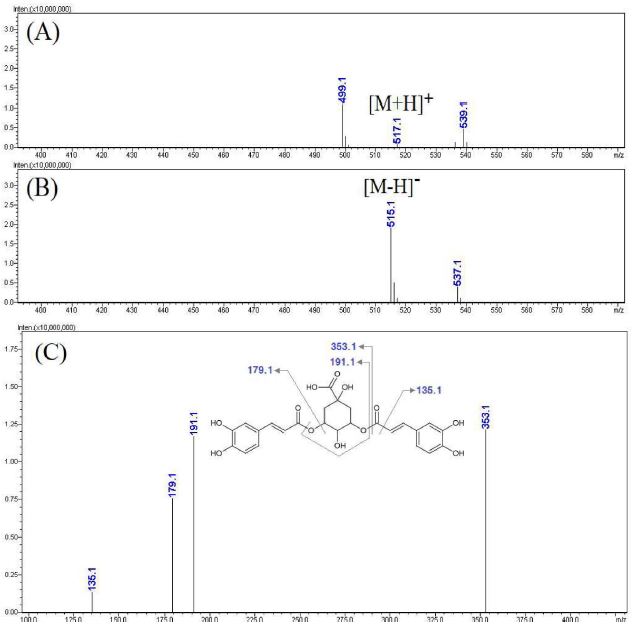
LC-MS analysis results of the major active peak f.(A) positive mode MS spectra of the major peak f, (B) negative mode MS spectra of the major peak F, (C) MS2 spectra of m/z 515.1 ([M-H]-).
3. 활성 성분 분석을 위한 multiple reaction monitoring 조건 설정
주요 활성 peak의 LC-MS 분석 결과를 바탕으로 모분자 이온과 생성 이온을 선정하였으며, 분석 방법의 정성 및 정량성 확보를 위해 Table 2와 같이 성분별로 2 가지 multiple reaction monitoring (MRM) 조건을 설정하였다. 또한 머무름 시간 겹침이나 간섭에 관계없이 분석이 가능한 MRM mode의 질량분석 특성을 감안하여 30 분에 분석이 완료되도록 이동상 조건을 설정하였다.

Negative ESI mode multiple reaction monitoring conditions of LC-MS/MS for analysis of radical scavenging active compounds.
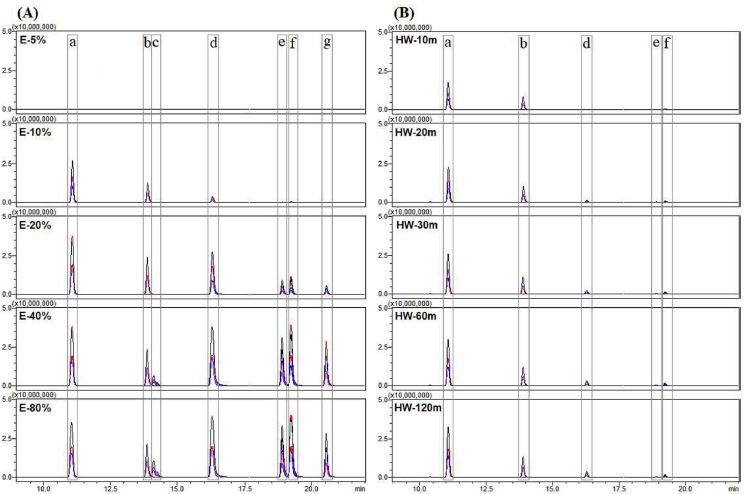
설정된 MRM mode 분석 방법의 유용성을 확인하기 위해 추출 시간별 열수 추출물 및 농도별 에탄올 추출물을 제조하여 비교 분석을 실시하였다. Fig. 12에 제시된 MRM mode의 LC-MS/MS chromatogram과 같이 추출 조건별로 각 활성 성분의 함량 차이가 존재함을 확인할 수 있었으며, 추출물별로 각 성분의 peak 면적을 비교하여 Table 3에 나타낸 상대 함량 결과를 산출할 수 있었다. 60 분간 실시한 Fig. 3의 LC profile 분석 결과에 비해 각 성분의 머무름 시간 간격이 짧아졌으나 머무름 시간이 겹치더라도 분석이 가능한 MRM mode 분석을 이용하면 분석 시간을 60 분에서 30 분으로 줄이더라도 커피나무 잎에 존재하는 항산화 활성 성분 분석에 문제가 없음을 확인하였다. 또한 분석 대상 성분을 제외한 성분에 대한 검출이 배제되므로 일반적인 LC 분석의 자외선 (ultraviolet; UV) 검출기를 적용한 chromatogram에 비해 간결하고 명확한 비교가 가능하였다.
4. 추출 조건별 커피나무 잎 추출물 비교 분석
Table 3에 제시한 결과와 같이 농도별 에탄올 추출물의 분석 결과에서 에탄올 농도가 높아지면 전반적으로 활성 성분의 함량도 증가됨을 확인할 수 있었다. 다만, 5-caffeoyl quinic acid와 3-caffeoyl quinic acid는 20% 에탄올 추출에서도 추출이 충분히 이루어지는 것으로 나타났으며, 3,4-dicaffeoyl quinic acid와 4,5-dicaffeoyl quinic acid는 40% 에탄올 추출에서 80% 에탄올 추출과 유사한 수준의 함량을 보였다. Cinnamtannin B-1의 경우 40% 이상의 에탄올 농도에서 추출이 원활히 이루어지는 특성을 나타냈으며, 10% 이하의 에탄올 농도에서는 전반적으로 활성 성분들의 추출 효율이 낮은 것으로 확인되었다.
열수 추출물에서는 추출 시간별로 5-caffeoyl quinic acid가 80% 에탄올 추출물 대비 34.0% - 70.5%, 3-caffeoyl quinic acid는 36.9% - 58.9% 수준의 상대 함량을 나타내었다. 두 가지 성분을 제외한 성분들은 열수 추출 조건에서는 효과적인 추출이 어려운 것을 확인할 수 있었다. 전반적으로 추출 시간이 늘어날수록 함량이 증가되는 것으로 나타났으나 cinnamtannin B-1, 3,4-dicaffeoyl quinic acid, 3,5-dicaffeoyl quinic acid, 4,5-dicaffeoyl quinic acid는 추출시간에 관계없이 추출이 거의 되지 않거나 증가율이 낮은 것으로 나타났다.
이와 같은 결과는 국내에서 재배된 커피나무 잎의 활성 성분에 대한 관련 연구에서 neo-chlorogenic acid, chlorogenic acid, caffeine 등 3 가지 성분 함량이 열수 추출물보다 에탄올 추출물에서 전반적으로 높게 나타난 것으로 보고한 것과 유사한 경향으로 보이지만 (Im and Doo, 2021a), 품종이나 재배 지역 및 채취 시기, 세부적인 추출 방법의 차이 등을 반영한 추가적인 연구가 지속적으로 이루어져야 할 것으로 판단된다.
커피나무는 우리나라의 제주도, 전남, 경남 지역 등에서 시설재배 방식을 활용하여 재배가 점차 늘어나고 있으므로 관련된 제품 개발을 위한 다양한 연구가 필요하다. 국내에서 재배된 커피나무 잎에 존재하는 항산화 활성 성분에 대한 탐색을 위해 DPPH radical 소거 활성을 LC 분석과 동시에 측정한 후 확인된 radical 소거 활성 성분 peak의 질량분석을 실시하여 5-caffeoyl quinic acid, 3-caffeoyl quinic acid, cinnamtannin B-1, mangiferin, 3,4-dicaffeoyl quinic acid, 3,5-dicaffeoyl quinic acid, 4,5-dicaffeoyl quinic acid 등 7 종의 활성 성분을 확인하였다.
질량분석 결과를 바탕으로 MRM mode 분석 조건을 설정하여 LC-MS/MS를 활용한 커피나무 잎 추출물 중 radical 소거 활성 성분 분석 방법을 설정하였으며, 추출 시간별 열수 추출물과 농도별 에탄올 추출물을 대상으로 비교 분석을 실시하여 유용성을 확인하였다.
전통적인 LC 분석에서는 동시 분석 대상 성분이 많아질수록 성분들간의 간섭을 줄이기 위해 분석 시간이 증가될 수밖에 없으며, 일반적인 식물 추출물은 다양한 성분이 혼재되어 있기 때문에 60 분 이내에 여러 성분을 동시에 분석하기가 어려운 경우가 빈번히 발생된다. 본 연구에서는 30 분의 분석 조건을 적용하였으나 머무름 시간이 중복되더라도 분석이 가능한 LC-MS/MS MRM mode의 특성을 적용하면 20 분 이하의 분석 조건 설정도 가능하며, column 조건 등을 개선하면 보다 짧은 분석도 가능할 것으로 판단된다. 이와 같은 분석 방법과 연구 결과는 최근 증가되고 있는 국내 커피나무 재배 관련 품종 및 산지별 특성 연구나 식품, 화장품, 의약품 등 관련 산업 분야에서의 제품 개발이나 품질관리 등을 위한 기초 자료로서 활용될 수 있을 것으로 기대된다.
References
-
Bajko E, Kalinowska M, Borowski P, Siergiejczyk L and Lewandowski W. (2016). 5-O-Caffeoylquinic acid: A spectroscopic study and biological screening for antimicrobial activity. LWT-Food Science and Technology. 65:471-479.
[https://doi.org/10.1016/j.lwt.2015.08.024]

-
Blois MS. (1958). Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Campa C, Mondolot L, Rakotondravao A, Bidel LPR, Gargadennec A, Couturon E, La Fisca P, Rakotomalala JJ, Jay-Allemand C and Davis AP. (2012). A survey of mangiferin and hydroxycinnamic acid ester accumulation in coffee(Coffea) leaves: Biological implications and uses. Annals of botany. 110:595– 613.
[https://doi.org/10.1093/aob/mcs119]

- Cha BC. (2015). Changes in the constituents and antioxidant activity in accordance with the processing conditions of Citrus unshiu Markovich. Korean Journal of Pharmacognosy. 46:23-30.
-
Chen X, Kitts DD, Ji D and Ding J. (2019). Free radical scavenging activities of phytochemical mixtures and aqueous methanolic extracts recovered from processed coffee leaves. International Journal of Food Science and Technology. 54:2872-2879.
[https://doi.org/10.1111/ijfs.14099]

-
Chen X, Ma Z and Kitts DD. (2018). Effects of processing method and age of leaves on phytochemical profiles and bioactivity of coffee leaves. Food Chemistry. 249:143-153.
[https://doi.org/10.1016/j.foodchem.2017.12.073]

-
Clifford MN, Knight S and Kuhnert N. (2005). Discriminating between the six isomers of dicaffeoylquinic acid by LC-MSn. Journal of Agricultural and Food Chemistry. 53:3821-3832.
[https://doi.org/10.1021/jf050046h]

-
Davis AP, Govaerts R, Bridson DM and Stoffelen P. (2006). An annotated taxonomic conspectus of the genus Coffea(Robiaceae). Botanical Journal of the Linnean Society. 152:465-512.
[https://doi.org/10.1111/j.1095-8339.2006.00584.x]

-
de Almeida RF, Trevisan MTS, Thomaziello RA, Breuer A, Klika KD, Ulrich CM and Owen RW. (2019). Nutraceutical compounds: Echinoids, flavonoids, xanthones and caffeine identified and quantitated in the leaves of Coffea arabica trees from three regions of Brazil. Food Research International. 115:493-503.
[https://doi.org/10.1016/j.foodres.2018.10.006]

- Devasagayam TPA, Tilak JC, Boloor KK, Sane KS, Ghaskadbi SS and Lele RD. (2004). Free radicals and antioxidants in human health: Current status and future prospects. Journal of Association of Physicians of India. 52:794-804.
-
Hariyadi DM, Tedja CA, Zubaidah E, Yuwono SS and Fibrianto K. (2020). Optimization of brewing time and temperature for caffeine and tannin levels in Dampit coffee leaf tea of Robusta(Coffea canephora) and Liberica(Coffea liberica). Potravinarstvo Slovak Journal of Food Sciences. 14:58-68.
[https://doi.org/10.5219/1212]

-
Hong JS, Kang BG, Jang YS, Kim SH, Wang Z, Park YH, Park JH and Lim SS. (2014). Studies on standardization of licorice based on its active components with on-line HPLC bioassay system. Korean Journal of Plant Resources. 27:401-414.
[https://doi.org/10.7732/kjpr.2014.27.5.401]

- Im DY and Doo YT. (2021a). Analysis of characteristics by extraction conditions for product development using coffee tree leaves. Journal of Product Research. 39:53-58.
-
Im DY and Doo YT. (2021b). A study on the physiological activity of coffee tree leaf extract as a cosmetic material. Journal of Business Convergence. 6:63-68.
[https://doi.org/10.31152/JB.2021.08.6.3.63]

- Im DY and Lee KI. (2020). LC-MS/MS screening method for radical scavenging active compounds in extracts of Ulmus pumila cortex. Journal of Life Science. 30:956-964.
-
Im DY, Pyo BS, Kim SM and Lee KI. (2017). Measurement of the anti-oxidative properties of extract from medicinal plants using an on-line HPLC-DPPH assay. Journal of Life Science. 27:44-49.
[https://doi.org/10.5352/JLS.2017.27.1.44]

-
Kim AY, Pyo BS, Kim SM, Park MJ, Lee SS and Lee KI. (2019). Radical scavenging effects of 10 plant essential oils and active compound screening analysis. Korean Journal of Medicinal Crop Science. 27:427-435.
[https://doi.org/10.7783/KJMCS.2019.27.6.427]

-
Kim HG, Kang SM, Park DJ, Yong SH, Yang WH, Park JH, Yu CY, Solomon T and Choi MS. (2018). Effects of blending oil and antioxidants to prevent rancidity of sancho oil. Korean Journal of Medicinal Crop Science. 26:455-463.
[https://doi.org/10.7783/KJMCS.2018.26.6.455]

- Kim IH and Lee JH. (2018). Antibacterial and whitening activities of Coffea arabica ethanol extract. Korean Chemical Engineering Research. 56:245-251.
- Kim MS, Woo KW, Lee KH, Lee HJ, Lee SY, Kang BM, Jeon BH, Cho JH and Cho HW. (2016). Isolation and quantitative analysis of cinnamtannin B-1 from Osmunda japonica Thunb. Korean Journal of Pharmacognosy. 47:232-236.
-
Kim SM, Kim AY and Lee KI. (2020). Nitric oxide production inhibitory effects of three caffeoylquinic acids isolated from hot water extract of Eriobotrya japonica L. leaves. Korean Journal of Medicinal Crop Science. 28:245-253.
[https://doi.org/10.7783/KJMCS.2020.28.4.245]

-
Lee BE, Yang JC and Kim BA. (2016). A study of antioxidative and antimicrobial effects of coffee residue extracts. Journal of Oil and Applied Science. 33:606-613.
[https://doi.org/10.12925/jkocs.2016.33.3.606]

- Lee KE, Son SH and Kang SG. (2018). The coffee sliver skin extracts from coffee beans exhibited cosmetic properties with antioxiant activity and inhibitory effects for elastase, collagenase and tyrosinase. Journal of the Society of Cosmetic Scientists of Korea. 44:39-48.
-
Lee KW, Kim DY and Lee MY. (2015). Quality characteristics of Gastrodia elata extract glutinous rice porridge jochung and principal component analysis of antioxidant activity. Journal of the East Asian Society of Dietary Life. 25:1018-1028.
[https://doi.org/10.17495/easdl.2015.12.25.6.1018]

-
Lee YJ, Song B, Lee SL, Shin HS and Park SN. (2018). Antimicrobial, antioxidant and cellular protective effects against oxidative stress of Anemarrhena asphodeloides Bunge extract and fraction. Microbiology and Biotechnology Letters. 46:360-371.
[https://doi.org/10.4014/mbl.1809.09002]

-
Maxiselly Y, Anusornwanit P, Rugkong A, Chiarawipa R and Chanjula P. (2022). Morpho-physiological traits, phytochemical composition, and antioxidant activity of Canephora coffee leaves at various stages. International Journal of Plant Biology. 13:106-114. https://www.mdpi.com/2037-0164/13/2/11, (cited by 2022 May 23).
[https://doi.org/10.3390/ijpb13020011]

-
Monteiro Â, Colomban S, Azinheira H, Guerra-Guimarães L, Silva MDC, Navarini L and Resmini M. (2020). Dietary antioxidants in coffee leaves: Impact of botanical origin and maturity on chlorogenic acids and xanthones. Antioxidants. 9:6. https://www.mdpi.com/2076-3921/9/1/6, (cited by 2021 Dec 20).
[https://doi.org/10.3390/antiox9010006]

-
Moon SY, Baek SY and Kim MR. (2019). Determination of aroma profiles of coffee cultivated in Goheung, Korea by gas chromatography–ion mobility spectrometry. Korean Journal of Food Preservation. 26:576-585.
[https://doi.org/10.11002/kjfp.2019.26.5.576]

-
Na ES, Kim SS, Hong SS, Kim KJ, Lee YJ, Lee BC and Lee SK. (2020). Development of multi-residue analytical method for 261 pesticides in herbal medicines using GC-MS/MS and LC-MS/MS. The Korean Journal of Environmental Agriculture. 39:142-169.
[https://doi.org/10.5338/KJEA.2020.39.2.19]

-
Nam SH and Kang SJ. (2015). Changes of biochemical components and physiological activities of coffee beans according to different roasting conditions. Korean Journal of Food Preservation. 22: 182-189.
[https://doi.org/10.11002/kjfp.2015.22.2.182]

-
Ngamsuk S, Huang TC and Hsu JL. (2019). Determination of phenolic compounds, procyanidins, and antioxidant activity in processed Coffea arabica L. leaves. Foods. 8:389. https://www.mdpi.com/2304-8158/8/9/389, (cited by 2021 Sep 4).
[https://doi.org/10.3390/foods8090389]

-
Rue EA, Rush MD and van Breemen RB. (2018). Procyanidins: A comprehensive review encompassing structure elucidation via mass spectrometry. Phytochemistry Reviews. 17:1-16.
[https://doi.org/10.1007/s11101-017-9507-3]

-
Rush MD, Rue EA, Wong A, Kowalski P, Glinski JA and van Breemen RB. (2018). Rapid determination of procyanidins using MALDI-ToF/ToF mass spectrometry. Journal of agricultural and food chemistry. 66:11355-11361.
[https://doi.org/10.1021/acs.jafc.8b04258]

- Shin HK. (2019). Analysis of antioxidant components in coffee making process using washed coffee and natural coffee. The Korean Journal of Food and Nutrition. 32:312-320.
-
Song JH and Lee SR. (2015). Anti-oxidant and inhibitory activity on NO production of extract and its fractions from Rosa davurica Pall. leaves. Korean Journal of Medicinal Crop Science. 23:20-26.
[https://doi.org/10.7783/KJMCS.2015.23.1.20]

-
Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M and Telser J. (2007). Free radicals and antioxidants in normal physiological functions and human disease. International Journal of Biochemistry and Cell Biology. 39:44-84.
[https://doi.org/10.1016/j.biocel.2006.07.001]

-
Woo KW, Jung JK, Lee HJ, Kim TM, Kim MS, Jung HK, An BK, Ham SH, Jeon BH and Cho HW. (2017). Phytochemical constituents from the rhizomes of Osmunda japonica Thunb and their anti-oxidant activity. Natural Product Sciences. 23: 217-221.
[https://doi.org/10.20307/nps.2017.23.3.217]

-
Yoo NH, Kim HK, Lee CO, Park JH and Kim MJ. (2019). Comparison of anti-oxidant and anti-inflammatory activities of methanolic extracts obtained from different parts of Cotoneaster wilsonii Nakai. Korean Journal of Medicinal Crop Science. 27:194-201.
[https://doi.org/10.7783/KJMCS.2019.27.3.194]

-
Zhang H, Xi W, Yang Y, Zhou X, Liu X, Yin S, Zhang J and Zhou Z. (2015). An on-line HPLC-FRSD system for rapid evaluation of the total antioxidant capacity of Citrus fruits. Food Chemistry. 172:622-629.
[https://doi.org/10.1016/j.foodchem.2014.09.121]