
서로 다른 인공광원 하에서 기내 발아 및 배양된 새싹 황기의 생육 특성 및 생리활성 검정
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Astragalus membranaceus Bunge is a plant belonging to the Leguminosae family that is used in oriental medicine as a diuretic or a tonic and has blood pressure-lowering properties. Several other propertieds, including reduction of blood sugar, antitumor, and antiviral properties, have also been reported.
A. membranaceus treated exposed to blue light showed the maximum value for plant height, root length, and leaf number. Antioxidant activity was also observed under white light. The maximum values of total phenol and total flavonoid content were observed under white light and blue light, respectively. To assess the whitening and anti-wrinkle activities, the tyrosinase inhibiting activity was determined, which showed the highest value at the maximum concentration of 5,000 μg/㎖ in blue light-treated A. membranaceus.
The use of LED light will benefit the commercial production of A. membranaceus for cosmetic and food purposes.
Keywords:
Astragalus membranaceus, Biological Activity, Different Light Source, Growth Characteristic, In vitro Cultured Plant, Total Phenol Content, Total Flavonoid Content서 언
기후는 작물이 성장하는데 중요한 요인으로 각 생장단계에 영향을 미친다. 작물은 생육 단계에 따라 생육에 적합한 기후 조건이 충족되어야 하며 그렇지 못할 경우 생육이 정상적으로 이루어지지 않을 수 있다. 따라서 기후변화는 작물의 생육 시기 및 생육 특성 등 농업생태에 큰 영향을 미칠 수 있다 (Lee et al., 2008).
최근 농업 인구의 고령화와 급격한 기후 변화 등으로 인해 농업 환경이 빠르게 변화하고 있으며, 이에 대응하기 위해 스마트팜 또는 식물공장에 대한 관심이 증가하고 있다. 식물공장이란 환경을 조절하여 기후에 관계 없이 일정한 작업을 통해 연속적으로 작물을 재배할 수 있는 생산시스템을 말한다 (Baek et al., 2018). 스마트팜 또는 식물공장은 이전의 농업 기술에 자동화와 정보화 등의 기술들을 적용하여 작물의 생산부터 소비까지 생산성과 효율성 및 품질 향상을 통해 고부가가치 창출이 가능한 농업 기술이다 (Hwang et al., 2021).
식물공장은 자연광 이용형과 인공광 이용형 식물공장으로 분류할 수 있으며, 두 가지 모두 시설 내에서 광과 온도, 습도, 이산화탄소, 수분 등을 조절할 수 있다. 이러한 환경을 정밀하게 다루어 작물의 생산량을 향상시키고 고품질의 식물체를 생산할 수 있다 (Cha et al., 2014). 또한 노지에서 재배가 불가능한 기능성 작물들을 재배함으로써 고부가가치 농업을 실현할 수 있고, 화학약품을 처리하지 않은 청정작물의 생산이 가능하다 (Lee and Kim, 2012).
삶의 질이 향상되면서 인간의 기본적 욕구 이외에 외적 요인 또한 중요한 조건으로 인식되면서 피부에 대한 관심이 지속적으로 증가하고 있다. 남성과 여성의 직장 생활과 야외 활동이 활발해지면서 자외선에 노출되는 시간이 증가하였다 (Kim et al., 2011). 피부가 자외선에 오랜 시간 노출될 경우 피부 홍반, 색소 침착, 피부암 등을 유발할 수 있다. 또한 인체는 산소와 자외선에 노출되면 활성산소인 ROS (Reactive Oxygen Species)가 유도되며, 이로 인해 산화적 스트레스를 받아 피부의 노화가 가속화된다 (Kim et al., 2011).
노화현상은 체내 대사 작용, 자외선의 노출, 각종 스트레스 등에 의해 체내 free radical의 생성이 촉진되면서 발생한다. 생성된 free radical은 보통 체내의 항산화 효소와 항산화 물질에 의해 제거되지만 과도하게 생성될 경우 이러한 보호망이 점차 파괴되고, 제거되지 않은 free radical이 생체조직을 손상시킬 뿐만 아니라 노화를 촉진한다. 따라서 이들 활성산소들은 피부 노화 뿐만 아니라 각종 암이나 염증, 성인병을 일으키는 요인으로 작용한다 (Kim et al., 2011).
인간의 피부와 모발의 색을 결정하는 요인인 멜라닌은 멜라닌 형성세포에 의해 생성되어 자외선으로부터 피부를 보호하는 역할을 한다. 하지만 과도한 멜라닌의 합성은 피부의 색소 침착을 일으켜 기미, 주근깨, 검버섯 등을 생성시키고, 특히 피오멜라닌은 피부암을 유발할 수 있다고 보고된 바 있다 (Yoon et al., 2013). 멜라닌 합성에는 cAMP, protein kinase A (PKA), cAMP response element binding protein (CREB) 등의 인자가 관여하며, tyrosine이 tyrosinase의 작용에 의해 DOPA로, 다시 DOPA를 DOPA-quinone으로 전환하여 최종적으로 melanin을 합성을 유도한다 (Jung and Park, 2018).
피부 미백에 대한 관심이 증가함에 따라 tyrosinase 활성을 억제하는 미백 소재에 대한 연구가 활발히 진행되고 있으며, 현재까지 arbutin, kojic acid, lactic acid, glucosamine, vitamin C 등이 알려져 있다. 하지만 이들 중 일부는 피부 자극이나 안정성에 문제가 있어 사용이 제한되어 있다 (Lee and An, 2012).
Elastin은 진피층의 3% - 4% 정도를 차지하며 피부의 탄력을 결정하는 요인이다. Elastine을 분해하는 효소인 elastase는 elastine 외에도 collagen을 분해할 수 있는 비특이적 가수분해 효소이다. 따라서 elastase 저해제는 피부 주름을 개선하는 효과가 있으며, 대표적으로 ursolic acid 등이 elastase 저해제로 이용되고 있다 (Kim et al., 2008).
황기 (Astragali Radix; Astragalus membranaceus Bunge)는 콩과 (Leguminosae)에 속하는 다년생 초본식물로 우리나라에서는 강원도 정선에서 양질의 황기가 재배되며, 예부터 인삼 다음의 보약으로 쓰이고 있는 약용식물이다 (Kim et al., 1996; Kim et al., 2007). 황기는 한국, 중국 등의 아시아 지역과 유럽 및 아프리카 일부 지역에 널리 분포한다 (Jung et al., 2006). 한방에서는 지산과 이뇨, 강장, 혈압강하 등의 목적으로 사용되며, 이 세 가지 효과와 더불어 혈당 강하, 항종양, 항바이러스 등 다양한 효과가 보고된 바 있다 (Yin et al., 2009).
황기에 함유된 대표적인 성분으로는 여성 호르몬의 천연 대체물질로서 잘 알려져 있는 isoflavone 배당체인 formononetin이 있으며, 식물성 유사호르몬 (phytoestrogen)으로서 존재한다 (Song et al., 2020). 그 밖에 saponins, flavonoids, amino acids, trace elements, polysaccharides 등이 황기에 함유된 주요 생리활성 성분으로 보고되었다 (Park et al., 2013).
황기의 이러한 기능성 물질과 생리활성 때문에 한약재로서의 활용뿐 아니라 식품으로서의 수요도 증가하고 있으며, 이에 따른 약재 수입 및 재배 면적 또한 증가하고 있다. 황기를 활용한 선행 연구로는 황기의 성분에 대한 연구와 항산화 활성, 항염, 항노화 효과와 같은 생리활성 연구들이 보고된 바 있다 (Bae, 2021).
황기에 대한 재배 연구는 한약재로 많이 사용되는 뿌리 부분의 생산량 증대에 관한 내용으로 진행되어오고 있으며 노지재배에 이용된 황기 식물체를 이용하여 인공광원 이용성 연구를 보고된 바 있으나 (Choi et al., 2018), 기후 변화에 대비한 스마트팜이나 식물공장 운영에 있어 인공광원에 따른 기내 배양 새싹 황기의 생육 특성 및 생리활성 변화에 대한 연구는 전무한 실정이기 때문에 기내 새싹황기의 발아 및 초기 생육에 있어 광질의 종류가 어떠한 영향을 미치는지에 대한 기초 연구가 필요하다.
따라서 본 연구에서는 스마트팜 재배용 기내 새싹 황기의 식물공장 이용성의 기초 데이터로 활용하기 위해 기내에서 발아시킨 새싹 황기에 백색, 적색, 청색의 서로 다른 LED를 처리하여 생육 특성과 항산화 활성, 미백 및 항주름 활성을 비교하였고, 이를 통해 황기의 생리활성이 가장 높아지는 최적의 광 조건을 찾아 최근 지속적으로 관심도가 상승하고 있는 식물공장형 기능성 식품 및 화장품 산업에 이용될 수 있는 소재 발굴에 기여하고자 연구하였다.
재료 및 방법
1. 황기의 무균 식물체 준비
본 연구에 사용된 황기 (A. membranaceus) 종자는 KS 종묘 (주) (Incheon, Korea)에서 구입하여 이용하였다. 황기 종자를 70% EtOH에 넣고 1 분간 흔들어준 뒤 3% NaClO로 옮겨 3 분간 다시 흔들어주었다. 멸균 증류수를 이용해 3 회 - 5 회 종자를 세척한 후 고체 MS 배지가 있는 유리병으로 옮겨주었다. 황기 무균 식물체는 실험의 3 반복 수준을 고려하여 준비하였다.
2. 인공광원 처리 조건 및 생육 특성 조사
무균 상태의 황기 종자에 처리한 LED 광 (GrinMax, Goyang, Korea) 은 PG200N 조도계 (United Power Research Technology Co., Zhunan Township, Taiwan)를 이용하여 측정하였으며, 측정한 광 종류는 white (continuous spectrum), red (631 ㎚, 2.00 μ㏖/㎡/s), blue (464 ㎚, 1.32 μ㏖/㎡/s) 총 3 가지 광으로, 광주기는 주간 16 시간, 야간 8 시간으로 설정하였다. 모든 광원은 종자 상태부터 동일하게 총 6 주간 처리한 후 실험에 이용하였다 (Fig. 1).
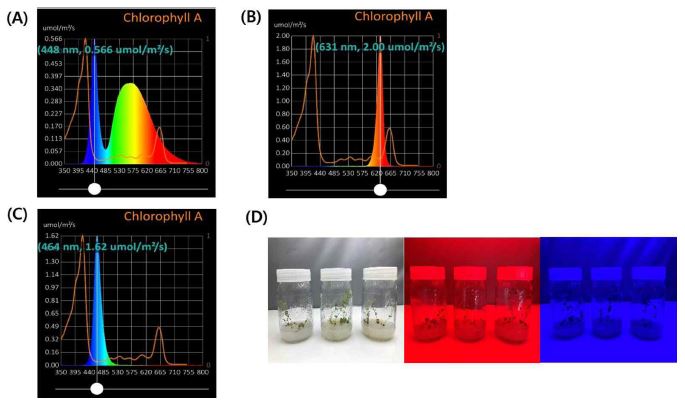
Wavelengths of each LED light sources (A; White, continuous spectrum, B; Red, 631 ㎚, 2.00 μ㏖/㎡/s, C; Blue, 464 ㎚, 1.32 μ㏖/㎡/s) and seedling of A. membranaceus grown in vitro cultured under 3 types of LEDs lights for 6 weeks (D).
기내 새싹 황기의 생육 특성 조사항목으로는 초장 (plant height), 뿌리 길이 (root length), 잎 수 (number of leaf), 잎 길이 (leaf length), 잎 너비 (leaf width)를 조사하였다.
3. 황기 추출물 제조
6 주간 기내에서 발아하고 생육한 새싹 황기를 꺼내 뿌리에 남아있는 배지를 모두 제거해준 뒤 60℃에서 24 시간 건조시켰다. 이후 100% MeOH를 첨가하여 암조건에서 72 시간 동안 추출한 뒤 250 ㎜ filter paper (Hyundai Micro Co., Ltd., Seoul, Korea)를 사용하여 여과하였다. 여과액을 회전감압농축기 (EYELA N-1000, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)를 이용하여 감압 농축한 뒤 100% MeOH로 10,000 ㎍/㎖의 농도로 제조하여 실험에 이용하였다.
4. DPPH 라디칼 소거능
DPPH 라디칼 소거능 실험은 Blois (1958)에 의해 실시된 방법을 참고하여 진행하였다.
DPPH (α, α-diphenyl-β-picrylhydrazyl, Alfa aesar Co., Ltd., Haverhill, MA, USA)를 MeOH에 0.15 mM로 희석하여 실험에 이용하였다.
1,000, 2,000, 5,000 ㎍/㎖의 농도로 희석한 샘플 100 ㎕와 희석한 DPPH 용액 100 ㎕를 혼합하여 96 well plate에 넣은 뒤 상온에서 암조건으로 30 분간 반응시켰다.
이후 UV/Vis spectrophotometer (Multiskan FC Microplate Photometer, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 519 ㎚에서 흡광도를 측정하였다. 각 시료에 대한 라디칼 소거 활성은 무처리구 흡광도에 대한 시료 처리구의 상대적인 흡광도를 %로 나타내었다.
5. 총 페놀 함량
총 페놀 함량은 Sato 등 (1996)에 의해 실시된 Folin-ciocalteau’s 방법을 참고하여 실험을 진행하였다. 1,000 ㎍/㎖의 농도로 희석한 샘플 100 ㎕를 Folin-ciocalteau’s phenol (Sigma-Aldrich Co., St. Louis, MO, USA) 50 ㎕와 혼합하여 상온에서 3 분 - 5 분간 반응시킨 후 증류수로 희석한 20% Na2CO3 (Junsei Chemicals Co., Ltd., Tokyo, Japan) 300 ㎕를 넣고 상온에서 15 분간 반응시켰다. 이어서 증류수 1 ㎖를 넣고 상온에서 13,000 rpm으로 2 분간 원심분리한 후 상층액 200 ㎕를 96 well plate에 넣어 740 ㎚에서 UV/Vis – spectrophotometer (Multiskan FC Microplate Photometer, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 흡광도를 측정하였다.
총 페놀 함량은 gallic acid를 standard로 사용하여 standard curve를 작성하였고, gallic acid equivalents (㎎ · GAE/g)로 값을 나타내었다.
6. 총 플라보노이드 함량
총 플라보노이드 함량은 Moreno 등 (2000)에 의해 실시된 방법을 참고하여 실험을 진행하였다. 96 well plate에 증류수로 희석한 1 M potassium acetate (Mallinckrodt Co., Ltd., Tokyo, Japan)와 10% aluminum nitrate (Yakuri Co., Ltd., Shizuoka, Japan) 100 ㎕를 1,000 ㎍/㎖의 농도로 희석한 샘플 500 ㎕와 혼합하여 반응시킨 뒤 UV/Vis – spectrophotometer (Multiskan FC Microplate Photometer, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 414 ㎚에서 흡광도를 측정하였다.
총 플라보노이드 함량은 quercetin을 standard로 사용하여 standard curve를 작성하였고 quercetin equivalent (㎎ · QE/g)로 값을 나타내었다.
7. Tyrosinase 저해 활성
Tyrosinase 저해 활성은 Bermard와 Berthon (2000)의 의해 실시된 방법을 참고하여 실험을 진행하였다.
기질인 L-DOPA (3,4-dihydroxy-L-phenylalanine, Sigma-Aldrich Co., St. Louis, MO, USA)와 효소인 mushroom tyrosinase (Sigma-Aldrich Co., St. Louis, MO, USA)를 67 mM PBS buffer (Phosphate Buffered Saline, pH 7.4, T&I Co., Ltd., Gwangju, Korea)를 이용하여 각각 10 mM과 123 unit/8 ㎖로 준비하였다. 96 well plate에 1,000, 2,000, 5,000 ㎍/㎖의 농도로 희석한 샘플 및 효소 40 ㎕와 기질 120 ㎕를 첨가하여 암조건, 37℃에서 30 분간 반응시킨 뒤 UV/Vis spectrophotometer (Multiskan FC Microplate Photometer, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 519 ㎚에서 흡광도를 측정하였다.
Tyrosinase 저해활성은 샘플 처리구와 무처리구의 흡광도 감소율로 나타내었다. 양성 대조군으로는 koijc acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 이용하였다.
8. Elastase 저해 활성
Elastase 저해 활성은 Cannell 등 (1988)에 의해 실시된 방법을 참고하여 실험을 진행하였다.
100 mM Tris-HCl buffer (pH 6.8, Geneall Biotechnology Co., Ltd., Seoul, Korea)를 이용하여 기질인 N-succinyl-Ala-Ala-p-nitroanilide (Sigma-Aldrich Co., St. Louis, MO, USA)와 효소인 elastase (Sigma-Aldrich Co., St. Louis, MO, USA)를 각각 1 mM과 0.25 unit/10 ㎖로 준비하였다. 96 well plate에 Buffer 100 ㎕와 기질 및 효소 30 ㎕, 500, 1,000, 2,000 ㎍/㎖의 농도로 희석한 샘플 40 ㎕를 첨가하여 37℃에서 30 분간 반응시킨 뒤 UV/Vis - spectrophotometer (Multiskan FC Microplate Photometer, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 414 ㎚에서 흡광도를 측정하였다.
Elastase 저해활성은 샘플 처리구와 무처리구의 흡광도 감소율로 나타내었다. 양성 대조군으로는 ascorbic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 이용하였다.
9. 통계분석
모든 실험은 3 반복으로 진행하였고, IBM SPSS Statistics v26 (SPSS, International Business Machines Co, Armonk, NY, USA) 프로그램을 사용하여 5% 유의수준에서 Duncan’s Multiple Range Test (DMRT)로 통계처리를 진행하였다 (p < 0.05).
결과 및 고찰
1. 3 가지의 서로 다른 광원 처리하에 기내 발아된 새싹 황기의 생육 특성 비교
서로 다른 파장의 광원 하에서 발아하고 생육한 기내 새싹 황기의 생육 특성을 파종한 후 6 주 동안 관찰한 결과, 초장의 경우 6 주차에 청색광과 백색광을 처리한 새싹 황기가 각각 최대값 (11.13 ± 2.15 ㎝)과 최소값 (4.43 ± 1.56 ㎝)을 나타내었다. 뿌리 길이는 4 주차까지 백색광을 처리한 새싹 황기가 최대값 (4.37 ± 0.81 ㎝)을 나타내다가 5 주차부터 청색광을 처리한 새싹 황기가 최대값 (5.60 ± 0.40 ㎝)을 보였다 (data not shown). 잎 수는 6 주차에 청색광을 처리한 새싹 황기가 51.00 ± 9.64 개로 가장 많았으며, 적색광을 처리한 새싹 황기가 22.00 ± 7.94 개로 가장 적은 것을 확인하였다. 잎의 길이와 너비는 모든 광 처리구에서 통계적으로 유의미한 차이를 보이지 않았다 (Table 1).

Growth characteristics in seedling of A. membranaceus in vitro cultured under 3 types of LEDs light sources for 6 weeks.
Choi 등 (2020)은 적색광 처리하에서 생육한 단삼이 형광등 조명하에서 생육한 단삼에 이어 가장 긴 초장과 잎의 길이 및 너비를 나타내었고, 청색광에서 생육한 단삼이 최소값의 잎의 길이와 너비를 나타내었다고 보고하였다. 또한 메밀 새싹에 각각 다른 파장의 LED를 처리하였을 때 청색광에 비해 적색광에서 초장이 더 길었고 (Jeon et al., 2015), 거베라의 기내 배양묘에 서로 다른 LED 광원을 처리한 경우, 적색광에서 가장 긴 초장, 잎 수 및 잎 너비 나타내었다고 보고하였다 (Kwon et al., 2012).
Choi 등 (2018)의 연구에서는 황기에 서로 다른 광원을 처리하고 생육 특성을 비교한 결과, 적색광이 청색광보다 긴 초장을 나타내었다고 보고하였는데 이는 본 연구의 결과와는 상반된 결과로, 원예용 상토에 키운 황기 육묘 식물체와 기내에서 발아와 생육이 이루어지는 새싹 황기 간 식물체의 발달단계 및 환경이 서로 상이한 조건 하에서 발생하는 차이인 것으로 판단된다. 이러한 결과는 같은 작물이라도 작물의 생육 환경과 발달 단계에 따라 인공광원에 반응하는 작물의 반응체계가 다르며 광원 이외에 외부 다른 여러 가지 환경 요인에 영향을 받을 수 있기 때문으로 판단된다.
2. 3 가지의 서로 다른 광원 처리하에 기내 발아된 새싹 황기의 DPPH 라디칼 소거활성 비교
서로 다른 파장의 광원 하에서 발아하고 생육한 기내 새싹 황기 추출물의 항산화 활성을 확인하고 비교하기 위해 DPPH 라디칼 소거능을 측정하였다.
그 결과, 백색광을 처리하여 발아 · 생육한 기내 새싹 황기 추출물의 DPPH 라디칼 소거 활성은 최고농도인 2,000 ㎍/㎖에서 가장 높게 (89.25 ± 0.18%) 나타났으며, 이는 양성 대조구인 ascorbic acid를 2,000 ㎍/㎖의 농도 수준으로 처리한 경우 (93.53 ± 0.22%)와 유사한 값이었다. 또한 모든 광 조건에서 기내 새싹 황기 추출물이 농도 의존적으로 DPPH 라디칼 소거 활성이 증가하는 것을 확인하였고, 적색광과 청색광을 처리한 기내 새싹 황기 추출물은 2,000 ㎍/㎖의 농도에서 각각 54.53 ± 0.48%, 34.68 ± 0.82%의 저해율을 나타내었다 (Fig. 2).
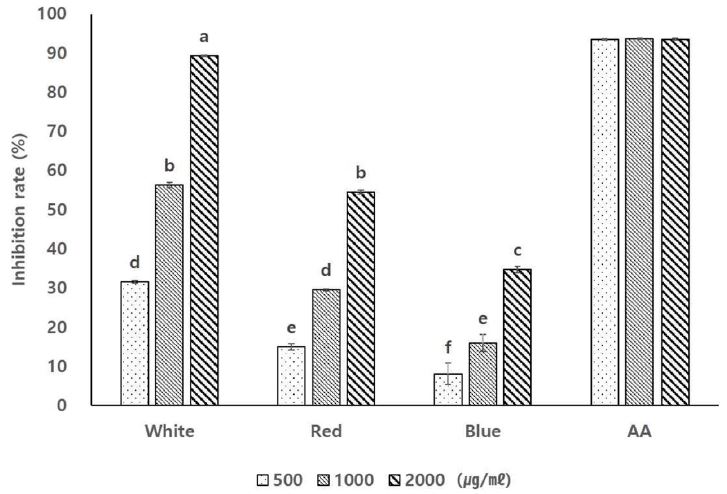
DPPH radical scavenging activity of seedling extract in A. membranaceus in vitro cultured under 3 types of LEDs lights sources for 6 weeks.3 different type of LED light sources composed to white (continuous spectrum), red (631 ㎚, 2.00 μ㏖/㎡/s) and blue (464 ㎚, 1.32 μ㏖/㎡/s). Mean values ± SD from triplicate separated experiments are shown (n = 3). *Means with the same letter are not significantly different based on the Duncan's Multiple Range Test (DMRT, p < 0.05).
Cho 등 (2008)의 브로콜리에 관한 연구에서 백색, 청색, 적색, 녹색, 황색, 적색광 + 청색광의 서로 다른 LED 광을 처리한 브로콜리 추출물을 대상으로 DPPH 라디칼 소거활성을 비교한 결과, 백색광을 처리하였을 때 가장 낮은 IC50 값을 나타내었다. 또한 Cho 등 (2008)의 아마란서스 연구에서 동일한 조건으로 실험을 진행하여 DPPH 라디칼 소거활성을 비교하였을 때, 2,000 ㎍/㎖의 농도에서 적색광+청색광 처리구와 청색광 처리구에서 각각 36.1%, 34.1%의 DPPH 라디칼 소거활성을 나타내었고, 적색광과 백색광 처리구에서 DPPH 라디칼 소거활성은 각각 30.8%, 30.5%로 나타났다.
이러한 연구 결과를 통해 광원 처리에 따른 광질의 종류와 작물 내에 축적되어지는 이차대사산물의 종류와 축적 정도가 서로 달라질 수 있으며, 이에 따라 광질의 종류에 따라 작물이 나타내는 DPPH 라디칼 소거능 등의 생리 활성에 있어서 차이를 나타낼 수 있다는 것을 확인하였다.
특히, 스마트팜 내에서 재배되어지는 황기의 경우, 작물의 생육 정도와 이차대사산물의 축적 정도, 그리고 생리 활성을 향상시킬 수 있는데 알맞은 최적의 광원이 서로 다를 수 있으며, 지속적인 연구가 필요할 것으로 생각된다.
3. 3 가지의 서로 다른 광원 처리하에 기내 발아된 기내 새싹 황기의 총 페놀 및 총 플라보노이드 함량 비교
서로 다른 파장의 광원 하에서 발아하고 생육한 기내 새싹 황기 추출물의 총 페놀 및 총 플라보노이드 함량은 Table 2와 같다. 1,000 ㎍/㎖의 농도에서 기내 새싹 황기 추출물의 총 페놀 함량은 백색광에서 23.63 ± 0.22 ㎎ · GAE/g로 가장 높았고, 청색광에서 16.86 ± 0.08 ㎎ · GAE/g로 가장 낮은 함량을 나타내었다. 총 플라보노이드 함량은 동일 농도에서 청색광을 처리한 기내 새싹 황기가 20.75 ± 0.09 ㎎ · QE/g로 가장 높았고, 백색광을 처리한 기내 새싹 황기가 16.30 ± 0.04 ㎎ · QE/g로 가장 낮은 값을 보였다.

Total phenol and total flavonoid contents of seedling extract in A. membranaceus in vitro cultured under 3 types of LEDs lights sources for 6 weeks.
서로 다른 파장의 광원 하에서 발아하고 생육한 기내 새싹 황기에서의 총 페놀 함량은 백색광이, 총 플라노보이드 함량에서는 청색광이 각각 최대값을 나타내었다. Cho등 (2008)은 백색, 청색, 적색, 녹색, 황색, 적색광+청색광의 서로 다른 LED 광을 처리한 브로콜리 추출물의 총 페놀 및 플라보노이드 함량은 백색광과 청색광을 처리하였을 때 1,000 ㎍/㎖의 농도에서 각각 83.0 ㎎ · GAE/g과 72.60 ㎎ · QE/g로 최대값을 나타낸다고 하였다. 또한, Cho 등 (2008)의 아마란서스 연구에서는 동일 조건 하에서 총 페놀 함량이 청색광에서 93.0 ㎍/㎖로 최대값을, 황색광에서 64.2 ㎍/㎖로 최소값을 나타내었으며, 총 플라보노이드 함량은 적색광+청색광에서 21.2 ㎍/㎖로 최대값을, 황색광에서 11.1 ㎍/㎖로 최소값을 나타내었다.
이상의 결과를 통해, 조사되어지는 광원의 종류에 따라 적용되어지는 작물마다 총 페놀 및 플라보노이드 함량에 차이가 있음을 확인하였으며, HPLC와 같은 추가적인 성분 분석 실험을 통해 구체적으로 어떤 종류의 페놀 및 플라보노이드 성분의 변화가 나타나는지 확인하기 위한 추가적인 실험이 필요하다고 생각되어진다.
4. 3 가지의 서로 다른 광원 처리하에 기내 발아된 기내 새싹 황기의 미백 및 주름 개선 활성 비교
서로 다른 파장의 광원 하에서 발아하고 생육한 기내 새싹 황기 추출물의 미백 활성을 비교하기 위해 tyrosinase 저해율을 확인하였다. 서로 다른 파장의 광원 하에서 발아하고 생육한 기내 새싹 황기 추출물의 tyrosinase 저해 활성은 모든 광 조건에서 농도 의존적으로 저해율이 증가하였고, 최대 농도인 5,000 ㎍/㎖에서 백색광과 청색광을 처리한 기내 새싹 황기가 각각 62.68 ± 3.06%와 65.62 ± 9.80%로 비슷한 tyrosinase 저해 활성을 나타내었고, 적색광을 처리한 기내 새싹 황기는 46.66 ± 1.93%로 가장 낮은 tyrosinase 저해 활성을 보였다 (Fig. 3).
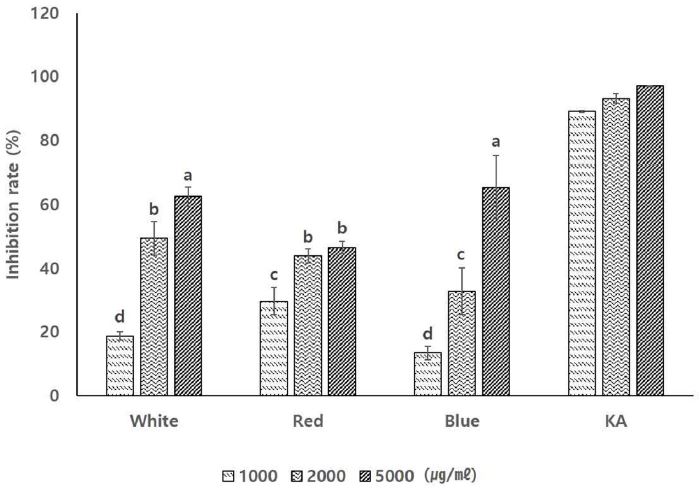
Tyrosinase inhibition rate of seedling extract in A. membranaceus in vitro cultured under 3 types of LEDs lights sources for 6 weeks.3 different type of LED light sources composed to white (continuous spectrum), red (631 ㎚, 2.00 μ㏖/㎡/s) and blue (464 ㎚, 1.32 μ㏖/㎡/s). Mean values±SD from triplicate separated experiments are shown (n = 3). *Means with the same letter are not significantly different based on the Duncan's Multiple Range Test (DMRT, p < 0.05).
서로 다른 파장의 광원 하에서 발아하고 생육한 기내 새싹 황기 추출물 항주름 활성을 비교하기 위한 elastase 저해 활성에서는 백색광을 처리한 기내 새싹 황기가 1,000 ㎍/㎖에서 41.98 ± 3.59%로 가장 높은 저해율을 나타내었고, 청색광을 처리한 기내 새싹 황기가 동일 농도에서 25.35 ± 2.65%로 가장 낮은 저해율을 보였다. 모든 광조건에서 통계적으로 농도별 저해율의 유의미한 차이는 확인되지 않았다 (Fig. 4).
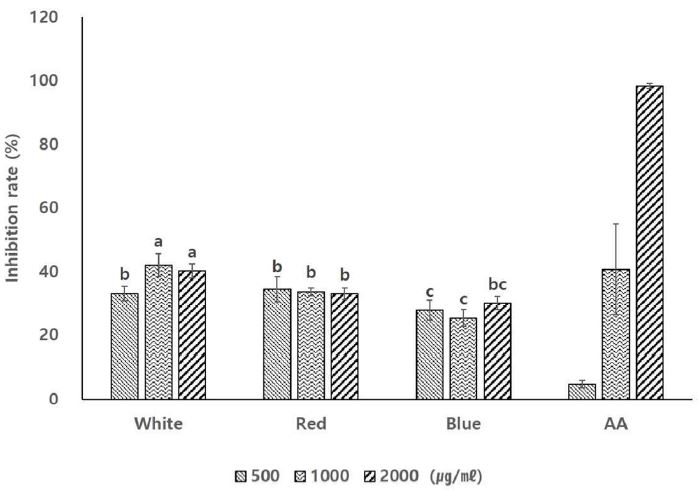
Elastase inhibition rate of seedling extract in A. membranaceus in vitro cultured under 3 types of LEDs lights sources for 6 weeks.3 different type of LED light sources composed to white (continuous spectrum), red (631 ㎚, 2.00 μ㏖/㎡/s) and blue (464 ㎚, 1.32 μ㏖/㎡/s). Mean values ± SD from triplicate separated experiments are shown (n = 3). *Means with the same letter are not significantly different based on the Duncan's Multiple Range Test (DMRT, p < 0.05).
Jung 등 (2015)은 효소인 tyrosinase에 서로 다른 파장의 LED를 처리하였을 때 청색광을 처리한 처리군이 형광등 다음으로 높은 저해율을 나타내었으며, 적색광을 처리하였을 때 가장 낮은 저해율을 보였다고 보고하였으며 이러한 결과는 본 실험의 결과와 유사하였다. Yoo 등 (2017)의 연구에서는 서로 다른 종류의 LED를 처리한 들깨의 부위별 tyrosinase 함량을 분석한 결과, 잎은 Laser Excited Phosphor광을 처리하였을 때 가장 높은 저해율을 나타내었고, 줄기와 뿌리의 경우 청색광을 처리하였을 때 최대값을 가지는 것을 확인하였다고 보고한 바 있다. 이를 통해 식물체의 부위별로 처리한 광의 종류에 따라 미백 활성에 차이를 보이는 것을 확인하였고, 황기 또한 전초가 아닌 부위별로 나누어 추가적인 실험이 필요할 것이라 생각된다.
서로 다른 파장의 광원 하에서 발아하고 생육한 기내 새싹 황기의 항주름 활성에서는 백색광에서 발아하고 생육한 기내 새싹 황기가 상대적으로 높은 활성을 보였지만, 처리군 간의 유의미한 차이는 보이지 않았다. 황기의 elastase 최대 저해율이 50% 미만으로 나타났지만 2,000 ㎍/㎖의 고농도 농축물을 이용하였기 때문에 시료의 농도를 더 높이는 방법보다는 추출 조건을 바꾸는 등의 방안을 통하여 추가적인 실험이 필요할 것으로 생각된다.
Acknowledgments
본 연구는 2022년도 강원대학교 학술연구조성비의 지원에 의해 이루어진 결과로, 이에 감사드립니다.
References
- Bae HK. (2021). Bioactive characteristics of the Astragalus Membranaceus ethanol and bioconversion extracts as functional cosmetic materials. Journal of the Korean Applied Science and Technology. 38:1265-1272.
-
Baek JH, Heo JW, Kim HH, Hong YS and Lee JS. (2018). Research-platform design for the korean smart greenhouse based on cloud computing. Protected Horticulture and Plant Factory. 27:27-33.
[https://doi.org/10.12791/KSBEC.2018.27.1.27]

-
Cha MK, Kim JS, Shin JH, Son JE and Cho YY. (2014). Practical design of an artificial light-used plant factory for common ice plant (Mesembryanthemum crystallinum L.). Protected Horticulture and Plant Factory. 23:371-375.
[https://doi.org/10.12791/KSBEC.2014.23.4.371]

-
Choi HL, Seo JW, Hwang MH, Lee HI, Kim MJ and Yu CY. (2020). Growth characteristics and functional analysis of Salvia miltiorrhiza Bunge by artificial light sources. Korean Journal of Medicinal Crop Science. 28:200-208.
[https://doi.org/10.7783/KJMCS.2020.28.3.200]

-
Choi JH, Seong ES, Yoo JH, Choi SK, Lee JG, Lim JD, Na JK and Yu CY. (2018). Enhancement of growth characteristics and biological activities in Astragalus membranaceus using artificial light sources. Russian Journal of Plant Physiology. 65:732-739.
[https://doi.org/10.1134/S1021443718050059]

- Cho JY, Son DM, Kim JM, Seo BS, Yang SY, Bae JH and Heo BG. (2008). Effect of LED as light quality on the germination, growth and physiological activities of Broccoli sprouts. Journal of Bio-Environment Control. 17:116-123.
- Cho JY, Son DM, Kim JM, Seo BS, Yang SY, Kim BW and Heo BG. (2008). Effects of LEDs on the germination, growth and physiological activities of Amaranth sprouts. Horticultural Science and Technology. 26:106-112.
-
Hwang SH, Kim SC, Seong JA, Lee HY, Cho DY, Kim MJ, Jung JG, Jeong EH, Son KH and Cho KM. (2021). Comparison of ginsenoside contents and antioxidant activity according to the size of ginseng sprout has produced in a plant factory. Journal of Applied Biological Chemistry. 64:253-261.
[https://doi.org/10.3839/jabc.2021.035]

-
Jeon AY, Kim KH, Kwon SJ, Roy SK, Cho SW and Woo SH. (2015). Effects of LED light conditions on growth and analysis of functional components in Buckwheat sprout. Korean Journal of Crop Science. 60:388-393.
[https://doi.org/10.7740/kjcs.2015.60.3.388]

- Jeong YU and Park YJ. (2018). Studies on antioxidant and whitening Activities of Salix gracilistyla Extracts. Journal of Society of Cosmetic Scientists of Korea. 44:317-325.
-
Jung HY, Kim JS and Noh BS. (2015). Effect of light emitting diode irradiation on tyrosinase activity during storage. Korean Journal of Food Science and Technology. 47:785-788.
[https://doi.org/10.9721/KJFST.2015.47.6.785]

- Jung TK, Kim MJ, Lim KR and Yoon KS. (2006). Moisturizing and anti-oxdation effect of Astragalus membranaceus root extract. Journal of Society of Cosmetic Scientists of Korea. 32:193-200.
- Kim ID, Kwon RH, Heo YY, Jung HJ, Kang HY and Ha BJ. (2008). Supercritical extraction of oriental herb: Anti-aging and anti-wrinkle effects. Korean Society for Biotechnology and Bioengineering Journal. 23:529-534.
- Kim JS, Kim YT and Kim CS. (1996). A study on the constituents from the roots of Astragalus membranaceus(I). Korean Journal of Pharmacognosy. 27:336-341.
- Kim MJ, Lim KR, Jung TK and Yoon KS. (2007). Anti-aging effect of Astragalus membranaceus root extract. Journal of Society of Cosmetic Scientists of Korea. 33:33-40.
-
Kim SH, Lee SY, Hong CY, Gwak KS, Yeo HM, Lee JJ and Choi IG. (2011). Whitening and antioxidant activities of essential oils from Cryptomeria japonica and Chamaecyparis obtusa. Journal of the Korean Wood Science and Technology. 39:291-302.
[https://doi.org/10.5658/WOOD.2011.39.4.291]

-
Kwon MK, Nam HH, Sung JJ and Lim JH. (2012). Effect of light-emitting diodes on growth of in vitro propagules in Gerbera hybrida. Flower Research Journal. 20:233-237.
[https://doi.org/10.11623/frj.2012.20.4.233]

- Lee SH, Heo IH, Lee KM, Kim SY, Lee YS and Kwon WT. (2008). Impacts of climate change on phenology and growth of crops: In the case of Naju. Journal of the Korean Geographical Society. 43:20-35.
-
Lee WS and Kim SG. (2012). Development of the rotational smart lighting control system using artificial light for plant factory. Journal of the Korea Academia-Industrial Cooperation Society. 13:1474-1479.
[https://doi.org/10.5762/KAIS.2012.13.4.1474]

-
Park YC, Lee JS, Kim DY, Son HY, Lee JW, Cheoi YS, Kim KK, Yu CY, Chung IM, Im MH, Lee KJ, Choi RN, Shim HS and Lim JD. (2013). A 90 day repeated dose-oral toxicity study of extracts from Astragalus membranaceus-aboveground parts in rats. Korean Journal of Medicinal Crop Science. 21:474-485.
[https://doi.org/10.7783/KJMCS.2013.21.6.474]

-
Song BN, Lee DM, Lee SH, Park BR, Choi JH, Kim YS and Park SY. (2020). Physicochemical properties and antioxidant activity of extract from Astragalus membranaceus Bunge leaf fermented with lactic acid bacteria. Korean Journal of Medicinal Crop Science. 28:428-434.
[https://doi.org/10.7783/KJMCS.2020.28.6.428]

- Yin Y, Heo SI, Jung MJ and Wang MH. (2009). Antioxidant and antidiabetic effects of various sections of Astragalus membranaceus. Korean Journal of Pharmacognosy. 40:1-5.
-
Yoo JH, Choi JH, Kang BJ, Jeon MR, Lee CO, Kim CH, Seong ES, Heo K, Yu CY and Choi SK. (2017). Antioxidant and tyrosinase inhibition activity promoting effects of Perilla by the light emitting plasma. Korean Journal of Medicinal Crop Science. 25:37-44.
[https://doi.org/10.7783/KJMCS.2017.25.1.37]

- Yoon YM, Bae SH, An SK, Choe YB, Ahn KJ and An IS. (2013). Effects of ultraviolet radiation on the skin and skin cell signaling pathways. Korean Journal of Aesthetics and Cosmetology. 11:417-426.