
자운영 에탄올 추출물이 인간 진피 섬유아세포에 미치는 노화 방지 효과
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Skin aging is caused by two factors: Intrinsic factors such as genetics and extrinsic factors such as ultraviolet exposure. This study aimed to explore the ameliorating activity of ethanol extract of Astragalus sinicus (ASE) on human skin fibroblast (HDFs) subjected to intrinsic and extrinsic aging via continuous culturing and UVB radiation, respectively.
Matrix metalloproteinase (MMP-1) mRNA expression and elastase activity were determined using qRT-PCR and ELISA, respectively. The activities of senescence-associated β-galactosidase (SA-β-gal) with or without UVB exposure were investigated using enzyme histochemical staining assay. ASE treatment decreased MMP-1 expression and elastase activity. Furthermore, ASE treatment suppressed SA-β-gal activity in both UVB-exposed and UVB-free environments.
These finding suggest that ASE has dermal anti-aging effects and can be employed as a functional cosmetic material.
Keywords:
Astragalus sinicus, Anti-photoaging, Human dermal fibroblast, Senescence-associated β-galactosidase, Ultraviolet B서 언
과도한 자외선 (ultraviolet, UV)의 노출은 피부의 광손상 (photodamage)과 광노화 (photoaging)를 유발한다. UV는 파장의 길이에 따라 크게 UVA, UVB, UVC로 나누는데, 이 중 실제로 인체에 도달되는 UVB는 주름, 색소 침착, 피부 건조 및 탄력 소실과 같은 피부 노화를 일으키는 주원인으로 알려져 있다 (Amaro-Ortiz et al., 2014). 피부에 노화가 진행되면서 피부를 구성하는 표피 (epidermis), 진피 (dermis), 피하조직층 (subcutaneous layer)은 퇴행성 변화를 일으키게 되는데, 피부 노화의 대표적인 특징인 주름 발생, 탄력 저하, 점진적 위축 현상은 주로 진피 노화 (dermal aging)에 의한 진피층의 변형에 의해 발생한다 (Lapiere, 1990).
진피는 섬유아세포와 세포사이의 세포 외 기질 (extracellular matrix, ECM)로 구성되어 있다. ECM은 피부의 구조적 지지와 강도 및 탄력을 제공하는 콜라겐 (collagen), 엘라스틴 (elastin) 및 수분결합과 압축성을 조절하는 물질 등을 포함한다 (Kendall and Feghali-Bostwick, 2014). 진피 섬유아세포의 노화는 세포 크기의 감소, 기능 저하, 콜라겐 양의 감소 등으로 주름 발생, 진피층의 위축, 건조 등 진피층의 변형을 특징으로 진행된다. 노화는 내적 및 외적 요인으로 인한 활성 산소종의 증가가 진피 섬유아세포의 기능을 감소시키고, 콜라겐 합성경로인 transforming growth factor-beta (TGF-β) 신호 전달을 억제하고, 콜라겐 분해효소의 활성을 증가시킴으로써 진피내 콜라겐을 감소시킨다 (Qin et al., 2017). 진피층내 부족해진 콜라겐의 양은 주름 발생뿐만 아니라 세포와 ECM 사이의 물리적 상호작용을 방해함으로써 진피세포의 기능과 콜라겐 합성 저하를 가속화하여 노화 진행을 더욱 촉진한다 (Cole et al., 2018).
노화 관련 베타-갈락토시다아제 (senescence-associated beta-galactosidase, SA-β-gal)는 베타-갈락토시드 (β-galactoside)를 단당류로 가수분해하는 노화 세포에서 발견되는 효소이다 (Lee et al., 2006). SA-β-gal이 노화 세포에서 반드시 발현되는 것은 아니지만 in situ 및 in vitro 모두의 노화 세포에서 쉽게 검출되고 신뢰할 수 있기 때문에 세포 노화 (celluar senescence)를 측정하는 유용한 마커로 사용되고 있다 (Hall et al., 2016). 이는 연속적인 세포배양을 이용한 내인성 인자와 광노출을 이용한 외인성 인자로 인한 노화된 세포 특징적으로 과발현되고 축적되는 리소좀 효소인 SA-β-gal의 활성을 측정하는 원리이다 (Lee et al., 2006).
자운영 (Astragalus sinicus)은 일본, 중국 남부, 한국 중부 등 동아시아에서 발견되는 다년생 초본의 콩과 (Leguminosae) 식물이다. 자운영은 생육기간 동안 토양 박테리아와 공생하면서 질소를 영양분으로 이용하여 토양을 비옥하게 만드는 질소 고정 (nitrogen fixation) 작용이 있어 주로 논에서 벼 재배기술 향상을 위해 종자를 파종하는 식물로 알려져 있다 (Kim et al., 2010).
자운영 활용을 위한 효능 연구에 의하면, 자운영의 어린잎과 줄기가 부드러워 먹을 수 있는 안전한 식물로 풍담해수, 인후통, 외상 출혈 및 대상포진 등을 치료하는 민간요법으로 이용된 바 있다 (Choi et al., 2009). 그러나 지금까지 자운영에 대한 연구 자료는 토양 시스템에서 벼 재배의 효율성을 높이는데 자운영을 천연비료로 활용하려는 연구가 대부분이었으며, 자운영을 새로운 약용식물자원으로서 개발하는 연구는 크게 이루어지지 않았다.
Yeom 등 (2003)은 자운영 종자의 아세톤 추출물에서 총플라보노이드량과 총페놀량의 함량을 측정하고 DPPH 라디컬 소거능을 측정하여 항산화 효과가 있다고 보고한 바 있고, 자운영 종자에서 추출한 오일을 함유한 크림 제형을 제조하여 보습효과를 보고함으로써 자운영 종자 오일에 대하여 피부에 대한 긍정적 효과와 제품화의 가능성을 제시한 바 있다. (Kim and Kim, 2011). Kim 등 (2014)이 자운영의 뿌리와 줄기를 메탄올로 추출하여 HaCaT 세포에 대한 항산화 효과와 항염증 효과 기전을 보고하였는데, 자운영 메탄올 추출물은 NF-κB 염증 신호경로와 관련되어 IL-1, IL-6, IL-8, TNF-α 등의 염증성 사이토카인의 생성을 감소시키는 작용으로 항염증 효과를 나타낸다고 보고하였다.
성분 연구에서는 Cui 등 (1992)이 자운영의 전초에 trigonelline, canavanine, choline, soyasaponin, sapogenol 등이 함유되어 있고, 종자에는 canavanine, canaline, homoserin, coumestrol, daidzin 등의 성분이 함유되어 있다고 보고하였다.
이에 본 연구에서는 인체에 안전한 어린잎 및 줄기를 포함하는 자운영 전초를 astragalin을 지표성분으로 하는 에탄올 추출물로 제조하여, 연속계대배양을 이용한 자연 노화와 UVB 노출에 의한 광노화를 이용하여 피부 진피세포의 항노화 효과를 확인하고자 하였다.
재료 및 방법
1. 실험재료
자운영 (A. sinicus)은 식물에 함유된 소수성 및 친수성 물질 모두를 추출하는데 효과적이면서 인체 적용에 가장 안전하다고 알려진 에탄올을 추출용매로 사용하여 자운영 70% 에탄올 추출물 (ASE)로 제조하여 사용하였다 (Lefebvre et al., 2021).
구체적으로 자운영을 전남 함평에서 대량 재배된 전초 80 ㎏을 2021년 5월 초순에 채취하여 ㈜한국생명과학연구소에서 식물형태학적 검증을 거쳐 증류수로 세척하고 열풍건조 후 분쇄하여 8.68 ㎏ 얻어 암소에 보관하면서 추출물 제조에 사용하였다.
자운영 70% 에탄올 추출물의 제조는 건조된 자운영 전초 100 g을 2 ℓ 에탄올 : 정제수 (7 : 3, v/v)에 침지하여 80℃에서 6 시간 동안 방치하여 추출하였다. ASE는 거름막으로 여과한 추출액을 진공 농축하여 에탄올을 제거한 후 안정한 보관을 위해 농축 여액을 다시 동결건조 (FD 5510 SPT, IlsinBioBase, Dongducheon, Korea)하여 갈색의 자운영 추출 분말을 얻었으며 -20℃에 냉동 보관하며 시료로 사용하였다. ASE의 수율은 15.34%로 확인되었다.
2. 시약
본 실험에 사용한 Dulbecco’s Modified Eagle’s Medium (DMEM)과 phosphate buffer saline (PBS)는 Welgene (Daegu, Korea)에서, fetal bovine serum (FBS)과 penicillin/streptomycin은 각각 GenDEPOT (Katy, TX, USA)과 Gibco (Grand Island, NY, USA)에서 구입하여 사용하였다.
Astragalin의 표준시약은 BIOFRON (La Mirada, CA, USA)에서 구매하여 사용하였다. 그 외 언급하지 않은 시약들은 모두 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하여 사용하였다.
3. HPLC 분석 조건 및 astragalin 함량 분석
ASE에 대한 astragalin의 함량 분석은 Theppakorn and Wongsakul (2013)의 방법을 변형하여 Waters 600 HPLC (Milford, MA, USA)를 사용하여 수행하였으며, HPLC에 시료 및 표준품 40 ㎕를 주입하여 1.0 ㎖/min의 유속으로 분석하였다. 표준용액의 범위는 1 ㎍/㎖ - 100 ㎍/㎖이었다.
이동상으로 trifluoroacetic acid : acetonitrile : water를 0.1 : 16.95 : 82.95 (v/v/v) 비율로 혼합하여 사용하였다. Column은 Phenomenex사의 Luna C18 (250 ㎜ × 4.6 ㎜, 5 ㎛, Phenomenex Inc., Torrance, CA, USA)을 사용하였으며, isocratic elution 방법으로 흡광도 254 ㎚에서 분석하였다.
4. 세포배양
Human dermal fibroblast (HDF)는 Gibco (Grand Island, NY, USA)에서 분양받아 실험에 사용하였다. HDF 세포는 DMEM에 10% FBS, 100 U/㎖ penicillin, 100 ㎍/㎖ streptomycin을 첨가한 배지를 사용하였다.
5. UVB 조사
UVB 노출은 HDF 세포주를 96-well plate에 1 × 104 cells/well, 24-well plate에 5 × 104 cells/well로 분주하여 배양하였다.
세포가 부착된 후 FBS가 없는 DMEM을 첨가하여 4 시간 동안 배양한 후 PBS를 넣고 UVB 램프 (Sankyo Denki, G8T5E, Kanagawa, Japan)가 장착된 UVC 500 UltraViolet Crosslinker (Amersham, Bucks, England)를 이용하여 30 mJ/㎠로 UVB를 조사하였다. 세포를 PBS로 세척 후 ASE를 100, 125, 250, 500, 800, 1,000 ㎍/㎖ 농도별로 처리하고 24 시간 동안 추가 배양하였다. 대조군은 UVB 조사 없이 동일한 조건으로 진행되었다.
6. 세포 생존율 측정
ASE의 HDF 세포에 독성이 나타나는 농도를 확인하기 위해 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylte-trazolium bromide (MTT) 분석법을 이용하여 확인하였다.
96-well plate에 HDF 세포를 1 × 104 cells/well의 세포 수로 부착한 후, ASE를 100, 125, 250, 500, 800, 1,000 ㎍/㎖로 처리하여 24 시간 동안 배양하였다. 5 ㎎/㎖의 MTT를 첨가하고 3 시간에서 4 시간 동안 반응한 후 상등액을 제거하였다. 형성된 formazan을 DMSO 200 ㎕에 녹이고 microplate reader VICTOR X3 (PerkinElmer, Waltham, MA, USA)를 이용하여 540 ㎚에서 흡광도를 측정하였다. 세포 생존율은 대조군과 비교하여 흡광도의 백분율로 표시하였다.
7. qRT-PCR
ASE의 농도별 처리에 따라 HDF에서 collagen 분해와 연관된 MMP-1의 mRNA 발현 수준을 검정함으로써 주름 개선효능을 평가하고자 real-time quantitative reverse transcription polymerase chain reaction (qRT-PCR)로 실시하였다.
세포 독성 검정에서 독성이 없는 범위 내에서 TrizolTM (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 total RNA를 추출하였고 cDNA 합성 키트 (ECDNA 100, NanoHelix Co., Ltd., Daejeon, Korea)를 이용하여 cDNA를 합성하였다. 이후 프리미어 qPCR 키트 (PQL-S500, Nano-Helix Co., Ltd., Daejeon, Korea)를 사용하여 PCR을 증폭하였다
cDNA 합성 조건은 65℃에서 5 분간 RNA denaturation 시킨 후 42℃에서 1 시간 동안 cDNA를 합성하고 95℃에서 5 분간 reverse transcriptase를 불활성화시켰다. PCR 조건은 95℃에서 30 초간 pre-denaturation을 한 후 95℃에서 5 초, 60℃에서 30 초를 40 cycle로 반응하여 원하는 형광값을 검출하였다. 사용된 프라이머 서열은 다음과 같다 (Table 1).
8. Elastase 활성 억제 효과
HDF 세포를 100 ㎜ dish에 2 × 105 cells/well로 분주한 후 90% 이상 배양된 세포를 수확하여 5,000 rpm에서 2 분간 원심분리하였다. 상층액을 버리고 세포 침전물에 protein lysis buffer (PRO-PREPTM) 100 ㎕를 가하여 세포를 균질화하였다. 이 용액을 4℃, 15,000 rpm으로 30 분간 원심분리 후, 상층액을 취하여 elastase 효소액으로 사용하였다.
효소액을 Bradford법 (1976)으로 단백질을 정량하여 각 well 당 100 ㎍의 단백질 함유량을 96 well plate에 넣고 0.2 M Tris-HCl 완충액 (pH 8.0)을 넣어 88 ㎕가 되도록 하였다. ASE를 농도별로 10 ㎕ 씩 넣고 기질인 50 mM N-succinyl-tri-alanyl-p-nitroanilide를 well 당 2 ㎕ 씩 넣고 37℃에서 배양하였다. 90 분간 반응시킨 후 microplate reader VICTOR X3 (PerkinElmer, Waltham, MA, USA)를 이용하여 405 ㎚에서 흡광도를 측정하였다.
본 실험에서는 피부 섬유아세포 유래 elastase 효소 활성 억제 효과를 나타내는 phosphoramidon을 양성대조군으로 사용하여 (Alcorn and Wright, 2004) 비교하였다.
9. Senescence-associated beta-galactosidase (SA-β-gal) 활성 측정
세포 노화를 측정하기 위해 바이오마커로 알려져 있는 세포 내 β-galactosidase를 염색하는 방법인 SA-β-galactosidase assay를 senescence detection kit (#K320-250, BioVision, Milpitas, CA, USA)를 이용하여 수행하였다 (Lee et al., 2006).
내인성 자극과 외인성 자극 요인 모두에 대한 세포 노화현상을 측정하기 위하여, 최소 30 회 이상의 계대배양으로 내인성 자극에 의한 자연 노화를 유도한 HDF 세포와 외인성 자극 UVB 노출로 광노화를 유도한 HDF 세포를 각각 실험에 사용하였다.
내인성 자극 환경을 위한 연속 계대배양된 HDF 세포는 24 well plate에 5 × 104 cells/well의 세포수로 부착한 후, ASE를 125, 250, 500, 800 ㎍/㎖로 처리하여 24 시간 동안 배양하였다. 또한, 외인성 자극환경을 위한 실험군은 10 회 이하로 계대배양된 HDF 세포에 30 mJ/㎠ 조사량으로 UVB를 노출시키고 세포를 PBS로 세척 후 ASE를 농도별로 처리하고 24 시간 동안 배양하였다. ASE 처리시간 후 모든 실험군은 배양액을 제거하고 PBS로 wash한 후 세포를 고정시키기 위해 fixative solution 500 ㎕를 첨가하여 상온에서 15 분간 방치하였다.
고정화된 세포는 PBS로 wash한 후, staining solution 혼합액 (staining solution 470 ㎕, staining supplement 5 ㎕, 20 ㎎/㎖ X-gal in DMSO 25 ㎕)을 500 ㎕씩 첨가한 뒤 37℃에서 24시간 동안 배양하여 세포를 염색하였다.
염색된 세포를 현미경용 카메라 DigiRetina 16 Camera (Tucsen Photonics Co., Ltd., Fuzhou, China)를 이용하여 촬영한 뒤, 촬영한 이미지는 전체 세포에서 염색된 세포의 비율을 통해 세포 노화 정도를 확인한 후 수치화하였다.
10. 통계분석
본 실험의 결과는 4 회 이상 반복한 값을 평균 ± 표준편차 (means ± SD)로 나타내었다. 각 실험 결과에 대한 통계분석은 SPSS 26.0 program (Statistical Package for Social Sciences, SPSS Inc., Chicago, IL, USA)을 이용하여 One-way Analysis of Variance (ANOVA)를 실시한 후 Tukey HSD 다중분석법을 사용하여 각 처리구간의 유의적 차이를 5% 수준에서 검증하였다 (p < 0.05).
결과 및 고찰
1. 자운영 에탄올 추출물의 astragalin의 지표성분 함량 분석
자운영 (A. sinicus)은 콩과에 속하는 황기속 (Astragalus Linne) 식물로 알려져 있다. 황기속 식물에서 대표적인 황기 (Astragalus membranaceus)의 지표성분으로 알려진 astragalin은 flavonoid 계열의 성분이다 (Kwon and Park, 2012; Riaz et al., 2018). Astragalin은 황기속 식물 이외에도 Cassia alata, Moringa oleifera, Nelumbo nucifera, Cuscuta spp., Morus alba 및 Eucommia ulmoides 등의 다양한 약용식물에서 분리되었으며, 식물의 지표 성분 뿐만 아니라 항염증, 항산화, 뇌 신경 및 심혈관 보호 작용, 항당뇨, 항암 등의 효과에서 유효 성분으로 약리작용과 그 기전이 연구되고 있다 (Riaz et al., 2018).
본 연구에서 사용된 황기속 식물인 자운영의 에탄올 추출물에서도 astragalin 성분이 함유되어 있음을 확인함으로써, 본 연구는 astragalin을 지표성분으로 하는 70% 에탄올 추출물을 제조하였다. HPLC 방법으로 분석한 결과 astragalin은 약 12.20 분의 retention time을 가진 peak로 확인되었고, 표준곡선의 검량식은 y = 70,493.01x - 9,011.97이었고 r2는 0.99로 우수한 직선성을 나타내었다. Astragalin 함량은 1.87 ± 0.18 ㎎/g로 확인되었다 (Fig. 1).
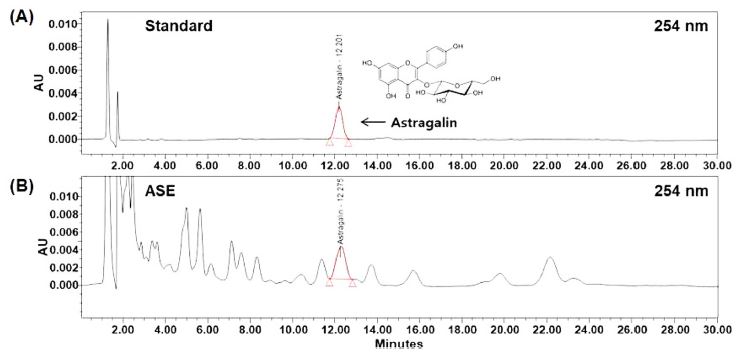
HPLC chromatogram of astragalin.(A); HPLC chromatogram of astragalin standard chemical (1 μg/㎖), (B); HPLC chromatogram of astragalin in ASE. ASE; 70% ethanol extract of A. sinicus.
Riaz 등 (2018)은 astragalin을 함유하는 약 1,650 종의 다양한 약용식물과 약용식물에서 추출한 astragalin에서 항산화, 항염증, 항암, 항골다공증, 항당뇨, 항비만, 심혈관계, 뇌질환 등의 다양한 생리활성효과를 보고한 바 있다. 이 연구에 의하면 astragalin의 성분 자체의 작용기전 연구와 astragalin 유도체 합성연구 및 astragalin을 함유하는 식물의 효능 연구가 함께 진행되고 있다고 설명하였다.
이에 본 연구에서는 자운영추출물이 astragalin을 함유하는 유용한 식물자원으로서 피부 항노화 효과를 가진 새로운 기능성 천연 소재로 개발하고자 진행하였다.
2. 자운영 에탄올 추출물의 세포 독성 평가
진피 섬유아세포는 표피층과 접하고 있으며 ECM과 상호작용하며 진피층을 이루고 있으므로 피부가 항상성 (skin homeostasis)을 유지하는데 매우 중요하다 (Tissot et al., 2018). 진피층에서 섬유아세포는 콜라겐 (collagen), 엘라스틴 (elastin) 등 주요 섬유 단백질을 생산하며, 그 외에도 fibronectin, glycan과 같은 기질 내 matrix의 기능성 단백질을 합성 및 분비하여 피부의 구조적 지지를 유지하고 주름 형성에 관여한다 (Cole et al., 2018).
ASE가 진피 섬유아세포에 미치는 영향과 효능을 평가하기 위하여 세포 독성이 나타나지 않는 유효농도 범위를 설정하고자 ASE 처리에 의한 HDF의 세포 생존률과 세포 독성을 평가하였다. ASE를 100, 125, 250, 500, 800, 1,000 ㎍/㎖의 농도 수준으로 처리한 결과 최종농도인 ASE 1,000 ㎍/㎖까지 세포 독성이 확인되지 않았다 (Fig. 2A).
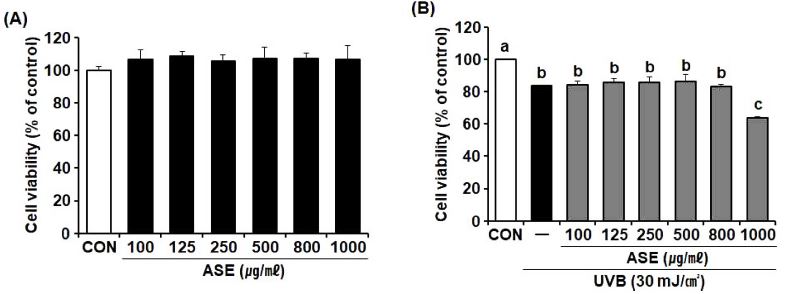
Cytotoxicity of ASE on HDF cells by MTT assay.(A) HDF cells were treated with ASE for 24 h. (B) Cells were exposed to UVB (30 mJ/㎠) and then treated with ASE for 24 h. The results were expressed as percentages of the untreated control (CON). Data are presented as the means ± SD (n = 5). p-values were calculated by One-way ANOVA and Tukey’s HSD test. ASE; 70% ethanol extract of A. sinicus, CON; untreated control, MTT; 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, UVB; ultraviolet B radiation.
UVB는 280 ㎚ - 320 ㎚의 파장을 갖는 자외선으로 일광화상, 과색소침착, 일광각화증, 일광탄력증 및 피부 노화를 일으키는 가장 대표적인 환경적 피부 자극 요인이 된다 (Kim et al., 2021). Hudson과 Towers (1991)는 많은 천연 소재들이 잠재적 광과민제 (photosensitizer) 효과를 나타낼 수 있으며, 이는 천연 소재가 특정 빛의 파장에 의해 광과민 반응을 일으켜 세포 독성이 증가될 수 있다고 보고하였다.
따라서 ASE 처리에 대하여 세포 독성이 전혀 일어나지 않았던 섬유아세포의 세포 생존률 결과에서 UVB 노출에 대한 ASE의 광과민성 반응이 나타날 가능성을 확인하기 위하여 UVB 노출에 대한 ASE의 섬유아세포 독성효과를 재확인하였다.
실험 결과 HDF에 대한 UVB 노출 (30 mJ/㎠)은 UVB를 조사하지 않은 군에 비해 16.2%의 세포 독성을 나타내었는데 실험에 사용한 UVB 조사량의 경우 20% 이내로 섬유아세포에 독성효과를 나타낸다는 보고와 일치하는 경향을 나타내었다 (Kim et al., 2021).
UVB 조사와 함께 처리한 ASE 실험군은 ASE를 처리하지 않고 UVB만을 조사한 실험군과 비교하여 1,000 ㎍/㎖ 농도군을 제외하고는 세포 독성에 영향을 미치지 않았다 (Fig. 2B).
ASE를 단독으로 처리하여 세포 독성을 측정한 실험에서 ASE는 1,000 ㎍/㎖의 처리농도에서 세포 독성을 전혀 나타내지 않았으나 (Fig. 2A), UVB 조사와 함께 ASE를 1,000 ㎍/㎖의 농도 수준으로 처리한 경우 UVB 단독 조사군에 비하여 약 24.05%의 세포 독성을 더 나타내었다 (Fig. 2B). 이는 ASE가 1,000 ㎍/㎖ 이상의 고농도 범위에서 나타날 수 있는 광과민성 반응의 가능성을 보여준다고 할 수 있다.
Sulaiman 등 (2022)은 최근까지 보고된 광과민성 활성이 있는 천연물 유래 성분으로 aloe emodin, emodein, berberine, curcumin, furanocoumarin, scopoletin, rubiadin 등을 제시하였으며, 이들은 항암, 항염증, 항바이러스효과, 항골다공증 등 다양한 질환의 효능 연구에 적용할 수 있다고 설명하였다. 그러나, 광과민제 개발에 있어서는 이상적인 흡수 파장대의 광선과 표적세포에서의 높은 선택성 및 안정성 등이 확보되어야 한다고도 기술하였다. 이에, 본 연구에서는 광과민성 효능보다는 ASE의 진피 노화에 대한 효능을 연구하기 위하여 ASE의 농도를 800 ㎍/㎖ 이하의 범위로 설정하고 진행하였다.
3. 자운영 에탄올 추출물의 MMP-1 mRNA 발현 및 elastase 활성 억제 효과
진피의 노화는 진피층의 두께를 얇게 만들어 위축시키고 피부 탄력성에 영향을 미치는 세포 간의 ECM 구성성분에 변화를 일으킨다. 진피 노화의 가장 대표적인 반응은 ECM의 70% - 80%를 차지하는 콜라겐과 엘라스틴의 생성과 분해의 균형이 깨지면서 ECM 내 콜라겐의 총량이 급격히 저하된다 (Cole et al., 2018).
Matrix metalloproteinase-1 (MMP-1)과 elastase는 ECM 내의 콜라겐과 엘라스틴을 분해하는 효소로서, 내인성 및 외인성 노화 요인에 의해 ECM 내 활성산소 활성이 증가되면 이들 효소가 활성화되어 진피층의 ECM으로 분비된 콜라겐과 엘라스틴 섬유를 분해시킨다 (Won et al., 2021). 이는 결국 진피층의 위축과 피부 주름, 탄력 상실 및 수분 소실 등 피부 노화의 임상 변화로 이어진다 (Quan et al., 2010).
본 실험에서는 ASE의 진피 노화에 대한 개선 효과를 확인하기 위하여 ASE를 진피 섬유아세포에 처리하여 콜라겐과 엘라스틴 분해효소인 MMP-1 mRNA 발현과 elastase 활성 억제 효과를 측정하였다. ASE는 실험에 사용한 모든 농도에서 MMP-1 발현을 농도 의존적으로 크게 억제시켰다. ASE를 800 ㎍/㎖의 수준으로 처리한 경우 대조군 대비 약 57.0%까지 MMP-1 발현을 억제하였으며 이는 양성대조군인 TGF-β (10 ng/㎖)를 처리한 수준과 유사하였다 (Fig. 3A).
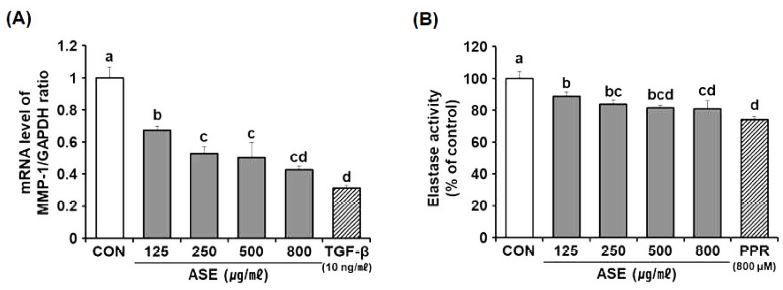
Effects of ASE on mRNA levels of MMP-1 and elastase activity in HDF cells.(A) Cells were treated with ASE (125 to 800 ㎍/㎖) for 24 h, and then mRNA level of MMP-1 expression was measured using qRT-PCR. Data are presented as means ± SD (n = 5) and normalized to the mRNA expression levels of GAPDH. (B) Elastase activity was measured in cell lysates treated with ASE of HDF. Data are presented as the means ± SD (n = 5) and expressed as percentages of untreated controls. P values were calculated by One-way ANOVA and Tukey’s HSD test. ASE; 70% ethanol extract of A. sinicus, CON; untreated control, MMP-1; matrix metalloprotease-1, TGF-β; transforming growth factor-β, GAPDH; glyceraldehyde-3-phosphate dehydrogenase, PPR; phosphoramidon.
Elastase는 엘라스틴 섬유를 분해하는 효소로 elastase 활성이 증가되었다는 것은 ECM내 elastin의 양을 감소시켜 피부 주름을 형성하고 탄력성을 감소시킨다는 것을 의미한다 (Kim et al., 2016). ASE는 MMP-1 억제 효과와 마찬가지로 실험에 사용한 모든 농도에서 elastase 활성을 억제하였다. ASE 125, 250, 500, 800 ㎍/㎖에서 각각 11.3%, 16.4%, 18.4%, 19.0%로 유의성 있는 elastase 활성 억제 효과를 나타내었으며, ASE의 800 ㎍/㎖ 농도에서는 19.0%로 양성대조군으로 사용한 phosphoramidon의 억제 효과 25.5%와 근접한 억제율이 나타났다 (Fig. 3B).
Choi 등 (2011)은 자운영 종자의 아세톤 추출물에서 MMP-1과 elastase 효소 활성이 크게 억제되었다고 보고하였는데, 이는 ASE의 MMP-1 및 elastase 억제 결과와 유사하다. Yeom 등 (2003)도 자운영 종자의 아세톤 추출물에서 항산화 효과와 flavonoid 함량을 보고하였는데, 이는 본 연구에서 사용된 ASE에서 함유된 flavonoid 성분 astragalin의 항산화 효과와 생리활성 효과와도 유사하였다 (Riaz et al., 2018). Choi 등 (2011)이 보고한 자운영 종자 아세톤 추출물의 항주름 효과는 본 연구에서 사용한 자운영의 종자를 제외한 전초 전부를 사용한 에탄올 추출물의 항주름 효과와 유사하며, 이는 astragalin 등의 유효성분이 자운영 종자 및 전초 부위에 모두 분포되어 있을 가능성을 제시한다. 그러나 자운영에 대한 연구 결과가 매우 적어서 부위별로의 성분분포와 그 효능에 대한 연구는 향후 더 이루어져야 할 것으로 판단된다.
4. 자운영 에탄올 추출물의 SA-β-gal 활성 억제 효과
SA-β-gal은 세포의 노화 진행과 함께 점차 활성이 증가되는 효소로 이는 UVB 노출에 의한 광노화 반응에서도 활성이 증가되어 피부세포의 노화 정도를 평가하는데 크게 활용되고 있다 (González−Gualda et al., 2021). 본 연구에서는 ASE가 진피 섬유아세포에 대하여 항노화 효과가 있는지 확인하기 위하여 HDF 세포에서 SA-β-gal 활성을 측정하였다.
자연 노화를 유도한 HDF 세포에 ASE를 처리하고 SA-β-gal 활성을 측정한 결과 ASE는 효능 실험에 사용한 모든 농도 (125 ㎍/㎖ - 800 ㎍/㎖)에서 SA-β-gal의 활성을 농도 의존적으로 84.9%까지 크게 억제하였다 (Fig. 4A and 4B).
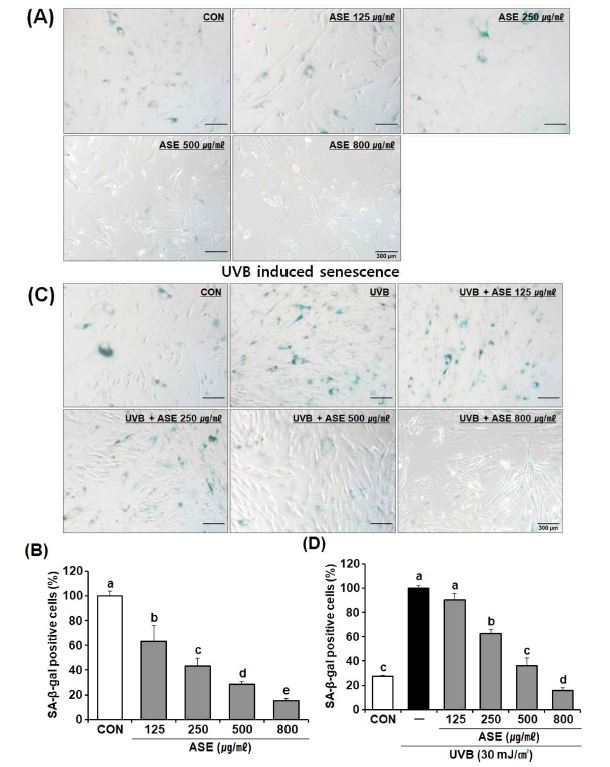
Effect of ASE on senescence-associated-β-galactosidase activity in HDF cells.High passage HDF cells (passage number ≥ 30) were stained with the SA-β-gal assay kit. (A) SA-β-gal activity in HDF cells treated with ASE for 24 h. (B) Quantification of SA-β-gal positive cells cultures shown in A. (C) UVB (30 mJ/㎠)-exposed or unexposed cells cultured in the presence of ASE for 24 h. (D) Quantification of SA-β-gal positive cells cultures shown in C. Data represent the means ± SD (n = 4). P values were calculated by One-way ANOVA and Tukey’s HSD test. ASE; 70% ethanol extract of A. sinicus, CON; untreated control, UVB; ultraviolet B radiation, SA-β-gal; senescence-associated β-galactosidase.
외인성 자극에 의한 광노화 반응에서는 UVB (30 mJ/㎠)를 HDF 세포에 조사하고 ASE를 처리하여 SA-β-gal의 활성을 비교한 결과 UVB를 조사한 세포군은 UVB를 조사하지 않은 세포군에 비해 SA-β-gal의 활성이 3.67 배로 크게 증가됨을 확인하였으며 (Fig. 4C and 4D), 이는 HDF 세포에서 UVB 노출에 의해 외인적 광노화 자극과 이에 따른 노화 현상을 인위적으로 유도할 수 있음을 의미한다.
UVB 노출과 함께 ASE를 처리한 군에서는 실험에 사용한 모든 농도 (125 ㎍/㎖ - 800 ㎍/㎖)에서 농도 의존적으로 SA-β-gal의 활성이 크게 감소하여 항노화 효과를 나타내었다. 가장 효과가 크게 나타난 ASE 800 ㎍/㎖ 농도에서는 UVB를 조사하지 않은 정상 대조군 수준으로 회복되는 결과를 보여주었다 (Fig. 4C and 4D). 이러한 결과는 ASE가 자연 노화와 광노화 모두의 세포 노화 반응에서 우수한 항노화 효과가 있음을 의미한다.
피부의 노화 반응은 내인성 인자와 외인성 인자의 자극으로 유발된다. 이들은 노화 과정에서 서로 연관되어 영향을 미쳐서 내인성 노화와 외인성 노화가 독립되어 이루어지지 않고 복잡한 상호 작용으로 서로 영향을 미치며 유발되는 것으로 생각되고 있으며 자연 노화와 광노화는 주름 발생 등 피부 노화의 임상적 특징에서 큰 차이를 나타내진 않지만, 광노화는 자연 노화와 달리 활성산소종 축적과 진피 내 염증세포의 침윤 및 염증 반응이 두드러지게 나타난다고 보고되고 있다 (Bonté et al., 2019).
본 연구 결과를 통하여 자운영 에탄올 추출물 ASE가 진피 세포의 노화 반응 뿐만 아니라 자외선 노출에 의한 광노화에서도 우수한 보호 효과가 있음을 확인하였다. ASE는 세포 독성을 나타내지 않는 안전한 유효농도 범위에서 MMP-1 발현과 elastase 활성을 억제하였고, HDF의 내인성 인자에 의한 자연 노화 및 UVB 노출에 의한 광노화 반응에서도 모두 우수한 효과를 나타내었다. 이는 ASE가 자연 노화 뿐만 아니라 노화를 가속화시키는 광노화 반응에서도 보호 효과가 있음을 의미한다. 따라서 본 연구는 ASE가 자연 노화와 광노화 모두에서도 우수한 효과를 나타내는 새로운 피부 항노화의 기능성 소재로 개발될 수 있음을 제시하여준다고 생각된다.
Acknowledgments
본 연구는 2021년도 중소벤처기업부의 기술개발사업(과제번호: S3083453)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Alcorn JF and Wright JR. (2004). Degradation of pulmonary surfactant protein D by Pseudomonas aeruginosa elastase abrogates innate immune function. Journal of Biological Chemistry. 279:30871-30879.
[https://doi.org/10.1074/jbc.M400796200]

-
Amaro-Ortiz A, Yan B and D'Orazio JA. (2014). Ultraviolet radiation, aging and the skin: Prevention of damage by topical cAMP manipulation. Molecules. 19:6202-6219. https://www.mdpi.com/1420-3049/19/5/6202/htm?wm=book_wap_0005, (cited by Aug 1).
[https://doi.org/10.3390/molecules19056202]

-
Bonté F, Girard D, Archambault J and Desmoulière A. (2019). Skin changes during ageing. Biochemistry and Cell Biology of Ageing: Part II Clinical Science. Springer. Berlin, Germany. p.249-280.
[https://doi.org/10.1007/978-981-13-3681-2_10]

-
Bradford MM. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72:248-254.
[https://doi.org/10.1016/0003-2697(76)90527-3]

-
Choi DB, Choi OY, Park J, Kim HS and Kim R. (2011). Potential application of acetone extract of Astragalus sinicus Linne seed to functional cosmetics. Korean Journal of Chemical Engineering. 28:890-894.
[https://doi.org/10.1007/s11814-010-0510-2]

- Choi DB, Lee KI, Kim NY and Kim R. (2009). An analysis on physicochemical characteristics and components of seeds of Astragalus sinicus Linne. The Asian Journal of Beauty and Cosmetology. 7:217-223.
-
Cole MA, Quan T, Voorhees JJ and Fisher GJ. (2018). Extracellular matrix regulation of fibroblast function: Redefining our perspective on skin aging. Journal of Cell Communication and Signaling. 12:35-43.
[https://doi.org/10.1007/s12079-018-0459-1]

-
Cui B, Inoue J, Takeshita T, Kinjo J and Nohara T. (1992). Triterpene glycosides from the seeds of Astragalus sinicus L. Chemical and Pharmaceutical Bulletin. 40:3330-3333.
[https://doi.org/10.1248/cpb.40.3330]

-
González-Gualda E, Baker AG, Fruk L and Muñoz-Espín D. (2021). A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288:56-80.
[https://doi.org/10.1111/febs.15570]

-
Hall BM, Balan V, Gleiberman AS, Strom E, Krasnov P, Virtuoso LP, Rydkina E, Vujcic S, Balan K, Gitlin I, Leonova K, Polinsky A, Chernova OB and Gudkov AV. (2016). Aging of mice is associated with p16(Ink4a)-and β-galactosidase-positive macrophage accumulation that can be induced in young mice by senescent cells. Aging. 8:1294-1315.
[https://doi.org/10.18632/aging.100991]

-
Hudson JB and Towers GHN. (1991). Therapeutic potential of plant photosensitizers. Pharmacology and Therapeutics. 49:181-222.
[https://doi.org/10.1016/0163-7258(91)90055-Q]

-
Kendall RT and Feghali-Bostwick CA. (2014). Fibroblasts in fibrosis: Novel roles and mediators. Frontiers in Pharmacology. 5:123. https://www.frontiersin.org/articles/10.3389/fphar.2014.00123/full, (cited by 2022 July 23).
[https://doi.org/10.3389/fphar.2014.00123]

-
Kim BH, Oh I, Kim JH, Jeon JE, Jeon B, Shin J and Kim TY. (2014). Anti-inflammatory activity of compounds isolated from Astragalus sinicus L. in cytokine-induced keratinocytes and skin. Experimental and Molecular Medicine. 46:e87. https://www.nature.com/articles/emm2013157, (cited by 2022 July 23).
[https://doi.org/10.1038/emm.2013.157]

- Kim R and Kim HS. (2011). A study on the cream containing chinese milk vetch(Astragalus sinicus Linne) seeds oil and its skin refreshing effect. Asian Journal of Beauty and Cosmetology. 9:1-9.
-
Kim SH, Ha CW, Lim H, Jang S, Namkoong S, Hong S, Kim YK, Kim JY, Lee SR and Sohn EH. (2021). Aqueous extract of phragmites communis rhizomes attenuates phototoxicity in skin cells. Molecular and Cellular Toxicology. 17:29-40.
[https://doi.org/10.1007/s13273-020-00106-5]

- Kim SY, Hwang WH, Lee JH, Oh SH, Cho JH, Han SI, Jeong KH, Park ST, Choi KJ, Kim JI, Lee JY, Song YC, Yeo US and Kang HW. (2010). Change of seed dormancy and viability of chinese milk vetch(Astragalus sinicus L.) in rice field. Korean Journal of Crop Science. 55:76-82.
-
Kim YM, Jung HJ, Choi JS and Nam TJ. (2016). Anti-wrinkle effects of a tuna heart H2O fraction on Hs27 human fibroblasts. International Journal of Molecular Medicine. 37:92-98.
[https://doi.org/10.3892/ijmm.2015.2407]

-
Kwon HJ and Park YD. (2012). Determination of astragalin and astragaloside content in radix astragali using high-performance liquid chromatography coupled with pulsed amperometric detection. Journal of Chromatography A. 1232:212-217.
[https://doi.org/10.1016/j.chroma.2011.12.035]

-
Lapiѐre CM. (1990). The ageing dermis: The main cause for the appearance of ‘old’ skin. British Journal of Dermatology. 122:5-11.
[https://doi.org/10.1111/j.1365-2133.1990.tb16119.x]

-
Lee BY, Han JA, Im JS, Morrone A, Johung K, Goodwin EC, Kleijer WJ, DiMaio D and Hwang ES. (2006). Senescence-associated β-galactosidase is lysosomal β-galactosidase. Aging Cell. 5:187-195.
[https://doi.org/10.1111/j.1474-9726.2006.00199.x]

-
Lefebvre T, Destandau E and Lesellier E. (2021). Selective extraction of bioactive compounds from plants using recent extraction techniques: A review. Journal of Chromatography A. 1635:461770. https://www.sciencedirect.com/science/article/abs/pii/S002196732031044X, (cited by 2022 Aug 6).
[https://doi.org/10.1016/j.chroma.2020.461770]

-
Qin Z, Balimunkwe RM and Quan T. (2017). Age?related reduction of dermal fibroblast size upregulates multiple matrix metalloproteinases as observed in aged human skin in vivo. British Journal of Dermatology. 177:1337-1348.
[https://doi.org/10.1111/bjd.15379]

-
Quan T, Shao Y, He T, Voorhees JJ and Fisher GJ. (2010). Reduced expression of connective tissue growth factor(CTGF/CCN2) mediates collagen loss in chronologically aged human skin. Journal of Investigative Dermatology. 130:415-424.
[https://doi.org/10.1038/jid.2009.224]

-
Riaz A, Rasul A, Hussain G, Zahoor MK, Jabeen F, Subhani Z, Younis T, Ali M, Sarfraz I and Selamoglu Z. (2018). Astragalin: A bioactive phytochemical with potential therapeutic activities. Advances in Pharmacological and Pharmaceutical Sciences. 2018:9794625. https://www.hindawi.com/journals/aps/2018/9794625/, (cited by 2022 Aug 23).
[https://doi.org/10.1155/2018/9794625]

-
Sulaiman C, George BP, Balachandran I and Abrahamse H. (2022). Photoactive herbal compounds: A green approach to photodynamic therapy. Molecules. 27:5084. (cited by 2022 Aug 6).
[https://doi.org/10.3390/molecules27165084]

- Theppakorn T and Wongsakul S. (2013). Optimization and validation of the HPLC-based method for the analysis of gallic acid, caffeine and 5 catechins in green tea. Naresuan University Journal. 20:1-11.
-
Tissot FS, Estrach S, Boulter E, Cailleteau L, Tosello L, Seguin L, Pisano S, Audebert S, Croce O and Féral CC. (2018). Dermal fibroblast SLC3A2 deficiency leads to premature aging and loss of epithelial homeostasis. Journal of Investigative Dermatology. 138:2511-2521.
[https://doi.org/10.1016/j.jid.2018.05.026]

-
Won HR, Lee PJ, Oh SR and Kim YM. (2021). Epigallocatechin-3-gallate suppresses the expression of TNF-α-induced MMP-1 via MAPK/ERK signaling pathways in human dermal fibroblasts. Biological and Pharmaceutical Bulletin. 44:18-24.
[https://doi.org/10.1248/bpb.b20-00304]

- Yeom SH, Kim MK, Kim HJ, Shim JG, Lee JH and Lee MW. (2003). Phenolic compounds from seeds of Astragalus sinicus and its antioxidative activities. Korean Journal of Pharmacognosy. 34:344-351.
