
RCP 기후변화 시나리오에 따른 천궁의 생장 및 생리 활성 변화
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Cnidium officinale Makino is a representative medicinal plant, but it is sensitive to changes in climate. The aim of this study was to investigate the growth, physiological reaction, and active compound content of C. officinale Makino in different Representative Concentration Pathway scenarios (RCP 2.6, 4.5, and 8.5).
The net photosynthesis rate of C. officinale was reduced in July and was highest in RCP 8.5 over the entire study period. The maximum carboxylation rate and maximum electron transport rate were reduced in July, therefore, photosynthetic activity also decreased. Chlorophyll a and b, total chlorophyll, and carotenoid content were significantly decreased in high-level RCP scenarios. An increased amount of light energy was captured in photosystem II, but it was lost as heat rather than being used in the electron transfer process. The decrease in the photosynthetic activity of C. officinale in RCP 8.5 was due to the accumulation of excitation energy by inactivation of the reaction center of photosystem II. The chlorogenic acid, ferulic acid, and senkyunolide A content in were significantly low in RCP 8.5.
CO2 concentration significantly affects the growth, physiological sensitivity, and active compound content of C. officinale.
Keywords:
Cnidium officinale Makino, Climate Change, Morphological Growth Characteristics, Physiological Active Compounds, Representative Concentration Pathway (RCP)서 언
약용식물은 질병과 장애로부터 인체에 대한 위협을 완화시키는 데 매우 중요한 역할을 한다고 알려져 있다 (Sharma et al., 2020). 천궁 (Cnidii Rhizoma)은 산형과 (Umbelliferae)에 속하는 다년생 초본으로, 원산지는 중국이며, 대한민국과 일본 등에 분포한다. 기원식물에 따라 일천궁 (Cnidium officinale Makino)과 토천궁 또는 중국천궁 (Ligusticum chuanxiong Hort.)으로 나뉜다 (Seo et al., 2018).
국내의 대표적인 한약재 중 하나인 천궁은 진통제 및 항염 증제로 많이 사용되어 왔으며 (Lee et al., 2016; Lim et al., 2019; Lee and Kang, 2020), 천궁의 뿌리 부위는 항균 및 항진균, 항산화, 혈관확장, 고혈압. 진정효과 등의 약리작용이 있는 약용작물이다 (Lee et al., 2015).
일천궁은 여름철에도 서늘하고 광량이 높지 않은 곳에서 잘 서식하며, 여름철 기온이 30℃ 이상으로 상승하게 되면 하고 현상 (夏枯現象)이 발생하여 잎이 말라 고사하게 된다 (Kim et al., 2020). 이에 따라 일천궁의 최적 재배 조건은 오전이나 오후에 그늘이 지고 여름철 기온이 급상승하지 않는 산간고랭지가 적합할 것이다.
천궁의 생산량 및 재배 면적은 각각 1997년 2,294 M/T과 789 ㏊에서 2020년 1,105 M/T과 133 ㏊로 크게 감소하였다 (MAFRA, 2020). 이와 같이 천궁의 생산량과 재배면적이 크게 감소한 원인은 첫째로, 천궁이 고온 및 가뭄 등과 같은 기후변화에 민감하고 둘째, 천궁은 연작장해가 심한 작물이어서 지속적인 재배지 변경이 이루어져야 하는 단점이 있기 때문이다 (Kim et al., 2016; Seo et al., 2018; Jung et al., 2019). Seo 등 (2018)의 연구에 따르면 일천궁은 1 년의 연작으로도 초작지에 비해 노두 수가 약 60% 감소하여 10 a 당 생산량은 36% 감소되었다.
가뭄, 기온 및 해수면 상승 등과 같은 기후변화 (climate change)로 인해 나타나는 문제들은 전세계적으로 규모가 점차 넓어지고 있으며, 다시 이전의 상태로 되돌릴 수 없는 비가역성 (irreversibility)을 가진다는 점에서 매우 중요한 이슈이다 (Solomon et al., 2009). 이러한 기후변화는 온도, 습도, 광량, 이산화탄소 등 다양한 환경적인 요인과 산업이 발달함에 따라 점차 가속화되어 가고 있으며, 특히 이산화탄소는 기후변화에 주요 원인 인자로 보고되어 있다. 기후변화는 생물 다양성에 크게 위협이 될 수 있으며 (Lindzen, 1990; Das et al., 1999), 기온의 급증과 같은 요인은 식물 생장에 스트레스로 작용하여 2차 대사산물 및 다양한 활성물질에 영향을 끼칠 수 있다 (Mishra, 2016).
Intergovernmental Panel on Climate Change (IPCC)에서 발간한 5차 평가보고서에서는 1880년부터 2012년까지 지구의 표면온도가 0.85℃ 상승하였다고 밝혔다 (IPCC, 2013). 광범위한 미래 기후변화의 범위를 RCP 시나리오 (Representative Concentration Pathways)를 통해 소개하고 있으며, RCP 시나리오는 온실가스 농도를 반영하여 미래 기후를 예측하는 것으로, 복사강제력 (radicative forcing, W/m2)을 나타내며, 온실가스 등으로 에너지의 평형을 변화시키는 영향력의 정도를 의미한다 (Meinshausen et al., 2011; Taylor et al., 2012; Zhang et al., 2016; KMA, 2018). 국립원예특작과학원에서는 기후변화시나리오에 근거한 해발고도에 따라 과수 (사과, 포도, 감귤) 및 인삼, 천궁, 당귀 작물의 생산성이 변화함을 보고하였다 (NIHHS, 2017).
따라서, 본 연구에서는 RCP 시나리오 (RCP 2.5, 4.5, 8.5)에 따라 서로 다른 이산화탄소 농도 (400 ppm, 540 ppm, 940 ppm) 및 온도 상승 조건이 천궁의 생장 및 생리적인 반응에 미치는 영향을 조사하여 이에 대한 작물생산성 변화 예측과 생리적 감수성을 파악해 보고자 수행하였다.
재료 및 방법
1. 실험재료 및 실험구 조성
실험에 사용된 천궁은 산림약용자원연구소에서 분양받은 개체를 사용하였으며, 2021년 4월 8일 원예용 상토 (Horticulture nursery media, Punong, Gyeongju, Korea)를 이용한 높이 30 ㎝, 직경 30 ㎝ 포트의 중심에 1 본씩 이식하였다.
기후변화 조건에 따른 대기 이산화탄소 농도 등 기상 조건을 제공하기 위해 한국농수산대학 기후변화교육센터 내 자연광형 정밀환경조절시스템인 Soil fruit daylit system chambers (SFDS chamber, PTW Freiburg, Freiburg, Germany)을 이용하였으며 (Fig. 1A), 실험구는 RCP 2.6 (CO2 400 ppm), RCP 4.5 (CO2 540 ppm) 및 RCP 8.5 (CO2 940 ppm)로 구분하였다 (Fig. 1B). 또한 기온은 RCP 2.6의 경우 최근 3 년간의 전주지역 기상 조건을 참조하여 주기적으로 챔버 내부 온도 조건을 변화시켰으며, RCP 4.5와 RCP 8.5는 RCP 2.6과 비교해 각각 +1.2℃, +2.6℃씩 상승시켰고 (KMA, 2018), 습도는 공통적으로 60%로 조절하였다 (Fig. 2).

The Soil fruit daylit system chambers (A) and growth performance (B) of C. officinale under three RCP scenarios.Three RCP scenario indicated by carbon dioxide concentration at 400 ppm (RCP 2.6, left pannel), 540 ppm (RCP 4.5, central pannel), and 940 ppm (RCP 8.5, right pannel).
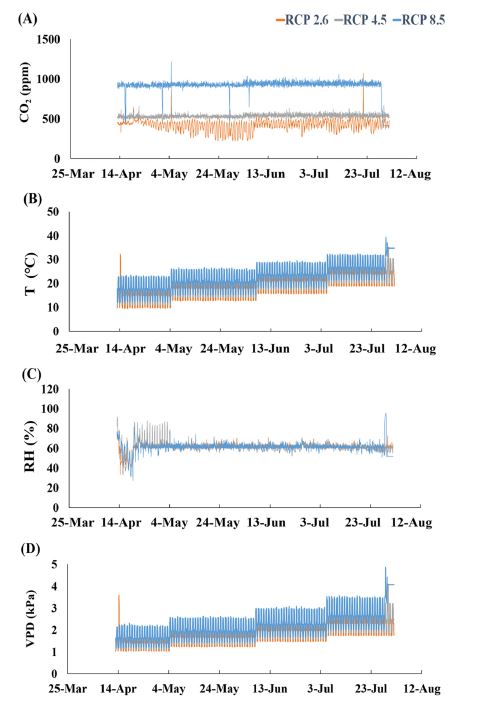
Changes of (A) CO2 concentration, (B) temperature, (C) relative humidity and (D) Vapor pressure deficit during the experimental period.
실험은 2021년 4월 15일부터 7월 20일까지 55% 차광막을 설치한 후 챔버당 각각 20 개체씩 배치하여 진행하였으며, 실험 기간 중 기온 및 상대습도 변화는 챔버 내 설치된 기상관측센서 (CO2: GMW86P, Vaisala, Vantaa, Finland, 습도: HMW82, Vaisala, Vantaa, Finland, 온도: RBF185L, Pyromation Inc., Fort Wayne, USA)를 활용하였다. 측정된 온도 및 습도 결과를 통해 대기수증기압차 (Vapor Pressure Deficit; VPD)를 산출하였다.
2. 광합성 반응
기후변화 시나리오별 광합성 및 기공 반응을 관찰하기 위해 휴대용 광합성 측정기 (Portable Photosynthesis system, Li-6800, Li-Cor Inc., Lincoln, NE, USA)를 이용하여 5월부터 7월까지 매월 20 일 - 25 일에 처리구당 6 반복으로 측정하였다.
측정 시 광합성 측정 장치에 부착된 LED light source를 이용하여 PPFD (photosynthetic photon flux density)를 1,000 μmol·m-2·s-1로 고정하였으며, 순광합성속도 (net photosynthesis rate; A), 기공증산속도 (stomatal transpiration rate; E), 기공전도도 (stomatal conductance; gs) 등을 조사하였다.
측정된 결과를 통해 내재적 수분이용효율 (intrinsic water use efficiency, WUEi)과 순간증산효율 (instantaneous transpiration efficiency, ITE)을 산출하였다 (Zheng et al., 2011; Xia et al., 2014; Lee et al., 2019). 또한 CO2 농도 (0 μ㏖·m-2·s-1 - 1400 μ㏖·㏖-1)에 의한 엽육세포내 CO2 반응 곡선 (A-Ci)을 Ethier and Livingston (2004)의 방법으로 작성하고 최대카르 복실화속도 (maximum carboxylation rate, Vcmax), 최대전자전달속도 (maximum electron transport rate, Jmax) 및 엽육전도도 (mesophyll conductance, gm)를 산출하였으며 (Sharkey et al., 2007; Kodama et al., 2011), 이때 공통된 측정 조건은 챔버로의 유입 공기유량을 600 μmol·s-1, 온도를 25 ± 1℃로 유지하였다. 또한 광합성 실험이 종료된 잎을 각각 채취하여 스캔한 후 Imaje J 프로그램 (Bio Rad Inc., Hercules, CA, USA)을 이용해 엽면적을 산출한 후 재산정하였다.
3. 엽록소 및 카로티노이드 함량
엽록소 및 카로티노이드 함량을 조사하기 위해 광합성 실험이 종료된 7월 25일경 각 처리구당 5 장의 엽을 채취하고, 엽편 0.1 g을 10 ㎖의 DMSO (dimethyl sulfoxide) 용액이 들어있는 20 ㎖ 유리병에 넣어 65℃로 설정된 항온기에서 6 시간 색소를 추출하였다 (Hiscox and Israelstam, 1979).
추출한 용액은 분광광도계 (UV/VIS Spectrophotometer, HP 8453, Hewlett Packard, Wilmington, DE, USA)를 이용하여 663 ㎚, 645 ㎚, 470 ㎚의 파장에서 흡광도를 측정하고, 엽록소 a, b, a + b 및 carotenoid 함량을 산출하였다 (Arnon, 1949; Lichtenthaler, 1987).
4. 엽록소 형광반응
엽록소 형광반응 측정기 (Plant Efficiency Analyzer, Hansatech Instrument Ltd., King’s Lynn, England)를 이용하여 5월부터 7월까지 매월 1 회씩 처리구당 6 반복으로 OKJIP 분석 (polyphasic rise of chlorophyll a fluorescence transients)을 실시하였다.
측정 전 모든 잎은 20 분간 암적응 시켰으며, 이후 3,500 μ㏖ · m-2 · s-1의 광량을 1 초간 조사하고, 50 ㎲ (O단계), 300 ㎲ (K단계), 2 ㎳ (J단계), 30 ㎳ (I단계), 500 ㎳ (P단계)의 엽록소 형광밀도를 조사하였다. OKJIP 분석 결과를 통해 생물리학적 변수 [biophysical parameters; Fv/Fm (probability that an absorbed photon leads to reduction further than QA-), VJ (relative variable fluorescence at the J-step), VI (relative variable fluorescence at the I-step), Vk (relative variable fluorescence at the k-step), Mo (approximated initial slope (in ms-1) of the fluorescence transient V = f(t)), Sm (normalized total complementary area above the OJIP transient (reflecting multiple turnover QA reduction events) or total electron carriers per RC), ABS/RC (absorption flux per reaction center), DI0/RC (energy dissipation flux per reaction center at t = 0), TR0/RC (trapped energy flux per reaction center at t = 0), ET0/RC (electron transport flux from QA to QB per reaction center at t = 0), RE0/RC (electron transport flux until PSI acceptors per reaction center at t = 0), PIabs (performance index on absorption basis), DFabs (driving force on absorption basis) 및 SFIabs (the structure function index on absorption basis)]를 산출하여 제시하였다 (Table 1) (Strasser et al., 2000; Wang et al., 2012; Lee et al., 2021a).
5. 생장특성
생리 반응 조사가 모두 종료된 7월 25일경 모든 시료의 잎 + 줄기, 뿌리를 구분하고 건조기 (DS-80-5, Dasol Scientific Co. Ltd., Hwaseong, Korea)에 48 시간 동안 80℃로 건조하여 부위별 건중량을 측정하였다. 또한 측정 결과에 따라 S/R률 (shoot/root ratio), 엽중비 (leaf weight ratio; LWR) 및 뿌리중비 (root weight ratio; RWR)를 계산하였다.
6. 활성성분 분석
RCP 시나리오에 따른 활성 성분의 변화를 측정하기 위하여, 분말 시료 1 g을 80% methanol 30 ㎖을 가한 후 1 시간 동안 초음파 추출 (JAC-5020, KODO, Korea)하였다. 추출액은 다시 1 시간 동안 교반 (HG-15D, Daihan, Korea)하고 0.2 ㎛ membrane filter (Whatman Syringe Filter, Maidstone, England)로 여과하여 천궁에 함유되어 있는 chlorogenic acid, ferulic acid, senkyunolie A, ligustilide의 함량을 HPLC (Ultimate3000 HPLC, Dionex, Waltham, MA, USA)를 이용하여 분석하였다.
분석에 사용한 컬럼은 Inno C-18 column 5 ㎛ (4.6 × 250 ㎜, Youngjin Biochrom Co., Ltd., Seongnam, Korea)이며, column 온도는 45℃로 설정하여 유지하였다. 이동상으로 solvent A는 0.1% trifluoroacetic acid (J.T. Baker, Easton, PA, USA) in DW, solvent B는 acetonitrile (J.T. Baker, Easton, PA, USA)로 선정하였고, 시간에 따른 용매의 조건은 다음과 같이 기울기 용리법으로 분석하였다 (0 min - 17 min, 10% B; 17 min - 20 min, 30% B; 20 min - 26 min, 100% B; 26 min - 30 min, 10% B). 모든 시료에 대한 분석 시간은 30 분으로 하였고, 유속은 1 ㎖/min로 조정하였으며, 주입량은 10 ㎕로 하였다. 검출기는 diode array detector (DAD)를 이용하여 326 ㎚에서 측정하였다.
Chlorogenic acid, ferulic acid, senkyunolide A, ligustilide의 표준품 (Sigma-Aldrich Co., St. Louis, MO, USA)을 농도별로 분석하여 calibration curve를 작성한 후 각 시료에 대한 성분 함량을 정량 분석하였다.
7. 데이터 분석
실험 결과분석을 위한 통계는 SPSS Statistics program 19.0 (SPSS Inc., Chicago, IL, USA)을 이용하여 일원분산분석 (One-way ANOVA)을 실시하였으며, 각 처리간의 유의성은 DMRT (Duncan's Multiple Range Test) 5% 수준에서 실시하였다 (p < 0.05).
결과 및 고찰
1. 광합성 반응
시기별로 RCP 시나리오에 따른 순광합성속도 (A)를 비교한 결과, 전반적으로 5, 6월에 비해 7월의 순광합성속도가 다소 감소되는 경향을 보였고, 처리구별로는 RCP 8.5에서 모든 시기에 걸쳐 유의적으로 가장 높은 순광합성속도를 보였다 (Table 2).
기공증산속도 (E)는 RCP 4.5와 8.5의 경우 5월에 비해 6월에 다소 증가된 경향을 보인데 비해 RCP 2.6은 큰 변화가 없이 유지되고 있었으며, 7월로 경과되면서 처리구간에는 통계적인 유의성을 보이지 않았으나 (p < 0.05), RCP 8.5 처리구가 6월에 비해 약 36% 수준까지 급격하게 감소된 것으로 나타났다. 이러한 경향은 기공전도도 (gs)의 변화와 유사한 것으로 RCP 2.6은 5월에서 7월까지 큰 변화가 없었던 것에 비해 RCP 4.5는 점진적인 증가를 보이고, RCP 8.5는 6월까지 증가하다가 7월에 크게 감소된 기공전도도 (gs)를 나타내었다.
이와 대조적으로 수분이용효율은 7월에 RCP 8.5 처리구에서 뚜렷하게 증가한 경향을 보였는데 (p < 0.05), RCP 8.5는 RCP 2.6에 비해 내재적 수분이용효율 (WUEi)은 약 2 배, 순간증산효율 (ITE)은 약 2.6 배 높은 값을 나타냈다. RCP 4.5의 경우 5월에 상대적으로 가장 높은 수분이용효율을 보였다가 이후 감소된 경향을 보이면서, 7월에는 전반적으로 RCP 2.6과 큰 차이를 나타내지 않았다 (Table 2).
특히 기후변화 조건의 초기 적응 시기인 5월에서 RCP 4.5는 RCP 2.6에 비해 순광합성속도는 큰 차이가 없었으나 기공전도도는 약 49% 낮은 수준을 보여 (Table 2) 기온 상승에 대한 항상성 유지를 위한 기공조절이 민감하게 이루어지고 있는 것으로 여겨지며, 이후 점차 안정적으로 환경조건에 적응해 나가는 것으로 볼 수 있다. 그러나 RCP 8.5는 대기 CO2 농도가 940 ppm으로 RCP 2.6에 비해 약 2.4 배 높은 조건이며, 5월과 6월에는 기공전도도를 높여 대기 중 높은 CO2를 적극적으로 받아들이면서, 체내 CO2 분압을 증가시키는 반응을 보이고 있으나 기온이 가장 높은 7월로 경과하면서 CO2 흡수 보다는 기공을 닫아 체내 수분손실을 막기 위한 반응에 집중하는 것으로 여겨진다.
일반적으로 대기 중 CO2 농도가 상승하게 되면 대기에서 광합성 기관까지 CO2 확산이 용이해져 광합성 속도가 증가되는 탄소시비 효과 (CO2 fertilization effect)를 보일 수 있다 (Hopkins and Hüner, 2008). 대표적인 약용작물인 인삼 역시 대조구에 비해 CO2 농도는 2 배 (750 ppm - 800 ppm), 온도는 평균 2℃ 높게 유지한 상태로 생육시킨 경우 1, 2년생 모두 광합성율이 증가하였으며 (Lee et al., 2012), 이러한 경향은 배추 (Oh et al., 2016), 포도 (Son et al., 2014), 백합나무 (Lee et al., 2013) 등 다양한 종류의 식물에서도 흔히 관찰되고 있다.
그러나, 상대적으로 높은 광합성속도는 체내 수분소비도 증가시킬 수 있으며, 수종에 따라서는 대기 중의 CO2 농도와 온도가 상승할 경우, 삼투 스트레스로 인해 기공전도도가 낮아지고 증산을 억제시키는 기작을 보이기도 한다 (Leymarie et al., 1999; Lee et al., 2005; Lee et al., 2021a). 특히 상승된 CO2 조건에서 기공 전도도 (gs)의 감소는 CO2 고정 속도를 제한할 수 있지만 가뭄 등 수분 부족 기간이 증가할 것으로 예상되는 기후 변화 맥락에서 식물 성장에 도움이 되도록 수분이용효율 (WUE)을 촉진할 수 있다 (Leakey et al., 2009; Xu et al., 2016).
천궁 역시 기온과 수증기압차 (VPD)가 가장 높은 시기인 7월이 되면서 뚜렷한 기공전도도의 감소를 통해 증산은 억제되고, 수분이용효율은 크게 증가시키는 경향을 보였는데, 세포 내 잔존해 있는 CO2 농도가 높게 유지되는 경우 기공 닫힘이 증가된 상태에서도 상대적으로 높은 광합성속도를 보일 수 있다 (Zhou and Quebedeaux, 2003; Lee et al., 2021a). 결과적으로 천궁은 940 ppm의 높은 대기 중 CO2 농도에서 광합성 속도의 증가와 수분의 효율적인 소비를 통해 물과 이산화탄소 활용의 적절한 균형을 유도하는 반응이 나타나는 식물임을 알 수 있다.
루비스코 (rubisco)의 활성을 의미하는 최대카르복실화속도 (Vcmax)와 RuBP (ribulose-1,5-bisphosphate)의 재생을 제한하는 요소인 최대전자전달속도 (Jmax)는 광합성 능력의 중요한 지표이며 (Hopkins and Hüner, 2008), 일반적으로 식물이 높은 CO2 농도에 장기간 노출되면 광합성 속도가 증가하더라도 CO2 분압 상승에 의한 광합성 촉진이 점차 둔화하면서 광합성 능력은 감소한다고 알려져 있다 (Cen and Sage, 2005; Ainsworth and Rogers, 2007; Wang et al., 2012; Lee et al., 2021b).
천궁에서도 RCP 8.5에서 뚜렷한 최대카르복실화속도인 Vcmax와 최대전자전달속도인 Jmax의 감소가 나타나므로 CO2를 고정시키기 위한 루비스코의 효율 저하 및 RuBP의 재생성이 지연되고 있음을 알 수 있다 (Fig. 3). 이는 RCP 8.5에서 엽육전도도 (gm)의 감소와 유사한 경향을 보이므로 엽육 내 CO2 확산속도의 감소가 광합성 능력 감소에 큰 영향을 미치는 것으로 여겨진다. 이와 더불어, RCP 4.5의 경우 RCP 8.5에 비해 월별 감소폭이 크지는 않지만 비교적 이른 6월경부터 최대카르복실화속도인 Vcmax와 최대전자전달속도인 Jmax의 유의적인 감소가 나타나 점진적인 광합성 능력의 감소 현상이 나타남을 알 수 있었다.
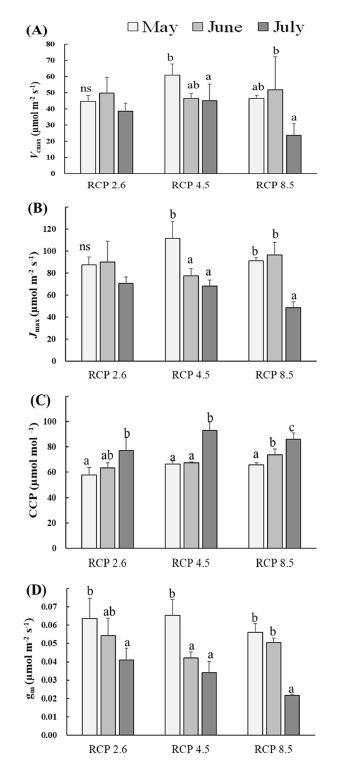
Changes in maximum carboxylation rate (A, Vcmax), maximum electron transport rate (B, Jmax), CO2 compensation point (C, CCP) and mesophyll conductance (D, gm) of C. officinale under three RCP scenarios.The different letters are significantly different (*p < 0.05) by Duncan's Multiple Range Test (DMRT, n = 3).
또한, CO2 보상점 (CCP)은 생육기간이 길어짐에 따른 증가 경향이 모든 처리구에서 유사하게 나타났으나, 처리구간 차이는 크지 않았다. 이러한 시기별 변화는 온도, 토양 수분 등의 환경요인에 의한 것으로 생각해 볼 수 있으며 (Borjigidai et al., 2006), 시기적으로 7월의 높은 평균 기온이 영향을 미칠 수 있다고 여겨진다.
3. 엽록소 및 카로티노이드 함량
엽록소 및 카로티노이드는 엽내의 질소 함량, 광합성 능력 등과 상관성이 높은 광합성 색소 (Terashima and Evans, 1988; Hikosaka and Terashima, 1995)로서 대기 중 CO2 농도와 온도 상승에 따른 광합성 색소의 변화는 수종간에 다양한 차이를 보이는 것으로 알려져 있다 (Lee et al., 2013; Lee et al., 2021b).
천궁의 경우 RCP 2.6과 4.5는 엽록소 a (chlorophyll a, Chl a), 엽록소 b (chlorophyll b, Chl b) 및 총 엽록소 함량 (total chlorophyll, T Chl)에서 큰 차이가 없는 것으로 나타났으나 고농도의 CO2 조건 및 대기 온도를 상승시킨 RCP 8.5 처리구는 유의적인 감소를 보였으며 (p < 0.05), 카로테노이드 함량 (Car.)은 기후변화 시나리오 수준이 높아질수록 점진적으로 감소하는 경향을 나타내었다 (Table. 3).
장기간 CO2 농도를 상승시킨 경우에 엽록소 함량의 감소가 나타나는 것은 생장의 증가로 인해 토양내 질소 함량이 감소하며 엽내로 공급이 제한되어 나타나는 결과로 여겨지며 (Long et al., 2004), 잎의 황화현상 및 조기낙엽의 증가는 노화의 촉진으로 이어지게 된다 (Lee et al., 2021b). 이러한 엽색소의 감소는 수분부족이나 강광에 의한 추가적인 스트레스가 제공될 경우 광계 II (photosystem II)에 공급되는 빛에너지를 감소시켜 광합성 기구의 보호에 도움을 줄 수 있다.
4. 생장
기후변화 시나리오별 천궁의 생장을 비교한 결과, 엽과 줄기 건중량 (shoot dry weight)과 지하부 건중량 (root dry weight) 및 총 건중량 (total dry weight)이 RCP 시나리오 수준이 높아질수록 다소 증가하는 경향을 보였으나 통계적으로 엽과 줄기 건중량에서만 유의성이 인정되었다 (Fig. 4) (p < 0.05). 또한, 물질분배율을 나타내는 S/R률 (shoot/root ratio), 엽중비 (LWR), 뿌리중비 (RWR) 모두 유의성이 인정되지 않았다. 결과적으로 대기 중 CO2 농도의 증가로 인해 지하부의 생장은 큰 차이가 없는 것에 비해 지상부의 생육은 촉진되는 경향을 보인 것으로 볼 수 있다.
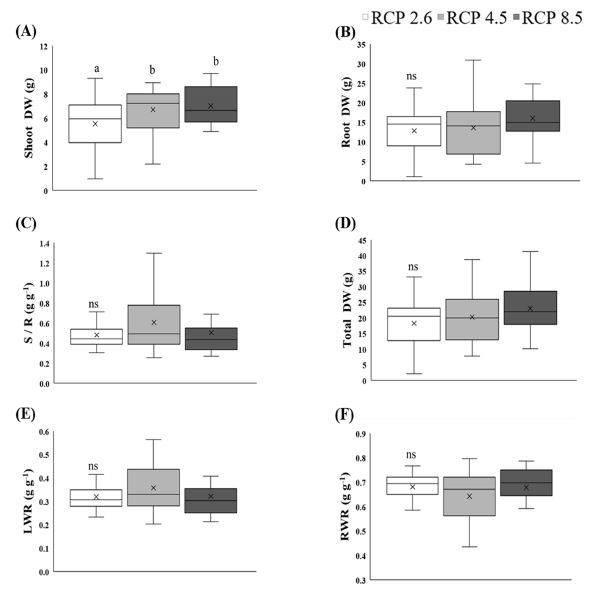
Changes in growth characteristics of C. officinale under three RCP scenarios.The different letters are significantly different (*p < 0.05) by Duncan's Multiple Range Test (DMRT, n = 20). Shoot DW; shoot dry weight, Root DW; root dry weight, Total DW; total dry weight, S/R: Stem+leaf / root ratio, LWR; leaf weight ratio, RWR; root weight ratio.
일반적으로 대기 중 CO2 농도가 증가하면, 식물들의 생장 역시 증가하는 것으로 알려져 있으며, 특히 초본식물의 경우 상대적으로 지상부 생장이 증가한 경우가 많이 보고되고 있다 (Lee et al., 2012; Xu et al., 2013; Oh et al., 2016). Lee 등 (2012)에 따르면 1 년생 인삼의 경우에도 대조구에 비해 CO2와 온도를 상승시킨 처리구에서 줄기 길이, 잎 수 등 지상부의 생장이 유의적으로 높은 것에 비해 지하부 생장은 통계적인 차이를 보이지 않았다고 하였다.
5. 엽록소 형광반응
엽록소 형광 분석과 광합성의 복잡한 역학관계는 광합성 생물리학적 과정의 기본적인 이해를 도와주며 (Kalaji et al., 2016), 특히 OKJIP 형광분석은 가시적인 스트레스 징후가 나타나기 전 스트레스 내성 및 생리적 장애에 대한 지표로 사용될 수 있다 (Strasser et al., 2000; Hopkins and Hüner, 2008).
Fv/Fm은 초기광화학반응에서 광계 II의 최대양자수율을 의미하며, 일반적으로 건강한 식물의 경우 Fv/Fm이 0.8 정도를 나타낸다 (Kim et al., 2020). 천궁의 경우에는 모든 처리구에서 0.8 이상으로 나타났으며, 처리구간에도 유의미한 차이를 확인할 수 없었다 (Fig. 5) (p > 0.05).
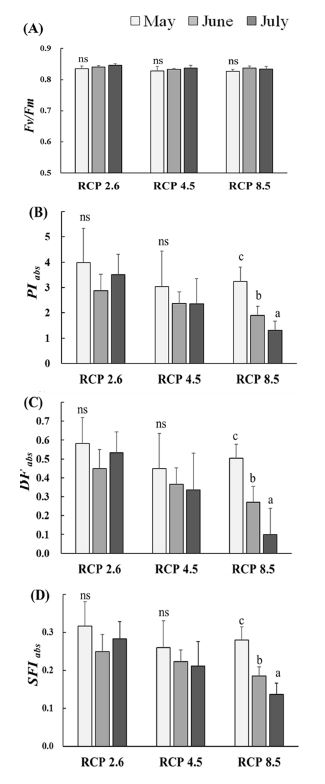
Changes in several chlorophyll fluorescence parameters (Fv/Fm, PIabs, DFabs and SFIabs) of C. officinale under three RCP scenarios.The different letters are significantly different (*p < 0.05) by Duncan's Multiple Range Test (DMRT, n = 6).
PIabs, DFabs 및 SFIabs는 다양한 환경스트레스에 대한 광합성 기구의 활력지수 (vitality indexes)로 활용되며, 환경스트레스 민감한 지표로 알려져 있다 (Strasser et al., 2000; Demetriou et al., 2007; Wang et al., 2012; Kalaji et al., 2016). PIabs는 흡수된 빛에너지를 이용해 전자 운반자들 (electron carriers)이 환원되는 과정에서의 에너지 보존효율을 의미하는데, 천궁의 경우 다른 처리구는 생육이 진행됨에 따라 유의적인 변화가 나타나지 않은 것에 비해 RCP 8.5는 뚜렷한 감소를 보여 광계 II로부터 이어지는 전자전달효율이 점차 저하되고 있음을 알 수 있다 (Fig. 5).
이러한 경향은 광합성 과정에서 전자전달의 추진력을 의미하는 DFabs와 광합성 기구의 분자적 구조와 기능을 나타내는 SFIabs에서도 유사하게 나타나는 것을 알 수 있으며 (Fig. 5), RCP 8.5는 전반적으로 광계 Ⅱ의 활력이 저하됨에 따라 암반 응시 요구되는 화학에너지의 생성이 원활하게 이루어지지 못하는 것으로 볼 수 있다 (Strasser et al., 2000; Dudeja and Chaudhary, 2005; Demetriou et al., 2007; Hopkins and Hüner, 2008; Kalaji et al., 2016; Lee et al., 2021). 특히 RCP 8.5에서 PIabs와 SFIabs는 5월에 비해 7월에 각각 40.4%, 48.8% 수준으로 감소한 것과 비교해 DFabs는 19.6% 수준까지 민감하게 감소되는 경향을 보여, 광합성 과정의 구동력 저하가 두드러지게 나타남을 알 수 있다.
기후변화 시나리오 조건에서 천궁의 생육 기간이 길어짐에 따라 엽록소 형광의 세부적인 지표도 유의미한 차이가 많아지는 경향을 보였다 (Fig. 6). 5월의 경우 모든 지표에서 처리구간에 뚜렷한 차이가 나타나지 않았으나, 6월경에는 Mo, Sm과 미세형광변이 VJ, VI, VK에서 유의적인 변화가 나타나기 시작했다. 7월경에는 처리구별로 RE0/RC를 제외한 모든 지표에서 유의적인 차이를 보였는데, VJ, VK, Mo, ABS/RC, DI0/RC, TR0/RC, ET0/RC는 증가하고, Sm은 감소되는 경향을 보였다 (Fig. 6).
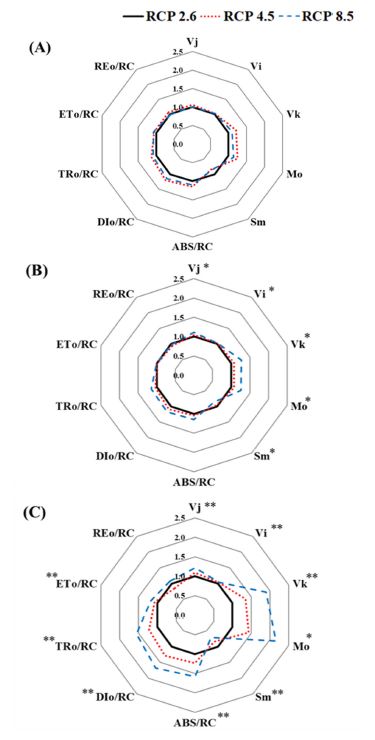
Radar plots of several fluorescence parameters of C. officinale under three RCP scenarios.(A); Radar plots in May. (B); Radar plots in June. (C); Radar plots in July. All values are shown as percent of RCP 2.6 (n = 6). The asterisk indicates significance (*p < 0.05, **p < 0.01).
이러한 경향은 RCP 8.5가 RCP 4.5에 비해 더욱 두드러진 것을 알 수 있었으며, 특히 Vk, Mo는 RCP 8.5가 RCP 2.6에 비해 약 2 배 이상 증가된 것으로 관찰되었다 (Fig. 6). 미세형광변이 Vk의 증가는 산소발생복합체 (oxygen-evolving complex)의 비활성화로 인해 광계 II에서 초기 전자수용체 퀴논 QA- 이후 전자전달이 저해됨을 의미하며 (Wang et al., 2012; Lee et al., 2021a), 전자공여체의 기능이 저하되는 스트레스 반응으로 볼 수 있다.
Mo와 ABS/RC의 증가는 반응중심이 닫혀있어 (Mo) 반응 중심당 흡수되는 빛에너지가 증가함 (ABS/RC)을 보여주는데, 광합성 전자전달과정에 활용되지 못한 과도한 여기에너지는 활성산소종 (ROS)의 생성을 초래하게 되며 결과적으로 엽록체 내부의 틸라코이드 막에 산화적 피해를 야기시킬 수 있고 광합성 능력의 저하로 이어질 수 있다 (Giorio and Sellami, 2021). 실제 Fig. 3에서 나타난 바와 같이 RCP 8.5의 경우 엽록소 함량의 감소가 두드러지게 관찰되었다.
TR0/RC와 DI0/RC의 증가를 통해 이러한 에너지가 반응중 심당 광계 Ⅱ에 포획되는 빛에너지의 증가를 유도하지만 이와 대조적으로 전자전달과정에 쓰이지 못하고 열로 소실되는 에너지 역시 크게 증가하고 있음을 보여준다 (Strasser et al., 2000; Wang et al., 2012; Lee et al., 2021a). 또한 ET0/RC는 초기전자수용체 이후 전자전달계로 전해지는 에너지이고, RE0/RC는 광계 I로 전해지는 에너지 흐름으로 ET0/RC는 상대적으로 변화 폭이 크지 않았으며, RE0/RC는 유의적인 차이를 보이지 않아 천궁의 광합성 활력 감소는 광계 II의 반응중심 비활성화로 인한 여기에너지 축적이 큰 요인임을 나타내며 이는 반응중심의 총 전자운반을 의미하는 Sm의 감소에서도 알 수 있다 (Strasser et al., 2000; Wang et al., 2012; Lee et al., 2021a).
결과적으로 기후변화 조건은 광계 II의 반응중심 비활성화로 인한 여기에너지 축적으로 에너지 보존효율, 광합성의 구동력 및 광합성 기구의 기능 등 전반적인 활력 지표를 저하시키고 이는 광합성 능력 감소에도 영향을 미치는 것을 알 수 있으며, 특히 RCP 4.5에 비해 상대적으로 더 높은 대기 CO2 농도와 기온 조건을 가진 RCP 8.5에서 두드러지게 나타남을 알 수 있다.
6. 유효성분 함량
천궁의 유효성분으로 보고 되어 있는 chlorogenic acid 및 ferulic acid, senkyunolide A, ligustilide를 RCP 시나리오 처리구별로 측정하였다 (Fig. 7). Chlorogenic acid와 ferulic acid, senkyunolide A의 함량은 이산화탄소의 농도가 400 ppm인 RCP 2.6 처리구에서 유의적으로 높게 나타났다. 반면, ligustilide의 함량도 RCP 2.6 처리구에서 높게 나타났으나, 다른 처리구와 유의적인 차이를 보이지는 않았다.
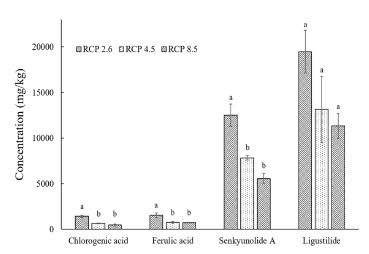
The contents of active compounds (chlorogenic acid, ferulic acid, senkyunolide A, ligustilide) of C. officinale Makino with different RCP scenarios. 400 ppm: RCP 2.6, 540 ppm: RCP 4.5, 940 ppm: RCP 8.5.*The different letters are significantly different by Duncan's Multiple Range Test (DMRT, p < 0.05).
다른 약용작물인 디기탈리스 (Digitalis lanata)는 높은 CO2 농도에서 다양한 glycoside (digoxin-mono-digitoxoside, digitoxin, digitoxigenin)이 유의적으로 감소하였다고 보고하였다 (Stuhlfauth et al., 1987; Stuhlfauth and Fock, 1990). 또한, 은행나무 (Ginkgo biloba)는 높은 수준의 CO2와 O3에 노출되었을 경우, terpenoid 함량은 quercetin aglycon의 증가에 따라 변하였고, kaempferol aglycon과 isorhamnetin, bilobalide에서 유의적인 감소를 보고하였다 (Huang et al., 2010). 이와 마찬가지로, 천궁도 RCP 시나리오별로 CO2의 농도가 증가함에 따라 4 가지 유효성분의 함량이 감소하는 결과를 보여 CO2 농도가 유효성분 함량에 영향을 끼칠 수 있는 것으로 생각되며, 이러한 결과는 이전 연구의 결과와 유사하게 나타남을 알 수 있다.
Acknowledgments
본 연구는 국립산림과학원 “임업·산림분야 기후변화 영향·취약성 평가 및 적응 연구(FE0100-2018-11)”의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Ainsworth EA and Rogers A. (2007). The response of photosynthesis and stomatal conductance to rising [CO2]: Mechanisms and environmental interactions. Plant, cell and environment. 30:258-270.
[https://doi.org/10.1111/j.1365-3040.2007.01641.x]

-
Arnon DI. (1949). Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris. Plant Physiology. 24:1-15.
[https://doi.org/10.1104/pp.24.1.1]

-
Borjigidai A, Hikosaka K, Hirose T, Hasegawa T, Okada M and Kobayashi K. (2006). Seasonal changes in temperature dependence of photosynthetic rate in rice under a free-air CO2 enrichment. Annals of Botany. 97:549-557.
[https://doi.org/10.1093/aob/mcl001]

-
Cen YP and Sage RF. (2005). The regulation of rubisco activity in response to variation in temperature and atmospheric CO2 partial pressure in sweet potato. Plant Physiology. 139:979–990.
[https://doi.org/10.1104/pp.105.066233]

- Das M, Zaide PH, Pal M and Sengupta UK. (1999). Carbon dioxide enrichment effect on growth and development of some crops. Journal of Agronomy and Crop Science. 181:221-225.
-
Demetriou G, Neonaki C, Navakoudis E and Kotzabasis K. (2007). Salt stress impact on the molecular structure and function of the photosynthetic apparatus-the protective role of polyamines. Biochimica et Biophysica Acta(BBA)-Bioenergetics. 1767:272-280.
[https://doi.org/10.1016/j.bbabio.2007.02.020]

-
Dudeja SS and Chaudhary P. (2005). Fast chlorophyll fluorescence transient and nitrogen fixing ability of chickpea nodulation variants. Photosynthetica. 43:253-259.
[https://doi.org/10.1007/s11099-005-0041-y]

-
Ethier GH and Livingston NJ. (2004). On the need to incorporate sensitivity to CO2 transfer conductance into the Farquhar-von Caemmerer-Berry leaf photosynthesis model. Plant, Cell and Environment. 27:137-153.
[https://doi.org/10.1111/j.1365-3040.2004.01140.x]

-
Giorio P and Sellami MH. (2021). Polyphasic OKJIP chlorophyll a fluorescence transient in a landrace and a commercial cultivar of sweet pepper(Capsicum annuum L.) under long-term salt stress. Plants. 10:887. https://www.mdpi.com/2223-7747/10/5/887, (cited by 2022 Sep 3).
[https://doi.org/10.3390/plants10050887]

-
Hikosaka K and Terashima I. (1995). A model of the acclimation of photosynthesis in the leaves of C3 plants to sun and shade with respect to nitrogen use. Plant, Cell and Environment. 18:605-618.
[https://doi.org/10.1111/j.1365-3040.1995.tb00562.x]

-
Hiscox JD and Israelstam GF. (1979). A method for the extraction of chlorophyll from leaf tissue without maceration. Canadian Journal of Botany. 57:1332-1334.
[https://doi.org/10.1139/b79-163]

- Hopkins WG and Hüner NPA. (2008). Introduction to plant physiology. (4nd ed.). John Wiley and Sons. New York, NY, USA. p. 223-230.
-
Huang W, He XY, Liu CB and Li DW. (2010). Effects of elevated carbon dioxide and ozone on foliar flavonoids of Ginkgo biloba. Advanced Materials Research. 113:165-169.
[https://doi.org/10.4028/www.scientific.net/AMR.113-116.165]

-
Intergovermental Panel on Climate Change(IPCC). (2013). In climate change 2013: The physical science basic contribution of working group 1 to the fifth assessment report of the intergovernmental panel on climate change. Cambridge University Press. Cambridge, England. p.159-167.
[https://doi.org/10.1017/CBO9781107415324]

-
Jung CR, Jeong DH, Park HW, Kim HJ, Jeon KS and Yoon JB. (2019). Molecular identification of thrips in two medicinal crops, Cnidium officinale Makino and Ligusticum chuanxiong Hort. Korean Journal of Medicinal Crop Science. 27:17-23.
[https://doi.org/10.7783/KJMCS.2019.27.1.17]

-
Kalaji HM, Jajoo A, Oukarroum A, Brestic M, Zivcak M, Samborska IA, Cetner MD, Łukasik I, Goltsev V and Ladle RJ. (2016). Chlorophyll a fluorescence as a tool to monitor physiological status of plants under abiotic stress conditions. Acta Physiologiae Plantarum. 38:102. https://link.springer.com/article/10.1007/s11738-016-2113-y, (cited by 2022 Sep 1).
[https://doi.org/10.1007/s11738-016-2113-y]

-
Kim DR, Gang GH, Jung HJ, Hong SW and Kwak YS. (2016). Effect of culture conditions on the chemical control efficacy of root rot disease of Platycodon grandiflorum and Codonopsis lanceolata. Korean Journal of Pesticide Science. 20:165-171.
[https://doi.org/10.7585/kjps.2016.20.2.165]

-
Kim KS, Seo YJ, Kim DC, Nam HH, Lee BY and Kim JH. (2020). Effect of soil water and shading treatment on chlorophyll fluorescence parameters and photosynthetic capacity in Cnidium officinale Makino. Korean Journal of Medicinal Crop Science. 28:412-420.
[https://doi.org/10.7783/KJMCS.2020.28.6.412]

-
Kim KY, Han KM, Kim HJ, Jeon KS, Kim CW and Jung CR. (2020). The study of soil chemical properties and soil bacterial communities on the cultivation systems of Cnidium officinale Makino. Korean Journal of Environmental Agriculture. 39:1-9.
[https://doi.org/10.5338/KJEA.2020.39.1.1]

-
Kodama N, Cousins A, Tu KP and Barbour MM. (2011). Spatial variation in photosynthetic CO2 carbon and oxygen isotope discrimination along leaves of the monocot triticale (Triticum × Secale) relates to mesophyll conductance and the Péclet effect. Plant, Cell and Environment. 34:1548-1562.
[https://doi.org/10.1111/j.1365-3040.2011.02352.x]

- Korea Meteorological Administration(KMA). (2018). Analysis of climate change forecasts on the Korean Peninsula. Korea Meteorological Administration. Seoul. Korea. p. 16.
-
Leakey ADB, Ainsworth EA, Bernacchi CJ, Rogers A, Long SP and Ort DR. (2009). Elevated CO2 effects on plant carbon, nitrogen, and water relations: Six important lessons from FACE. Journal of Experimental Botany. 60:2859-2876.
[https://doi.org/10.1093/jxb/erp096]

-
Lee HS, Lee S, Lee JC, Kim KW and Kim PG. (2013). Effects of elevated CO2 concentration and temperature on physiological characters of Liriodendron tulipifera. Korean Journal of Agricultural and Forest Meteorology. 15:145-152.
[https://doi.org/10.5532/KJAFM.2013.15.3.145]

-
Lee KC, An JA, Hwang JE, Kim PB, Park HB, Kim SJ, Park HJ, Lee CW, Lee BD and Kim NY. (2021). Effects of light condition on growth and physiological characteristics of the endangered species Sedirea japonica under RCP 6.0 climate change scenarios. Plants. 10:1891. http://www.mdpi.com/2223-7747/10/9/1891, (cited by 2022 Sep 5).
[https://doi.org/10.3390/plants10091891]

-
Lee KC, Han SK, Kwon YH, Jeon SR, Lee CW, Seo DJ and Park WG. (2019). Effects of shading treatments on growth and physiological characteristics of Aruncus dioicus var. kamtschaticus (Maxim.) H. Hara seedling. Korean Journal of Medicinal Crop Science 27:30-37.
[https://doi.org/10.7783/KJMCS.2019.27.1.30]

-
Lee KM, Kim HR, Lim H and You YH. (2012). Effect of elevated CO2 concentration and temperature on the growth and ecophysiological responses of ginseng(Panax ginseng C.A. Meyer). Korean Journal of Crop Science. 57:106-112.
[https://doi.org/10.7740/kjcs.2012.57.2.106]

-
Lee MJ and Kang MK. (2020). Analysis of the antimicrobial, cytotoxic, and antioxidant activities of Cnidium officinale extracts. Plants. 9:988. https://www.mdpi.com/2223-7747/9//8/988, (cited by 2022 Sep 6).
[https://doi.org/10.3390/plants9080988]

-
Lee SJ, Han SH, Oh CY, Bae EK, Lee JC and Kim PG. (2005). Effects of elevated CO2 concentration and air temperature on the water physiological characters of Populus alba × P. glandulosa cutting. Journal of Agriculture and Life Science. 49:101-110.
[https://doi.org/10.14397/jals.2015.49.6.101]

-
Lee SK, Cho JG, Jeong JH, Ryu SH, Han JH and Do GR. (2021). Effect of the elevated carbon dioxide on the growth and physiological responses of peach ‘Mihong’. Journal of Bio-Environment Control. 30:312-319.
[https://doi.org/10.12791/KSBEC.2021.30.4.312]

-
Lee YM, Lee YR, Kim CS, Jo KH, Sohn EJ, Kim JS and Kim JH. (2016). Cnidium officinale extract and butylidenephthalide inhibits retinal neovascularization in vitro and in vivo. BMC Complementary and Alternative Medicine. 16:231. http://link.springer.com/article/10.1186/s12906-01-1216-8, (cited by Aug 17).
[https://doi.org/10.1186/s12906-016-1216-8]

-
Lee YM, Lee YR, Kim JS, Kim YH and Kim J. (2015). Cnidium officinale and its bioactive compound, butylidenephthalide, inhibit laser-induced choroidal neovascularization in a rat model. Molecules. 20:20699-20708. https://www.mdpi.com/1420-3049/20/11/20699, (cited by Aug 19).
[https://doi.org/10.3390/molecules201119728]

-
Leymarie J, Lascève G and Vavasseur A. (1999). Elevated CO2 enhances stomatal responses to osmotic stress and abscisic acid in Arabidopsis thaliana. Plant, Cell and Environment 22:301-308.
[https://doi.org/10.1046/j.1365-3040.1999.00403.x]

-
Lichtenthaler HK. (1987). Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes. Methods in Enzymology. 148:350-382.
[https://doi.org/10.1016/0076-6879(87)48036-1]

-
Lim EY, Kim JG, Lee J, Lee C, Shim J and Kim YT. (2019). Analgesic effects of Cnidium officinale extracts on postoperative, neuropathic, and menopausal pain in rat models. Evidence-Based Complementary and Alternative Medicine. 2019:9698727. https://www.hindawi.com/journals/ecam/2019/9698727, / (cited by Aug 19).
[https://doi.org/10.1155/2019/9698727]

-
Lindzen RS. (1990). Some coolness concerning global warming. Bulletins of the American Meteorological Society. 71:288-299.
[https://doi.org/10.1175/1520-0477(1990)071<0288:SCCGW>2.0.CO;2]

-
Long SP, Ainsworth EA, Rogers A and Ort DR. (2004). Rising atmospheric carbon dioxide: Plants FACE the future. Annual Review of Plant Biology. 55:591-628.
[https://doi.org/10.1146/annurev.arplant.55.031903.141610]

-
Meinshausen M, Smith SJ, Calvin K, Daniel JS, Kainuma M, LAmarque J, Matsumoto K, Montzka S, Raper S, Riahi K, Thomson A, Velders GJM and van Vuuren DPP. (2011). The RCP greenhouse gas concentrations and their extensions from 1765 to 2300. Climatic Change. 109:213-241.
[https://doi.org/10.1007/s10584-011-0156-z]

- Ministry of Agriculture, Food and Rural Affairs(MAFRA). (2020). Production performance of industrial drops. Ministry of Agriculture, Food and Rural Affairs, Sejong, Korea. p.98-106.
- Mishra T. (2016). Climate change and production of secondary metabolites in medicinal plants: A review. International Journal of Herbal Medicine. 4:27-30.
- National Institute of Horticultural and Herbal Science(NIHHS). (2017). Impact assessment based on climate change scenarios (RCP) in apple, grape, mandarin, ginseng, cnidium, and Korean angelica. National Institute of Horticultural and Herbal Science. Rural Development Administration. Wanju, Korea. p.120-148.
-
Oh S, Son IC, Wi SH, Song EY and Koh SC. (2016). Photosynthetic and growth responses of Chinese cabbage to rising atmospheric CO2. Korean Journal of Agricultural and Forest Meteorology. 18:357-365.
[https://doi.org/10.5532/KJAFM.2016.18.4.357]

- Seo YJ, Nam HH, Jang WC, Kim JS and Lee BY. (2018). Effect of meteorological factors on evapotranspiration change of Cnidium officinale Makino. Korean Journal of Agricultural and Forest Meteorology. 20:366-375.
-
Sharkey TD, Bemacchi CJ, Farquhar GD and Singsaas EL. (2007). Fitting photosynthetic carbon dioxide response curves for C3 leaves. Plant, Cell and Environment. 30:1035-1040
[https://doi.org/10.1111/j.1365-3040.2007.01710.x]

- Sharma M, Thakur R, Sharma M, Sharma AK and Sharma AK. (2020). Changing scenario of medicinal plants diversity in relation to climate changes: A review. Plant Archives. 20:4389-4400.
-
Solomon S, Plattner GK, Knutti R and Frielingstein P. (2009). Irreversible climate change due to carbon dioxide emissions. Proceedings of the National Academy of Sciences of the United States of America. 106:1704-1709.
[https://doi.org/10.1073/pnas.0812721106]

-
Son IC, Han JH, Cho JG, Kim SH, Chang EH, Oh SI, Moon KH and Choi IM. (2014). Effects of the elevated temperature and carbon dioxide on vine growth and fruit quality of 'Campbell Early' grapevines(Vitis labruscana). Horticultural Science and Technology. 32:781-787.
[https://doi.org/10.7235/hort.2014.13059]

- Strasser RJ, Srivastava A and Tsimilli-Michael M. (2000). The fluorescence transient as a tool to characterize and screen photosynthetic samples. In Yunus M, Pathre U, and Mohanty P. (ed.). Probing Photosynthesis: Mechanism, regulation and adaptation. CRC Press. Boca Raton. FL, USA. p.445-483.
-
Stuflfauth T, Klug K and Fock HP. (1987). The production of secondary metabolites by Digitalis lanata during CO2 enrichment and water stress. Phytochemistry. 26:2735-2739.
[https://doi.org/10.1016/S0031-9422(00)83581-5]

-
Stuhlfauth T and Fock HP. (1990). Effect of whole season CO2 enrichment on the cultivation of a medicinal plant, Digitalis lanata. Journal of Agronomy and Crop Science. 164:168-173.
[https://doi.org/10.1111/j.1439-037X.1990.tb00803.x]

-
Taylor KE, Stouffer R and Meehl GA. (2012). An overview of CMIP5 and the experiment design. Bulletins of. American Meteorological Society. 93:485-498.
[https://doi.org/10.1175/BAMS-D-11-00094.1]

- Terashima I and Evans JR. (1988). Effects of light and nitrogen nutrition on the organization of the photosynthetic apparatus in spinach. Plant and Cell Physiology. 29:143-155.
-
Wang ZX, Chen L, Ai J, Qin HY, Liu YX, Xu PL, Jiao ZQ, Zhao Y and Zhang QT. (2012). Photosynthesis and activity of photosystem II in response to drought stress in amur grape(Vitis amurensis Rupr.). Photosynthetica. 50:189-196.
[https://doi.org/10.1007/s11099-012-0023-9]

-
Xia JB, Zhang GC, Wang RR and Zhang SY. (2014). Effect of soil water availability on photosynthesis in Ziziphus jujuba var. spinosus in a sand habitat formed from seashells: Comparison of four models. Photosynthetica. 52:253-261.
[https://doi.org/10.1007/s11099-014-0030-0]

-
Xu Z, Jiang Y, Jia B and Zhou G. (2016). Elevated-CO2 response of stomata and its dependence on environmental factors. Frontiers in Plant Science. 7:657. https://www.frontiers.org/articles/10.3389/fpls.2016.00657/full (cited by 2022 Aug 26).
[https://doi.org/10.3389/fpls.2016.00657]

-
Xu Z, Shimizu H, Yagasaki Y, Ito S, Zheng Y and Zhou G. (2013). Interactive effects of elevated CO2, drought, and warming on plants. Journal of Plant Growth Regulation. 32:692-707.
[https://doi.org/10.1007/s00344-013-9337-5]

-
Zhang Y, You Q, Chen C and Ge J. (2016). Impacts of climate change on streamflows under RCP scenarios: A case study in Xin River Basin, China. Atmospheric Research. 178-179:521-534.
[https://doi.org/10.1016/j.atmosres.2016.04.018]

- Zheng WP, Wang P, Zhang HX and Zhou D. (2011). Photosynthetic characteristics of the cotyledon and first true leaf of castor (‘Ricinus communis’ L.). Australian Journal of Crop Science. 5:702-708.
-
Zhou R and Quebedeaux B. (2003). Changes in photosynthesis and carbohydrate metabolism in mature apple leaves in response to whole plant source-sink manipulation. Journal of the American Society for Horticultural Science. 128:113-119.
[https://doi.org/10.21273/JASHS.128.1.0113]

