찔레꽃 에탄올추출물의 생리활성과 화장품 방부효과
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The Rosa multiflora, a well-known plant belonging to Rosacea, is widely used in orthodox medicine in worldwide. However, its biological activity and cosmetic preservative efficacy have not yet been studied. Thus, this species is yet to be defined as a functional cosmetic material. Accordingly, an investigation of the above mentioned atrributes was performed on a 50% ethanol extract of Rosa multiflora.
The antioxidant activity was assessed through free radical scavenging assays with 2,2-diphenyl-1-picrylhydrazyl (DPPH). Additionally, the contents of total phenols and flavonoids were analyzed. The phenolic compounds were detected using HPLC. The antimicrobial activity against Staphylococcus aureus, Escherichia coli, and Candida albicans was assessed using the disc diffusion assay. The preservative effect (challenge test) on a formulation of soothing gel was performed for 28days. The DPPH radical scavenging ability, denoted by the SC50 (half maximal inhibitory concentration for DPPH radical scavenging) value was found to be 131.63 μg/ml. The content of total polyphenol and flavonoid content were 202 ㎎/g and 86.77 ㎎/g, respectively. In additon, astragalin and gallic acid were identified in the extract. The antimicrobial activity of the extract against S. aureus and E. coli was observed to be 5 - 0.5%, and no significant activity was noted against C. albicans. The ethanol extracts (5% and 10%) met the preservation standards of the Cosmetics, Toiletry, and Fragrance Association (CTFA).
Thus the ethanol extract of R. multiflora can be used in cosmetics as a natural preservative and antioxidant.
Keywords:
Rosa multiflora, Antimicrobial Activity, Antioxidative Activity, Cosmetic Preservative Effect서 언
미생물의 생장은 적절한 온도, 수분, pH 등의 조건에 영향 을 받으며, 살아있거나 죽어있는 유기체내에서 번식하므로 대 부분의 화장품은 미생물오염의 우려가 많다 (Zhoh et al., 2002).
화장품의 방부제는 미생물의 생육을 저해하여 제품을 오랫 동안 유지시키는 역할을 하며 화장품에 사용하는 방부제는 화 학합성방부제와 천연방부제로 나뉜다. 화장품 생산량 증가에 따라 방부제의 사용량 또한 증가하고 있으며 종류도 더욱 다 양해지고 있으나 대부분 화학합성방부제를 개발하고 있다. 화학합성방부제는 피부자극을 유발하는 원인이 되고 있으며, 대표적인 예로 파라벤류의 방부제를 들 수 있다 (Esposito et al., 2003). 파라벤류는 세균류에 대해 매우 넓은 항균 스펙트 럼을 갖고 있으며, 진균류에도 방부효과가 뛰어나고 비교적 독 성이 낮다는 장점으로 전 세계적으로 사용량 및 사용빈도가 가장 높은 방부제이다 (Steinberg et al., 1999).
하지만, 대부분의 화학합성방부제는 알레르기성 접촉 피부 염 (allergic contact dermatitis)을 유발하는 경향을 가지고 있 는 것으로 보고되고 있다 (Bonnevie, 1940; Sarkany, 1960; Fisher, 1973; Cooper and Shaw, 1998; Vilaplana and Romaquera, 2000). 또한, 내성균 유발 및 환경호르몬 가능성 등의 문제점을 가지고 있으며, 지속적인 체내 축적으로 인한 급성, 만성 독성과 돌연변이 유발 등의 새로운 문제 가능성이 대두되고 있다 (Shin, 1990; Routledge et al., 1998). 또한, 파라벤은 중추신경계와 자율신경계에 영향을 미치며, 에스트 로겐 수용체와 결합하여 에스트로겐 호르몬에 의해 조절되는 유전자 발현에 영향을 주어 내분비계의 변화를 일으킬 수 있 으며, 유방암 발생에 영향을 미치고 (Ahn et al., 2009), 임산 부가 사용하였을 경우 태아에게까지 영향을 미칠 수 있다 (Fredereriksen et al., 2008). 이러한 화학합성방부제의 단점으 로 화장품업계에서는 방부제를 사용하지 않은 preservative-free 제품, 자체 방부기능을 가능하게 할 수 있는 원료를 사용하는 self-preserving 제품 등에 관심이 늘어나고 있다 (Abe et al., 2003).
최근에는 자체 항균작용이 있는 1,2-hexanediol 등을 사용하 여 화장품에서 방부효과를 나타낼 수 있는 방법이 지속적으로 검토되고 있다 (Choi, 2015). 1,2-hexanediol은 상용성이 우수하 고 화장품의 제형에도 큰 영향을 주지 않으며, 보습기능을 가 지고 있다. 하지만, 화장품에는 2% 이하로 사용하여야 하며, 그 이상 사용할 경우 피부 트러블이나 가려움증 등 부작용을 일 으킬 수 있고 가격이 고가이기 때문에 화장품업계에서도 사용 하기가 부담스러운 측면이 있다.
화학합성방부제를 대체하기 위해 천연항균물질을 방부제로 사용하기 위한 많은 연구가 현재 진행되고 있다. 지금까지 실 용화된 천연항균물질인 피톤치드는 항균, 방충, 소취 등 다양 한 기능을 가지고 있으나 항균제로 사용하기에는 비교적 살균 력이 낮고 가격이 고가라는 문제가 있다 (Kim et al., 2007).
자몽종자추출물은 세포벽 및 세포막의 기능을 약화시키고 효소활성을 저해하며 DNA, RNA에서 비롯되는 세포증식기작 을 억제하여 미생물에 대한 살균효과가 크다 (Chin et al., 2005). 또한 Pseudomonas aeruginosa에 대해 가장 큰 항균활 성을 나타낸 황금은 CTFA 기준을 만족하는 방부력이 보고되 고 있다 (Hwang, 2009). 감초는 메틸파라벤과 프로필파라벤보 다 감초성분 중의 하나인 isoloquiritigenin이 최소저해농도에서 뛰어난 항균활성을 나타냈다 (Kim et al., 2014).
찔레꽃 (Rosa multiflora Thunb.)은 장미과 (Rosaceae)에 속하는 식물로서 산이나 들의 기슭, 계곡 등에서 쉽게 볼 수 있고 약성이 좋아 어느 하나도 버릴 것이 없을 정도로 오랫동 안 한방에서 사용되었다. 찔레꽃의 꽃, 열매, 뿌리, 씨앗 등 부 위별로 항산화, 항염증, 항균, 발모 등의 효능이 우수한 소재 로 알려져 있다 (Kim et al., 2012b; Cho, 2013; Yeo et al., 2014).
찔레꽃의 알려진 성분으로는 flavonoid의 계열인 quercetin 배당체 (multinoside A, multinoside B, quercitrin 등), kaempferol 배당체 (multiflorin A, multiflorin B, afzelin, astragalin 등), 탄닌 계열의 methyl gallate 및 과실의 홍색색소 인 lycopene 등이 보고되었다 (Aritomi, 1962; Hübner et al., 1999). 한편 찔레꽃은 P. aeruginosa, Staphylococcus epidermidis, Staphylococcus aureus, Malassezia furfur 균에 서 항균활성을 나타내는 것으로 보고되고 있으나 화장품 방부 제로서의 연구는 없는 상황이다.
본 연구에서는 찔레꽃 에탄올 추출물의 항산화 활성, 항균 활성 및 방부효과를 측정하여 기능성 화장품소재 및 천연방부 제로서의 이용가능성을 조사하였다.
재료 및 방법
1. 재료
본 시험에서 사용한 찔레꽃 (Rosa multiflora Thunb.)은 2017년 5월 전라북도 남원시 송동면 일대에서 직접 채취하여 사용하였으며, 꽃을 포함한 지상부를 사용하였다. 채취한 찔레 꽃은 40℃에서 72 시간 건조 (LD9013, L’EQUIP Co., Seoul, Korea)한 후 4℃에서 보관하면서 실험에 사용하였다.
2. 찔레꽃 에탄올 추출물 제조
건조된 찔레꽃을 분쇄기 (HMF-3600TG, Hanil Electric, Wonju, Korea)를 이용하여 분쇄한 후 100 g에 50% 에탄올 2ℓ를 혼합하고 80℃에서 4 시간동안 추출하였다. 추출물은 부직포와 종이여과지를 이용하여 2 회 여과하였으며, 여과된 추출물은 감압농축기 (R-100, BUCHI, Flawil, Switzerland)를 이용하여 50℃에서 농축하고, 동결건조기 (MCFD8508, IlshinBiobase Co., Dongducheon, Korea)를 이용하여 동결 건 조하여 분석용 시료로 사용하였다.
3. DPPH 라디칼 소거 활성 측정
2,2-diphenyl-1-picrylhydrazyl (DPPH) 라디칼 소거 활성은 Blois법 (Blois, 1958)을 변형하여 측정하였다. 일정 농도로 희 석한 시료 100㎕에 0.2 mM DPPH (Sigma-Aldrich Co., St. Louis, MO, USA) 용액 400㎕와 에탄올 100㎕를 혼합하여 실온에서 30 분간 반응시킨 후 ELISA reader (Spark 10M, Tecan, Mannedorf, Switzerland)를 사용하여 517㎚에서 측정 하였다.
DPPH의 흡광도가 50% 감소할 때 나타나는 시료의 농도 (SC50)를 구하였으며, 각 시료는 3 회 반복실험을 실시하였다. 이때 L-ascorbic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 양성대조구로 사용하였다.
DPPH라디칼 소거활성 (%) = [(1 - (시료첨가군의흡광도/무첨가군의 흡광도)] × 100
4. 총 polyphenol 함량 측정
찔레꽃 에탄올 추출물의 polyphenol 함량은 Folin-Denis의 방법 (Folin and Dennis, 1912)을 변형하여 측정하였다. 일정 농도로 희석한 시료 80㎕에 1N Folin-Ciocalteu’s phenol reagent (Sigma-Aldrich Co., St. Louis, MO, USA) 20㎕를 혼합하고 실온에서 5 분간 반응시켰다. 반응용액에 2% Na2CO3 (Daejung Chemicals and Metals Co., Ltd., Siheung, Korea) 100㎕를 혼합하여 실온에서 30 분간 반응시 킨 후 750㎚에서 측정하였다.
표준물질로 tannic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였으며 시료와 동일한 방법으로 측정하여 얻은 검량선으로부터 총 polyphenol 함량을 산출하였다.
5. 총 flavonoid 함량 측정
찔레꽃 에탄올 추출물의 총 flavonoid 함량은 Kang 등 (1996)의 방법을 변형하여 측정하였다. 일정 농도로 희석한 시 료 10㎕에 diethylene glycol (Daejung Chemicals and Metals Co., Ltd., Siheung, Korea) 100㎕와 1N NaOH 10㎕를 혼합하여 37℃에서 1 시간 동안 반응시킨 후 ELISA reader를 사용하여 420㎚에서 측정하였다. 표준물질로 kaempferol (Sigma-Aldrich Co., St. Louis, MO, USA)를 사 용하였으며 시료와 동일한 방법으로 측정하여 얻은 검량선으 로부터 총 flavonoid 함량을 산출하였다.
6. Phenolic compounds에 대한 high performance liquid chromatography (HPLC) 분석
찔레꽃 에탄올 추출물의 phenolic compounds 함량 분석은 High performance liquid chromatography (e2695 system, Waters, Milford, MA, USA)를 이용하여 함량을 분석하였다.
시료 10㎎ 또는 표준품 1㎎을 취하여 50% 에탄올 1㎖ 에 용해하였고, 시료 10㎕를 HPLC에 주입하고 0.8㎖/min 속도로 분석하였다. 이동상으로는 water (0.1% formic acid)와 acetonitrile (0.1% formic acid)를 사용하였고, column은 Shim-pack VP-ODS (4.6㎜ × 250㎜, 5㎛) (Shimadzu, Kyoto, Japan)를 이용하여 흡광도 280㎚에서 분석하였다.
표준품은 gallic acid, protocatechuic acid, chlorogenic acid, methyl gallate, caffeic acid, syringic acid, coumaric acid, ferulic acid, astragalin, quercitrin, rosmarinic acid, myricetin, luteolin, quercetin, apigenin, kaempferol, hesperetin (Sigma- Aldrich Co., St. Louis, MO, USA)을 이용하였다.
7. Paper disk를 이용한 항균활성 측정
찔레꽃 에탄올 추출물의 항균활성은 Davision 과 Parish, (1989)에 따라 실험하였으며, 공시 균주는 S. aureus KCTC 1916, E. coli KCTC 2571과 C. albicans KCTC 7965를 한 국생명공학연구원 생물자원센터로부터 제공받아 사용하였다.
균주 배양을 위한 배지로는 tryptic soy agar와 yeast mold agar를 Difco Laboratories (Detroit, MI, USA)에서 구입하여 사용하였다.
찔레꽃 에탄올 추출물의 항균활성을 확인하기 위하여 disc diffusion assay를 수행하였다. 각각의 균주를 고체배지에 도말 하고, 멸균된 8㎜ paper disc에 농도별로 희석된 찔레꽃 에탄 올 추출물을 20㎕ 점적하여 건조하고 S. aureus와 E. coli는 37℃에서 C. albicans는 25℃에서 배양하면서 paper disk 주 위에 생성된 저해환의 유무로 항균활성을 확인하였다. 양성대 조군으로 S. aureus와 E. coli는 0.01% tetracycline (Sigma- Aldrich Co., St. Louis, MO, USA)을 C. albicans는 0.25% ketoconazole (Sigma-Aldrich Co., St. Louis, MO, USA)을 사용하였다.
8. 찔레꽃 에탄올 추출물 첨가에 따른 방부효과 (challenge test)
Challenge test는 미국화장품협회 (Cosmetics, Toilety, and Fragrance Association, CTFA)의 방법을 변형하여 수행하였다 (Farrinton et al., 1994).
방부효과 측정은 방부제를 첨가하지 않은 수딩젤을 제조하 여 실험에 사용하였으며 방부제 무첨가군, 5% 찔레 추출물 첨 가군, 10% 찔레 추출물 첨가군, 2% 1,2-hexanediol 첨가군 (positive control)으로 나누어 실험하였다.
100 g의 멸균된 유리용기에 제조한 화장품 50 g를 넣고 세 균 S. aureus 1.0 × 106 CFU/㎖를 E. coli는 2.8 × 107 CFU/㎖ 를 접종하고, 진균 C. albicans 2.5 × 105 CFU/㎖를 접종하여 7 일 이내에 처음 접종 균수의 99.9%가 사멸하고 그 후 28 일째까지 증식하지 않으면 방부제로서의 유효성을 인정하 였다. 균수 측정은 건조배지필름 (3M, St. Paul, MN, USA) 을 이용하였다. 세균과 진균을 접종한 화장품에서 1㎖를 취 하여 9㎖의 멸균 희석수에 용해한 뒤 S. aureus와 E. coli는 세균용 petri film에, C. albicans는 효모 및 곰팡이류 petri film에 각각 점적하고 고정시킨 후 세균은 37℃에서 배양하고 진균은 25℃에서 배양한 후 균의 발현 유무와 균수를 측정하 였다.
9. 통계학적 분석
모든 분석 자료는 평균 ±표준오차 (Mean ± SD)로 나타내었 으며 실험결과는 GraphPad InStat software (San Diego, CA, USA)를 이용하였다. 각 군 간의 측정치 비교는 Oneway analysis of variance (ANOVA)를 시행한 후 Tukeykramer multiple comparisons test 방법을 이용하여 유의성을 5% 수준에서 검정하였다 (p < 0.05).
결과 및 고찰
1. DPPH 라디칼 소거활성
DPPH는 라디칼 상태에서 phenolic compound와 같이 수소 나 전자를 제공해주는 전자공여체와 반응하면 전자나 hydrogen radical을 받아 phenoxy radical을 생성하게 되어 안 정한 분자로 전환되며 환원될 때 탈색이 되는 특성을 가지고 있다 (Jung et al., 2008). 자색의 DPPH의 색이 탈색되는 정 도에 따라 물질의 항산화활성을 나타내는 방법으로 비교적 간 단하여 여러 시료로부터 항산화 활성을 탐색할 때 유용하다.
본 연구에서 찔레꽃 (Rosa multiflora Thunb.) 에탄올 추출 물의 DPPH 라디칼 소거활성을 Fig. 1에 나타내었다. 찔레꽃 에탄올 추출물을 31.25㎍/㎖부터 500㎍/㎖까지 측정한 결과 13.3 - 84.09%의 라디칼 소거활성을 보였으며, 250㎍/㎖이상 농도에서 80% 이상의 우수한 라디칼 소거활성을 나타냈다. 또 한, 찔레꽃 에탄올 추출물의 DPPH 라디칼을 50% 소거하는데 필요한 시료의 농도 (SC50)로 나타낸 결과 123.1㎍/㎖로 나 타났으며, 양성대조군인 L-ascorbic acid의 SC50은 27.5㎍/㎖ 로 나타났다 (Fig. 1).
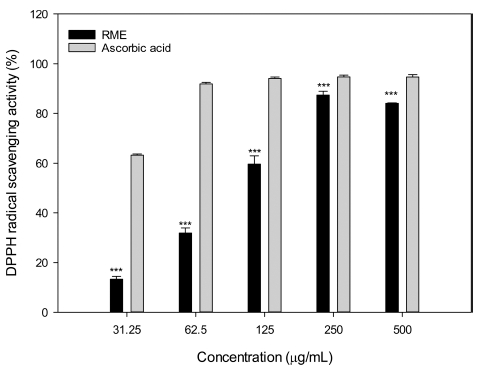
DPPH radical scavenging activity of ethanol extract of Rosa multiflora.Mean values ± SD from triplicate separated experiments are shown. *Means within a column followed by the same letter are not significant based on the Tukey-kramer multiple comparisons test (***p < 0.001). RME; ethanol extract of Rosa multiflora. Ascorbic acid was used as a positive control.
찔레꽃과 진달래꽃 추출물에서 caffeic acid, chlorogenic acid, coumaric acid, quercetin 등의 페놀 화합물들이 보고되 었으며, 이러한 페놀 화합물들은 라디칼 소거활성이 높은 것 으로 알려져 있다. (Chung et al., 1996; Kadoma and Fujisawa, 2008; Cho, 2013).
한편, 찔레꽃 용매별 항산화 활성을 연구한 결과와 비교해 보면 에탄올 추출물의 SC50값은 145.85㎍/㎖으로 본 연구결 과와 유사한 수치를 보였다 (Yeo et al., 2014). 진달래꽃의 DPPH 저해 활성을 연구한 결과와 비교해보면 진달래꽃 에탄 올 추출물의 SC50값이 257㎍/㎖으로 본 연구결과 보다 낮은 활성을 보였다 (Lee et al., 2005).
2. 총 polyphenol 및 flavonoid 함량
Polyphenol은 식물계에 널리 분포되어 있는 2차 대사산물로 다수의 hydroxyl기가 존재하여 여러 화합물들과 쉽게 결합하 는 특성을 가지고 있어 항산화 활성 및 다양한 생리활성에 관 여하는 것으로 알려져 있다 (Lu and Foo, 2000; Ferreres et al., 2009).
Polyphenol류의 한 종류인 flavonoid는 자연계에 널리 분포 하고 있으며 polyphenol과 같이 식물의 잎, 꽃, 과실, 줄기 및 뿌리 등 거의 모든 부위에 함유되어 있다 (Hetog et al., 1993). flavonoid는 세포손상을 초래하는 free radical을 효과적 으로 제거하여 항산화 활성이 높다고 알려져 있으며 (Heim et al., 2002), 항암 및 항균활성 등 다양한 생리활성을 가지는 것 으로 알려져 있다 (Manach et al., 2005; Ryu et al., 2010).
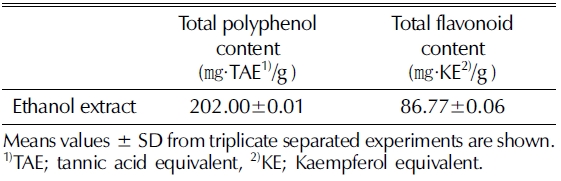
찔레꽃 에탄올 추출물의 총 polyphenol과 flavonoid 함량 측정결과를 Table 1에 나타내었다. 찔레꽃 에탄올 추출물의 총 polyphenol과 flavonoid 함량이 각각 202 ± 0.01㎎/g, 86.77 ± 0.06㎎/g으로 나타났다 (Table 1). 이는 Yeo 등 (2014)이 연구한 찔레꽃의 꽃잎 에탄올 추출물의 polyphenol과 flavonoid 함량은 37.834㎎/g, 42.68㎎/g으로 본 연구결과와 는 상이한 결과를 보였다. 이러한 차이는 찔레꽃의 추출부위 차이에 의한 것으로 추측된다. 또한 Im 과 Lee (2011)의 흰 민들레 에탄올 추출물의 polyphenol 함량 238.59㎎/g과 유사 할 정도의 높은 수준을 보였다. Kim 등 (2012a)의 연구결과 와 비교하면 polyphenol과 flavonoid 함량이 가장 높은 비수 리 추출물은 각각 228.9㎎/g, 90.15㎎/g으로 본 연구결과와 유사한 수치를 보였다.
한편, 찔레꽃 에탄올추출물에 대한 페놀 화합물을 분석한 결 과는 Fig. 2에 나타내었다. 주요 페놀 화합물 중 astragalin 33.6 ± 0.07㎎/g으로 가장 높았으며, gallic acid 3.5 ± 0.02㎎/ g으로 분석되었다 (Fig. 2). 이는 찔레꽃의 꽃잎에서 astragalin 을 분리 규명한 연구보고서와 일치하는 결과이다 (Aritomi, 1962).
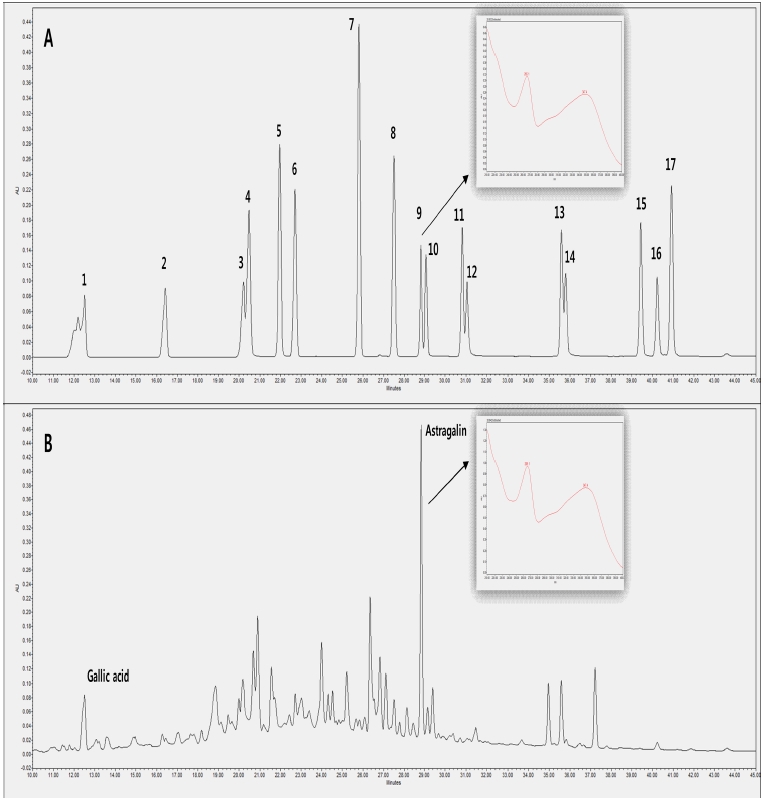
Phenolic compound of HPLC chromatogram of standards (A) and ethanol ectract of Rosa multiflora (B).Peak 1; gallic acid, peak 2; protocatechuic acid, peak 3; chlorogenic acid, peak 4; methyl gallate, peak 5; caffeic acid, peak 6; syringic acid, peak 7; coumaric acid, peak 8; ferulic acid, peak 9; astragalin, peak 10; quercitrin, peak 11; rosmarinic acid, peak 12; myricetin, peak 13; luteolin, peak 14; quercetin, peak 15; apigenin, peak 16; kaempferol and peak 17; hesperetin. Pannel indicated by arrow line is UV spectrum of astragalin.
3. 항균활성
피부에 존재하면서 피부병을 유발하는 S. aureus, E. coli, C. albicans에 대한 찔레꽃 에탄올 추출물의 항균활성을 측정 한 결과 Fig. 3에 나타내었다.
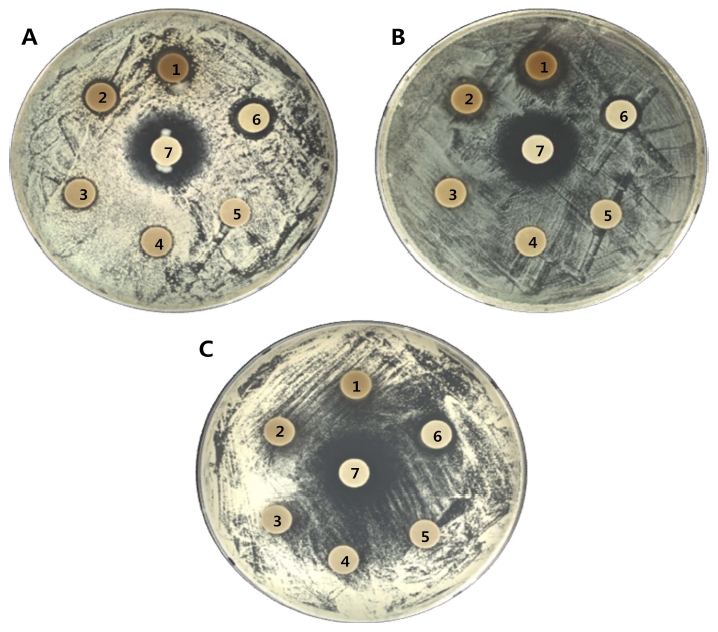
Antimicrobial activity of various concentration ethanol extract from Rosa multiflora by disc diffusion assay.A; S. aureus, B; E. coli, C; C. albicans, 1; 5%, 2; 2.5%, 3; 1.0%, 4; 0.5%, 5; 0.25%, 6; astragalin (0.1%) and 7; tetracycline/ ketoconazole (positive control).
S. aureus과 E. coli에서는 높은 항균효과를 보였지만 C. albicans에서는 항균활성을 보이지 않았다. 또한, 페놀 화합물 분석결과 주성분이었던 astragalin을 0.1% 처리한 결과 S. aureus, E. coli, C. albicans 모두에서 항균활성을 보였다. 이 는 astragalin을 다량 함유한 나도산마늘 (Allium ursinum), 털 마삭줄 (Trachelospermum jasminoides), 잣나무 (Pinus koraiensis) 잎 등의 추출물에서 높은 항균활성을 보고한바 있 다 (Hosoi et al., 2006; Ivanova et al., 2009; Kim et al., 2010). 또한 gallic acid의 P. aeruginosa, E. coli, S. aureus, Listeria monocytogenes에 대한 항균활성이 보고된바 있다 (Borges et al., 2013).
이상의 연구결과로부터 찔레꽃 에탄올 추출물에 다량 함유 된 astragalin과 gallic acid에 의해 높은 항균활성이 나타났을 것으로 생각된다. 찔레꽃 에탄올 추출물은 S. aureus와 E. coli에 대하여 추출물 농도는 각각 5 - 0.5%, 5 - 1.0%에서 항 균활성을 보였고, S. aureus에서 더 높은 항균활성을 보였다.
찔레꽃 에탄올추출물의 S. aureus, M. furfur, C. albicans, P. aeruginosa, P. acnes에 대한 항균활성을 연구한 보고와 비 교해볼 때 S. aureus에서는 항균활성을 보인 반면 C. albicans에서는 항균활성을 보이지 않은 연구결과와 일치하였 다 (Cha et al., 2008). 하지만, 찔레꽃의 꽃잎 에탄올추출물과 메탄올추출물의 E. coli에 대한 항균활성이 미비하다는 연구결 과와는 상이한 결과를 보였다 (Kim, 2015).
4. 화장품 방부효과
CTFA 기준에 따라 찔레꽃 에탄올추출물의 방부효과를 측정 한 결과 Fig. 4에 나타내었다. 방부제를 첨가하지 않는 대조군 (control), 2% 1,2-hexanediol 첨가한 군 (positive control), 5% 찔레 에탄올추출물 첨가군, 10% 찔레 에탄올추출물 첨가 군으로 나누어 실험을 진행하였으며 CTFA 기준에 따라 7 일 이내에 처음 접종 균수의 99.9%가 사멸하고 그 후 28 일째 까지 증식하지 않으면 방부제로서의 유효성을 인정하였다 (Fig. 4).
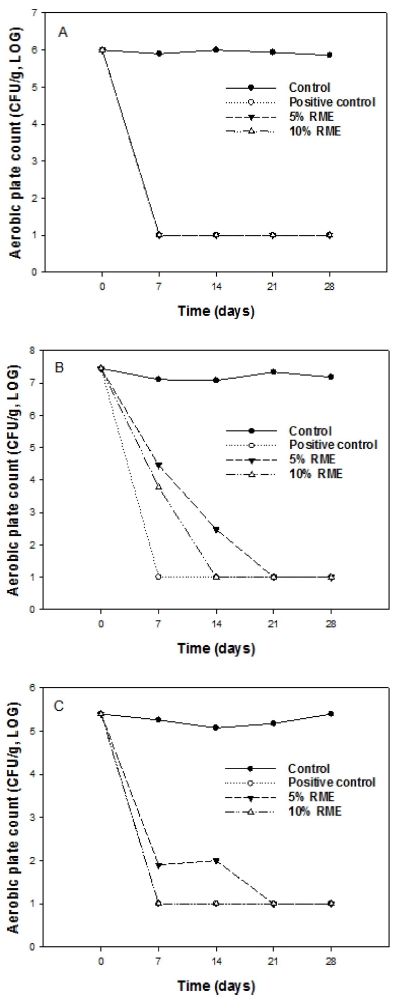
Preservative effect of extracts of Rosa multiflora against bacteria and fungi.A; S. aureus, B; E. coli, C; C. albicans, control; unpreserved, positive control; 2% 1,2- hexanediol, 5% RME; 5% ethanol extract of Rosa multiflora, 10% RME; 10% ethanol extract of Rosa multiflora.
S. aureus는 초기 접종량 1.0 × 106CFU/㎖이었으며 control 군에서는 28 일까지 균이 계속 증식하고 있었으나 2% 1,2- hexanediol 첨가군, 5% 찔레꽃 에탄올추출물 첨가군 및 10% 찔레꽃 에탄올추출물 첨가군에서는 7 일 후 100% 사멸율을 보였으며 28 일까지 유지되어 CTFA 기준을 만족하였다. E. coli는 초기 접종량 2.8 × 107 CFU/㎖ 이었으며 control군에서 는 28 일까지 균이 계속 증식하고 생존하고 있음을 확인할 수 있었다 (Fig. 4).
5% 와 10% 찔레꽃 에탄올추출물에서는 7 일 후 99.9% 사멸율을 보였으며 14 일 후 100% 사멸율을 보였고 28 일까 지 유지하여 CTFA 기준을 만족하였다. C. albicans는 초기 접종량 2.5 × 105 CFU/㎖이었으며 control군에서는 28 일까지 균이 계속 증식하고 생존하고 있음을 확인할 수 있었으며 5% 찔레꽃 에탄올추출물 첨가군은 7 일 후 99.9% 사멸율을 보였으며 21 일 후 100% 사멸율을 보였고 28 일까지 유지 되었다. 2% 1,2-hexanediol 첨가군과 10% 찔레꽃 에탄올추출 물 첨가군에서는 7 일 후 100% 사멸율을 보였으며 28 일까 지 유지되어 CTFA 기준을 만족하는 결과를 보였다.
찔레꽃 에탄올 추출물은 5 - 10% 농도에서 S. aureus, E. coli, C. albicans에 대한 방부효과가 있음을 확인할 수 있었으 며 positive control인 1,2-hexanediol과도 유사한 방부효과를 나타내어 천연방부제로서의 개발가능성을 확인하였다.
이상의 결과에서 찔레꽃 에탄올추출물은 높은 polyphenol 함량을 바탕으로 높은 DPPH 라디칼 소거활성을 보이는 것으 로 확인되었으며, HPLC를 통해 페놀 화합물을 분석한 결과 astragalin과 gallic acid가 분석되었다. 피부 상재균인 S. aureus, E. coli, C. albicans에 대한 항균활성과 방부효과를 측정한 결과 S. aureus와 E. coli에서 높은 항균활성을 보였으 며, 5%와 10% 찔레 에탄올추출물을 첨가한 화장품 제형에서 7 일 후 99.9%의 사멸율을 보였고 28 일까지 유지되어 CTFA 기준을 만족하는 결과를 보였다.
본 연구결과를 통해 찔레꽃을 활용한 기능성 화장품 소재 및 천연방부제로서의 개발가능성이 있을 것으로 기대된다.
감사의 글
본 연구는 농림축산식품부의 재원으로 농림수산식품기술기 획평가원의 농생명산업기술개발사업(과제번호: 317024-5)의 지 원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Abe, S, Sato, Y, Inoue, S, Ishibashi, H, Maruyama, N, Takizawa, T, Oshima, H, Yamaguchi, H, (2003), Anti-Candida albicans activity of essential oils including Lemongrass(Cymbopogon citratus) oil and its component, citral, JapaneseJournal of Medical Mycology, 44, p285-291, 14615795.
[https://doi.org/10.3314/jjmm.44.285]

- Ahn, HS, Nah, WH, Lee, JE, Oh, YS, Gye, MC, (2009), Toxicity and endocrine disrupting effect of parabens, Korean Journal of Environmental Biology, 27, p323-333.
-
Aritomi, M., (1962), On the components of the flower petals of Rosa multiflora Thunb. and Rubus hirsutus Thunb, Journal of the Pharmaceutical Society of Japan, 82, p771-773, 13862288.
[https://doi.org/10.1248/yakushi1947.82.5_771]

-
Blois, MS, (1958), Antioxidant determinations by the use of a stable free radical, Nature, 181, p1199-1200.
[https://doi.org/10.1038/1811199a0]

- Bonnevie, P., (1940), Overfolsomhed for aetylparaoxybenzoat (Mycoten), Nordisk Medicine, 6, p684-685.
-
Borges, A, Ferreira, C, Saavedra, MJ, Simões, M, (2013), Antibacterial activity and mode of action of ferulic and gallic acids against pathogenic bacteria, Microbial Drug Resistance, 19, p256-265, 23480526.
[https://doi.org/10.1089/mdr.2012.0244]

-
Cha, JY, Ha, SE, Sim, SM, Park, JK, Chung, YO, Kim, HJ, Park, NB, (2008), Antimicrobial effects of ethanol extracts of Korea endemic herb plants, Journal of Life Science, 18, p228-233.
[https://doi.org/10.5352/JLS.2008.18.2.228]

- Chin, KB, Kim, WY, Kim, KH, (2005), Physicochemical and textural properties, and antimicrobial effects of low-fat comminuted sausages manufactured with grapefruit seedextract, Korean Journal for Food Science of Animal Resources, 25, p141-148.
- Cho, YJ, (2013), Antioxidant and antimicrobial activity of Rosamultiflora thunberg fruits extracts., Current Research onAgriculture and Life Sciences, 31, p170-176.
- Choi, EY, (2015), Effect of phenoxyethanol and alkane diolmixture on the antimicrobial activity and antiseptic ability in cosmetics, Korean Journal of Aesthetic and Cosmetology, 13, p213-220.
- Chung, TY, Kim, MA, Jones, AD, (1996), Antioxidative activity of phenolic acids isolated from Jindalrae flower (Rhododendron mucronulatum Turzaninow), Agricultural Chemistry and Biotechnology, 39, p506-511.
-
Cooper, SM, Shaw, S, (1998), Allergic contact dermatitis from parabens in a tar shampoo, Contact Dermatitis, 39, p140, 9771996.
[https://doi.org/10.1111/j.1600-0536.1998.tb05871.x]

- Davidson, PM, Parish, ME, (1989), Methods for testing the efficacy of food antimicrobials, Food technology, 43, p148-155.
- Esposito, E, Bortolotti, F, Nastruzzi, C, Menegatti, E, Cortesi, R, (2003), Diffusion of preservatives from topical dosage forms: A comparative study, Journal of Cosmetic Science, 54, p239-250, 12858223.
- Farrinton, JK, Martz, EL, Wells, SJ, Ennis, CC, Holder, J, Levchuk, JW, Avis, KE, Hoffman, PS, Hitchins, AD, Madden, JM, (1994), Ability of laboratory methods to predict in-use efficacy of antimicrobial preservatives in an experimental cosmetic, Applied and Environmental Microbiology, 60, p4553-4558, 7811091.
-
Ferreres, F, Gomes, D, Valentão, P, Gonçalves, R, Pio, R, Chagas, EA, Seabra, RM, Andrade, PB, (2009), Improved loquat (Eriobotrya japonica Lindl.) cultivars: Variation of phenolics and antioxidative potential, Food Chemistry, 114, p1019-1027.
[https://doi.org/10.1016/j.foodchem.2008.10.065]

- Fisher, AA, (1973), The paraben paradox, Cutis, 12, p830-832.
- Folin, O, Denis, W, (1912), On phosphotungstic-phosphomolybdic compounds as color reagent, Journal of Biological Chemistry, 12, p239-243.
-
Frederiksen, H, Taxvig, C, Hass, U, Vinggaard, AM, Nellemann, C, (2008), Higher levels of ethyl paraben and butyl paraben in rat amniotic fluid than in maternal plasma after subcutaneous administration, Toxicological Sciences, 106, p376-383, 18713765.
[https://doi.org/10.1093/toxsci/kfn171]

-
Heim, KE, Tagliaferro, AR, Bobilya, DJ, (2002), Flavonoid antioxidants: Chemistry, metabolism, and structure-activity relationships, Journal of Nutritional Biochemistry, 13, p572-584, 12550068.
[https://doi.org/10.1016/S0955-2863(02)00208-5]

-
Hetog, MGL, Hollman, PCH, Van de Putte, B, (1993), Content of potentially anticarcinogenic flavonoids of teainfusions, wines, and fruit juices, Journal of Agricultural andFood Chemistry, 41, p1242-1246.
[https://doi.org/10.1021/jf00032a015]

-
Hosoi, S, Shimizu, E, Ohno, K, Yokosawa, R, Kuninaga, S, Coskun, M, Sakushima, A, (2006), Structural studies ofzoospore attractants from Trachelospermum jasminoides var.pubescens: Taxifolin 3-O-glycosides, Phytochemical Analysis, 17, p20-24, 16454472.
[https://doi.org/10.1002/pca.876]

-
Hübner, G, Wray, V, Nahrstedt, A, (1999), Flavonol oligosaccharides from the seeds of Aesculus hippocastanum, Planta Medica, 65, p638-640, 17260289.
[https://doi.org/10.1055/s-1999-14038]

- Hwang, SH, (2009), Preservation of Scutellariae radix extract for cosmetics., Master Thesis, Kyung Hee University, p1-61.
-
Im, DY, Lee, KI, (2011), Antioxidative and antibacterial activity and tyrosinase inhibitory activity of the extract and fractions from Taraxacum coreanum Nakai, Korean Journal of Medicinal Crop Science, 19, p238-245.
[https://doi.org/10.7783/KJMCS.2011.19.4.238]

- Ivanòva, A, Mikhova, B, Najdenski, H, Tsvetkova, I, Kostova, I, (2009), Chemical composition and antimicrobial activity of wild garlic Allium ursinum of Bulgarian origin, Natural Product Communications, 4, p1059-1062, 19768983.
- Jung, MJ, Yin, Y, Heo, SI, Wang, MH, (2008), Antioxidant and anticancer activities of extract from Artemisia capillaries, Korean Journal of Pharmacognosy, 39, p194-198.
-
Kadoma, Y, Fujisawa, S, (2008), A comparative study of the radical-scavenging activity of the phenolcarboxylic acid caffeic acid, p-coumaric acid, chlorogenic acid and ferulic acid, with orwithout 2-mercaptoethanol, a thiol, using the induction periodmethod, Molecules, 13, p2488-2499, 18923340.
[https://doi.org/10.3390/molecules13102488]

- Kang, YH, Park, YK, Lee, GD, (1996), The nitrite scavenging and electron donating ability of phenolic compounds, Korean Journal of Food Science and Technology, 28, p232-239.
-
Kim, EJ, Choi, JY, Yu, MR, Kim, MY, Lee, SH, Lee, BH, (2012a), Total polyphenols, total flavonoid contents, and antioxidant activity of Korean natural and medicinal plants, Korean Journal of Food Science and Technology, 44, p337-342.
[https://doi.org/10.9721/KJFST.2012.44.3.337]

-
Kim, HJ, Jang, HN, Bae, JY, Ha, JH, Park, SN, (2014), Antimicrobial activity, quantification and bactericidal activitiesof Licorice active ingredients, Korean Journal of Microbiologyand Biotechnology, 42, p386-392.
[https://doi.org/10.4014/kjmb.1410.10002]

- Kim, JE, Kim, WY, Kim, JW, Park, HS, Lee, SH, Lee, SY, Kim, MJ, Kim, AR, Park, SN, (2010), Antibacterial, antioxidativeactivity and component analysis of Pinus koraiensis leaf extracts, Journal of the Society of Cosmetic Scientists of Korea, 36, p303-314.
-
Kim, JH, Hong, SK, Hwang, SJ, Son, SW, Choi, YS, (2012b), The preclinical and clinical effects of herbal product containing Rosa mutiflora roots extracts as a main component on the hair growth promotion, Korean Journal of Medicinal Crop Science, 20, p108-116.
[https://doi.org/10.7783/KJMCS.2012.20.2.108]

- Kim, SQ, Shin, MK, Auh, QS, Lee, JY, Hong, JP, Chun, YH, (2007), Effect of phytoncide on Porphyromonas gingivalis, Korean Journal of Oral Medicine, 32, p137-150.
- Kim, YJ, (2015), Antioxidant and antibacterial activity from extracts of Lonicera japonica, Rosa hybrida and Rosa multiflora, Master Thesis, Sunchon National University, p1-28.
- Lee, SO, Lee, HJ, Yu, MH, Im, HG, Lee, IS., (2005), Totalpolyphenol contents and antioxidant activities of methanol extracts from vegetables produced in Ullung island, KoreanJournal of Food Science and Technology, 37, p233-240.
-
Lu, Y, Foo, LY, (2000), Antioxidant and radical scavengingactivities of polyphenols from apple pomace, Food Chemistry, 68, p81-85.
[https://doi.org/10.1016/S0308-8146(99)00167-3]

-
Manach, C, Williamson, G, Morand, C, Scalbert, A, Rémésy, C, (2005), Bioavailability and bioefficacy of polyphenols in humans. Part 1. Review of 97 bioavilability studies1-3, The American Journal of Clinical Nutrition, 81, p230-242, 15640486.
[https://doi.org/10.1093/ajcn/81.1.230S]

-
Routledge, EJ, Parker, J, Odum, J, Ashby, J, Sumpter, JP, (1998), Some alkyl hydroxy benzoate preservatives(parabens) are estrogenic, Toxicology and Applied Pharmacology, 153, p12-19, 9875295.
[https://doi.org/10.1006/taap.1998.8544]

- Ryu, MJ, Lee, SY, Park, Y, Yang, YK, (2010), Antioxidativeactivities and antifungal effect against Malassezia furfur in the extracts from 6 spp. medicinal plants, Journal of KoreanSociety of Cosmetology, 16, p120-128.
-
Sarkany, L., (1960), Contact dermatitis from paraben, British Journal of Dermatology, 72, p345-347, 13746514.
[https://doi.org/10.1111/j.1365-2133.1960.tb13815.x]

- Shin, DH, (1990), Present status of natural antimicrobial compound and their application, Food Science and Industry, 23, p68-77.
-
Steinberg, D, Hirschfeld, Z, Tayeb, I, Ben-Yosef, S, David, A, Friedman, M, (1999), The effect of parabens in a mouthwash and incorporated into a sustained release varnish on salivarybacteria, Journal of Dentistry, 27, p101-106, 10071466.
[https://doi.org/10.1016/S0300-5712(98)00040-2]

- Vilaplana, J, Romaguera, C, (2000), Contact dermatitis from parabens used as preservatives in eyedrops, Contact Dermatitis, 43, p248, 11011947.
-
Yeo, JS, Chun, SS, Choi, JH, (2014), Antioxidant activities ofsolvent extracts from Rosa multiflora, Journal of Life Science, 24, p1217-1223.
[https://doi.org/10.5352/JLS.2014.24.11.1217]

- Zhoh, CK, Kim, BN, Hong, SH, Han, CG, (2002), Theantimicrobial effects of natural aromas for substitution of parabens, Journal of the Society of Cosmetic Scientists of Korea, 28, p166-185.