
Colchicine 처리에 의해 유기된 4배체 하수오의 형태 및 세포유전학적 특성
© The Korean Society of Medicinal Crop Science. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
For stable induction of tetraploidy in Fallopia multiflora Haraldson, colchicine was treated to establish the condition of induction and investigated the morphological and cytogenetic traits of the tetraploid plants obtained compared to those of diploid ones.
For the induction of tetraploidy, F. multiflora plants were soaked in aqueous solutions of colchicine at various concentration (0.1, 0.5, and 1.0%). After this, 2% dimethyl sulfoxide (DMSO) was added at room temperature on a shaker set at 150 rpm for periods of 12, 24, and 48 h. The induction rate of tetraploids appeared to be the highest in plants treated with 0.5% colchicine for 24 h. As the colchicine concentration and soaking time increased above these levels, the growing tip of the roots did not develop and they began to rot. When compared to diploid plants, tetraploids differed greatly in various characteristics, including the sizes and shapes of the leaves, fruits, flowers and roots. The induced tetraploid F. multiflora had larger guard cells, and chloroplasts, increased number of chloroplast in the guard cells and decreased stomatal densities.
When colchicine induced plants for tetraploid, it can be distinguished from diploids, in various characteristics such as morphological changes as stomatal size, number of chloroplasts per guard cell, number of chromosomes and flow cytometry. Therefore, it proved that these methods are suitable, quick and easy methods for the identification of the ploidy level of F. multiflora.
Keywords:
Fallopia multiflora Haraldson, Colchicine, Tetraploid서 언
하수오는 마디풀과 (Polygonaceae)에 속한 여러 해 살이 덩 굴성 초본으로 Fallopia multiflora을 기원식물로 하며 덩이뿌 리를 건조한 것이다 (Kim et al., 2014).
하수오는 염색체수가 2n = 22 (2×)의 2배체와 2n = 33 (3×) 의 3배체 두 종이 있으며 최초의 하수오 기원은 고위도 지역 이며, 저위도 지역으로 전이하는 과정에서 염색체 수와 구조 의 변화로 3배체가 만들어졌고 외형적인 특성에 큰 차이가 없 는 것으로 미루어 2배체 집단 내에서 3배체가 만들어진 것으 로 추정하고 있다 (Liu et al., 2013).
현재 국내에서는 하수오 자원에 대한 배수체 검정 연구가 수행되지 않았기 때문에 국내 자생하고 있는 자원에 대한 배 수성 확인 연구와 더불어 유전체 정보를 이용한 유전적 다양 성 분석이 필요하다 (Jiang and Leem, 2016; Park et al., 2017; Gil et al., 2017).
배수체는 원 식물체에 비해 수량이 증가하고 환경 스트레스 와 병에 대한 저항성이 향상되며 (Ahloowalia, 1967), 식물체 내에 유용한 2 차 대사산물의 함량이 높아지는 경우가 있다고 보고되어지고 있어 (Majdi et al., 2010), 현재까지 다양한 작 물과 약용작물에서 배수성을 이용한 육종소재가 개발되어 왔 다 (Ahloowalia, 1967; Kermani et al., 2003; Tang et al., 2010; Kanoktip et al., 2014).
국내에서는 배수화제 colchicine을 처리하여 2배체와 4배체 인공교배에 의한 씨없는 수박 품종 육성을 위해 4배체 수박품 종 개발 하였고 (Koh, 2002), 고추냉이의 다수확 품종 육성을 위해 colchicine과 EMS를 처리하여 돌연변이체를 유기하였다 (Park et al., 1996). 또한 포도의 3배체 육성에 필요한 4배체 교배모본을 육성하고자 4배체 포도 품종을 개발하였으며 (Noh et al., 2010), 꽃의 크기가 작은 특성을 개량하기 위한 자란 4배체 육성 (Yon et al., 2004), 사포닌 함량을 높이고 지하부 수량을 높이기 위해 더덕 4배체 및 도라지 4배체 육성 연구가 수행되었다 (Kim et al., 2003a, 2003b).
본 연구에서는 하수오 재래종의 낮은 수량을 극복하고 겨울 철 월동율이 낮아 고사되는 내한성을 강화시켜 중부지역에서 도 재배가 가능하도록 지역적응성을 넓히고, 기능성분이 강화 된 하수오 4배체 품종 개발을 위하여 anti-mitotic agent로서 colchicine을 열매에 침지 처리하여 염색체를 배가시키는 조건 을 구명하고 이로부터 얻어진 4배체의 식물학적 형태 및 세포 유전학적 특성을 분석하여 보고하고자 한다.
재료 및 방법
1. 실험재료
시험에 사용한 2배체 하수오 (Fallopia multiflora)는 고유 특성을 유지하고 수량이 높은 자원을 충북농업기술원에서 수 집하여 보존하고 있는 국가등록번호 IT249568 (CBM0061) 자원을 4배체 유기 실험재료로 사용하였다.
IT 249568 자원의 고유 특성으로는 덩굴은 담갈색을 띠며 잎은 어긋나기로 붙고 잎자루가 있다. 잎 모양은 끝이 뾰족하 고 밑 부분이 넓어져 심장형을 이루며 꽃은 8 - 9 월에 피며 담황백색이고 꽃차례는 원추화서를 이루며 열매 1,000립 (천 립중)의 무게는 1.1 g 정도로 전형적인 하수오의 형태적 특성 을 지니고 있다.
2. 염색체 배수화 처리
하수오 IT249568 자원의 종자를 각각 800 립씩 사용하여 증류수로 2 - 3 회 세척 후 거즈에 싸서 1% 락스로 10 분간 살균 후 멸균수로 3 회 세척하였다. 세척한 종자를 dimethyl sulfoxide (DMSO, MB cell, Seoul, Korea) 2%에 녹인 콜히 친 (Sigma-Aldrich Co., St. Louis, MO, USA) 수용액을 0.1, 0.5 및 1% 농도로 희석하여 각각 침지하였다.
침지한 종자는 농도별로 각각 12, 24, 48 시간 동안 상온에 서 교반기 (RK-1D, DAIHAN, Seoul, Korea)를 이용하여 150 rpm 조건으로 반응시켰다. 침지한 종자를 800 립씩 파종 하여 4 주 동안 유리온실에서 육묘하여 생존율을 조사한 후, 본엽이 출현한 시점부터 본포 정식 후 2 년간 생육 단계에 따라 수시로 3 반복하여 4배체 검정을 하였다.
3. Flow cytometry를 이용한 배수성 검정
파종 후 4 주에 발생한 어린 잎과 포장 정식 후 2 년간 재배하여 올라오는 어린 잎을 처리별로 1㎝2 크기의 유엽의 엽육을 채취하여 페트리디쉬 위에 놓고 cystain UV precise P (PARTEC, Goerlitz, Germany) kit의 nucleus isolation buffer를 0.5㎖씩 떨어뜨려 면도날로 20 초간 쳐서 잘게 조각 내었다.
조각난 잎이 든 시료를 30㎜ nylon mesh (Celltrics® PARTEC, Munster, Germany)에 filtering한 후, 동일한 kit 내 에 들어있는 DNA staining 용액을 1.5㎖씩 첨가하여 핵 DNA 함량을 측정하였다. 콜히친을 처리하지 않은 2배체의 fluorescent intensity 값을 100으로 설정하고 콜히친을 처리한 식물체의 peak가 fluorescent intensity 값 200에 위치하면 4 배체, 100과 200에 모두 위치하면 혼배수체 (mixploid)로 하 였으며 모든 배수체 검정은 3 반복하였다.
4. Chromosome counting 분석
4배체로 유기된 식물체와 2배체 식물체를 본포에 정식하고 8 주가 경과된 시점에서 오전 8 - 9 시경 개체별로 유근을 6 개씩 0.5 ㎝ 길이로 채취하여 3 차 멸균수에 담가 4℃에 24 시간 동안 저온처리 하였다. 이후 glacial acetic aicd (Sigma- Aldrich Co., St. Louis, MO, USA)와 ethanol (Sigma- Aldrich Co., St. Louis, MO, USA)이 1 : 3 (v/v)로 혼합된 고정액에 넣어 고정시킨 다음 멸균수로 근단을 세척하였다.
세척된 근단을 60℃로 가열된 1N HCl 용액을 1㎖씩 넣 어 약 3 - 5 분간 반응시킨 뒤 멸균수로 다시 세척하였다. 이 후 근단은 90㎜ petridish (SPL, Seoul, Korea)에 옮겨 1% acetoorcein 염색 시약을 1 - 2 방울 떨어뜨려 3 시간 동안 염 색하고 슬라이드를 준비하여 엄지 손가락으로 세게 압착한 후 광학 현미경 (Nikon, ECLIPSE Ni, Tokyo, Japan) 400 - 1,000 배율에서 유액을 투입하여 사진을 촬영하였고 염 색체 수는 10 개체를 3 반복 조사하였다.
5. 공변세포 및 엽록체의 크기 및 형태 비교
공변세포의 특성을 조사하기 위해 잎의 뒷면에 투명 메뉴큐 어로 피층을 분리하였으며, 공변세포의 엽록체 수는 잎의 이 면표피 부분만 분리하여 슬라이드 글라스 위에 올려놓고 표피 조직 위에 iodine-potassium iodide 용액 [1% iodine (w/v), 2% (w/v) potassium iodide] (Samchun, Pyeongtaek, Korea) 을 한 방울 떨어뜨린 다음 cover glass를 덮고 광학현미경을 이용하여 1,000 배율로 검경하였다. 공변세포와 엽록체는 3 개 체의 잎에서 10 개의 세포 내의 엽록체를 3 반복으로 조사하 였다.
6. 4배체와 2배체 식물 특성 비교
하수오 2배체와 4배체 식물체는 충북농업기술원 특작포장에 정식 후 2 년 동일한 조건에서 재배하면서 지상부 생육 및 형태적 특성은 초장, 줄기 직경 , 엽장, 엽폭, 꽃 직경, 꽃 길 이, 화서 직경, 화서 폭, 꽃 수 등을 조사하였으며 엽록소 함 량은 색차계 (SPAD 501, Minolta Co., Ltd., Osaka, Japan) 로 조사하였다. 지하부는 근장, 근경, 근색, 근중 및 수량을 조 사하였고 모든 조사는 10 개씩 3 반복으로 조사하였다.
7. 통계 처리
본 연구는 모든 처리에 3 반복하여 측정하였으며 시험 결과 의 분석은 PC용 통계패키지인 MYSTAT (Systat software Inc., Chicago, IL, USA)를 이용하여 분산분석 (ANOVA)을 실시한 후 Duncan’s Multiple Range Test (DMRT)로 유의성 을 p < 0.05 수준에서 검정하였다.
결과 및 고찰
1. 하수오 4배체 유기 조건 설정
하수오 (Fallopia multiflora) 종자에 콜히친을 처리농도와 시 간을 다르게 처리하여 4배체를 유기한 결과는 Table 1과 같다.
콜히친 수용액의 농도와 처리시간이 증가할수록 본엽이 출 현하기 전에 고사하거나 생장점이 비정상적으로 변형되어 더 이상 생장을 하지 않는 식물체의 숫자가 증가하여 생존율이 떨어지는 경향을 보였다 (Table 1). 하지만 콜히친 농도와 침 지시간이 증가할수록 혼수체 및 4배체 유기율이 유의하게 높 아지는 경향을 보였다.
콜히친의 적정 처리시간은 성공적인 4배체 유기에 매우 중 요한 요인이다. Wang 등 (2017)은 Fagopyrum tataricum L. Gaertn의 본엽 2매 단계에서 생장점에 콜히친을 처리하였을 때, 처리시간이 길어짐에 따라 치사율이 높았고 4배체 유기율 에도 큰 영향을 미친다고 보고하였다. 한편 높은 치사율을 보 이는 콜히친 처리시간은 4배체 유기율이 높은 경우를 보이기 도 한다 (Abodli et al., 2013). 다른 식물들과 마찬가지로 하 수오에서도 콜히친 처리시간은 유식물체의 생존율에 큰 영향 을 미치는 것으로 보인다.
본 연구에서 0.5 - 1.0%의 콜히친 농도 조건에서 48 시간 이상 침지하였을 경우에는 유식물체의 생존율이 크게 감소하 는 것으로 나타났다 (Table 1). 하수오는 다른 식물체에 비해 종자단계에서 콜히친의 독성에 다소 높은 저항성을 보이는 것 으로 판단된다. Lolium perenne 식물의 경우 종자를 0.2 % 콜히친에 3 시간 침지하였을 때 74.6%의 높은 치사율을 보이 고 (Ahloowalia, 1967), Platanus acerifolia 식물의 종자를 0.5% 콜히친에 24 시간 침지할 경우 치사율이 100%에 이른 다 (Liu et al., 2007). 하지만 본 연구에서 하수오는 0.5%의 비교적 고농도의 콜히친에 종자를 24 시간 침지하여도 약 23%의 생존율을 보였다 (Table 1).
중국 재래종 하수오의 엽아에 0.2% 농도의 콜히친 수용액 에 36 시간 처리한 후 BA 및 IAA가 함유되어 있는 MS배 지에서 발아시켜 배수성을 검정한 결과 4배체 유기율이 가장 높았다는 보고 (Zhang and Gao, 2006)와 본 연구에서 종자 에 콜히친 0.5 % 농도의 수용액에 24 시간 침지했을 때 4배 체 유기율이 높았다는 결과가 상이한 부분이 있는데, 이는 샘 플 처리부위 및 방법이 달라서 콜히친 처리 적정 농도 및 시 간에 영향을 준 것으로 판단된다.
2. 하수오 4배체의 배수성 검정
콜히친 처리 직후 파종 4 주차에 발생한 어린 잎을 flow cytometry로 각 처리별로 배수성을 검정하여 4배체 및 혼배수 체로 관찰된 개체를 선발하여 포장에 정식하였다.
선발은 배수성 검정을 위하여 flow cytometry를 이용, GAIN값을 485 으로 고정시킨 후, 잎의 DNA 함량의 배가유 무를 확인하여 선발하였는데 2배체 식물로부터 추출된 DNA 함량은 G1 phase에 fluorescent intensity값이 100으로 확인되 었고, 4배체 식물의 경우 200, 혼수체는 peak가 100과 200에 모두 위치하는 것을 확인하였다 (Fig. 1.).

Histograms of relative DNA content obtained by flow cytometric anal using nuclei isolated from young leaf tissue of diploid (A), mixploid (B), tetraploid (C) of colchicine treated F. multiflora.
Flow cytometry 분석에 따른 fluorescent intensity 기준 값 은 시험자에 따라 달리 정할 수 있는데 2배체를 fluorescent intensity 50인 값으로 지정하면 4배체의 경우 100으로 제시하 기도 한다 (Jaskani et al., 2005).
정식 후 12 주 후에 혼배수체에서 각 측지의 배수성을 검 정한 결과 거의 모든 측지가 2배체인 것으로 나타났다 (data not shown). 유식물체에서 4배체였던 식물체의 각 측지의 배 수성을 재확인한 결과 몇 개의 식물체 일부 측지에서 2배체 및 4배체 측지가 모두 관찰되었다 (data not shown).
이 결과는 콜히친을 처리한 당대의 4배체 유식물체의 배수 성이 생육 후기에 다시 2배체로 돌아갈 수 있고 이는 생육이 진전될수록 2배체 세포의 분열속도가 4배체 세포의 분열 속도 보다 빠르므로 기관에 따라 생육후기에는 2배체 세포가 4배체 세포보다 더 많아지거나, 2배체 세포와 4배체 세포가 동일하 게 존재하거나 4배체 세포만 존재하는 경우가 있다는 보고와 일치한다 (Kim, 2017).
따라서 콜히친 처리를 통하여 하수오 4배체를 생산할 경우, 유식물체 단계에서 혼배수체의 선발은 큰 의미가 없는 것으로 판단된다. 또한 4배체를 유식물체 단계에서 검정하여 선발하 였더라도 생육 후기 또는 차년도에 배수성을 수시로 검정하여 4배체로 확인된 개체의 영양체를 삽목 증식하여 완전한 4배체 를 생산하여야 할 것으로 판단된다.
3. 하수오 4배체의 염색수 검정
Flow cytometry 분석을 통해 확보된 4배체 식물로부터 근단 세포의 염색체수를 조사하여 이들의 배수성 여부를 확인하였 다 (Fig. 2).
본 연구에서 사용된 하수오의 염색체 수는 2n = 2× = 22 인 2배체로 콜히친 처리에 의하여 유기된 4배체 10개체의 염색체 수는 모두 2n = 4× = 44 개로 확인 되었다 (Fig. 2).
중국내 하수오 재래종 가운데 2배체의 염색체수는 2n = 2× = 22 개였으며, 액아에 콜히친 처리 후 기내 MS배지에서 발아시켜 어린 싹의 배수성을 조사한 결과 유기된 하수오 4배 체의 염색체수는 2n = 4× = 44개라고 보고한 것과 일치하였다 (Huang et al., 2014; Zhang and Gao, 2006).
이들 근단세포를 이용한 염색체 관찰방법은 엽록체 수와 flow cytometry분석과 함께 배수성을 진단하는 중요한 도구로 알려져 있다 (Sari et al., 1999).
4. 하수오 4배체의 공변세포 및 엽록체 특성
콜히친 처리로 유기된 4배체 및 2배체 하수오의 잎의 공변 세포 특성을 비교 조사하였다. 2배체의 공변세포 내 엽록체수 는 평균 13.4 개인데 비해 4배체에서는 평균 23.2 개로 2 배 정도 많았다. 엽록체의 크기를 비교해 보면 2배체는 길이 2.4㎛ 폭 2.3㎛였고, 4배체는 길이 3.3㎛, 폭 3.2㎛로 4배 체가 더 큰 것으로 조사되었다 (Table 2, Fig. 3).
Compton 등 (1996)은 4배체와 2배체의 판별에 공변세포에 들어 있는 엽록체의 수를 조사하였는데 4배체에서는 공변세포 한 쌍 세포에 엽록체의 수가 19.0 개로 2배체의 11.2 개에 비하여 두 배 정도 많았으며 크기도 컸다고 하였고, 4배체 ‘Kinnow’ mandarin 에서도 L-1층에서 분화되는 잎의 표피에 존재하는 기공의 거대화가 관찰되었다고 보고하였다 (Khan et al., 1992).
이 같은 결과는 감자의 배수성에 따른 공변세포 내의 엽록 체 수에서 반수체가 12.2 개, 3배체 18.4 개 및 4배체 20.2 개로 배수성이 증가됨에 따라 유의하게 증가하며 담배 및 망 종화에 있어서도 배수성이 증가함에 따라 공변세포 내의 엽록 체 수도 증가한다는 결과와 매우 유사한 경향이었다 (Cho et al., 1994; Bae et al., 2001; Kwon et al., 2013).
공변세포의 크기는 2배체에서는 길이와 폭이 각각 19.2㎛, 18.0㎛ 인데 비해 4배체에서는 38.9㎛, 30.3㎛ 로 거의 두 배 정도 길었으나 공세변포의 수는 2배체가 104 개/㎟ 로 4 배체 28 개/㎟ 개 보다 3.7 배 정도 많았다 (Table 2).
도라지의 배수성에 따른 공변세포의 수에서 2배체 387 개 /㎟, 4배체 191 개/㎟ 개로 보고되었고 더덕에서도 2배체가 264 개/㎟, 4배체가 73 개/㎟ 로 배수성이 증가됨에 따라 유 의하게 공변세포의 수가 줄어든다는 보고와 매우 유사한 경향 이었다 (Kim et al., 2003a, 2003b).
5. 하수오 4배체와 2배체 식물 특성 비교
염색체의 수를 확인한 4배체 식물의 지상부 생육을 비교한 결과 2배체의 엽 및 엽병의 길이와 너비는 4배체보다 작은 경 향을 보였고 엽수는 적어지는 경향 (data not shown)을 보였 으나 모두 통계적으로는 유의성을 보이지 않았다. 엽록소의 함 량도 4배체 식물에서 많았다 (Table 3).
하수오 4배체 식물 열매의 형태적 특성을 2배체와 비교하였 다 (Table 4). 열매는 화피를 제거한 상태에서 측정하였으며 4 배체의 열매 길이 3.4㎜인 반면 2배체는 2.2㎜로 약 1.5 배 길었으며 너비는 4배체가 2.2㎜로 2배체 1.4㎜보다 1.6 배 두꺼워 (Fig. 5) 4배체가 2배체보다 유의적으로 컸다. 천립중 은 4배체가 1.6 g인 반면 2배체는 0.9 g으로 유의적으로 무거 웠다. 이와 같은 결과는 4배체 종자가 2배체에 비하여 크기가 커지고 두꺼워진다는 보고와 일치하였다 (Kihara, 1951).

Comparison of tetraploid (A) and diploid (B) fruits of F. multiflora.A; Seed with testa under a microscope 10×, B; Naked seed under a microscope 16×.
4배체의 꽃과 화서의 특성과 종자 발아 특성을 2배체와 비 교하였다 (Table 5). 꽃 길이가 4배체는 1.6㎜, 2배체 1.2㎜ 로 보다 길었으며, 꽃 너비도 4배체는 3.2㎜, 2배체는 2.6㎜ 으로 꽃이 커지는 특성을 보였다.
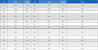
Comparison of flower, inflorescence and seed germination characteristics between diploid and tetraploid on F. multiflora.
화서의 길이는 2배체가 14.7㎝로 길고, 화서의 줄기 직경 은 1.1㎜로 4배체 2.0㎜보다 얇았다. 화서 당 꽃수는 2배체 가 평균 142 개로 4배체 92 개보다 많았으며 화서당 열매 형 성수도 121 개로 4배체 31 개보다 4 배 정도 많았다 (Table 5, Fig 6).

Comparison of flower and inflorescence shape on flowering stage (A, B) and fruit maturation stage(C) of tetraploid(a) and diploid(b) of F. multiflora.
열매를 128 공 포트트레이에 각 3 반복으로 파종하여 발아 일수를 조사한 결과 2배체 및 4배체 발아일수는 8 일 정도 소요되었고 발아율은 2배체 94.5%, 4배체는 9.1%로 2배체가 발아율이 높았다 (Table 5). 이는 기존의 개발된 4배체 품종들 이 대부분 수정능력이 감소되는 경향이 있고 (Lower and Johnos, 1969) 수박에서 열매당 10 개 이하 종자가 만들어진 다는 보고 (Compton et al., 2004)와 비슷하였다.
4배체로 유기된 선발개체를 포장에 2 년간 재배한 4배체 식 물의 지하부 생육을 비교한 결과 2배체의 주근의 길이는 13.5㎝로 4배체 17.0㎝보다 작고, 너비도 4.1㎝로 4배체 5.5㎝보다 작았다. 주근의 중량은 2배체가 268 g/주, 4배체가 418 g/주로 4배체가 약 36% 무거웠다 (Table 6, Fig. 7).
본 실험에서는 하수오 4배체를 유도하고자 염색체 배수화제 colchicine을 처리하여 적정 농도 및 침지시간을 구명하였고 유 기된 4배체 식물의 배수성 검정을 위하여 flow cytometry에 의한 DNA 함량 배가여부, 세포내 염색체 수 조사를 통해 4 배체임을 확인할 수 있었다. 하수오 4배체와 2배체 식물의 형 태 및 해부학적 특성은 공변세포 및 엽록체 크기 및 형태 비 교, 지상부 및 지하부 생육특성을 조사한 결과 4배체가 열매, 엽, 줄기 및 뿌리 조직이 커지는 특성을 보여 다수성 품종 개 발을 위해서는 4배체 하수오 자원의 확보가 필수적이라 판단 하였고 2018년 3월 국립산림품종관리센터에 “대건” 이라는 품 종명으로 품종출원하였다.
감사의 글
본 연구는 농촌진흥청 연구사업(과제번호: PJ0137832018)의 지원에 의해 이루어진 것으로 이에 감사드립니다.
References
-
Abodli, M, Moieni, A, Badi, HN, (2013), Morphological, physiological, cytological and phytochemical studies in diploid and colchicine-induced tetraploid plants of Echinacea purpurea (L.), Acta Physiologiae Plantarum, 35, p2075-2083.
[https://doi.org/10.1007/s11738-013-1242-9]

-
Ahloowalia, BS, (1967), Colchicine induced polyploids in ryegrass, Euphytica, 16, p49-60.
[https://doi.org/10.1007/BF00034098]

- Bae, CH, Lee, YH, Yang, DC, Min, KS, Kim, HI, Lee, HY, (2001), Changes of chloroplast number per guard cell pairs of leaves by ploidy level in Nicotiana tabacum L. cv. BY-4, Korean Journal of Plant Tissue Culture, 28, p179-184.
- Cho, HM, Kim, HY, Mok, IG, (1994), Stomatal cell characters as an indicator for haploid indentification from progeny plants derived by 4x2x interspecific crosses in potatoes, KoreanJournal of Breeding Science, 26, p66-73.
-
Compton, ME, Gray, DJ, Elmstrom, GW, (1996), Identification of tetraploid regenerants from cotyledons of diploid watermelon cultured in vitro, Euphytica, 87, p165-172.
[https://doi.org/10.1007/BF00023744]

-
Compton, ME, Gray, DJ, Gaba, VP, (2004), Use of tissue culture and biotechnology for the genetic improvement of watermelon, Plant Cell, Tissue and Organ Culture, 77, p231-243.
[https://doi.org/10.1023/B:TICU.0000018428.43446.58]

- Gil, JS, Um, YR, Byun, JK, Chung, JW, Chan, YL, Chung, CM, (2017), Genetic diversity analysis of wood-cultivated ginseng using simple sequence repeat Markers, Korean Journal of Medicinal Crop Science, 25, p389-396.
-
Huang, HP, Wang, J, Huang, LQ, Gao, SL, Huang, P, Wang, DL, (2014), Germplasm preservation in vitro of Polygonummultiflorum Thunb, Pharmacognosy Magazine, 10, p179-184, 24914285.
[https://doi.org/10.4103/0973-1296.131032]

- Jaskani, MJ, Kwon, SW, Kin, DH, (2005), Flow cytometry of DNA contents of colchicines treated watermelon as a ploidy screening method at M1 stage, Pakistan Journal of Botany, 37, p685-696.
-
Jiang, GB, Leem, JY, (2016), Comparative analysis of cultivation region of Angelica gigas using a GC-MS-based metabolomics approach, Korean Journal of Medicinal Crop Science, 24, p93-100.
[https://doi.org/10.7783/KJMCS.2016.24.2.93]

-
Kanoktip, P, Ratchada, S, Ikuo, N, Masahiro, M, Kanyaratt, S, (2014), Tetraploid induction of Mitracarpus hirtus L. by colchicines and its characterization including antibacterial activity, Plant Cell, Tissue and Organ Culture, 117, p381-391.
[https://doi.org/10.1007/s11240-014-0447-y]

-
Kermani, MJ, Sarasan, V, Roberts, AV, Yokoya, K, Wentworth, J, Sieber, VK, (2003), Oryzalin-induced chromosome doubling in Rosa and its effect on plant morphology and pollen viability, Theoretical and Applied Genetics, 107, p1195-1200, 12955205.
[https://doi.org/10.1007/s00122-003-1374-1]

- Khan, MM, Khan, IA, Muhgal, AH, (1992), Growth and morphological comparison of diploid and tetraploid strains of Kinnow mandarin., Proceedings of the International Society ofCitriculture, p93-95.
- Kihara, H., (1951), Triploid watermelons, Proceedings of the American Society for Horticultural Science, 58, p217-230.
- Kim, HL, (2017), Induction of tetraploid radishes(Raphanus sativus L.) and evaluation of morphological traits, Master Thesis, Chungbuk National University, p13-23.
- Kim, IH, Kim, HH, Hong, EY, Yun, JS, Yun, T, Hwang, JK, Lee, CH, (2003a), Breeding of tetraploid in Codonopsis lanceolata(Sied. et Zucc.) trautvetter by colchicine treatment, Korea Journal of Plant Resources, 6, p227-232.
- Kim, IH, Kim, HH, Hong, EY, Yun, JS, Yun, T, Hwang, JK, Lee, CH, (2003b), Breeding of tetraploid in Platycodon grandiflorum(Jacq.) A.DC. by colchichine treatment, Korea Journal of Plant Resources, 6, p188-194.
-
Kim, MJ, Kim, IJ, Choi, SY, Han, DH, Kim, YH, Lim, SC, Kim, TJ, Nam, SY, Song, BH, Oh, BU, Park, CG, (2014), Comparison of Cynanchum wilfordii, C. auriculatum, Metaplexisjaponica and Polygonum multiflorum by morphological characters, Korean Journal of Medicinal Crop Science, 22, p113-120.
[https://doi.org/10.7783/KJMCS.2014.22.2.113]

- Koh, GC, (2002), Tetraploid production of Moodeungsan watermelon, Horticulture Environment and Biotechnology, 43, p671-676.
-
Kwon, SJ, Cho, KY, Kim, HH, (2013), A tetrploid induction in Hypericum patulum thunberg by colchicine soaking treatment, Korea Journal of Plant Resources, 26, p284-288.
[https://doi.org/10.7732/kjpr.2013.26.2.284]

-
Liu, G, Li, Z, Bao, M, (2007), Colchicine-induced chromosome doubling in Platanus acerifolia and its effect on plant morphology, Euphytica, 157, p145-154.
[https://doi.org/10.1007/s10681-007-9406-6]

- Liu, HC, Wang, Z, Zhang, S, Wang, H, Zhao, Z, (2013), Analysis of karyotype and evolution trend of Polygonum multiflorum Thunb. germplasm resources, Acta Botanica Boreali-Occidentalia Sinica, 33, p1123-1136.
- Lower, RL, Johson, KW, (1969), Observations on sterility of induced autotetraploid watermelons, Journal of the American Society for Horticultural Science, 94, p367-369.
- Majdi, M, Karimzadeh, G, Malboobi, MA, Omidbaigi, R, Mirzaghaderi, G, (2010), Induction of tetraploidy to feverfew(Tanacetum parthenium SchulzBip.): Morphological, physiological, cytological and phytochemical changes, HortScience, 45, p16-21.
- Noh, JH, Park, KS, Yun, HK, Do, GR, Hur, YY, Kim, SH, Lee, HC, Ryou, MS, Park, SJ, Jung, SM, (2010), Determination of chimera types and ploidy level of sports from campbellearly grape(Vitis labruscana), Korean Journal of Horticultural Science and Technology, 28, p996-1002.
- Park, KC, Kim, YG, Kyeong, HB, Gil, JS, Chung, H, Park, SG, Hong, CP, Lee, Y, (2017), Development of simple sequence repeat markers from Adenophora triphylla var. japonica(Regel) H. Hara using next generation sequencing, Korean Journal of Medicinal Crop Science, 25, p411-417.
- Park, KI, Yoon, MJ, Kwon, SW, Choi, SY, Lee, KS, (1996), Effects of cholchicine and EMS on induction of variants inWasabia japonica Matsum, Korea Journal of Medicinal Crop Science, 4, p12-18.
-
Sari, N, Abak, K, Pitrat, M, (1999), Comparison of ploidy level screening methods in watermelon: Citrullus lanatus (Thunb.) Matsum and Nakai, Scientia Horticulturae, 82, p265-277.
[https://doi.org/10.1016/S0304-4238(99)00077-1]

-
Tang, ZQ, Chen, DL, Song, ZJ, He, YC, Cai, DT, (2010), In vitro induction and identification of tetraploid plants of Paulownia tomentosa, Plant Cell, Tissue and Organ Culture, 102, p213-220.
[https://doi.org/10.1007/s11240-010-9724-6]

-
Wang, LJ, Sheng, MY, Wen, PC, Du, JY, (2017), Morphological, physiological, cytological and phytochemicalstudies in diploid and colchicine-induced tetraploid plants of Fagopyrum tataricum(L.) Gaertn, Botanical Studies, 58, p2, https://link.springer.com/content/pdf/10.1186%2Fs40529-016-0157-3.pdf (cited by 2018 Jul 27).
[https://doi.org/10.1186/s40529-016-0157-3]

- Yon, JS, Hong, EY, Kim, IH, Shin, K, Yun, T, Lee, CH, Kim, TS, Paek, KY, (2004), Breeding of a new tetraploid Bletilla striata Reichb. fil, Chungbuk Jaran, Korean Journal of Horticultural Science and Technology, 22, p495-498.
- Zhang, XN, Gao, SL, (2006), Induction and physiological indices determination of autotetraploids of Polygonum multiflorum, Journal of Plant Resources and Environment, 4, p48-57.









