
하우스에서 재배된 새싹인삼의 재배시기별 생육, 유효성분 및 물성의 변화
 ; Sun Ick Kim*
; Sun Ick Kim* ; Moo Geun Jee*
; Moo Geun Jee* ; Hee Chul Lee*
; Hee Chul Lee* ; A Reum Kwon*
; A Reum Kwon* ; Hyun Ho Kim*
; Hyun Ho Kim* ; Jun Yeon Won**
; Jun Yeon Won** ; Ka Soon Lee*, †
; Ka Soon Lee*, †
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The ginseng ginsenosides, which have various physiological activities, are known to be more abundant in the leaves than in the roots, and the consumers' interest in ginseng sprout as a functional vegetable has been increasing.
The aim of this study was to investigate the effects of growth period on growth properties, active ingredients and rheology of ginseng sprouts cultivated in a non-heated greenhouse equipped with a shade net for 60 days, starting from the end of May to the middle of July. The chlorophyll content of the leaves decreased, but their length and width increased with increasing cultivation days. In particular, growth increased significantly until 40 days, but only slightly after 50 days. The stem length did not increase greatly from the 20 th to the 30 th day of cultivation, but increased significantly from the 30 th to the 40 th day, and then further increased gradually. The weight of the leaves, stems, and roots increased slightly, but not change significantly. After 40 days of cultivation, the total ginsenoside content increased by 1.07 times in the leaves and decreased by 0.80 times in the roots with increasing cultivation days. The leaf contents of ginsenosides Rg1, Re, Rb1, Rc, F3 and F4 increased with increasing cultivation days. The rheological properties of ginseng sprout showed the greatest influence on stem hardening with increasing cultivation days.
Therefore, based on the growth characteristics, active ingredients and physical properties, 40 days after sowing was considered to be an appropriate harvesting time for ginseng sprouts.
Keywords:
Fresh Vegetable, Ginseng Sprout, Ginsenoside, Rheology, Transplanting Days서 언
새싹채소는 싹채소, 어린싹 및 싹기름 채소라고 부르며, 종자로부터 발아하여 떡잎이 전개되거나 그 전 단계에서 모든 부위를 이용하거나 배축부를 절단하여 이용하는 채소이다 (Kim and Lee, 2010). 또한 쌈 채소는 엽채류와 양채류 중에서 쌈용으로 소비하는 채소로서 상추, 치커리, 쑥갓, 깻잎, 케일 등 다종이 많이 재배 생산되고 있다 (Jun et al., 2012; Lee and Park, 2014).
새싹채소는 종자에서 싹이 터 자신의 성장을 위해서 영양소와 생리활성 물질을 생합성하므로 완전히 성장한 채소나 종자에 비해 그 함량이 높고, 무기질, 비타민 및 폴리페놀 화합물을 다량 함유하고 있어 생리활성 효과가 우수하다고 보고가 있다 (Kim et al., 1997; Lee et al., 2009). 그러므로 새싹을 섭취함으로 평상시의 식생활로 섭취하기 어려운 각종 효소나 칼슘, 칼륨, 철분 등의 미네랄 및 비타민 등을 섭취할 수 있는 장점을 가지고 있다 (Kim and Lee, 2010).
따라서 산업구조 변화에 의한 국민 의식 수준의 향상 및 식생활의 소비성향도 변화를 초래하여 건강 지향성 및 편의성을 중시함으로서 새싹 및 쌈 채소에 대한 관심이 증가하고 소비가 증가하는 추세이다 (Jun et al., 2012; Lee and Park, 2014).
인삼 (Panax ginseng C. A. Meyer)이 식품으로 애용되기 시작하면서 인삼 중에 사포닌이 다량 함유되어있고 이들 성분이 피로 회복, 면역력 증진, 혈행 개선 등의 기능성을 띠고 있어 (MDFS, 2015, 2017) 건강기능성 식품으로 인정되고 있는 인삼은 뿌리를 주로 식용하였는데 최근 인삼 잎이나 열매에서 뿌리보다도 더 많은 사포닌을 함유하고 있다고 보고되었다 (Yahara et al., 1979; Choi et al., 2009). 또 Xie 등 (2004)에 의하면 인삼 잎은 항산화, 항노화, 항피로, 항당뇨 및 심혈관계 질병예방 등 각종 생리기능성이 우수하다고 보고되어 있다.
이에 인삼 잎을 이용한 각종 가공식품 및 화장품 등의 제품 개발에도 애용되고 있으며 (Jeon et al., 2011; Cho et al., 2015), Kim 등 (2016)은 사포닌 함량이 많은 새싹인삼을 카스테라 제조 시 5%를 첨가 혼합하여 만들 경우 기호도와 물성이 좋아진다는 보고 등 새싹인삼이 가공제품의 제조 원료로 많이 애용되고 있다. 또, 인삼은 일반 재배 시 인삼 잎의 수확시기에 따라 잎에 함유된 사포닌 함량에 차이가 있는 것으로 알려져 있다 (Choi et al., 2009).
그런데 인삼 잎을 이용하기 위해 수확을 하게 되면 논이나 밭에서 재배되고 있는 인삼은 더 성장할 수 없게 되어 뿌리와 잎을 모두 이용하기에는 좀 어려운 실정이고 또 밭에서 정상적으로 재배된 인삼 잎은 경화되어 있을 뿐만 아니라 쓴맛이 너무 강하여 쌈 채소로 이용하기에는 적절하지 않다. 따라서 최근 묘삼을 이용하여 새싹 삼을 만든 다음 인삼의 모든 부위를 다 식용할 수 있도록 새싹인삼이 재배 생산되어 소비자들에게 제공되고 있다.
그러나 새싹인삼을 샐러드 및 쌈용으로 이용하는 신선채소차원에서 새싹인삼을 연구한 내용이 없고 특히 채소로서 이용할 경우 새싹인삼에 대한 물성을 연구한 결과들을 볼 수가 없다. 따라서 식감이 가장 좋으면서 인삼 내 함유되어 있는 유효성분의 함량 측면에서 볼 때 적절한 재배조건과 수확시기를 검토해 볼 필요가 있다.
본 연구에서는 1년생 묘삼을 이용하여 새싹인삼을 무가온하우스에서 재배하여 재배시기별로 새싹인삼의 생육적 특성, 유효성분 및 물성학적 특성의 변화를 조사하여 새싹인삼을 샐러드 및 쌈용으로 이용 시 최적의 수확시기를 구명하고자 수행하였다.
재료 및 방법
1. 새싹인삼용 묘삼 재료
본 실험에 사용된 새싹인삼 (Panax ginseng C. A. Meyer)용 묘삼은 충남 금산군에서 재배된 것을 2018년 3월 초순에 수확하여 원료로 사용하였다.
2. 재배조건
새싹인삼 재배는 Choi 등 (2012)의 방법에 따라 피트모스와 펄라이트를 1 : 1로 혼합한 인삼전용 상토에 묘삼을 이식하여 충남농업기술원 인삼약초연구소 비닐하우스에서 무가온으로 실온에서 재배하여 사용하였다. 이때 사용되었던 비닐하우스는 폐쇄용 하우스로 너비 8.4 m, 길이 31 m, 높이 5 m의 단동하우스로 직사광선을 차단하기 위하여 차광율 85%의 검정색 차광망을 산란비닐 위에 씌웠으며 하우스 측면 쪽의 하우스 부분은 온도와 광량조절을 위하여 지표면에서 높이 2.2 m까지 커튼 형식으로 차광망이 개폐될 수 있는 구조로 설계되었다.
새싹인삼을 재배한 시기는 인삼의 생육적온을 고려하여 5월 21일에 이식하여 7 월 하순경까지 재배하였다. Fig. 1과 같이 이 시기의 재배지역의 최저온도는 묘삼을 이식하여 재배를 시작한 날에 8.3℃이었고, 최고온도는 재배 종료일인 7월 20일에 35.9℃이었으며 무가온 비닐하우스 내의 온도는 최저온도 10.2℃, 최고온도는 35.1℃였다. 새싹인삼을 재배한 상자는 사각형 삽목상자 (52.0 × 36.5 × 9.0㎝)로서, 전용상토를 부피단위로 8ℓ의 양을 충전하였으며 묘삼을 균등 분배하여 80 주를 45o 각도로 뉘워서 이식하여 재배하였다. 재배하는 동안 하우스 내 광원은 황색 LED [Ev-3,106Lx, TCP-3,415k 레오(주), Cheongju, Korea]를 이용하여 삽목상자 표면에서부터 80㎝ 떨어진 위치에서 1 일에 10 시간씩 조사하였다. 또한 상토의 수분조절과 새싹인삼의 생육을 위하여 출아 전에는 상면관수, 출아 후에는 점적관수를 이용하여 주 2 회 상자당 4ℓ의 관수를 하여 재배하였다.

Changes in daily maximum, mean, minimum air temperatures in cultured region and shaded green house during ginseng sprout cultivation after transplanting seedling. Tmin in region; minimum temperature in cultivated region, Tmax in region; maximum temperature in cultivated region, Tmean in region; mean temperature in cultivated region, Tmin in house; minimum temperature in cultivated house, Tmax in house; maximum temperature in cultivated house.
3. 지상부와 지하부의 생육 특정
재배일수별 새싹인삼의 잎과 줄기 부분인 지상부와 뿌리부분인 지하부의 생육 특성은 분리하여 Song 등 (2017) 및 Jeong 등 (2018)의 방법에 준하여 조사하였다. 잎에서 엽장과 엽폭은 중앙소엽에 대한 것을, 생체중은 5 잎 전부를 전자저울을 이용하여 측정하였고, 엽록소함량은 chlorophyll meter (SPAD-502, Konica Minolta Inc., Tokyo, Japan)를 이용하여 측정하였다. 줄기부분은 경장은 뇌두부분에서 잎자루 시작부위까지를, 경직경은 뇌두부분에서 2.0㎝ 떨어진 부위에 대한 지름을, 생체중은 뇌두부터 잎자루 시작부위까지를 절단하여 무게를 측정하였다. 지하부는 근장은 뇌두 부분부터 뿌리 가장 끝부분까지를, 근직경은 뇌두부분에서 1.2㎝ 떨어진 부분의 두께를, 생체중은 줄기 부분을 절단한 후의 무게를 조사하였다. 모든 시료는 하우스 내에 식재된 상토 1 상자에 식재된 80 포기의 새싹인삼을 모두 측정하여 평균값을 산출하였으며 반복 상자수는 3 상자를 조사하였다.
4. 진세노사이드 함량 분석
재배일수별로 수확된 새싹인삼은 동결건조한 후 분쇄하여 분석시료로 사용하였으며 Jeong 등 (2018)의 방법에 준하여 분석하였다. 분말시료 0.5 g에 70% 메탄올 10 ㎖을 가하여 3 시간 초음파 추출하여 원심분리한 다음 각각 membrane filter (0.20㎛ pore size, Whatman Co., Maidstone, England)로 여과, 액체크로마토그래프 (HPLC, Agilent 1200, Agilent Technologies Inc., Santa Clara, CA, USA)에 10㎕씩 주입하여 진세노사이드를 분석하였다.
분석에 사용한 칼럼은 YMC Pro C18 RS (YMC Co., Ltd., Kyoto, Japan)이었으며, 검출기는 photo diode array (PDA) detector (203㎚, Agilent 1200, Agilent Technologies Inc., Santa Clara, CA, USA)를 이용하여 분석하였고, 분석조건은 이 동상으로 용매 A (water)와 용매 B (acetonitrile)를 이용하여 용매 B를 0 분 (20%), 10 분 (20%), 25 분 (24%), 30 분 (33%), 42 분 (37%), 57 분 (80%), 58 분 (100%), 68 분 (60%), 70 분 (20%)의 조건하에 유속 1.0㎖/min으로 흘려주었다. 진세노사이드 표준시약으로는 Rg3 (Chengdu Biopurify Phytochemicals Ltd., Sichuan, China)등 20 종의 사포닌을 이용하였다 (Jo et al., 2011).
5. 총폴리페놀 함량 및 페놀산 함량 분석
총 폴리페놀함량은 Coseteng 과 Lee (1987)의 방법을 이용하여 실험하였다. 즉, 추출물의 일정량을 80% 에탄올을 10 배가하여 희석한 후 시료로 사용하였다. 그 희석액 1.0㎖에 folin-ciocalteu 시약 3.0㎖을 가하고 10 분간 방치한 다음 7.5% Na2CO3 1㎖을 첨가하여 30 분간 실온에 방치한 후 분광광도계로 760㎚에서 흡광도 측정하였고, 표준물질로는 tannic acid를 이용하여 환산 정량하였다.
페놀산은 Krygier 등 (1982)의 방법을 이용하여 유리형, 에스테르형 및 결합형의 phenolic acid를 추출 분리하였다. 우선 분말의 인삼 잎을 hexane으로 탈지 처리한 후 분석시료로 이용하였다. 즉 유리형은 탈지한 인삼 잎 10 g을 증류수로 3 회 반복 추출하여 추출액을 얻은 다음, 이 여과액을 1 N HCl을 이용하여 pH를 2.0으로 조정한 다음 diethylether : ethylacetate (1 : 1) 혼합액을 이용하여 phenolic acid를 분리 용출하였고, 에스테르형 phenolic acid는 분쇄한 인삼 잎을 물로 3 회 추출하여 얻은 여액에 NaOH를 첨가하여 최종 NaOH 농도가 2 N이 되도록 조절한 다음 실온에서 4 시간 이상 가수분해 시킨 후 가수분해 되어진 용액을 다시 HCl용액으로 pH가 2.0이 되도록 조절하여 유리형 phenolic acid를 분리 용출하는 방법과 동일하게 분리 용출하였으며, 결합형 phenolic acid는 유리형 phenolic acid를 추출하고 남은 잔사를 가지고 2 N의 NaOH 250㎖를 가하여 실온에서 가수분해 한 후 HCl용액으로 pH를 2.0으로 조절하여 유리형 phenolic acid를 분리 용출하는 방법과 동일한 방법으로 용출하였다.
각각 분리 용출하여 얻어진 phenolic acid를 30℃ 이하의 온도에서 감압 농축하여 건고한 다음 HPLC용 메탄올 용액으로 일정량 용해한 후 membrane filter (0.20㎛ pore size)로 여과하여 HPLC를 이용하여 분석하였다. 분석조건은 Zorbax SB-C18 (4.6 × 250㎜, 5㎛, Agilent Technologies Inc., Santa Clara, CA, USA) 칼럼을 장착한 HPLC (Agilent 1200 series system with DAD detector at 280㎚, 320㎚)을 이용하여 분석하였으며, 이동상으로 용매 A (1% acetic acid)와 용매 B (methanol)를 이용하여 용매 A를 0 분 (100%), 25분 (70%), 40 분 (40%), 50 분 (0%), 55 분 (100%)의 조건하에 유속 0.8㎖/min으로 흘려주었다.
6. 물성 측정
새싹인삼을 쌈 채소로 이용하기 위하여 잎 및 줄기 조직 부분의 경화가 일어나기 직전의 재배기간을 선정하기 위하여 물성을 측정하였다. 물성은 texture analyzer (TA-Plus, Lloyd Instruments Ltd., West Sussex, England)를 이용하여 loading cell 10㎏f, P 5 (5㎜ dia Cylinder Probe, Stainless steel)를 장착하여 test type TPA (texture profile analysis test) 프로그램 (Ametek Inc., Berwyn, PA, USA)을 이용하였다. 측정은 시료를 2 회 연속적으로 침입시켰을 때 얻어지는 force-time curve로부터 hardness를 포함하여 4 종의 물성적 특성값을 분석하였다.
분석조건은 probe; P5 (5㎜ dia Cylinder Probe, Stainless steel), test speed; 10㎜/min, distance; 50%, trigger type; 20㎏f으로 하였고. 각각의 새싹 잎, 줄기 및 뿌리의 측정 처리 수는 70 개로 하여 평균값으로 나타내었다.
잎 부분은 sample size; 2.0 × 2.0 × 2.0㎝의 크기로 자른 새싹 잎을 5 장씩 겹쳐서 물성을 측정하였으며 줄기는 뿌리 부분에서 1.5㎝ 떨어진 부분을 측정하였으며, 뿌리는 줄기가 나온 머리 부분에서 1.0㎝ 떨어진 부분을 측정하였다.
7. 통계처리
본 실험에서 얻어진 결과는 자료 처리는 SPSS program (12.0, SPSS Inc., Chicago, IL, USA)을 이용하여 실시하였으며, 각 항목에 대한 평균 (mean) 및 표준편차 (standard deviation, SD)를 산출하였다. 각 일수별에 의하여 재배된 재배일수별 차이는 p < 0.05 수준에서 One-way ANOVA를 실시하였으며, Duncan’s Multiple Range Test (DMRT)로 그 유의성을 검증하였다.
결과 및 고찰
1. 재배일수에 따른 지상부와 지하부의 생육 특성
묘삼을 상토에 이식 후 재배일수에 따른 새싹인삼의 지상부와 지하부의 생육의 변화를 조사한 결과 Fig. 2와 3과 같았다.
Fig. 1과 같이 이식 후 재배기간 동안 무가온 비닐하우스 내의 온도는 최저온도 10.2℃, 최고온도는 35.1℃으로 지역 내 최저기온보다 보온되어 2 - 3℃정도 하우스 내 온도가 올라가는 현상을 보여주었고, 최고온도는 광량을 차단하기 위하여 차광망을 설치하고 측면의 통풍 조건을 준 조건이어서 1 - 2℃정도의 최고온도를 낮출 수 있었다. 이는 Kim 등 (2017)이 차광처리에 의하여 2 - 3℃정도 최고온도를 낮출 수 있었다고 보고한 결과와 비슷한 경향을 보여주었다. 따라서 무가온 하우스에서 새싹인삼을 재배하는 기간 동안 인삼의 재배 생육적온을 크게 벗어나지 않았다.

Growth characteristics of leaf, stem and root on ginseng sprouts after transplanting seedling. (A); leaf, (B); chlorphyll contents of leaf, (C); stem, (D); root. Each value presents the means ± SD (n = 80), The different letters indicate a significant difference by Duncan’s Multiple Range Test (DMRT) (p < 0.05).

Growth status of leaf, stem and root on ginseng sprouts during cultivation after transplanting seedling. (A); 20days, (B); 30 days, (C); 40 days, (D); 50 days, (E); 60days.
지상부 잎의 엽록소함량 (SPAD value)은 재배일수 20 일째 31.7 ± 0.3에서 재배일수 60 일째 26.5 ± 0.2로 재배일수가 증가함에 따라 엽록소 함량이 감소하였고, 엽장 및 엽폭은 재배 20 일째 각각 4.02 ± 0.35㎝ 및 1.72 ± 0.22㎝에서 40 일째는 5.71 ± 0.68㎝ 및 2.72 ± 0.49㎝로 속도가 컸으나 50 일 이후는 미약하게 증가함을 볼 수 있었다. 이는 Fig. 1에서 보는 바와 같이 50 일 이후가 되는 7월 10일 경부터는 하우스 내 최고온도가 35℃를 웃돌아서 고온에 의하여 생육이 저해됨을 알 수 있었다.
줄기부분에서 경장은 재배일수 20 일부터 30 일까지는 7.24 ± 7.71㎝로 크게 증가하지 않다가 30 일째부터 크게 증가하여 40 일째 10.2 ± 0.96㎝로 크게 증가하였으며, 그 이후는 서서히 증가하는 경향이었고, 경직경은 재배기간 동안 1.66 - 2.04㎝로 서서히 증가하는 경향이었다.
뿌리 부분에서는 근직경만 20 일째 4.84 ± 0.60㎝에서 30 일째 4.65 ± 0.52㎝로 미약하게 감소하다가 그 이후는 증가하는 경향이었으며, 근장의 길이는 거의 증가하지 않음을 볼 수 있었다. 또 잎, 줄기 및 뿌리의 무게는 모두 증가는 미약하게 하였으나 유의성은 인정되지 않을 정도로 중량의 변화는 크지 않았다. 이는 Jang 등 (2018) 수확시기별로 새싹삼의 생육을 본 결과 이식 후 20 일까지는 잎과 줄기부분의 생체중이 크게 증가하다가 그 이후는 미약하게 증가하는 경향이었으며 뿌리는 30 일까지는 약간 감소하다가 40 일 이후부터 증가하였다고 보고한 것과 비슷한 경향을 보였다.
엽록소 함량은 재배 40 일까지 거의 변화가 없는 경향이었다가 그 이후는 감소하는 경향으로 본 실험결과와는 약간의 차이를 보였으며 재배일수가 길어질수록 감소하는 결과는 비슷한 결과를 보여주었다. 이는 하우스 내에서 광원종류 및 광량을 LED로 조절함에 있어 광량 및 조사되는 거리 등이 하우스 내에서 새싹인삼이 생육하면서 광량을 받는 정도가 달라짐에 따라 재배 시 엽록소의 함량변화에 영향을 주는 것으로 생각되며 이는 앞으로 새싹인삼을 하우스에서 재배할 경우 생육정도에 따라 광량 조절이 필요할 것으로 생각된다.
2. 진세노사이드 조성 및 함량
묘삼을 상토에 이식 후 재배일수에 따른 새싹인삼의 부위별 진세노사이드 의 함량을 분석한 결과 Table 1과 같다.
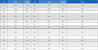
Changes of ginsenosides composition in leaf, stem and root on ginseng sprouts after transplanting seedling. (Unit: ㎎/g, dry basis)
새싹인삼의 잎 부분에서는 재배일수가 20 일에서 40 일까지는 총 진세노사이드 함량이 116.64㎎/g에서 124.60㎎/g으로 증가하는 경향이었고 그 이후는 크게 증가하지 않는 것을 볼 수 있었다. 새싹 잎의 주된 사포닌은 Re와 Rd로 각각 40㎎/g의 함량 이상이었으며 Re는 재배 40 일까지 크게 변함 없다가 50 일 이후 증가하는 것을 볼 수 있었고, Rd는 40 일까지 조금씩 증가하다가 그 이후부터는 감소하는 경향을 보여주었다. 그 다음으로 많은 함유하고 있는 Rb2와 Rg1는 재배 일수가 증가할수록 미량 증가하는 경향을 보였다. 새싹인삼의 뿌리부분의 진세노사이드 총 함량과 뿌리부분에 가장 많이 함유하고 있는 Re의 함량은 잎 부분과는 달리 감소하는 경향을 보였다.
이는 Choi 등 (2009)이 채취시기별에 따른 인삼 지상부 중 잎 부분의 진세노사이드 조성 및 함량을 분석한 결과와 Kim 등 (2011)이 인삼의 잎을 이용하기 위하여 잎이 황화되기 전의 수확기에 수확된 인삼 부위별 진세노사이드 함량을 본 결과 주된 진세노사이드는 Re이었다고 보고한 것과는 같은 결과를 보여주었으나, 그 다음의 주된 진세노사이드는 4 월 초순에 수확된 잎 중 Rb1, Rd라고 보고한 것 (Choi et al., 2009)과, 10 월 중순에 수확된 잎 중 Rd라고 보고한 것 (Kim et al., 2011)을 보면 인삼 잎 중의 진세노사이드가 재배 기간이 길어질수록 Rd는 감소하는 경향을 보여주어 잎 중에서 재배일수가 길어질수록 가장 많이 함유되어있는 Re를 제외하고는 감소하는 경향을 보여주었다.
본 연구결과, 새싹인삼을 이용하기 위한 것으로 잎과 줄기가 경화되기 전이기 때문에 Rd 함량이 높은 것으로 보였지만 재배일수가 60 일이 되었을 때 급격히 감소하는 것을 볼 수 있었다.
3. 페놀산 조성 및 함량
묘삼을 상토에 이식 후 재배일수에 따른 새싹인삼의 부위별 페놀산 조성 및 함량을 분석한 결과 줄기와 뿌리 부분에서는 페놀산 함량이 정량되지 않았으며 잎에서는 Table 2와 같았다.
인삼 잎에서 페놀산 함량은 ester형 페놀산이 가장 많이 함유되어 있었으며 결합형과 유리형의 페놀산은 총 함량에서는 거의 비슷한 수준으로 함유되어 있었다. 에스테르형 페놀산 중 sinapic acid가 가장 많이 함유되어 있었으나 재배일수가 40 일까지 증가할수록 감소하는 경향이었고 그 이후는 거의 비슷한 함량을 보이는 반면에 p-coumaric acid와 ferulic acid는 재배일수가 증가할수록 증가하는 경향을 보여 총 페놀산함량은 40 일까지는 감소하다가 그 이후에 증가하는 경향을 보여 주었다. 결합형과 유리형 페놀산의 가장 많이 함유된 페놀산은 각각 sinapic acid와 gentisic acid이었으며 이들도 재배일 수가 길어질수록 미비하게 감소하는 경향을 보였으나 총 함량은 거의 변화가 없을 정도이었다.
Lee 등 (2010)에 의하면 인삼 수확기인 10 월 중순에 수확한 인삼 잎에서 주된 페놀산은 ferulic acid이었으며 ester형과 free형에서 각각 50.7㎎·%와 12.6 ㎎·%를 함유하고 있었다고 보고한 바에 의하면 새싹인삼에서의 페놀산 함량은 재배 60 일째 각각 1.232㎎/g (123.2㎎·%)과 0.021㎎/g으로 ester형의 ferulic acid은 일반 인삼 잎보다 상당히 높았으며, free형의 ferulic acid은 상당히 낮음을 볼 수 있었다. 또한 총 함량으로 볼 때도 새싹인삼이 4.63 - 4.03㎎/g으로 일반 인삼 잎의 총 함량 93.7㎎·%보다 (Lee et al., 2010) 높은 것을 볼 수 있었다.
4. 물성
일반적으로 묘삼을 상토에 이식한 후 새싹인삼의 잎, 줄기 및 뿌리 부분을 다 식용하기에 적절한 최소한의 크기로 재배할 경우 재배일수가 20 일이었으나, 그 크기가 작아서 수확량이 낮아 비효율적이며, 또 재배일수에 상관없이 무한정으로 재배할 경우에는 새싹인삼의 줄기부분이 경화되어 새싹인삼으로서의 가치가 떨어져 소비자들의 기호도가 낮아지는 경향을 볼 수 있다.
따라서 잎, 줄기 및 뿌리 부분 모두 식용하기에 적절한 경도와 씹힘성이 될 정도의 가장 적절한 재배일수를 확립시켜 줄 필요가 있다. 이에 재배일수에 따른 새싹인삼의 물성 중 hardness, chewiness, springiness 및 stiffness를 측정해 본 결과 Table 3과 같았다.

Changes of hardness, chewiness, springiness and stiffness in leaf, stem and root of ginseng sprouts after transplanting seedling.
새싹인삼의 잎에서 hardness는 재배일수가 30 일까지는 오히려 감소하다가 그 이후는 크게 변함이 없었고, chewiness는 재배일수에 크게 영향을 미치지 않았으나 springiness는 재배일수 50 일째 까지 증가하다가 그 이후는 감소하는 경향이었으며 stiffness는 재배일수 40 일째 까지 증가하다가 그 이후는 감소하는 경향이었다. 새싹인삼의 줄기에서는 hardness, chewiness, springiness 및 stiffness 모두 재배일수가 증가할수록 증가하는 경향이었다. 뿌리 부분에서는 hardness는 재배일수가 30 일까지는 오히려 감소하다가 그 이후는 증가하는 경향이었는데 재배 40 일 이후부터는 급격히 증가하는 것을 볼 수 있었고, chewiness와 stiffness는 30 일째 급격히 감소하다가 그 이후에 증가하는 것을 볼 수 있었다. 새싹인삼을 재배할 때 재배일수가 증가함에 따라 잎과 줄기부분은 체형은 커지는 반면에 뿌리 부분은 증가하지 못하는 것을 볼 수 있다 (Fig. 2).
이는 뿌리 부분이 상토에서 재배되는 동안 외부로부터의 양분을 추가적으로 주지 않기 때문에 뿌리 부분에 있는 각종 영양소가 재배일수 30 - 40 일 사이에는 지상부의 성장에 소모되기 때문으로 뿌리의 물성이 일시적으로 감소하는 경향인 것으로 판단되고, 재배일수 40 일 이후부터 는 새싹인삼에서 지상부인 잎의 크기가 커짐에 따라 광합성작용이 이루어짐으로써 뿌리 부분도 다시 물성이 증가하는 것으로 생각된다.
이상의 특성으로 보아 새싹인삼에 대한 소비자들의 가장 큰 관심은 잎, 줄기 및 뿌리를 다 섭취하는 것인데 이 세부분 중에 걸림돌이 줄기부분의 경화임을 볼 수 있었다.
본 조사에서 줄기부분의 hardness, chewiness, springiness 및 stiffness는 재배일수가 증가함에 따라 커짐을 볼 수 있었고 hardness와 stiffness가 각각 2.0 kgf 및 8.0 kgf/㎜이상인 줄기 부분에서 손으로 줄기부분을 잡아서 조직도를 볼 경우 줄기가 경화된 것으로 볼 수 있었다. 따라서 새싹인삼을 쌈 채소용으로 시장에 내놓을 경우 줄기부분이 경화되지 않은 새싹인삼이 필요함을 알 수 있었고, 이와 같은 새싹인삼을 재배고자 할 때 무가온 비닐하우스에서 재배할 경우 본 실험에서의 조건에서는 40 일 정도가 물성적인 면에서 가장 좋은 것을 알 수 있었다.
그러나 비닐하우스에서 무가온으로 할 경우 5 월 말 이전에 이식할 경우이라면 이식 후 야간 온도가 낮을 경우 생육이 정지되는 현상을 볼 수 있었고, 7 월 이후에 이식할 경우는 주간온도가 너무 높아짐으로서 생육이 불량해 질 수 있어서 재배시기에 따라 성장의 속도가 다른 것을 알 수 있었기 때문에 기상변화에 따라 재배일수는 어느 정도의 가감이 필요할 것으로 생각된다. 특히, 무가온 비닐하우스에서 재배할 경우 차광망 설치에 의한 광량 및 온도 조절이 꼭 필요할 수 있으며, 앞으로 기온의 상승변화에 따라 특별한 환경을 설치하지 않을 경우는 수확시기를 앞당겨서 재배할 필요도 있을 것으로 생각된다.
5. 새싹인삼 재배 시 재배 특성 및 물성 간의 상관관계
차광망이 설치된 무가온 비닐하우스에서 묘삼을 이식 후 새싹인삼을 재배시킬 때, 새싹인삼의 잎, 줄기 및 뿌리 부분에 대한 재배 특성 및 물성 간의 상관관계를 조사하였다 (Table 4).
재배기간에 따른 재배적 특성에는 잎과 줄기부분은 엽중, 엽장 및 엽폭 모두 높은 상관관계를 보여주었으나 뿌리 부분은 무게와 직경은 약간 높은 상관관계를 보이고 근장은 크게 상관관계를 보이지 않았다.
물성적인 특성에서는 잎은 hardness와 chewiness는 음의 상관관계를, springiness와 stiffness는 양의 상관관계를 보였고 줄기는 물성 모두 양의 높은 상관관계를, 뿌리 부분에서는 hardness만 양의 상관관계를 보여주어 이는 시각적으로 판단할 때와 비슷한 경향을 보여주었다. 이와 같이 무가온 비닐하우스에서 묘삼을 이용하여 새싹인삼을 재배할 경우 새싹인삼의 물성적 품질에 가장 민감한 부분이 줄기임을 볼 수 있었으며 줄기부분이 경화가 시작되기 전인 40 일째 까지 재배하는 것이 가장 품질이 좋은 새싹인삼을 수확할 수 있었다.
REFERENCE
-
Cho, GY, Park, HM, Kwon, LK, Cho, SA, Kang, BY, and Kim, YB., (2015), Preliminary research on the effect of cosmetic containing ginseng extract on quality of life of healthy women based on skindex-16, Journal of the Society of Cosmetic of Korea, 41, p333-340.
[https://doi.org/10.15230/scsk.2015.41.4.333]

-
Choi, JE, Lee, NR, Jo, SR, Kim, JS, and Choi, YK., (2012), Effects of various bed soil substrates on the growth and yield of 2-year-old ginseng grown in the closed plastic house, Korean Journal of Medicinal Crop Science, 20, p217-221.
[https://doi.org/10.7783/kjmcs.2012.20.4.217]

- Choi, JE, Li, X, Han, YH, and Lee, KT., (2009), Changes of saponin contents of leaves, stems and flower-buds of Panax ginseng C. A. Meyer by harvesting days, Korean Journal of Medicinal Crop Science, 17, p251-256.
-
Coseteng, MY, and Lee, CY., (1987), Change in apple polyphenoloxidase and polyphenol concentrations in relation to degree of browning, Journal of Food Science, 52, p985-989.
[https://doi.org/10.1111/j.1365-2621.1987.tb14257.x]

- Jang, IB, Yu, J, Suh, SJ, Jang, IB, and Kwon, KB., (2018), Growth and ginsenoside content in different parts of ginseng sprouts depending on harvest time, Korean Journal of Medicinal Crop Science, 26, p205-213.
- Jeon, JM, Choi, SK, Kim, YJ, Jang, SJ, Cheon, JW, and Lee, HS., (2011), Antioxidant and antiaging effect of ginseng berry extract fermented by lactic acid bacteria, Journal of the Society of Cosmetic of Korea, 37, p75-81.
- Jeong, DH, Lee, DY, Jang, IB, Yu, J, Park, KC, Lee, EH, Kim, YJ, and Park, HW., (2018), Growth and ginsenoside content of one year old ginseng seedlings in hydrophonic culture over a range of days after transplanting, Korean Journal of Medicinal Crop Science, 26, p464-470.
- Jo, HK, Sung, MC, and Ko, SK., (2011), The comparison of ginseng prosapogenin composition and contents in red and black ginseng, Korean Journal of Pharmacognosy, 42, p361-365.
-
Jun, SY, Kim, TH, and Hwang, SH., (2012), The consumption status and preference for sprouts and leafy vegetables, Korean Journal of Food Preservation, 19, p783-791.
[https://doi.org/10.11002/kjfp.2012.19.5.783]

- Kim, DS, and Lee, KB., (2010), Physiological characteristics and manufacturing of the processing products of sprouts vegetables, Korean Journal of Food Cook Science, 26, p238-245.
-
Kim, GH, Seong, BJ, Kim, SI, Han, SH, Kim, HH, and Lee, KS., (2011), Yield and quality characteristics of ginseng’s first byproducts, Korean Journal of Medicinal Crop Science, 19, p313-318.
[https://doi.org/10.7783/kjmcs.2011.19.5.313]

- Kim, IS, Han, SH, and Han, KW., (1997), Study on the chemical change of amino acid and vitamin of rapeseed during germination, Journal of Korean Society of Food Science and Nutrition, 26, p1058-1062.
-
Kim, KP, Kim, KH, and Yook, HS., (2016), Quality characteristics of castella with Panax ginseng sprout powder, Journal of Korean Society of Food Science and Nutrition, 45, p711-716.
[https://doi.org/10.3746/jkfn.2016.45.5.711]

- Kim, MH, Song, BM, and Choi, EY., (2017), Determination of growth, yield and carbohydrate content of Allium hookeri grown under shading treatment, Korean Journal of Medicinal Crop Science, 25, p397-403.
- Krygier, K, Sosulski, F, and Hogge, L., (1982), Free, esterified, and insoluble-bound phenolic acids. Part 1: Extraction and purification procedure, Journal of Agricultural and Food Chemistry, 30, p330-334.
- Lee, HE, Lee, JS, Choi, JW, Pae, DH, and Do, KR., (2009), Effect of mechanical stress on postharvest quality of baby leaf vegetables, Korean Journal of Food Preservation, 16, p699-704.
-
Lee, KS, and Park, GS., (2014), Studies in the consumption and preference for sprout vegetables, Journal of East Asian Society of Dietary Life, 24, p896-905.
[https://doi.org/10.17495/easdl.2014.12.24.6.896]

- Lee, KS, Seong, BJ, Kim, GH, Kim, SI, Han, SH, Kim, HH, and Baek, ND., (2010), Ginsenoside, phenolic acid composition and physiological significances of fermented ginseng leaf, Journal of Korean Society of Food Science and Nutrition, 39, p1194-1200.
- Ministry of Food and Drug Safety(MDFS), (2015), Standards and specifications of health functional foods, Ministry of Food and Drug Safety, Cheongju, Korea.
- Ministry of Food and Drug Safety(MDFS), (2017), Standards and specifications of health functional foods, Ministry of Food and Drug Safety, Cheongju, Korea.
- Song, BH, Wu, WG, Kim, DH, and Chung, JW., (2017), Comparative analysis of genetic relationships by quanitative characters and their characteristics in germplasm of Panax ginseng C. A. Meyer collected in Korea and China, Korean Journal of Medicinal Crop Science, 25, p381-388.
- Xie, JT, Lin, E, Wang, CZ, and Yuan, CS., (2004), Constituents and effects of ginseng leaf, Oriental Pharmacy and Experimental Medicine, 4, p1-8.
-
Yahara, S, Kaji, K, and Tanaka, O., (1979), Further study on dammarane-type saponins of roots, leaves, flower-buds, and fruits of Panax ginseng C. A. Meyer, Chemical and Pharmaceutical Bulletin, 27, p88-92.
[https://doi.org/10.1248/cpb.27.88]
