
식물 유래 항암제와 생산 개선을 위한 식물 합성생물학 연구 동향
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Plants are rich in phytochemicals, and their bioactive compounds have been employed in traditional medicine since ancient times. A variety of medicinal plant species and phytochemicals have been used to treat a wide range of chronic diseases, most notably, cancer.
As the global prevalence of cancer increases, numerous investigations are being carried out to develop phytochemical-based medicines. For example, paclitaxel, camptothecin, vinca alkaloids, and podophyllotoxin are US Food and Drug Administration (FDA)-approved anticancer drugs derived from plants. However, plants contain only trace amounts of phytochemicals, which makes it difficult to supply them continuously. Moreover, their complicated structures hinder their ability to produce large quantities of chemicals for commercial use. Recently, researchers have developed a number of biotechnological platforms to enhance the production of phytochmicals.
In this review, we summarize the current status of four FDA-approved anticancer drugs derived from plants and provide plant biotechnology strategies, including synthetic biology, to facilitate their production.
Keywords:
Anticancer Drugs, Camptothecin, Paciltaxel, Phytochemicals, Plant, Podophyllotoxin, Synthetic Biology, Vinblastine서 언
2018년 전 세계적으로 1,810 만 건의 암 발병이 일어났고, 2030년까지 2,360 만 건으로 증가할 것으로 예상되는 등, 암은 전 세계적으로 주요 사망원인 질병 중 하나이다 (Bray et al., 2018; Choudhari et al., 2020).
암 진행의 분자적인 메커니즘 규명 연구 결과들을 통해 수많은 항암제 후보 물질들이 개발되었으며 (Choudhari et al., 2020), 1940년부터 2014년까지 승인된 항암제의 약 50%가 식물의 천연물에서 유래하여 제조되었다 (Newman and Cragg, 2016; Choudhari et al., 2020). 현재까지 식물에서 자연적으로 만들어지는 천연화학물질인 피토케미컬 (phytochemical)과 유도체로부터 암 치료 효율을 높이고 부작용을 줄일 수 있는 유망한 화합물을 찾고자 지속적인 연구들이 수행되었다 (Rong et al., 2020; Garcia-Oliveira et al., 2021).
일반적으로 의약품 개발에 활용할 수 있는 약리학적, 생물학적 활성을 갖는 천연물은 항산화, 항염증, 항암 등 다양한 효능을 보이고, 이는 주로 생물학적 활성 유도 분리를 통해 중요한 약물의 발견으로 이어졌다 (Lahlou, 2007). 이를 통해 아스피린, 모르핀 등과 같은 대부분의 초기 의약품 개발의 기초가 되었다 (Butler, 2004; Lahlou, 2013). 현재까지 미국 식품의약국 (food and drug administration, FDA, Silver Spring, MD, USA)의 승인을 받아 상용화된 식물의 천연물 유래의 대표적인 항암제로는 파클리탁셀 (paclitaxel), 캄토테신 (camptothecin), 빈카 알칼로이드 (vinca alkaloids)와 포도필로톡신 (podophyllotoxin)이 있다 (Sun et al., 2017; Oyenihi et al., 2021).
이러한 천연물 유래 항암제는 자유라디칼 제거 (Lee et al., 2013), 종양 침습성과 혈관 신생합성 감소 (Lu et al., 2018), 악성 세포 생존 및 증식 억제 (Yan et al., 2018) 등을 통해 발암을 지연시키는 등 항암 메커니즘을 가지며 (Choudhari et al., 2020), 시험관 및 생체 내에서 항암 효능에 대해 검증되었다.
천연물 유래 항암제의 경우 유한한 자원으로부터의 화합물 공급과 매우 적은 양으로 인하여 지속적인 공급에 한계가 있으며, 2022년도에 미국에서 조사한 결과에 따르면 앞서 언급한 4 종 항암제의 경우 매년 수요는 증가하고 있지만, 의약품 부족 문제도 증가하고 있어 치료에 악영향을 미치고 있다 (McBride et al., 2022). 이를 극복하기 위하여 전합성 (chemical synthesis) 방법이 개발되었지만, 천연물들의 복잡한 구조로 인하여 전합성에 많은 합성 단계와 비싼 화학물질들이 필요하고, 반응 조건의 어려움뿐만 아니라 산업적 규모로 생산하기에는 낮은 생산량 등의 어려움을 갖고 있다 (Hezari and Croteau, 1997; Lahlou, 2007).
따라서 이러한 의약품의 산업적 생산은 여전히 식물자원을 재료로 하여 직접 최종 물질을 추출하거나 혹은 식물에서 추출한 핵심 전구체로부터 화학반응을 통해 최종 물질로 전환하는 반합성 (semi-synthesis) 방법을 통해 이루어지고 있다 (Courdavault et al., 2021). 반합성 방법은 최종 물질을 더 높은 수율로 추출할 수 있다는 장점이 있지만 (Lahlou, 2007), 이는 물질 공급을 위하여 여전히 식물이 사용됨을 의미함으로 식물자원의 공급량 혹은 천연물의 생산량 증진을 위한 관심이 증대되고 있다.
식물에서 천연물의 낮은 함유량과 더불어 화학 합성의 어려움을 극복하기 위하여, 세포·조직배양이나 유전자 도입을 통한 생산량 증진 방법을 통해 식물 유래 천연물 의약품의 생산을 구현하는 연구들이 이루어지고 있다 (McCoy and O'Connor, 2008; Pant, 2014; Lu et al., 2016; Courdavault et al., 2021).
이러한 연구들은 최근 차세대 염기서열 분석 기술의 발달과 함께 다양한 식물자원의 오믹스 데이터의 축적과 더불어 천연물 생합성 유전자 예측과 기능 규명 등으로 가능해졌고 (Courdavault et al., 2021; Younessi-Hamzekhanlu et al., 2022), 이를 활용하여 다양한 부품들을 조합하여 새로운 기능을 갖거나 기존보다 효율적인 생물 시스템을 설계하는 합성생물학 연구도 발달하게 되었다 (Liu and Stewart, 2015; Pouvreau et al., 2018).
예를 들어 천연물 생산 유전자들을 선발하면, 이들을 이용하여 천연물 대사경로를 재설계하고 새롭고 다양한 이형 기주 시스템에 도입시켜 천연물을 생산할 수 있다. 합성생물학 연구에서 이형 기주 시스템으로는 성장이 빠르고 대사경로 조절이 가능한 미생물과 식물이 활용되고 있다 (Mutanda et al., 2021).
특히 식물은 천연물과 같은 이차대사산물을 생산하기 위해 스스로 햇빛과 CO2를 이용하고, 동일한 세포소기관, 보조인자 (cofactor)와 전구체들을 공유하므로 미생물에서 장애물로 여겨지는 천연물 생합성에 주요 효소인 cytochrome P450s (CYP450s)의 쉽고 안정적인 발현 등으로 인하여 미생물보다 효율적인 생산 시스템으로 여겨진다 (Christ et al., 2019).
또한 기존의 재조합 DNA 기술에서 합성생물학으로의 기술발전은 이형 기주 시스템에서 최적화된 대사경로의 발현, 효소들의 촉매반응 촉진 및 높은 기질 특이성 등을 개선한 대사경로 재설계를 가능하게 하였고 (Mutanda et al., 2021), 식물에서도 이차대사물질 대량 생산을 통해 산업적으로 응용할 수 있다는 가능성을 제시하였다.
본 총설에서는 현재 미국 FDA로부터 승인받아 상용화되어 사용 중인 4 종의 식물 유래 천연 항암제들인 파클리탁셀, 캄토테신, 빈카 알칼로이드와 포도필로톡신을 소개하고, 이들의 생합성 경로와 식물에서 생산성 증진을 위하여 수행된 연구와 합성생물학 방법에 대한 자세한 정보를 제공하고자 한다.
1. FDA-승인 식물 유래 항암제와 생합성 경로
파클리탁셀은 태평양 주목나무 (pacific yew, Taxus brevifolia)의 껍질과 잎에서 분리된 식물 유래 천연 항암제로, 탁솔 (taxol)이라고 명명되어 판매되고 있다 (Fig. 1).

Food and drug administration (FDA)-approved plant-derived anticancer drugs.(A) Illustrations of plant species that produce anticancer drugs. (B) Chemical structure of paclitaxel, camptothecin, vinblastine, vincristine, and podophyllotoxin.
파클리탁셀은 1992년 미국 FDA에서 최초로 승인받은 난소암 치료제로 (Swain et al., 1995), 유방암, 췌장암, 전립선암 및 폐암 치료에 사용된다 (Choudhari et al., 2020). 파클리탁셀은 미세소관의 안정화 및 분해 방지를 통해 암세포의 사멸을 유도한다 (Schiff et al., 1979).
이는 측쇄구조 (side chain)의 C2-벤조일기와 β-튜불린의 상호 작용에 의해 유도되며 (He et al., 2000; Kingston, 2000), 파클리탁셀이 유도하는 유사분열 정지는 염색체의 양극성 부착을 유지하는 키네토코어 (kinetochore)의 긴장을 감소시키고 (Weaver, 2014), 유사분열 중기에서 후기로의 세포 분열을 억제한다 (Kelling et al., 2003).
최근에는 대식세포, 조절 T세포, NK세포 등 면역세포의 조절을 통해 암세포를 사멸시킬 수 있다는 연구 결과도 보고되었다 (Zhu and Chen, 2019).
파클리탁셀의 세계 시장 규모는 2019년 110 백만 달러부터 2025년 152 백만 달러까지 연평균성장률 8.2%로 성장할 것으로 예상된다 (Sabzehzari et al., 2020). 하지만, 암 환자 한명에게 필요한 파클리탁셀의 양은 2 g - 3 g이지만, 주목나무 한 그루로부터 추출 가능한 파클리탁셀의 양은 2 ㎎ 정도로 그 양은 매우 부족하다 (Sabzehzari et al., 2020).
파클리탁셀의 생산은 주목나무의 세포배양을 통한 생산 방법, 전합성과 baccatin Ⅲ로부터 파클리탁셀로 전환하는 반합성 방법 등을 통해 이루어지지만, 생산량을 효율적으로 증진시키는 것이 가장 큰 과제이다. 주목속 (Taxus) 식물체의 느린 성장과 자원 부족 등으로 인해 식물체로부터의 직접적인 추출로는 증가하는 시장의 수요를 충족시키기에 충분하지 않다 (Priyadarshini and Keerthi, 2012). 현재 이러한 문제점을 해결하기 위한 생명공학 기술을 이용한 연구가 다양하게 진행되고 있다 (Sabzehzari et al., 2020).
파클리탁셀은 테르페노이드의 전구체인 isopentenyl pyrophosphate (IPP)와 dimethylallyl diphosphate (DMAPP)의 합성을 시작으로, 파클리탁셀의 탄소 고리 골격이자 파클리탁셀의 주요 전구체인 baccatin Ⅲ의 합성과 측쇄구조의 합성을 포함하는 총 3 단계를 통해 생합성된다 (Fig. 2).
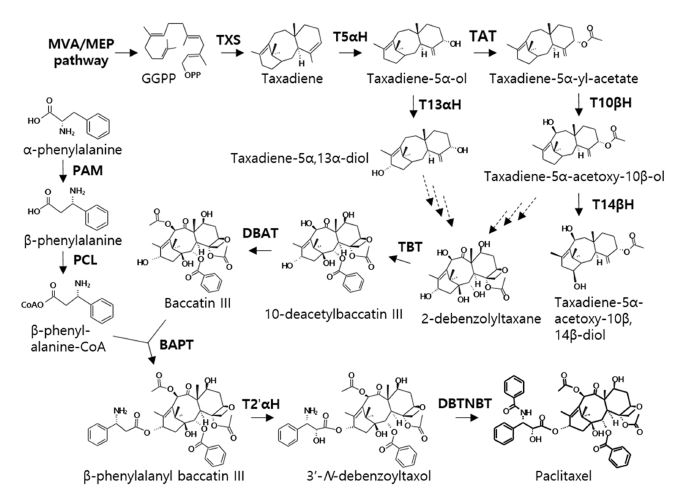
Biosynthetic pathway of paclitaxel.The dashed arrow indicates unidentified steps. MVA; mevalonate, MEP; methylerythritol phosphate, GGPP; geranylgeranyl diphosphate, TXS; taxadiene synthase, T5αH; taxadiene-5α-hydroxylase, TAT; taxadien-5α-ol-O-acetyltransferase, T13αH; taxadiene-13α-hydroxylase, T10βH; taxadiene-10β-hydroxylase, T14βH; taxadiene-14β-hydroxylase, PAM; phenylalanine aminomutase, PCL; β-phenylalanine-CoA ligase, TBT; taxane-2α-O-benzoyltransferase, DBAT, 10-deacetylbaccatin III 10-O-acetyltransferase, BAPT; baccatin III amino phenylpropanoyl-13-O-transferase, T2'αH; taxane-2'α hydroxylase, DBTNPT; 3’-N-debenzoyltaxol 3’-N-benzoyltransferase.
먼저 메발론산 (mevalonate, MVA)과 비메발론산 (methyl erythritol phosphate, MEP) 경로를 통해 합성된 IPP와 DMAPP는 엽록체에서 geranylgeranyl diphosphate synthase (GGPPS)에 의해 geranylgeranyl diphosphate (GGPP)로 전환된다. GGPP는 taxadiene synthase (TXS)에 의해서 taxadiene으로 전환되고 (Zerbe and Bohlmann, 2015), taxadiene은 taxadiene-5α-hydroxylase (T5αH)에 의하여 C-5 위치에 수산화 기능기 (Hydroxyl group, -OH)가 결합된 형태의 taxadien-5α-ol로 전환된다 (Hefner et al., 1996). 그리고 taxadien-5α-ol-O-acetyltransferase (TAT)에 의해 taxadien-5α-ol이 taxadien-5α-yl-acetate로 전환된다 (Walker et al., 2000). Taxadien-5α-yl-acetate는 cytochrome P450인 taxane 10β-hydroxylase (T10βH)에 의한 수산화 반응을 통해서 C-10 위치에 수산화 기능기가 결합됨으로 인하여 taxadien-5α-acetoxy-10β-ol이 만들어진다 (Schoendorf et al., 2001).
Taxadien-5α-ol은 taxane 13α-hydroxylase (T13αH)에 의해 taxadiene-5α,13α-diol로 전환되고, taxadien-5α-acetoxy-10β-ol 은 taxadiene 14β-hydroxylase (T14βH)에 의하여 taxadien-5α-acetoxy-10β,14β-diol로 전환된다. 그 후로, C-1, C-2, C-4, C-7 and C-9 위치에 수산화 반응과 C-4, C-5 위치에 에폭시화 (epoxidation) 반응 등을 통해서 2-debenzoyltaxane이 만들어진다. Taxane 2α-O-benzoyltransferase (TBT)는 2-debenzoyltaxane으로부터 10-deacetylbaccatin III (10-DAB)로의 전환을 촉매시킨다 (Walker and Croteau, 2000b). 10-DAB는 10-deacetylbaccatin III 10-O-acetyltransferase (DBAT)에 의하여 baccatin III로 전환된다 (Menhard and Zenk, 1999; Walker and Croteau, 2000a).
파클리탁셀의 의약적 활성을 위하여 중요한 C-13 측쇄 구조는 phenylalanine aminomutase (PAM)에 의한 α-phenylalanine에서 β-phenylalanine으로 전환을 통해 시작되고 (Walker et al., 2004), β-phenylalanine-CoA ligase (PCL)에 의해 측쇄 구조를 갖춘 β-phenylalanine-CoA가 만들어진다. β-phenylalanine-CoA와 baccatin III의 결합은 baccatin III amino phenylpropanoyl-13-O-transferase (BAPT)에 의하여 촉매되어 beta-phenylalanyl baccatin III가 만들어진다. 그리고 taxane 2'α hydroxylase (T2'αH)에 의해 C-2' 위치에 수산화 기능기가 결합된 N-debenzoyltaxol이 만들어지고, 마지막으로 taxane N-debenzoyltransferase (DBTNBT)에 의해 파클리탁셀이 생성된다 (Tong et al., 2021).
전반적으로 2-debenzoyltaxane으로부터 파클리탁셀까지의 생합성 경로는 잘 규명되어있으나 (Sabzehzari and Naghavi, 2019), 특정 수산화 반응과 에폭시화 단계에 관여하는 효소들과 중간 전구체들에 대한 정보는 아직까지 명확하지 않으며, 이는 앞으로 규명되어야 한다.
캄토테신은 1966년 미국 국립 암 연구소 (National Cancer Institute, NCI, Bethesda, MD, USA)에서 희수나무 (Camptotheca acuminata)의 껍질에서 추출한 물질로 항암제로써 활성이 보고되었다 (Wall et al., 1966).
니사나무속의 낙엽고목인 희수나무는 중국에서 예로부터 암치료를 위한 한약재로 사용되었으며, 특히 줄기와 수피에는 여러 종류의 알칼로이드 계통의 화합물이 있는 것으로 알려져 있다 (Bae et al., 2009). 그 중에서도 캄토테신은 모노터펜 인돌알칼로이드 (monoterpene indole alkaloid, MIA) 계열의 화합물로 43 개의 식물 종에서 캄토테신이 생산된다고 알려져 있으며 (Pu et al., 2019), 희수나무, Nothapodytes nimmoniana, Ophiorrhiza pumila가 대표적인 캄토테신 생산 식물로 알려져 있다 (Fig. 1).
캄토테신은 DNA 복제 시에 필수적인 효소인 토포아이소머 라아제 I (topoisomerase I)에 선택적으로 작용한다. 즉, 토포 아이소머라아제 I에 의한 DNA 재결합을 억제하여 DNA 이 중사슬 손상을 통해 결국 세포사멸을 유도하는 항암 활성을 나타낸다 (Liu et al., 2015).
캄토테신 천연 화합물은 수용성이 낮고 부작용을 초래한다고 보고되어 치료용으로 적합하지 않았지만, 난용성과 부작용 등이 개선된 반합성 캄토테신 유도체들인 irinotecan (Camptosar®, 1994년)과 topotecan (Hycamtin®, 1996년)이 미국 FDA로부터 승인되어 대장암, 직장암과 난소암 등의 치료에 사용 중이다 (Fig. 1). 그 후, 한국 제약회사 (종근당)에서 개발한 belotecan (Camtobell®)이 2003년 한국에서 승인되어 난소암과 소세포폐암 치료에 사용되고 있다 (Bailly, 2019).
캄토테신 유도체들의 세계 시장 규모는 연간 10 억 달러에 달하고 있으며, 앞으로 급속하게 성장할 것으로 예상된다 (Asano et al., 2009). 캄토테신은 화학구조가 복잡하여 화학 합성이 어렵기 때문에, 항암제로 사용되는 irinotecan, topotecan과 belotecan은 주로 희수나무와 N. nimmoniana 같은 천연 나무로부터 추출한 캄토테신에 의존하여 상업적으로 생산된다 (Kai et al., 2015).
하지만 이들 식물도 긴 생육 주기와 캄토테신의 낮은 함량 (희수나무 어린잎, 4 ㎎/g - 5 ㎎/g 건조 중량)으로 지속적인 캄토테신 공급에 어려움이 있다 (Lorence and Nessler, 2004). 세계 시장에서는 연간 3,000 ㎏의 캄토테신이 필요하지만, 생산량은 연간 600 ㎏ 정도로 증가하는 캄토테신의 수요를 맞출 수가 없다 (Raveendran, 2015). 이를 해결하고자, 캄토테신 함량이 높은 신규 식물 종을 발굴하거나 캄토테신을 대량 생산하기 위하여 조직배양과 캄토테신 생산 내생균 (endophytic fungus) 활용 등과 같은 대체 방법들이 대안으로 활용되고 있다 (Asano et al., 2009; Kai et al., 2015).
MIA인 캄토테신은 생합성 경로가 잘 규명된 strictosidine을 전구물질로 사용하여 생합성된다고 보고되어 있지만 (O’Connor and Maresh, 2006), strictosidine 이후의 캄포테신 생합성 경로는 현재까지 명확히 규명되지 않았다 (Fig. 3). 그리고 캄토테신 생산 주요 식물인 희수나무에서는 strictosidine이 검출되지 않고, strictosidinic acid가 중간 전구체로 캄토테신 생합성에 활용된다고 보고되었다 (Sadre et al., 2016). 이와는 다르게 N. nimmoniana와 O. pumila에서는 strictosidine이 캄토테신 생합성을 위한 전구물질로 사용됨이 보고됨으로써 캄토테신을 생산하는 식물체마다 구별된 캄토테신 생합성 경로가 존재함을 시사하였다 (Yang et al., 2021).
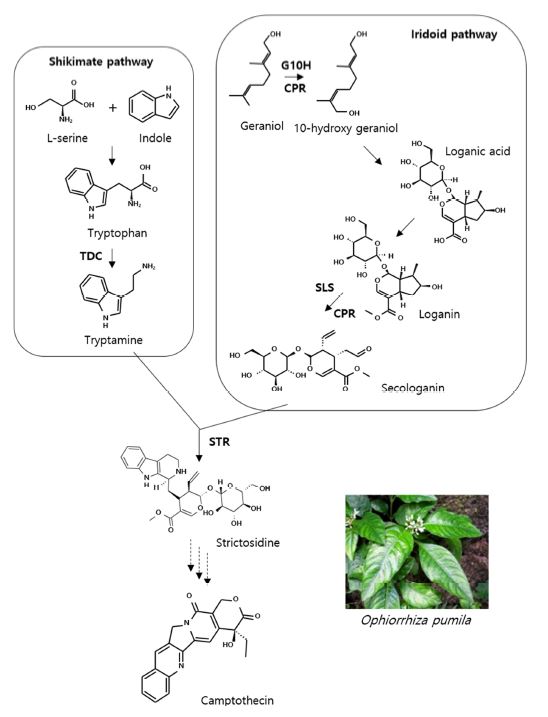
Biosynthetic pathway of camptothecin from Ophiorrhiza pumila.Camptothecin is derived from a strictosidine intermediate in O. pumila. The dashed arrow indicates unidentified steps. TDC; tryptophan decarboxylase, G10H; Geraniol-10-hydroxylase, CPR; NADPH : cytochrome P450 reductase, SLS; secologanin synthase, STR; strictosidine synthase.
캄토테신은 시킴산 (shikimate) 경로와 이리도이드 (iridoid) 경로를 통해 제공된 인돌 (indole)과 터펜 (terpene) 전구체에 의하여 합성된다 (Fig. 3). 시킴산 경로에서는 tryptophan decarboxylase (TDC)에 의하여 tryptophan이 tryptamine으로 변환된다고 보고되었다 (Yamazaki et al., 2003a; Wang et al., 2019). 이리도이드 경로에서는 2 개의 CYP450 family synthases의 기능이 규명되었다. Geraniol-10-hydroxylase (G10H)에 의하여 geraniol이 10-hydroxygeraniol로 전환되며, secologanin synthase (SLS)에 의하여 loganin이 secologanin으로 전환된다 (Yamazaki et al., 2003a; Shi et al., 2020). 이때 NADPH : cytochrome P450 reductase (CPR)가 G10H와 SLS 활성에 중요하다고 보고되었다 (Yamazaki et al., 2003a). 이들 경로를 통해 만들어진 tryptamine과 secologanin은 strictosidine synthase (STR)에 의해 strictosidine으로 전환된다 (Yamazaki et al., 2003a; Kai et al., 2015).
하지만 strictosidine에서 캄토테신이 어떻게 만들어지는지는 명확하지 않으며, 이들 생합성에 관여하는 유전자들을 규명하기 위한 지속적인 연구가 필요하다.
협죽과에 속하는 1년초인 일일초 (Catharanthus roseus) 에는 약 200 여종의 인돌 알칼로이드를 함유하고 있다. 특히 일일초의 잎에는 산업적으로 중요한 물질로 급성백혈병과 악성 임파종양 등의 치료제로 사용되는 이량체 터페노이드 인돌 알칼로이드 (terpenoid indole alkaloid, TIA) 계열의 빈크리스틴과 빈블라스틴이 축적되어 있다 (Fig. 1; Lee et al., 2002).
빈크리스틴과 빈블라스틴은 암 치료에 사용된 최초의 천연의약품이자 여전히 암 치료에 사용되는 가장 중요한 물질 중 하나로서 vindoline과 catharanthine에서 유래한 비신돌 알칼로이드 (bisindole alkaloid)이다 (Costa et al., 2008). 이는 인간의 종양 (tumor) 치료에서 여전히 가장 가치 있는 화학요법제에 포함된다 (Sottomayor and Barcelo, 2006). 빈크리스틴 및 빈블라스틴 알칼로이드는 암 화학 요법에 사용되는 상업용 TIA로 암 치료제 중 두 번째로 많이 사용된다 (Jordan et al., 1998).
일일초의 옛 이름이 Vinca rosea인 점에 기인하여 이와 관련된 반합성 화합물들은 빈카 알칼로이드로 명명되었으며, 이러한 화합물은 세포사멸을 유발하여 암세포 성장을 억제시킨다. 빈크리스틴 및 빈블라스틴과 유사한 반합성 화합물인 비노렐빈 (vinorelbine)과 빈데신 (vindesine)이 치료 작용을 증가시키기 위해 개발되고 (Nirmala et al., 2011) 임상 시험에 사용되었지만, 빈크리스틴, 빈블라스틴 및 비노렐빈만 미국에서 치료적 이용에 대해 승인되었다 (Nobili et al., 2020). 식물에서 분리된 알칼로이드인 빈블라스틴은 홉킨스병, 융모막 종양 치료에 많이 사용된다 (Moudi et al., 2013).
빈블라스틴의 산화된 형태인 빈크리스틴은 급성 백혈병, 악성 림프종, 홉킨스병, 급성 적혈구 혈증 및 급성 범골수증 치료에 사용된다. 빈크리스틴은 어린이의 백혈병 치료에 실험적으로 사용되고 있으며, 빈크리스틴과 빈블라스틴은 항암뿐만 아니라 강력한 항균 활성도 보고되었다 (Grellier et al., 1999).
빈블라스틴과 빈크리스틴도 마찬가지로 화학적 합성의 어려움으로 인하여 현재의 생산 방법은 주로 일일초에서 추출한 전구체인 vindoline과 catharanthine의 화학적 결합을 통해서 이루어지고 있다. 빈블라스틴과 빈크리스틴 의약품 1 g을 생산하기 위하여, 각각 500 ㎏과 2,000 ㎏의 일일초 건조 잎이 필요하지만, 일일초 잎에서의 낮은 함유량 (빈블라스틴, 0.32 ㎍/g; 빈크리스틴, 3.77 ㎍/g)으로 인하여 활용에 어려움이 있다 (Jeong and Lim, 2018; Zhang et al., 2022). 특히, 수요 증가와 함께 빈블라스틴과 빈크리스틴 가격은 ㎏당 백만 달러까지 증가하였으며, 이는 식물 추출 방법의 대안 연구의 중요성을 각인시켰다.
비신돌 알칼로이드 생합성 단계는 1. tryptamine과 secologanin의 형성, 2. vindoline과 catharanthine과 같은 단량체 알칼로이드의 형성, 3. 빈블라스틴과 빈크리스틴의 형성이라는 세 가지 범주로 요약될 수 있다 (Zhu et al., 2015). 현재까지 일일초에서 빈블라스틴과 빈크리스틴 생합성을 위하여 31 단계의 복잡한 과정이 필요하며, 최소 25 개 효소가 관여하는 것으로 보고되었다 (Fig. 4).
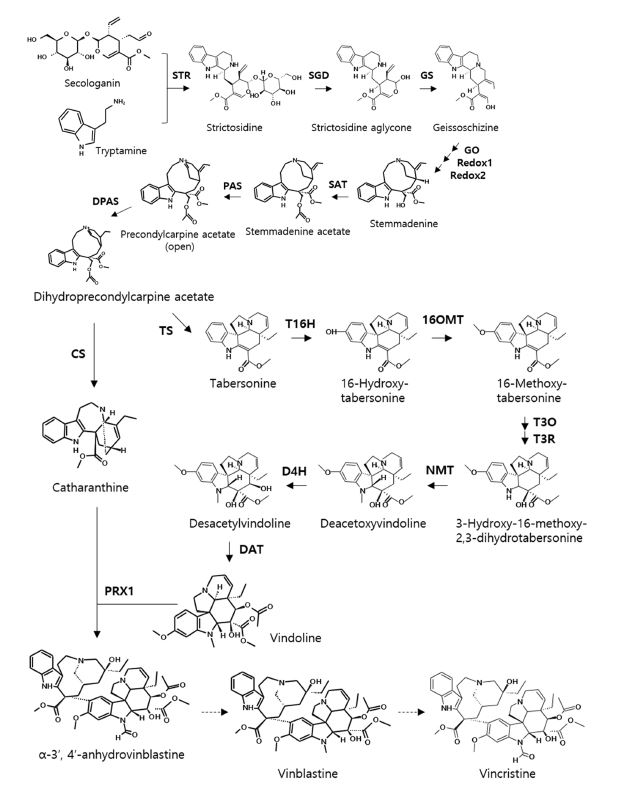
Biosynthetic pathway of vinblastine and vincristine.The dashed arrow indicates unidentified steps. STR; strictosidine synthase, SGD; strictosidine-β-glucosidase, GS; geissoschizine synthase, GO; geissoschizine oxidase, SAT; stemmadenine-O-acetyltransferase, PAS; precondylocarpine acetate synthase, DPAS; dihydroprecondylocarpine acetate synthase; TS; tabersonine synthase, CS; catharanthine synthase, T16H; tabersonine 16-hydroxylase, 16OMT; tabersonine 16-O-methyltransferase, T3O; tabersonine 3-oxygenase, T3R; 16-methoxy-2,3-dihydro-3-hydroxytabersonine synthase, NMT; 3-hydroxy-16-methoxy-2,3-dihydrotabersonine-N-methyltransferase, D4H; deacetoxyvindoline 4-hydroxylase, DAT; deacetylvindoline-O-acetyl-transferase, PRX1; class III peroxidase.
앞서 캄토테신 생합성 과정에서 언급한 바와 같이, secologanin과 tryptamine이 STR에 의하여 strictosidine으로 응축되는 첫번째 단계가 촉진된다. Strictosidine은 모든 TIA의 중심 중간체로 알려져 있다 (Oudin et al., 2007). Strictosidine은 strictosidine-β-glucosidase (SGD) 효소에 의해 당 반수체가 제거되어 불안정하고 반응성이 높은 알데히드 분자인 strictosidine aglycon으로 전환된다 (Stevens et al., 1993). Strictosidine aglycon은 일일초에서 TIA의 다양성을 부여하는 대사경로의 핵심 분자로서 (Geerlings et al., 2000), geissoschizine synthase (GS)에 의해 geissoschizine으로, geissoschizine oxidase (GO)와 레독스단백질 (Redox1과 Redox2)에 의한 연속적인 반응을 통해서 stemmadenine으로 전환된다 (Zhang et al., 2022). 그리고 stemmadenine-O-acetyltransferase (SAT)에 의해 stemmadenine acetate가 형성되며, 이는 precondylocarpine acetate synthase (PAS)와 dihydroprecondylocarpine acetate synthase (DPAS)에 의한 산화환원 반응을 통해 dihydroprecondylocarpine acetate로 전환된다 (Caputi et al., 2018). Dihydroprecondylocarpine acetate는 tabersonine synthase (TS)와 catharanthine synthase (CS)에 의하여 각각 tabersonine과 catharanthine으로 합성된다. 이때 tabersonine은 잘알려진 7 개 효소 (tabersonine 16-hydroxylase, T16H; tabersonine 16-O-methyltransferase, 16OMT; tabersonine 3-oxygenase, T3O; 16-methoxy-2,3-dihydro-3-hydroxytabersonine synthase, T3R; 3-hydroxy-16-methoxy-2,3-dihydrotabersonine-N-methyltransferase, NMT; deacetoxyvindoline 4-hydroxylase, D4H; deacetylvindoline-O-acetyl-transferase, DAT)가 관여하는 일련의 반응을 통해 vindoline으로 전환된다 (Zhang et al., 2022).
이렇게 형성된 단량체성 알칼로이드인 vindoline과 catharanthine은 최종적으로 class III peroxidase (PRX1)에 의해 α-3',4'-anhydrovinblastine (AVLB)으로 합성된다. 빈블라스틴과 빈크리스틴은 여러 단계를 거쳐 AVLB에서 파생되지만, 현재까지 정확한 생합성 단계는 규명되지 않았다 (Zhang et al., 2022).
포도필로톡신은 aryltetralin lignan 구조를 기본 골격으로 하는 천연 물질로서, 매자나무과 (Berberidaceae), 운향과 (Rutaceae), 미나리과 (Apiaceae), 측백나무과 (Cupressaceae), 아마과 (Linaceae), 물푸레나무과 (Oleaceae) 등 약 60 여 관다발 식물과에서 생성되며 (Shah et al., 2021), 주로 이들의 뿌리나 땅속줄기 (rhizomes)에서 축적된다 (Fig. 1).
그러나 이들 중 매자나무과의 Podophyllum속 식물들에서 가장 높은 함량의 포도필로톡신이 검출된다 (Kumar et al., 2015). 매자나무는 매자나무과의 낙엽관목으로 한국 특산종이며, 잎에는 독성을 가지나 줄기 및 뿌리에 진통, 항암, 항결핵, 항균 등의 효과가 보고되어 한방에서도 한약재로 사용된다 (Jin et al., 2008). 또한 Podophyllum 식물 추출물은 과거로부터 다양한 문화권에서 해독제, 구충제, 발포제 등의 약용 물질로 사용되어왔으며 (Ayres and Loike, 1990), 1942년에 Podophyllum 식물 뿌리 추출물 수지인 podophyllin의 성기 사마귀에 대한 치료 효과가 발표되면서 podophyllin의 약리적 중요성이 관심을 받았다 (Kaplan, 1942).
이후 1946년에 포도필로톡신 또는 그의 배당체들이 tubulin 중합을 저해하여 체세포 분열을 억제함이 밝혀지면서 잠재적 항암제로써 주목받기 시작하였다 (King and Sullivan, 1946). 그 후 포도필로톡신을 기본 골격으로 하는 배당체들을 포함한 다양한 유도체들의 분리, 합성 및 약리효과에 대한 연구들이 이어져 항암, 항바이러스, 항류마티스, 항건선, 면역활성 등 다양한 약리효과들이 검증되었다 (Stoll et al., 1954; Stoll et al., 1955; von Wartburg et al., 1957; Rutschmann and Renz, 1959; Stähelin and von Wartburg, 1989; Joel, 1996; Pugh et al., 2001).
포도필로톡신의 화학 합성 유도체인 에토포시드 (etoposide)와 테니포시드 (teniposide)는 1960년대 중반에 처음 발표되었으며 (Goldin et al., 1966; Kuhn and von Wartburg, 1967), 현재까지 소세포성 폐암, 림프종, 백혈병, 난소암, 신경모세포종 등 다양한 유형의 암 치료에 널리 적용되고 있는 주요 항암제들이다 (Fig. 1; Schacter, 1996).
이들은 포도필로톡신과 달리 4'-position의 demethylation과 4-position의 β-glycosidic moeity를 지니는 구조적 차이점에 기인하여 tubulin 중합 저해가 아닌 DNA topoisomerase II의 저해제로 작용함으로써 암세포 증식을 억제한다 (Ayres and Loike, 1990; Gordaliza et al., 2000). 에토포시드와 테니포시드는 topoisomerase II-DNA complex의 결합을 고착화시켜 DNA 사슬을 비가역적으로 끊음으로써 유사분열시 S-phase에서 세포주기를 정지시켜 세포사멸을 유도한다 (Robles et al., 1999).
그러나 이러한 세포독성이 정상세포에도 영향을 미치거나 골수억제, 약물 내성 등의 부작용 또한 유발할 수 있다. 따라서 이러한 부작용들을 극복하고 수용성 및 생체이용률을 높이기 위해 NK-611 (Mross et al., 1996), NPF (Huang et al., 1999), GL-311 (Lee and Huang, 2001), F14512 (Ardalani et al., 2017)과 같은 다양한 포도필로톡신 유도체들이 개발되어 에토포시드와 테니포시드를 빠르게 대체하고 있다. 2022년 글로벌 시장조사기관 (Market Growth Reports)에 따르면 전세계 포도필로톡신 시장 규모는 2028년까지 100 만 달러의 가치가 있을 것으로 예상되는 주요 화합물이다.
포도필로톡신 생합성 경로는 phenylpropanoids 대사경로를 통해 phenylalanine으로부터 유래한 coniferyl alcohol의 중합으로부터 시작되며, 이후 다양한 효소들의 촉매작용에 의해 aryltetralin lignan 구조가 형성된다 (Fig. 5).
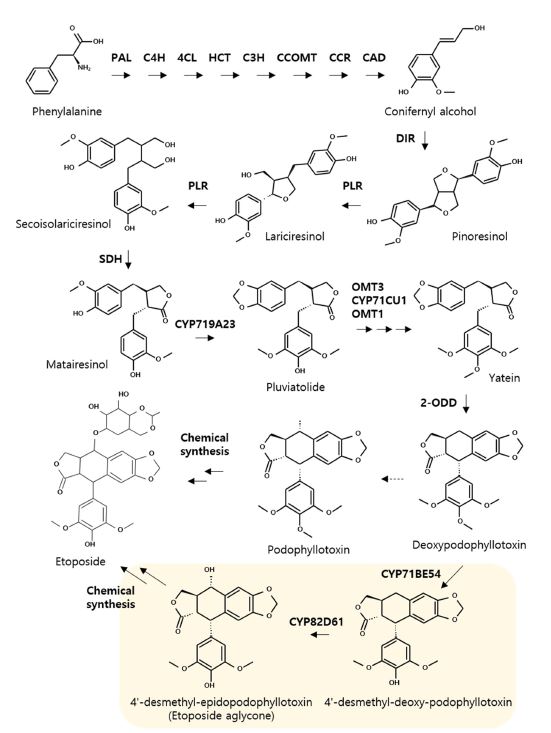
Biosynthetic pathway of podophyllotoxin.The dashed arrow indicates unidentified step. The step of etopside aglycone pathway is highlighted with yellow color shade. PAL; phenylalanine ammonia lyase; C4H; cinnamate 4-hydroxylase; 4CL; 4-coumarate, HCT; hydroxycinnamoyl-CoA shikimate/quinate hydroxycinnamoyl transferase, C3H; p-coumarate 3-hydroxylase CoA ligase; CCOMT; caffeoyl CoA o-methyltransferase, CCR; cinnamoyl CoA reductase, CAD; cinnamyl alcohol dehydrogenase, DIR; dirigent protein, PLR; pinoresinol lariciresinol reductase, SDH; secoisolariciresinal dehydrogenase, OMT3; O-methyltransferase3, OMT1; O-methyltransferase1, 2-ODD; 2-oxoglutarate dependent dioxygenase.
이러한 대사경로는 지금까지 forsythia, linum, podophyllum 속 등 관련 식물들에서의 생합성 유전자 규명을 통해 밝혀져 왔다 (Dinkova-Kostova et al., 1996; Davin et al., 1997; Lau and Sattely, 2015). 대사경로의 시작인 coniferyl alcohol의 중합은 dirigent protein (DIR) 활성에 의한 입체특이적 이량체화를 통해 이루어지며 그 결과 대사경로의 속도 조절 단계라 할 수 있는 (+)-pinoresinol 생합성이 이루어진다.
(+)-pinoresinol은 pinoresinol-lariciresinol reductase (PLR)에 의한 두차례의 환원과정을 거쳐 (-)-secoisolariciresinol로 변환되며, 이후 secoisolariciresinal dehydrogenase (SDH)에 의해 (-)-matairesinol로 변환된다. CYP719A23은 (-)-matairesinol의 methylenedioxy bridge 형성을 촉매하여 A-ring이 완성되며 이를 통해 (-)-pluviatolide가 형성된다. (-)-pluviatolide 이후 최종 구조인 etoposide aglycone까지의 후기 단계 대사경로 유전자들은 최근 Lau와 Sattely (2015)에 의해 Podophyllum hexandrum으로부터 규명되었다.
O-methyltransferase 3 (O-OMT3)와 CYP71CU1, O-methyltransferase 1 (OMT1)의 활성은 (-)-pluviatolide E-ring의 trimethylation을 완성함으로써 (-)-yatein으로 변환시키며 이후 2-oxoglutarate dependent dioxygenase (2-ODD)에 의해 촉매되는 C-C 결합을 통해 C-ring이 형성됨으로써 (-)-deoxypodophyllotoxin이 생성된다. 그리고 (-)-deoxypodophyllotoxin의 4-position은 CYP82D61에 의해 수산기가 결합되어 (-)-podophyllotoxin의 최종구조가 완성될 것으로 예상되지만, 실제로 식물에서는 CYP82D61에 의한 (-)-podophyllotoxin 생산이 확인되지 않았으며 (Lau and Sattely, 2015), CYP71BE54에 의한 4'-position의 demethylation과 CYP82D61의 수산화 반응을 통해 etoposide의 전구체인 etoposide aglycone이 형성되었다 (Lau and Sattely, 2015; Schultz et al., 2019).
2. 식물 시스템에서 식물 유래 항암제 생산 증진 연구 동향
1992년 탁솔을 생산하는 Taxus cuspidata의 시험관 내 배양 성공을 시작으로 (Fett-Neto et al., 1992; Sabzehzari et al., 2020), 주목나무를 포함하여 여러 종 (T. cuspidate, T. baccata, T. yunnanensis 등)에서 시험관 배양을 통해 탁솔의 생산이 보고되었다 (Liu et al., 2016).
탁솔의 초기 생산량은 1 ㎎/ℓ- 3 ㎎/ℓ였지만, 배지의 조성, 삼투압, 가스 조성 및 온도 등 배양 조건의 최적화를 통해 77.5 ㎎/ℓ- 153 ㎎/ℓ 범위로 생산량이 향상되었다 (Bringi et al., 1995; Onrubia et al., 2013; Sabzehzari et al., 2020). 그 결과 조직배양 방법은 시험관 조건에서 탁솔을 생산할 수 있는 대안 중 하나로 인식되었다.
또한 대사공학 방법을 이용하여 식물에서 GGPPS와 TXS의 과다발현을 유도하는 안정적인 형질전환 방법으로 taxadiene을 생산한 연구들이 주로 보고되었다 (Besumbes et al., 2004; Kovacs et al., 2007; Cha et al., 2012; Hasan et al., 2014). 애기장대에서는 TXS의 항시 발현과 발현 유도 시스템을 이용하여 각각 건조 중량 (g) 당 24.6 ㎍과 0.6 ㎍의 taxadiene 생산이 보고되었으며 (Besumbes et al., 2004), 담배에서는 TXS의 과다발현으로 건조 중량 (g) 당 27 ㎍까지 생산 사례가 보고되었다 (Hasan et al., 2014). 그리고 TXS의 과다발현으로 이끼 (Physcomitrella patens)에서는 생체중량의 0.05% 정도의 taxadiene이 생산되었으며 (Anterola et al., 2009), taxadiene의 전구체인 GGPP가 taxadiene 생산을 위하여 사용되도록 카로티노이드 생산이 결핍된 토마토 돌연변이 (yellow flesh) 과실에 TXS를 발현시킨 결과 건조 과실 1 ㎏으로부터 160 ㎎의 taxadiene을 생산할 수 있었다 (Kovacs et al., 2007).
이러한 연구 결과들은 탁솔 생합성에 관여하는 주요 유전자들을 활용하여 식물에서 탁솔과 그 전구체를 생산할 수 있음을 의미하지만, 여전히 낮은 생산량을 효율적으로 증대시킬 수 있는 새로운 기술 발굴의 필요성을 의미한다.
캄토테신은 희수나무와 O. pumila 식물체로부터 Agrobacterium rhizogenes에 의해 유래한 모상근 (hairy-root)을 배양하여 생산하는 조직배양 사례가 대표적이다 (Asano et al., 2009).
희수나무와 O. pumila 식물의 모상근에서 건조 중량 당 1 ㎎/g의 캄토테신이 추출되었다 (Yamazaki et al., 2003b; Lorence and Nessler, 2004). 모상근 외에도 캘러스나 세포배양 (cell suspension)을 이용한 캄토테신 물질 생산 연구도 진행되었지만, 토양에서 키운 식물체에서 추출한 생산량보다 적게 검출되었다. 희수나무의 세포배양과 캘러스 배양을 통해서 건조 중량을 기준으로 각각 0.004 ㎎/g과 2.000 ㎎/g 까지의 캄토테신이 생산되었다 (van Hengel et al., 1992; Wiedenfeld et al., 1997).
캄토테신 함량을 증가시키기 위하여 캘러스와 식물체에 활성유도제 (elicitors)를 처리한 연구들도 보고되었다. 희수나무 캘러스에 ultraviolet-B (UV-B)를 처리하였을 때, 캄토테신의 함량이 11 배 증가하였다 (Pi et al., 2010). 그리고 희수나무 유묘에 앱시스산 (abscisic acid), 메틸 자스몬산 (methyl jasmonate)과 살리신산 (salicylic acid)을 처리하였을 때에도 작지만 약 1.4 배까지 캄토테신 함량이 증가되었다 (Kai et al., 2014).
식물뿐만 아니라 N. nimmoniana에서 추출한 내생균인 Entrophospora infrequens에서도 캄토테신이 생산된다고 보고되었으며 (Amna et al., 2006), 최근에는 N. nimmoniana 식물에서 추출한 Alternaria sp.에서 약 400 ㎍/g (건조 중량)의 캄토테신이 확인되었다 (Mohinudeen et al., 2021). 결과적으로, 조직배양, 활성유도제 처리와 내생균 활용 등의 다양한 방법이 캄토테신 함량을 증진시키기 위한 방안으로 오랫동안 사용되고 있다.
상대적으로 생합성 경로가 적게 규명된 캄토테신의 경우, 생합성 유전자를 직접 도입시켜 식물에서 생산을 증진시키기 위한 연구 사례보다 전사조절인자들에 의한 캄토테신 생합성 조절 연구가 활발하게 보고되고 있다 (Hao et al., 2021).
음성조절인자 (negative regulator)인 OpWRKY1를 과다발현시킨 O. pumila 모상근에서는 OpCPR 유전자의 발현 억제를 통해 캄포테신 함량이 대조구 대비 54%까지 감소되었으며 (Xu et al., 2020), 반대로 양성조절인자 (positive regulator)인 OpWRKY3를 과다발현시킨 O. pumila 모상근에서는 OpTDC와 OpCPR 유전자의 발현 증가를 통해 1.37 배 캄포테신 함량이 증가되었다 (Wang et al., 2019). 또한 OpWRKY2도 양성조절인자로 OpTDC의 발현을 활성화시켜서 캄토테신 함량을 O. pumila 모상근에서 3 배 증가시켰다 (Hao et al., 2021). 그 외에도 ERF 전사조절인자인 OpERF2와 MYB 전사조절인자인 OpMYB1이 각각 양성과 음성 조절인자로써 캄토테신 생합성을 조절한다고 보고되었다 (Rohani et al., 2016; Udomsom et al., 2016).
O. pumila 외에 희수나무에서는 광에 의해 조절되는 캄토테신 생합성을 bZIP 전사조절인자인, CaLMF이 음성적으로 조절한다고 규명되었다 (Chang et al., 2018). 이러한 결과들은 대사공학적으로 캄토테신 생합성 유전자들의 발현을 조절하는 전사조절인자들을 적절하게 이용하면 식물체에서 캄토테신 생산량을 향상시킬 수 있음을 시사한다.
빈크리스틴과 빈블라스틴을 식물에서 직접 추출하는 대안으로, 식물 조직 배양을 기반으로 일일초의 체외 세포 현탁액과 모상근 배양으로 광범위하게 이루어지고 있다 (Islas et al., 1994; Hughes et al., 2004; Hong et al., 2006; Liu et al., 2011; Rizvi et al., 2015).
이러한 연구는 세포 조직, 형태 분화 및 특정 배양 조건의 수준에 따라 다르며, 세포배양에 대사공학적 방법을 접목시켜서 ajmalicine, serpentine, vindoline과 catharanthine 같은 단량체 알칼로이드들 생성이 확인되었다. 불행하게도, 세포 현탁액 및 모상근 배양을 통해서는 세포/조직 분화의 낮은 효율과 함께, 완전한 TIA 생합성이 잎에서만 제한적으로 발생하기 때문에 이량체 빈블라스틴 및 빈크리스틴을 합성하는데 어려움이 있었다 (Zhao and Verpoorte, 2007).
최근 효모 시스템을 이용한 vindoline과 catharanthine 등의 전구체 생산 연구들이 활발하게 보고되고 있지만 (Zhang et al., 2022), 아직 식물 시스템에서 대사공학을 이용한 생산 연구는 드물게 보고되었다. 그 사례로, 일일초 형질전환 시스템을 이용하여 CsDAT의 과다발현으로 vindoline의 생산이 대조구보다 2.4 배 증진되었으며 (Wang et al., 2012), 일일초 AP2 전사조절인자인 CrORCA3 (Octadecanoid-derivative Responsive 3)와 CrG10H가 함께 과다발현된 형질전환 식물체에서 strictosidine, vindoline과 catharanthine의 축적 증가를 야기하였다 (Pan et al., 2012). 그리고 일일초에 CsTDC와 CsSTR을 과다발현 시킨 결과, 빈블라스틴 생산량을 5 배 증가시킨 결과가 대표적인 사례이다 (Sharma et al., 2018).
현재까지는 주로 Podophyllum 식물체로부터 추출 분리한 포도필로톡신을 전구체로 사용하고 화학 합성을 통해 에토포시드, 테니포시드와 같은 유도체들이 생산되고 있다. 그러나 Podophyllum의 성장 속도가 느리므로 물질의 대량 획득에 한계가 있으며, 또한 Podophyllum 종의 멸종 위기를 초래하는 등의 문제점들이 대두되고 있다.
이를 극복하기 위한 노력으로 관련 식물자원들의 기내배양, 캘러스 유도 및 현탁배양, 모상근 배양 등의 기술들이 개발되었으며 (van Uden et al., 1989; van Uden et al., 1990; Muranaka et al., 1998; Nadeem et al., 2000; Farkya and Bisaria, 2008), 물질 생산 극대화를 위한 빛 (적생광, 청색광) (Yousefzadi et al., 2012), 온도 (4℃ - 10℃) (Yang et al., 2016), pH (4.8) (Alam and Naik, 2009), 영양소 (Li et al., 2013) 등의 최적 배양 조건들이 확립되었다.
또한 메틸 자스몬산과 살리신산 등이 식물체내 포도필로톡신 생합성을 증가시키는 활성유도제로써 작용할 수 있음이 밝혀졌다. 메틸 자스몬산 또는 살리신산을 P. hexandrum과 Linum album의 세포현탁배양에 각각 처리할 경우 4-coumarate-CoA ligase (4CL), caffeoyl CoA O-methyltransferase (CCOMT), cinnamyl-alcohol dehydrogenase (CAD)와 같은 coniferyl alcohol 생합성 유전자들의 발현이 촉진되며 결과적으로 포도필로톡신 생산이 증가되었다 (Yousefzadi et al., 2010; Hazra et al., 2017). 또한 P. hexandrum 잎에 상처 또는 메틸 자스몬산 처리 시 coniferyl alcohol 이후 생합성 단계인 DIR, PLR, SDH와 같은 포도필로톡신 생합성 유전자들의 발현이 유도되는 양상이 보고되었다 (Wankhede et al., 2013).
Fusarium graminearum과 같은 곰팡이 추출물 또한 활성 유도제로써 작용할 수 있으며, L. album의 세포현탁배양에 이러한 곰팡이를 처리할 경우 phenylalanin ammonia-lyase (PAL), cinnamoyl-CoA reductase (CCR), CAD 및 PLR의 발현 촉진을 통한 포도필로톡신 생산 증가가 보고되었다 (Bahabadi et al., 2012).
이처럼 수십 년 전부터 식물 세포·조직배양이나 재조합 DNA 기술을 활용한 대사공학 연구 등을 통해 식물에서 천연물 함량 증진을 위한 다양한 연구들이 수행되었다. 특히, 천연 화합물 함량 증진을 위한 가장 쉬운 방법 가운데 하나가 바로 천연 화합물을 함유한 식물을 직접 사용하는 방법이다. 앞서 언급한 캄토테신과 포도필로톡신이 다양한 식물에 함유되어 있듯이, 앞으로 고부가 천연 화합물이나 전구체를 많이 함유한 신규 식물자원을 발굴하기 위한 노력이 수반되어야 한다.
또한 O. pumila와 일일초의 형질전환으로 천연물과 전구체 함량 조절이 가능한 것처럼, 식물자원을 직접 조작하기 위한 형질전환 및 식물 재분화 기술 개발도 필요하다. 식물마다 형질전환 및 식물 재분화 효율이 다르므로 식물 유전자형에 최적화된 기술이 개발되어야 한다. 최근 기술 발전으로 유전 물질 전달이 용이하고, 발달 조절인자들과의 공동 발현으로 식물 재분화 효율이 증진된다는 연구들이 보고되면서 모델 식물이 아닌 식물자원을 조작하는 기술의 장벽이 낮아져 성공적인 기술 개발이 가능할 것으로 여겨진다.
3. 식물 시스템에서 합성생물학을 이용한 생산 연구 동향과 전망
끊임없는 인구 증가와 질병 발생률 증가로 인하여 더욱 많은 천연 의약품 생산량 증가가 요구되고 있으며, 기존의 생명 공학 기술의 한계로 충분한 의약품을 생산하기에 어려움이 있어 새로운 생명공학 기술 개발의 필요성이 대두되었다. 최근 생물정보학과 분자생물학 기술 등의 발달과 함께 식물의 천연물 생합성과 관련된 수많은 데이터가 축적됨에 따라 이를 활용한 합성생물학 연구도 발달하게 되었다.
실제로 합성생물학 기술로 제빵용 효모 (Saccharomyces cerevisiae)에서 암, 통증 및 말라리아를 치료하기 위해 식물 유래 아편류, 칸나비노이드, 테르펜 및 알칼로이드의 생산이 보고되었다 (Ro et al., 2006; Brown et al., 2015; Galanie et al., 2015; Luo et al., 2019; Zhang et al., 2022). 이는 합성생물학이 기존 생명공학 기술보다 대중적이고, 경제적, 환경친화적으로 고부가 가치의 천연물들을 생산할 수 있음을 증명하였다.
비록 합성생물학 연구들이 미생물 시스템에서 주로 연구되었고 식물 대사물질의 복잡성, 식물에 적합한 부품의 부족과 장비 활용의 제약 등으로 인하여 식물 시스템에서는 합성생물학 연구가 활발히 진행되지 못하였다. 그러나 생명공학 기술의 발달과 함께 담배에서 아르테미시닌 (artemisinine) 생산을 시작으로 (Farhi et al., 2011), 최근 10 년 동안 식물에서도 합성생물학 방법으로 천연 의약품 생산이 성공적으로 보고되고 있다 (Courdavault et al., 2021).
식물 합성생물학 연구를 위한 이형 기주 식물로는 이차대사산물 생합성을 위한 전구물질을 많이 함유한 식물을 사용할 수 있다 (Kotopka et al., 2018). 특히 담배 (Nicotiana benthamiana)는 미생물 기반 생산 시스템에 대한 대안으로 빠른 성장과 높은 바이오매스를 보이는 비식품 작물로서 대표 식물이다 (Reed and Osburn, 2018). 그리고 담배에서 아그로박테리움을 이용한 외래 유전자 발현은 이미 잘 사용되고 있는 시스템으로, 유전자들의 발현을 조절하여 빠르게 대사경로의 순서 혹은 중간 대사물질들을 규명하기에 최적 식물로 이용되고 있다. 현재까지 연구 결과가 보고되지 않은 캄토테신을 제외하고 담배 식물에서 합성생물학 방법으로 천연물 생산을 성공한 연구 사례를 집중적으로 서술하고자 한다.
담배 (N. benthamiana)에서 합성생물학 기술을 이용한 탁솔 생산 가능성은 2019년도에 성공적으로 보고되었다 (Table 1).

Recent advancements in plant synthetic biology for the production of paclitaxel, vinblastine, and podophyllotoxin.
TXS, T5αH, 그리고 CPR 유전자들의 엽록체 발현과 MEP 대사경로의 DXS와 GGPPS를 이용한 GGPP 전구체 증진 방법을 이용하여 담배에서 taxadiene (56.6 ㎍/g, 생중량)과 taxadiene-5α-ol (1.3 ㎍/g, 생중량)이 생산됨을 확인하였다 (Li et al., 2019). 이후에 TXS와 GGPPS의 엽록체 타겟팅 서열을 제거하여 세포질에서 발현되도록 경로를 변경시키고, MEV 대사경로의 HMGR (hydroxy 3 methylglutaryl coenzyme A reductase)을 함께 발현시킨 담뱃잎에서 taxadiene의 생산량이 약 1.3 ㎎/g (건조 중량)까지 증진될 수 있음이 보고되었다 (De La Peña and Sattely, 2020).
이는 엽록체 대사경로를 재설계하는 방법보다 세포질 경로 재설계를 통해 taxadiene 생산량을 6 배 수준으로 개선시킬 수 있었다. 그리고 담배 일시발현 (transient expression) 시스템이 안정적 형질전환 (stable transformaion) 시스템으로 축적된 taxadiene에 의하여 야기되는 식물 생장 저해 문제점들을 해결할 수 있는 대안으로 사용될 수 있음을 보여주었다.
특히 파클리탁셀의 경우에는 담배 이외에도 완두 (Pisum sativum L.)의 잎에서 추출한 원형질체에 BAPT, DBTNBT와 TB506 (T2'αH) 유전자를 발현시키고 파클리탁셀의 전구체인 baccatin III (100 ㎎/ℓ)와 ß-phenylananine-CoA (100 ㎎/ℓ), 생산 유도제인 coronatine (1 μM)을 제공한 조건에서 72 시간 배양한 결과, 원형질체 세포 내·외부 추출물에서 각각 1.88 ㎎/ℓ과 1.19 ㎎/ℓ의 파클리탁셀을 생산하였다 (Table 1, Sanchez-Muñoz et al., 2020).
빈블라스틴 생합성에 관여하는 새로운 산화환원 효소 (redox enzymes)와 가수분해 효소 (hydrolases)의 기능 규명 연구를 통해서, 담뱃잎에서 빈블라스틴 생성에 중요한 물질인 catharanthine과 tabersonine 생합성이 보고되었다 (Caputi et al., 2018).
기질인 stemmadenine acetate (50 μM)를 제공하고 2 개의 산화환원 효소인 PAS, DPAS와 가수분해효소인 CS의 일시발현으로 catharanthine이 생성되었으며, PAS, DPAS와 TS 공동 발현을 통해서 tabersonine의 생성이 확인되었다 (Table 1).
Lau와 Sattely (2015)에 의해 담배에서 etoposide aglycone [(–)-4'-desmethyl-epipodophyllotoxin]의 생산 결과는, 목표 이차대사물질 생합성에 관여하는 유전자들의 발현 벡터를 함유한 아그로박테리움 셀들을 조합하여 담뱃잎으로 유전자들의 동시 발현을 유도하고 이차대사물질 생산을 성공한 대표적 사례이다 (Table 1).
Etoposide aglycone은 (-)-podophyllotoxin보다 에토포시드 합성에 바로 사용되는 전구체이다 (Schultz et al., 2019). 기존에 coniferyl alcohol부터 pluviatolide 생합성에 관여한다고 보고된 4 개 유전자와 새롭게 기능 규명한 하위 생합성 단계의 6 개 유전자의 여러 조합으로 대사경로의 중간 산물 [pluviatolide, 5'-desmethoxy-yatein, (–)-5'-desmethyl-yatein, (–)-yatein, (–)-deoxypodophyllotoxin, (–)-4'-desmethyldeoxypodophyllotoxin]과 최종 산물인 etoposide aglycone의 생산을 확인하였다. 그리고 최종적으로 10 개 유전자 (DIR, PLR, SDH, CYP719A23, OMT3, CYP71CU1, OMT1, 2-ODD, CYP71BE54, CYP82D61)를 이용하여 대사경로를 재설계하고 담뱃잎에 발현시킨 다음 기질인 pinoresinol (100 μM)을 제공한 결과, 기질을 제공하지 않는 조건 (1 ng/㎎ 이하, 건조 중량) 보다 etoposide aglycone의 생산량이 10 배 이상인 10.3 ng/㎎ (건조 중량)까지 증가하였다 (Lau and Sattely, 2015).
담배에서 (–)-deoxypodophyllotoxin을 11.4 ㎍/g (건조 중량)까지 생산할 수 있었지만, 전구체 대사량 공급의 필요성이 제기되었으며 4 년 후에 같은 연구팀에 의하여 (–)-deoxypodophyllotoxin 생산량이 4.3 ㎎/g (건조 중량)까지 개선된 연구 결과가 보고되었다 (Table 1, Schultz et al., 2019).
이는 DIR, PLR, SDH, CYP719A23, OMT3, CYP71CU1, OMT1과 2-ODD 유전자로 설계한 (–)-deoxypodophyllotoxin 대사경로에 전구체인 coniferyl alcohol 함량을 증가시키기 위한 PAL, C4H (cinnamate 4-hydroxylase), 4CL, HCT (hydroxycinnamoyl-CoA shikimate/quinate hydroxycinnamoyl transferase), C3H (coumarate 3-hydroxylase), CCoA-OMT (caffeoyl CoA O-methyltransferase), CCR과 CAD 유전자 8개를 추가하여 총 16 개 유전자로 대사경로를 재설계함으로써 가능하였다.
이와 같은 방식은 경제적 비용이 드는 중간 전구체의 추가 투입 없이도 내재적 기초 물질대사로부터 밀리그램 단위의 높은 포도필로톡신 생산을 가능케 하는 효과적인 식물 생산 시스템의 좋은 예라 할 수 있으며, 현재 다양한 고부가 가치 식물 이차대사물질 생산에도 유용하게 적용되고 있다.
합성생물학 방법으로 복잡한 대사경로 재설계가 기존보다 수월하고, 전구체 공급 없이 물질 생산 증진이 가능해지면서 효모나 대장균에서 천연 의약품 생산이 실현되었지만, 여전히 낮은 생산성의 한계가 존재하고 불명확한 대사경로로 인하여 성공 사례도 제한적이다. 특히 식물에서는 천연 화합물들의 중간 전구체 생산만이 보고되었을 뿐 아직 최종 산물의 생산 사례는 보고된 바 없기에 앞으로 이를 개선하기 위한 노력이 수반되어야 한다.
먼저, 최신 생명공학 기술로 다양한 식물자원의 유전체, 전사체와 대사체 비교분석을 통해 천연 화합물의 대사경로를 명확히 규명함으로써 극복할 수 있다. 최근 분석 기술의 발달로 비용이 저렴해지면서 천연물 대사경로 발굴 연구가 활발하게 이루어졌다. 이러한 연구들은 식물의 천연 화합물 생산을 조절하고 이해하는데 큰 도움이 되었으며, 4 종의 식물 유래 항암제에서 상대적으로 대사경로의 많은 단계가 규명되지 않은 캄토테신이 합성생물학 기술을 적용하여 생산하기 위한 연구가 아직 보고되지 못한 사실은 대사경로 규명의 중요성을 시사한다.
또한 식물마다 캄토테신을 합성하는데 서로 다른 전구체를 사용한다는 연구 결과는 식물이 같은 화합물을 만드는데 다양한 경로가 존재할 수 있다는 것을 의미한다. 천연 화합물을 함유하는 다양한 식물자원의 대사경로를 규명하는 연구는 이에 관여하는 신규 유전자들을 발굴하는데 많은 정보를 제공할 수 있다.
식물에는 290 만개 정도의 유사한 서열과 구조를 갖는 유전자군 (gene family)이 존재하며, 이를 통해서 다양한 기능이 수행된다. 지금까지 대사경로가 발굴된 정보에 비하여 생합성 관련 유전자 발굴 연구는 상대적으로 적은 편이다. 그러므로 아직 규명되지 않은 핵심 유전자들의 기능 분석 연구는 식물 합성생물학 연구 발전을 위해 매우 필요하다. 나아가 유전자들의 주요 기능 외에도 추가적인 기능 발굴은 천연 화합물의 변형을 유도하여 새로운 활성을 부여하거나 반합성 기술을 대체할 수도 있을 것이다.
이처럼 대사경로와 유전자 발굴은 식물 합성생물학에 적합한 유전자 부품을 확보하기 위한 첫 번째 단계이며, 기능 분석을 통해 표준화된 유전자 부품은 최적화된 대사경로 재설계를 위해 사용되어 식물 합성생물학 발전에 기여할 수 있을 것이다.
Acknowledgments
본 총설은 농촌진흥청 바이오그린연계농생명혁신기술개발 과제의 차세대바이오21 사업(과제번호: PJ0158082022)의 수행 중에 확보한 자료를 바탕으로 이루어진 결과로 이에 감사드립니다.
References
-
Alam MA and Naik PK. (2009). Impact of soil nutrients and environmental factors on podophyllotoxin content among 28 populations of Podophyllum Hexandrum. Communications in Soil Science and Plant Analysis. 40:2485-2504.
[https://doi.org/10.1080/00103620903111368]

-
Amna T, Puri SC, Verma V, Sharma JP, Khajuria RK, Musarrat J, Spiteller M and Qazi GN. (2006). Bioreactor studies on the endophytic fungus Entrophospora infrequens for the production of an anticancer alkaloid camptothecin. Canadian Journal of Microbiology. 52:189-196.
[https://doi.org/10.1139/w05-122]

-
Anterola A, Shanle E, Perroud P and Quatrano R. (2009). Production of taxa-4(5),11(12)-diene by transgenic Physcomitrella patens. Transgenic Research. 18:655-660.
[https://doi.org/10.1007/s11248-009-9252-5]

- Ardalani H, Avan A and Ghayour-Mobarhan M. (2017). Podophyllotoxin: A novel potential natural anticancer agent. Avicenna Journal of Phytomedicine. 7:285-294.
-
Asano T, Sudo H, Yamazaki M and Saito K. (2009). Camptothecin production by in vitro cultures and plant regeneration in Ophiorrhiza species. Methods in Molecular Biology. 547:337-345.
[https://doi.org/10.1007/978-1-60327-287-2_27]

-
Ayres DC and Loike JD. (1990). Lignans. Chemical, biological and clinical properties. Cambridge University Press. Cambridge, England. p.85-86
[https://doi.org/10.1017/CBO9780511983665]

- Bae DH, Park WS, Hwang SJ and Hwang B. (2009). Plant regeneration through organogenesis from callus of Camptotheca acuminata decaisne. Korean Journal of Medicinal Crop Science. 17:192-197.
-
Bahabadi SE, Sharifi M, Behmanesh M, Safaie N, Murata J, Araki R, Yamagaki T and Satake H. (2012). Time-course changes in fungal elicitor-induced lignan synthesis and expression of the relevant genes in cell cultures of Linum album. Journal of Plant Physiology. 169:487-491.
[https://doi.org/10.1016/j.jplph.2011.12.006]

-
Bailly C. (2019). Irinotecan: 25 years of cancer treatment. Pharmacological Research. 148:104398. https://www.sciencedirect.com/science/article/abs/pii/S1043661819315257, (cited by 2022 Aug 5).
[https://doi.org/10.1016/j.phrs.2019.104398]

-
Besumbes Ó, Sauret-Güeto S, Phillips MA, Imperial S, Rodríguez-Concepción M and Boronat A. (2004). Metabolic engineering of isoprenoid biosynthesis in Arabidopsis for the production of taxadiene, the first committed precursor of Taxol. Biotechnology and Bioengineering. 88:168-175.
[https://doi.org/10.1002/bit.20237]

-
Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA and Jemal A. (2018). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68:394-424.
[https://doi.org/10.3322/caac.21492]

- Bringi V, Kadkade PG, Prince CL, Schubmehl BF, Kane EJ and Roach B. (1995). Enhanced production of taxol and taxanes by cell cultures of Taxus species. USA. Patent. 5,407,816.
-
Brown S, Clastre M, Courdavault V and O’Connor SE. (2015). De novo production of the plant-derived alkaloid strictosidine in yeast. Proceedings of the National Academy of Sciences. 112:3205-3210.
[https://doi.org/10.1073/pnas.1423555112]

-
Butler MS. (2004). The role of natural product chemistry in drug discovery. Journal of Natural Products. 67:2141-2153.
[https://doi.org/10.1021/np040106y]

-
Caputi L, Franke J, Farrow SC, Chung K, Payne RME, Nguyen TD, Dang TT, Soares Teto Carqueijeiro I, Koudounas K, Dugé de Bernonville T, Ameyaw B, Jones DM, Vieira IJC, Courdavault V and O'Connor SE. (2018). Missing enzymes in the biosynthesis of the anticancer drug vinblastine in Madagascar periwinkle. Science. 360:1235-1239.
[https://doi.org/10.1126/science.aat4100]

-
Cha M, Shim SH, Kim SH, Kim OT, Lee SW, Kwon SY and Baek KH. (2012). Production of taxadiene from cultured ginseng roots transformed with taxadiene synthase gene. BMB Reports. 45:589-594.
[https://doi.org/10.5483/BMBRep.2012.45.10.085]

-
Chang C, Liu Z, Wang Y, Tang Z and Yu F. (2018). A bZIP transcription factor, CaLMF, mediated light-regulated camptothecin biosynthesis in Camptotheca acuminata. Tree Physiology. 39:372-380.
[https://doi.org/10.1093/treephys/tpy106]

-
Choudhari AS, Mandave PC, Deshpande M, Ranjekar P and Prakash O. (2020). Phytochemicals in cancer treatment: From preclinical studies to clinical practice. Frontiers in Pharmacology. 10:1614. https://www.frontiersin.org/articles/10.3389/fphar.2019.01614/full, (cited by 2022 Aug 5).
[https://doi.org/10.3389/fphar.2019.01614]

-
Christ B, Xu C, Xu M, Li FS, Wada N, Mitchell AJ, Han XL, Wen ML, Fujita M and Weng JK. (2019). Repeated evolution of cytochrome P450-mediated spiroketal steroid biosynthesis in plants. Nature Communications. 10:3206. https://www.nature.com/articles/s41467-019-11286-7, (cited by 2022 Aug 5).
[https://doi.org/10.1038/s41467-019-11286-7]

-
Costa MMR, Hilliou F, Duarte P, Pereira LG, Almeida I, Leech M, Memelink J, Barceló AR and Sottomayor M. (2008). Molecular cloning and characterization of a vacuolar class III peroxidase involved in the metabolism of anitcancer alkaloids in Catharanthus roseus. Plant Physiology. 146:403-417.
[https://doi.org/10.1104/pp.107.107060]

-
Courdavault V, O’Connor SE, Jensen MK and Papon N. (2021). Metabolic engineering for plant natural products biosynthesis: New procedures, concrete achievements and remaining limits. Natural Product Reports. 38:2145-2153.
[https://doi.org/10.1039/D0NP00092B]

-
Davin LB, Wang HB, Crowell AL, Bedgar DL, Martin DM, Sarkanen S and Lewis NG. (1997). Stereoselective bimolecular phenoxy radical coupling by an auxiliary(dirigent) protein without an active center. Science. 275:362-366.
[https://doi.org/10.1126/science.275.5298.362]

-
De La Peña R and Sattely ES. (2021). Rerouting plant terpene biosynthesis enables momilactone pathway elucidation. Nature Chemical Biology. 17:205-212.
[https://doi.org/10.1038/s41589-020-00669-3]

-
Dinkova-Kostova AT, Gang DR, Davin LB, Bedgar DL, Chu A and Lewis NG. (1996). (+)-Pinoresinol/(-)-Lariciresinol Reductase from Forsythia intermedia. Protein purification, cDNA cloning, heterologous expression and comparison to isoflavone reductase. Journal of Biological Chemistry. 271:29473-29482.
[https://doi.org/10.1074/jbc.271.46.29473]

-
Farhi M, Marhevka E, Ben-Ari J, Algamas-Dimantov A, Liang Z, Zeevi V, Edelbaum O, Spitzer-Rimon B, Abeliovich H, Schwartz B, Tzfira T and Vainstein A. (2011). Generation of the potent anti-malarial drug artemisinin in tobacco. Nature Biotechnology. 29:1072-1074.
[https://doi.org/10.1038/nbt.2054]

-
Farkya S and Bisaria VS. (2008). Exogenous hormones affecting morphology and biosynthetic potential of hairy root line(LYR2i) of Linum album. Journal of Bioscience and Bioengineering. 105:140-146.
[https://doi.org/10.1263/jbb.105.140]

-
Fett-Neto AG, DiCosmo F, Reynolds WF and Sakata K. (1992). Cell culture of Taxus as a source of the antineoplastic drug taxol and related taxanes. Biotechnology. 10:1572-1575.
[https://doi.org/10.1038/nbt1292-1572]

-
Galanie S, Thodey K, Trenchard IJ, Filsinger Interrante M and Smolke CD. (2015). Complete biosynthesis of opioids in yeast. Science. 349:1095-1100.
[https://doi.org/10.1126/science.aac9373]

-
Garcia-Oliveira P, Otero P, Pereira, AG, Chamorro, F, Carpena M, Echave J, Fraga-Corral M. Simal-Gandara J and Prieto MA. (2021). Status and challenges of plant-anticancer compounds in cancer treatment. Pharmaceuticals. 14:157. https://www.mdpi.com/1424-8247/14/2/157, (cited by 2022 Aug 5).
[https://doi.org/10.3390/ph14020157]

-
Geerlings A, Ibañez MM, Memelink J, van Der Heijden R and Verpoorte R. (2000). Molecular cloning and analysis of strictosidine beta-D-glucosidase, an enzyme in terpenoid indole alkaloid biosynthesis in Catharanthus roseus. Journal of Biological Chemistry 275:3051-3056.
[https://doi.org/10.1074/jbc.275.5.3051]

- Goldin A, Serpick AA and Mantel N. (1966). Experimental screening procedures and clinical predictability value. Cancer Chemotherapy Reports. 50:172-218.
-
Gordaliza M, Castro MA, Miguel del Corral JM and San Feliciano A. (2000). Antitumor properties of podophyllotoxin and related compounds. Current Pharmaceutical Design. 6:1811-1839.
[https://doi.org/10.2174/1381612003398582]

-
Grellier P, Sinou V, Garreau-de Loubresse N, Bylèn E, Boulard Y and Schrével J. (1999). Selective and reversible effects of vinca alkaloids on trypanosoma cruzi epimastigote forms: Blockage of cytokinesis without inhibition of the organelle duplication. Cell Motility and the Cytoskeleton. 42:36-47.
[https://doi.org/10.1002/(SICI)1097-0169(1999)42:1<36::AID-CM4>3.0.CO;2-G]

-
Hao X, Xie C, Ruan Q, Zhang X, Wu C, Han B, Qian J, Zhou W, Nützmann HW and Kai G. (2021). The transcription factor OpWRKY2 positively regulates the biosynthesis of the anticancer drug camptothecin in Ophiorrhiza pumila. Horticulture Research. 8:7. https://academic.oup.com/hr/article/doi/10.1038/s41438-020-00437-3/6446656?login=true, (cited by 2022 Aug 5).
[https://doi.org/10.1038/s41438-020-00437-3]

-
Hasan MM, Kim HS, Jeon JH, Kim SH, Moon BK, Song JY, Shim SH and Baek KH. (2014). Metabolic engineering of Nicotiana benthamiana for the increased production of taxadiene. Plant Cell Reports. 33:895-904.
[https://doi.org/10.1007/s00299-014-1568-9]

-
Hazra S, Bhattacharyya D and Chattopadhyay S. (2017). Methyl jasmonate regulates podophyllotoxin accumulation in Podophyllum hexandrum by altering the ROS-Responsive podophyllotoxin pathway gene expression additionally through the down regulation of few interfering miRNAs. Frontiers in Plant Science. 8:164. https://www.frontiersin.org/articles/10.3389/fpls.2017.00164/full, (cited by 2022 Aug 5).
[https://doi.org/10.3389/fpls.2017.00164]

-
He L, Jagtap PG, Kingston DG, Shen HJ, Orr GA and Horwitz SB. (2000). A common pharmacophore for Taxol and the epothilones based on the biological activity of a taxane molecule lacking a C-13 side chain. Biochemistry. 39:3972-3978.
[https://doi.org/10.1021/bi992518p]

-
Hefner J, Rubenstein SM, Ketchum RE, Gibson DM, Williams RM and Croteau R. (1996). Cytochrome P450-catalyzed hydroxylation of taxa-4(5),11(12)-diene to taxa-4(20),11(12)-dien-5alpha-ol: The first oxygenation step in taxol biosynthesis. Chemistry and Biology. 3:479-489.
[https://doi.org/10.1016/S1074-5521(96)90096-4]

-
Hezari M annd Croteau R. (1997). Taxol biosynthesis: An update. Planta Medica. 63:291-295.
[https://doi.org/10.1055/s-2006-957684]

-
Hong SB, Peebles CAM, Shanks JV, San KY and Gibson SI. (2006). Expression of the Arabidopsis feedback-insensitive anthranilate synthase holoenzyme and tryptophan decarboxylase genes in Catharanthus roseus hairy roots. Journal of Biotechnology. 122:28-38.
[https://doi.org/10.1016/j.jbiotec.2005.08.008]

-
Huang TS, Lee CC, Chao Y, Shu CH, Chen LT, Chen LL, Chen MH, Yuan CC and Whang-Peng J. (1999). A novel podophyllotoxin-derived compound GL331 is more potent than its congener VP-16 in killing refractory cancer cells. Pharmaceutical Research. 16:997-1002.
[https://doi.org/10.1023/A:1018971313256]

-
Hughes EH, Hong SB, Gibson SI, Shanks JV and San KY. (2004). Metabolic engineering of the indole pathway in Catharanthus roseus hairy roots and increased accumulation of tryptamine and serpentine. Metabolic Engineering. 6:268-276.
[https://doi.org/10.1016/j.ymben.2004.03.002]

-
Islas I, Loyola-Vargas VM and Miranda-Ham ML. (1994). Tryptophan decarboxylase activity in transformed roots from Catharanthus roseus and its relationship to tryptamine, ajmalicine, and catharanthine accumulation during the culture cycle. In Vitro Cellular and Developmental Biology. 30:81-83.
[https://doi.org/10.1007/BF02632125]

-
Jeong WT and Lim HB. (2018). A UPLC-ESI-Q-TOF method for rapid and reliable identification and quantification of major indole alkaloids in Catharanthus roseus. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences. 1080:27-36.
[https://doi.org/10.1016/j.jchromb.2018.02.018]

- Jin L, Han JG, Ha JH, Jeong HS, Kwon MC, Ahn JH, Kim JC, Choi GP, Chung EK and Lee HY. (2008). Effect of immune activity on Berberis koreana Palibin by ultra high pressure low temperature process. Korean Journal of Medicinal Crop Science. 16:439-445.
-
Joel S. (1996). The clinical pharmacology of etoposide: An update. Cancer Treatment Reviews. 22:179-221.
[https://doi.org/10.1016/S0305-7372(96)90002-X]

-
Jordan A, Hadfield JA, Lawrence NJ and McGown AT. (1998). Tubulin as a target for anticancer drugs: agents which interact with the mitotic spindle. Medicinal Research Reviews. 18:259-296.
[https://doi.org/10.1002/(SICI)1098-1128(199807)18:4<259::AID-MED3>3.0.CO;2-U]

-
Kai G, Wu C, Gen L, Zhang L, Cui L and Ni X. (2015). Biosynthesis and biotechnological production of anti-cancer drug Camptothecin. Phytochemistry Reviews. 14:525-539.
[https://doi.org/10.1007/s11101-015-9405-5]

- Kai GY, Teng XJ, Cui LJ, Li SS, Hao XL, Shi M and Yan B. (2014). Effect of three plant hormone elicitors on the camptothecin accumulation and gene transcript profiling in Camptotheca acuminata seedlings. International Journal of Sciences. 3:86-95.
- Kaplan IW. (1942). Condylomata acuminata. New Orleans Medical and Surgical Journal. 94:388-390.
- Kelling J, Sullivan K, Wilson L and Jordan MA. (2003). Suppression of centromere dynamics by Taxol® in living osteosarcoma cells. Cancer Research. 63:2794-2801.
-
King LS and Sullivan M. (1946). The similarity of the effect of podophyllin and colchicine and their use in the treatment of Condylomata acuminata. Science. 104:244-245.
[https://doi.org/10.1126/science.104.2698.244]

-
Kingston DGI. (2000). Recent advances in the chemistry of taxol. Journal of Natural Products. 63:726-734.
[https://doi.org/10.1021/np000064n]

-
Kotopka BJ, Li Y and Smolke CD. (2018). Synthetic biology strategies toward heterologous phytochemical production. Natural Product Reports. 35:902-920.
[https://doi.org/10.1039/C8NP00028J]

-
Kovacs K, Zhang L, Linforth RST, Whittaker B, Hayes CJ and Fray RG. (2007). Redirection of carotenoid metabolism for the efficient production of taxadiene [taxa-4(5),11(12)-diene] in transgenic tomato fruit. Transgenic Research. 16:121-126.
[https://doi.org/10.1007/s11248-006-9039-x]

-
Kuhn M and von Wartburg A. (1967). Podophyllum lignane: Struktur und absolutkonfiguration von podorhizol-β-D-glucosid (= Lignan F). Helvetica Chimica Acta. 50:1546-1565.
[https://doi.org/10.1002/hlca.19670500614]

-
Kumar P, Pal T, Sharma N, Kumar V, Sood H and Chauhan RS. (2015). Expression analysis of biosynthetic pathway genes vis-à-vis podophyllotoxin content in Podophyllum hexandrum Royle. Protoplasma. 252:1253-1262.
[https://doi.org/10.1007/s00709-015-0757-x]

-
Lahlou M. (2007). Screening of natural products for drug discovery. Expert Opinion on Drug Discovery. 2:697-705.
[https://doi.org/10.1517/17460441.2.5.697]

-
Lahlou M. (2013). The success of natural products in drug discovery. Pharmacology and Pharmacy. 4:17-31.
[https://doi.org/10.4236/pp.2013.43A003]

-
Lau W and Sattely ES. (2015). Six enzymes from mayapple that complete the biosynthetic pathway to the etoposide aglycone. Science. 349:1224-1228.
[https://doi.org/10.1126/science.aac7202]

-
Lee CC and Huang TS. (2001). A novel topoisomerase GL331 preferentially induces DNA cleavage at (C/G)T sites and can cause telomere DNA damage. Pharmaceutical Research. 18:846-851.
[https://doi.org/10.1023/A:1011048831698]

- Lee HK, Kim JS, Kim MJ, Heo K, Lee HY and Yu CY. (2002). Comparison of biological activities of MeOH extracts in different cultivars and organs of Catharanthus roseus(L.) G.Don. Korean Journal of Medicinal Crop Science. 10:212-216.
-
Lee WL, Huang JY and Shyu LF. (2013). Phytoagents for cancer management: Regulation of nucleic acid oxidation, ROS, and related mechanisms. Oxidative Medicine and Cellular Longevity. 2013:925804. https://www.hindawi.com/journals/omcl/2013/925804, / (cited by 2022 Aug 5).
[https://doi.org/10.1155/2013/925804]

-
Li J, Mutanda I, Wang K, Yang L, Wang J and Wang Y. (2019). Chloroplastic metabolic engineering coupled with isoprenoid pool enhancement for committed taxanes biosynthesis in Nicotiana benthamiana. Nature Communications. 10:4850. https://www.nature.com/articles/s41467-019-12879-y, (cited by 2022 Aug 5).
[https://doi.org/10.1038/s41467-019-12879-y]

-
Li MF, Li W, Yang DL, Zhou LL, Li TT and Su XM. (2013). Relationship between podophyllotoxin accumulation and soil nutrients and the influence of Fe2+ and Mn2+ on podophyllotoxin biosynthesis in Podophyllum hexandrum tissue culture. Plant Physiology and Biochemistry. 71:96-102.
[https://doi.org/10.1016/j.plaphy.2013.07.001]

-
Liu DH, Ren WW, Cui LJ, Zhang LD, Sun XF and Tang KX. (2011). Enhanced accumulation of catharanthine and vindoline in Catharanthus roseus hairy roots by overexpression of transcriptional factor ORCA2. African Journal of Biotechnology. 10:3260-3268.
[https://doi.org/10.5897/AJB10.1556]

-
Liu W and Stewart CN. (2015). Plant synthetic biology. Trends in Plant Science. 20:309-317.
[https://doi.org/10.1016/j.tplants.2015.02.004]

-
Liu WC, Gong T and Zhu P. (2016). Advances in exploring alternative Taxol sources. RSC Advances. 6:48800-48809. https://pubs.rsc.org/en/content/articlelanding/2016/ra/c6ra06640b/unauth, (cited by 2022 Aug 8).
[https://doi.org/10.1039/C6RA06640B]

-
Liu YQ, Li WQ, Morris-Natschke SL, Qian K, Yang L, Zhu GX, Wu XB, Chen AL, Zhang SY, Nan X and Lee KH. (2015). Perspectives on biologically active camptothecin derivatives. Medicinal Research Reviews. 35:753-789.
[https://doi.org/10.1002/med.21342]

-
Lorence A and Nessler CL. (2004). Camptothecin, over four decades of surprising findings. Phytochemistry. 65:2735-2749.
[https://doi.org/10.1016/j.phytochem.2004.09.001]

-
Lu L, Zhao Z, Liu L, Gong W and Dong J. (2018). Combination of baicalein and docetaxel additively inhibits the growth of non-small cell lung cancer in vivo. Traditional Medicine and Modern Medicine. 1:213-218.
[https://doi.org/10.1142/S2575900018500131]

-
Lu X, Tang K and Li P. (2016). Plant metabolic engineering strategies for the production of pharmaceutical terpenoids. Frontiers in Plant Science. 7:1647. https://www.frontiersin.org/articles/10.3389/fpls.2016.01647/full, (cited by 2022 Aug 5).
[https://doi.org/10.3389/fpls.2016.01647]

-
Luo X, Reiter MA, d’Espaux L, Wong J, Denby CM, Lechner A, Zhang Y, Grzybowski AT, Harth S, Lin W, Lee H, Yu C, Shin J, Deng K, Benites VT, Wang G, Baidoo EEK, Chen Y, Dev I, Petzold JC and Keasling JD. (2019). Complete biosynthesis of cannabinoids and their unnatural analogues in yeast. Nature. 567:123-126.
[https://doi.org/10.1038/s41586-019-0978-9]

-
McBride A, Hudson-DiSalle S, Pilz J, Hamm M, Boring B, Buie LW and DeRemer DL. (2022). National survey on the effect of oncology drug shortages in clinical practice: A hematology oncology pharmacy association survey. JCO Oncology Practice. 18:8. https://ascopubs.org/doi/full/10.1200/OP.21.00883, (cited by 2022 Aug 5).
[https://doi.org/10.1200/OP.21.00883]

-
McCoy E and O'Connor SE. (2008). Natural products from plant cell cultures. Progress in Drug Research. Birkhauser. Basel. Switzerland. p.329-370.
[https://doi.org/10.1007/978-3-7643-8117-2_9]

-
Menhard B and Zenk MH. (1999). Purification and characterization of acetyl coenzyme A: 10-hydroxytaxane O-acetyltransferase from cell suspension cultures of Taxus chinensis. Phytochemistry. 50:763-774.
[https://doi.org/10.1016/S0031-9422(98)00674-8]

-
Mohinudeen IAHK, Kanumuri R, Soujanya KN, Shaanker RU, Rayala SK and Srivastava S. (2021). Sustainable production of camptothecin from an Alternaria sp. isolated from Nothapodytes nimmoniana. Scientific Reports. 11:1478. https://www.nature.com/articles/s41598-020-79239-5, (cited by 2022 Aug 5).
[https://doi.org/10.1038/s41598-020-79239-5]

- Moudi M, Go R, Yien CYS and Nazre M. (2013). Vinca alkaloids. International Journal of Preventive Medicine. 4:1231-1235.
-
Mross K, Hüttmann, A, Herbst K, Hanauske AR, Schilling T, Manegold C, Burk K and Hossfeld DK. (1996). Pharmacokinetics and pharmacodynamics of the new podophyllotoxin derivative NK 611. A study by the AIO groups PHASE-I and APOH. Cancer Chemotherapy and Pharmacology. 38:217-224.
[https://doi.org/10.1007/s002800050474]

-
Muranaka T, Miyata M, Ito K and Tachibana S. (1998). Production of podophyllotoxin in Juniperus chinensis callus cultures treated with oligosaccharides and a biogenetic precursor in honour of Professor GH Neil Towers 75th Birthday. Phytochemistry. 49:491-496.
[https://doi.org/10.1016/S0031-9422(98)00295-7]

-
Mutanda I, Li J, Xu F and Wang Y. (2021). Recent advances in metabolic engineering, protein engineering, and transcriptome-guided insights toward synthetic production of taxol. Frontiers in Bioengineering and Biotechnology. 9:632269. https://www.frontiersin.org/articles/10.3389/fbioe.2021.632269/full, (cited by 2022 Aug 5).
[https://doi.org/10.3389/fbioe.2021.632269]

-
Nadeem M, Palni LMS, Purohit AN, Pandey H and Nandi SK. (2000). Propagation and conservation of Podophyllum hexandrum Royle: an important medicinal herb. Biological Conservation. 92:121-129.
[https://doi.org/10.1016/S0006-3207(99)00059-2]

-
Newman DJ and Cragg GM. (2016). Natural products as sources of new drugs from 1981 to 2014. Journal of Natural Products. 79:629-661.
[https://doi.org/10.1021/acs.jnatprod.5b01055]

- Nirmala MJ, Samundeeswari A and Sankar PD. (2011). Natural plant resources in anti-cnacer therapy-A review. Research in Plant Biology. 1:1-14
-
Nobili S, Lavacchi D, Perrone G, Vicini G, Tassi R, Landini I, Grosso AM, Roviello G, Mazzanti R, Santomaggio C and Mini E. (2020). Vinorelbine in non-small cell lung cancer: real-world data from a single-institution experience. Oncology Research. 28:237-248.
[https://doi.org/10.3727/096504019X15755437099308]

-
O’Connor SE and Maresh JJ. (2006). Chemistry and biology of monoterpene indole alkaloid biosynthesis. Natural Product Reports. 23:532-547.
[https://doi.org/10.1039/b512615k]

-
Onrubia M, Cusido RM, Ramirez K, Hernandez-Vazquez L, Moyano E, Bonfill M and Palazon J. (2013). Bioprocessing of plant in vitro systems for the mass production of pharmaceutically important metabolites: Paclitaxel and its derivatives. Current Medicinal Chemistry. 20:880-891.
[https://doi.org/10.2174/092986713805219064]

-
Oudin A, Mahroug S, Courdavault V, Hervouet N, Zelwer C, Rodriguez-Concepcion M, St-Pierre B and Buralt V. (2007). Spatial distribution and hormonal regulation of gene products from methyl erythritol phosphate and monoterpene-secoiridoid pathways in Catharanthus roseus. Plant Molecualr Biology. 65:13-30.
[https://doi.org/10.1007/s11103-007-9190-7]

-
Oyenihi OR, Oyenihi AB, Erhabor JO, Matsabisa MG and Oguntibeju OO. (2021). Unravelling the anticancer mechanisms of traditional herbal medicines with metabolomics. Molecules. 26:6541. https://www.mdpi.com/1420-3049/26/21/6541, (cited by 2022 Aug 5).
[https://doi.org/10.3390/molecules26216541]

-
Pan Q, Wang Q, Yuan F, Xing S, Zhao J, Choi YH, Verpoorte R, Tian Y, Wang G and Tang K. (2012). Overexpression of ORCA3 and G10H in Catharanthus roseus plants regulated alkaloid biosynthesis and metabolism revealed by NMR-metabolomics. PLoS One. 7:1-14. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0043038, (cited by Aug 5).
[https://doi.org/10.1371/journal.pone.0043038]

-
Pant B. (2014). Application of plant cell and tissue culture for the production of phytochemicals in medicinal plants. In Adhikari R and Thapa S. (eds.). Infectious diseases and nanomedicine II. Advances in experimental medicine and biology. Springer. New Delhi. India. p.25-39.
[https://doi.org/10.1007/978-81-322-1774-9_3]

- Pi Y, Jiang K, Hou R, Gong Y, Lin J, Sun X and Tang K. (2010). Examination of camptothecin and 10-hydroxycamptothecin in Camptotheca acuminata plant and cell culture, and the affected yields under several cell culture treatments. Biocell. 34:139-143.
-
Pouvreau B, Vanhercke T and Singh S. (2018). From plant metabolic engineering to plant synthetic biology: The evolution of the design/build/test/learn cycle. Plant Science. 273:3-12.
[https://doi.org/10.1016/j.plantsci.2018.03.035]

- Priyadarshini K and Keerthi Aparajitha U. (2012). Paclitaxel against cancer: A short review. Medicinal Chemistry. 2:139-141.
-
Pu X, Zhang CR, Zhu L, Li QL, Huang QM, Zhang L and Luo YG. (2019). Possible clues for camptothecin biosynthesis from the metabolites in camptothecin-producing plants. Fitoterapia. 134:113-128.
[https://doi.org/10.1016/j.fitote.2019.02.014]

-
Pugh NI, Khan IA, Moraes RM and Pasco DS. (2001). Podophyllotoxin lignans enhance IL-1β but suppress TNF-α mRNA expression in LPS-treated monocytes. Immunopharmacology and Immunotoxicology. 23:83-95.
[https://doi.org/10.1081/IPH-100102570]

-
Raveendran VV. (2015). Camptothecin-discovery, clinical perspectives and biotechnology. Natural Products Chemistry and Research. 3:175.
[https://doi.org/10.4172/2329-6836.1000175]

-
Reed J and Osbourn A. (2018). Engineering terpenoid production through transient expression in Nicotiana benthamiana. Plant Cell Reports. 37:1431-1441.
[https://doi.org/10.1007/s00299-018-2296-3]

-
Rizvi NF, Cornejo M, Stein K, Weaver J, Cram EJ and Lee-Parsons CWT. (2015). An efficient transformation method for estrogen-inducible transgene expression in Catharanthus roseus hairy roots. Plant Cell Tissue and Organ Culture. 120:475-487.
[https://doi.org/10.1007/s11240-014-0614-1]

-
Ro DK, Paradise EM, Ouellet M, Fisher KJ, Newman KL, Ndungu JM, Ho KA, Eachus RA, Ham TS, Kirby J, Chang MCY, Withers ST, Shiba Y, Sarpong R and Keasling JD. (2006). Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature. 440:940-943.
[https://doi.org/10.1038/nature04640]

-
Robles SJ, Buehler PW, Negrusz A and Adami GR. (1999). Permanent cell cycle arrest in asynchronously proliferating normal human fibroblasts treated with doxorubicin or etoposide but not camptothecin. Biochemical Pharmacology. 58:675-685.
[https://doi.org/10.1016/S0006-2952(99)00127-6]

-
Rohani ER, Chiba M, Kawaharada M, Asano T, Oshima Y, Mitsuda N, Ohme-Takagi M, Fukushima A, Rai A, Saito K and Yamazaki M. (2016). An MYB transcription factor regulating specialized metabolisms in Ophiorrhiza pumila. Plant Biotechnology. 33:1-9.
[https://doi.org/10.5511/plantbiotechnology.15.1117a]

-
Rong Y, Huang L, Yi K, Chen H, Liu S, Zhang W, Yuan C, Song X and Wang F. (2020). Co-administration of sulforaphane and doxorubicin attenuates breast cancer growth by preventing the accumulation of myeloid-derived suppressor cells. Cancer Letters. 493:189-196.
[https://doi.org/10.1016/j.canlet.2020.08.041]

-
Rutschmann J and Renz J. (1959). Ueber säurehydrazide aus der podophyllotoxin-reihe. Helvetica Chimica Acta. 42:890-907.
[https://doi.org/10.1002/hlca.19590420334]

-
Sabzehzari M and Naghavi MR. (2019). Phyto-miRNAs-based regulation of metabolites biosynthesis in medicinal plants. Gene. 682:13-24.
[https://doi.org/10.1016/j.gene.2018.09.049]

-
Sabzehzari M, Zeinali M and Naghavi MR. (2020). Alternative sources and metabolic engineering of Taxol: Advances and future perspectives. Biotechnology Advances. 43:107569. https://www.sciencedirect.com/science/article/abs/pii/S0734975020300665, (cited by 2022 Aug 5).
[https://doi.org/10.1016/j.biotechadv.2020.107569]

-
Sadre R, Magallanes-Lundback M, Pradhan S, Salim V, Mesberg A, Jones AD and DellaPenna D. (2016). Metabolite diversity in alkaloid biosynthesis: A multilane(diastereomer) highway for camptothecin synthesis in Camptotheca acuminata. Plant Cell. 28:1926-1944.
[https://doi.org/10.1105/tpc.16.00193]

-
Sanchez-Muñoz R, Perez-Mata E, Almagro L, Cusido RM, Bonfill M, Palazon J and Moyano E. (2020). A novel hydroxylation step in the taxane biosynthetic pathway: A new approach to paclitaxel production by synthetic biology. Frontiers in Bioengineering and Biotechnology. 8:410. https://www.frontiersin.org/articles/10.3389/fbioe.2020.00410/full, (cited by 2022 Aug 5).
[https://doi.org/10.3389/fbioe.2020.00410]

- Schacter L. (1996). Etoposide phosphate: What, why, where, and how? Seminars in Oncology. 23:1-7.
-
Schiff PB, Fant J and Horwitz SB. (1979). Promotion of microtubule assembly in vitro by taxol. Nature. 277:665-667.
[https://doi.org/10.1038/277665a0]

-
Schoendorf A, Rithner CD, Williams RM and Croteau RB. (2001). Molecular cloning of a cytochrome P450 taxane 10 beta-hydroxylase cDNA from Taxus and functional expression in yeast. Proceedings of the National Academy of Sciences. 98:1501-1506.
[https://doi.org/10.1073/pnas.98.4.1501]

-
Schultz BJ, Kim SY, Lau W and Sattely ES. (2019). Total biosynthesis for milligram-scale production of etoposide intermediates in a plant chassis. Journal of the American Chemical Society. 141:19231-19235.
[https://doi.org/10.1021/jacs.9b10717]

-
Shah Z, Gohar UF, Jamshed I, Aamir Mushtaq A, Mukhtar H, Zia-UI-Haq M, Toma SI, Manea R, Moga M and Popovici B. (2021). Podophyllotoxin: History, recent advances and future prospects. Biomolecules. 11:603. https://www.mdpi.com/2218-273X/11/4/603, (cited by 2022 Aug 5).
[https://doi.org/10.3390/biom11040603]

-
Sharma A, Verma P, Mathur A and Mathur AK. (2018). Overexpression of tryptophan decarboxylase and strictosidine synthase enhanced terpenoid indole alkaloid pathway activity and antineoplastic vinblastine biosynthesis in Catharanthus roseus. Protoplasma. 255:1281-1294.
[https://doi.org/10.1007/s00709-018-1233-1]

-
Shi M, Gong H, Cui L, Wang Q, Wang C, Wang Y and Kai G. (2020). Targeted metabolic engineering of committed steps improves anti-cancer drug camptothecin production in Ophiorrhiza pumila hairy roots. Industrial Crops and Products. 148:112277.
[https://doi.org/10.1016/j.indcrop.2020.112277]

-
Sottomayor M and Barcelo AR. (2006). The vinca alkaloids: From biosynthesis and accumulation in plant cells, to uptake, activity and metabolism in animal cells. Studies in Natural Products Chemistry. 33:813-857.
[https://doi.org/10.1016/S1572-5995(06)80041-4]

-
Stähelin H and von Wartburg A. (1989). From podophyllotoxin glucoside to etoposide. Progress in Drug Research. 33:169-266.
[https://doi.org/10.1007/978-3-0348-9146-2_8]

-
Stevens LH, Blom TJM and Verpoorte R. (1993). Subcellular localization of tryptophan decarboxylase, strictosidine synthase and strictosidine glucosidase in suspension cultured cells of Catharanthus roeus and Tabernaemontana divaricata. Plant Cell Reports. 12:573-576.
[https://doi.org/10.1007/BF00233063]

-
Stoll A, Renz J and von Wartburg A. (1954). The isolation of podophyllotoxin glucoside. Journal of the American Chemical Society. 76:3103-3104.
[https://doi.org/10.1021/ja01640a094]

-
Stoll A, von Wartburg A and Renz J. (1955). The isolation of α-peltatin glucoside from the rhizomes of Podophyllum peltatum L. Journal of the American Chemical Society. 77:1709-1710.
[https://doi.org/10.1021/ja01611a110]

-
Sun J, Wei Q, Zhou Y, Wang J, Liu Q and Xu H. (2017). A systematic analysis of FDA-approved anticancer drugs. BMC Systems Biology. 11:87. https://bmcsystbiol.biomedcentral.com/articles/10.1186/s12918-017-0464-7, (cited by 2022 Aug 5).
[https://doi.org/10.1186/s12918-017-0464-7]

-
Swain SM, Honig SF, Tefft MC and Walton L. (1995). A phase II trial of paclitaxel(Taxol) as first line treatment in advanced breast cancer. Investigational New Drugs. 13:217-222.
[https://doi.org/10.1007/BF00873803]

-
Tong Y, Luo YF and Gao W. (2021). Biosynthesis of paclitaxel using synthetic biology. Phytochemistry Reviews. 21:863-877.
[https://doi.org/10.1007/s11101-021-09766-0]

-
Udomsom N, Rai A, Suzuki H, Okuyama J, Imai R, Mori T, Nakabayashi R, Saito K and Yamazaki M. (2016). Function of AP2/ERF transcription factors involved in the regulation of specialized metabolism in Ophiorrhiza pumila revealed by transcriptomics and metabolomics. Frontiers in Plant Science. 7:1861. https://www.frontiersin.org/articles/10.3389/fpls.2016.01861/full, (cited by 2022 Aug 5).
[https://doi.org/10.3389/fpls.2016.01861]

-
van Hengel AJ, Harkes MP, Wichers HJ, Hesselink PGM and Buitelaar RM. (1992). Characterization of callus formation and camptothecin production by cell lines of Camptotheca acuminata. Plant Cell, Tissue and Organ Culture. 28:11-18.
[https://doi.org/10.1007/BF00039910]

-
van Uden W, Pras N and Maingré TM. (1990). The accumulation of podophyllotoxin-β-D-glucoside by cell suspension cultures derived from the conifer Callitris drummondii. Plant Cell Reports. 9:257-260.
[https://doi.org/10.1007/BF00232296]

-
van Uden W, Pras N, Visser JF and Malingré TM. (1989). Detection and identification of Podophyllotoxin produced by cell cultures derived from Podophyllum hexandrum royle. Plant Cell Reports. 8:165-168.
[https://doi.org/10.1007/BF00716832]

-
von Wartburg A, Angliker E and Renz J. (1957). Lignanglucoside aus Podophyllum peltatum L. Helvetica Chimica Acta. 40:1331-1357.
[https://doi.org/10.1002/hlca.19570400525]

-
Walker K and Croteau R. (2000a). Molecular cloning of a 10-deacetylbaccatin III-10-O-acetyl transferase cDNA from Taxus and functional expression in Escherichia coli. Proceedings of the National Academy of Sciences. 97:583-587.
[https://doi.org/10.1073/pnas.97.2.583]

-
Walker K and Croteau R. (2000b). Taxol biosynthesis: molecular cloning of a benzoyl-CoA:taxane 2alpha-O-benzoyltransferase cDNA from Taxus and functional expression in Escherichia coli. Proceedings of the National Academy of Sciences. 97:13591-13596.
[https://doi.org/10.1073/pnas.250491997]

-
Walker K, Schoendorf A and Croteau R. (2000). Molecular cloning of a taxa-4(20),11(12)-dien-5alpha-ol-O-acetyl transferase cDNA from Taxus and functional expression in Escherichia coli. Archives of Biochemistry and Biophysics. 374:371-380.
[https://doi.org/10.1006/abbi.1999.1609]

-
Walker KD, Klettke K, Akiyama T and Croteau R. (2004). Cloning, heterologous expression, and characterization of a phenylalanine aminomutase involved in Taxol biosynthesis. Journal of Biological Chemistry. 279:53947-53954.
[https://doi.org/10.1074/jbc.M411215200]

-
Wall ME, Wani MC, Cook CE, Palmer KH, McPhail AT and Sim GA. (1966). Plant antitumor agents. I. The isolation and structure of camptothecin, a novel alkaloidal leukemia and tumor inhibitor from Camptotheca acuminate. Journal of the American Chemical Society. 88:3887-3890.
[https://doi.org/10.1021/ja00968a057]

-
Wang C, Wu C, Wang Y, Xie C, Shi M, Nile S, Zhou Z and Kai G. (2019). Transcription factor OpWRKY3 is involved in the development and biosynthesis of camptothecin and its precursors in Ophiorrhiza pumila hairy roots. Interntional Journal of Molecular Sciences. 20:3996. https://www.mdpi.com/1422-0067/20/16/3996, (cited by 2022 Aug 5).
[https://doi.org/10.3390/ijms20163996]

-
Wang Q, Xing S, Pan Q, Yuan F, Zhao J, Tian Y, Chen Y, Wang G and Tang K. (2012). Development of efficient Catharanthus roseus regeneration and transformation system using Agrobacterium tumefaciens and hypocotyls as explants. BMC Biotechology. 12:34-46.
[https://doi.org/10.1186/1472-6750-12-34]

-
Wankhede DP, Biswas DK, Rajkumar S and Sinha AK. (2013). Expressed sequence tags and molecular cloning and characterization of gene encoding pinoresinol/lariciresinol reductase from Podophyllum hexandrum. Protoplasma. 250:1239-1249.
[https://doi.org/10.1007/s00709-013-0505-z]

-
Weaver BA. (2014). How Taxol/paclitaxel kills cancer cells. Molecular Biology of the Cell. 25:2677-2681.
[https://doi.org/10.1091/mbc.e14-04-0916]

-
Wiedenfeld H, Furmanowa M, Roeder E, Guzewska J and Gustowski W. (1997). Camptothecin and 10-hydroxycamptothecin in callus and plantlets of Camptotheca acuminata. Plant Cell, Tissue and Organ Culture. 49:213-218.
[https://doi.org/10.1023/A:1005704429339]

-
Xu M, Wu C, Zhao L, Wang Y, Wang C, Zhou W, Ming Y and Kai G. (2020). WRKY transcription factor OpWRKY1 acts as a negative regulator of camptothecin biosynthesis in Ophiorrhiza pumila hairy roots. Plant Cell, Tissue and Organ Culture. 142:69-78.
[https://doi.org/10.1007/s11240-020-01833-2]

-
Yamazaki Y, Sudo H, Yamazaki M, Aimi N and Saito K. (2003a). Camptothecin biosynthetic genes in hairy roots of Ophiorrhiza pumila: Cloning, characterization and differential expression in tissues and by stress compounds. Plant and Cell Physiology. 44:395-403.
[https://doi.org/10.1093/pcp/pcg051]

-
Yamazaki Y, Urano A, Sudo H, Kitajima M, Takayama H, Yamazaki M, Aimi N and Saito K. (2003b). Metabolite profiling of alkaloids and strictosidine synthase activity in camptothecin producing plants. Phytochemistry. 62:461-470.
[https://doi.org/10.1016/S0031-9422(02)00543-5]

- Yan X, Xie T, Wang S, Wang Z, Li H and Ye Z. (2018). Apigenin inhibits proliferation of human chondrosarcoma cells via cell cycle arrest and mitochondrial apoptosis induced by ROS generation-an in vitro and in vivo study. International Journal of Clinical and Experimental Medicine. 11:1615-1631.
-
Yang DL, Sun P and Li MF. (2016). Chilling temperature stimulates growth, gene over-expression and podophyllotoxin biosynthesis in Podophyllum hexandrum Royle. Plant Physiology and Biochemistry. 107:197-203.
[https://doi.org/10.1016/j.plaphy.2016.06.010]

-
Yang M, Wang Q, Liu Y, Hao X, Wang C, Liang Y, Chen J, Xiao Y and Kai G. (2021). Divergent camptothecin biosynthetic pathway in Ophiorrhiza pumila. BMC Biology. 19:122. https://link.springer.com/article/10.1186/s12915-021-01051-y, (cited by 2022 Aug 5).
[https://doi.org/10.1186/s12915-021-01051-y]

-
Younessi-Hamzekhanlu M, Ozturk M, Jafarpour P and Mahna N. (2022). Exploitation of next generation sequencing technologies for unraveling metabolic pathways in medicinal plants: A concise review. Industrial Crops and Products. 178:114669.
[https://doi.org/10.1016/j.indcrop.2022.114669]

-
Yousefzadi M, Sharifi M, Behmanesh M, Ghasempour A, Moyano E and Palazon J. (2010). Salicylic acid improves podophyllotoxin production in cell cultures of Linum album by increasing the expression of genes related with its biosynthesis. Biotechnology Letters. 32:1739-1743.
[https://doi.org/10.1007/s10529-010-0343-4]

-
Yousefzadi M, Sharifi M, Behmanesh M, Ghasempour A, Moyano E and Palazon J. (2012). The effect of light on gene expression and podophyllotoxin biosynthesis in Linum album cell culture. Plant Physiology and Biochemistry. 56:41-46.
[https://doi.org/10.1016/j.plaphy.2012.04.010]

-
Zerbe P and Bohlmann J. (2015). Plant diterpene synthases: Exploring modularity and metabolic diversity for bioengineering. Trends in Biotechnology. 33:419-428.
[https://doi.org/10.1016/j.tibtech.2015.04.006]

-
Zhang J, Hansen LG, Gudich O, Viehrig K, Lassen LMM, Schrübbers L, Adhikari KB, Rubaszka P, Carrasquer-Alvarez E, Chen L, D'Ambrosio V, Lehka B, Haidar AK, Nallapareddy S, Giannakou K, Laloux M, Arsovska D, Jørgensen MAK, Chan LJG, Kristensen M, Christensen HB, Sudarsan S, Stander EA, Baidoo E, Petzold CJ, Wulff T, O'Connor SE, Courdavault V, Jensen MK and Keasling JD. (2022). A microbial supply chain for production of the anti-cancer drug vinblastine. Nature. 609:341-347.
[https://doi.org/10.1038/s41586-022-05157-3]

-
Zhao J and Verpoorte R. (2007). Manipulating indole alkaloid production by Catharanthus roseus cell cultures in bioreactors: From biochemical processing to metabolic engineering. Phytochemistry Reviews. 6:435-457.
[https://doi.org/10.1007/s11101-006-9050-0]

-
Zhu J, Wang M, Wen W and Yu R. (2015). Biosynthesis and regulation of terpenoid indole alkaloids in Catharanthus roseus. Pharmacognosy Reviews. 9:24-28.
[https://doi.org/10.4103/0973-7847.156323]

-
Zhu L and Chen L. (2019). Progress in research on paclitaxel and tumor immunotherapy. Cellular and Molecular Biology Letters. 24:40. https://link.springer.com/article/10.1186/s11658-019-0164-y, (cited by 2022 Aug 5).
[https://doi.org/10.1186/s11658-019-0164-y]
