산마늘 뿌리줄기 물 추출물의 항염증 및 피부장벽 강화 효과
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Atopic dermatitis is a chronic inflammatory skin disease caused by skin barrier dysfunction. Allium victorialis var. platyphyllum (AVP) is a perennial plant considered as a vegetable and herbal medicine. This study aimed to investigate the effects of AVP on skin barrier and inflammatory response and indicate its potential as a new cosmetic materials
High peformance liquid chromatography-ultraviolet analysis showed that AVP contains 0.12 ± 0.02 and 0.10 ± 0.01 ㎎/g of chlorogenic and gallic acids, respectively. AVP at 100 ㎍/㎖ was shown to increase the mRNA levels of filaggrin and involucrin, which are related to skin barrier function, by 1.50-fold and 1.43-fold, respectively. Based on a scratch assay, AVP at concentrations of 100 ㎍/㎖ and 200 ㎍/㎖ significantly increased wound closure rate and narrowed scratch area. AVP suppressed inflammation-related factors, such as cyclooxygenase 2 and nitric oxide, that were increased by lipopolysaccharide treatment. Additionally, AVP decreased the release of β-hexosaminidase which was increased by dinitrophenyl-bovine serum albumin treatment on RBL-2H3 cells.
Therefore, AVP can be developed as a functional cosmetic material for atopy management given its skin barrier protective, anti-inflammatory, and anti-pruritic effects.
Keywords:
Allium victorialis var. platyphyllum, Anti-allergy, Atopic Dermatitis, Anti-inflammatory, Rhizome, Skin Barrier서 언
아토피 피부염 (이하, 아토피)은 심한 가려움증을 동반하는 재발성 만성 알러지성 피부질환 중 하나로 서구화된 간편식 위주의 식사, 인공적 주거환경의 변화 및 미세먼지 등의 대기오염이 아토피 환자의 수를 증가시키는 요인으로 작용하고 있어 전 세계적인 아토피 발병률은 평균 10% 이상을 나타내고 있으며 계속 증가추세에 있다 (Bylund et al., 2020).
아토피는 유전적 소인을 포함하여 피부 장벽 손상과 면역 이상 반응의 복합적 요인으로 발생하며 최근에는 가려움증이 이들 원인을 더욱 악화시키는 추가적인 요인으로 인식되고 있다 (Yosipovitch et al., 2020). 또한 아토피는 발병에 따른 치료 후에도 환경적 요인, 스트레스, 다른 질병과의 연관성 등의 소인으로 인해 다시 재발할 수 있기 때문에 치료 이후의 지속적인 관리가 매우 중요하다 (de Lucas et al., 2019).
화장품 개발은 미(美)를 추구하는 목적뿐만 아니라 피부 건강을 지키기 위한 목적을 가지고 있기 때문에 화장품법에서도 일반화장품과 구분하여 피부 건강과 기능 개선, 외부 자극으로부터 피부를 보호하는데 효과적인 화장품을 기능성 화장품으로 정의하고 있으며, 아토피 관리와 예방에 대해서도 피부장벽의 기능을 회복하여 가려움 등의 개선에 도움을 주는 화장품으로 그 기능성을 제시하고 있다 (de Lucas et al., 2019).
따라서 아토피의 지속적인 관리와 재발 방지 및 피부 건강을 위한 기능성 화장품 소재 개발을 위해서는 피부 장벽의 기능을 강화하고 가려움증과 염증반응을 억제 조절하는 새로운 소재를 탐색하는 것은 매우 중요하다.
피부 장벽은 표피층의 최외각에 위치하여 장벽 (barrier) 역할을 하는 각질층 (stratum corneum)을 말한다. 각질층은 각질형성세포 (keratinocyte)가 분화되어 형성된 각질세포 (corneocyte)와 세라마이드 (ceramides), 콜레스테롤 (cholesterol) 및 유리 지방산 (free fatty acids)으로 구성된 라멜라 지질층 (lamellar lipid bilayer)으로 이루어져 있다. 이들은 벽돌 사이를 시멘트가 메워주는 구조 (bricks and mortar model)처럼 각질세포 사이를 세포간 지질이 메워줌으로써 매우 단단한 장벽층을 이루고 있어서 미생물 감염과 유해물질 노출로부터 피부를 보호하고, 수분 손실을 방지하여 건조한 외부 환경으로부터 수분 차단막 역할을 한다 (Elias, 2005; Kezic and Jakasa, 2016).
필라그린 (filaggrin, FLG), 로리크린 (loricrin, LOR), 인볼루크린 (involucrin, INV)은 피부 장벽의 구조와 기능에 영향을 미치는 중요한 단백질로 알려져 있다 (Furue, 2020). 이들 은 각질형성세포가 각질세포로 증식 및 분화하는 각화 (keratinization) 과정과 각질층을 형성하는데 관여하며, 피부 장벽 구조에서 물리적인 지질층 구조를 유지하는 역할을 하고 있다 (Candi et al., 2005).
FLG은 각질층을 이루는 케라틴 중간 미세섬유를 연결하여 각질세포 사이의 접착력을 유지하고, LOR와 INV는 각질세포를 둘러싸고 있는 각질세포 단백질 외막 (cornified protein envelope)과 각질세포 지질 외막 (cornified lipid envelope)에 서 공유결합을 형성하여 피부 장벽의 완전성 (integrity)을 형성하는 역할을 담당하고 있다 (Mu et al., 2014).
특히, FLG는 피부 장벽의 구조를 유지시켜주는 기능 뿐만 아니라 천연보습인자 (natural moisturizing factor)로서도 작용하기 때문에 FLG 생성이 감소되면 각질세포막 형성이 감소되고, 각질세포 사이의 접착력이 약화되며, 경표피 수분 손실 (transepidermal water loss)이 증가됨에 따라 피부 전반적으로 장벽의 견고함과 수분 손실 방지 기능이 감소되고 이에 따라 피부건조증과 가려움증이 생길 수 있다 (Dębińska, 2021).
Kawasaki 등 (2012)은 FLG 유전자 결핍 (Flg(-/-)) 돌연변이 생쥐에서 피부 장벽이 완전히 손상되고, 이로 인해 아토피 발생에 대한 피부 민감도를 높아졌다고 보고하였다. 이와 같이 피부 장벽이 약화되거나 손상되면 피부는 미생물 감염 및 알러지 유발물질에 대한 노출 등에 취약하게 되어지고 이에 따른 염증반응과 피부 건조증, 가려움증 등이 유발된다. 이때 발생하는 염증 유발물질과 가려움에 의한 긁는 (scratching) 자극은 피부 장벽을 더욱 손상시키는 요인으로 작용하여 아토피 유발 및 재발의 원인으로 작용한다 (Engebretsen and Thyssen, 2016; Yosipovitch et al., 2019).
‘명이나물’로 알려진 산마늘 (Allium victorialis var. platyphyllum)은 백합과 (Liliaceae) 다년생 초본식물로서 아시아 중부, 북서 아메리카 및 유럽에서 자생하고 있다 (Khan et al., 2019). 우리나라의 경우, 산마늘은 울릉도와 강원도 지역에서 식물 전초를 나물용으로 재배하여 음식으로 섭취해왔으며, 한방에서 산마늘의 말린 알뿌리를 약재로 하여 고혈압, 동맥경화, 위염, 복통 및 종기 등 다양한 질환 치료에 사용하였다고 기록되어 있다 (Choi et al., 2005; Kim et al., 2012).
산마늘의 유효성분으로 diallyl disulfide, methyl allyl disulfide, methyl allyl trisulfide, 3,4-dihydro-3-vinyl-1, 2-dithiin, 2-vinyl-1,3-dithiin, 1-kestose, neokestose와 astragalin, quercetin, kaempferol, allicin 및 ferulic acid 등 항산화 효능을 지닌 생리활성 물질이 함유되어있는 것으로 보고된 바 있다 (Nishimura et al., 1988; Hong et al., 2007; Khan et al., 2019). 산마늘에는 특히 gallic acid, chlorogenic acid, protocatechuic acid, catechin, p-coumaric acid 등의 플라보노이드와 페놀산이 지표성분으로 확인되었으며, 이러한 화합물은 각종 과일, 채소, 차, 커피 등의 식품에서 발견되는 중요한 항산화 물질로 알려져 있다 (Kothari et al., 2020).
산마늘의 생리활성 효과를 입증하는 다양한 연구들이 발표되었는데 산마늘 추출물의 혈전 및 고지혈증, 동맥경화 억제 효과 및 항암, 항산화, 항당뇨 및 간 보호 효과 등이 보고되었다 (Nishimura et al., 1988; Choi et al., 2005).
산마늘은 독특한 향과 맛을 가진 건강 식재료로 알려져 수요가 계속 증가하여 농가의 고소득 작물로 인식됨에 따라 생산력 증대를 위한 연구들이 진행되어 왔으나 (Kim et al., 2012), 대부분의 연구가 식품소재로 활용하기 위한 연구가 주를 이루고 있으며, 피부 건강과 관련되어 화장품 소재로 개발하고자 한 연구 사례는 보고된 바가 없다.
본 연구는 산마늘을 이용하여 피부 장벽의 기능을 회복하여 가려움 등의 개선에 도움을 주는 화장품 소재를 개발하여 산업적으로 활용하고자 하였다. 피부 장벽을 이루는 각질형성세포를 이용하여 FIG, INV, LOR의 발현조절과 물리적 긁힘 자극에 대한 상처 닫힘 효과를 확인하고, 염증관련 세포를 이용하여 항염증 효과와 항히스타민 효과를 확인함으로써 산마늘 뿌리줄기 물 추출물을 아토피 관리에 안전하게 사용할 수 있는 기능성 화장품 개발 소재로 제안하고자 하였다.
재료 및 방법
1. 실험재료
본 실험에 사용한 Dulbecco’s Modified Eagle’s Medium (DMEM)과 phosphate buffer saline (PBS)는 Welgene (Daegu, Korea)에서, fetal bovine serum (FBS)과 penicillin/streptomycin은 각각 GenDEPOT (Katy, TX, USA)과 Gibco (Grand Island, NY, USA)에서 구입하여 사용하였다. 그 외 본 연구에 사용한 시약들은 모두 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하여 사용하였다.
2. 산마늘 뿌리줄기 물 추출물 제조
산마늘 (A. victorialis) 시료는 전라북도 진안군에서 대량 재배된 5년생 이상의 뿌리줄기를 2021년 10월 말에 채취하여 한국농수산대학교 작물산림학부에서 식물형태학적 검증을 실시하여 확인하고 실험에 사용하였다.
천연물 추출공정에서 증숙과 고압추출은 수득률을 높이는 방법으로 사용될 수 있다고 하였으며 (Santos et al., 2017), 증숙은 추출물의 용해도를 증가시켜 추출 효율을 높이고, 고압추출은 적은 양의 용매를 사용하여 높은 압력을 가해 추출물을 분리해내는 방법으로 추출시간을 단축하고 수득률을 높이는데 사용된다.
산마늘 인경부위를 산업적 소재로 활용하기 위하여 경제적측면을 고려하여 산마늘의 수득률을 높일 수 있는 증숙과 고압추출방법을 사용하였다. 시료 1 ㎏을 선별 및 증류수로 세척하여 40℃에서 열풍 건조한 후 120℃에서 12 시간 증숙하고 다시 40℃에서 건조하여 암소에 보관하였다.
건조 보관한 산마늘 뿌리줄기 50 g에 증류수 500 ㎖를 가하여 120℃ 고압추출기 (JSAC-100, JS Research Inc., Gongju, Korea)에 3 시간 동안 추출하는 과정을 두 번 반복하였다. 획득된 추출물을 여과지 (Whatman No. 4, Middlesex, England)에 여과한 다음, 진공 농축하고, 농축 여액을 동결건조 (FD 5510 SPT, IlsinBioBase, Dongducheon, Korea)하여 산마늘 추출 분말을 얻었으며 시험에 사용하기 전까지 -20℃에 냉동보관하였다.
산마늘 뿌리줄기 물 추출물 (AVP)의 수율은 52.16%로 확인되었다.
3. HPLC 분석 조건
화장품원료로서 기능성을 가진 산마늘을 산업적으로 활용하기 위해서는 추출과정에서 균일화된 품질관리가 중요하다. 본 연구는 인체적용에 대한 안전성을 크게 확보하기 위하여 물용매를 이용하여 산마늘을 추출하고 이를 증숙과 고압추출방법으로 수득률을 높였다. 이러한 제조 과정에서 품질을 유지하기 위해 산마늘 추출물의 품질을 평가하는 지표성분으로 gallic acid, chlorogenic acid, protocatechuic acid, catechin, p-coumaric acid 등의 플라보노이드와 페놀산 성분을 선발하였고, 이 중에서 gallic aid와 chlorogenic acid가 낮은 농도로 검출되었다. 이에 AVP의 품질관리를 위한 지표성분으로 gallic acid 및 chlorogenic acid의 함량을 프로파일로 제시하고 다음과 같은 분석법을 이용하였다.
지표성분으로 선정된 gallic acid 및 chlorogenic acid의 함량을 정량하기 위하여 DIONEX Ultimate 3000 (Thermo Fisher Scientific Inc., Waltham, WA, USA) 기기를 사용하여 수행하였으며, HPLC에 시료 및 표준품 1 ㎕를 주입하여 1.0 ㎖/min의 유속으로 분석하였다. 표준물질의 농도 범위는 0.1 ㎍/㎖ - 100 ㎍/㎖이었다.
이동상으로는 (A) water (0.1% formic acid)와 (B) acetonitrile (0.1% formic acid)를 사용하여 gradient elution 방법으로 분석 프로그램을 적용하였다 [gradient 조건 : 0 분 - 15 분 (A : B = 92 : 8) → 15 분 - 18 분 (A : B = 50 : 50) → 18 분 - 20 분 (A : B = 60 : 40) → 20 분 - 22 분 (A : B = 8 : 92)]. Column은 ZORBAX Eclipse plus (C18, 250 ㎜ × 4.6 ㎜, 5 ㎛, Agilent Technologies Inc., Santa Clara, CA, USA)을 사용하였으며, 검출기 파장을 280 ㎚로 고정하여 분석하였다.
4. 세포주 및 세포배양 조건
Human keratinocyte HaCaT 세포와 rat basophilic leukemia cell line RBL-2H3 세포는 CLS Cell Lines Service (Eppelheim, Baden-Württemberg, Germany)에서, macrophage RAW264.7 세포는 한국세포주은행 (KCLB, Seoul, Korea)에서 분양받아 실험에 사용하였다.
HaCaT, RBL-2H3, RAW264.7 세포는 DMEM에 10% FBS, 100 U/㎖ penicillin, 100 ㎍/㎖ streptomycin을 첨가한 배지를 사용하여 단층으로 37℃, 5% CO2 배양기 (Forma Direct Heat CO2 Incubator, Thermo Fisher Scientific Inc., Waltham, WA, USA)에서 배양하였다. 계대 배양을 위해 0.01 M의 ethylene-diamine-tetraacetic acid (EDTA)를 함유하는 0.125% trypsin을 사용하여 세포를 분리하였다.
5. 세포 생존율 측정
AVP의 HaCaT, RAW264.7 및 RBL-2H3 세포에 독성이 나타나는 농도를 확인하기 위해 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylte-trazolium bromide (MTT) 분석법을 이용하여 확인하였다
96-well plate에 HaCaT, RAW264.7, RBL-2H3 세포를 1 × 104 cells/well의 세포수로 부착한 후, AVP를 12.5, 25, 50, 100, 200, 400 ㎍/㎖로 처리하여 24 시간 동안 배양하였다. 5 ㎎/㎖의 MTT를 첨가하고 3 시간에서 4 시간 동안 반응한 후 상등액을 제거하였다. 형성된 formazan을 DMSO 200 ㎕에 녹이고 microplate reader VICTOR X3 (PerkinElmer Inc., Waltham, MA, USA)를 이용하여 540 ㎚에서 흡광도를 측정하였다. 세포 생존율은 대조군과 비교하여 흡광도의 백분율로 표시하였다.
6. Quantitative real-time polymerase chain reaction (qRT-PCR)
AVP의 농도별 처리에 따라 HaCaT 세포에서 피부장벽 구성성분 단백질인 filaggrin, involucrin, loricrin의 mRNA 발현 및 RAW264.7 세포에서 prostaglandin의 생성과 연관된 COX-2 mRNA 발현 수준을 검정하기 위해 real-time quantitative reverse transcription polymerase chain reaction (qRT-PCR)로 실시하였다
세포 독성 검정에서 독성이 없는 범위 내에서 Trizol™ (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 total RNA를 추출하였고 cDNA 합성 키트 (ECDNA100, NanoHelix Co., Ltd., Daejeon, Korea)를 이용하여 cDNA를 합성하였다. 이후 Premier qPCR Kit (PQL-S500, NanoHelix, Daejeon, Korea)를 사용하여 PCR을 증폭하였다.
cDNA 합성 조건은 65℃에서 5 분간 RNA denaturation 시킨 후 42℃에서 1 시간 동안 cDNA를 합성하고 95℃에서 5 분간 reverse transcriptase를 불활성화시켰다. PCR 조건은 95℃에서 30 초간 pre-denaturation을 한 후 95℃에서 5 초, 60℃에서 30 초를 40 cycle로 반응하여 원하는 형광값을 검출하였다. 사용된 프라이머 서열은 다음과 같다 (Table 1).
7. 각질형성세포 이동에 의한 상처 닫힘 효과
6-well plate에 HaCaT 세포를 8 × 105 cells/well의 수준으로 부착한 후, 세포의 수가 80%에서 90% 정도 채워졌을 때 FBS 무첨가 (serum free) 배지로 교체하여 12 시간 동안 starvation 시켰다.
각 well에 200 ㎕의 pipette tip을 이용하여 스크래치 한 후, 농도별로 희석한 AVP 25, 50, 100, 200 ㎍/㎖를 처리하여 24 시간 동안 배양하였다. 현미경용 카메라 DigiRetina 16 Camera (TUCSEN, Fuzhou, China)를 이용하여 12 시간, 24 시간 배양 후에 촬영하고, 촬영된 이미지는 image J soft ware 프로그램 (National Institutes of Health, Bethesda, MD, USA)을 이용하여 상처 닫힘 정도를 수치화하였다.
8. Nitric oxide (NO) 분비량 측정
NO의 농도는 배양액 내의 nitrite 농도를 Griess 반응을 이용하여 측정하였다. 6-well plate에 RAW264.7 세포를 4 × 105 cells/well의 세포 수로 부착한 후, 1 ㎍/㎖의 LPS와 AVP 25, 50, 100, 200 ㎍/㎖를 처리하여 18 시간 동안 배양하였다.
배양액의 상층액을 얻은 후, 동량의 Griess 시약 (1% sulfanilamide + 0.1% naphthylendiamine dihydrochloride, 1 : 1)을 첨가하여 실온에서 10 분간 반응시킨 후, microplate reader VICTOR X3 (PerkinElmer Inc., Waltham, MA, USA)를 이용하여 540 ㎚에서 흡광도를 측정하였다. 세포배양액 내 NO의 농도는 sodium nitrite (NaNO2)의 농도별 표준곡선과 비교하여 산출하였다
9. β-Hexosaminidase 분비량 측정
알레르기 활성을 평가하기 위한 지표로서 비만세포에서의 β-hexosaminidase 분비량을 측정하였다
24-well plate에 RBL-2H3 세포를 5 × 105 cells/well의 세포수로 분주한 후 12 시간 배양한 다음 DNP-IgE (0.1 ㎍/㎖)를 처리하여 4 시간 동안 감작시켰다. 상층액을 제거 후 siraganian buffer (119 mM NaCl, 5 mM KCl, 5.6 mM glucose, 0.4 mM MgCl2, 25 mM PIPES, 1 mM CaCl2, 0.1% BSA, pH 7.2)로 3 회 세척한 다음 siraganian buffer로 10분 동안 37℃에서 배양하였다. AVP 25, 50, 100, 200 ㎍/㎖를 20 분간 처리하고 DNP-BSA (1 ㎍/㎖)를 30 분간 처리하여 탈과립시킨 후 ice bath에서 10 분간 방치함으로써 반응을 종결시켰다
β-Hexosaminidase의 분비 정도를 확인하기 위하여 상등액을 취해 vortex 한 후 96-well plate에 상등액 12.5 ㎕를 옮기고 4-p-nitrophenyl-N-acetyl-β-D-glucosaminide 2 mM와 sodium citrate 0.05 M로 구성된 substrate buffer (pH 4.5) 12.5 ㎕를 넣어 37℃에서 1 시간 동안 반응하도록 배양하였다. 각 well 당 stop solution (0.1 M Na2CO3/NaHCO3, pH 10.0) 200 ㎕를 첨가하여 반응을 종결시키고 microplate reader VICTOR X3 (PerkinElmer Inc., Waltham, MA, USA)를 이용하여 405 ㎚에서 흡광도를 측정하였다.
10. 통계분석
본 실험의 결과는 4 회 이상 반복한 값을 평균 ± 표준편차 (means ± SD)로 나타내었다. 각 실험 결과에 대한 통계분석은 GraphPad Prism 7 Software (San Diego, CA, USA)를 이용하여 One-way analysis of variance (ANOVA)의 Tukey’s test를 통해 각각 5%와 1%에서 유의수준을 검정하였다 (p < 0.05, p < 0.01).
결과 및 고찰
1. 산마늘 뿌리줄기 물 추출물의 지표성분 함량 분석
지금까지 알려진 산마늘의 유효성분은 대부분 아세톤, 헥산, 메틸렌클로라이드, 메탄올, 에탄올 등의 용매 추출물에 함유된 화합물의 분석에 관한 보고들이다 (Nishimura et al., 1988; Hong et al., 2007; Khan et al., 2011; Kim et al., 2012; Woo and Lee, 2013). 그러나, 대부분의 유기 용매들은 발암성 등의 안전성에 관한 논란이 있으며, 천연물 추출 용매의 요건으로 추출 효율, 안전성, 불연성, 경제성 등이 요구되고 있다 (Tiwari et al., 2011). 물은 광범위한 극성 화합물을 추출하기에 가장 적합하며, 독성이 없고, 불연성의 우수한 추출 용매로 여겨지고 있다 (Tiwari et al., 2011).
본 연구에서는 산마늘 뿌리줄기 물 추출물 (AVP) 중 품질표준화를 위한 지표성분으로 수용성 성분의 플라보노이드 및 페놀계 화합물로 알려진 gallic acid와 chlorogenic acid의 함량을 HPLC 방법으로 분석하였다. 그 결과 gallic acid, chlorogenic acid는 각각 약 2.77, 5.42 분의 retention time을 가진 단일의 peak가 확인되었다 (Fig. 1A).

HPLC chromatogram of the standard and the aqueous extract of A. victorialis showing gallic acid and chlorogenic acid.(A); Chromatogram of gallic acid and chlorogenic acid (standards), (B); Chromatogram of the AVP. AVP; aqueous extract of A. victorialis, HPLC; high-performance liquid chromatography.
본 연구에서는 산마늘의 산업적 활용도를 높이기 위해 증숙을 통해 추출물의 용해도를 증가시키고 높은 압력으로 추출물을 분리해내는 방법의 고압증숙법으로 추출 효율을 높였다. 그 결과, AVP는 52.16%의 높은 수득률을 나타내었으나, 주요 생리활성물질로 알려진 gallic aicd (0.10 ± 0.01 ㎎/g)와 chlorogenic acid (0.12 ± 0.02 ㎎/g)의 함량은 높게 나타나지않았다 (Fig. 1B).
고온, 고압, 증숙 처리과정에서 페놀성화합물과 플라보노이드의 함량 변화가 나타날 수 있는데, 이는 물질마다 다르게 나타날 수 있으며, 처리공정 과정에서 용출되어지는 성분간에서도 반응이 일어날 수 있다고 보고되었다 (Xu and Chang, 2008). Xu 등은 검은콩과 노란콩을 이용한 연구에서 열탕 (boiling)과 증숙 (steaming) 공정이 모두 총페놀함량과 총플라보노이드 함량을 감소시킨다고 보고하였다. 그러나 고압증숙 (pressure steaming)의 경우 노란콩은 총페놀함량을 증가시켰으며, 개별 페놀화합물의 경우에는 검은콩과 노란콩이 모두 gallic acid의 함량은 증가되고, chlorogenic acid는 감소하였다고 보고하였다 (Xu and Chang, 2008). 다음해 동일 연구팀은 일반증숙과 고압증숙을 비교하여 완두콩과 렌즈콩 (lentil)의 페놀화합물 함량 변화를 분석하였는데, 고압증숙 추출법에서 렌즈콩은 총페놀산함량 뿐만 아니라 gallic acid와 chlorogenic acid의 함량을 모두 감소시켰다고 보고하였다. 이는 AVP를 고압증숙 처리한 결과에서 gallic acid와 chlorogenic acid의 함량이 낮게 측정된 결과와 유사하다. Xu 연구팀은 고온, 고압, 증숙 등 추출공정에 의한 구성 성분의 변화는 검은콩, 노란콩, 렌즈콩 등 같은 콩류라도 물질마다 다르며, 추출법에 의한 페놀화합물, 플라보노이드 및 안토시아닌의 함량 변화가 항산화활성 등의 효능 차이로 이어진다고 설명하였다 (Xu and Chang, 2009).
Gallic acid와 chlorogenic acid는 잎, 뿌리 및 종자 등에서 존재하며 우수한 항산화력과 항염증, 항암, 항고지혈증, 지질과산화 억제 작용, 혈당 조절 효과 및 심장 독성 보호 효과 등 다양한 생리활성 효과가 보고된 친수성 물질이다 (Zanwar et al., 2014; Wang et al., 2022). 또한, 매우 안전한 물질로도 알려져 있는데, gallic acid의 경우 급성 경구 독성 연구에서 최대 무해 용량이 5,000 ㎎/㎏ 이상, 아급성 독성 연구에서는 1,000 ㎎/㎏ 까지 무독성이거나 치명적인 독성이 관찰되지 않았으며 (Zanwar et al., 2014), chlorogenic acid도 급성및 아급성 경구 독성 연구에서 1,000 ㎎/㎏까지 독성이 나타나지 않았다고 보고되었다 (Venkatakrishna et al., 2021).
AVP의 gallic acid와 chlorogenic acid는 산마늘 물추출물의 효능에 대한 유효성분으로 제시하기에는 그 함량이 낮았지만, 고압증숙 공정으로 추출한 AVP의 품질관리를 위한 지표성분 프로파일 성분으로서 gallic acid와 chlorogenic acid 두 성분을 함께 제시할 수 있을 것으로 생각되었다. 향후 산마늘의 추출효율을 높이기 위한 고온, 고압, 증숙 등의 추출공정에 따른 성분변화와 효능에 대한 상관관계에 대한 연구가 더 이루어져야 할 것으로 보인다.
2. 산마늘 뿌리줄기 물 추출물이 세포 생존에 미치는 영향
본 연구에서는 산마늘 추출물이 인간 유래 각질형성세포주 HaCaT, 마우스 대식세포주 RAW264.7 및 랫드 호염기성 백혈병 비만세포주 RBL-2H3에 대한 피부 장벽 강화 및 항염증 효능을 평가하기 위하여 세포 독성이 나타나지 않는 유효농도 범위를 설정하고자 하였다.
AVP를 12.5, 25, 50, 100, 200, 400 ㎍/㎖의 농도로 각각의 세포에 처리한 결과, AVP를 200 ㎍/㎖ 수준까지 모든 세포주의 세포 생존율에 영향을 주지 않았으며, RAW264.7를 대상으로 AVP를 400 ㎍/㎖로 처리한 경우에서도 96.22%의 높은 세포 생존율이 관찰되었다 (Fig. 2A - 2C).
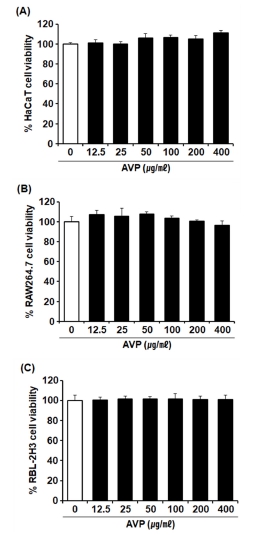
Cell viability of the aqueous extract of A. victorialis on HaCaT, RAW264.7, and RBL-2H3 cells.(A); HaCaT cells, (B); RAW264.7 cells, and (C); RBL-2H3 cells were treated with AVP for 24 h. Data are presented as the means ± SD (n = 5). P values were calculated by ANOVA and Tukey’s test.
이에 본 연구에서 대상 세포주에 대한 세포 생존에 영향을 주지 않은 AVP 200 ㎍/㎖ 이하 농도의 범위로 설정하고 진행하였다.
3. 산마늘 뿌리줄기 물 추출물이 각질형성세포에서 filaggrin, involucrin, loricrin의 mRNA 발현에 미치는 영향
각질세포는 표피세포의 주요 구성 요소로서 활발한 증식과 분화과정을 거쳐 각질화를 통해 피부 장벽을 형성한다. 이러한 각질세포 분화에 중요한 역할을 하는 각질형성세포 (keratinocyte)는 기저층에서 형성되어 상위층으로 이동하여 분화하게 되는데, filaggrin은 각질세포의 단백질인 케라틴과 keratin-filaggrin 복합체를 형성하고 loricrin과 involucrin, envoplakin 등을 포함하는 다양한 세포골격 및 장벽 관련 분자와 결합하여 불용성의 견고한 각질세포 외막을 형성함으로써 피부장벽 기능을 하게 된다 (Kalinin et al., 2001; Furue, 2020). 따라서, 정상적인 표피 항상성 유지를 확인하는 주요한 단백질로 filaggrin (FLG), loricrin (LOR), involucrin (INV) 등의 발현 조절 효과는 피부장벽기능 개선에 도움이 될 수 있는 소재의 효능 평가 방법으로 활용되고 있다 (Lee et al., 2014).
본 연구에서 산마늘 뿌리줄기 물 추출물의 피부 표피 항상성에 관여하는 피부장벽 구성 단백질 발현 조절 효능을 확인하기 위해 각질형성세포주 HaCaT에 AVP를 농도별로 처리하여 FLG, INV, LOR의 mRNA 발현을 확인하였다. 양성대조군인 CaCl2는 FLG, INV, LOR의 mRNA 발현을 대조군에 비해 각각 1.36 배, 1.73 배, 2.82 배 증가시켰다. AVP 처리군에서 FLG 및 INV mRNA 발현이 100 ㎍/㎖까지 농도 의존적으로 증가하였으며, AVP 100 ㎍/㎖ 처리군에서 대조군에 비해 FLG 1.50 배, INV 1.43 배 유의적으로 (p < 0.01) 증가하였다. 하지만, AVP 200 ㎍/㎖ 처리군에서는 FLG 및 INV의 mRNA의 발현이 대조군에 비해 유의적인 효과를 나타내지 않았다.
다양한 생리활성물질이 함유된 천연소재의 경우, 농도가 증가하더라도 최대 반응 (maximal response) 농도에 도달하면 더 큰 효과를 일으키지 못하는 현상이 나타날 수 있다 (Mathijssen et al., 2014). 이에 따라, AVP의 FLG 및 INV의 mRNA 발현 조절에 대한 결과는 최대 반응 농도와 관련된 것으로 생각된다.
AVP의 농도가 증가할수록 함유 유효성분의 농도도 높아지면서 효능을 상쇄하는 성분도 함께 증가하여 이들 간의 상호작용이 오히려 효능을 약화시키는 결과를 나타내는 것으로 추측할 수 있다. 이는 향후 AVP의 유효성분 함량과 효능 간의 상관관계에 대한 추가적인 연구가 필요함을 제시한다고 하겠다. 또한 AVP의 농도별 처리에 따른 LOR mRNA 발현에는 통계적 유의성을 나타내지 않았다 (Fig. 3A - 3C).
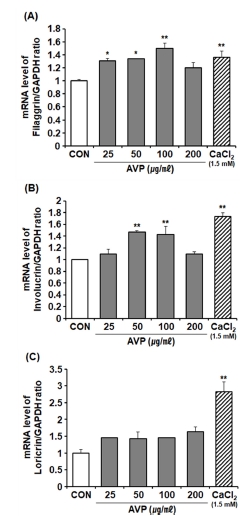
Effect of A. victorialis on the mRNA expression of filaggrin, involucrin, and loricrin.HaCaT cells were treated with AVP for 24 h. Positive control was 1.5 mM CaCl2 to induce differentiation. The mRNA expression levels of (A); filaggrin, (B); involucrin, and (C); loricrin were determined using qRT-PCR. The results were normalized to the mRNA levels of GAPDH and expressed as an index of the untreated control (CON). CON; untreated control, AVP; Aqueous extract of A. victorialis. Data are presented as the means ± SD (n = 4). P values were calculated by ANOVA and Tukey’s test (*p < 0.05 and **p < 0.01 vs control)
본 연구 결과는 산마늘 뿌리줄기 물 추출물이 피부 장벽 기능에 기여하는 중요한 표피 단백질로서 FLG 및 INV를 선택적으로 조절함으로써 피부 장벽 강화에 도움을 줄 수 있을 것으로 생각되며, 향후 단백질의 선택적 조절 메커니즘에 대한 추가적인 연구가 필요할 것으로 판단된다.
특히, FLG는 각질세포 내 천연보습인자를 함유하여 건조한 외부 환경으로부터 최적화된 방어 역할을 하는 것으로 알려졌으며 (Dębińska, 2021), 산마늘 뿌리줄기 물 추출물의 FLG 조절 효과는 피부 보습에 도움을 줄 수 있는 기능성 소재로서의 가능성을 제시한다고 하겠다.
4. 산마늘 뿌리줄기 물 추출물의 긁힘에 대한 각질형성세포 상처 닫힘 효과
각질세포는 피부 장벽을 구성하는 주요 세포이며 각질형성 세포가 분화되면서 형성되는데, 기저층에서부터 형성되어 분화된 새로운 각질세포는 표피 외층으로 이동한다. 따라서 각질형성세포의 이동은 피부 장벽의 형성과 유지에 매우 중요하다 (Lowes et al., 2007; Li et al., 2014).
본 연구에서는 AVP의 물리적 긁힘에 대한 각질형성세포의 상처 닫힘을 측정함으로써 피부 장벽 형성의 촉진 효과를 확인하고자 하였다. 각질형성세포 HaCaT 세포주에 scratch를 내어 긁힘으로 열린 상처를 만들고 AVP를 처리하여 24 시간 경과 후의 상처에 대한 닫힘 정도를 측정하였다. 그 결과, AVP는 24 시간 경과 후 농도 의존적으로 상처 닫힘 속도가 증가되었으며, 특히, 100, 200 ㎍/㎖의 농도에서 대조군에 비하여 1.39 배, 1.29 배의 통계적으로 유의미한 수준으로 상처 닫힘 속도의 증가되어지는 것을 관찰하였다 (Fig. 4A and 4B, p < 0.01).
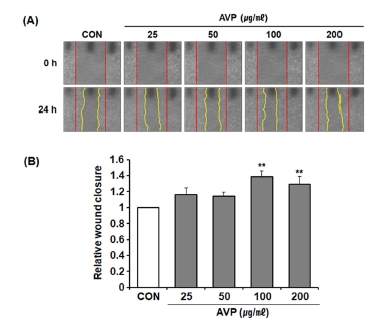
Effect of A. victorialis on the wound closure of HaCaT cells.(A); Image of wound closure of AVP ranged from 25 to 200 ㎍/㎖, (B); Bar graph depicting relative wound closure width, which was defined as the difference between the initial wound width (at 0 hours) and the wound width after 24 hours. AVP; aqueous extract of A. victorialis. Data are presented as the means ± SD (n = 4). P values were calculated by ANOVA and Tukey’s test (*p < 0.05 and **p < 0.01 vs control)
피부 각질층이 손상되면 상처 주변의 세포들은 각질세포 재생을 통해 상처 치유과정을 진행하는데, 이때 FLG, LOR, INV 등의 단백질이 각질층 재생 과정에서 중요한 역할을 하는 것으로 알려졌다 (Arai et al., 2013). 특히, INV는 피부 상처의 상피세포 재생에 중요한 역할을 한다고 보고되었다 (Obedencio et al., 1999). 이를 종합해보면 본 연구 결과 산마늘 뿌리줄기 물 추출물이 FLG과 INV의 상향 조절을 통해 각질세포 분화 유도를 통한 상처 닫힘 증가에 영향을 줄 수 있으며, 피부 장벽 개선에 효과적인 소재로 활용할 수 있음을 나타낸다고 하겠다.
5. 산마늘 뿌리줄기 물 추출물의 COX-2 mRNA 발현 및 NO 분비량 효과
정상적인 피부 장벽은 미생물 및 알레르겐 등에 대한 선천적 면역 메커니즘에서 최초로 작용하는 방어막으로 작용하며, 인체의 면역 체계와 사이토카인은 피부 장벽 단백질 발현 및 기능과 밀접한 연관이 있다고 알려져 있다 (Mu et al., 2014).
특히, FLG 단백질의 이상은 피부 장벽의 무결성 (integrity)을 파괴하고, 박테리아 및 알레르겐을 포함한 환경 요인에 대한 노출을 촉진하여 피부 장벽 기능의 상실에 의한 급성 피부염증과 아토피염 등의 피부질환을 촉진한다고 보고되었다 (Mu et al., 2014).
이전 연구들에서 nitric oxide (NO), prostaglandin E2 (PGE2), 염증성 사이토카인 (cytokine) 등의 염증매개인자는 표피 증식, 분화 및 피부 상처 치유를 포함한 다양한 표피 기능을 조절과 관련이 있으며, 염증 상태에서 PEG2 등 염증인자 생산의 증가와 FLG 발현을 감소를 유도함으로써 피부 장벽을 손상시킬 수 있다고 보고하였다 (Lee et al., 2016; Kitano et al., 2017; Dang et al., 2020)
따라서, 염증매개인자의 조절은 피부 장벽의 항상성 유지에 중요한 요소로 판단되었으므로, 본 연구에서 산마늘 추출물이 대식세포의 COX-2 mRNA 발현과 NO 분비량에 미치는 영향을 측정하였다. Lipopolysaccharide (LPS)에 의해 증가된 COX-2 mRNA 발현은 AVP를 25 ㎍/㎖에서 200 ㎍/㎖까지 처리됨에 따라 모든 농도에서 농도 의존적으로 크게 억제되었다. 특히, AVP 200 ㎍/㎖ 처리군에서 COX-2 mRNA 발현이 대조군 대비 약 46.10% 억제되었으며, 양성대조군인 celecoxib (CEL, 5 µM)의 억제율인 78.05%보다 효과적이지는 않았으나, 유의적인 수준으로 COX-2 mRNA 발현을 억제하였다 (Fig. 5A). 또한, AVP 25, 50, 100, 200 ㎍/㎖에서 NO 분비를 각각 15.60%, 25.19%, 29.70%, 35.13%로 억제하였으며, 양성대조군인 dexamethasone (DEX, 100 µM)의 억제율 (67.39%)보다 효과적이지는 않았으나, 유의적인 수준으로 NO 분비를 억제하였다 (Fig. 5B)
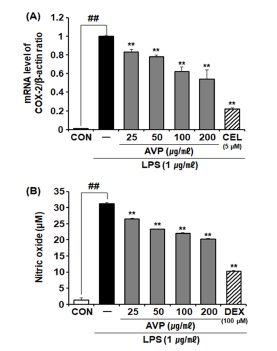
Effect of A. victorialis on NO production and COX-2 mRNA expression in LPS-stimulated RAW264.7 cells.(A); Effect of AVP (25, 50, 100, and 200 ㎍/㎖) on mRNA expressions of COX-2 was determined by quantitative real-time PCR analysis. and (B); Effect of AVP (25, 50, 100, and 200 ㎍/㎖) on NO production in LPS-induced RAW264.7 cells was measured by NO assay. Data are presented as means ± SD (n = 4). P values were calculated by ANOVA and Tukey’s test. ## and ** indicate p < 0.01 when compared with the control group (CON) and treatment control group, respectively. CON; untreated control, AVP; Aqueous extract of A. victorialis, LPS; lipopolysaccharide, COX-2; cyclooxygenase-2, NO; nitric oxide, CEL; celecoxib, DEX; dexamethasone.
이전 보고된 연구들에서 산마늘 지상부의 에탄올 추출물이 대식세포에서 LPS에 의해 증가된 NO 분비 조절 효능이 보고된 바 있으나 (Lee, 2015), 본 연구에서는 산마늘 뿌리줄기의 물 추출물이 염증매개인자 조절을 통해 피부 장벽 손상으로부터 보호하고 만성염증으로의 진행을 지연시킬 수 있는 소재로서의 가능성을 제시하고자 하였다.
6. 산마늘 뿌리줄기 물 추출물의 β-hexosaminidase 분비 조절 효과
아토피를 비롯한 각종 피부염의 초기 증상은 비만세포에서 분비되는 히스타민에 의해 유발되며 치료를 위해 항히스타민제 계열의 약물을 사용하는 것이 일반적이며 β-hexosaminidase는 탈과립의 바이오마커로 알려져 있다 (Ban et al., 2012).
AVP의 항알러지 효과를 확인하기 위하여 AVP를 RBL-2H3 세포에 처리하여 β-hexosaminidase 분비 효과를 측정한 결과, anti-DNP IgE로 감작된 RBL-2H3에서 DNP-BSA로 유도한 β-hexosaminidase 분비량은 대조군에 비해 131.32% 증가하였으며, AVP 50, 100, 200 ㎍/㎖ 처리에 의해 각각 19.15%, 25.35%, 27.69% 억제되었다 (Fig. 6).
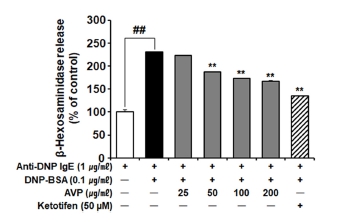
Effect of A. victorialis on β-hexosaminidase release.AVP treated (25, 50, 100, and 200 ㎍/㎖) in DNP-IgE/BSA sensitized RBL-2H3 cells. Data are presented as means ± SD (n = 4). P values were calculated by ANOVA and Tukey’s test. ## and ** indicate p < 0.01 when compared to the anti-DNP IgE group and the DNP-IgE/BSA group, respectively. AVP; Aqueous extract of A. victorialis, DNP-BSA; dinitrophenyl-bovine serum albumin conjugate, anti-DNP IgE; anti-dinitrophenyl immunoglobulin E.
AVP는 양성대조군으로 사용된 ketotifen (50 µM)의 억제율인 41.59%보다 낮은 수준이기는 하지만 유의적으로 β-hexosaminidase 분비량을 억제하는 것을 확인하였다. 이러한 연구 결과는 AVP가 β-hexosaminidase 분비를 유의적으로 억제함으로써 초기 알러지 반응과 가려움증을 매우 효과적으로 제어할 수 있음을 의미한다.
피부 장벽을 증진시키는 것은 손상된 피부 장벽과 가려움증 및 염증을 주요 특징으로 하는 아토피 치료와 관리에 매우 우수한 접근방법이다 (Kim et al., 2013). 본 연구를 통하여 산마늘 뿌리줄기 물 추출물은 각질형성세포에서 FLG과 INV의 발현을 증가시키고 (Fig. 3A and 3B), 물리적 긁힘에 대한 각질형성세포의 이동과 회복을 촉진시켰다 (Fig. 4). 또한, 산마늘 뿌리줄기 물 추출물은 알러젠 자극에 의한 가려움증 관련 물질 β-hexosaminidase의 탈과립 분비를 억제하였으며 (Fig. 6), 염증유발물질 COX-2 발현과 NO의 생성을 억제함을 확인하였다 (Fig. 5). 이는 산마늘 추출물이 피부 장벽의 개선 뿐만 아니라 가려움증과 염증을 억제 조절하는 효과적인 소재임을 제시한다
따라서 본 연구에 사용된 산마늘 뿌리줄기 물 추출물은 안전한 식품 원료로서 피부장벽의 기능을 회복하고, 염증과 가려움증을 개선하는 새로운 화장품 소재로서 개발 가능성이 높다고 하겠다.
Acknowledgments
본 연구는 2022년도 중소벤처기업부의 기술개발사업(과제번호: S3216587)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Arai M, Matsuzaki T and Ihara S. (2013). Wound closure on the neonatal rat skin I. The modulation of the thickness of epidermis at the closing incisional wounds. CellBio. 2:248-256.
[https://doi.org/10.4236/cellbio.2013.24027]

- Ban HJ, Park DI and Kang KH. (2012). Inhibitory effect of Artemisiae asiaticae herba on degranulation, production of cytokine, and FcεRI expression in RBL-2H3 cells. Journal of Physiology and Pathology in Korean Medicine. 26:915-921.
-
Bylund S, von Kobyletzki LB, Svalstedt M and Svensson Å. (2020). Prevalence and incidence of atopic dermatitis: A systematic review. Acta Dermato-Venereologica. 100:320-329.
[https://doi.org/10.2340/00015555-3510]

-
Candi E, Schmidt R and Melino G. (2005). The cornified envelope: a model of cell death in the skin. Nature Reviews Molecular Cell Biology. 6:328-340.
[https://doi.org/10.1038/nrm1619]

- Choi JW, Lee KT, Kim WB, Park KK, Chung WY, Lee JH, Lim SC, Jung HJ and Park HJ. (2005). Effect of Allium victorialis var. platyphyllum leaves on triton WR-1339-induced and poloxamer-407-induced hyperlipidemic rats and on diet-induced obesity rats. Korean Journal of Pharmacognosy. 36:109-115.
-
Dang E, Man G, Zhang J, Lee D, Mauro TM, Elias PM and Man MQ. (2020). Inducible nitric oxide synthase is required for epidermal permeability barrier homeostasis in mice. Experimental Dermatology. 29:1027-1032.
[https://doi.org/10.1111/exd.14176]

-
de Lucas R, García-Millán C, Pérez-Davó A, Moreno E and Redondo P. (2019). New cosmetic formulation for the treatment of mild to moderate infantile atopic dermatitis. Children. 6:17. https://www.mdpi.com/2227-9067/6/2/17, (cited by 2023 March 14).
[https://doi.org/10.3390/children6020017]

-
Dębińska A. (2021). New treatments for atopic dermatitis targeting skin barrier repair via the regulation of FLG expression. Journal of Clinical Medicine. 10:2506. https://www.mdpi.com/2077-0383/10/11/2506, (cited by 2023 March 14).
[https://doi.org/10.3390/jcm10112506]

-
Elias PM. (2005). Stratum corneum defensive functions: An integrated view. Journal of Investigative Dermatology. 125:183-200.
[https://doi.org/10.1111/j.0022-202X.2005.23668.x]

-
Engebretsen KA and Thyssen JP. (2016). Skin barrier function and allergens. Current Problems in Dermatology. 49:90-102.
[https://doi.org/10.1159/000441548]

-
Furue M. (2020). Regulation of filaggrin, loricrin, and involucrin by IL-4, IL-13, IL-17A, IL-22, AHR, and NRF2: Pathogenic implications in atopic dermatitis. International Journal of Molecular Sciences. 21:5382. https://www.mdpi.com/1422-0067/21/15/5382, (cited by 2023 March 14).
[https://doi.org/10.3390/ijms21155382]

- Hong EY, Choi SI and Kim GH. (2007). Determination of flavonoids from Allium victorialis var. platyphyllum and their effect on gap junctional intercellular communication. Food Science and Biotechnology. 16:747-752.
-
Kalinin A, Marekov LN and Steinert PM. (2001). Assembly of the epidermal cornified cell envelope. Journal of Cell Science. 114:3069-3070.
[https://doi.org/10.1242/jcs.114.17.3069]

-
Kawasaki H, Nagao K, Kubo A, Hata T, Shimizu A, Mizuno H, Yamada T and Amagai M. (2012). Altered stratum corneum barrier and enhanced percutaneous immune responses in filaggrin-null mice. Journal of Allergy and Clinical Immunology. 129:1538-1546.
[https://doi.org/10.1016/j.jaci.2012.01.068]

-
Kezic S and Jakasa I. (2016). Filaggrin and skin barrier function. Current Problems in Dermatology. 49:1-7.
[https://doi.org/10.1159/000441539]

- Khan S, Kazmi MH, Inamullah F and Fatima I. (2019). A review on phytochemical constituents and pharmacological properties of Allium victorialis. International Journal of Scientific and Engineering Research. 10:278-288.
-
Khan S, Mehmood R, Kazmi MH and Malik A. (2011). Alliumonoate: A new cyclopentane derivative from Allium victorialis. Journal of Asian Natural Products Research. 13:1165-1169.
[https://doi.org/10.1080/10286020.2011.619183]

-
Kim HJ, Shin JU and Lee KH. (2013). Atopic dermatitis and skin barrier dysfunction. Allergy Asthma and Respiratory Disease. 1:20-28.
[https://doi.org/10.4168/aard.2013.1.1.20]

-
Kim JY, Cho JY, Na HS, Choi GC, Park JS, Lee JH, Jeong SH and Moon JH. (2012). Analysis of the various constituents and comparison of biological activities of different parts of Allium victorialis var. platyphyllum. Korean Journal of Food Science and Technology. 44:100-105.
[https://doi.org/10.9721/KJFST.2012.44.1.100]

-
Kitano T, Yamada H, Kida M, Okada Y, Saika S and Yoshida M. (2017). Impaired healing of a cutaneous wound in an inducible nitric oxide synthase-knockout mouse. Dermatology Research and Practice. 2017:2184040. https://www.hindawi.com/journals/drp/2017/2184040/, (cited by 2023 March 14).
[https://doi.org/10.1155/2017/2184040]

-
Kothari D, Lee WD and Kim SK. (2020). Allium flavonols: Health benefits, molecular targets, and bioavailability. Antioxidants. 9:888. (cited by 2023 April 28).
[https://doi.org/10.3390/antiox9090888]

-
Lee CW, Lin ZC, Hu SS, Chiang YC, Lee FH, Lin YC, Lee IT, Tsai MH and Fang JY. (2016). Urban particulate matter down-regulates filaggrin via COX2 expression/PGE2 production leading to skin barrier dysfunction. Scientific Reports. 6:27995. https://www.nature.com/articles/srep27995, (cited by 2023 March 14).
[https://doi.org/10.1038/srep27995]

- Lee HJ. (2015). The whitening cosmetics ingredients development possibility study using flavonoid of Allium victorialis var. platyphyllum’s above ground part ethanol extracts. Master Thesis. Chungang University. p.1-34.
-
Lee WJ, Park KH, Cha HW, Sohn MY, Park KD, Lee SJ and Kim DW. (2014). The expression of involucrin, loricrin, and filaggrin in cultured sebocytes. Annals of Dermatology. 26:134-137.
[https://doi.org/10.5021/ad.2014.26.1.134]

-
Li XM, Choi DK, Lim SK, Ahn IS, Kim DI, Piao YJ, Kim CD and Lee JH. (2014). Stimulation of keratinocyte differentiation by extract of combined medicinal plant. Journal of Biomedical and Translational Research. 15:176-181.
[https://doi.org/10.12729/jbr.2014.15.4.176]

-
Lowes MA, Bowcock AM and Krueger JG. (2007). Pathogenesis and therapy of psoriasis. Nature. 445:866-873.
[https://doi.org/10.1038/nature05663]

-
Mathijssen RHJ, Sparreboom A and Verweij J. (2014). Determining the optimal dose in the development of anticancer agents. Nature Reviews Clinical Oncology. 11:272-281.
[https://doi.org/10.1038/nrclinonc.2014.40]

-
Mu Z, Zhao Y, Liu X, Chang C and Zhang J. (2014). Molecular biology of atopic dermatitis. Clinical Reviews in Allergy and Immunology. 47:193-218.
[https://doi.org/10.1007/s12016-014-8415-1]

-
Nishimura H, Wijay CH and Mizutani J. (1988). Volatile flavor components and antithrombotic agents: Vinyldithiins from Allium victorialis L. Journal of Agricultural and Food Chemistry. 36:563-566.
[https://doi.org/10.1021/jf00081a039]

-
Obedencio GP, Nuccitelli R and Isseroff RR. (1999). Involucrin-positive keratinocytes demonstrate decreased migration speed but sustained directional migration in a DC electric field. Journal of Investigative Dermatology. 113:851-855.
[https://doi.org/10.1046/j.1523-1747.1999.00763.x]

-
Santos LM, Oliveira FA, Ferreira EH and Rosenthal A. (2017). Application and possible benefits of high hydrostatic pressure or high-pressure homogenization on beer processing: A review. Food Science and Technology International. 23:561-581.
[https://doi.org/10.1177/1082013217714670]

- Tiwari P, Kumar B, Kaur M, Kaur G and Kaur H. (2011). Phytochemical screening and extraction: A review. Internationale Pharmaceutica Sciencia. 1:98-106.
-
Venkatakrishna K, Sudep HV and Shyamprasad KK. (2021). Acute and sub-chronic toxicity evaluation of a standardized green coffee bean extract (CGA-7™) in Wistar albino rats. SAGE Open Medicine. 2021:9:2050312120984885. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7907716/, (cited by 2023 March 14)
[https://doi.org/10.1177/2050312120984885]

-
Wang L, Pan X, Jiang L, Chu Y, Gao S, Jiang X, Zhang Y, Chen Y, Luo S and Peng C. (2022). The biological activity mechanism of chlorogenic acid and its applications in food industry: A review. Frontiers in Nutrition. 9:943911. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9278960/, (cited by 2023 March 14).
[https://doi.org/10.3389/fnut.2022.943911]

- Woo KW and Lee KR. (2013). Phytochemical constituents of Allium victorialis var. platyphyllum. Natural Product Sciences. 19:221-226.
-
Xu B and Chang SKC. (2008). Total phenolics, phenolic acids, isoflavones, and anthocyanins and antioxidant properties of yellow and black soybeans as affected by thermal processing. Journal of Agricultural and Food Chemistry. 56:7165-7175.
[https://doi.org/10.1021/jf8012234]

-
Xu B and Chang SKC. (2009). Phytochemical profiles and health-promoting effects of cool-season food legumes as influenced by thermal processing. Journal of Agricultural and Food Chemistry. 57:10718-10731.
[https://doi.org/10.1021/jf902594m]

-
Yosipovitch G, Berger T and Fassett MS. (2020). Neuroimmune interactions in chronic itch of atopic dermatitis. Journal of the European Academy of Dermatology and Venereology. 34:239-250.
[https://doi.org/10.1111/jdv.15973]

-
Yosipovitch G, Misery L, Proksch E, Metz M, Ständer S and Schmelz M. (2019). Skin barrier damage and itch: Review of mechanisms, topical management and future directions. Acta Dermato-Venereologica. 99:1201-1209.
[https://doi.org/10.2340/00015555-3296]

-
Zanwar AA, Badole SL, Shende PS, Hegde MV and Bodhankar SL. (2014). Role of gallic acid in cardiovascular disorders. In Watson RR. et al. (ed.). Polyphenols in human health and disease. Academic Press. Cambridge. MA, USA. p.1045-1047.
[https://doi.org/10.1016/B978-0-12-398456-2.00080-3]