
토양수분함량이 지황 ‘토강’의 생육, 광합성 및 항산화효소 활성에 미치는 영향
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Rehmannia glutinosa, a rhizomatous herbaceous perennial plant, is widely used as a medicinal plant in the Far East region. Although the influence of waterlogging on the growth and yield of R. glutinosa has been evaluated, few studies have focused on how these plants respond to a wide range of soil water status including wet and dry conditions, in terms of growth and physiological characteristics. Therefore, this study investigated the effect of contrasting soil moisture regimes on the growth, photosynthesis, chlorophyll fluorescence, antioxidant enzyme activity, and bioactive compound content in R. glutinosa var. ‘Togang’.
Potted ‘Togang’ plants were irrigated according to five different soil water statuses, −10, −20, −30, −40, and −50 ㎪, with each moisture level controlled using tensiometers throughout the experiment. The effects on sprouting rate from rhizome propagules, vegetative growth, rhizome yield, photosynthetic characteristics, antioxidant enzyme activity, and rhizome catalpol content were determined. A significant reduction in the sprouting rate of propagules and vegetative growth (leaf number and growth) was found when plants were irrigated at −50 ㎪. Yield components such as the number of rhizomes and the total and marketable weights of rhizomes were the highest at the −30 ㎪ treatment. Although the total rhizome weight in the −10 ㎪ and −20 ㎪ treatments was as high as that in the -30 ㎪ treatment, the marketable weight was significantly reduced because root rot occurred under these high moisture conditions; root rot decay was the highest at −10 ㎪ (7.6% of total rhizome weight), followed by 5.3% at −20 ㎪, whereas it was negligible in the range of −30 ㎪ and −50 ㎪ soil water status. Regarding water stress-induced antioxidant levels, the superoxide dismutase, peroxidase, and catalase activities increased when the plants were stressed with water excess (−10 ㎪) or shortage treatment (−50 ㎪), compared to those with the −30 ㎪ treatment. The net photosynthesis and transpiration rates were considerably higher at −20 ㎪ and −30 ㎪ than those at the other treatments. Chlorophyll fluorescence measurements showed that the −20 ㎪ and −30 ㎪ treatments showed a maximum quantum yield (Fv/Fm) of higher than 0.8 (considered as the stress threshold), whereas the −10 ㎪ or −50 ㎪ treatments showed a quantum yield of less than 0.8. The content of catalpol, a bioactive compound in rhizomes, was the highest at −30 ㎪ (35.9 ㎎/g FW).
Considering its effect on vegetative growth, yield, some physiological characteristics (photosynthesis and chlorophyll florescence), and rhizome catalpol content, our results indicate that approximately −30 ㎪ of soil water potential is the appropriate soil water status for cultivating Rehmannia glutinosa var. ‘Togang’.
Keywords:
Rehmannia glutinosa (Gaertn.) Libosch. ex Steud., Antioxidant Enzymes, Catalase, Chlorophyll Fluorescence, Peroxidase, Photosynthesis, Soil Water Status, Superoxide Dismutase, Quantum Yield of PSII서 언
지황 [Rehmannia glutinosa (Gaertn.) Libosch. ex Steud.]은 대표적인 약용작물 중 하나로, 2021년 기준 국내 재배면적은 88 ㏊, 생산량 550 M/T이며 (MAFRA, 2022), 한방에서 경옥고, 십전대보탕 등의 원료로 사용되고 있다. 2012년부터 2021년까지 평균 연간 수입량은 1,059 M/T으로 (APQA, 2022) 국내 소비량의 2 배에 달한다.
지황은 온난한 기후에서 잘 자라는 식물로 재배 적지는 우리나라 중부 산간 지역과 중·남부지역이다. 국내 지황의 주산단지는 충남 금산, 전북 정읍, 경북 안동, 영주이며 전국 각지에서 소규모 농가가 재배하고 있다. 최근 기후변화로 인해 평균기온이 상승하여 인삼, 천궁 등 내서성이 약한 작물들의 재배 적지가 이동하고 (RDA, 2014), 또한 생산성 감소로 이를 대체할 수 있는 작물의 발굴이 필요한데 그 중 지황이 주목을 받고 있다.
지황은 온도가 높은 하계에 노지에서 재배되는 관계로 기상조건의 영향을 많이 받을 수 있다. 특히 기후변화에 따른 고온의 지속과 가뭄, 그리고 여름철 집중 강우는 수분의 과부족을 유발하고 식물의 생리장해를 초래할 수 있다. 따라서 고품질의 지황을 생산하기 위하여 토양의 수분 및 양분, 기후 등 환경요인이 생육에 미치는 연구가 필요하다. 지금까지의 연구를 살펴보면 지황의 토양수분에 따른 생리 반응에 대한 결과가 거의 없는 실정이다.
수분은 식물 생장에 관여하는 여러 가지 환경인자 중 가장 큰 영향을 미치는 요인이며, 작물의 팽압 유지나 무기 또는 유기용질을 수송하는 매체, 작물의 냉각 등의 역할을 한다 (Hopkins, 2009). 장기적인 토양 과습은 토양 내 산소량을 급격히 감소시키며 (Kozlowski, 1997), 호흡 장해를 받는 뿌리의 양·수분 흡수가 저해되고 기공 전도도의 감소로 기공이 폐쇄되어 광합성과 같은 생리 반응이 저하된다 (Pettigrew, 2004; Snider et al., 2014). 반대로 토양 내 수분의 함량이 감소하면 체내 활성산소의 생성 속도가 증가하며 이를 제거하기 위한 환원작용 속도도 비례적으로 증가하게 된다 (Zlatev et al., 2006). 또한 식물체 스스로 수분의 부족 상태에 적응하는 생화학적 반응을 나타낸다. 각종 스트레스에 대한 식물의 생리 반응과 스트레스 수준을 분석, 평가할 수 있는 기법으로 엽록소 형광 (Chlorophyll fluorescence, CF) 측정이 있는데, 이 기법은 또한 광합성 과정 중 광 에너지 이용효율, 열 및 형광 발생 정도를 측정할 수도 있다 (Cen et al., 2017). 엽록소 형광 기법을 이용한 생물적 스트레스 평가로 Fv/Fm (maximum quantum yield of PSⅡ), ФPSⅡ (effective quantum yield of PSⅡ), qP (photochemical quenching), NPQ (non-photochemical quenching) 등의 매개변수가 사용되는 반면, 비생물적 스트레스 평가에는 Fo (minimum chlorophyll fluorescence), Fm (maximum chlorophyll fluorescence), ФPSⅡ 등이 사용된다 (Streb et al., 2008).
본 연구에서는 토양수분의 과부족이 지황의 생장에 부정적 영향을 미칠 것으로 예상하고, 스트레스 환경에서 생성되는 활성산소종의 제거에 효율적인 몇몇 주요 항산화효소의 활성을 구명하였다.
비생물적 환경 스트레스에 의해 과다하게 생성된 활성산소종 (ROS, reactive oxygen species)은 산화적 스트레스를 유기시키는 요인으로 생리적으로 중요한 세포막, 지질, 단백질및 핵산과 같은 세포질 구성 요소에 유해한 수산기나 유도체를 생성시키는 유독성 물질로 대사작용을 방해하여 장해를 일으키는 것으로 알려져 있다 (Foyer, 2017; Salin, 1991). 대부분의 작물은 ROS에 대한 방어기작으로 catalase (CAT), glutathione peroxidase (GSH-Px), peroxidase (POD), superoxide dismutase (SOD) 등의 항산화 효소와 비타민, 식물성 화합물, 미네랄 등의 저분자 항산화 물질 등을 포함한 복합 항산화 시스템을 가지고 있다 (Davies, 1995; Lee et al., 2021). 특히 SOD는 활성산소종을 과산화수소와 산소로 전환시키는 반응을 촉매하는 효소로 작용한다 (Bannister et al., 1987). SOD에 의해 유기된 과산화수소는 POD나 CAT에 의해 물 분자와 산소 분자로 분해됨으로써 과다한 ROS에 의한 피해를 감소시키는 것으로 알려져 있다 (Salin, 1991; Anderson et al., 1995).
재배 기간 중 부적절한 관수 관리로 인한 생육 불량, 품질저하 등으로 경제적 손실이 발생하는 경우가 많아 본 연구에서는 지황 재배를 위한 적정 토양수분 조건을 구명하고자 다양한 수준의 토양수분 조건에서 지황을 재배하며 식물의 생육과 광합성 및 엽록소 형광 반응 특성, 항산화 효소의 활성 그리고 유효성분 함량 변화를 조사하였다.
재료 및 방법
1. 시험 재료 및 토양수분 처리
본 연구는 충청남도농업기술원 인삼약초연구소의 PE 플라스틱 온실에서 포트에 재식한 식물을 사용하여 수행하였다. 포트재식에 사용하였던 토양의 이화학성은 pH 8.2, EC 1.27 dS·m-1, 유기물 25.7 g·㎏-1, 유효인산 1,108 ㎎·㎏-1, Ex. Ca 11.9 c㏖c·㎏-1, Ex. Mg 3.3 c㏖c·㎏-1이었다.
농촌진흥청 지황 비료사용처방 기준 pH 6.0 - 6.5, 유효인산 150 - 250 ㎎·㎏-1에 비하여 높은 편이었다 (RDA, 2022). 연구에 사용하였던 지황 (R. glutinosa)의 품종은 ‘토강’으로, 4월 11일에 2 ㎝ 근경 단편을 50 ℓ 원형포트 (직경 45 ㎝, 높이 50 ㎝)에 4 개씩 재식하였고 온실 내에 난괴법(randomized block design)으로 배치하여 시설 내 존재할 수 있는 환경효과를 통계분석에 고려하였다. 총 4 개의 block에서 각 block 내에 관수처리 당 pot를 5 개씩 그룹으로 총 25 개 pot (5 관수처리 × 처리 당 5 pots)을 완전 임의방식으로 배치하였다.
토양 수분함량은 지표면으로부터 30 ㎝ 깊이에 매설된 토양수분장력계 (Tensiometer, Irrometer Co., CA, USA)를 사용하여 5 수준, 즉 −10, −20, −30, −40, −50 ㎪로 재식 직후부터 10월 10일까지 조절하였다. 토양수분장력계가 정해진 토양수분포텐셜에 도달 시 20 개 (4 blocks × 5 pots per block) 전체 화분에 지하수를 주 당 400 ㎖씩 점적식으로 관수하였다. 장비의 제한으로 토양수분장력계를 처리 당 단 하나만 설치하였지만, 실험 식물이 균일한 포트에서 대체적으로 균일하게 생장하고 있었기 때문에 각 처리 당 관수 조절이 처리 내 모든 식물에 걸쳐 무난히 이루어졌다고 간주하였다.
실험 기간 중 토양의 수분상태는 텐시오미터에 연결된 데이터로거 (WatchDog, Spectrum Technologies Inc., Bridgend, England)를 이용하여 1 시간 단위로 측정하였다. 관수처리 기간 동안 각 관수처리에 대해 매일 측정된 토양수분포텐셜의 평균값은 −9.5 ± 1.5, −19.4 ± 2.3, −28.4 ± 7.6, −39.0 ± 7.3, −50.3 ± 6.7 ㎪로 조사되었는데, 관수량이 적을수록 편차가 크게 나타났다 (Fig. 1).
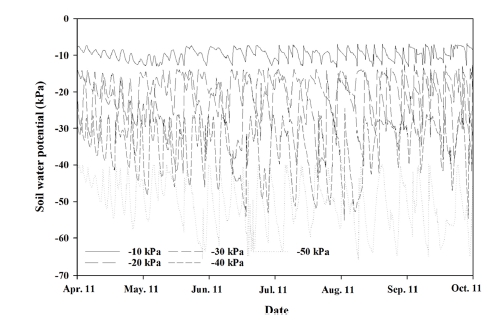
Changes in five different soil water potentials (−10, −20, −30, −40 and −50 ㎪) throughout the experimental period, set to simulate various soil water status for cultivating R. glutinosa var. Togang in the plastic house.
하우스 내 온도와 습도는 실외용 데이터로거 (Aion ENG Co., Ltd., Daejeon, Korea)를 이용하여 지표면으로부터 1.5 m 높이에서 1 시간 단위로 데이터를 수집하였다. 실험 기간 중 재배환경은 그림 2와 같이 평균기온은 25.7℃, 최저기온은 5℃, 최고기온은 48.2℃, 평균상대습도 76.6%, 광도는 174.6 W/㎡로 생육이 진전될수록 하우스 내 온도와 습도가 증가하였고 생육 후기로 갈수록 감소하는 경향이었다. 기타 재배관리는 농촌진흥청 약용작물 농업기술길잡이에 준하여 실시하였다(RDA, 2019).
2. 생육 및 수량 특성
출아율 (sprouting rate)은 재식 60 일 후 조사하였고, 재식 180 일 후에 건전한 개체를 시험구 당 4 주씩 3 반복으로 초장, 엽수, 엽장, 엽폭 및 생체중을 측정하였다. 근경 (rhizomes)을 수확하여 근경 수, 길이, 굵기, 수량 및 뿌리썩음병(root rot) 감염 정도를 측정하였다.
근경의 수량은 4 가지로, 즉 상품근중 (marketable rhizome weight), 종근중 (propagule rhizome weight), 부패근중 (decayed rhizome weight) 그리고 비상품근중 (non-marketable rhizome weight)으로 분류하였다. 부패근중은 뿌리썩음병이 발생한 부위를 절단하고 계량하여 측정하였고, 비상품근은 직경이 6 ㎜ 미만인 근경이 해당되었다.
3. 광합성 및 엽록소 형광반응 특성
토양수분 처리별 광합성 특성을 조사하기 위해 완전히 전개되었고 정상적인 생육상태를 유지하고 있는 건전엽을 대상으로 재식 60 일 부터 150 일까지 30 일 간격으로 휴대용 광합성 측정장치 (LCpro T, ADC BioScientific Ltd., England)를 사용하여 오전 10시부터 오후 12시까지 처리 당 3 반복으로 측정하였다.
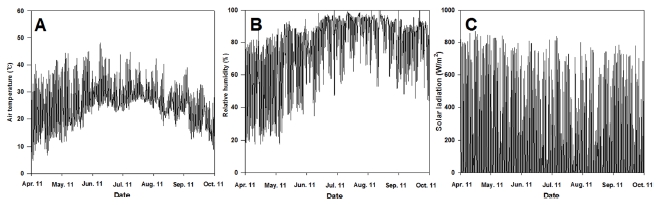
Daily changes in air temperatures (A), relative humidity (B) and solar radiation (C) under the plastic house during the experiment period.
재식 150 일째 각 관수처리별 광-반응곡선 (light-response curve)을 결정하기 위해 광도를 임의로 조절할 수 있는 LED light source를 이용하여 PPFD (photosynthetic photon flux density)를 0, 50, 100, 250, 500, 1,000, 1,500, 2,000 µ㏖·m-2·s-1의 8 수준으로 증가시키며 광합성을 측정하였다. 광합성 측정 시 측정기의 leaf chamber에 유입되는 공기의 유량은 400 µ㏖·s-1, 온도는 25℃로 설정하였고, 광합성 측정기에 CO2 injector system을 부착하여 CO2 농도가 400 ± 2 µ㏖·㏖-1 범위에서 안정된 상태를 유지하도록 하였다 (Kim et al., 2001).
엽록소 형광반응은 엽록소 형광반응 측정기 (OS1p, OPTI-SCIENCES Inc., Hudson, NH, USA)를 사용하여 조사하였으며, 형광반응은 광합성 측정 시 사용하였던 잎을 대상으로 측정하였다. Fo (minimal fluorescence)를 측정하기 위해 잎을 dark adaptation clip으로 20 분간 물려 암조건에 적응시켜 광계Ⅱ의 반응중심을 열린 상태로 만들어 준 후 1 초 동안 1.0 µ㏖·m-2·s-1 이하의 modulated light (660 ㎚ LED with 690 ㎚ short pass filter)로 순간 조사하였다. Fm (maximal fluorescence)측정을 위해 0.8 초 동안 광계Ⅱ의 반응중심이 닫힐 정도의 포화광 (11,000 µ㏖·m-2·s-1)을 조사하였다. Fm과 Fo의 차인 Fv (variable fluorescence)를 계산하여 광합성 효율을 나타내는 Fv/Fm (maximal efficiency of photochemistry)를 도출하였다 (Yang, 2017).
4. 항산화효소의 활성 분석
토양수분 처리 후 60 일째에 잎의 항산화 효소 활성과 발생한 과산화수소의 함량을 측정하였다. 엽 시료는 외엽에서 100 ㎎ 씩 3 반복으로 혼합 채취하였고, 근경 시료는 3 주로부터 채취한 시료를 혼합하여 100 ㎎씩 3 반복 채취한 후 액체질소를 사용하여 마쇄하였다. 단백질 추출을 위해 각 시료 100 ㎎에 1 ㎖ PBS (phosphate buffered saline, pH 7.0)를 첨가하여 4℃, 15,000 rpm에서 30 분간 원심 분리 후 상등액을 추출하였다.
지황의 잎과 근경의 superoxide dismutase (SOD), peroxidase (POD) 및 catalase (CAT) 효소 활성을 각각 EZ-SOD assay kit (DoGenBio Co., Seoul, Korea), EZ-Hydrogen Peroxide/Peroxidase assay kit (DoGenBio Co., Seoul, Korea) 및 EZ-Catalase assay kit (DoGenBio Co., Seoul, Korea)를 사용하여 측정하였다 (Lee et al., 2021; Jee, 2023).
SOD 효소 활성 측정은 조효소액 20 ㎕에 WST working solution 200 ㎕와 enzyme working solution 20 ㎕를 혼합하여 37℃에서 20 분간 반응시킨 후 450 nm의 파장에서 흡광도를 측정하였다. POD 효소의 활성 측정을 위해 조효소액 50 ㎕에 동량의 Oxi-probe/H2O2 working solution을 혼합하고 상온에서 30 분간 빛을 차단하여 반응시킨 후 560 ㎚ 파장에서 흡광도를 측정하였다.
CAT 효소의 활성은 조효소액 25 ㎕에 40 µM H2O2 용액 25 ㎕를 혼합한 후 상온에서 30 분간 빛을 차단하여 반응시킨 후 측정하였다. 반응이 완료된 시료에 Oxi-Probe/HRP working solution 50 ㎕를 혼합하여 빛이 차단된 37℃ 조건에서 30분간 반응시킨 후 560 ㎚ 파장에서 흡광도를 측정하였다.
잎의 과산화수소 (H2O2)의 함량은 Lee 등 (2021)의 방법에 따라 EZ-Hydrogen Peroxide/Peroxidase assay kit (DoGenBio Co., Seoul, Korea)를 사용하여 분석하였다. 간단히, 조효소액 50 ㎕에 동량의 Oxi-probe/HRP working solution을 혼합하고 상온에서 30 분 간 빛을 차단하여 반응시킨 후 560 ㎚ 파장에서 흡광도를 측정하여 H2O2 함량을 분석하였다.
5. 근경의 유효성분 함량 분석
근경의 유리당 (free sugars) 및 만니톨 (mannitol) 함량의 변화를 조사하기 위해 시료를 동결건조한 후 분쇄하였다.
분말 0.5 g을 증류수 10 ㎖에 넣고 50℃의 온도에서 3 시간 초음파 진탕 추출한 후 상등액을 membrane filter (0.22 μM pore size, Whatman Co., Kent, England)로 여과한 후 HPLC(Agilent 1200, Agilent Technologies Inc., Santa Clara, CA, USA)를 사용하여 분석하였다. ELSD 검출기(Altech 3300, Altech Co., Ltd., Tokyo, Japan)와 Prevail Carbohydrate ES Column (Altech Co., Ltd., Tokyo, Japan)을 사용하였다. 컬럼 온도는 30℃, 그리고 water : acetonitrile 용매의 이동상조건은 유속 1.0 ㎖/min으로 0 min에서 acetonitrile을 83%로 시작하여 65 min에 35%의 조건으로 진행하였다. ELSD 검출기의 조건은 온도 40℃와 질소가스 1.5 ㎖/min의 유속이었다.
근경의 catalpol 함량을 측정하기 위해 동결건조한 시료를 분쇄한 후 분말 0.5 g을 10 ㎖의 30% 메탄올 용액에 넣고 50℃의 온도에서 3 시간 동안 초음파 진탕 추출하였다. 얻어진 상등액을 membrane filter (0.22 μM pore size, Whatman Co., Kent, England)로 여과한 후 얻어진 용액을 HPLC (Agilent 1200, Agilent Technologies Inc., Santa Clara, CA, USA)에 주입하여 catalpol을 분석하였다.
HPLC 분석에 YMC-C18 컬럼 (250 × 4.6 ㎜, 5 ㎛, 12 nm, YMC Co., Ltd., Kyoto, Japan)을 사용하였고, 컬럼 온도는 30℃, 유출용매는 1% acetonitrile로 1.0 ㎖/min 유속으로 흘려보냈으며, 검출기는 refractive index detector (Agilent 1200, Agilent Technologies Inc., Santa Clara, CA, USA)를 사용하여 3 회 반복하여 측정하였다. 유리당과 만니톨, catalpol의 표준시료는 Sigma 사 (St. Louis, MO, USA)로부터 구입하였다.
6. 통계분석
통계분석은 SAS EG (SAS Institute Inc., Cary, NC, USA) 프로그램을 이용하여 분산분석 (ANOVA)을 실시하였다.
난괴법 실험구 배치에서 시설 내 block의 효과는 측정했던 거의 모든 dependent variables에서 관찰되지 않았지만, 유의성이 확인되는 variables (엽수, 근경장, 만니톨 함량)에 대해서는 측정치가 보정되었다. 각 측정군의 평균과 표준편차를 산출하고, 평균 간 유의성 비교는 p ≤ 0.05 수준에서 Duncan’s Multiple Range Test (DMRT)로 실행하였다.
결과 및 고찰
1. 토양수분함량에 따른 생육 특성
토양수분함량에 따른 지황 (Rehmannia glutinosa)의 생육 특성을 조사한 결과는 Table 1과 같다. 종근으로부터 지상부의 출현율은 토양수분함량이 높을수록 유의하게 증가하였다.

Effect of contrasting soil water status on the growth characteristics of R. glutinosa var. Togang, determined 180 days after planting.
−10 ㎪ 처리구에서 지상부 출현율은 98.4%로 가장 높았던 반면 −50 ㎪에서는 76.9%로 가장 낮았다. 초장은 −10 ㎪ −40 ㎪ 범위의 토양수분처리구에서 유사하였고, −50 ㎪ 처리구에서는 상당히 작았다. 전개된 엽수는 −20 ㎪와 −30 ㎪ 처리에서 주당 약 42 개로 가장 많았던 반면, 수분함량이 가장 낮은 −50 ㎪ 처리구에서 약 33 개로 가장 낮았다. 엽장과 엽폭은 −10 ㎪ - −40 ㎪ 범위의 처리에서 유사하였고, −50 ㎪ 처리에서 유의하게 낮았다. 주당 생경엽중도 엽장과 엽폭의 결과처럼 −10 ㎪ - −40 ㎪ 처리구가 −50 ㎪ 처리보다 유의적으로 높게 관찰되었다. 예를 들면, −30 ㎪ 처리구에서 경엽중은 226.6 g으로 −50 ㎪ 처리에 비하여 2 배가량 높게 나타났다.
지황의 토양수분함량별 근경의 생장, 수량 및 뿌리썩음병 발생 정도는 Table 2에 나타난 바와 같다.

Effect of contrasting soil moisture regimes on the rhizome growth characteristics at harvest and incidence of root rot in R. glutinosa var. Togang, determined 180 days after planting.
근경의 수는 토양수분의 함량이 많을수록 증가하였다. −30 ㎪ 처리에서 주당 7.7 개로 유의하게 많았으며, −50 ㎪ 처리에서 5.5개로 가장 적었다. 근경의 길이는 -20 ㎪ 처리에서 42.1 ㎝로 가장 길었고, −10 ㎪ 처리에서 32.8 ㎝로 가장 짧았는데, 그 이유는 과습 상태가 오래 지속되어 근경 끝부터 부패가 일어났기 때문이었다. 근경의 굵기는 −10 ㎪ - −40 ㎪ 처리간 유의한 차이 없이 약 17 ㎜로 −50 ㎪ 처리구에 (15.1 ㎜)에 비해 유의하게 굵었다. 총수량은 −10 ㎪ - −40 ㎪ 범위의 토양수분 처리 시 유사하게 평균 223 g에 달하였으나, −50 ㎪ 처리구에서는 158.6 g으로 약 32% 정도 감소하였다. 상품성이 있는 상근의 무게는 -30 ㎪ 처리구에서 170.7 g으로 가장 많았고, −10 ㎪ 처리구에서 96.5 g으로 가장 적었는데 이와 같은 원인은 토양 내 과도한 수분으로 인한 뿌리썩음병 발생 때문이었다. 이와 반대로 번식에 이용될 종근의 수량은 -10 ㎪ 처리에서 80.4 g으로 가장 많았던 반면, −30 ㎪에서 44.5 g으로 가장 적었다.
근경의 뿌리썩음병은 토양 수분이 가장 적은 −50 ㎪ 처리구에서 발생되지 않았지만, 토양 내 수분함량이 증가할수록 병발생율도 점차 증가하여 −10 ㎪에서는 7.6%로 가장 높았고, −20 ㎪에서 5.3%로 뒤를 따랐다. −30 ㎪ - −40 ㎪ 처리구에서 뿌리썩음병 발생율은 1% 이하로 낮았다. −20 ㎪ 처리구에서 ‘토강’의 초기 영양생장은 촉진되었지만, 생육 후반기, 즉 근경의 비대가 시작되는 시점에 −20 ㎪ 정도의 토양수분은 과습한 조건을 형성하여 근경의 썩음병 발생이 증가하는 것으로 사료된다.
토양수분의 차이에 따른 쥐오줌풀의 생육에 토양수분이 90%까지 많아질수록 엽장과 엽폭이 증가한다는 보고 (Lee, 1995)와 유사하게 본 연구에서 지황의 지상부 생육에도 수분의 영향이 큰 것으로 나타났다.
Jee 등 (2022)과 Lee 등 (2010)은 인삼에서 과습상태는 산소부족을 일으켜 지하부에 피해가 나타나는데 뿌리 길이가 짧아지고 연약해지며 근직경은 굵어지고 표피는 두꺼워진다고 보고 하였는데, 본 연구에서도 지황은 −10 ㎪의 과습처리 시 부패가 일어나 길이가 짧아지는 것 같았다.
지황은 건조한 토양 조건보다는 수분이 충분한 환경에서 잘 자라지만 너무 과습한 조건에서는 오히려 생육의 저하가 일어난다는 것을 알 수 있었고, 이와 같은 결과는 산괴불주머니(Gil et al., 2020)의 결과와도 유사하였다.
2. 토양수분함량이 광합성에 미치는 영향
토양수분함량에 따른 ‘토강’의 광합성 속도는 전체적으로 모든 처리구에서 생육이 진전될수록 감소하였으며, 예상했던 것처럼 토양수분이 가장 낮은 −50 ㎪ 처리구에서 광합성속도는 가장 낮았다 (Fig. 3).
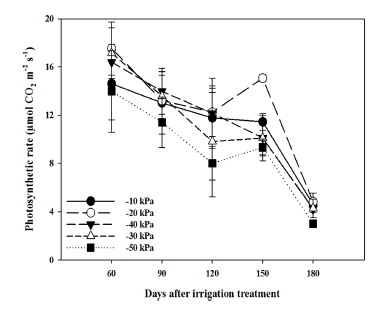
Changes in photosynthetic rate of R. glutinosa var. Togang as a function of various soil water status.Vertical bars represent standard deviation of means (n = 3).
처리 간 측정치들의 상대적 큰 오차 때문에 −10 ㎪ - −40 ㎪ 처리구 간 유의성의 확인은 어려웠지만 전체적으로 −20 ㎪ 처리구가 높은 광합성을 유지하는 경향을 보였다. 일반적으로 토양수분장력에 따른 수분 상태를 보면 −10 ㎪ 이상에서 과습, −50 ㎪ 이하에서 약간 건조, 그리고 −100 ㎪ 이하에서 건조 조건에 해당한다고 알려져 있다. 토양 장력에 대한 토양수분 함량은 사양토의 경우 −10 ㎪은 22.1%, −50 ㎪은 15.6%, 그리고 −100 ㎪은 12.8%에 해당된다 (NIAST, 2010).
본 실험에서 지황은 토양수분이 과습하거나 건조할 때 광합성이 저해되었는데, 이러한 결과는 수분 부족에 따른 기공전도도 감소가 이산화탄소의 유입을 감소시켜 탄소고정을 저해하였기 때문인 것 같다 (Kozlowski, 1997). 수분이 지나칠 경우 근권의 산소 부족이 초래될 수 있고 이는 뿌리에 의한 수분흡수의 감소로 이어질 수 있어 수분부족 환경과 유사한 상황이 발생할 수 있다 (Kozlowski, 1997; Snider et al., 2014).
다른 수준의 토양수분처리에 노출된 지황의 광합성속도가 광도의 변화에 어떠한 반응을 보이는지 파악하기 위해 재식 후 150 일째에 광-반응곡선 (light-response curve)을 구하였다(Fig. 4A).
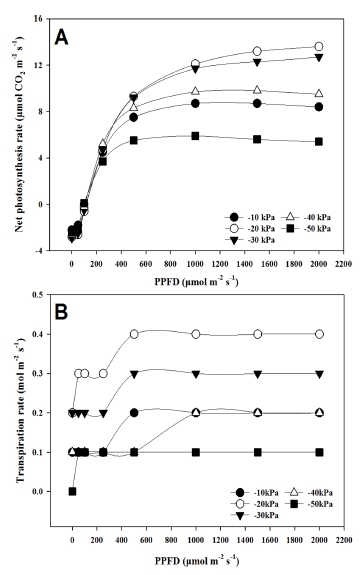
Effect of contrasting soil moisture regimes on the kinetics of net photosynthesis (A) and transpiration (B) as a function of photon flux density in leaves of R. glutinosa var. Togang, determined 150 days after irrigation treatment.
광합성에 대한 광포화점과 최대 광합성속도는 처리구 중 −50 ㎪ 처리에서 가장 낮았던 반면, −20 ㎪에서 가장 높게 관찰되었고, −30 ㎪ 처리도 높은 광합성속도를 보였다. 광도의 변화에 따른 증산율의 광-반응곡선을 살펴보면 (Fig. 4B), 광합성 광-반응곡선에서 관찰되었던 것처럼 −20 ㎪의 토양수분 조건에서 0.41 ㏖·m-2·s-1로 가장 높았던 반면, −50 ㎪에서는 0.10 ㏖·m-2·s-1로 가장 낮았다. 이 결과는 수분부족 환경인 −50 ㎪에서 식물 잎의 기공전도도 감소가 광합성과 증산을 감소시켰다는 것을 말해준다 (data not shown).
반음지성 작물인 천궁은 토양수분이 많은 곳에서 광합성과 증산이 높아진다고 하였던 반면 (Kim et al., 2020), 오미자는 −10 ㎪의 수분 과다한 조건에서 광합성과 증산율이 크게 저해되었다고 보고되었다 (Seo et al., 2015). 본 연구에서 ‘토강’은 일반적으로 식물의 유효수분함량 범위인 −33 ㎪ - −50 ㎪ (Kirkham, 2004) 보다 높은 토양수분 조건에서 광합성과 증산의 효율이 높아지는 것으로 관찰되었다.
3. 토양수분함량에 따른 엽록소 형광반응
‘토강’의 토양수분함량에 따른 엽록소 형광반응을 검정하였다 (Fig 5). 처리에 따라 Fo는 −50 ㎪과 −10 ㎪에서 각각 346.6, 329.6으로 유의하게 증가하였고 (Fig. 5A), Fm은 1489.1, 1540.9로 감소하였으며 (Fig. 5B), Fv도 1142.6, 1211.3으로 다른 수분 처리구에 비하여 유의하게 감소하였다 (Fig. 5C). 광화학 반응에 대한 순양자수율의 최대치인 광화학효율을 나타내는 Fv/Fm은 −50 ㎪ 처리에서 0.77, −10 ㎪ 처리에서 0.79로 처리구 중 통계적으로 유의하게 낮게 나타났다 (Fig. 5D).
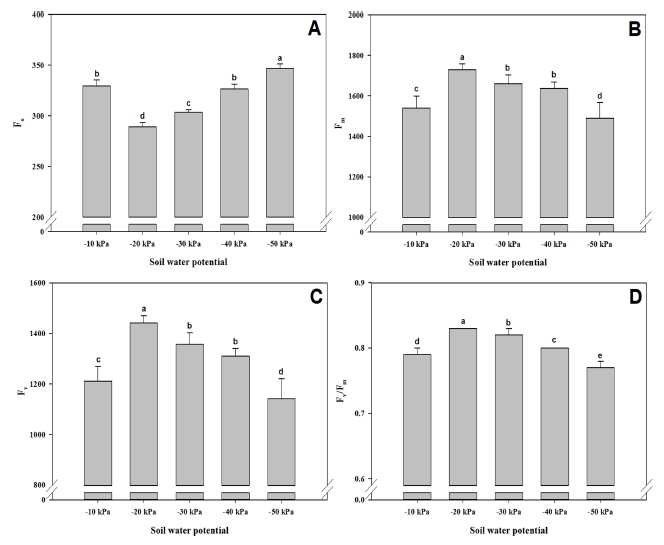
Values of chlorophyll fluorescence parameters, determined 150 days after irrigation treatment, from leaves of R. glutinosa var. Togang plants grown under various soil water status.(A) minimal fluorescence yield (Fo), (B) maximal fluorescence yield (Fm), (C) maximum variable fluorescence (Fv), and (D) maximum quantum yield (Fv/Fm) of PSII. Vertical bars represent ± SD (n = 10). *Different letters above each bar indicate a significant difference at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05).
이러한 수치는 stress threshold 수치로 간주되는 0.80-0.83 (Björkman and Demming, 1987)보다 작은 값으로서, −10 ㎪과 −50 ㎪ 처리에서 지황 식물은 스트레스에 처할 수 있다는 사실을 나타내준다. 스트레스를 받을 경우 광계Ⅱ가 손상을 입었거나 불활성화되어 Fv/Fm 값이 감소한다고 알려져 있다. 본 실험 결과 0.83보다 낮은 값을 보이는 처리구는 −50 ㎪, −10 ㎪, −40 ㎪이었다.
이는 앞에서 언급한 광합성 특성의 결과와 유사한 경향을 보여주고 있는데, 이와 같은 결과는 오미자 (Seo et al., 2015)와 인삼 (Jee et al., 2022)에서 −10 ㎪ 처리와 담수 처리는 Fv/Fm의 값을 감소시켜 광합성 효율에 영향을 미쳤다는 보고와 일치하였다.
토양이 과습하면 광화학반응에 이용되는 에너지가 감소하고 전자전달에 이용되지 못하는 에너지가 증가하여 광계Ⅱ 활성이 감소한다. 반대로 토양의 건조한 조건이 지속될 경우 수분스트레스로 인한 엽내 수분함량 부족이 엽록체 내 막의 손상을 일으키고, 또한 ABA 함량 증가로 기공폐쇄를 유도하여 증산과 광합성율의 감소를 초래한다고 알려져 있다.
땃두릅에서 건조한 상태가 14 일 지속되면 광합성율과 증산율의 감소가 나타났고 (Lee et al., 2014), 산딸나무에 무관수 처리 시 22 일째부터 형광반응 Fv/Fm 값이 크게 감소하였다고 보고되었다 (Sung et al., 2008).
본 연구에서도 지황이 낮은 토양수분조건에 처할 경우 광화학효율이 저하되어 광합성이 감소되는 결과를 보였다.
4. 토양수분함량에 따른 항산화효소 활성 변화
다양한 수준의 토양수분 환경에서 자란 지황의 잎과 근경에서 항산화 효소의 활성을 측정한 결과, ‘토강’이 토양 수분이 가장 낮거나, 가장 높은 환경에서 생장했을 때 SOD의 활성이 두 기관 모두에서 유의적으로 상승하였음을 알 수 있었다(Fig. 6A).
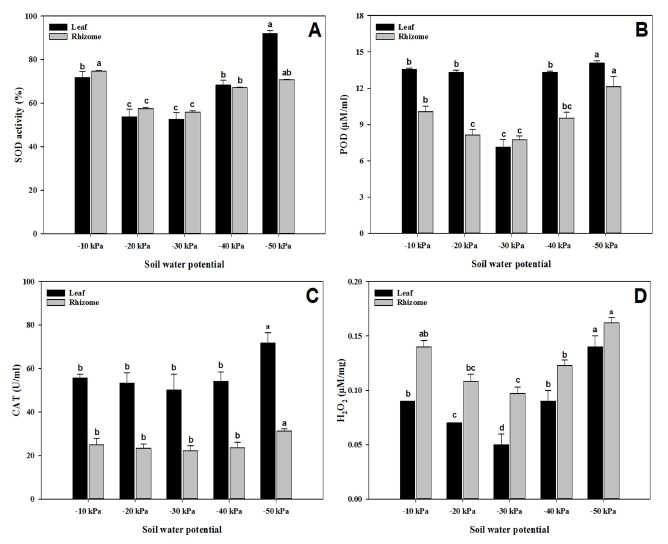
Effect of contrasting soil water status on the activity of key antioxidant enzymes (A) superoxide dismutase (SOD), (B) peroxidase (POD), (C) catalase (CAT) and (D) hydrogen peroxide content in the leaves and rhizomes of R. glutinosa var. Togang, determined 60 days after irrigation treatment.Vertical bars represent the standard deviation of the means (n = 5). *Different letters above each bar indicate a significant difference at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05).
반면에 상대적으로 토양 수분이 적절할 것으로 예상되는 −20 ㎪과 −30 ㎪ 처리에서는 가장 효소활성은 낮았다. 이 결과는 지황이 수분이 너무 많거나 부족한 환경에 노출 시 식물의 항산화효소 활성이 증가한다는 것을 나타낸다. 식물이 스트레스 등의 원인으로 세포 내에 활성산소가 과도하게 쌓이게 되면 세포 노화로 인한 세포막 손상이 발생하는 것으로 알려져 있다 (Fridovich, 1975).
SOD는 이러한 활성산소를 제거하는 항산화효소로 활성이 높을수록 활성산소 제거 능력이 크다. Tian 등 (2012)은 메리골드가 가뭄 스트레스에 처했을 때 잎과 꽃잎에서 모두 SOD가 높게 발현되었다고 보고하였다. 다양한 사과 품종에서 뿌리가 저산소 피해를 받았을 때 SOD가 활성화 되었고 (Bai et al., 2010), 산괴불주머니도 높은 토양수분함량에서 SOD가 높게 발현되었다는 보고가 있었는데 (Gil et al., 2020), 이러한 결과는 식물이 저산소나 지나친 수분공급 환경에 처했을 때 공히 관찰되는 SOD의 활성 증가는 근권 부위의 산소 부족이 그 원인일 거라는 사실을 제시해준다.
환경스트레스에 의해 유발되는 활성산소종의 과다 발생은 식물의 생산성을 감소시키는 주요 원인으로 (Asada, 1999; Noctor and Foyer, 2017), 그 중 식물의 체내 과산화수소를 제거하는 항산화효소들이 다수 존재한다. 그 중 대표적인 것에는 POD, CAT, APX 등이 있다 (Shim et al., 2018). 불량 환경에서 식물체 내 POD의 주된 역할은 SOD에 의해 유기된 과산화수소를 물 분자와 산소 분자로 분해함으로써 과다한 활성산소종에 의한 피해를 감소시키는 것이다 (Salin, 1991; Anderson et al., 1995).
본 실험의 과습·건조 조건에서 지황의 POD 활성이 전반적으로 증가하는 양상을 보였는데 지상부에서는 −30 ㎪ 처리 대비 최대 50.6% 증가하였다 (Fig. 6B).
토마토 육묘 시 과습 처리구에서 POD의 활성이 높아졌고, 스트레스에 따른 반응은 부위별로 차이가 있다고 보고되었는데 (Kang et al., 2007; Kim et al., 2019), 이러한 결과는 본 연구와 유사하였다. 또한 CAT 효소의 활성은 SOD의 경우처럼 지상부에서 −50 ㎪ 처리에서 유의적으로 증가하였고(Fig. 6C), 함량은 지하부보다 지상부가 높았다. 이러한 결과는 식물이 수분 부족 스트레스를 받았을 때 상대적으로 더 많은 스트레스에 노출된 지상부 기관에서 스트레스에 대항하기 위한 SOD나 CAT와 같은 주요 항산화효소가 더 활발하게 작동한다는 것을 암시한다.
SOD에 의해서 유기된 세포 내 H2O2의 함량은 대체적으로 잎보다는 근경에서 높게 나타났는데, 두 기관 공히 −30 ㎪에서 가장 낮았고 −50 ㎪에서 가장 높았다 (Fig. 6D). Shim 등 (2018)은 Leymus chinensis Trin. 식물이 건조와 염 스트레스에 처했을 때 유식물체의 지상부와 지하부에서 APX가 항산화 방어에 주요한 효소라 보고하였다.
결론적으로 지황 식물이 수분 과부족 스트레스 환경에 지속적으로 노출될 경우 식물체에 스트레스가 유발된다는 사실을 항산화효소 분석을 통해서 확인할 수 있었고, 이러한 지속적 수분 관련 스트레스는 결국 지황의 생장과 생산성 하락으로 이어질 것으로 여겨진다.
5. 토양수분함량에 따른 유효성분함량 변화
토양수분함량에 따른 ‘토강’ 근경의 유효성분 함량을 재식180 일 후에 분석한 결과 (Table 3) catalpol의 함량은 −30 ㎪에서 35.9 ㎎/g으로 가장 많았던 반면, 수분 부족 처리구인 −50 ㎪ 처리구에서 28.3 ㎎/g으로 가장 낮게 나타났다. 샘플링 시기에 따라 유효성분 함량의 변화를 보면 catalpol의 함량은 모든 처리구에서 재식 120 일부터 급격히 증가하였는데 (Fig. 7A), 근경이 급격하게 비대되는 시점과 일치하여 세포가 비대하면서 catalpol의 함량도 증가한 것으로 보여진다.

Catalpol, mannitol, free sugars and moisture contents at harvest of rhizomes of R. glutinosa var. Togang in response to various controlled soil water status.
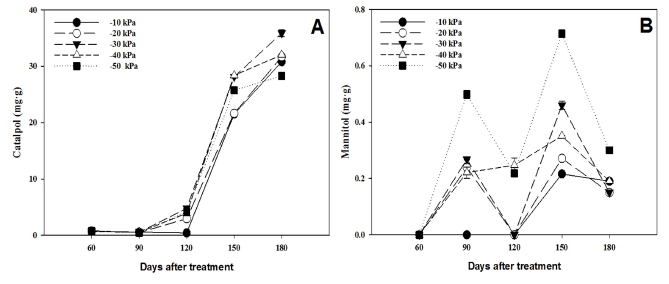
Changes in the concentration of catalpol (A) and mannitol (B) in the rhizome of R. glutinosa var. Togang as a function of various soil water status.Vertical bars represent standard deviation of the means (n = 3).
‘지황 1호’ 품종을 가지고 수행한 Lee 등 (2019)은 파종 후 5 개월에서 6 개월 사이에 catalpol 함량이 급격이 증가한다고 보고하였는데, 본 실험에서 ‘토강’ 품종은 그보다 1 개월 앞당겨진 파종 후 4 개월에서 5 개월 사이에 많은 증가가 이루어졌다. 이 결과는 catalpol 함량의 증가 시점이 품종에 따라 다르게 나타난다는 것을 나타낸다. Catalpol 함량이 중국약전 기준치인 0.2% 이상 (Lee et al., 2017)으로 나타나 조기 수확도 가능할 것으로 생각된다.
수확 시 근경의 mannitol의 함량은 −50 ㎪ 처리구에서 0.30 ㎎/g으로 다른 처리에 비하여 상당히 높았다. Karakas 등(2008)은 담배가 가뭄 스트레스에 처했을 때 mannitol 축적이 있었고, 이러한 함량 증가는 삼투조정 (osmoregulation) 능력의 향상과 관련된다고 보고하였다.
생육이 진행되는 동안 mannitol의 함량 변화를 측정했을 때 모든 처리구에서 재식 후 150 일경에 최대값을 보이는 경향이었고, 측정 기간 동안 −50 ㎪에서 지속적으로 높게 나타났다 (Fig. 7B).
근경의 유리당 중에서 과당은 검출되지 않았고, 총 유리당 농도는 −10 ㎪와 −50 ㎪ 처리구가 다른 처리에 비해 유의적으로 높게 관찰되었다. Glucose와 sucrose 함량은 −50 ㎪ 처리에서 가장 높게 나타났다.
결론적으로 본 연구에서 토양수분함량이 지황 ‘토강’의 생육, 광합성 특성, 엽록소 형광 반응, 항산화 효소의 활성 그리고 근경의 유효성분 함량에 미치는 영향을 조사한 결과, 생육(출아율, 초장, 지상부의 생체중)과 수량에 가장 부정적 영향을 미쳤던 토양수분 처리구는 –50 ㎪이었다.
수량 구성요소인 근경의 수와 판매 가능한 상근의 무게는 −30 ㎪에서 유의하게 가장 높았다.
뿌리썩음병의 발생은 상대적으로 높은 토양수분처리구인 −10 ㎪과 −20 ㎪ 처리구에서 전체 근경 대비 5.3% - 7.6% 비율로 나타났는데, 뿌리썩음병 발생은 판매 가능한 상근중의 감소로 이어졌다.
광합성속도와 광합성 효율을 나타내는 광계II의 최대양자수율은 −20 ㎪와 −30 ㎪ 처리에서 가장 높게 관찰되었다.
스트레스의 지표로 사용되는 SOD나 CAT와 같은 항산화효소의 활성은 −20 ㎪과 −30 ㎪처리에서 유의적으로 낮았던 반면, −10 ㎪나 −50 ㎪의 과습·건조한 조건, 즉 스트레스 유발환경에서 높게 나타났다.
지황 근경의 유효성분인 catalpol의 함량은 −30 ㎪에서 35.9 ㎎/g으로 가장 높았던 반면, −50 ㎪에서 가장 낮았다.
따라서 토양수분상태에 따른 생장, 광합성특성, 근경 수량 및 유효성분 함량 변화를 고려했을 때, 지황 ‘토강’의 재배를 위한 적정 토양수분 함량은 -30 ㎪ 부근일 것으로 판단된다.
References
-
Anderson MD, Prasad TK and Stewart CR. (1995). Changes in isozyme profiles of catalase, peroxidase, and glutathione reductase during acclimation to chilling in mesocotyls of maize seedlings. Plant Physiology. 109:1247-1257.
[https://doi.org/10.1104/pp.109.4.1247]

- Animal and Plant Quarantine Agency(APQA). (2021). Animal and Plant Quarantine Agency. https://okminwon.pqis.go.kr/minwon/information/statistics.html, (cited by 2023 April 1).
-
Asada K. (1999). The water-water cycle in chloroplasts: Scavenging of active oxygens and dissipation of excess photons. Annual Review of Plant Biology. 50:601-639.
[https://doi.org/10.1146/annurev.arplant.50.1.601]

-
Bai T, Li C, Ma F, Feng F and Shu H. (2010). Responses of growth and antioxidant system to root-zone hypoxia stress in two Malus species. Plant and Soil. 327:95-105.
[https://doi.org/10.1007/s11104-009-0034-x]

-
Bannister JV, Bannister WH and Rotilio G. (1987). Aspects of the structure, function, and applications of superoxide dismutase. Critical Reviews in Biochemistry. 22:111-180.
[https://doi.org/10.3109/10409238709083738]

-
Björkman O and Demming B. (1987). Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77 K among vascular plants of diverse origins. Planta. 170:489-504.
[https://doi.org/10.1007/BF00402983]

-
Cen H, Weng H, Yao J, He M, Lv J, Hua S, Li H and He Y. (2017). Chlorophyll fluorescence imaging uncovers photosynthetic fingerprint of citrus huanglongbing. Frontiers in Plant Science. 8:1509. https://www.frontiersin.org/articles/10.3389/fpls.2017.01509/full, (cited by 2023 April 1).
[https://doi.org/10.3389/fpls.2017.01509]

-
Davies KJA. (1995). Oxidative stress: The paradox of aerobic life. In Evans CR. et al. (eds.). Free radicals and oxidative stress: Environment, drugs, and food additives. Biochemical Society Symposia. Portland Press. London. England. p.1-32.
[https://doi.org/10.1042/bss0610001]

-
Foyer CF. (2017). Ascorbic acid. In Alscher RG and Hess JL (eds.). Antioxidants in higher plants. CRC Press. Boca Raton. FL, USA. p.31-58.
[https://doi.org/10.1201/9781315149899-2]

-
Fridovich I. (1975). Superoxide dismutases. Annual Review of Biochemistry. 44:147-159.
[https://doi.org/10.1146/annurev.bi.44.070175.001051]

-
Gil M, Kwon HH, Kwon YH, Jung MJ, Kim SY and Rhie YH. (2020). Growth of Minuartia laricina, Arenaria juncea, and Corydalis speciosa in field with various soil water contents. Journal of Bio-Environment Control. 29:344-353.
[https://doi.org/10.12791/KSBEC.2020.29.4.344]

- Hopkins GW. (2009). Introduction to Plant Physiology. John Wiley and Sons. New York. NY, USA. p.512.
-
Jee MG, Hong YK, Kim SI, Park YC, Lee KS, Jang WS, Kwon A, Seong BJ, Kim MS and Cho YG. (2022). Evaluation of waterlogging tolerance using chlorophyll fluorescence reaction in the seedling of Korean ginseng(Panax ginseng C. A. Meyer) accessions. Journal of Plant Biotechnology. 49:240-249.
[https://doi.org/10.5010/JPB.2022.49.3.240]

- Jee MG. (2023). Physiological characterization and differential gene expression under waterlogging in Korean ginseng(Panax ginseng C. A. Meyer). Ph. D. Thesis. Chungbuk National University. p.21-22.
- Kang NJ, Cho MW, Rhee HC, Choi YH and Um YC. (2007). Differential responses of antioxidant enzymes on chilling and drought stress in tomato seedlings(Lycopersicon esculentum L.). Journal of Bio-Environment Control. 16:121-129.
-
Karakas B, Ozias-akins P, Stushnoff C, Suefferheld M and Rieger M. (2008). Salinity and drought tolerance of mannitol-accumulating transgenic tobacco. Plant. Cell and Environment. 20:609-616.
[https://doi.org/10.1111/j.1365-3040.1997.00132.x]

- Kim DE, Kang JK, Shin YA, Hong SJ, Lee WY and Woo YH. (2019). Effects of soil water content on growth and antioxidative enzymes of tomato plug seedlings. Journal of Practical Agriculture and Fisheries Research. 21:59-69.
-
Kim KS, Seo YJ, Kim DC, Nam HH, Lee BY and Kim JH. (2020). Effect of soil water and shading treatment on chlorophyll fluorescence parameters and photosynthetic capacity in Cnidium officinale Makino. Korean Journal of Medicinal Crop Science. 28:412-420.
[https://doi.org/10.7783/KJMCS.2020.28.6.412]

- Kim PG, Yi YS, Chung DJ, Woo SY, Sung JH and Lee EJ. (2001). Effects of light intensity on photosynthetic activity of shade tolerant and intolerant tree species. Journal of Korean Society of Forest Science. 90:476-487.
-
Kirkham MB. (2004). Principles of soil and plant water relations. Elsevier Science and Technology. Manhattan. NY, USA. p.101-115.
[https://doi.org/10.1016/B978-012409751-3/50008-6]

-
Kozlowski TT. (1997). Responses of woody plants to flooding and salinity. Tree Physiology. 17:490-490.
[https://doi.org/10.1093/treephys/17.7.490]

-
Lee HJ, Choi KY, Chiang MH and Choi EY. (2022). Photosynthesis, growth and yield characteristics of Peucedanum japonicum T. grown under aquaponics in a plant factory. Journal of Bio-environment Control. 31:67-76.
[https://doi.org/10.12791/KSBEC.2022.31.1.067]

- Lee JC. (1995). Effect of soil moisture content on the growth of Korean Valerian(Valeriana fauriei var. dasycarpa HARA). Korean Journal of Medicinal Crop Science. 3:81-83.
- Lee JE, Kim HS, Kwon YU, Jung GH, Lee CK, Yun HT and Kim CK. (2010). Responses of root growth characters to waterlogging in soybean[Glycine max(L.) Merril]. Korean Journal of Crop Science. 55:1-7.
- Lee JH, Lee HJ, Wi SH, Yu IH, Yeo KH, An SW, Jang YA and Jang SH. (2021). Enhancement of growth and antioxidant enzyme activities on Kimchi cabbage by melatonin foliar application under high temperature and drought stress conditions. Horticultural Science and Technology. 39:583-592.
-
Lee KC, Kim SH, Park WG and Kim YS. (2014). Effects of drought stress on photosynthetic capacity and photosystem Ⅱ activity in Oplopanax elatus. Korean Journal of Medicinal Crop Science. 22:38-45.
[https://doi.org/10.7783/KJMCS.2014.22.1.38]

-
Lee SH, Hong CO, Lee SH, Koo SC, Hur M, Lee WM, Chang JK and Han JW. (2019). Investigation of rhizome enlargement stage and harvest time in Rehmannia glutinosa(Gaertn.) Libosch. ex Stued. Korean Journal of Medicinal Crop Science. 27:315-321.
[https://doi.org/10.7783/KJMCS.2019.27.5.315]

-
Lee SH, Yoon JS, Kim JK, Park CG, Chang JK and Kim YB. (2017). Analysis of iridoid glycoside and GABA content in the roots of the Rehmannia glutinosa cultivars. Korean Journal of Medicinal Crop Science. 25:146-151.
[https://doi.org/10.7783/KJMCS.2017.25.3.146]

- Ministry of Agriculture, Food and Rural Affairs(MAFRA). (2022). 2021 an actual output of crop for a special purpose. Ministry of Agriculture, Food and Rural Affairs. Sejong. Korea. p.7.
- National Institute of Agricultural Science Technology(NIAST). (2010). Manual of water management for the drought in crop lands. National Institute of Agricultural Science Technology. Rural Development Administration. Suwon, Korea. p.65.
-
Noctor G and Foyer CH. (1998). Ascorbate and glutathione: Keeping active oxygen under control. Annual Review of Plant Biology. 49:249-279.
[https://doi.org/10.1146/annurev.arplant.49.1.249]

-
Pettigrew WT. (2004). Physiological consequences of moisture deficit stress in cotton. Crop Science. 44:1265-1272.
[https://doi.org/10.2135/cropsci2004.1265]

- Rural Development Administration(RDA). (2014). Prediction map for major fruit and medicinal crops with future climate scenario. Rural Development Administration. Jeonju. Korea. p.85-94.
- Rural Development Administration(RDA). (2019). Medicinal crops. Rural Development Administration. Jeonju. Korea. p.175-182.
- Rural Development Administration(RDA). (2022). Fertilizer recommendation for crops. Rural Development Administration. Jeonju. Korea. p.336.
-
Salin ML. (1991). Chloroplast and mitochondrial mechanisms for protection against oxygen toxicity. Free Radical Research Communications. 13:851-858.
[https://doi.org/10.3109/10715769109145867]

-
Seo YJ, Kim BS, Lee JP, Kim JS, Park KC, Park CG, Ahn YS and Cha SW. (2015). Effects of soil water potential and nitrogen fertilization on characteristics of photosynthesis and chlorophyll fluorescence induction in Schisandra chinensis Baillon. Korean Journal of Soil Science and Fertilizer. 48:705-711.
[https://doi.org/10.7745/KJSSF.2015.48.6.705]

- Shim DH, Nam KJ and Kim YH. (2018). Analysis of antioxidant enzyme activity during seedling growth of Leymus chinensis Trin under salt and dehydration stresses. Journal of Life Science. 28:772-777.
-
Snider JL, Collins GD, Whitaker J, Perry CD, Chastain DR. (2014). Electron transport through photosystem Ⅱ is not limited by a wide range of water deficit conditions in field-grown Gossypium hirsutum. Journal of Agronomy and Crop Science. 200:77-82.
[https://doi.org/10.1111/jac.12044]

-
Streb P, Aubert S, Gout E, Feierabend J and Bligny R. (2008). Cross tolerance to heavy-metal and cold-induced photoinhibiton in leaves of Pisum sativum acclimated to low temperature. Physiology and Molecular Biology of Plants. 14:185-193.
[https://doi.org/10.1007/s12298-008-0018-y]

- Sung JH, Cho JH, Kim SH, Je SM and Kim YG. (2008). Physiological responses of C. Kousa, P. sargentii and A. mono by water stress. Journal of Bio-Environment Control. 17:188-190.
-
Tian Z, Wang F, Zhang W, Liu C and Zhao X. (2012). Antioxidant mechanism and lipid peroxidation patterns in leaves and petals of marigold in response to drought stress. Horticulture, Environment, and Biotechnology. 53:183-192.
[https://doi.org/10.1007/s13580-012-0069-4]

- Yang EY. (2017). Studies on physiological and genetic characteristics and breeding of waterlogging tolerance in pepper(Capsicum annuum L.). Ph.D. Thesis. University of Seoul. Korea. p.21.
-
Zlatev ZS, Lidom FC, Ramalho JC and Yordanov IT. (2006). Comparision of resistance to drought of three bean cultivar. Biologia Plantarum. 50:389-394.
[https://doi.org/10.1007/s10535-006-0054-9]
