흑노호 줄기 추출물의 항산화 활성 및 산화적 손상에 따른 간세포보호 효과
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Reactive oxygen species (ROS) contribute to increased intracellular oxidative stress, which has detrimental effects on normal cells and reduces antioxidant levels. This oxidative stress, particularly in the liver, causes inflammation, which leads to the development of acute and chronic liver diseases. Hence, substances with the ability to efficiently reduce ROS levels and oxidative stress are needed.
Kadsura coccinea stem extract exhibited a concentration-dependent antioxidant activity and imporved alcohol dehydrogenase and aldehyde dehydrogenase effects. Non-cytotoxic effects and increased cell activity were observed in HepG2 cells treated with K. coccinea stem extract under conditions of hydrogen peroxide induced hepatotoxicity. Additionally, the extract effectively reduced ROS levels, as confirmed by 2′,7′-dichlorodihydrofluorescein diacetate (DCFH-DA) assay in HepG2 cells simultaneously exposed to hydrogen peroxide and the K. coccinea stem extract. mRNA expression analysis revealed elevated levels of antioxidant enzymes, including superoxide dismutase 1 (SOD1), glutathione peroxidase 1 (GPx1), and catalase (CAT).
These findings reveal the potential therapeutic value of K. coccinea stem extract for oxidative stress related liver disorders.
Keywords:
Kadsura coccinea, Antioxidant, Ethanol Extract, Hepatoprotective Effects , Reactive Oxygen Species서 언
간은 탄수화물, 아미노산, 단백질, 지방, 담즙산 및 빌리루빈, 비타민 및 무기질, 호르몬의 대사 및 해독 그리고 살균 작용 등 다수의 대사작용을 담당하는 기능을 한다 (Rui, 2014; Almazroo et al., 2017; Jeon and Carr, 2020).
간의 기능이 다양한 만큼 충분한 예비 기능을 비축하고 있어 간세포가 상당수 파괴되어도 증상이 없는 경우가 대부분이라 ‘침묵의 장기’라고 불리며, 간 손상으로 인해 증상이 발생하게 되면 이미 심각한 단계로 진행한 상태임을 의미한다. 현대인들은 음주 습관, 기름진 음식 섭취, 스트레스, 흡연, 유해물질에 대한 노출 등의 다양한 이유로 간을 위협하는 요인에 노출되어 있으며, 이에 따라 간을 보호하기 위한 연구들이 진행되어 왔다 (Cho et al., 2015; Qu et al., 2020).
활성산소종 (Reactive Oxygen Species, ROS)은 세포 내 산화스트레스를 증가시킴으로써 정상 세포를 손상시키며, 항산화 수준을 낮추어 특히 간에서 염증을 일으켜 급성 및 만성으로 간질환을 유발한다 (Sharma et al., 2023). 또한, 에탄올로 유발된 ROS는 신체의 대사 반응 중 자연적으로 소량 생성되는 반응성이 높은 분자로, 지질, 단백질 또는 DNA와 같은 복잡한 세포 분자와 반응하여 손상을 일으킨다 (Sies et al., 2022). 간세포는 에탄올을 알코올탈수소효소 (alcohol dehydrogenase, ADH)와 사이토크롬 P450 효소 (CYP2E1)의 두 가지 주요 경로를 통해 산화적으로 대사시킨다 (Balusikova and Kovar, 2013).
이러한 경로는 아세트알데히드 및 대량의 과산화물라디칼과 과산화수소 등의 ROS와 같은 에탄올 대사산물을 생성하고 superoxide dismutase (SOD), catalase (CAT) 및 glutathione peroxidase (GPx)와 같은 항산화 효소를 고갈시킨다 (Jiang et al., 2020). 하지만 기존의 치료제들은 급성 간 손상에 대한 예방 및 치료 효과를 보이나, 대부분이 합성 화합 물질로서 간세포의 손상을 경감시킨다는 점에서 보조 치료제로 기능한다 (Singh et al., 2017). 이에 인체에 안전하면서도 간 기능 개선, 예방 또는 치료에 뛰어난 항산화 효능을 발휘하는 천연물 소재를 개발하는 것이 필요한 실정이다.
흑노호 (Kadsura coccinea)는 중국과 베트남에 분포하는 덩굴성 목본식물로서 줄기, 잎, 및 뿌리를 채취하여 약재로 사용한다. 흑노호 말린 뿌리, 줄기 및 잎은 류마티스 관절염, 십이지장 궤양, 위장 장애 및 부인과 문제를 치료하기 위해 전통적으로 사용되는 광범위한 효능을 갖고 있다 (Woo et al., 2020; Xia et al., 2020; Yang et al., 2020). 과실 부위는 대부분 생과일, 주스, 과실주 등의 형태로 섭취되며, 다양한 항산화 효능을 갖는 것으로 알려져 있다 (Yang et al., 2019; Tram et al., 2021). 이전 연구에서 리그난, 트리테르페노이드, 플라보노이드, 페놀산, 스테로이드, 아미노산과 같은 생리 활성 성분이 풍부하여 영양학적, 약학적 가치가 높은 것으로 알려졌다 (Liu et al., 2014; Yang et al., 2020).
그러나 다양한 효능에도 불구하고 비교적 흑노호 줄기에 대한 효능 연구는 미비하며, 특히 항산화 기전에 따른 간세포보호 효과와 대한 결과는 아직 없는 것으로 확인된다.
따라서 본 연구에서는 흑노호 줄기 추출물을 식의약소재로 활용하기 위하여 항산화 활성을 측정하고 과산화수소를 이용해 인간 간암세포주 인 HepG2 세포에 산화스트레스를 유도한 후 세포독성, 세포보호효과, ROS 감소 및 항산화 효소 활성화 기전을 분석하였다.
재료 및 방법
1. 흑노호 줄기 추출물의 제조
흑노호 줄기는 베트남 달랏대학교 (Dalat, Vietnam)에서 제공받았으며, 흑노호 줄기 추출물은 흑노호 줄기를 80 mesh 사이즈로 분쇄하여 분말 형태로 만든 후 흑노호 줄기 분말 20 g에 20% (v/v) 에탄올 (≥ 99.9%, Daejung, Siheung, Korea) 1 ℓ를 첨가한 후 상온에서 혼합하여 6 시간 추출하였으며 여과지 (Whatman No. 2, Whatman Inc., Maidstone, England)를 이용하여 여과한 후 감압농축기 (Rotavapor, R-220SE, Büchi Labortechnik AG, Flawil, Switzerland)를 이용하여 농축하고 동결건조기 (Ilshinbiobase Co., Ltd, Yangju, Korea)에서 건조하여 흑노호 줄기 추출물을 제조하였다.
2. 흑노호 줄기 추출물의 항산화 활성 측정
총 폴리페놀 함량은 시료 150 ㎕에 2 N Folin reagent (Sigma Chemical Co., St Louis, MO, USA) 150 ㎕, 10% Na2CO3용액 150 ㎕를 첨가하였다. 이 혼합액을 상온에서 1 시간 동안 정치한 후 760 ㎚에서 흡광도를 측정하였다. 시료의 총 폴리페놀 함량은 gallic acid (Sigma Chemical Co., St Louis, MO, USA)로 표준 곡선을 계산하고 gallic acid equivalent (㎎·GAE/g)로 나타내었다.
DPPH radical 소거능 활성은 시료 용액 50 ㎕에 0.2 mM의 2,2-diphenyl-1-picrylhydrazyl (DPPH) 100 ㎕를 넣고 교반한 후 517 ㎚에서 흡광도를 측정하였으며 (Blois, 1958), 전자공여능은 시료 용액의 첨가군와 무첨가군의 흡광도 감소율로 나타냈다.
ABTS radical 소거능 활성은 ABTS cation decolorization 방법 (Re et al., 1999)을 적용하였으며 7 mM 2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS, Sigma Chemical Co., St Louis, MO, USA)에 2.45 mM potassium persulfate (Sigma Chemical Co., St Louis, MO, USA)를 첨가하여 24 시간 동안 ABTS+을 형성시킨 후 734 ㎚에서 흡광도 값이 0.70 - 0.90이 되도록 희석하였다. 시료 50 ㎕에 희석액 100 ㎕를 첨가한 후 734 ㎚에서 흡광도를 측정하였고 저해율은 다음의 식으로 산출하였다
시료의 환원력 측정은 Oyaizu 방법으로 측정하였다 (Oyaizu, 1986). 시료 1 ㎖에 1% potassium ferricyanide 1 ㎖를 혼합하여 50℃에서 20 분 동안 반응시키고, 10% trichloroacetic acid (TCA; Sigma Chemical Co., St Louis, MO, USA) 1 ㎖를 첨가하였다. 혼합물을 4℃에서 10 분 동안 8000 × g으로 원심 분리한 후, 상등액 1 ㎖에 증류수 1 ㎖와 0.1% 염화철 용액 0.1 ㎖를 첨가하여 700 ㎚에서 흡광도를 측정하였다.
3. 알코올 분해효소 활성 분석
ADH 및 aldehyde dehydrogenase (ALDH) 활성은 alcohol dehydrogenase activity assay kit (Sigma-Aldrich, St Louis, MO, USA) 및 colorimetric aldehyde assay kit (Sigma-Aldrich, Sigma Chemical Co., St Louis, MO, USA)를 사용하여 측정하였다.
96 well plate에 흑노호 줄기 추출물 0 ㎍/㎖ (control), 100 ㎍/㎖ (KC100), 200 ㎍/㎖ (KC200) 및 400 ㎍/㎖ (KC400)을 50 ㎕ 씩을 분주하고 kit 시약들과 1 시간 반응하여 흡광도 450 ㎚에서 측정하였다. ADH 및 ALDH 활성은 계산식을 이용하여 산출하였다.
4. 세포 독성 및 세포 보호 시험
세포독성 시험을 위하여 96 well plate에 HepG2 세포를 1 × 105 cells/well로 100 ㎕ 씩 분주하고 37℃에서 24 시간 동안 배양하였다.
이후 흑노호 줄기 추출물을 10 ㎕ 씩 처리하여 0 ㎍/㎖ (control), 100 ㎍/㎖ (KC100), 200 ㎍/㎖ (KC200) 및 400 ㎍/㎖ (KC400)로 최종농도를 맞춘 후 37℃에서 24 시간 추가 배양하였다. 그 후 10 ㎕의 CCK-8 용액을 처리하여 37℃에서 4 시간 동안 배양 후 450 ㎚에서 흡광도를 측정하였다.
측정 결과는 무처리구 대조군의 세포 생존율이 100%가 되도록 계산하였다. 또한 세포 보호 시험을 위해 위의 방법으로 추출물까지 처리한 후 과산화수소 (1 mM) 첨가 배지로 교체하여 24 시간 추가 배양하였다.
세포보호 효과는 또한 CCK-8 assay를 이용해 450 ㎚에서 흡광도를 측정하고, 측정 결과는 양성대조군 (1 mM 과산화수소 처리)의 세포 생존율이 100%가 되도록 계산하였으며 상기 측정한 흡광도를 통해 formazan의 농도를 산출하여 세포의 활성 (% of control)을 산출하였다.
5. 활성산소종(ROS) 생성억제 시험
활성산소종 생성억제 시험은 간세포인 HepG2 세포와 dihlorodihydrofluorescein-diacetate (DCFH-DA)를 이용하여 수행하였다.
HepG2 세포를 1 × 105 cells/㎖의 농도로 24 well plate에 24 시간 배양한 뒤 흑노호 줄기 추출물 0 ㎍/㎖ (control), 100 ㎍/㎖ (KC100), 200 ㎍/㎖ (KC200) 및 400 ㎍/㎖ (KC400)을 최종농도로 처리한 후, 1 mM 과산화수소 (H2O2)를 처리하였다.
37℃에서 24 시간 배양 후 PBS (phosphate buffer saline)로 2 회 세척한 뒤 DCFH-DA (50 μM)를 처리하여 37℃ 암실에서 30 분간 배양하였다. 다시 PBS로 2 회 세척하여 남아있는 DCFH-DA를 제거하고, Fluoview confocal microscope (40 ×, Olympus, Tokyo, Japan)과 SpectraMax M5 microplate reader (504 ㎚ / 524 ㎚, Molecular Devices, Sunnyvale, CA, USA)를 이용하여 DCF 형광 발광 정도를 측정하였다.
6. 항산화 효소 관련 유전자 활성화 시험
항산화 효소 SOD1, GPx1 및 CAT의 mRNA가 발현되는 양을 정량적 역전사 중합효소 연쇄반응 (quantitative reverse transcription polymerase chain reaction, qRT-PCR)을 이용하여 분석하였다.
6 well plate에 HepG2 세포 (1 × 106 cells/㎖)를 24 시간 배양하고, 흑노호 줄기 에탄올 추출물 (100, 200, 400 ㎍/㎖)을 처리한 후 37℃에서 24 시간 동안 배양하였다. 그 후 1 mM 과산화수소 (H2O2)를 처리하여 37℃에서 24 시간 동안 추가 배양한 후 기존의 배지를 버리고 PBS로 2 회 세척하여 시료를 준비하였다.
RNA는 배양된 세포로부터 RNA isolation kit (Qiagen Inc., Valencia, CA, USA)를 사용하여 RNA를 추출하였다. Reverse Transcription Master Premix (Elpis-biotech Co., Daejeon, Korea)를 사용하여 1 ㎍의 RNA를 cDNA로 역전사시켰으며, 유전자 발현 수준은 LightCycler 480 Instrument II (Roche Diagnostics, Mannheim, Germany)를 사용하여 RT-PCR에 의해 분석하였다.
본 연구에 사용된 oligonucleotide primers는 5’ → 3’ 방향의 SOD1 (Forward: ACGGTGGGCCAAAGGATGAA, Reverse: TCATGGACCACCAGTGTGCG), CAT (Forward :CCAACAGCTTTGGTGCTCCG, Reverse: GGCCGGCAATGTTCTCACAC), GPx1 (Forward : GTGCTCGGCTTCCCGTGCAAC, Reverse: CTCGAAGAGCATGAAGTTGGGC), GAPDH (Forward : GTATGACTCCACTCACGGCAAA, Reverse : GGTCTCGCTCCTGGAAGATG)를 사용하였다.
PCR 조건은 95℃에서 5 분 동안 pre-denaturation 후, 95℃에서 15 초, 55℃에서 15 초, 72℃에서 30 초의 40 cycles로 반복, 상대 정량 분석을 위해 glyceraldehyde-3-phosphate dehydrogenase (GAPDH)로 정규화하였다.
7. 통계처리
모든 실험은 3 번 이상 반복 실험으로 진행되었으며, 모든 데이터는 평균 ± 표준편차로 표시하였다. 결과값의 통계처리는 SPAW 18 software (IBM Corp, Armonk, NY, USA)를 이용하여 수행하였으며, 결과값의 유의성은 oneway ANOVA test를 실시하여 5% 수준에서 Duncan’s Multiple Range Test (DMRT)로 각 데이터 간의 유의차를 검정하였다 (p < 0.05).
결과 및 고찰
1. 흑노호 줄기추출물의 항산화 활성 분석
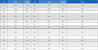
흑노호 줄기 추출물의 총 폴리페놀함량은 검량선 (y = 0.0144x-0.0191, R2 = 0.9952)을 구한 후 gallic acid 당량 ㎎으로 표기되었으며 103.39 ± 0.31 ㎎·GAE/g로 확인되었다. DPPH 소거 활성은 각각 흑노호 줄기추출물 50, 100, 200, 400 ㎍/㎖을 투여하였을 때 10.69 ± 1.90%, 22.55 ± 2.05%, 40.65 ± 1.06%, 56.80 ± 1.64%의 소거 활성 효과를 나타내었다 (Table 1).
ABTS 라디칼 소거능은 ABTS의 양이온 라디칼의 흡광도가 항산화 활성 물질에 의해 감소되는 원리에 기초한 방법으로 각각 흑노호 줄기추출물 50, 100, 200, 400 (㎍/㎖)을 처리하였을 때 31.70 ± 0.41%, 59.86 ± 0.31%, 97.28 ± 0.21%, 99.46 ± 0.01%로 소거 활성이 확인되었다 (Table 1).
활성산소종 및 유리기에 전자를 공여하는 능력을 확인하는 방법을 사용하여 항산화 활성을 검증하였다. 흑노호 줄기추출물의 환원력은 각각 50, 100, 200, 400 (㎍/㎖)을 처리하였을 때 0.258 ± 0.00, 0.276 ± 0.00, 0.311 ± 0.00, 0.398 ± 0.00 로 농도 의존적으로 흡광도가 증가하였다 (Table 1).
흑노호 열매에서 추출된 폴레페놀과 안토시아닌은 항산화 활성이 우수한 것으로 알려져 있다 (Sun et al., 2009). 또한 Zhao 등 (2021)에 의하면 흑노호 줄기에 함유한 주요 화합물에는 α-pinene , β-pinene, camphene, borneol, δ-cadinene, and β-elemene 등이 있으며, 이러한 성분에 기인하여 항산화 활성과 항균 활성을 나타낸다고 보고하였다.
2. ADH 및 ALDH 분해 효소의 활성 변화
에탄올 대사는 알코올 탈수소효소, 미세소체 에탄올 산화 시스템 및 카탈라아제 대사 경로를 통한 산화스트레스 증가와 관련이 있다 (Tsermpini et al., 2022). 따라서 alchol dehydrogenase (ADH) 및 acetaldehyde dehydrogenase (ALDH)의 활성을 측정하기 위하여 흑노호 줄기 추출물에 의한 ADH와 ALDH의 활성 변화를 분석하였다.
그 결과 ADH 및 ALDH 활성은 흑노호 줄기 추출물 200 ㎍/㎖ 처리 시 무처리 대조군과 비교하여 각각 137.2 ± 10.1%, 및 134.4 ± 12.9%의 증가하는 경향을 나타내었으며, 400 ㎍/㎖ 처리 시 169.9 ± 4.2% 및 195.6 ± 10.5%의 높은 효소 활성 증가를 나타내는 것으로 확인되었다 (Fig. 1).

Effect of Kadsura coccinea stem ethanol extract on alcohol dehydrogenase (ADH) and aldehyde dehydrogenase (ALDH) activities by in vitro kit.ADH (A) and ALDH (B) activity of K. coccinea stem ethanol extract is increased compared with control. KC100, 200, 400 means K. coccinea stem extracts each 100 ㎍/㎖, 200 ㎍/㎖, and 400 ㎍/㎖. Results are expressed as percent control and represent means ± standard deviations (SD) of three independent experiments. *Means with letters on the bar are significantly different from each other at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05).
흑노호 줄기 추출물의 처리 농도가 증가할수록 농도 의존적으로 ADH 및 ALDH 효소의 활성이 증가하는 것을 알 수 있었다. 체내에 흡수된 알코올은 위장과 소장에서 흡수되어 간에서 대사 과정을 거치는데 ADH에 의해 acetaldehyde로 분해되고, acetaldehyde는 ALDH에 의해 acetic acid으로 분해된 후 이산화탄소와 물로 가수분해된다 (Takei et al., 2011).
또한 에탄올에서 ADH에 의해 1차 분해된 아세트알데하이드는 뇌 손상, 심근병증, 췌장염 및 태아 알코올 증후군을 포함한 다른 병리학적 발달을 초래할 수 있는 것으로 알려져 있다 (Ahmed and Younus, 2019).
Do 등 (2017)은 약용식물 원료 50종을 이용하여 ADH 및 ALDH 효소활성을 분석하였으며, 백수오, 모시대, 삽주, 대추 추출물은 ADH의 활성을 120% 이상 증가시켰으나, ALDH의 활성은 106-109.6% 증가시키는 데 그쳤다. 특히 무 뿌리 추출물은 ADH의 활성을 132.1% 증가시켜 에탄올을 가장 빠르게 분해시켰으며, ALDH 활성이 제일 높은 마늘 추출물은 120.1%로 나타났다.
이에 따라 본 연구의 흑노호 줄기 추출물은 다른 약용식물 대비 에탄올 및 아세트알데하이드에 분해효소의 우수한 활성을 갖는 것을 알 수 있었다.
3. 간세포 독성 및 세포보호 활성
흑노호 줄기 추출물의 간세포 HepG2에 대한 세포독성을 알아보기 위하여 CCK-8을 이용하여 측정하였다.
흑노호 줄기 추출물을 처리한 HepG2 세포의 세포생존율은 흑노호 줄기 추출물 100 ㎍/㎖, 200 ㎍/㎖, 및 400 ㎍/㎖ 농도에서 각각 100.3 ± 1.1%, 101.0 ± 1.8%, 및 99.9 ± 2.1%를 나타내었다 (Fig. 2A).

Effect of Kadsura coccinea stem ethanol extract on human hepatoma HepG2 cells.(A) Percentage of viable cells was calculated with control cells. (B) Percentage of viable cells was calculated with control (+) on hydrogen peroxide stimulated HepG2 cells. KC100, 200, 400 means K. coccinea stem extracts each 100 ㎍/㎖, 200 ㎍/㎖, and 400 ㎍/㎖. Results are expressed as percent control and represent means ± standard deviations (SD) of three independent experiments. *Means with letters on the bar are significantly different from each other at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05).
흑노호 줄기 추출물의 처리 농도 400 ㎍/㎖까지 증가하여도 간세포 HepG2의 세포 활성 (cell viability, % of control)이 줄어들지 않고 유지되는 것으로 확인되어 세포독성은 없는 것으로 판단되었다. 또한 간세포 HepG2에 과산화수소 (1 mM)을 처리한 후 흑노호 줄기 추출물을 처리한 결과 흑노호 줄기 추출물의 농도가 증가함에 따라 간세포 HepG2의 활성이 증가하는 것으로 확인되었다 (Fig. 2B).
과산화수소 (1 mM)을 처리한 후 흑노호 줄기 추출물 100 ㎍/㎖, 200 ㎍/㎖, 및 400 ㎍/㎖을 처리한 결과 각각 110.0 ± 5.4%, 132.0 ± 5.9%, 153.2 ± 2.9%의 세포 생존율을 보여 농도 유의적으로 세포생존율이 증가하는 것으로 확인되었다 (Fig. 2B).
과산화수소는 세포에서 많이 발견되는 활성산소종으로, 세포막 통과가 용이하여 외부자극에 빠르게 반응하여 산화적 스트레스를 증가시킴에 따라 미토콘드리아 막전위를 감소시켜 미토콘드리아 내부의 cytochrome c 방출을 촉진시켜 caspase-9과 caspase-3의 활성화를 통해 apoptosis를 유발시키는 것으로 알려져 있다 (Kim et al., 2010).
따라서 본 연구에서의 흑노호 줄기 추출물은 간세포 HepG2에 독성을 보이지 않으며, 과산화수소와 같은 산화 및 apoptosis로부터 HepG2 세포를 보호하는 것으로 판단된다.
4. 활성산소종(ROS) 생성 억제
본 연구에서 흑노호 줄기 추출물의 간세포 HepG2에 대한 활성산소종 (reactive oxygen species, ROS) 생성 억제 효과를 분석하였다.
Dichlorodihydrofluorescein-diacetate (DCFH-DA)는 세포를 투과하며 비형광 특성을 가지는 염료로서 DCFH-DA를 세포에 처리하면 세포 내로 침투하여 DCFH으로 변환되고 상기 DCFH가 세포 내에 존재하는 ROS의 의해 산화되면 형광특성을 가지는 2,7-dichlorodihydrofluorescein (DCF)으로 변환된다 (Yu et al., 2021). 따라서 DCFH-DA를 세포에 처리한 후 유세포 분석을 통해 형광분석을 수행하면 세포 내에 존재하는 ROS의 양을 산출할 수 있게 된다.
분석 결과 흑노호 줄기 추출물의 처리양이 많을수록 형광의 세기가 낮은 것으로 확인되었다. HepG2 세포에 과산화수소 1 mM을 처리한 결과, ROS는 3.2 ± 0.4%에서 100.0%로 증가하였고, 형광 이미지에서도 뚜렷한 차이를 보였다 (Fig. 3A).

Effect of Kadsura coccinea stem ethanol extract on reactive oxygen species determined by DCFH-DA assay showing reduction in intracellular ROS.(A) Fluorescence microscopic images of intracellular ROS production by DCFH-DA staining (green) in HepG2 cells. (B) Fluorescence intensity of DCFH-DA in different treated HepG2 cells. Percentage of intensity was calculated with control (+) cells. KC100, 200, 400 means K. coccinea stem extracts each 100 ㎍/㎖, 200 ㎍/㎖, and 400 ㎍/㎖. Results are expressed as percent control (+) and represent means ± standard deviations (SD) of three independent experiments. *Means with letters on the bar are significantly different from each other at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05).
흑노호 줄기 추출물 100 ㎍/㎖, 200 ㎍/㎖, 및 400 ㎍/㎖ 농도에서 생성된 ROS는 과산화수소 처리군 대비 각각 48.5 ± 9.1%, 33.7 ± 7.0%, 및 28.5 ± 5.2%로 농도 유의적으로 감소하는 것이 확인되었다 (Fig. 3B). 이는 흑노호 줄기 추출물이 과산화수소 처리된 간세포 Hep2의 활성산소종 생성을 억제한다는 것을 의미한다.
Jeon 등 (2021)의 연구에서는 B16F10 미백세포에 UVA 또는 UVB 조사하여 ROS 독성을 유발하여 K. coccinea 과실, 잎, 줄기 및 뿌리 등의 부위별 추출물을 처리한 결과 ROS가 억제되는 것을 확인하였다.
또한 Lu 등 (2022)에 따르면 정맥내피세포 (HUVEC)에 과산화수소를 처리하여 ROS를 유발하여 K. coccinea 과일에서 정제한 페놀성 화합물이 포함된 추출물을 200 ㎍/㎖ 수준으로 처리하였을 때 ROS 함량은 각각 50% 이상 감소시키는 연구결과도 보고되었다.
이는 K. coccinea 추출물은 세포 내 다양한 외부요인에 의해 유발된 ROS 생성을 억제 또는 제거하고 손상된 세포를 보호하는 것으로 보인다.
5. 항산화 효소 관련 유전자 활성 변화
항산화 효소 SOD는 세포에 존재하는 O2- (superoxide radical)을 과산화수소와 산소로 분해하는 효소로 free radical 및 활성산소를 제거하는 효소이며, CAT는 SOD에 의해 분해되어 생긴 과산화수소를 산소와 물로 분해하는 효소이다. GPx1는 2차로 과산화수소를 산소와 물분자로 분해하는 효소이며, 과산화지질을 분해하여 해독시키는 글루타치온의 활동을 촉진하는 효소이다 (Ighodaro and Akinloye, 2018).
따라서 ROS 생성억제 등 항산화 효능이 우수한 흑노호 줄기 추출물의 간세포 HepG2에 대한 항산화 효소활성을 유전자 발현 수준에서 분석하였다.
HepG2 세포에 과산화수소 (1 mM)를 처리하고 흑노호 줄기 추출물을 농도별로 처리한 후 superoxide dismutase 1 (SOD1), glutathione peroxidase 1 (GPx1) 및 catalase (CAT)의 mRNA 발현 차이를 분석하였다. 과산화수소 (1 mM) 처리에 의해 HepG2 세포 내 항산화 효소 SOD1, GPx1 및 CAT는 mRNA 발현이 무처리군에 비해 유의적으로 감소하였다 (Fig. 4).

Expression analysis of antioxidant-related genes (A) superoxide dismutase 1 (SOD1), (B) glutathione peroxidase 1 (GPx1) and (C) catalase (CAT) on Kadsura coccinea stem ethanol extract in HepG2 cell.Results are expressed as percent control (+) and represent means±standard deviations (SD) of three independent experiments. Percentage of viable cells was calculated with control (+) cells. KC100, 200, 400 means K. coccinea stem extracts each 100 ㎍/㎖, 200 ㎍/㎖, 400 ㎍/㎖. Results are expressed as percent control and represent means ± standard deviations (SD) of three independent experiments. *Means with letters on the bar are significantly different from each other at 5% by Duncan’s Multiple Range Test (DMRT, p < 0.05).
흑노호 줄기 추출물 400 ㎍/㎖ 농도 처리구에서 SOD는 무처리군 대비 63.5% 수준으로 항산화 효소 활성이 회복되는 것을 알 수 있었다 (Fig. 4A). GPx1은 흑노호 줄기추출물을 400 ㎍/㎖ 농도 수준으로 처리하였을 때 92.1%까지 활성이 크게 증가하였으며 (Fig. 4B), CAT의 경우에는 104.1%로 과산화수소 무처리군과 동일한 수준까지 회복되었으며 통계적으로 유의한 결과를 나타내었다 (Fig. 4C).
Zhang (2022) 등에 따르면 흑노호 과일 추출물은 흰 닭의 면역 기관의 발달을 촉진하고, 혈청 내 SOD 및 GPx 함량이 매우 증가한 것을 보고된 바 있다. 또한 고지방식으로 유발된 고지혈증 쥐에 흑노호 과일 다당류 섭취를 통해 간에 존재하는 SOD, CAT 및 GSH-Px의 효소활성이 대조군에 비해 유의하게 증가하였다고 보고하였다 (Long et al., 2022).
이러한 결과로 흑노호 추출물은 외부의 다양한 산화 스트레스로부터 SOD, CAT 및 GPx1의 항산화 효소 활성을 증가시켜 항산화 체계를 보호하며, 세포가 손상되는 것을 예방할 수 있는 것으로 보인다. 본 연구에서는 흑노호 줄기 추출물은 항산화 활성을 갖으며, 에탄올과 아세트알데하이드의 분해 활성을 높이며, 과산화수소 처리로 유발된 간세포의 산화적 손상으로부터 간세포를 효과적으로 보호할 수 있는 특성을 갖는 것으로 보인다.
또한, Kadsura 속 과실 추출물에는 favonol (quercetin), flavanone (naringenin), anthocyanidins (cyanidin and delphinidin) 등이 풍부하며, 이들 플라보노이드 계열은 항산화 활성 및 당뇨 관련 주요 효소 억제에 관여하는 것으로 보고되었다 (Sritalahareuthai et al., 2020). 그리고 Kadsura 속 과실에서 분리된 리그난 유사체인 2,2′-cyclolignans, heilaohuguosus A와 L, tiegusanin I 그리고 kadsuphilol I은 N-acetyl-p-aminophenol (APAP)로 독성이 유발된 HepG2 세포에 10 μM 처리 시 세포 생존율은 각각 53.5 ± 1.7%, 55.2 ± 1.2%, 52.5 ± 2.4%, 54.0 ± 2.2%로 우수한 간 보호 활성을 보였다 (Jia et al., 2021).
따라서 흑노호 줄기는 간을 보호하는 건강기능식품으로서 이용가치가 높을 것으로 기대되며, 하지만 산업화를 위해서 흑노호 줄기에 포함된 주요 화합물의 분석 및 상호작용 등에 관한 추가적인 연구가 필요하다고 생각된다.
Acknowledgments
본 연구는 2021년 - 2022년 바이오산업 국제교류협력지원사업(춘천시)의 지원으로 이루어진 결과로 이에 감사드립니다.
References
-
Ahmed LA and Younus H. (2019). Aldehyde toxicity and metabolism: the role of aldehyde dehydrogenases in detoxification, drug resistance and carcinogenesis. Drug Metabolism Reviews. 51:42-64.
[https://doi.org/10.1080/03602532.2018.1555587]

-
Almazroo OA, Miah MK and Venkataramanan R. (2017). Drug metabolism in the liver. Clinics in Liver Disease. 21:1-20.
[https://doi.org/10.1016/j.cld.2016.08.001]

-
Balusikova K and Kovar J. (2013). Alcohol dehydrogenase and cytochrome P450 2E1 can be induced by long-term exposure to ethanol in cultured liver HEP-G2 cells. In Vitro Cellular and Developmental Biology-Animal. 49:619-625.
[https://doi.org/10.1007/s11626-013-9636-y]

-
Blois MS. (1958). Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Cho EK, Jung KI and Choi YJ. (2015). Anti-diabetic, alcohol metabolizing enzyme, and hepatoprotective activity of Acer tegmentosum Maxim. stem extracts. Journal of the Korean Society of Food Science and Nutrition. 44:1785-1792.
[https://doi.org/10.3746/jkfn.2015.44.12.1785]

-
Do JH, Gwak JW, Lee SJ, Rho, JJ, Lee KS and Kim DC. (2017). Effect of medicinal plant extracts on the ethanol-metabolizing enzyme activities. Food Engineering Progress. 21:286-291.
[https://doi.org/10.13050/foodengprog.2017.21.3.286]

-
Ighodaro OM and Akinloye OA. (2018). First line defence antioxidants-superoxide dismutase(SOD), catalase(CAT) and glutathione peroxidase(GPX): Their fundamental role in the entire antioxidant defence grid. Alexandria Journal of Medicine. 54:287- 293.
[https://doi.org/10.1016/j.ajme.2017.09.001]

-
Jeon JS, Kang HM, Park JH, Kang JS, Lee YJ, Park YH, Je BI, Park SY and Choi YW. (2021). A comparative study on photo-protective and anti-melanogenic properties of different Kadsura coccinea extracts. Plants. 10:1633. https://www.mdpi.com/2223-7747/10/8/1633, (cited by 2023 October 13).
[https://doi.org/10.3390/plants10081633]

-
Jeon S and Carr R. (2020). Alcohol effects on hepatic lipid metabolism. Journal of Lipid Research. 61:470-479.
[https://doi.org/10.1194/jlr.R119000547]

-
Jia YZ, Yang YP, Cheng SW, Cao L, Xie QL, Wang MY, Liu B, Jian YQ, Liu B, Peng CY and Wang, W. (2021). Heilaohuguosus AS from the fruits of Kadsura coccinea and their hepatoprotective activity. Phytochemistry. 184:112678. https://https://www.sciencedirect.com/science/article/abs/pii/S003194222100025X, (cited by 2023 October 23).
[https://doi.org/10.1016/j.phytochem.2021.112678]

-
Jiang Y, Zhang T, Kusumanchi P, Han S, Yang Z and Liangpunsakul S. (2020). Alcohol metabolizing enzymes, microsomal ethanol oxidizing system, cytochrome P450 2E1, catalase, and aldehyde dehydrogenase in alcohol-associated liver disease. Biomedicines. 8:50. https://www.mdpi.com/2227-9059/8/3/50, (cited by 2023 October 23).
[https://doi.org/10.3390/biomedicines8030050]

-
Kim HJ, Lee JM, Moon SH, Park HR. (2010). Protective effect of Prunella spica extracts against H2O2-induced cytotoxicity in PC12 cells. Journal of Life Science. 20:1121-1126.
[https://doi.org/10.5352/JLS.2010.20.7.1121]

-
Liu J, Qi Y, Lai H, Zhang J, Jia X, Liu H, Zhang B and Xiao P. (2014). Genus Kadsura, a good source with considerable characteristic chemical constituents and potential bioactivities. Phytomedicine. 21:1092-1097.
[https://doi.org/10.1016/j.phymed.2014.01.015]

-
Long H, Xia X, Liao S, Wu T, Wang L, Chen Q, Wei S, Gu X and Zhu Z. (2022). Physicochemical characterization and antioxidant and hypolipidaemic activities of a polysaccharide from the fruit of Kadsura coccinea(Lem.) AC Smith. Frontiers in Nutrition. 9:903218. https://www.frontiersin.org/articles/10.3389/fnut.2022.903218/full, (cited by 2023 October 23).
[https://doi.org/10.3389/fnut.2022.903218]

-
Lu J, Zheng Y, Yang Z, Cheng J and Luo F. (2022). Phenolics profile and protective effect on injuried HUVEC Cells of epicarp extracts from Kadsura coccinea. Foods. 11:556. https://www.mdpi.com/2304-8158/11/4/556, (cited by 2023 October 23).
[https://doi.org/10.3390/foods11040556]

-
Oyaizu M. (1986). Studies on products of browning reaction: Antioxidant activities of products of browning reaction prepared from glucosamine. Japanese Journal of Nutrition and Dietetics. 44:307-315.
[https://doi.org/10.5264/eiyogakuzashi.44.307]

-
Qu J, Huang P, Zhang L, Qiu Y, Qi H, Leng A and Shang D. (2020). Hepatoprotective effect of plant polysaccharides from natural resources: A review of the mechanisms and structure-activity relationship. International Journal of Biological Macromolecules. 161:24-34.
[https://doi.org/10.1016/j.ijbiomac.2020.05.196]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M and Rice- Evans C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine. 26:1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Rui L. (2014). Energy metabolism in the liver. Comprehensive Physiology. 4:177-197.
[https://doi.org/10.1002/cphy.c130024]

- Sharma P, Nandave M, Nandave D, Yadav S, Vargas-De-La- Cruz C, Singh S, Tandon R, Ramniwas S and Behi T. (2023). Reactive oxygen species(ROS)-mediated oxidative stress in chronic liver diseases and its mitigation by medicinal plants. American Journal of Translational Research. 15:6321-6341.
-
Sies H, Belousov VV, Chandel NS, Davies MJ, Jones DP, Mann GE, Murphy MP, Yamamoto M and Winterbourn C. (2022). Defining roles of specific reactive oxygen species(ROS) in cell biology and physiology. Nature Reviews Molecular Cell Biology. 23:499-515.
[https://doi.org/10.1038/s41580-022-00456-z]

-
Singh S, Osna NA and Kharbanda KK. (2017). Treatment options for alcoholic and non-alcoholic fatty liver disease: A review. World Journal of Gastroenterology. 23:6549-6570.
[https://doi.org/10.3748/wjg.v23.i36.6549]

-
Sritalahareuthai V, Temviriyanukul P, On-Nom N, Charoenkiatkul S, and Suttisansanee U. (2020). Phenolic profiles, antioxidant, and inhibitory activities of Kadsura heteroclita(Roxb.) Craib and Kadsura coccinea(Lem.) AC Sm. Foods. 9:1222. https://www.mdpi.com/2304-8158/9/9/1222, (cited by 2023 October 23).
[https://doi.org/10.3390/foods9091222]

-
Sun J, Yao J, Huang S, Long X, Wang J and García-García E. (2009). Antioxidant activity of polyphenol and anthocyanin extracts from fruits of Kadsura coccinea(Lem.) AC Smith. Food Chemistry. 117:276-281.
[https://doi.org/10.1016/j.foodchem.2009.04.001]

-
Takei T, Iguchi N and Haruta M. (2011). Synthesis of acetoaldehyde, acetic acid, and others by the dehydrogenation and oxidation of ethanol. Catalysis Surveys from Asia. 15:80-88.
[https://doi.org/10.1007/s10563-011-9112-1]

-
Tram LH, Huong TT, Thuy LT, Thong NV, Anh NT, Minh NH, Ha TT, Dung DA, Thao NP, Thuong PT, Le DD, Hiep ND and Shin HJ. (2021). A new triterpenoid from the stems of Kadsura coccinea with antiproliferative activity. Natural Product Research. 36:2542-2546.
[https://doi.org/10.1080/14786419.2021.1914612]

-
Tsermpini EE, Plemenitaš IA and Dolžan V. (2022). Alcohol-induced oxidative stress and the role of antioxidants in alcohol use disorder: A systematic review. Antioxidants. 11:1374. https://www.mdpi.com/2076-3921/11/7/1374, (cited by 2023 October 23).
[https://doi.org/10.3390/antiox11071374]

-
Woo MH, Nguyen DH, Choi JS, Park SE, Thuong PT, Min BS and Le DD. (2020) Chemical constituents from the roots of Kadsura coccinea with their protein tyrosine phosphatase 1B and acetylcholinesterase inhibitory activities. Archives of Pharmacal Research. 43:204-213.
[https://doi.org/10.1007/s12272-020-01211-8]

-
Xia Z, Hao E, Chen Z, Zhang M, Wei Y, Wei M, Hou X, Du Z and Deng J. (2020). Roots and stems of Kadsura coccinea extract induced developmental toxicity in zebrafish embryos/larvae through apoptosis and oxidative stress. Pharmaceutical Biology. 58:1303-1310.
[https://doi.org/10.1080/13880209.2020.1859553]

-
Yang Y, Liu Y, Daniyal M, Yu H, Xie Q, Li B, Jian Y, Man R, Wang S, Zhou X, Liu B and Wang W. (2019) New lignans from roots of Kadsura coccinea. Fitoterapia. 139:104368. https://www.sciencedirect.com/science/article/abs/pii/S0367326X19317800, (cited by 2023 October 23).
[https://doi.org/10.1016/j.fitote.2019.104368]

-
Yang YP, Hussain N, Zhang L, Jia YZ, Jian YQ, Li B, Choudhary MI, Rahman AU and Wang W. (2020). Kadsura coccinea: A rich source of structurally diverse and biologically important compounds. Chinese Herbal Medicines. 12:214-223.
[https://doi.org/10.1016/j.chmed.2020.03.006]

-
Yu D, Zha Y, Zhong Z, Ruan Y, Li Z, Sun L and Hou S. (2021). Improved detection of reactive oxygen species by DCFH-DA: New insight into self-amplification of fluorescence signal by light irradiation. Sensors and Actuators B: Chemical. 339:129878. https://www.sciencedirect.com/science/article/abs/pii/S0925400521004470, (cited by 2023 October 23).
[https://doi.org/10.1016/j.snb.2021.129878]

-
Zhang T, Zhou D, Wang X, Xiao T, Wu L, Tang Q and Lu Y. (2022). Effects of Kadsura coccinea L. fruit extract on growth performance, meat quality, immunity, antioxidant, intestinal morphology and flora of white-feathered broilers. Animals. 13:93. https://www.mdpi.com/2076-2615/13/1/93, (cited by 2023 October 23).
[https://doi.org/10.3390/ani13010093]

-
Zhao T, Ma C and Zhu G. (2021). Chemical composition and biological activities of essential oils from the leaves, stems, and roots of Kadsura coccinea. Molecules. 26:6259. https://www.mdpi.com/1420-3049/26/20/6259, (cited by 2023 October 23).
[https://doi.org/10.3390/molecules26206259]