지황 싹 틔우기가 묘 품질 및 수량에 미치는 영향
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study addressed the issues of uneven sprouting and yield reduction in Rehmannia glutinosa when traditionally sown directly into open fields. A plug-tray seedling method incorporating a sprouting process was employed to try and mitigate these problems.
Sprouting R. glutinosa, the rhizomes were sown into 72-cell standard trays, covered with soil, and maintained at an average daily temperature of 25°C and over 98% humidity. The sprouting periods were set at 3, 4, 5, 6, and 7 days and three cultivation methods were analyzed to compare the effects of sprouting: conventional direct sowing of rhizomes in open-fields, rhizomes plug-tray cultivation, and sprouted rhizomes plug-tray cultivation. The results showed that a 5 days sprouting period was the most effective in terms of shoot length and weight. Sprouted rhizome plug-tray cultivation followed by transplanting significantly outperformed both the conventional direct seeding cultivation in the open-field and non-sprouted rhizomes plug-tray cultivation followed by transplanting, with an underground yield of 2,040 ㎏/10a and a catalpol content of 5%.
Sprouting effectively enhances R. glutinosa yield and quality. Further research is needed to address the challenges of root development in vegetatively propagated crops compared to seed-propagated crops and mechanization studies are required to improve the transplanting efficiency.
Keywords:
Catalpol Content, Plug Tray Seedling Method, Rhizomes, Seedling Quality, Yield and Quality Enhancement서 언
지황 [Rehmannia glutinosa (Gaertn.) Libosch. ex Steud.]은 현삼과 (Scrophulariaceae)의 다년생 초본 작물로 한국을 비롯하여 중국, 일본, 베트남 등 광범위하게 자생하고 있는 약용작물이다 (Jeong et al., 2004). 국내 재배 면적은 87 ㏊로 조사 되었고, 생산량은 548 톤으로 보고되었으며 (MAFRA, 2023), 주산지는 충남 금산, 전북 정읍, 경북 영주, 안동이고, 충남 서천, 충북 제천, 음성에서도 일부 재배가 이루어지고 있다 (Lee et al., 2020).
지황은 가공 상태에 따라 생지황 (生地黃), 건지황 (乾地黃), 숙지황 (熟地黃)으로 구분하며, 주요 성분으로는 catalpol, aucubin, rehmanin, GABA (γ-Aminobutyric acid), 5–hydroxymethyl–2-furaldehyde (5-HMF), vitamin A 등이 있으며, 이 중에 catalpol은 생지황과 건지황의 지표성분으로, 5-HMF는 숙지황의 지표성분으로 알려져 있다 (Kim et al., 2000; Lee et al., 2017).
Reina 등 (2013)은 iridoid 배당체로 알려진 aucubin이 항산화, 항염증, 간 건강에 도움을 준다고 하였고, 생지황의 지표 성분으로 알려진 catalpol은 당뇨병, 당뇨병, 신경변성질환 등에 효과가 있다고 보고되었다 (Jiang et al., 2015; Zhao et al., 2016). GABA는 신경계의 흥분 조절 역할을 하고 있으며 항불안, 심신 안정 등에 효과가 있다고 보고된 바 있다 (Chapouthier and Venault, 2001; Foster and Kemp, 2006). 최근 건강기능식품 시장이 확대되면서 지황의 활성에 관한 연구가 다양하게 이루어지고 있어 (Huang et al., 2016; Li et al., 2017) 향후 국산 원료 사용 및 건강기능식품 개발의 증가가 기대되는 작물이다 (Han et al., 2022).
지황의 재배는 종자를 파종하거나 영양체인 지하경을 이식하는데, 일반적으로 농가에서는 굵기 6 ㎜ - 10 ㎜, 길이 2 ㎝ 내외 규격의 종근을 선별하여 파종하여 재배한다 (Lee et al., 2019a). Lee 등 (2019b)은 파종 및 이식 후 기상환경이 불안정할 경우 출아 불량, 종근 부패 등이 발생할 수 있으며, 특히 온도가 높고 건조하면 출아가 균일하지 못하여 늦어지고, 강수량이 많고 온도가 급격히 올라가면 부패가 많이 일어날 수 있다고 하였다.
지황을 노지에 재배하는 경우 종근의 영양 상태, 재배 환경 등에 따라 출아율이 불균일하며, 관행적으로 농가에서는 출아율이 80% 이하면 보식 작업을 실시한다. 그러나 보식 작업은 노지에서 결주가 확인된 후에 실시하기 때문에 생육 시기가 먼저 파종한 개체들보다 한 달가량 늦어져 생산량이 적어지는 경향이 있다. 따라서 보식용 지황을 플러그 트레이에 미리 준비하여 생산성을 유지하기 위한 연구가 수행되기도 하였다 (Lee et al., 2019b).
육묘를 위해서는 하우스 등의 시설이 필요하므로 작물의 생산성과 경제성이 시설투자 비용을 만족시킬 수 있는지가 중요 하다 (Kang et al., 2013). 그러나 지황은 영양번식 작물로 지하경을 통한 번식법은 증식 배율이 낮아 품종 보급 속도가 늦으며 신품종 육성 및 육묘를 위한 기초 연구가 계속 필요한 실정이다 (Han et al., 2022).
플러그 묘는 소량의 배지가 담긴 플러그 트레이에서 구분된 셀을 기준으로 생산된 어린 묘를 의미하며 (Jeong et al., 2016), 플러그 묘를 통해 생산되는 묘는 품질이 균일하고, 생장 속도가 빠를 뿐만 아니라 공간 이용 효율도 높아 정식에 쉽다 (Park et al., 2011). 또한 노동력 절감, 효율성, 안정성 및 연중 계획 생산을 목적으로 할 수 있어서 품질이 균일하고 규격한 묘를 연중 생산할 수 있다는 장점이 있다 (RDA, 2019).
일반적으로 채소 작물을 중심으로 발달한 플러그 공정묘 생산기술은 1960년대 미국에서 개발되어 1980년대 유럽과 일본에 보급되었다 (Park et al., 2011). 국내에 공정육묘 기술이 본격적으로 도입되어 보급된 시기는 1990년대 초기이며 (Jeong et al., 2016), 플러그 묘의 품질과 육묘 후 작물의 수량에는 육묘 소요 일수, 셀 (근권부) 크기, 관수 관리법 등 다양한 요인이 영향을 미친다 (Kim et al., 2001; Lee and Suh, 2009; Yu et al., 2002).
기존 약용작물 재배는 주로 노지에서 이루어져 왔으나, 최근 기후변화, 연작장해, 그리고 병해충 증가 등의 위험 요인으로 인해 시설 내 생산 연구에 대한 필요성이 더 커지고 있다. 따라서 약용작물의 육묘 연구도 활발히 이루어지고 있으며, 특히 지황에서는 플러그 트레이 육묘를 위한 적정성 평가와 육묘 기간을 제시하는 연구가 진행되었다 (Lee et al., 2019a, 2019b; Lee et al., 2020).
본 연구에서는 기존에 관행으로 사용되고 있는 노지 직파재배의 한계 중 하나인 출아율의 불균일성을 극복하고 육묘 소요 일수를 단축하기 위해 싹틔우기 공정을 도입하였다. 이를 통해 싹틔우기의 효과를 평가하고 지황의 성분과 수량을 분석하여 지황의 플러그 육묘에 대한 재배 방법을 더욱 심층적으로 연구하여, 산업체나 농가에 균일하고 고품질의 지황을 제공할 수 있는 표준화된 방법을 제시하고자 한다.
재료 및 방법
1. 종근 재료확보
본 연구에서는 지황의 종근 재료로 2023년 3월 상순에 한국농업기술진흥원 시험포장에서 수확한 지황 ‘토강’ 품종의 지하부를 분양받아 3월 하순까지 4℃ 냉장에서 보관한 후, 길이 2 ㎝로 정선하여 시험에 사용하였다.
2. 싹틔우기
볍씨에 주로 사용하는 규격 모판 (60 ㎝ × 30 ㎝)에 원예 범용 상토 (Seoulbio Co. Ltd., Eumseong, Korea)를 채우고, 2 ㎝ 크기의 지황 종근을 파종한 후 상토를 덮어주었다 (Fig. 1A and 1B).

Sowing process in plug cell trays after sprouting.(A) filling the seedbed with growing medium and sowing Rehmannia glutinosa rhizomes, (B) covering the topsoil after sowing Rehmannia glutinosa rhizome in the seedbed, (C) maintaining optimal temperature and humidity by covering the seedbed with plastic vynil, (D) transferring the sprouted rhizomes to a 72-cell plug tray.
모판 위에 비닐을 덮어 (Fig. 1C) 하루평균 온도 25℃, 습도 98% 이상을 유지하도록 한 후, 3 일, 4 일, 5 일, 6 일, 7 일차까지 싹을 틔운 후 싹튼 종근을 모판에서 옮겨 72-셀 (538 ㎜ × 280 ㎜ × 46 ㎜) 트레이에 이식하였다.
3. 재배 방법
냉장 보관 후 길이 2 ㎝로 분주한 지황을 3월 하순에 3 개의 처리구로 나누어 파종하였다. 첫 번째 처리구는 일차별 싹 틔우기 후 싹 튼 종근을 플러그 트레이에 파종, 두 번째 처리구는 싹틔우기 과정 없이 종근을 플러그 트레이에 파종, 세 번째 처리구는 플러그 트레이 파종 과정 없이 바로 노지에 종근 직파한 처리구였다.
각 처리구별로 생육기 초장, 근장, 근경, 수량 등을 조사하였다. 플러그 트레이로 하우스에서 지황을 재배한 3월 하순에서 4월 하순의 하우스 내 일 평균 기온은 25.5 ± 5.7℃였다.
4. 묘 품질 및 수량 조사
플러그 묘의 품질을 평가하기 위해 종근 파종 후 19 일에 지상부 초장, 지상부 중, 지하부 근장, 지하부 중을 1 차 조사했으며, 파종 후 33 일에 동일 항목에 대하여 2 차 조사를 한 후 4월 하순에 노지 정식하였다. 조간 거리 30 ㎝, 주간 거리 15 ㎝로 심었고, 정식 후 한 달째 되는 날 활착한 개체 수의 비율을 구하여 활착률 (%)을 계산하였다.
10월 하순에 시험 포장에서 정상적으로 생육한 지황을 수확하여, 지하부에 묻은 흙을 세척하고 물기를 제거한 후 지하부의 길이, 직경, 무게를 측정하였다.
5. Catalpol 함량 분석
Catalpol 표준품은 Sigma-Aldrich 제품 (St. Louis, MO, USA)을 사용하였고, 검액은 약 0.1 g의 분쇄된 동결건조 지황을 1 ㎖의 80% methanol에 현탁하여 30 분간 초음파 추출한 후, syringe filter (0.45 ㎛)로 여과하여 Vanquish Flex UHPLC (Thermo Fisher Scientific, MA, USA)로 정량 분석하였다. 분석 조건은 Table 1과 같다.
6. 통계 분석
통계 분석은 SAS Enterprise 7.1 (SAS Institute Inc., Cary, NC, USA) 프로그램을 사용하여 일원 분산분석 (one-way analysis of variance)을 수행하였으며, Duncan’s Multiple Range Test (DMRT)와 Student t-test를 이용하여 5% 수준에서 처리 간 평균값의 유의성을 검정하였다 (p < 0.05).
결과 및 고찰
1. 싹틔우기 일차별 묘 품질 평가
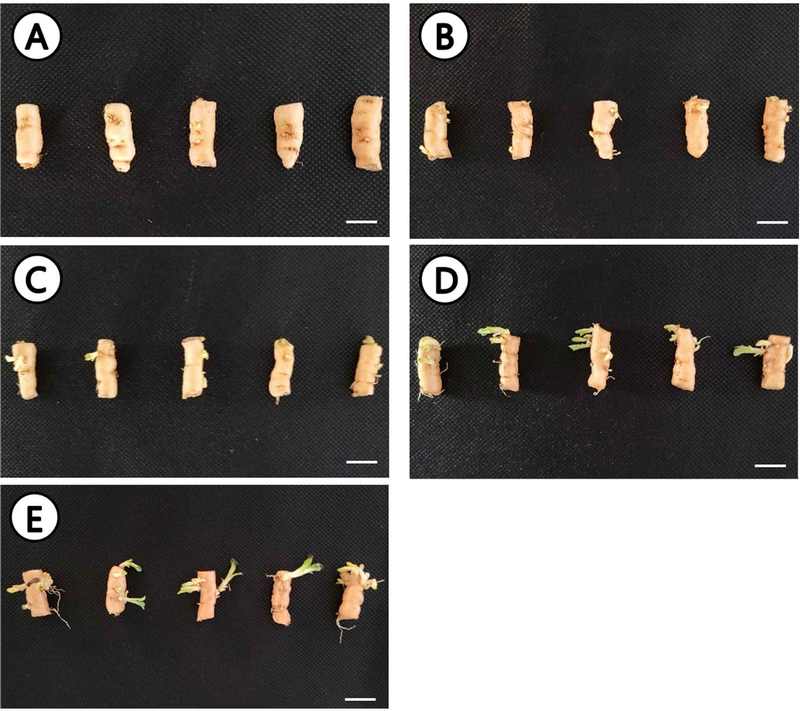
지황 종근을 싹틔우기하여 플러그 트레이에 파종한 후 19 일에 실시한 1 차 묘 품질 평가에서, 지상부의 초장은 싹틔우기 5 일 차에 7.0 ± 0.8 ㎝로 가장 높았고 (Table 2), 지상부 중량은 5 일 차 처리구를 기점으로 싹틔우기 7 일 차 처리구까지 1.1 g - 1.2 g으로 나타났다. 싹틔우기 5 일 차 이후 지상부의 생육 상태는 전반적으로 잘 발달하였으며 (Fig. 3), 싹틔우기 일수가 증가함에 따라 지하부 근장도 유의적으로 증가하였다.

Growth characteristics of R. glutinosa rhizome seedlings observed in the initial survey (19 days after planting) based on the number of days after sprouting.

Growth state of R. glutinosa sprouted rhizomes sown in 72-cell plug trays and harvested during the first survey according to the number of sprouting days.(A) sprouted rhizomes for 3 days, sown in plug trays, (B) sprouted rhizomes for 4 days, sown in plug trays, (C) sprouted rhizomes for 5 days, sown in plug trays, (D) sprouted rhizomes for 6 days, sown in plug trays, (E) sprouted rhizomes for 7 days, sown in plug trays. The photo at the top was taken immediately after harvesting from the plug tray, and the photo at the bottom was taken after the topsoil was removed.
이러한 생육 경향은 파종 후 33 일 차에 실시한 2 차 조사에서도 유사하게 나타났으며, 싹틔우기 5 일 차 처리구에서 지상부 초장과 지상부 중량 등이 유의적으로 높게 나타났다 (Table 3, Fig. 4).

Growth characteristics of R. glutinosa rhizome seedlings conducted in the second survey (33 days after planting) according to the number of sprouting days.

Growth state of R. glutinosa sprouted rhizomes sown in 72-cell plug trays and harvested during the second survey according to the number of sprouting days.(A) sprouted rhizomes for 3 days, sown in plug trays, (B) sprouted rhizomes for 4 days, sown in plug trays, (C) sprouted rhizomes for 5 days, sown in plug trays, (D) sprouted rhizomes for 6 days, sown in plug trays, (E) sprouted rhizomes for 7 days, sown in plug trays. The photo at the top was taken immediately after harvesting from the plug tray, and the photo at the bottom was taken after the topsoil was removed.
싹틔우기 처리는 생육 기간을 단축하고 품질을 향상시키기 위해 다양한 작물에서 연구가 수행된 바, 오리엔탈나리의 절화에서 싹틔우기 처리 효과로 절화장, 절화중 및 화뢰장이 증가하였고, 생리장해인 블라인드 발생률이 감소했으며 수확 소요 일수가 단축되는 효과를 나타냈으며 (Ko et al., 2012), 다년생 여름 잡초에 속하는 시리아수수새 (Sorghum halepense)에서는 싹틔우기가 뿌리줄기 발달에 자극 효과를 나타냈고 싹틔우기에 온도가 미치는 영향이 컸다 (Loddo et al., 2012). 약용과 식용으로 사용되고 있는 약용작물 생강과 강황에서 근경의 싹틔우기에 미치는 온도의 영향을 예측하는 생육 모델 연구가 진행되었다 (Retana-Cordero et al., 2021).
이렇게 싹틔우기 처리는 근경, 구근, 뿌리줄기 등 지하부를 이용하는 작물의 수량과 품질을 높이기 위해 수행되는데, 약용작물 지황은 대한민국약전에 수록된 약재로 뿌리를 약용하며 지하경으로 영양 번식하기 때문에 지하부의 번식력과 품질이 매우 중요하다. 본 실험을 통해 지황의 지상부와 지하부의 묘 품질을 종합적으로 고려했을 때, 싹틔우기 적정 일수는 5 일인 것으로 판단된다.
2. 싹틔우기 효과 평가
싹틔우기의 실효성을 평가하기 위해, 싹틔우기의 유무에 따른 생육 지표들을 비교하였다. 첫 번째 처리구에서는 싹틔우기 과정 없이 트레이에 종근을 직접 파종하였고, 두 번째 처리구에서는 5일 차 싹 틔운 종근을 모판에서 플러그 트레이로 옮겨서 파종했다.
플러그 트레이 파종 처리구와 싹틔우기 처리구의 묘 품질을 조사한 결과, 파종 후 33 일 차에 실시한 2차 생육 조사에서는 지상부 중량과 지하부 근장 지표가 2.3 g과 7.6 g으로, 싹틔우기 5일 차 처리구에서 더 높게 나타났다 (Table 4).

Growth characteristics of R. glutinosa seedlings observed in the second survey based on the presence or absence of sprouting.
지황에는 번식의 애로사항이 있는데 기존에 관행으로 사용되고 있는 노지 직파재배는 출아율이 균일하지 않다는 점이다. 출아 균일성을 높이기 위해 본 실험에서는 싹틔우기 공정을 추가하였다. 싹틔우기를 위해 규격 모판에 종근을 파종한 후 상토를 덮어준 후 하루평균 온도 25℃, 습도 98% 이상을 유지하면서 싹틔우기를 한 후 모판에서 옮겨 플러그 트레이에 파종하였다. 추가된 싹틔우기 처리는 복잡한 공정 없이 생육지표 중 지상부 중량과 지하부 근장을 유의하게 높이는 효과를 나타냈다.
3. 노지 수량 평가
노지육묘에 비해 공정육묘에는 추가적인 하우스 시설비와 인건비가 소요된다. 따라서 기존 관행 방식에 비해 경제적 이점이 있어야 지속 가능한 시스템으로 볼 수 있다. 싹틔우기 3 일 - 7 일의 일수에 따른 차이는 유의하게 나타나지 않았기 때문에 (Table 5 and Fig. 5), 가장 지하부 수량이 높았던 5 일 차 싹틔우기 처리를 관행 노지 직파와 플러그 트레이 처리구와 비교했을 때, 싹틔우기 처리가 유의적인 수량의 증가를 나타냈다 (Table 6 and Fig. 6).

Evaluation of R. glutinosa rhizome quantity according to the number of sprouting days.(A) sprouted rhizomes for 3 days, sown in plug trays, (B) sprouted rhizomes for 4 days, sown in plug trays, (C) sprouted rhizomes for 5 days, sown in plug trays, (D) sprouted rhizomes for 6 days, sown in plug trays, (E) sprouted rhizomes for 7 days, sown in plug trays. The scale bar size is 5 ㎝.

Evaluation of R. glutinosa rhizome quantity according to the sowing method. number of sprouting days.(A); SRTC (Sprouted Rhizomes Transplanting Cultivation), (B); RTC (Rhizomes Transplanting Cultivation), (C) DSC (Direct Seeding Cultivation); direct seeding of rhizomes into the open-field without using plug trays.
작물의 어린 묘를 정식할 때 발아율이 높고 균일하며 노지에 정식했을 때 활착률이 높은 것이 경영비를 최소화할 수 있어서, 공정육묘에서는 발아와 활착이 매우 중요한 지표이다 (Weston et al., 1989; Leskovar et al., 1991). 지황은 대표적인 영양번식 작물로, 지황 육묘에서 종근의 출아율이 중요하다. 그러나 지황을 노지에 파종하면 출아율은 약 70%대에 불과하며 (Table 7), 불균일한 출아율은 하우스 내 공정육묘 시 작업 효율을 떨어뜨릴 수 있다.
지황의 노지 출아율 저하 문제를 하우스 내 싹틔우기 과정으로 개선할 수 있어서, 생산성과 수량 증대에 따른 경제적 이점을 충분히 기대할 수 있다. 그러나 플러그 트레이 파종 처리에서 1194.5 ㎏, 노지 파종 처리에서 1,309.0 ㎏으로 오 히려 싹틔우기 공정 없이는 플러그 육묘 처리가 직파재배에 비해 수확기 지하부 무게가 낮아졌는데 (Table 6), 이는 플러그 트레이 내에서 종근이 잘 뿌리돌림 하지 못한 데에서 기인한 것으로 추정된다. 뿌리돌림이 잘돼야 상토가 응집하여 본 밭에 정식할 때 노동력이 절감되고 묘의 초기 생육이 증진된다 (Lee et al., 2023).
그러나 현재 기술적으로는 종자번식 작물에 비해 영양번식 작물인 지황의 트레이 내 뿌리돌림이 잘 이루어지지 않는 어려움이 있다. 추가로 종자번식 작물만큼이나 뿌리돌림이 잘되도록 온도와 호르몬 등의 처리 연구가 필요할 것으로 생각한다.
4. 성분분석
싹틔우기 일차별 처리구에서, 3 일 처리구는 5.4 ± 0.5%, 4 일 처리구는 5.5 ± 0.3%, 5 일 처리구는 5.0 ± 0.4%, 6 일 처리구는 4.9 ± 0.7%, 그리고 7 일 처리구는 5.0 ± 0.3%로 나타 났으며, 처리 간 유의한 차이는 관찰되지 않았다 (Table 7).
Catalpol은 생지황에서 가장 먼저 밝혀진 성분으로 (Kitagawa, 1971), 파종 방법에 따른 지황의 catalpol 함량을 분석한 결과 싹틔우기 5 일 처리에서 5.0 ± 0.4%, 플러그 트레이 파종 처리에서 4.4 ± 0.1%, 그리고 노지 파종 처리에서 4.5 ± 0.9%로 나타나 싹틔우기 처리구에서 유의하게 높은 결과를 확인했다 (Table 8).
지황의 catalpol 함량은 품질에 영향을 많이 받는데, 특히 건조 온도에 영향을 받았고 (Kim et al., 2020), catalpol 함량이 많을수록 항산화 활성이 우수하다는 보고가 있다 (You et al., 2011).
생육 특성과 수량, 성분함량 분석을 종합적으로 고려할 때 싹틔우기 공정은 기존 관행재배의 노지 직파재배와 플러그 트레이를 이용한 재배법보다 수량과 품질을 향상시키는 결과를 확인했다. 지황은 근경 굵기가 15 ㎜ 전후가 되면 상품(上品)의 등급으로 팔리는데 (Lee et al., 2019a, 2019b), 15 ㎜ 이상으로 상품성이 높은 비율이 싹틔우기 5 일 처리에서 59.2%로 플러그 트레이 파종 처리에서 50.0%, 그리고 노지 파종 처리에서 54.7% 보다 많아 싹틔우기 공정이 상품성도 높이는데 기여한 것으로 보되며, 높은 상품성이 catalpol 함량을 증가시켰다고 추측된다.
본 실험에서의 catalpol 함량 결과는 재배 지역별, 방식별 수확한 지황의 catalpol 함량 (3.67%)에 비해 높은 값을 보였는데 (Lee et al., 2020), 이는 성분 분석시 상품성이 낮은 15 ㎜ 의 종근은 제외하고 수행한 것으로 사료된다.
최근 지황의 영양번식 효율을 극대화하기 위하여 조직배양 등 다양한 번식 기술이 적용되었으며 (Kim et al., 2020), 트레이 육묘 방식도 출아율을 높이는 하우스 내 싹틔우기 과정을 선행하면 품질과 수량을 증가시키고 나아가 정식의 기계화 연구까지 가능할 것으로 예상된다.
Acknowledgments
본 연구는 농촌진흥청 시험연구사업(RS-2022-RD010298)의 지원에 의해 이루어진 것으로 이에 감사드립니다.
References
-
Chapouthier G and Venault P. (2001). A pharmacological link between epilepsy and anxiety. Trends Pharmacological Sciences. 22:491-493.
[https://doi.org/10.1016/S0165-6147(00)01807-1]

-
Foster AC and Kemp JA. (2006). Glutamate and GABA-based CNS therapeutics. Current Opinion in Pharmacology. 6:7-17.
[https://doi.org/10.1016/j.coph.2005.11.005]

-
Han JW, Kim EH, Oh MW, Lee JH, Ma KH, Yoon YH and Jeong JT. (2022). Seed morphology and germination characteristics of Rehmannia glutinosa. Korean Journal of Medicinal Crop Science. 30:187-194.
[https://doi.org/10.7783/KJMCS.2022.30.3.187]

-
Huang Y, Qin T, Huang Y, Liu Z, Bo R, Hu Y, Liu J, Wu Y and Wang D. (2016). Rehmannia glutinosa polysaccharide liposome as a novel strategy for stimulating an efficient immune response and their effects on dendritic cells. International Journal of Nanomedicine. 11:6795-6808
[https://doi.org/10.2147/IJN.S119108]

-
Jeong JH, Yu KW, Kim SJ, Choi YE and Paek KY. (2004). Plant regeneration from adventitious roots of Rehmannia glutinosa Liboschitz and bioreactor culture. Journal of Plant Biotechnology. 31:55-60.
[https://doi.org/10.5010/JPB.2004.31.1.055]

- Jeong BR, Hwang SJ and Kang NJ. (2016). Plug seedling production. Gyeongsang National University Press. Jinju, Korea, p.11.
-
Jiang B, Shen RF, Bi J, Tian XS, Hinchliffe T and Xia Y. (2015). Catalpol: A potential therapeutic for neurodegenerative diseases. Current Medicinal Chemistry. 22:1278-1291.
[https://doi.org/10.2174/0929867322666150114151720]

-
Kang YK, Ryou YS, Kim JG, Kim YH and Jang JK. (2013). Analysis on cooling effects of the vertical type geothermal heat pump system installed in a greenhouse for raising seedling. Journal of Bio-Environment Control. 22:19-25.
[https://doi.org/10.12791/KSBEC.2013.22.1.019]

- Kim NJ, Jung EA, Kim HJ, Sim SB and Kim JW. (2000). Quality evaluation of various dried roots of Rehmannia glutinosa. Korean Journal of Pharmacognosy. 31:130-141.
- Kim CK, Oh JY and Kang SJ. (2001). Effect of plug cell size and seedling age on growth and yield of chinese chives(Allium tuberosum R.). Journal of the Korean Society of Food Science and Nutrition. 42:167-170.
- Kim YB, Chang KW, Park CH and Park SU. (2020). The study for the production of Rehmannia glutinosa and the import movement and the improving methods of distribution. Journal of Practical Agriculture and Fisheries Research. 25:5-11.
-
Kim YJ, Ma KH, Han JW, Lee SH, Chang JK and Han SH. (2020). Quality characteristics of Rehmannia glutinosa dried at different drying temperature. Korean Journal of Food Preservation. 27:17-24.
[https://doi.org/10.11002/kjfp.2020.27.1.17]

-
Kitagawa I, Nishimura T, Furubayashi A and Yosioka I. (1971). On the constituents of rhizome of Rehmannia glutinosa Libosch. forma hueichingensis Hsiao. Yakugaku Zasshi 91:593-596.
[https://doi.org/10.1248/yakushi1947.91.5_593]

- Ko JY, Choi KJ, Hong DK and Rhee HK. (2012). Effect of pre- shooting duration on cut flower quality of Lilium oriental hybrid depending on planting time. Flower Research Journal. 20:1-6.
- Lee EJ and Suh JK. (2009). Effect of watering control on growth and bulb size of plug seedling in onion(Allium cepa L.) set production. Korean Journal of Horticultural Science and Technology. 27:167-173.
-
Lee ES, Kim YI, Kim YG, Kim MS and Han KS. (2023). Assessing the impact of seedling conditions on yield and seedling quality in two medicinal crops of the genus Angelica. Korean Journal of Medicinal Crop Science. 31:396-406.
[https://doi.org/10.7783/KJMCS.2023.31.6.396]

-
Lee KS, Kim GH, Kim HH, Seong BJ, Kim SI, Han SH, Kang EJ and Yoo YC. (2013). Qualities and anti-inflammatory activity of Kyungokgos sold in local markets. Journal of the Korean Society of Food Science and Nutrition. 42:335-341.
[https://doi.org/10.3746/jkfn.2013.42.3.335]

-
Lee SH, Yoon JS, Kim JK, Park CG, Chang JK and Kim YB. (2017). Analysis of iridoid glycoside and GABA content in the roots of the Rehmannia glutinosa cultivars. Korean Journal of Medicinal Crop Science. 25:146-151.
[https://doi.org/10.7783/KJMCS.2017.25.3.146]

-
Lee SH, Koo SC, Hur M, Lee WM, Park MS and Han JW. (2019a). Investigation of emergence conditions and plug seedling periods in Rehmannia glutinosa(Gaertn.) Libosch. ex Steud. Korean Journal of Medicinal Crop Science. 27:271-277.
[https://doi.org/10.7783/KJMCS.2019.27.4.271]

-
Lee SH, Kang SU, Lee SH, Koo SC, Hur M, Jin ML, Lee WM, Park MS, Kim YB and Han JW. (2019b). Appropriateness evaluation of plug seedling cultivation for replanting of Rehmannia glutinosa (Gaertn.) Libosch. ex Steud. Korean Journal of Medicinal Crop Science. 27:202-207.
[https://doi.org/10.7783/KJMCS.2019.27.3.202]

- Lee SH, LeeYJ, Oh MW, Lee SH, Koo SC, Hur M, Lee WM, Chang JK, Kim EH and Han JW. (2020). Appropriateness evaluation of plug seedling cultivation of Rehmannia glutinosa. Korean Journal of Plant Resources. 33:73-79.
-
Li Xj, Jiang C, Xu N, Li JX, Meng FY and Zhai HQ. (2018). Sorting and identification of Rehmannia glutinosa germplasm resources based on EST-SSR, scanning electron microscopy micromorphology, and quantitative taxonomy. Industrial Crops and Products. 123:303-314.
[https://doi.org/10.1016/j.indcrop.2018.06.088]

-
Loddo D, Masin R, Otto S and Zanin G. (2012). Estimation of base temperature for Sorghum halepense rhizome sprouting. Weed Research. 52:42-49.
[https://doi.org/10.1111/j.1365-3180.2011.00886.x]

- Ministry of Agriculture, Food and Rural Affair(MAFRA). (2023). Production record of cash crops. Ministry of Agriculture, Food and Rural Affair. Sejong, Korea. p.106.
- Rural Development Administration(RDA). (2019). Nongsaro. Plug seedling production. Rural Development Administration. JeonJu, Korea. http://nongsaro.go.kr/portal/ps/psq/psqb/farmTermDicLst.ps?menuld=PS00064&searchWord=%EA%B3%B5%EC%A0%95%EC%9C%A1%EB%AC%98&totalSearchYn=Y, (cited by 2024 Aug. 7).
- Park KH, Park HT, Han HS and Lee DP. (2011). A study on the current state and development strategies of raising seedlings industry. Journal of Bio-Environment Control. 16:205-209.
-
Reina E, Al-Shibani N, Allam E, Gregson KS, Kowolik M and Windsor LJ. (2013). The effects of Plantago major on the activation of the neutrophil respiratory burst. Journal of Traditional and Complementary Medicine. 3:268-272.
[https://doi.org/10.4103/2225-4110.119706]

-
Retana-Cordero M, Fisher PR and Gómez C. (2021). Modeling the effect of temperature on ginger and turmeric rhizome sprouting. Agronomy. 11:1931-1943.
[https://doi.org/10.3390/agronomy11101931]

-
You BR, Kim HR, Kim HJ, Lee JY, Lee SY, Song MR and Kim MR. (2011). Catalpol content and antioxidant activities in various cultivars of Rehmannia glutinosa. Journal of Korean Society of Food Science and Nutrition. 40:481-485.
[https://doi.org/10.3746/jkfn.2011.40.4.481]

-
Zhao M, Tao J, Qian D, Liu P, Shang EX, Jiang S, Guo J, Su SL, Duan JA and Du L. (2016). Simultaneous determination of loganin, morroniside, catalpol and acteoside in normal and chronic kidney disease rat plasma by UPLC-MS for investigating the pharmacokinetics of Rehmannia glutinosa and Cornus officinalis Sieb. drug pair extract. Journal of Chromatography B. 1010:122-129.
[https://doi.org/10.1016/j.jchromb.2015.12.020]