
예쁜꼬마선충을 이용한 홍삼 추출물의 항스트레스, 수명 연장 효능 평가 및 파킨슨 질환에의 효과 연구
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Cellular oxidative damage caused by reactive oxygen species, byproducts of intracellular metabolic processes, is considered a major causal factor of aging. Many anti-oxidant molecules have been studied for their anti-aging and lifespan-extending effects in various model organisms ranging from yeast to mice.
This study examined the effects of red ginseng extract on the stress response, lifespan, and age-related diseases using Caenorhabditis elegans as a model system. Red ginseng extract shows anti-oxidant activity in vitro and in vivo. Resistance to heat stress and ultraviolet irradiation was also significantly enhanced by red ginseng extract. Treatment with a 1/10 dilution of red ginseng extracts increased the mean and maximum lifespans without reducing fertility, which is frequently observed in many lifespan-extending interventions. In a genetic model of Parkinson’s disease, red ginseng extract completely blocked the degeneration of dopaminergic neurons and decreased alpha-synuclein expression.
Red ginseng extracts have anti-stress and lifespan-extending effects, and can reduce the risk of Parkinson’s disease. These findings suggested that red ginseng is a strong candidate for the development of novel nutriceuticals against aging and Parkinson’s disease.
Keywords:
Caenorhabditis elegans, Lifespan, Oxidative Stress, Parkinson’s Disease, Red Ginseng Extracts서 언
생물학적 관점에서 노화는 생체 기능의 점진적이고 불가역적인 감소 현상으로 특정될 수 있으며, 시간이 흐름에 따라 발생하는 유전자 및 분자적 변화와 다양한 환경적 요인들이 상호작용하여 발생하는 복잡한 생체 과정이다 (López-Otín et al., 2013).
노화의 주요 지표로는 DNA 손상, 세포 신호 전달 체계의 불균형, 단백질 변형 등이 있으며, 이러한 변화들은 생리적 기능의 저하를 초래한다. 이 과정에서 중요한 역할을 하는 분자적 요인 중 하나가 바로 활성산소종이다. 대표적인 활성산소종으로는 과산화수소 (H2O2), 수퍼옥사이드 음이온 (O2•-), 하이드록실 라디칼 (•OH), 일산화질소 (NO) 등이 있다.
활성산소종은 세포의 정상적인 대사 과정에서 부산물로 생성되며, 세포 내에 주요한 역할을 수행한다. 최근 연구에 의하면 성장인자 신호 전달, 자가 포식, 염증 반응과 같은 세포 내 다양한 신호 전달 과정에서 활성산소종이 주요한 조절 인자 기능을 수행한다고 보고되고 있다 (Finkel, 2011). 하지만, 활성산소종의 과도한 축적은 세포 내 산화적 스트레스를 유발하여 세포 손상과 염증 반응을 일으킨다 (Schieber and Chandel, 2014). 이러한 활성산소종은 DNA, 단백질, 지질 등에 산화적 손상을 유발하고, 세포의 기능을 저하시켜 궁극적으로 노화를 가속화하고 여러 질병의 발병 가능성을 증가시킨다. 활성산소종에 의한 산화적 스트레스와 노화와의 상관관계는 여러 실험 동물에서 연구되어 왔다. 예쁜꼬마선충과 초파리와 같은 무척추동물에서는 산화적 스트레스가 개체의 수명을 결정하는 주요 인자임이 증명되었으나, 포유류에서는 그들의 상관관계에 관한 일관된 결과를 보여주지 못하고 있다 (Golden et al., 2002). 최근에는 산화적 스트레스와 노화는 인과 관계라기보다는 세포 내에서 상호 영향을 주고받은 유기적 관계로 보는 가설도 주목받고 있다 (Santos et al., 2024).
항산화 물질은 세포 내 활성산소종을 제거하거나 감소시킴으로써 산화적 스트레스로부터 세포를 보호해 조직의 손상 및 노화의 진행을 지연시킬 수 있다는 점에서 중요한 역할을 한다 (Liguori et al., 2018). 특히 미토콘드리아가 손상되는 것을 막아 세포의 에너지 생산을 유지함으로써 수명 연장 및 노화 관련 질환 예방에 중요한 역할을 할 수 있음이 밝혀졌다 (Ristow and Schmeisser, 2011). 미토콘드리아 손상은 대표적인 노화 관련 신경퇴행성 질환인 알츠하이머병의 원인인 아밀로이드 베타 단백질과 파킨슨병 유발 단백질로 알려진 알파-시누클레인 (α-synuclein) 단백질의 축적을 유발하였다 (Lane et al., 2015). 또한 미토콘드리아 손상이나 미토콘드리아 DNA의 돌연변이 증가가 골다공증 발병과 밀접한 상관관계가 있음이 보고되었다 (Guo et al., 2011; Varanasi et al., 1999). 따라서 항산화 작용에 대한 이해는 노화와 관련된 다양한 문제를 이해하고 해결하는 데 필수적인 분야로 자리 잡고 있다.
퀘르세틴 (quercetin)은 잘 알려진 항산화 물질로, 주로 과일과 채소에서 발견되는 플라보노이드이다. 주요 항산화 효소인 수퍼옥사이드 디스뮤타제 (superoxide dismutase)와 카탈라아제 (catalase)의 활성을 증가시켜 세포 내 활성산소종을 제거하고 산화적 손상을 줄이는 데 도움을 준다. 또한, 미토콘드리아의 기능을 향상시켜 심혈관 질환 및 신경퇴행성 질환에 대한 보호 효과를 강화하는 것으로 알려져 있다 (Nyarko, 2024).
이외에도 강력한 항산화 물질인 아스코르브산 (ascorbic acid)은 활성산소종을 제거하고 항산화 효소와 상호작용하여 산화 스트레스를 줄여 면역 세포의 기능을 유지한다고 알려져 있다 (Carr and Maggini, 2017).
아미노산 유래 강력한 항산화제인 N-아세틸시스테인 (N-acetylcysteine)의 경우, 예쁜꼬마선충에서 식이 제한 유사 효과를 일으켜 개체의 수명을 연장시키고, 아밀로이드 베타 독성을 완화시켰다 (Oh et al., 2015; Oh and Park, 2017). 이러한 연구들은 항산화 물질이 노화 및 질병 진행을 지연시키는데 중요한 역할을 하며, 예방적인 측면에서도 효과적으로 활용될 수 있음을 시사한다.
홍삼 (Red ginseng)은 오랜 시간 동안 동양의 전통 의학에서 사용되어 온 약재로 항산화 및 항염증 효과에 대한 연구가 활발히 진행되고 있다. 홍삼의 주요 활성 성분인 진세노사이드는 항산화 효소의 활동을 촉진하여 산화적 스트레스를 줄이고, 염증 반응을 억제한다고 알려져 있다 (Hong and Lyu, 2011).
최근 연구에서는 진세노사이드 Rb1이 신경계 손상 후 신경재생을 촉진하고 손상을 최소화하는 신경 보호의 효과를 보인다는 결과가 보고되었다 (Gong et al., 2022). 이와 유사하게, 진세노사이드 Rg1이 알츠하이머병 마우스 모델에서 interleukin (IL)-1β 및 tumor necrosis factor (TNF)-α와 같은 염증 관련 단백질의 발현을 억제하고, Beclin1 및 microtubule-associated protein 1 light chain 3 (LC3) II/LC3 I와 같은 자가 포식과 관련한 단백질의 발현 증가를 통해 amyloid-β (Aβ) 축적과 신경손상을 감소시키는 효과를 보임이 밝혀졌다 (Li et al., 2023).
또한 진세노사이드 Rg3가 암세포의 증식, 전이 및 혈관 신생 억제와 세포 자살 유도 기전을 통해 항암 효과를 나타낸다는 연구 결과도 보고되었다 (Xia et al., 2022). 이러한 연구들은 홍삼이 다양한 질병에서 유망한 치료제로 활용될 가능성을 제시하고 있다.
그러나 홍삼이 생명체의 수명 연장에 기여할 수 있는지, 파킨슨 질환과 같은 신경퇴행성 질환에서 어떤 역할을 하는지에 대한 연구는 아직 초기 단계이다. 이러한 연구의 필요성을 배경으로, 예쁜꼬마선충은 이상적인 연구 모델로서 활용될 수 있다. 짧은 수명과 유전자 조작의 용이성, 그리고 인간의 노화 및 질병과 유사한 분자적 메커니즘을 가지고 있어 홍삼의 항산화 및 신경 보호 효과를 연구하는 데 적합한 실험 모델로 활용될 수 있다.
본 연구의 목표는 예쁜꼬마선충을 실험 모델로 하여 홍삼 추출물이 수명에 미치는 영향과 항산화 활성을 유도하는지, 그리고 파킨슨병 모델에서 신경 보호 효과를 나타내는지를 평가하는 것이다. 이를 통해 홍삼이 노화 및 노화 관련 질환 예방에 어떻게 기여할 수 있을지 밝히고자 한다.
특히, 홍삼의 신경 보호 효과를 뒷받침할 수 있는 새로운 기초 데이터를 제공하며, 파킨슨병과 같은 신경 퇴행성 질환치료에 대한 잠재적인 치료제로서의 가능성을 제시하고자 한다.
재료 및 방법
1. 예쁜꼬마선충 배양 및 홍삼 추출물 준비
본 연구에 사용된 예쁜꼬마선충은 야생형인 N2, 도파민 (dopamine) 분비 신경세포에 형광 단백질을 발현하는 BZ555 (egIs1 [dat-1p::GFP]), 형광 알파-시누클레인 (α-synuclein) 단백질을 발현하는 NL5901 (pkls2386 [unc-54p::alphasynuclein::YFP + unc-119(+)])이며, 모두 C. elegans Genetics Center (Minneapolis, MN, USA)에서 구입하였다.
예쁜꼬마선충은 20℃ 배양기에서 배양되었으며, 배양 배지로는 NGM (nematode growth medium) 배지가 사용되었다. NGM의 성분은 25 mM NaCl, 2.5 mg peptone/㎖, 50 mM KH2PO4, 5 ㎍ cholesterol/㎖, 1 mM CaCl2, 1 mM MgSO4, 1.7% agar이다. 예쁜꼬마선충의 먹이로는 대장균 OP50가 사용되었다. 홍삼 추출물은 ㈜대동고려삼 (Geumsan, Korea)에서 6년근 홍삼농축액 (진세노사이드 29.36 ㎎/g)을 구입하여 사용하였다. 본문에 기술하는 1/10 배 희석 홍삼 추출물은 진세노사이드 29.36 ㎎/g 함유 추출물을 원액으로 기준으로 했을 때, 이의 1/10 배 농도를 의미한다. 따라서 진세노사이드 2.936 ㎎/g 함유 추정 추출물이다. 1/100 배 희석 홍삼 추출물은 진세노사이드 0.2936 ㎎/g 함유 추정 추출물이며, 1/1000 배 희석 홍삼 추출물은 진세노사이드 0.02936 ㎎/g 함유 추정 추출물이다.
2. DPPH (2,2-diphenyl-1-picrylhydrazyl) assay
먼저 96-well plate (SPL, Pocheon, Korea)에 농도별 홍삼 추출물 (원액, 1/10 배 희석액, 1/100 배 희석액, 1/1000 배 희석액) 또는 양성 대조군인 아스코르브산 (Sigma-Aldrich, St. Louis, MO, USA) (2 ㎎/㎖)을 100 ㎕씩 첨가하였다. 다음, 99% 에탄올에 녹인 0.2 mM 2,2-diphenyl-1-picrylhydrazyl (DPPH) (Alfa aesar, Seoul, Korea) 용액 100 ㎕를 각 well에 첨가하였다. 37℃ 배양기 (Jeio Tech., Daejeon, Korea)에서 30 분간 반응시킨 후, 517 ㎚ 필터 (Biotek, Incheon, Korea)를 사용하여 흡광도를 측정하였다.
3. 산화적 스트레스 저항성
나이가 동일한 3 일 차 예쁜꼬마선충 (n = 30)을 홍삼 추출물 원액 또는 각 홍삼 추출물 희석액 (1/10 배 희석, 1/100 배희석, 1/1000 배 희석) 100 ㎕이 첨가된 NGM 배지 (5 ㎖)에 옮겨준 다음 20℃ 배양기 (Jeio Tech., Daejeon, Korea)에서 24 시간 적응시켰다. 그 후, 2 mM 과산화수소를 포함하는 96-well plate (SPL, Pocheon, Korea)에 한 well 당 한 마리씩 옮겼다. 8 시간 후 예쁜꼬마선충의 생존율을 기록하였다. 물리적인 힘을 가했을 때 움직이지 않는 경우, 사망한 것으로 간주하였다.
4. 열 저항성
나이가 동일한 3 일차 예쁜꼬마선충 (n = 60)을 홍삼 추출물 원액 또는 각 홍삼 추출물 희석액 (1/10 배 희석, 1/100 배 희석, 1/1000 배 희석) 100 ㎕이 첨가된 5 ㎖ NGM 배지에 옮겨 20℃에서 24 시간 적응시킨 후, 35℃에서 8 시간 동안 배양하여 열 스트레스를 유도하였다. 이후 20℃ 배양기 (Jeio Tech., Daejeon, Korea)로 옮겨 매일 생존율을 기록하였다.
5. 자외선 스트레스 저항성
나이가 동일한 3 일차 예쁜꼬마선충 (n = 60)을 홍삼 추출물 원액 또는 각 홍삼 추출물 희석액 (1/10 배 희석, 1/100 배 희석, 1/1000 배 희석) 100 ㎕가 처리된 5 ㎖ NGM 배양 배지에서 24 시간 적응시킨 후, 자외선 조사기 (Vilber Lourmat, Collegien, France)에서 20 J/㎠/min의 자외선에 1분간 노출시켰다. 이후 20℃ 배양기 (Jeio Tech., Daejeon, Korea)로 옮겨 예쁜꼬마선충의 생존율을 확인하였다.
6. 수명 연장 평가
동일한 날에 부화한 예쁜꼬마선충 성체 (n = 60)를 각 홍삼 추출물 희석액 (1/10 배 희석, 1/100 배 희석) 100 ㎕가 처리된 5 mL NGM 배지에 옮겨 실험에 사용된 모든 개체가 사망할 때까지 매일 살아있는 개체 수와 사망한 개체 수를 기록하였다. 성체 내부에서의 부화로 인한 사망을 방지하기 위해 DNA 합성 억제제 5-fluoro-2’-deoxyuridine (Sigma-Aldrich, St. Louis, MO, USA)을 배양 배지에 첨가하였다.
7. 번식력
각 홍삼 추출물 희석액 (1/10 배 희석, 1/100 배 희석) 100 ㎕를 처리한 5 ㎖ NGM 배지에서 키운 나이가 동일한 2 일차 예쁜꼬마선충 (n = 12)을 한 마리 씩 새로운 NGM 배지에 옮겨 24 시간 동안 알을 낳게 하였다. 24 시간 후. 동일한 시간에 새로운 NGM 배지로 옮겨 앞선 과정을 번식기간이 끝날 때까지 반복하였다. 전체 번식기간 동안 총 자손 수와 날짜별 자손 수를 비교 분석하였다.
8. 도파민 (dopamine) 분비 신경세포 분석
나이가 동일한 2 일차 BZ555 (Minneapolis, MN, USA) 개체에 6-OHDA (6-hydroxydopamine) (Sigma-Aldrich, St. Louis, MO, USA)를 처리하여 도파민 (dopamine) 분비 신경세포의 특이적 손상을 유도하였다. 그 후, 양성 대조군인 레보도파 (levodopa) (Sigma-Aldrich, St. Louis, MO, USA)와 홍삼 추출물 (1/10 배 희석액)을 100 ㎕ 씩 처리하였다. 20℃ 배양기 (Jeio Tech., Daejeon, Korea)에서 72 시간 배양한 다음 형광현미경 (Invitrogen, waltham, MA, USA)과 Image-J 프로그램 (version 1.54)을 통해 도파민 (dopamine) 분비 신경세포의 손상 정도를 비교하였다.
9. 알파-시누클레인 (α-synuclein) 정량
3 일간 배양한 NL5901 (CGC, Minneapolis, MN, USA) 배양 배지에 표백제를 처리하여 성체는 제거하고 알 만을 분리하였다. 분리된 알을 20℃ 배양기 (Jeio Tech., Daejeon, Korea)에서 24 시간 배양하여 부화시킨 후, 홍삼 추출물(1/10 배 희석액) 100 ㎕가 첨가된 5 ㎖ NGM 배지에 옮겨 72 시간 배양하였다. 이후 형광현미경 (Invitrogen, Waltham, MA, USA)과 Image-J 프로그램 (version 1.54)을 통해 알파-시누클레인 (α-synuclein) 발현 정도를 분석하였다.
10. 통계분석
연구 결과 통계 분석에는 수명 연장 평가 실험을 제외한 모든 실험 결과에 대해 the standard student t-test를 활용하였다. 통계 분석 결과 p-value가 0.05 이하인 경우에 유의적인 차이가 있는 것으로 간주하였다.
수명 연장 평가 실험 결과에 대한 그룹 간 평균 수명의 통계 분석에는 log-rank test 기법을 활용하였다 (Peto and Peto, 1972). 수명 연장 평가 실험 도중 내부 부화 또는 실험자의 실수로 인해 죽은 개체와 실험 도중 사라진 개체는 통계 분석에서 제외하였다.
결 과
1. 홍삼 추출물의 항산화 효능 평가
홍삼 추출물의 항산화능을 평가하기 위해 DPPH assay를 실시하였다. 아스코르브산 2 ㎎/㎖를 처리한 양성 대조군에서는 음성 대조군 (100%)에 비해 활성 산소량이 3.6 ± 0.59% (평균 ± 표준오차)로 감소하였다 (p < 0.05).
홍삼 추출물을 여러 농도로 희석하여 처리한 결과, 홍삼 추출물 원액과 1/10 배 희석 홍삼 추출물을 처리한 그룹에서 활성 산소량이 각각 12.1 ± 6.30% (p < 0.05), 27.1 ± 2.46% (p < 0.05)로 유의적으로 감소하였다. 홍삼 추출물을 1/1000 배 혹은 1/100 배 희석하여 처리한 그룹에서는 음성 대조군과 비교했을 때 활성 산소량에 유의적인 차이는 없었다 [1/1000 배 희석 그룹은 100.0 ± 17.83% (p = 0.998), 1/100 배 희석 그룹은 89.3 ± 5.01% (p = 0.077)] (Fig. 1A).
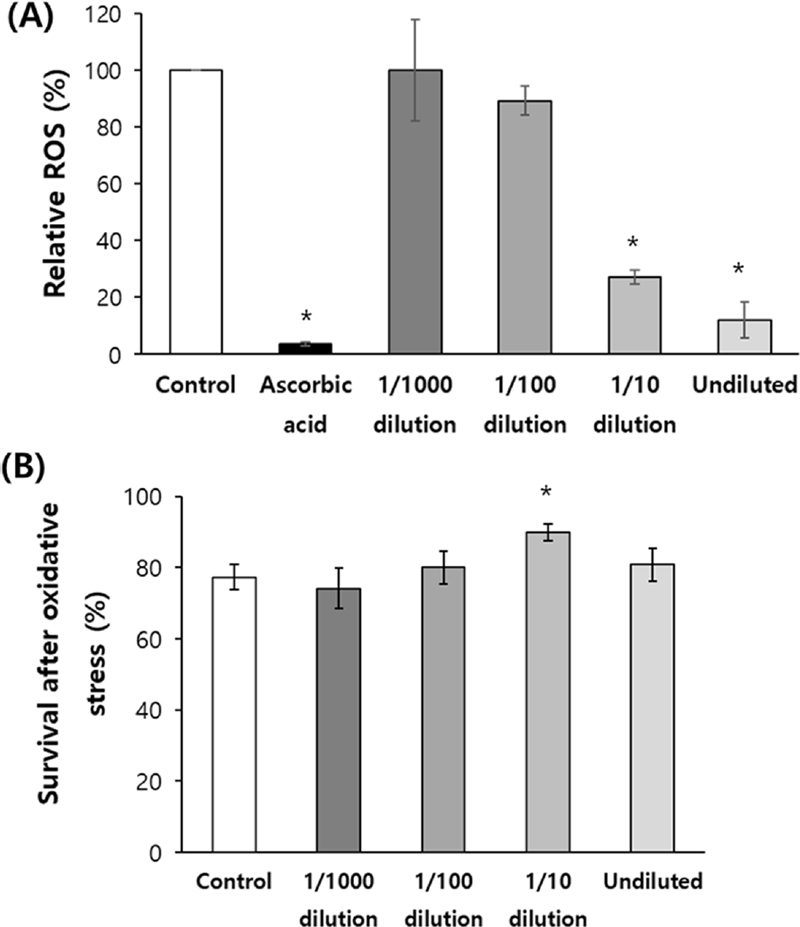
Anti-oxidant activity of red ginseng extracts.(A) in vitro ROS scavenging activity of red ginseng extracts was examined using 2,2-diphenyl-1-picrylhydrazyl (DPPH). 100 ㎕ of Ascorbic acid (2 ㎎/㎖), a positive control, and each red ginseng extracts were tested in a 96-well plate. After incubating in the dark for 30 min, the absorbance was measured with 517 ㎚ filter. (B) Oxidative stress was induced in vivo with 2 mM hydrogen peroxide (H2O2) for 8 h, to age-synchronized adult worms pre-treated with each concentrations of red ginseng extracts (undiluted, 1/10 dilution, 1/100 dilution, and 1/1000 dilution). The survival of worms was monitored. Both experiments were repeated three times. The Error bar indicates standard error. For statistical analysis, the standard student t-test was employed. Statistically significant difference compared to control (*p < 0.05).
홍삼 추출물이 개체 수준에서 산화적 스트레스 저항성에 미치는 영향을 평가하기 위해 홍삼 추출물을 여러 농도로 희석하여 처리한 다음 산화 스트레스로 인한 생존율을 평가하였다.
과산화수소 (2 mM)에 의한 산화적 스트레스 유발 환경에서 8 시간 배양한 후 생존율을 측정한 결과, 홍삼 추출물을 처리하지 않은 음성 대조군에서는 77.3 ± 3.66%의 생존율을 나타냈다. 그에 비해 홍삼 추출물을 1/10 배 희석하여 처리한 그룹에서는 생존율이 90.0 ± 2.36%까지 증가하였다 (p = 0.027). 하지만, 홍삼 추출물 원액을 포함한 다른 희석 배율 처리 그룹에서는 산화적 스트레스로 인한 생존율에 유의적인 변화가 없었다 (Fig. 1B).
2. 환경적 스트레스 하에서의 생존율 평가
홍삼 추출물이 산화적 스트레스 외 다른 환경적 스트레스에 대한 저항성에도 긍정적인 영향을 미치는지 평가하기 위해 열 스트레스와 자외선 스트레스에 대한 반응을 분석하였다.
먼저 예쁜꼬마선충에 35℃의 열 스트레스를 가한 경우, 홍삼 추출물 처리 군 모두에서 음성 대조군에 비해 유의적인 생존율 증가를 보였다. 홍삼 추출물을 처리하지 않은 음성 대조군에서는 생존율이 50%까지 감소하는 데 걸리는 시간이 3.0 일임에 비해, 홍삼 추출물 원액, 1/10 배 희석, 1/100 배 희석, 1/1000 배 희석 그룹에서는 각각 4.4, 6.5, 10.3, 7.9 일로 유의적으로 증가하였다 (p < 0.05). 총 3 회의 반복 실험에 대한 평균값을 Fig. 2A에 나타내었다.
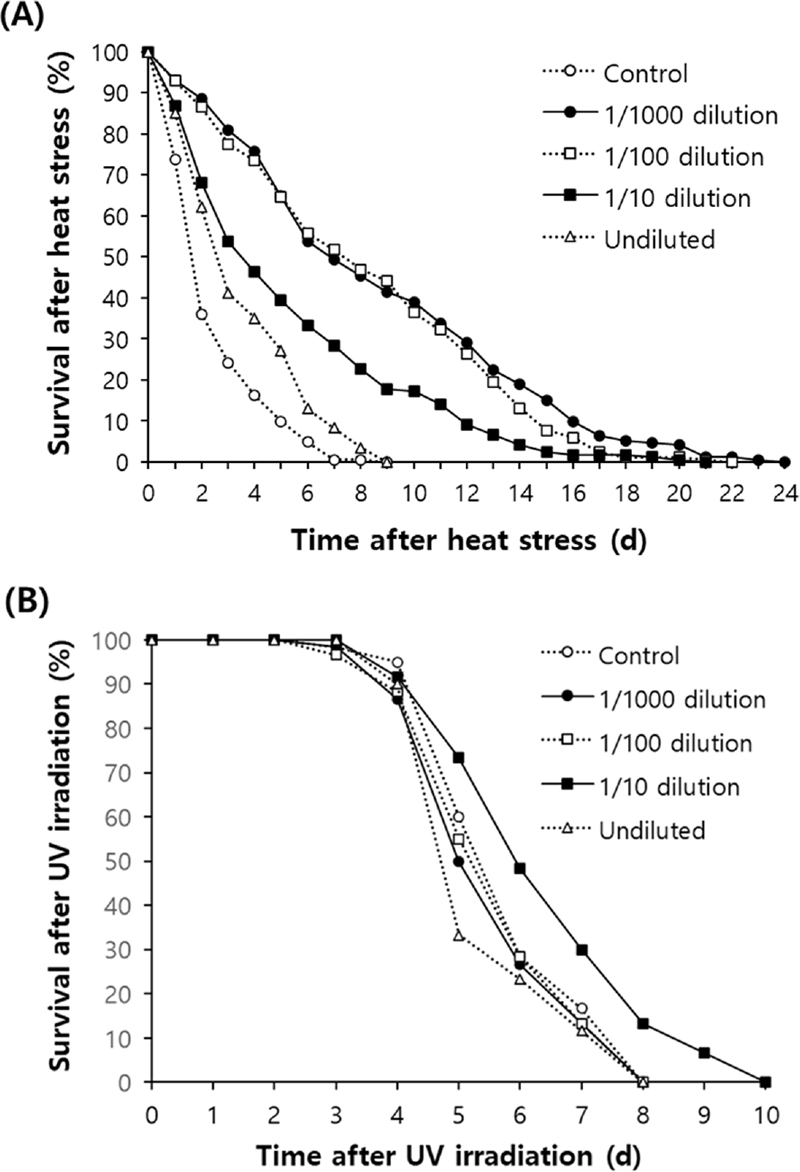
Increased resistance to environmental stresses by red ginseng extracts.(A) Effect of red ginseng extracts on heat stress was examined. Age-synchronized 3-day-old adult worms were treated with 100 ㎕ of each red ginseng extracts (undiluted, 1/10 dilution, 1/100 dilution, and 1/1000 dilution) for 24 h, then incubated at 35℃ for 8 h. The survival of worms was monitored daily after heat stress. (B) The same red ginseng extracts-treated adult worms were irradiated with 20 J/㎠/min of ultraviolet (UV) for 1 min, then survival of worms was recorded every day until all worms were dead.
자외선 조사 후, 개체의 생존율을 비교한 결과, 자외선 스트레스에 대한 저항성은 열 스트레스에 대한 저항성과는 달리 1/10 배 희석 홍삼 추출물을 처리한 그룹에서만 유의적인 증가를 보였다. 음성 대조군에서 6.0 일이었던 생존율 50%에 이르는 시간은 1/10 배 희석 홍삼 추출물 처리 그룹에서는 6.6 일로 증가하였다 (p = 0.049). 반면에 홍삼 추출물 원액, 1/100 배 희석, 1/1000 배 희석 그룹에서는 50%의 생존율에 이르는 시간이 각각 5.6 일 (p = 0.233), 5.8 일 (p = 0.648), 5.8 일 (p = 0.499)로 대조군과 차이를 보이지 못했다 (Fig. 2B).
3. 홍삼 추출물에 의한 예쁜꼬마선충의 수명변화
노화 이론 중 자유라디칼 이론은 시간이 지나면서 세포 내에 축적되는 자유라디칼에 의한 산화적 손상을 노화의 주원인으로 보고, 이를 막을 수 있는 항산화 물질의 중요성을 강조한다 (Harman, 1956).
홍삼 추출물의 활성 산소 제거능과 환경적 스트레스 저항성 증가 효능을 바탕으로 유의적인 항산화 효능을 보였던 희석액인 1/10 배 희석액과 1/100 배 희석액에 대해 홍삼 추출물이 개체의 수명에 미치는 영향을 평가하였다. 음성 대조군인 홍삼 추출물을 처리하지 않은 그룹의 평균 수명은 22.4 일로 나타난 반면, 1/10 배 희석 홍삼 추출물을 처리한 그룹에서는 평균 수명이 23.7 일로 유의적으로 증가하였다 (p = 0.016).
홍삼 추출물을 1/100 배 희석하여 처리한 그룹의 평균 수명은 22.1 일로 음성 대조군과 차이가 없었다 (p = 0.220).
최대 수명 또한 음성 대조군 (27 일)에 비해 홍삼 추출물 1/10 배 희석 그룹에서는 30 일로 증가하였고, 홍삼 추출물 1/100 배 희석 그룹에서는 27 일로 변화가 없었다 (Fig. 3).

Lifespan-extending effect of red ginseng in C. elegans.Sixty age-synchronized adult worms were randomly selected and treated with 1/10 or 1/100 dilution of red ginseng extracts (100 ㎕ of diluted red ginseng extracts on 5 ㎖ of NGM plates). Number of live/dead worms were counted every day until all worms were dead. Worms lost, killed, or internally hatched were excluded from analysis. Worms not responding to mechanical stimuli were regarded as dead.
총 3 회의 반복 실험에서도 모두 동일하게 1/10 배 희석 홍삼 추출물을 처리한 그룹에서 유의적인 수명 증가를 관찰할 수 있었다 (Table 1).
4. 개체의 번식력에 미치는 영향 평가
이전 연구를 통해 밝혀진 예쁜꼬마선충에서 수명을 연장시키는 것으로 알려진 유전자 조작이나 항산화 물질 처리 방법 중 많은 경우에서 수명 연장의 대가로 번식력의 감소가 관찰되었다 (Gruber et al., 2007; Hughes et al., 2007).
본 연구에서 관찰된 홍삼 추출물에 의한 수명 연장 역시 번식력의 감소를 동반하는지 알아보기 위해 예쁜꼬마선충의 자손 수를 비교 분석하였다. 홍삼 추출물을 처리하지 않은 음성대조군에서는 번식기 동안 부화된 총 자손 수는 276.8 ± 9.56이었다. 홍삼 추출물을 1/10 배, 1/100 배 희석하여 처리한 그룹의 경우, 총 자손 수가 각각 253.7 ± 11.30 (p = 0.133), 264.8 ± 9.04 (p = 0.372)으로 음성 대조군과 유의적인 차이가 없었다 (Fig. 4A).
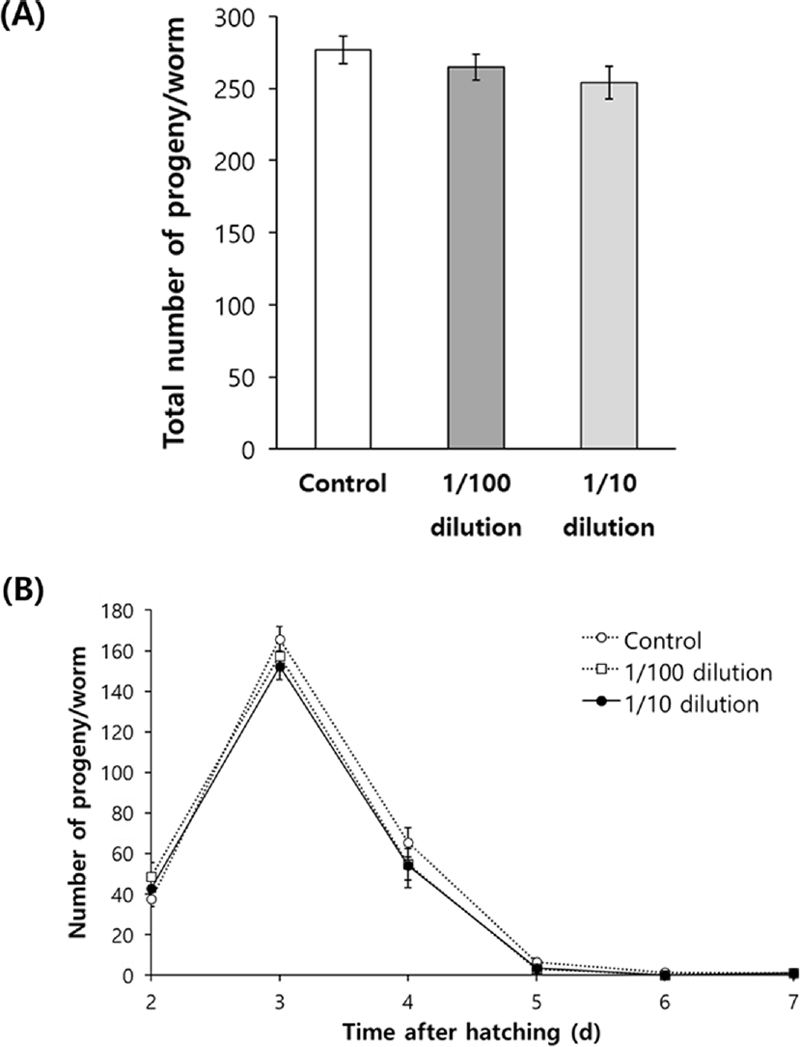
Effect of red ginseng extracts on fertility.Number of progeny produced during a gravid period produced was recorded. Worms were grown on 5 ㎖ NGM plate containing 100 ㎕ of each diluted red ginseng extracts. Number of progeny produced by each worm was counted during a gravid period. Total number of progeny (A) and daily distribution of progeny (B) were compared between untreated control and red ginseng extracts-treated groups. The experiment was repeated three times. The Error bar indicates standard error. For statistical analysis, the standard student t-test was employed.
번식기 동안의 날짜별 자손 수 분포 분석에서도 음성 대조군과 홍삼 추출물 1/10 배 희석, 1/100 배 희석 그룹 간의 자손 수의 날짜별 분포에 차이가 없었다 (Fig. 4B).
5. 파킨슨 질환 모델을 이용한 홍삼 추출물의 효능 평가
항산화, 수명 연장 효능을 보이는 물질들 중 많은 경우 노화 관련 질환에서도 유의미한 억제 효과를 보임이 보고되었다. 본 연구에서는 노화 관련 신경퇴행성 질환인 파킨슨 질환 모델을 활용하여 홍삼 추출물의 효과를 분석하였다.
6-OHDA 처리에 의해 음성 대조군에서 관찰되는 도파민 (dopamine) 분비 신경세포가 심각하게 손상됨을 관찰할 수 있었고, 파킨슨 질환 치료제로 사용되고 있는 레보도파 (levodopa)를 6-OHDA와 동시에 처리한 경우에는 도파민 (dopamine) 분비 신경세포의 손상이 억제되었다. 1/10 배 희석 홍삼 추출물의 경우도 6-OHDA에 의한 도파민 (dopamine) 분비 신경세포 손상을 유의적으로 억제하였다 (Fig. 5A).
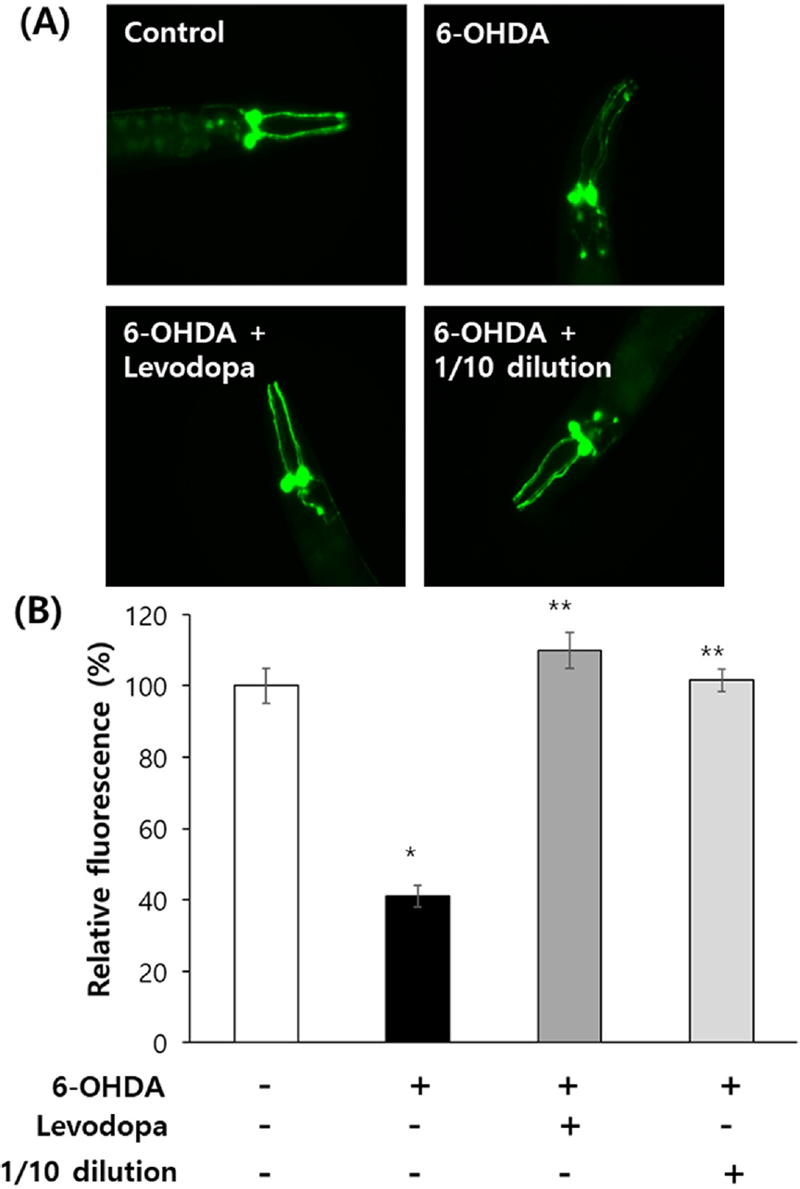
Inhibitory effect of red ginseng extracts on degeneration of dopaminergic neurons.(A) Fluorescent dopaminergic neurons in BZ555 untreated control and worms treated with 6-OHDA only, 6-OHDA/levodopa, and 6-OHDA/levodopa/red ginseng extracts were monitored using a fluorescence microscope. (B) Quantification of fluorescence of dopaminergic neurons was compared between untreated control and each experimental groups using Image-J program. Error bar indicates standard error. The experiment repeated three times. For statistical analysis, the standard student t-test was employed. Statistically significant difference compared to untreated control (*p < 0.05). Statistically significant difference compared to 6-OHDA-treated group (**p < 0.05).
도파민 분비 신경세포에 의해 관찰되는 형광도는 음성 대조군 (100.0 ± 4.97) 대비 6-OHDA 처리 군 (41.1 ± 2.99)에서 유의적으로 감소하였다 (p < 0.05). 6-OHDA에 의해 감소되는 형광도는 레보도파 또는 1/10 배 희석 홍삼 추출물을 함께 처리할 경우에는 음성 대조군 수준으로 회복되었다. 레보도파 동시 처리 군과 1/10 배 희석 홍삼 추출물 동시 처리 군의 상대적 형광도는 각각 109.9 ± 4.97과 101.5 ± 3.14로 나타났으며, 이는 6-OHDA 처리 군에 비해 유의적인 차이를 나타내었다 (p < 0.05, Fig. 5B).
파킨슨 질환의 원인 중 하나로 알려진 알파-시누클레인 (α-synuclein)의 축적에서도 홍삼 추출물이 유의적인 억제 효능을 보였다. 1/10 배 희석 홍삼 추출물을 처리한 동물에서 음성대조군에 비해 알파-시누클레인 (α-synuclein) 단백질의 현저한 감소가 관찰되었다 (Fig. 6A).
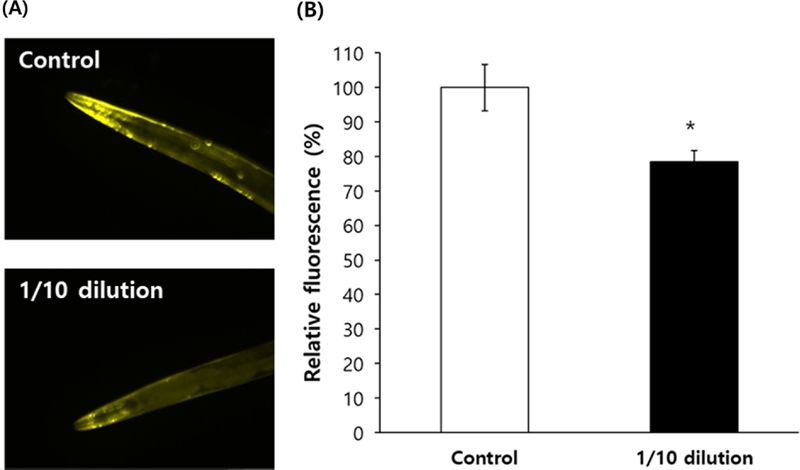
Decreased expression of alpha-synuclein by red ginseng extracts.(A) Protein level of alpha-synuclein was monitored under a fluorescence microscope using worms genetically modified to express fluorescent alpha-synuclein, NL5901. (B) Expression of alpha-synuclein in head region was quantitatively analyzed in untreated control and red ginseng extract-treated group using Image-J program. Error bar indicates standard error. The experiment repeated three times. For statistical analysis, the standard student t-test was employed. Statistically significant difference compared to untreated control (*p < 0.05).
알파-시누클레인 (α-synuclein)에 의한 형광도는 음성 대조군 (100.0 ± 6.69) 대비 1/10 배 희석 홍삼 추출물 처리 군에서 78.4 ± 3.24로 유의적으로 감소하였다 (p = 0.006, Fig. 6B).
고 찰
본 연구에서는 홍삼 추출물이 예쁜꼬마선충 모델에서 산화적 스트레스를 억제하고, 수명 연장 및 파킨슨병 모델에서 신경 보호 효과를 나타내는 것을 확인하였다.
DPPH 분석 및 산화적 스트레스 실험에서 유의미한 항산화 효능을 보였으며, 특히 1/10 배 희석 홍삼 추출물이 대조군과 비교해 높은 생존율과 항산화 효능을 나타냈다. 홍삼의 항산화 효능은 이전 연구에서도 입증된 바 있다. 구기자와 홍삼을 혼합한 추출물에서 활성산소종 소거능이 유의하게 증가하였으며 (Seong et al., 2018), 이러한 결과는 홍삼 추출물이 다른 소재의 추출물 또는 성분과 혼합하게 되면 항산화 효능이 증대될 수 있음을 시사한다.
더불어, 열과 자외선 등의 외부 자극에 대한 저항성 평가에서도 유의하게 저항성이 증가하였다. 이는 홍삼 추출물이 단순히 산화 스트레스를 줄이는 것뿐만 아니라, 환경적 스트레스 요인에 의한 세포 손상을 완화하는데도 기여할 수 있음을 입증한다.
1/10 배 희석 홍삼 추출물은 예쁜꼬마선충의 평균 수명과 최대 수명을 유의미하게 연장시켰다. 이러한 결과는 활성산소종의 축적을 효과적으로 억제함으로써 노화 과정을 지연시킨다는 점에서 의미가 크다.
일반적으로, 예쁜꼬마선충에서 수명 연장 효과를 나타내는 물질들은 번식력 감소와 같은 부작용을 동반하는 경우가 많다고 많은 연구를 통해 보고되었다. 셀레노시스테인 (selenocysteine) 섭취는 예쁜꼬마선충의 산화적 스트레스 저항성과 수명을 유의적으로 증가시켰으나, 자손 수의 감소를 유발하였으며, 식물 유래 파이토케미컬인 피세틴 (fisetin)과 뷰테인 (butein)은 수명 연장의 부작용으로 번식력 감소를 수반하였다 (Kim et al., 2017; Park et al., 2022; Kim et al., 2024).
이와 달리, 홍삼 추출물은 번식력 감소의 부작용 없이 수명을 연장하였다. 이는 홍삼 추출물의 생리적 안정성을 입증하는 결과이다. 이전 연구에 의하면 메밀 추출물도 개체의 생식능력 저하 없이 수명을 연장시켰으며, 갈색거저리 추출물의 경우에는 오히려 수명과 번식력을 모두 증가시키는 효과를 유도하였다 (Kim and Park, 2013; Won et al., 2016). 따라서 항산화 물질에 의한 수명과 번식력 변화의 상관관계는 각 물질 고유의 특성에 따라 결정된다고 판단된다.
파킨슨병 질환 모델을 활용한 연구 결과, 1/10 배 희석 홍삼 추출물은 신경 보호 효과를 나타냈다. 파킨슨병의 주요 병리학적 기전인 도파민 (dopamine) 분비 신경세포의 손상과 알파-시누클레인 (α-synuclein)의 비정상적인 축적은 파킨슨병 진행에 중요한 역할을 한다고 알려져 있다. 알파-시누클레인 (α-synuclein)은 파킨슨병에서 신경독성을 유발하는 주요 단백질로, 신경세포 내부에 루이체라는 독성 덩어리를 형성하며 신경 퇴행을 촉진한다 (Du et al., 2020).
본 연구에서는 홍삼 추출물 처리에 의해 알파-시누클레인 (α-synuclein)의 축적이 유의하게 억제되는 결과가 나타났으며, 이는 홍삼 추출물이 파킨슨병의 병리학적 특징을 직접적으로 차단할 수 있음을 시사한다. 또한 6-OHDA 처리로 손상된 도파민 (dopamine) 분비 신경세포는 홍삼 추출물 처리 후 대조군과 유사한 수준으로 회복되었으며, 파킨슨병 질환 치료제로 사용되고 있는 레보도파와 비슷한 효과를 나타내었다. 이러한 사실은 홍삼 추출물이 신경 퇴행성 질환에서 레보도파와 유사한 치료제로서 가능성을 제시하는 중요한 발견이다.
나아가, 홍삼 추출물의 효과는 노화와 함께 발생하는 다양한 장기 기능 저하와 대사 이상에도 적용될 가능성이 높다. 실제로, 이전 연구에서 홍삼 비사포닌 분획이 다이옥신 유도독성 모델에서 간 및 신장 기능 저하, 생식 기능 약화, 당뇨 고지혈증 등 병리적 변화를 억제한 바 있다 (Kwak et al., 2021). 이는 홍삼이 신경 보호 외에도, 다양한 노화 관련 질환의 예방에도 유용할 수 있음을 시사한다.
기존의 홍삼 추출물에 대한 연구들과 비교하여 본 연구의 결과는 홍삼 추출물이 단순한 항산화 효과를 넘어 수명 연장과 신경세포 보호까지 포함하는 광범위한 효능을 보인다는 점에서 차별성을 가진다.
향후 연구에서는 홍삼 추출물의 수명 연장 및 신경 보호 효과를 더 깊이 이해하기 위한 다양한 메커니즘 분석이 필요하다. 특히, 홍삼의 다양한 활성 성분들이 각각 어떤 방식으로 이러한 효과를 발휘하는지에 대한 구체적인 규명이 필요하다. 추가로, 노화로 인해 일어나는 다양한 병리적 변화를 억제할 수 있는지에 대한 연구 또한 필수적이다.
본 연구의 결과는 신경 퇴행성 질환뿐만 아니라 노화 관련 질환의 치료 및 예방에 홍삼을 기반으로 한 천연물 치료제 개발에 중요한 기초 자료가 될 수 있을 것이다.
Acknowledgments
본 연구는 교육부 주관하는 산학협력고도화지원(과제번호: 1345376881)과 순천향대학교의 연구비 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Carr AC and Maggini S. (2017). Vitamin C and immune function. Nutrients. 9:1-25.
[https://doi.org/10.3390/nu9111211]

-
Du X, Xie X and Liu R. (2020). The role of α-synuclein oligomers in parkinson’s disease. International Journal of Molecular Sciences. 21:1-17.
[https://doi.org/10.3390/ijms21228645]

-
Finkel T. (2011). Signal transduction by reactive oxygen species. Journal of Cell Biology. 194:7-15.
[https://doi.org/10.1083/jcb.201102095]

-
Golden TR, Hinerfeld DA and Melov S. (2002). Oxidative stress and aging: beyond correlation. Aging Cell. 1:117-123.
[https://doi.org/10.1046/j.1474-9728.2002.00015.x]

-
Gong L, Yin J, Zhang Y. Huang R, Lou Y, Jiang H, Sun L, Jia J and Zeng X. (2022). Neuroprotective mechanisms of ginsenoside Rb1 in central nervous system diseases. Frontiers in Pharmacology. 13:1-25.
[https://doi.org/10.3389/fphar.2022.914352]

-
Gruber J, Tang SY and Halliwell B. (2007). Evidence for a trade-off between survival and fitness caused by resveratrol treatment of Caenorhabditis elegans. Annals of the New York Academy of Sciences. 1100:530-542.
[https://doi.org/10.1196/annals.1395.059]

-
Guo Y, Yang TL, Liu YZ, Shen H, Lei SF, Yu N, Chen J, Xu T, Cheng Y, Tian Q, Yu P and Deng HW. (2011). Mitochondria-wide association study of common variants in osteoporosis. Annals of Human Genetics. 75:569–574.
[https://doi.org/10.1111/j.1469-1809.2011.00663.x]

-
Harman D. (1956). Aging: A theory based on free radical and radiation chemistry. Journal of Gerontology. 11:298-300.
[https://doi.org/10.1093/geronj/11.3.298]

-
Hong CE and Lyu SY. (2011). Anti-inflammatory and anti-oxidative effects of Korean red ginseng extract in human keratocytes. Immune Network. 11:42-49.
[https://doi.org/10.4110/in.2011.11.1.42]

-
Hughes SE, Evason K, Xiong C and Kornfeld K. (2007). Genetic and pharmacological factors that influence reproductive aging in nematodes. PLOS Genetics. 3:e25. https://journals.plos.org/plosgenetics/article?id=10.1371/journal.pgen.0030025, (cited by 2007 February 16).
[https://doi.org/10.1371/journal.pgen.0030025]

-
Kim CK and Park SK. (2013). Buckwheat extract increases resistance to oxidative stress and lifespan in Caenorhabditis elegans. Korean Journal of Medicinal Crop Science. 21:1-6.
[https://doi.org/10.7783/KJMCS.2013.21.1.1]

-
Kim JS, Kim SH and Park SK. (2017). Selenocysteine modulates resistance to environmental stress and confers anti-aging effects in C. elegans. Clinics. 72:491-498.
[https://doi.org/10.6061/clinics/2017(08)07]

-
Kim SA, Yoon HM and Park SK. (2024). Butein increases resistance to oxidative stress and lifespan with positive effects on the risk of age-related diseases in Caenorhabditis elegans. Antioxidants. 13:155. https://www.mdpi.com/2076-3921/13/2/155, (cited by 2024 January 26).
[https://doi.org/10.3390/antiox13020155]

-
Kwak YS, Kyung JS and Jung MG. (2021). Protective effect of red ginseng non-saponin fraction on toxicity induced by 2,3,7,8-Tetrachlorodibenzo-ρ-dioxin in rats. Korean Journal of Medicinal Crop Science. 29:201-209.
[https://doi.org/10.7783/KJMCS.2021.29.3.201]

-
Lane RK, Hilsabeck T and Rea SL. (2015). The role of mitochondrial dysfunction in age-related diseases. Biochimica et Biophysica Acta. 1847:1387-1400.
[https://doi.org/10.1016/j.bbabio.2015.05.021]

-
Liguori I, Russo G, Curcio F, Bulli G, Aran L, Della-Morte D, Gargiulo G, Testa G, Cacciatore F, Bonaduce D and Abete P. (2018). Oxidative stress, aging, and diseases. Clinical Interventions in Aging. 13:757-772.
[https://doi.org/10.2147/CIA.S158513]

-
Li X, Huang L, Kong L, Su Y, Zhou H, Ji P, Sun R, Wang C, Li W and Li W. (2023). Ginsenoside Rg1 alleviates learning and memory impairments and Aβ disposition through inhibiting NLRP1 inflammasome and autophagy dysfunction in APP/PS1 mice. Molecular Medicine Reports. 27:6. https://www.spandidos-publications.com/mmr/27/1/6, (cited by 2022 November 9).
[https://doi.org/10.3892/mmr.2022.12893]

-
Lopez-Otin C, Blasco MA, Partridge L, Serrano M and Kroemer G. (2013). The hallmarks of aging. Cell. 153:1194-1217.
[https://doi.org/10.1016/j.cell.2013.05.039]

-
Nyarko K. (2024). Investigating the antioxidant properties of Quercetin. In Qsredkar J. (ed)., Quercetin - Effects on human health. Intechopen. London, England. p.89-103.
[https://doi.org/10.5772/intechopen.1004648]

-
Oh SI, Park JK and Park SK. (2015). Lifespan extension and increased resistance to environmental stressors by N-acetyl-L-cysteine in Caenorhabditis elegans. Clinics. 70:380-386.
[https://doi.org/10.6061/clinics/2015(05)13]

-
Oh SI and Park SK. (2017). N-acetyl-L-cysteine mimics the effect of dietary restriction on lifespan and reduces amyloid beta-induced toxicity in Caenorhabditis elegans. Food Science and Biotechnology. 26:783-790.
[https://doi.org/10.1007/s10068-017-0079-1]

-
Park SH, Kim BK and Park SK. (2022). Effects of fisetin, a plant-derived flavonoid, on response to oxidative stress, aging, and age-related diseases in Caenorhabditis elegans. Pharmaceuticals. 15:1528. https://www.mdpi.com/1424-8247/15/12/1528, (cited by 2022 December 8).
[https://doi.org/10.3390/ph15121528]

-
Peto R and Peto J. (1972). Asymptotically efficient rank invariant test procedures. Journal of the Royal Statistical Society. Series A (General). 135:185-207.
[https://doi.org/10.2307/2344317]

-
Ristow M and Schmeisser S. (2011). Extending life span by increasing oxidative stress. Free Radical Biology and Medicine. 51:327-336.
[https://doi.org/10.1016/j.freeradbiomed.2011.05.010]

-
Santos DF, Simão S, Nóbrega C, Bragança J, Castelo-Branco P and Araújo IM. (2024). Oxidative stress and aging: synergies for age related diseases. FEBS Letters. 598:2074-2091.
[https://doi.org/10.1002/1873-3468.14995]

-
Schieber M and Chandel NS. (2014). ROS function in redox signaling and oxidative stress. Current Biology. 24:453-462.
[https://doi.org/10.1016/j.cub.2014.03.034]

-
Seong BJ, Kim SI, Ji MG, Kim SD, Kwon AR, Kim HH, Won JY and Lee KS. (2018). Antioxidant activity and angiotensin converting enzyme by Lycii fructus extracts prepared by adding white ginseng and red ginseng. Korean Journal of Medicinal Crop Science. 26:370-381.
[https://doi.org/10.7783/KJMCS.2018.26.5.370]

-
Varanasi SS, Francis RM, Berger CE, Papiha SS and Datta HK. (1999) Mitochondrial DNA Deletion Associated Oxidative Stress and Severe Male Osteoporosis. Osteoporosis International. 10:143-149.
[https://doi.org/10.1007/s001980050209]

-
Won SM, Cha HU, Yi SS, Kim SJ and Park SK. (2016). Tenebrio molitor extracts modulate the response to environmental stressors and extend lifespan in Caenorhabditis elegans. Journal of Medicinal Food. 19:938-944.
[https://doi.org/10.1089/jmf.2016.3729]

-
Xia J, Ma S, Zhu X, Chen C, Zhang R, Cao Z, Chen X, Zhang L, Zhu Y, Zhang S, Li S, Gu G, Wei X, Yu K and Wang J. (2022). Versatile ginsenoside Rg3 liposomes inhibit tumor metastasis by capturing circulating tumor cells and destroying metastatic niches. Science Advances. 8:eabj1262. https://www.science.org/doi/10.1126/sciadv.abj1262, (cited by 2022 February 11).
[https://doi.org/10.1126/sciadv.abj1262]

