
석산 물 추출물의 급성독성 및 변이원성 평가
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Lycoris radiata has various bioactive properties. However, some alkaloids exhibit neurotoxic and cytotoxic effects, and pose potential risks. These toxic compounds can have harmful effects on the body when consumed in excessive amounts, and may induce genetic mutations through cytotoxicity. Therefore, this study was conducted to determine whether the water extract of L. radiata exhibits acute toxicity and mutagenic effects.
In an acute toxicity test conducted at a maximum concentration of 2,000 ㎎/㎏, no signs of morbidity or death, and no clinical symptoms were observed. Furthermore, a bacterial reverse mutation test was performed with a maximum dose of 5,000 ㎍/plate, resulting in negative outcomes for all strains.
The approximate lethal dose could not be determined, and there was no indication of mutagenicity. The lethal dose is estimated to be ≥ 2,000 ㎎/㎏, and mutagenicity does not appear to occur up to 5,000 ㎍/plate. Further experiments involving increased concentrations or changes in extraction solvents and methods are required to better understand the toxic response.
Keywords:
Lycoris radiata, Acute Toxicity, Mutagenicity, Medicinal Crop서 언
석산은 (Lycoris radiata) 백합목 수선화과에 속하는 식물로 꽃무릇이라고도 부른다. 중국, 일본, 한국을 비롯해 동남아 등지에 자생하며 비늘줄기 형태의 알뿌리를 약재로 사용한다. 상처가 부은 것을 가라앉히고 [소종 (消腫)], 가래를 없애거나 [거담 (祛痰)], 체했을 때 구토를 야기하는 데 [최토 (催吐)] 사용되어 왔으며 (Jeong, 2016), 중국에서는 종기, 궤양, 고름이 나는 상처를 치료하기 위한 전통 약재로 사용되어 왔다.
수선화과 식물이 가진 알칼로이드는 약리학적 효과 때문에 상업적 가치가 높아 물, alcohol, methanol chloroform, ethyl acetate 등의 용매를 통해 분리 및 정제되어 (He et al., 2015; Duan et al., 2016; Takla et al., 2018; Soto-Vásquez et al., 2022) 유효성, 종자발아 특성, 분류학적 특성 등 다양한 분야에서 연구되고 있다 (Tae and Ko, 1995; Park and Chung, 1996a, 1996b; Tae and Ko, 1997).
대표적으로 알칼로이드인 lycorine, tazettine 등이 다양한 수선화과 식물에 포함되어 있고, 석산에서 narciclasine, hippeastrine 및 lycorine 등이 분리된다고 보고되어 있다 (Nair et al., 2013; Nair and Staden, 2014; Chen et al., 2016; Shen et al., 2019).
Lycorine은 바이러스의 중합효소 활성을 억제하고 단백질 합성 과정에서 단백질의 신장을 방해함으로써 항바이러스 효과를 가진다. 또한 lycorine의 전구체인 norbelladine은 염증을 유발하는 단백질인 nuclear factor kappa B과 염증 관련 효소인 cyclooxygenase의 발현을 억제함으로써 항염증 효과를 가진다고 알려져 있다 (Bastida et al., 2006; Matsuura and Felt-Neto, 2015; Ji et al., 2017; Cahlikova et al., 2020). Galanthamine은 기억, 인지기능에 중요한 역할을 하는 신경전달물질인 acetylcholine을 분해하는 acetylcholinesterase 물질을 억제하며 이를 이용해 치매와 같은 기억 장애를 치료하는데 사용되고 있다 (Cahlikova et al., 2020).
이 외에도 석산의 구근 에탄올 추출물은 항말라리아 효과를 가지며, 메탄올 추출물은 염증반응으로 생성된 nitric oxide (NO)와 tumor necrosis factor-α (TNF-α)를 현저히 감소시킬뿐만 아니라 높은 항산화 효과를 가진다는 연구 결과가 알려져 있다 (Kim et al., 2011; Hao et al., 2013).
수선화에 포함되어 있는 다양한 알칼로이드는 구토, 설사 메스꺼움과 같은 부작용이 관련되어 있을 뿐만 아니라 여러 암세포에서 세포독성 활성을 가지며, 석산에서 분리된 hippeastrine과 narciclasine은 topoisomerase I 억제제로 DNA 합성을 억제해 암세포에 대한 세포독성을 유발한다 (Weniger et al., 1995; Kretzing et al., 2011; Chen et al., 2016; Wang et al., 2023).
Acetylcholinesterase 억제제인 lycorine은 석산의 잎과 비늘줄기에 주로 분포하고 있는 알칼로이드로 석산의 잎을 이용한 물 추출에 의해 분리된다고 알려져 있으며, 일부 식물에 대한 타감작용을 가지고 구토, 메스꺼움 등과 같은 부작용을 일으킨다 (Iqbal et al., 2006; Mcnulty et al., 2010; Kretzing et al., 2011). acetylcholinesterase 억제제는 주로 위장관, 심혈관 및 신경계에 부작용을 일으킨다고 알려져 있다 (Ruangritchankul et al., 2021).
DNA 손상 유도법은 암세포의 증식 억제를 통해 암을 치료 하지만 대부분 세포에 같은 영향을 미치기 때문에 정상세포의 세포독성과 유전자 돌연변이를 유발다고 알려져 있다 (Hashimoto et al., 1995; Shen et al., 2019; Kuijk et al., 2022). 따라서 다양한 알칼로이드를 함유하고 있는 수선화과의 석산은 급성독성, 세포독성과 유전자 돌연변이를 유발할 수 있는 잠재적 위험성을 가지고 있다.
본 연구는 잠재적 위험성을 가지는 알칼로이드가 포함된 석산 물 추출물이 급성독성과 유전자 변이원성을 유발하는지 평가하고 안전성을 검증하여 향후 석산을 활용한 식품, 의약품, 건강기능식품 등의 기초자료를 제공하기 위해 수행했다.
재료 및 방법
1. 시료 제작
본 시험에서 사용한 시료는 영광군 농업기술센터에서 제공 받은 석산 (원산지 : 전라남도 영광) 1.7 ㎏을 원료로 제작하였다. 석산을 균질하게 세절하여 부직포에 넣고 10 ℓ의 정제수를 첨가한 후 환류추출기 (COSMOS 660, Kyungseo E&P, Incheon, Korea)를 이용하여 105℃, 3 시간의 조건으로 3 회 반복 추출하였다.
추출 후 대형 회전감압농축기 (NVC-2200, Eyela, Tokyo, Japan)를 이용하여 55℃에서 30 hPa로 농축하여 10 brix 내외의 표준 추출물을 제작하였다. 표준 추출물을 초저온냉동고 (TSE600D, Thermo scientific, Waltham, MA, USA)에 넣어 –70℃ 조건으로 동결시킨 뒤 동결건조기 (LYOPH-PRIDE 20R, IlShin Lab Co., Ltd., Dongducheon, Korea)를 이용하여 112 시간 동안 동결건조 시켰다. 동결 건조물 543 g (수율 : 31.9%)을 획득하였고 이를 석산 물추출물로 정의하였으며 용량별로 멸균수에 녹여 급성 독성 평가와 변이원성 평가에 사용했다.
2. 급성독성 평가
실험동물은 7 주령의 Sprague-dawley (SD) rat 암, 수 각각 20 마리를 오리엔트 바이오 (Seongnam, Korea)에서 구입하여 사용하였다. 입수 시 7 주령 rat의 평균 체중의 경우 암컷은 161 g – 183 g, 수컷은 229 g – 261 g의 범위로 10% 이내의 표준편차로 체중을 확인 후 1 주일 간 순화 과정을 거치고 일반 증상과 체중 변화에 이상이 없는 동물을 실험에 사용하였다.
실험동물에 대한 사육환경은 온도를 21.0℃ - 24.2℃, 습도 47.0% - 73.0%, 환기횟수 15 회 – 20 회/시간, 명암주기 12 시간, 조도 150 lux - 300 lux, 소음 60 dB 이하, 암모니아 농도는 20 ppm 이하가 되도록 유지하였다. 음수는 역삼투압 처리 후 자외선으로 소독한 정제수를, 사료는 pellet형 고형사료 (PMI LabDiet 5053, PMI Nutrition International, St Louis, MO, USA)를 자유섭취 시켰다.
실험동물은 음성대조군, 저용량군, 중용량군, 고용량군으로 나누어 그룹당 암/수 각각 5 마리 씩 배정했다. 석산 물추출물의 투여량은 Organisation for Economic Cooperation and Development (OECD) 가이드 라인과 여러 급성독성시험 연구를 참고해 500 (저용량군), 1,000 (중용량군), 2,000 ㎎/㎏ (고용량군)으로 설정하였다 (OECD, 2001; Kim, 2014; Cho et al., 2024; Jo et al., 2024). 투여액량은 10 ㎖/㎏으로 절식 후 투여 당일 체중을 기준으로 투여하였다.
투여 직후, 투여 후 0.5, 1, 2 및 4 시간에 일반 증상을 관찰하고 그 후 14 일 동안 1 일, 1 회의 빈도로 실험동물의 빈사, 사망 등을 포함한 일반 증상을 관찰하였다. 일반 증상 관찰 항목은 실험동물의 체위, 자세, 의식, 태도, 신경계, 호흡, 행동, 피모, 피부, 눈 등을 관찰하였으며 (Fentener van Vlissing et al., 2015), 체중은 투여 당일, 투여 후 1, 3, 7 및 14 일에 각각 측정하였다. 실험 종료 후 부검을 통해 고환, 난소, 신장, 비장, 간, 흉선, 심장, 폐 등을 육안 검사 하였다.
본 실험은 한약비임상시험센터 동물윤리위원회 (IACUC) 심의 및 승인 (동물실험 승인번호:NIKOM-2020-014)을 받아 수행하였다. 시험방법은 “의약품 등의 독성시험기준, 식품의약품안전처 고시 제2022-18호”를 참고하여 수행하였다.
3. 혈구 분석
급성독성 평가 수행 중 채취한 혈액 중 일부를 BD vacutainer glass blood collection tube with K3 EDTA (Thermo fisher scientific, Waltham, MA, USA)에 담아 RBC (red blood cell), HGB (hemoglobin), HCT (hematocrit), MCV (mean corpuscular volume), MCH (mean corpuscular hemoglobin), MCHC (mean corpuscular hemoglobin concentration), PLT (platelet), RET, WBC (white blood cell), NEU (neutrophil), LYM (lymphocyte), MONO (monocyte), EOS (eosinophil), BASO (basophil)를 IDEXX Procyte DX gematology analyzer (IDEXX, Westbrook, ME, USA)를 사용하여 분석하였다.
4. 혈액 생화학적 분석
급성독성 평가 수행 중 채취한 혈청 중 일부를 생화학 분석기 (AU480, Beckman coulter Inc., Brea, CA, USA)를 이용하여 AST (aspartate aminotransferase), ALT (alanine aminotransferase), ALP (alkaline phosphatase), GGT (gammaglutamyl trasferase), T_BIL (total bilirubin), T_CHO (total cholesterol), TG (triglyceride), BUN (blood urea nitrogen), CREA (creatinine), TP (total protein), ALB (albumin), IP (inorganic phosphorus), Ca (calcium), A_G (albumin/globulin ratio)를 측정하였다.
5. 변이원성 평가
균주는 히스티딘 요구성 균주인 Salmonella typhimurium TA98 (Lot No. 5508D, Moltox, Boone, NC, USA), TA100 (Lot No. 5506D, Moltox, Boone, NC, USA), TA1535 (Lot No. 5504D, Moltox, Boone, NC, USA), 및 TA1537 (Lot No. 5503D, Moltox, Boone, NC, USA)과 트립토판 요구성 균주인 Escherichia coli WP2 uvrA (Lot No. 5473D, Moltox, Boone, NC, USA)를 사용하였다.
대사 활성계는 랫드 간 분획물인 S9을 사용하였다. S9 (Lot No. 4230, Moltox, Boone, NC, USA)에 Cofactor (Lot No. 999901, Oriental Yeast Co., Ltd., Tokyo, Japan)를 첨가해 제조사의 프로토콜에 따라 S9의 최종농도가 5%가 되도록 조제 후 사용하였다.
음성 대조물질은 시험 물질 부형제인 멸균수를 사용하고 양성 대조물질은 sodium azide (SA), 2-nitrofluorene (2-NF), 2-aminoanthracene (2-AA), 9-aminoacridine (9-AA), benzo[a] pyrene (B[a]p), 4-nitroquinoline 1-oxide (4-NQO)를 사용하였다. 석산 물 추출물의 처리 농도는 6 단계 농도군 (4.88, 19.5, 78.1, 313, 1,250 및 5,000 ㎍/plate)으로 분류하였다.
처리 방법은 농도별 석산 물 추출물 100 ㎕와 대사 활성계의 유무에 따라 대사 활성계 적용 시 S9 mix 500 ㎕, 대사활성계 미적용 시 인산완충액 (pH 7.4) 500 ㎕를 혼합하고 균주 배양액 100 ㎕ 를 처리하였다. 처리 후 37℃ 진탕배양기에 20 분간 전배양 하였다 (Tejs, 2008).
전배양 종료 후 TA98, TA100, TA1535 및 TA1537 균주에는 히스티딘이 포함된 top agar 2 ㎖를, WP2 uvrA는 트립토판이 포함된 top agar 2 ㎖를 섞어 minimal glucose agar plate (21-40S21, Moltox, Boone, NC, USA)에 중층한 다음 37℃에서 48 시간 동안 배양하였다. 기본성장균층 (background lawn)의 이상 유무 및 물질의 침전 여부는 현미경 (E-200, Nikon, Tokyo, Japan)을 이용하여 관찰하였고, 복귀돌연변이수 (Colony)는 육안 계수하였다.
양성판정은 대사 활성계 유, 무와 관계없이 TA98, TA100 또는 WP2 uvrA 균주에서 음성 대조군에 비해 2 배 이상, TA1535 또는 TA1537 균주에서 3 배 이상 복귀돌연변이 수가 증가할 때 양성으로 판정하였다 (Levy, et al., 2019). 시험방법은 OECD 가이드라인 TG471, 식품의약품안전처 ‘의약품 등의 독성시험기준 (고시 제2022-18호) 및 Ames 시험법 (Maron and Ames, 1983)을 참고하여 수행하였다.
6. 통계처리
동물의 체중, 혈구 및 혈액 생화학 데이터는 평균 ± 표준편차 (means ± standard deviation)으로 표시하였으며 SPSS 통계프로그램 (Statistical Package for the Social Science, ver 25, IBM Corp., Armonk, NY, USA)을 이용해 one-way analysis of variance (ANOVA)를 실시한 뒤 Duncan’s Mutiple Range Test (DMRT)로 사후 검증 후 군간 유의성을 5% 수준에서 검증하였다 (p < 0.05).
결과 및 고찰
1. 급성독성 평가
랫드에 석산 물 추출물을 단회 경구투여 후 일반 증상을 관찰한 결과 시험 기간 동안 암/수 모두 독성 징후나 사망 개체가 발생하지 않았다. 시험 종료일에 체중을 측정한 결과 음성대조군, 석산 물 추출물 500 ㎎/㎏, 1,000 ㎎/㎏, 2,000 ㎎/㎏ 순으로 각각 수컷은 397.1 ± 25.8 g, 384.7 ± 38.7 g, 375.7 ± 13.4 g, 362.2 ± 55.0 g이며, 암컷은 240.9 ± 10.2 g, 241.9 ± 9.0 g, 242.8 ± 14.3 g, 240.5 ± 7.6 g으로 측정되었다 (Table 1).

Summary of Body weights(g) changes over 14 days after oral administration of water extract from Lycoris radiata.
독성시험 기준에서 시험 물질을 실험동물에 투여하였을 때 일정 기간 내에 대조군에 비하여 10% 이내의 체중 증감을 나타나거나 인도적인 안락사가 필요하지 않는 독성반응이 관찰되는 용량을 최대내성용량 (maximum tolerated dose)으로 정의하고, 이러한 최대내성용량은 임상시험의 목적 중 하나인 안전성을 평가하는데 중요한 기초 자료로 사용된다 (Van et al., 2022).
석산 물 추출물군과 대조군의 체중을 확인한 결과, 체중의 증감이 10% 이내로 나타냈으며 독성반응도 관찰되지 않았다. 이러한 결과로 석산 물 추출물의 최대내성용량은 2,000 ㎎/㎏ 이상으로 나타날 것이라는 것을 예상할 수 있었다. 독성시험에서 동물을 이용할 경우 최고농도는 각국의 법률이나 가이드라인을 통해 지침을 제공하고 있다. OECD에서는 화학물질의 독성 평가를 위한 표준 시험 방법을 제시하고 있으며, 이 가이드라인에서는 최고농도를 2,000 ㎎/㎏으로 제시하고 있다. 이는 동물 복지차원에서의 권고사항이며 타당한 이유가 있을 경우 예외적으로 2,000 ㎎/㎏ 이상의 농도에서의 시험을 허용하고 있다. 또한 OECD의 급성독성 분류에 따르면 반수치사량이 2,000 ㎎/㎏ 이상인 경우 안전한 물질로 분류하고 있다. 본 시험에서는 2,000 ㎎/㎏의 농도까지 독성반응이 관찰되지 않아 반수치사량과 최대내성용량의 수치를 구체적으로 제시하는 것에는 한계가 있으나 최대내성용량과 반수치사량이 2,000 ㎎/㎏ 이상이라는 예상을 통해 비교적 안전한 물질이라고 판단되었다.
안락사 후 부검을 통해 장기 조직의 크기, 위치, 색, 모양 등 관찰한 결과, 암컷의 장기 조직에 병변은 관찰되지 않았다. 다만, 수컷의 경우 석산 물 추출물 2,000 ㎎/㎏ 투여군에서 개체군 다섯 마리 중 한 마리의 고환과 부고환이 위축된 것을 확인하였다 (Table 2).
랫드는 노화에 의해 고환 내에 배아 상피의 위축과 염증성 병변이 흔하게 발견될 수 있으며 (James and Heywood, 1979), 랫드의 고환 위축은 10% 비율로 발생될 수 있는 것으로 알려져 있다 (Lee et al., 1993).
본 실험의 고환과 부고환의 위축은 자연 발생률로 생길 수 있으며, 통계학적 유의성이 없다는 점 (p = 0.5)에서 석산 물 추출물 2,000 ㎎/㎏ 투여군은 고환 위축에 영향을 주지 않는 것으로 생각된다.
급성독성 평가 결과 2,000 ㎎/㎏까지 안전한 것으로 보이며, 사망 개체가 발생하지 않았기 때문에 반수 치사량 (lethal dose 50, LD50)은 2,000 ㎎/㎏ 이상일 것으로 판단되었다.
2. 혈액 생화학적 분석
혈액 생화학적 분석은 혈청에 포함되어 있는 효소, 단백질, 전해질 및 다른 화학성분의 체내 변화 상태를 분석하는 방법으로 각 장기의 기능 및 대사 상태에 대한 정보를 제공한다. 부검 후 채취한 혈액의 혈청을 분석한 결과 GGT 수치가 수컷 500, 1,000, 2,000 ㎎/㎏, 암컷 2,000 ㎎/㎏ 투여군에서 음성 대조군과 비교하여 유의적인 차이를 보였다 (p < 0.05).
GGT는 일반적으로 간, 신장 및 췌장에 분포하고 질병 방어 기능을 하여 간질환의 지표로 널리 사용된다. 일반적으로 간질환을 판단하기 위해 ALP, AST, ALT 수치와 병행하여 판단한다 (Kim, 2009; Vroon and Israili, 1990).
GGT 수치의 유의적인 변화로 간질환을 판단하기 위해 ALP, AST, ALT 수치를 대조군과 비교한 결과 유의적인 차이가 나타나지 않았다. 또한 GGT 수치가 정상 범위 이내인 것을 확인하였다 (Petterino and Argentino-Storino, 2006). 따라서 GGT 수치 변화는 정상적인 범위 이내의 변화이며 석산물 추출물의 영향으로 보기 어렵다고 판단된다 (Table 3).
3. 혈구 분석
혈구 분석은 혈액 세포에 대한 정보를 제공하고 적혈구 수치 분석을 통한 산소 운반 능력 식별, 백혈구 수치를 통한 면역 체계에 대한 정보를 제공한다. 또한 빈혈, 특정 암, 감염, 급성 출혈, 알레르기 및 면역 결핍을 진단하는 데 유용하다 (George and Parker, 2003).
부검 후 채취한 혈액의 혈구분석 결과, 암컷 2,000 ㎎/㎏ 투여군에서 PLT의 수치가 유의적인 차이를 보였다 (p < 0.05). PLT 수치의 변화는 골수 생산 감소, 다양한 후천성 질환, 약물, 감염 등 다양한 요인에 영향을 받는다 (Stiff et al., 1990). 다만 본 시험의 PLT 수치는 보고된 정상 범위 이내에 수치로 (Petterino and Argentino-Storino, 2006), 석산 물 추출물의 영향으로 보기 어렵다고 판단된다 (Table 4).
4. 변이원성 평가
변이원성 평가를 위한 colony 계수 전 현미경을 통해 성장 균층을 관찰하면 독성이 없는 물질의 경우 균일하고 조밀하게 배열된 미세 colony들이 관찰된다. 이는 박테리아가 6 회 - 8 회의 세포 분열이 일어났음을 나타낸다. 하지만 미생물에 독성을 가지는 물질을 처리할 경우 성장균층이 얇아지거나 소실되는데 이는 박테리아가 사멸하거나 성장이 억제되었음을 나타낸다 (Fig. 1).
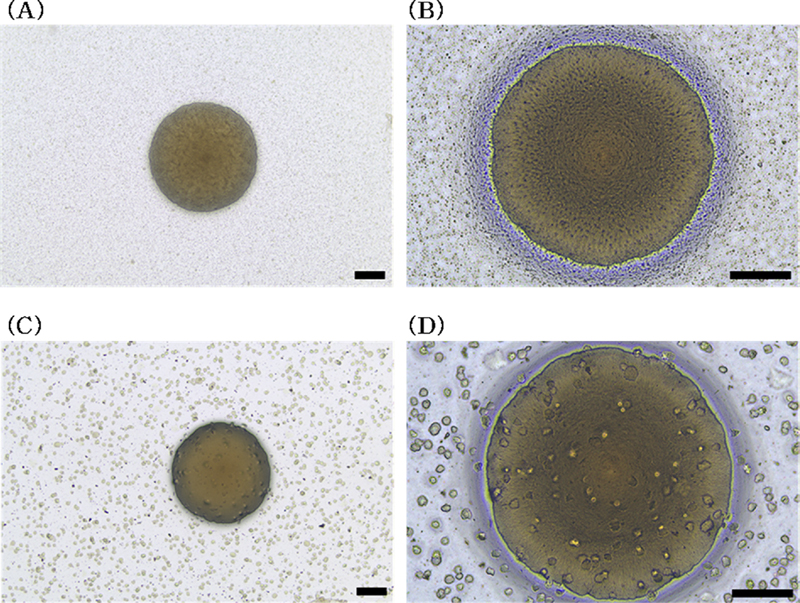
Normal and abnormal background lawn of Salmonella typhimurium on agar plates.(A)(B) The images show a normal background lawn of Salmonella typhimurium TA1535. In the case of a normal background lawn, it shows a dense and uniform growth. (C)(D) The images show an abnormal background lawn of Salmonella typhimurium TA1535. An abnormal background lawn exhibits irregular or uneven growth patterns, which may include areas of sparse growth. scale bar 0.25 ㎜.
박테리아의 사멸 또는 성장 억제로 인해 충분한 박테리아수를 확보하지 못할 경우 각 박테리아에 대해 시험 물질의 노출량이 증가하므로 잘못된 시험 결과가 나타날 수 있다 (Mortelmans and Zeiger, 2000). 이에 석산 물 추출물 처리 후 배양이 종료된 배지의 성장균층을 현미경을 통해 확인한 결과 미생물에 대한 독성은 확인되지 않았다.
석산 물 추출물 처리 시 미생물의 colony 형성에 미치는 영향을 판단하기 위해 colony 수를 계수한 결과, 대사 활성계의 적용 유무와 관계없이 음성 대조군과 비교하여 모든 균주의 양성 대조군이 2 배 이상 증가하였으며, 석산 물 추출물군은 2 배 또는 3 배 이상 증가하지 않았다 (Table 5).

Results of mutagenicity evaluation through bacterial reverse mutation test of water extract from Lycoris radiata.
복귀돌연변이 시험 판정 기준으로 복귀돌연변이 colony 수가 음성 대조군과 비교해 2 배 또는 3 배 (특정 균주) 증가하거나 용량 상관성을 나타낼 때 양성으로 판정하게 된다 (Ames et al., 1975; Cariello and Piegorsch, 1996; Levy et al., 2019).
본 연구 결과 TA98, TA100, WP2 uvrA 균주에서 석산 물 추출물의 colony 2 배 이상 증가하지 않았으며, TA1535, TA1537 균주에서 3 배 이상 증가하지 않는 것을 확인하였다. 따라서 본 시험 조건하에서 석산 물 추출물의 5,000 ㎍/plate 농도까지 변이원성을 유발하지 않는 것을 확인하였다. 유전독성 평가에는 복귀돌연변이시험 뿐만 아니라 염색체이상시험, 소핵시험을 포함한 다양한 시험법이 이용된다 (OECD, 2016a, 2016b). 본 시험에 사용된 시험법인 복귀돌연변이 시험은 안전성 시험 중 가장 기초가 되는 시험이라고 할 수 있다. 석산을 식품, 의약품, 건강기능식품 등으로 활용하기 위해서는 본 시험의 안전성 데이터를 바탕으로 추후 다양한 안전성 연구가 뒷받침되어야 할 것으로 생각된다.
Acknowledgments
본 연구는 전라남도 장흥군의 정남진 한약재산업 육성사업과 보건복지부의 한약비임상시설(GLP) 사업의 지원에 의해 수행된 결과로 이에 감사드립니다.
References
-
Ames BN, McCann J and Yamasaki E. (1975). Methods for detecting carcinogens and mutagens with the salmonella/ mammalian-microsome mutagenicity test. Mutation Research. 31:347-364.
[https://doi.org/10.1016/0165-1161(75)90046-1]

-
Bastida J, Lavilla R and Viladomat F. (2006). Chemical and biological aspects of narcissus alkaloids. The Alkaloids: Chemistry Biology. 63:87-179.
[https://doi.org/10.1016/S1099-4831(06)63003-4]

-
Cahlikova L, Breiterova K and Opletal L. (2020). Chemistry and biological activity of alkaloids from genus Lycoris (Amaryllidaceae). Molecules. 24:4797. https://www.mdpi.com/1420-3049/25/20/4797, (cited by 2024 Aug. 15).
[https://doi.org/10.3390/molecules25204797]

-
Cariello NF and Piegorsch WW. (1996). The Ames test: The two-fold rule revisited. Mutation Research. 369:23-31.
[https://doi.org/10.1016/S0165-1218(96)90044-0]

-
Chen GL, Tian YQ, Wu JL, Li N and Guo MQ. (2016). Antiproliferative activities of Amaryllidaceae alkaloids from Lycoris radiata targeting DNA topoisomerase I. Scientific Reports. 6:38284. https://www.nature.com/articles/srep38284, (cited by 2024 Sep. 28).
[https://doi.org/10.1038/srep38284]

-
Cho SY, Hwang SM, Kim SY and Jong Hyun Nho. (2024). Acute toxicity and genotoxicity study of water extracts from Rosa rugosa thunb. Korean Journal of Medicinal Crop Science. 32:202-210.
[https://doi.org/10.7783/KJMCS.2024.32.4.202]

-
Duan L, Dou LL, Guo L, Li P and Liu EH. (2016). Comprehensive evaluation of deep eutectic solvents in extraction of bioactive natural products. ACS Sustainable Chemistry & Engineering Journal. 4:2405-2411.
[https://doi.org/10.1021/acssuschemeng.6b00091]

-
Fentener van Vlissingen JM, Borrens M, Girod A, Lelovas P, Morrison F and Torres YS. (2015). The reporting of clinical signs in laboratory animals FELASA Working Group Report. Laboratory Animal. 49:267-283
[https://doi.org/10.1177/0023677215584249]

-
George-Gay B and Parker K. (2003). Understanding the complete blood count with differential. Journal of PeriAnesthesia Nursing. 18:96-117.
[https://doi.org/10.1053/jpan.2003.50013]

-
Hao B, Shen SF and Zhao QJ. (2013). Cytotoxic and antimalarial amaryllidaceae alkaloids from the bulbs of Lycoris radiata. Molecules. 18:2458-2468
[https://doi.org/10.3390/molecules18032458]

- Hashimoto H, Chatterjee S and Berger NA. (1995). Mutagenic activity of topoisomerase I inhibitors. Clinical Cancer Research. 1:369-376.
-
He M, Qu C, Gao O, Hu Xand Hong X. (2015). Biological and pharmacological activities of Amaryllidaceae alkaloids. RSC Advances. 5:16562-16574.
[https://doi.org/10.1039/C4RA14666B]

-
Henriques JA, Moreno PR, Von Poser GL, Querol CC and Henriques AT. (1991). Genotoxic effect of alkaloids. Memórias do Instituto Oswaldo Cruz. 86:71-74.
[https://doi.org/10.1590/S0074-02761991000600018]

-
Iqbal Z, Nasir H, Hiradate S and Fujii Y. (2006). Plant growth inhibitory activity of Lycoris radiata Herb. and the possible involvement of lycorine as an allelochemical. Weed Biology and Management. 6:221-227.
[https://doi.org/10.1111/j.1445-6664.2006.00217.x]

-
James RW and Heywood R. (1979). Age-related variations in the testes of sprague-dawley rats. Toxicology Letters. 4:257-261.
[https://doi.org/10.1016/0378-4274(79)90062-6]

-
Jeong JG. (2016). A Herbological study on the plants of Amaryllidaceae in Korea. Korea Journal of Herbology. 31:41-47.
[https://doi.org/10.6116/kjh.2016.31.1.41.]

-
Ji YB, Wei C and Xin GS. (2017). The study of chemical composition and pharmacological action of the alkaloid from plants of Lycoris Herb. IOP Conference Series: Earth and Environmental Science. 100:012045. https://iopscience.iop.org/article/10.1088/1755-1315/100/1/012045/meta, (cited by 2024 Aug 18).
[https://doi.org/10.1088/1755-1315/100/1/012045]

-
Jo SY, Hwang SM, Kim SY, Kim JS, Woo KW, Cho HW and Jong Hyun Nho. (2024). Acute toxicity and genotoxicity assessment of ligigeopoong-san. Journal of Korean Medicine. 45:40-53.
[https://doi.org/10.13048/jkm.24036]

- Kim BM, Yoo MJ, Song MS, Kwon TO, Lee YH and Chai KY. (2011). Research for the antiinflamation and antioxidation effect on the Lycoris squamigera Maxim. Herbal Formula Science. 19:109-118.
-
Kim DC. (2014). Single oral dose toxicity test of sobokchuko-tang, a polyherbal formula in ICR mice. Journal of Korean Obstetrics and Gynecology. 27:28-40.
[https://doi.org/10.15204/jkobgy2014.27.1.028]

- Kim KA. (2009). Understanding and application of liver function tests. Korean Journal of Medicine. 76:163-168.
-
Kretzing S, Abraham G, Seiwert B, Ungemach FR, Krugel U, Teichert J, Regenthal R. (2011). In vivo assessment of antiemetic drugs and mechanism of lycorine-induced nausea and emesis. Archives of Toxicology. 85:1565-1573.
[https://doi.org/10.1007/s00204-011-0719-9]

-
Kuijk E, Kranenburg O, Cuppen E and Van Hoeck A. (2022). Common anti-cancer therapies induce somatic mutations in stem cells of healthy tissue. Nature Communications. 13:5915. https://doi.org/10.1038/s41467-022-33663-5, (cited by 2024 Sep 28).
[https://doi.org/10.1038/s41467-022-33663-5]

-
Lee KP, Frame SR, Sykes GP and Valentine R. (1993). Testicular degeneration and spermatid retention in young male rats. Toxicologic Pathology. 21:292-302.
[https://doi.org/10.1177/019262339302100305]

-
Levy DD, Zeiger E, Escobar PA, Hakura A, van der Leede BM, Kato M, Moore MM, Sugiyama K. (2019). Recommended criteria for the evaluation of bacterial mutagenicity data(Ames test). Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 848:403074. https://www.sciencedirect.com/science/article/pii/S1383571819300774, (cited by 2024 Aug 7).
[https://doi.org/10.1016/j.mrgentox.2019.07.004]

-
Maron DM and Ames BN. (1983). Revised methods for the Salmonella mutagenicity test. Mutation Research. 113:173-215.
[https://doi.org/10.1016/0165-1161(83)90010-9]

-
Matsuura HN and Felt-Neto AG. (2015). Plant alkaloids : Main feature, toxicity, and mechanisms of action. Plant Toxins. 2:1-25.
[https://doi.org/10.1007/978-94-007-6728-7_2-1]

-
Mcnulty J, Nair JJ, Little JR, Brennan JD and Bastida J. (2010). Structure-activity studies on acetylcholinesterase inhibition in the lycorine series of amaryllidaceae alkaloids. Bioorganic and Medicinal Chemistry Letters. 20:5290-5294.
[https://doi.org/10.1016/j.bmcl.2010.06.130]

-
Mortelmans K and Zeiger E. (2000). Salmonella/microsome mutagenicity assay. Mutation Research. 455:29-60
[https://doi.org/10.1016/S0027-5107(00)00064-6]

-
Nair JJ and Van Staden J. (2014). Cytotoxicity studies of lycorine alkaloids of the Amaryllidaceae. Natural Product Communications. 9:1193-1210.
[https://doi.org/10.1177/1934578X1400900834]

-
Nair JJ and Van Staden J. (2013). Phamacological and toxicological insights to the South African Amaryllidaceae. Food and Chemical Toxicology. 62:262-275
[https://doi.org/10.1016/j.fct.2013.08.042]

- Organization for Economic Cooperation and Development (OECD). (2001). Test No. 420: Acute Oral Toxicity - Fixed Dose Procedure. OECD guidelines for the testing of chemicals, Section 4. Organization for Economic Cooperation and Development. Paris, France. https://www.oecd-ilibrary.org/environment/test-no-420-acute-oral-toxicity-fixed-dose-procedure_9789264070943-en, (cited by 2024 Oct 16).
- Organization for Economic Cooperation and Development (OECD). (2016a). Test No. 473: In vitro mammalian chromosomal aberration test. OECD guidelines for the testing of chemicals, Section 4. Organization for Economic Cooperation and Development. Paris, France. https://www.oecd.org/en/publications/test-no-473-in-vitro-mammalian-chromosomal-aberration-test_9789264264649-en.html, (cited by 2024 April 29).
- Organization for Economic Cooperation and Development (OECD). (2016b). Test No. 474: Mammalian erythrocyte micronucleus test. OECD guidelines for the testing of chemicals. Section 4. Organization for Economic Cooperation and Development. Paris, France. https://www.oecd-ilibrary.org/environment/test-no-474-mammalian-erythrocyte-micronucleus-test_9789264264762-en, (cited by 2024 April 29).
- Organization for Economic Cooperation and Development (OECD). (2020). Test No. 471: Bacterial reverse mutation test. Organization for Economic Cooperation and Development. Paris, France. https://www.oecd-ilibrary.org/environment/test-no-471-bacterial-reverse-mutation-test_9789264071247-en, (cited by 2024 April 29).
- Park YJ and Chung YO. (1996A). Studies on the characteristics of seed germination of Lycoris genera. Korean Journal of Medicinal Crop Science. 4:163-171.
- Park YJ and Chung YO. (1996B). Effects of chemicals, decoating and low temperature treatments of seed germination in Lycoris aurea. Korean Journal of Medicinal Crop Science. 4:172-177.
-
Petterino C and Argentino-Storino A. (2006). Clinical chemistry and haematology historical data in control Sprague-Dawley rats from pre-clinical toxicity studies. Experimental and Toxicologic Pathology. 57:213-219.
[https://doi.org/10.1016/j.etp.2005.10.002]

-
Ruangritchankul S, Chantharit P, Srisuma S and Gray LC. (2021). Adverse drug reactions of acetylcholinesterase inhibitors in older people living with dementia: A comprehensive literature review. Therapeutics and Clinical Risk Management. 17:927-949.
[https://doi.org/10.2147/TCRM.S323387]

-
Shen CY, Xu XL, Yang LJ and Jiang JG. (2019). Identification of narciclasine from Lycoris radiata(L'Her.) Herb. and its inhibitory effect on LPS-induced inflammatory responses in macrophages. Food and Chemical Toxicology. 125:605-613.
[https://doi.org/10.1016/j.fct.2019.02.003]

-
Soto-Vásquez MR, Rodríguez-Muñoz CA, Tallini LR and Bastida J. (2022). Alkaloid composition and biological activities of the amaryllidaceae species Ismene amancaes(Ker Gawl.) Herb. Plants (Basel). 11:1906.
[https://doi.org/10.3390/plants11151906]

- Stiff PJ. (1990). Platelets. In Walker HK. et al. (eds.). In Hall WD and Hurst JW. (ed.). Clinical methods : The history, physical, and laboratory examinations. 3rd edition. Butterworths. Boston. MA, USA. p.728-731
-
Tae KH and Ko SC. (1995). A taxonomic study of the genus Lycoris(Amaryllidaceae) based on morphological characters. Korean Journal of Plant Taxonomy. 25:237-254.
[https://doi.org/10.11110/kjpt.1995.25.4.237]

-
Tae KH and Ko SC. (1997). Cluster and cladistic analyses on some selected taxa of Lycoris. Korean Journal of Plant Taxonomy. 27:1-10.
[https://doi.org/10.11110/kjpt.1997.27.1.001]

-
Takla SS, Shawky E, Hammoda HM and Darwish FA. (2018). Green techniques in comparison to conventional ones in the extraction of Amaryllidaceae alkaloids: Best solvents selection and parameters optimization. Journal of Chromatography A. 1567:99-110. https://www.sciencedirect.com/science/article/pii/S0021967318308513, (cited by 2024 Oct 10).
[https://doi.org/10.1016/j.chroma.2018.07.009]

- Tejs S. (2008). The Ames test: A methodological short review. Environmental Biotechnology. 4:7-14.
-
Van Berlo D, Woutersen M, Muller A, Pronk M, Vriend J and Hakkert B. (2022). 10% Body weight(gain) change as criterion for the maximum tolerated dose: A critical analysis. Regulatory Toxicology and Pharmacology. 134:105235 https://www.sciencedirect.com/science/article/pii/S0273230022001222c, (cited by 2024 April 29).
[https://doi.org/10.1016/j.yrtph.2022.105235]

- Varoon DH and Israili Z. (1990). Alkaline phosphatase and gammaglutamyltransferase. In Walker HK. et al. (eds.). In Hall WD and Hurst JW. (ed.). Clinical methods : The history, physical, and laboratory examinations. 3rd edition. Butterworths. Boston. MA, USA. p.494-496.
-
Wang M, Liang L, Wang R, Jia S, Xu C, Wang Y, Luo M, Lin Q, Yang M, Zhou H, Liu D and Qing C. (2023). Narciclasine, a novel topoisomerase I inhibitor, exhibited potent anti-cancer activity against cancer cells. Natural Products and Bioprospecting. 13:27. https://link.springer.com/article/10.1007/s13659-023-00392-1, (cited by 2024 Sep 28).
[https://doi.org/10.1007/s13659-023-00392-1]

-
Weniger B, Italiano L, Beck JP, Bastida J, Bergonon S, Codina C and Anton R. (1995). Cytotoxic activity of Amaryllidaceae alkaloids. Planta Medica. 61:77-79.
[https://doi.org/10.1055/s-2006-958007]
