
괭이밥 열수 추출물의 항산화 및 항염증 효과
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In this study, we evaluated the antioxidant and anti-inflammatory effects of Oxalis corniculata hot water extract (OCWE) using lipopolysaccharide (LPS)-stimulated RAW264.7 cell.
Antioxidant activity was evaluated by measuring total polyphenol content, 2,2-diphenyl-1-picrylhydrazyl radical scavenging activity, 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) radical scavenging activity, and reducing power ability. The total polyphenol content was found to be 33.06 ± 0.31 ㎎ · gallic acid equivalent/g, and each evaluation showed reduction rates of 21.93 ± 2.43%, 64.93 ± 0.83%, and 0.260 ± 0.01 at the an OCWE concentration of 400 ㎍/㎖. To evaluate the anti-inflammatory effect of OCWE, a nitric oxide (NO) assay, reverse trascription polymerase chain reaction and western blotting were performed. At 400 ㎍/㎖ concentration of OCWE, NO generation was reduced by 52.5 ± 1.37%, compared to LPS-stimulated RAW264.7 cells. OCWE also inhibited iNOS, COX-2, TNF-α, and IL-6 in at the protein ans mRNA levels in a dose-dependent manner.
Taken together, these results indicate that OCWE had strong antioxidant and anti-inflammatory effects. We suggest that OCWE may be an antioxidant and anti-inflammation agent in functional foods.
Keywords:
Oxalis corniculata, Anti-inflammatory, Antioxidant, Cyclooxygenase-2, Inducible Nitric Oxide Synthase서 언
염증은 병원체 및 손상된 세포 등을 포함한 다양한 요인에 의해 유발될 수 있는 면역계의 생물학적 반응이다 (Chen et al., 2018). 염증반응은 인간이 살아가는데 필수적인 방어 작용이지만 암, 죽상동맥경화증, 천식, 다발성 경화증 등과 같은 해결되지 않는 질병의 주요 원인이 된다 (Nathan and Aihao, 2010).
염증을 유발시키는 인자는 대식세포, 호중구 표면에 있는 TLR (Toll-like recepter)에서 감지되며, TLR에 의해 자극된 염증 매개체는 국소 혈관을 포함한 표적 조직에 작용하여 혈관 확장 및 호중구 유출을 유도한다 (Medzhitov, 2010). 지질 다당류 (lipopolysaccharide, LPS)는 그람 음성 세균의 외부막을 구성하는 주요 성분으로, LPS에 의한 자극으로 활성화된 대식세포는 mitogen-activated protein kinase (MAPK) 경로를 통하여 nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB), Activator protein 1 (AP-1)와 같은 핵인자를 활성화한다 (Tian et al., 2021).
이러한 유전자 신호 전달체제를 통하여 inducible nitric oxide synthase (iNOS) 및 cyclooxygenase-2 (COX-2)와 같은 염증반응 매개 물질이 발현되며, 매개된 COX-2는 염증 과발현을 유도하는 Prostaglandin E2 (PGE2)의 생성을 촉진하고 iNOS는 L-아르기닌을 자극함으로써 nitric Oxide (NO)의 생성을 유도한다 (Kwon et al., 2013). 또 reactive oxygen species (ROS)의 생성을 증가시키고 interLeukin-6 (IL-6), tumor necrosis factor α (TNF-α)과 같은 사이토카인을 생성을 유발하면서 만성 염증 반응을 시작한다 (Tian et al., 2021).
대식세포가 증가시키는 reactive oxygen species (ROS)는 산화적 스트레스의 주요 원인으로 세포의 항상성을 교란시키며 색소, 단백질, 지질, 탄수화물 및 DNA와 같은 생체분자에 산화적 손상을 유발한다 (Das and Roychoudhury, 2014). ROS의 과잉 생산은 다양한 인간의 질병과 연관이 있으며, 특히 염증 반응과의 연계로 인해 지속적으로 연구되어 왔다 (Alessandro et al., 2016).
괭이밥 (Oxalis corniculata)은 전통적으로 발열, 통증 치료, 항균제로 흔하게 이용되는 약용 식물 중 하나이며 (Srikanth et al., 2012; Dighe et al., 2016), 우리나라에서도 민간에서 치질, 화상 및 피부병 치료제로 사용되었다 (Park and Kim, 2001). 괭이밥의 에탄올 추출물은 마우스에서 항산화 활성을 보였으며 (Kalavati and Patil, 2007), 괭이밥의 메탄올 추출물 및 에탄올 추출물은 DPPH 및 산화질소 라디칼 소거 활성과 항염증 효능을 가지는 것으로 보고되었다 (Juvekar et al., 2009, Sakat et al., 2010, Sowmya and Nivedhitha, 2021). 그러나 괭이밥의 열수 추출물 (OCWE)에 대한 항염증 효과에 대한 단백질, 유전자 수준의 기전 연구는 지금까지 보고되지 않았다.
식물에서 대표적으로 확인되는 폴리페놀 중 하나인 caffeoylquinic acid (CQA)은 항산화, 항균, 항기생충, 신경보호, 항염증, 항암 등의 광범위한 생물학적 활성을 가지고 있으며 (Liu et al., 2020), 그 중에도 3-O–caffeoylquinic acid (3-CQA)는 미세아교세포에서 지질다당류로 인한 종양 괴사 인자 생산을 조절하는 것으로 알려져 있다 (Socodato et al., 2015). 또한 Ellagic acid는 폴리페놀화합물로 항암작용, 항산화, 노화 억제 작용 등의 효능이 뛰어난 물질로 보고되었다. (Gupta et al., 2021).
따라서, 본 연구에서는 LPS에 의해 유도된 마우스 대식세포인 RAW264.7 cell을 이용하여 OCWE에 대한 항염증 및 항산화 효과를 검증하였으며, 지표 성분 분석을 통하여 향후 괭이밥의 기능성 소재 개발을 위한 기초자료로 활용하고자 하였다.
재료 및 방법
1. 시료 준비
괭이밥 (Oxalis corniculata)은 베트남 달랏대학교 (Dalat, Vietnam)로부터 제공받아 40℃ 조건에서 48 시간 열풍건조기 (Daedong, Nonsan, Korea)로 건조한 전초를 분쇄기 (Daesung Artlon, DA280-S, Paju, Korea)를 이용하여 80 mesh 사이즈로 분쇄하였다. 분쇄되어진 분말 10 g에 50 배의 증류수를 첨가하여 heating mentle (MTOPs. MS-EAM, Yangju, Korea)에서 100℃ 조건으로 6 시간 추출하였다.
추출된 용액을 4,500 rpm에서 15 분간 원심분리 (Hanil Science Co., Ltd., SUPRA 22K, Incheon, Korea) 후 상등액을 Whatman No. 1 filter paper (Whatman, Maidstone, England)를 이용하여 여과하고 동결건조 (PVTF20R, ilShinBioBase Co., Ltd., Dongducheon, Korea)하여 괭이밥 전초 열수 추출물 (OCWE)을 제조하였다.
2. 총 폴리페놀 함량 측정
괭이밥 전초 열수 추출물의 총 폴리페놀 함량 검정은 Folin-Denis 방법 (1912)에 따라 측정하였으며, 200 ㎍/㎖ 농도의 OCWE 150 ㎕에 2 N의 Folin & Ciocalteus’s phonol reagent (Sigma-Aldrich Co., St. Louis, MO, USA) 150 ㎕, 10% Na2CO3 용액 150 ㎕을 첨가하였다.
이 혼합액을 상온에서 1 시간 동안 정치한 후 ELISA reader (Molecular Devices Inc., Sunnyuale, CA, USA)를 이용하여 760 ㎚에서 흡광도를 측정하였다. 시료의 총 폴리페놀 함량은 gallic acid (Sigma Chemical Co., St. Louis, MO, USA)를 이용한 표준 검량선을 작성하여 산출하였다.
3. DPPH radical 소거능 활성
괭이밥 전초 열수 추출물의 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical 소거활성을 검정하기 위해 Blois의 방법 (Blois, 1958)을 일부 변형하여 사용하였다. OCWE 농도별 시료 용액 (50, 100, 200, 400 ㎍/㎖) 50 ㎕에 0.2 mM의 DPPH (Sigma-Aldrich Co., St. Louis, MO, USA) 용액 100 ㎕를 넣고 혼합한 후 ELISA reader (Molecular Devices, Sunnyuale, CA, USA)를 이용하여 517 ㎚에서 흡광도를 측정하였다. DPPH radical 소거능은 다음 식으로 환산하여 나타내었다.
저해율(%) = (1 – 시료 처리구의 흡광도/대조구의 흡광도) × 100
4. ABTS radical 소거능 활성
괭이밥 전초 열수 추출물의 2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) radical 소거 활성 측정은 ABTS+• cation decolourisation 방법 (Re et al., 1999)을 이용하여 측정하였다. 7 mM의 ABTS (Sigma-Aldrich Co., St. Louis, MO, USA)에 2.45 mM potassium persulfate (Sigma-Aldrich Co., St. Louis, MO, USA)를 첨가하여 24 시간 동안 상온에서 ABTS+•을 형성시킨 후 734 ㎚에서 흡광도 값이 0.70 - 0.90이 되도록 희석하였다.
희석 용액 100 ㎕에 OCWE 농도별 시료 (50, 100, 200, 400 ㎍/㎖) 50 ㎕를 첨가한 후 ELISA reader (Molecular Devices Inc., Sunnyuale, CA, USA)를 이용하여 734 ㎚에서 흡광도를 측정하였다. ABTS의 radical 소거능은 다음 식으로 환산하여 나타내었다.
저해율 (%) = (1 – 시료 처리구의 흡광도/대조구의 흡광도) × 100
5. 환원력 측정 (Reducing power ability)
괭이밥 전초 열수 추출물의 환원력 측정은 Oyaizu 방법 (1986)을 이용하여 으로 측정하였다. OCWE 농도별 시료 (50, 100, 200, 400 ㎍/㎖) 150 ㎕에 1% potassium ferricyanide 150 ㎕을 혼합하여 50℃에서 20 분 동안 반응시키고, 10% trichloroacetic acid (Sigma-Aldrich Co., St. Louis, MO, USA) 150 ㎕을 첨가하였다. 혼합물을 4℃에서 10 분 동안 4,500 rpm으로 원심 분리한 후, 상등액 150 ㎕에 증류수 150 ㎕과 0.1% ferric chloride 15 ㎕을 첨가한 후 ELISA reader (Molecular Devices Inc., Sunnyuale, CA, USA)를 이용하여 700 ㎚에서 흡광도를 측정하였다.
6. 항염증 효능 검증
항염증 효능 검증에 사용된 세포는 마우스 대식세포 RAW264.7 cell은 American Type Culture Collection (ATCC, Rockville, MD, USA)에서 구매해서 사용하였다.
세포의 배양은 10% FBS (fetal bovine serum)와 1% penicillin, streptomycin이 첨가된 DMEM (Dulbecco’s Modified Eagle’s Medium) 배지를 사용하였으며, 37℃, 5% CO2 조건으로 CO2 배양기 (HERA cell 150i, Thermo Scientific Inc., Cleveland, USA)를 이용하여 배양하였다.
배양된 RAW264.7 cell을 1 × 104 cells/well로 96 well plate에 100 ㎕씩 분주하여 18 시간 동안 배양한 후 OCWE 농도별 시료 용액 (50, 100, 200, 400 ㎍/㎖)을 각각 24 시간 동안 처리하였다.
시료 처리에 따른 세포 생존율은 Cell Counting Kit-8 (CCK-8, #SE814 Dojindo Molecular Technologies Inc., Rockville, MD, USA) 방법으로 확인하였으며, ELISA reader (Molecular Devices Inc., Sunnyuale, CA, USA)를 이용하여 흡광도를 측정하였다.
RAW264.7 cell을 2 × 105 cells/well로 24 well plate에 분주하여 24 시간 배양한 후 lipopolysaccharide (LPS, Sigma-Aldrich Co., St. Louis, MO, USA)를 2 ㎍/㎖가 되도록 처리하였다. LPS 처리 2 시간 후 OCWE의 농도별 (50, 100, 200, 400 ㎍/㎖) 시료를 각각 24 시간 동안 처리하여 상층액 100 ㎕를 획득하였으며 NO의 농도는 NO detection kit (iNtRON, Seongnam, Korea)를 이용하여 확인하였다.
유전자 수준에서 염증 관련 인자 및 사이토카인에 대한 OCWE의 효과를 확인하고자 배양된 세포로부터 RNA isolation kit (Qiagen Inc., Valencia, CA, USA)를 사용하여 RNA를 추출하였으며, Nanodrop (Thermo Fisher Scientific Inc., Madison, WI, USA)을 사용하여 RNA 농도 및 순도를 측정하였다.
Reverse Transcription Master Premix (Elpis-biotech Co., Daejeon, Korea)를 사용하여 1 ㎍의 RNA를 cDNA로 역전사 시켰으며, 유전자 발현 수준은 LightCycler 480 Instrument II (Roche Diagnostics, Mannheim, Germany)를 사용하여 RT-PCR에 의해 분석하였다.
본 연구에 사용된 Oligonucleotide primers는 Table 1과 같다. PCR 조건은 95℃에서 5 분 동안 pre-denaturation 후, 95℃에서 15 초, 58℃에서 15 초, 72℃에서 30 초의 40 cycles로 반복, 상대 정량 분석을 위해 GAPDH로 정규화하였다.
단백질 수준에서 염증 인자 및 사이토카인에 대한 OCWE의 효능을 확인하고자 6 well plate에 2.5 × 105 cells/well의 농도로 RAW264.7 cell을 분주하여 18 시간 동안 배양한 뒤 다시 LPS (2 ㎍/㎖)를 처리하고 2 시간 동안 추가 배양하였으며, OCWE의 농도별 시료 (100, 200, 400 ㎍/㎖)를 각각 24 시간 동안 처리하였다.
처리된 세포로부터 PRO-PREP™ (iNtRON, Seongnam, Korea)를 이용하여 단백질을 추출하였으며, 단백질 농도는 제조사의 프로토콜에 따라 Pierce™ BCA Protein Assay (Thermo Fisher Scientific Inc., Rockford, IL, USA)를 사용하여 측정하였다.
추출된 단백질을 SDS-PAGE를 통해 크기 별로 분리하였으며 membrane에 transfer 한 후 5% BSA로 membrane 상에 전기적으로 전달된 단백질이 결합하고 있는 부분 이외의 binding site를 blocking 해주어 background를 최소화하였다. 이후 1차 항체로 iNOS (#13120, Cell Signalling Technology Inc., Denvers, MA, USA), COX-2 (#12282, Denver, MA, USA), TNF-α (#11948S, Cell Signalling Technology Inc., Denver, MA, USA), IL-6 (#12912S, Cell Signalling Technology Inc., Denver, MA, USA), β-actin (#13E5, Cell Signalling Technology Inc., Denver, MA, USA)을 사용하였다. 이후 SuperSignal™ Western Blot Enhancer (Pierce, Rockford, IL, USA)를 사용하여 항체 신호를 검출하고 LAS-4000 (Fujifilm, Tokyo, Japan)을 사용하여 확인하였다.
7. 3-O-caffeoylquinic acid 및 Ellagic acid 성분 분석
괭이밥 전초 열수 추출물의 지표 성분 분석을 위해 3-O-caffeoylquinic acid 및 ellagic acid의 함량을 측정하였다. 3차 증류수를 이용하여 OCWE를 1 ㎎/㎖ 농도로 용해한 후 10분간 초음파 처리하고 6,500 rpm에서 20 분간 원심분리하였다. 원심분리 후 상층액을 0.45 ㎛ syringe filter (Pall Life Sciences, East Hills, NY, USA)로 여과한 후 분석 시료로 사용하였다.
3-O-caffeoylquinic acid (3-CQA; >98%, Sigma-Aldrich Co., St. Louis, MO, USA)와 ellagic acid (>98%, Sigma-Aldrich Co., St. Louis, MO, USA)는 50% 에탄올을 이용하여 10 ㎎/㎖의 농도로 제조하고, 0.1, 0.5, 1.0, 10.0 ㎍/㎖ 농도로 희석하여 검량을 위한 표준곡선을 작성하였다.
각 성분의 정량 분석을 위한 HPLC 시스템은 Arc HPLC (Waters Co., Milford, MA, USA)을 이용하였으며, 분석조건은 Table 2와 같다.
8. 통계처리
실험 결과는 3 번 이상 반복 독립 실험으로 진행되었으며, 모든 결과는 평균 ± 표준편차 (means ± SD)로 표시하였다. 실험 결과는 GraphPad Prism (GraphPad Software 8.0.1, GraphPad, San Diego, CA, USA)로 그래프화 되었으며, 각 실험 결과에 대한 통계 분석은 One-way Analysis of Variance (ANOVA)를 실시한 후 Tukey HSD 다중분석법을 사용하여 각 처리구간의 유의적 차이를 5.0%, 1.0%, 0.1% 수준에서 검증하였다 (*p < 0.05, **p < 0.01, ***p < 0.001).
결 과
1. 괭이밥 전초 열수 추출물의 총 폴리페놀 함량 측정 및 항산화 효능평가
괭이밥 (Oxalis corniculata) 전초 열수 추출물의 총 폴리페놀 함량은 33.06 ± 0.31 ㎎ · GAE/g으로 측정되었으며 (Table 3), 환원력은 각각 50, 100, 200 및 400 ㎍/㎖ 농도에서 0.171 ± 0.02, 0.192 ± 0.01, 0.215 ± 0.01, 0.260 ± 0.01로 농도 의존적으로 흡광도가 증가하는 경향을 나타내었다 (Table 3).
DPPH 소거 활성은 각각 OCWE 50, 100, 200 및 400 ㎍/㎖ 농도에서 각각 1.13 ± 1.09%, 3.93 ± 3.51%, 9.82 ± 1.47%, 21.93 ± 2.43%의 소거 활성 효과를 나타내었다 (Table. 4). 또한, 괭이밥 전초 열수 추출물 (OCWE)의 ABTS+• 라디칼 소거능을 측정한 결과 50, 100, 200 및 400 ㎍/㎖ 농도에서 각각 13.89 ± 0.43%, 24.90 ± 0.65%, 40.56 ± 0.81%, 64.93 ± 0.83%로 소거 활성이 확인되었다 (Table 4).
2. 괭이밥 전초 열수 추출물의 세포 생존율 및 nitric oxide 생성에 미치는 효과
괭이밥 전초 열수 추출물의 세포 독성을 확인하기 위하여 RAW264.7 cell을 대상으로 하여 OCWE를 50, 100, 200 및 400 ㎍/㎖ 농도 수준으로 처리하였다. 그 결과 아무것도 처리하지 않은 control 군과 비교하여 OCWE를 50, 100, 200 및 400 ㎍/㎖ 농도 수준으로 처리한 후 세포 생존률은 각각 94.0 ± 3.42%, 94.7 ± 4.17%, 93.3 ± 4.88%, 99.9 ± 0.01%로 측정되었으며, 최대 농도 400 ㎍/㎖ 이하에서는 독성이 없음을 확인하였다 (Fig. 1A).
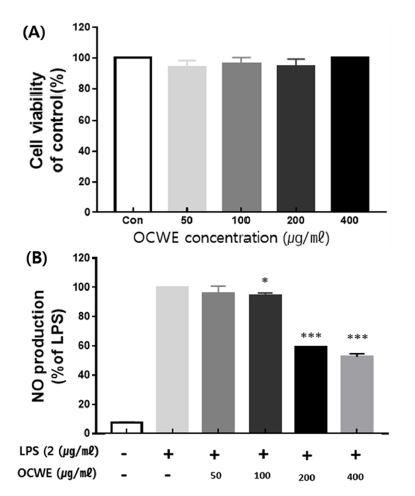
Effect of hot water extract of Oxalis corniculata whole plant (OCWE) on LPS-stimulated nitric oxide (NO) generation and cell viability in RAW264.7 cell.(A) Results for cell viability at various concentration of OCWE compared to control. (B) Results of inhibition of NO production rate at various concentration of OCWE compared to LPS-only treatment group. Data represent the means ± SD in triplicate. P-value were calculated based on LPS-only data by One-way ANOVA and Tukey’s test (*p < 0.05, ***p < 0.001).
LPS가 처리된 대식세포 RAW264.7 cell에 괭이밥 전초 열수 추출물을 세포 독성 영향이 나타나지 않는 처리 농도인 50 ㎍/㎖ - 400 ㎍/㎖의 수준으로 처리한 후 NO의 생성량을 측정하였다. LPS를 단독 처리한 군과 비교하여 (100%) 아무것도 처리되지 않은 대조군의 NO 생성 비율은 LPS를 처리구의 7.65 ± 0.50% 수준으로 확인되었으며, LPS 처리에 따라 NO 생성량이 크게 증가하였다. 반면 LPS를 처리하고 OCWE를 50, 100, 200 및 400 ㎍/㎖ 농도 수준으로 처리한 경우 NO 생성 비율은 각각 농도에 따라 LPS 단독 처리군 대비 95.7 ± 0.34%, 92.32 ± 1.50%, 59.4 ± 0.03%, 52.5 ± 1.4%의 NO 생성 비율을 보였으며, OCWE를 농도별로 처리하는 경우 LPS 처리에 의해 증가된 NO 생성 비율을 농도 의존적으로 감소시키는 것을 확인하였다 (Fig. 1B).
3. 괭이밥 전초 열수 추출물의 iNOS, COX-2 및 염증성 사이토카인 (TNF-α, IL-6)의 mRNA 발현에 미치는 효과
괭이밥 전초 열수 추출물이 염증성 사이토카인의 생성과 염증 발현과 관련된 유전자 전사에 미치는 영향을 확인하기 위하여 NO 생성과 연관된 iNOS, PGE2 합성과 연관된 COX-2, 그리고 염증성 사이토카인인 TNF-α 및 IL-6의 생성 유전자 전사에 미치는 효과를 RT-PCR을 통하여 확인하였다.
LPS가 처리되지 않은 control에서의 iNOS, COX-2, 염증성 사이토카인 TNF-α, IL-6의 mRNA 발현은 확인되지 않았다. LPS를 단독 처리한 군 (100%)과 iNOS mRNA 발현 수준을 비교하였을 때 LPS와 함께 OCWE를 100, 200 및 400 ㎍/㎖의 농도로 처리한 경우 각각 농도에 따라 iNOS는 68.64 ± 16.14%, 66.31 ± 12.82% 그리고 45.41 ± 7.90%로 측정되어 mRNA 발현 수준이 감소함을 확인할 수 있었다 (Fig. 2A).
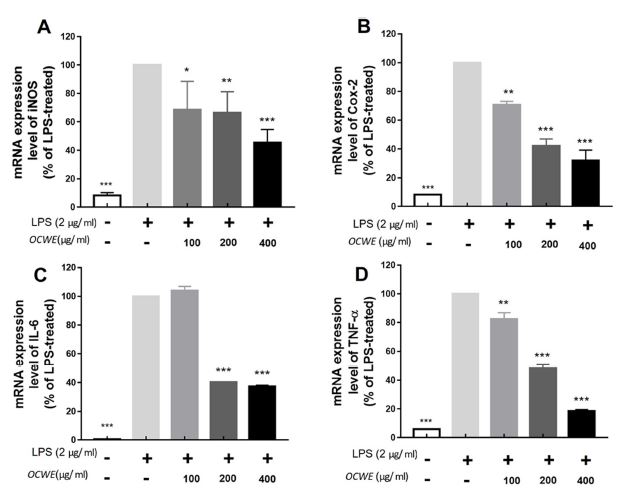
Inhibitory effect of inflammation-inducing mRNA of hot water extract of Oxalis corniculata whole plant (OCWE).All samples except control were treated with 2 ㎍/㎖ of LPS. Compared to (A) iNOS, (B) COX-2, (C) IL-6, (D) TNF-α mRNA expression levels based on LPS-only treatment. Data represent the means ± SD in triplicate. P-value were calculated based on LPS-only data by One-way ANOVA and Tukey’s test (*p < 0.05, ***p < 0.001).
COX-2의 경우 LPS를 단독 처리한 군 (100%)와 비교하여 OCWE를 100, 200 및 400 ㎍/㎖의 농도로 처리한 경우 각 농도에 따라 70.73 ± 1.71%, 42.73 ± 3.49%, 31.95 ± 5.16%로 감소되어지는 경향을 나타내었다 (Fig. 2B).
또한 사이토카인 중 하나인 IL-6는 LPS를 단독 처리한 경우와 비교하여 100 ㎍/㎖를 처리한 경우 103.90 ± 2.16%로 다소 증가하였다가, 200 및 400 ㎍/㎖의 농도로 처리한 경우 40.33 ± 0.14%, 37.24 ± 0.65%로 발현량이 감소하였다 (Fig. 2C).
TNF-α의 경우에서도 LPS를 단독 처리한 경우와 비교하여 OCWE 100, 200 및 400 ㎍/㎖의 농도처리에 의해 순서대로 82.41 ± 3.14%, 48.33 ± 1.84%, 18.44 ± 0.76%까지 발현 수준이 감소하였다 (Fig. 2D).
이러한 결과를 통해 OCWE의 처리는 염증 발현 관련 유전자의 mRNA 발현을 농도 의존적으로 저해할 수 있다는 것을 검증하였으며, 괭이밥 전초 열수 추출물이 염증 발현 억제에 효과적으로 사용될 수 있음을 확인하였다.
4. 괭이밥 전초 열수 추출물의 iNOS, COX-2 및 염증성 사이토카인 (TNF-α, IL-6)의 단백질 발현에 미치는 효과
괭이밥 전초 열수 추출물이 염증성 사이토카인의 생성과 염증 발현과 관련된 단백질 수준에서 저해 활성을 나타내는지 확인하기 위해 Western blot을 이용하여 확인하였다 (Fig. 3A).

Inhibitory effect of inflammation-inducing protein of hot water extract of Oxalis corniculata whole plant (OCWE).All samples except control were treated with 2 ㎍/㎖ of LPS. (A) Western blot detection bands of each protein. Compared to (B) iNOS, (C) COX-2, (D) IL-6, (E) TNF-α protein expression levels based on LPS-only treatment. P-value were calculated based on LPS-only data by One-way ANOVA and Tukey’s test (*p < 0.05, **p < 0.01, ***p < 0.001).
LPS가 처리되지 않은 대조군에서의 단백질 발현 수준이 매우 적은 수준이었으나 LPS를 단독 처리한 군의 경우 염증성 사이토카인의 생성과 염증 발현과 관련된 단백질은 모두 그 발현이 증가됨을 확인할 수 있었다. LPS 단독 처리구 (100%)에 대비하여 OCWE를 100 및 200 ㎍/㎖의 농도로 처리한 경우 각각 농도에 따라 iNOS의 단백질 발현은 43.98 ± 3.80%, 31.36 ± 4.56%로 감소하였으나 OCWE를 400 ㎍/㎖로 처리한 경우에서는 발현양이 31.61 ± 6.20% 수준으로 감소하여 200 ㎍/㎖을 처리한 경우에서의 단백질 발현양의 감소와 유사하였다 (Fig. 3B). 사이토카인 중 하나인 IL-6 단백질의 경우 LPS 단독 처리구 (100%) 대비, OCWE를 100, 200 및 400 ㎍/㎖의 농도로 처리한 경우 각각 47.33 ± 23.28, 31.11 ± 7.10, 31.74 ± 7.31으로 단백질 발현 비율이 감소하였으며, 200 ㎍/㎖와 400 ㎍/㎖ 처리 농도에 따른 단백질 발현은 차이를 나타내지 않았다 (Fig. 3D).
반면 COX-2 단백질 발현에 있어 LPS 단독 처리구 (100%) 대비, OCWE를 100, 200 및 400 ㎍/㎖의 농도로 처리한 경우 COX-2의 단백질 발현 비율은 각각 70.32 ± 1.78%, 61.50 ± 11.40%, 50.78 ± 9.00% 순으로 감소되어 OCWE의 농도가 높아질수록 농도 의존적으로 저해 되는 것을 확인할 수 있었다 (Fig. 3C). 또 다른 사이토카인인 TNF-α의 경우 LPS 단독 처리구 (100%) 대비, 50.28 ± 7.18%, 42.08 ± 6.15%, 35.42 ± 6.16%으로 측정되어, 단백질 발현 비율이 농도 의존적으로 감소하였다 (Fig. 3E).
5. 괭이밥 전초 열수 추출물의 지표 물질 3-O-caffeoylquinic acid 및 ellagic acid의 함량 분석
괭이밥 전초 열수 추출물의 지표 성분을 확인하기 위해 HPLC-DAD 검출기를 활용하여 3-O-caffeoylquinic acid (CQA) 및 ellagic acid의 함량을 분석하였다. 그 결과 3-O-caffeoylquinic acid 및 ellagic acid 모두가 30 분 이내에 용리되었으며, 1 ㎎/㎖의 OCWE 시료와 표준품의 성분 검출 시간은 각각 3-O-caffeoylquinic acid가 14.1 분, ellagic acid 26.6 분으로 확인되었다 (Fig. 4).
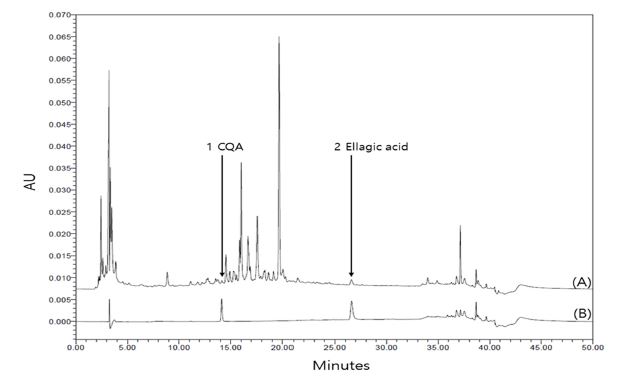
Results of HPLC-DAD chromatograms by hot water extract of Oxalis corniculata whole plant (OCWE).OCWE 1 ㎎/㎖ concentration was analyzed with a representative HPLC-DAD chromatogram of the compound at 254 ㎚. (A) Samples and (B) Standard.
괭이밥 전초 열수 추출물 내에 CQA 함량은 3.19 ± 0.09 ㎎/g이며, ellagic acid의 함량은 1.07 ± 0.12 ㎎/g으로 분석되었다 (Table 5). OCWE는 지표 성분 물질로서 CQA와 ellagic acid와 같은 기능성 성분을 함유하고 있는 것으로 확인되어진다.
고 찰
과도한 활성 산소종 (ROS) 형성은 산화 스트레스를 유발하여 세포 사멸을 초래하며, 산화 스트레스는 다양한 임상적인 질병과 연관되어 있는 것으로 보고되었다 (Casas et al., 2015).
폴리페놀은 식물계에서 발견되는 2차 대사산물 중 하나로 한 개 또는 두 개 이상의 수산기로 치환된 방향족 환을 가지고 있고, 이러한 특징은 활성 산소를 유발하는 자유 라디칼을 억제하면서 항산화 효과를 나타낸다 (Lee et al., 2013).
OCWE의 총 폴리페놀의 함량은 33.06 ± 0.31 ㎎ · GAE/g으로 측정되었으며 DPPH 라디칼 소거 활성, ABTS 라디칼 소거활성, 환원력 검증에서 농도 의존적으로 항산화 효과를 확인되었다 (Table 3, 4). 이는 대표적인 합성 항산화제로 사용되는 BHA, AA의 효과와 비교하였을 때 ABTS 라디칼 소거활성, 환원력 평가에서는 60%의 준하는 효과로 확인되었다 (Table 3, 4).
천연물에서 대표적으로 확인되는 폴리페놀인 3-CQA와 Ellagic acid의 함량을 OCWE에서 확인하였으며 3-CQA의 함량은 3.19 ± 0.09 ㎎/g, Ellagic acid의 함량은 1.07 ± 0.12 ㎎/g으로 분석되었다 (Fig. 4, Table 5). 3-CQA는 미세아교세포에서 지질다당류로 인한 종양 괴사 인자 생산을 조절하는 기전으로 ROS를 억제하여 항산화, 항염증 및 신경 흥분독성 완화의 특성을 나타낸다고 보고되었다 (Socodato et al., 2015). Ellagic acid는 생화학적 수준에서 IL-6, TNF-α와 같은 염증성 매개체를 조절하는 효능을 포함하여 NF-κB 작용을 억제, 자유 라디칼 소거, 철 킬레이트화, 여러 세포 신호 전달 경로의 개시 및 미토콘드리아 기능 장애의 완화 등의 효능으로 신경세포 보호 활성을 가지는 것으로 보고되고 있다 (Gupta et al., 2021).
한편 Dighe 등 (2016)에 의하면 괭이밥 잎을 벤진으로 추출하였을 때 항산화 능력이 뛰어난 β-sitosterol이 다량 추출되었다고 보고했으며, 분리된 β-sitosterol은 마우스의 발에서 부종 억제 및 생리활성 펩타이드인 브래디키닌 (Bradykinin)을 조절함으로써 항염증 효과를 낸다고 보고하였다 (Dighe et al,, 2016).
Sakat (2010)등의 논문에 따르면 200 ㎍/㎖ 농도에서 괭이밥 메탄올 추출물의 총 폴리페놀 함량은 25.62 ± 0.10 ㎎ · GAE/g으로 나타났으며, 본 연구에서 OCWE의 총 폴리페놀의 함량은 33.06 ± 0.31 ㎎ · GAE/g으로 더 높게 측정 되었다. DPPH 라디칼 소거 활성, ABTS 라디칼 소거 활성의 경우 괭이밥 메탄올 추출물의 결과는 IC50 값이 302.93 ± 4.17 ㎍/㎖, 73.07 ± 8.28 ㎍/㎖로 확인되었으며 (Saka et al., 2010), Sowmya과 Nivedhitha (2021)의 논문에 따르면 괭이밥 에탄올 추출물에서의 DPPH 라디칼 소거 활성에서 IC50 값은 113.37 ㎍/㎖으로 매우 우수한 것으로 보고 하였다.
ROS가 가져오는 산화적 스트레스는 염증 반응에도 영향을 미치며, 활성 산소에 의해 손상되어진 대식세포는 TNF-α, IL-6와 같은 염증성 사이토카인의 분비를 초래하고 (Kim et al., 2012), 산화적 스트레스는 NF-κB의 활성화를 통하여 염증성 사이토카인의 과분비를 유도하여 만성 염증 증상을 일으키고 지속적인 만성 염증 증상은 죽상 동맥 경화증, 암, 치매 등의 원인이 된다 (Liu et al., 2018). 염증은 체내 방어기전 중 하나이나 만성적이고 과도한 면역반응은 오히려 염증 반응을 심화시켜 세포나 조직의 기능장애나 유전적 변이를 유도하며 많은 질병의 원인이 되는 것으로 보고되고 있다 (Lee et al., 2022).
LPS에 의해 대식세포를 자극하면 여러 신호전달 경로를 통해 iNOS, COX-2가 유발되고 이는 nitric oxide (NO)와 염증성 사이토카인의 증가를 유발한다. OCWE의 항염증 효능을 평가하기 위해 LPS로 유발되어진 RAW264.7 cell을 이용하여 염증 인자를 저해하는지 확인하였다. OCWE은 400 ㎍/㎖에서 세포 생존율이 80% 이상으로 유지되었고 NO 생성량 확인을 위해 400 ㎍/㎖이하로 고정하여 실험에 사용하였다 (Fig. 1A).
NO의 생성은 iNOS에 의해 생성되며 과다한 iNOS의 증가 및 NO의 생성은 조직손상, 폐혈성 쇼크, 세포자멸사 등 다양한 유해반응을 유발한다 (Ren and Chung, 2007; Kim et al., 2018). COX-2의 과발현은 악성 종양에서 많이 발견되며 항암의 화학요법 및 방사선 요법에 내성을 촉진하는 인자로 알려져 있다 (Goradel et al., 2019). 또 IL-6의 과발현은 급성 전신 염증 증후군 및 만성 면역 매개 질환에 병리학적으로 영향을 미치며 류마티스 관절염, 소아 특발성 관절염의 병을 유발할 수 있다 (Tanaka et al., 2018). 심지어 TNF-α의 과발현은 열, 부종, 통증 등을 일으키고 더 나아가 미세혈관의 혈전, 심장 박출량 억제, 비만. 당뇨병의 유발 및 정신적인 우울장애에도 영향을 미친다고 알려져 있다 (Tzanavari et al., 2010; Ma et al., 2016; Lee et al., 2020).
본 연구에서 OCWE은 NO 생성을 저해하였으며 (Fig. 1B), 또한 OCWE를 400 ㎍/㎖의 농도로 처리한 경우, LPS 처리에 의해 증가된 iNOS, COX-2, IL-6, TNF-α의 mRNA의 발현을 45.41 ± 7.9%, 31.95 ± 5.16%, 37.24 ± 0.65%, 18.44 ± 0.76%의 수준으로 감소시켰다 (Fig. 2). 또한, 단백질의 발현에 있어서도 LPS 처리에 의해 증가된 iNOS, COX-2, IL-6, TNF-α의 단백질 발현을 31.61 ± 6.20%, 50.78 ± 9.00%, 31.74 ± 7.31% 35.42 ± 6.16% 수준으로 저해하였다 (Fig. 3). 이는 OCWE가 iNOS, COX-2과 같은 염증 매개 물질과 IL-6, TNF-α와 같은 사이토카인을 감소시킴으로써 항염증 효과와 더불어 만성 염증 및 급성 염증 반응과 연관되어 있는 다양한 질환에서 활용가능하다는 것을 시사한다.
Sakat (2010)등에 의하면 마우스의 간조직에서 괭이밥 (Oxalis corniculata) 메탄올 추출물은 염증의 원인이 되는 단백질 변성 및 적혈구 막 안정화를 억제하는 것으로 보고하였다 (Sakat et al., 2010). 또한 Juvekar (2009)등에서는 괭이밥 메탈올 추출물을 경구 투여 하였을 때 카라기난 (Carrageenan)으로 유도된 부종을 감소시켰으며, 대식세포의 덩어리인 육아종을 감소시키는 것으로 확인되었다 (Juvekar et al., 2009).
본 연구에서 실험된 항염증 지표에 대한 괭이밥 전초 열수 추출물 (OCWE)의 저해 효과는 괭이밥 전초의 항염증 소재로서의 활용을 위한 기초 연구로 제공되어 질 수 있을 것이며 향후 동물실험으로의 연구 확산, 또 가공, 추출 및 제품화 등의 다양한 방면에서 연구가 필요할 것으로 사료된다.
또한 괭이밥 전초가 가지는 항산화 및 항염증 효능과 함께 효능을 나타내는 활성본체로서의 유효 지표 성분인 3-CQA, ellagic acid의 함량 등의 상관관계에 대한 연구, 효능 지표성분으로 생각되는 β-sitosterol를 타겟으로 한 추가 연구, 괭이밥 전초에 대한 다양한 염증 지표들의 발현 및 발생의 관여하는 전사 인자 및 단백질들에 대한 검증 및 기능성 성분 분리 등의 추가 연구가 필요할 것으로 생각된다.
Acknowledgments
본 연구는 2022년 바이오산업 국제교류협력지원사업(춘천시)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Alessandro R, Maurizio P, Federica N, Mariusz RW and Paolo P. (2016). Mitochondrial reactive oxygen species and inflammation: Molecular mechanisms, diseases and promising therapies. International Journal of Biochemistry and Cell Biology. 81:281-293.
[https://doi.org/10.1016/j.biocel.2016.06.015]

-
Blois MS. (1958). Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200.
[https://doi.org/10.1038/1811199a0]

- Borah A, Yadav RN and Unni BG. (2012). Evaluation of antioxidant activity of different solvent extracts of Oxalis corniculata L. Journal of Pharmacy Research. 5:91-93.
-
Casas AI, Dao T, Daiber A, Maghzal GJ, Di Lisa F, Kaludercic N, Leach S, Cuadrado A, Jaquet V, Seredenina T, Krause KH, López MG, Stocker R, Ghezzi P and Schmidt HHHW. (2015). Reactive oxygen-related diseases: Therapeutic targets and emerging clinical indications. Antioxidant and Redox Signaling. 23:1171-1185.
[https://doi.org/10.1089/ars.2015.6433]

-
Chen L, Deng H, Cui H, Fang J, Zuo Z, Deng J, Li Y Wang X and Zhao L. (2018). Inflammatory responses and inflammation-associated diseases in organs. Oncotarget. 9:7204-7218.
[https://doi.org/10.18632/oncotarget.23208]

-
Cho ML, Lee DJ and You SG. (2012). Radical scavenging activity of ethanol extracts and solvent partitioned fractions from various red seaweeds. Ocean and Polar Research. 34:445-451.
[https://doi.org/10.4217/OPR.2012.34.4.445]

-
Das K and Roychoudhury A. (2014). Reactive oxygen species(ROS) and response of antioxidants as ROS-scavengers during environmental stress in plants. Frontiers in Environmental Science. 2:53. https://www.frontiersin.org/articles/10.3389/fenvs.2014.00053/full, (cited by 2022 Sep 1).
[https://doi.org/10.3389/fenvs.2014.00053]

- Dighe SB, Kuchekar BS and Wankhede SB. (2016). Analgesic and anti-inflammatory activity of β-sitosterol isolated from leaves of Oxalis corniculata. International Journal of Pharmaceutical Research. 6:109-113.
-
Folin O and Denis W. (1912). On phosphotungstic-phophomolybdic compounds as color reagents. Journal of Biological Chemistry. 12:239-243.
[https://doi.org/10.1016/S0021-9258(18)88697-5]

-
Goradel HN, Najafi M, Salehi E, Farhood B and Mortezaee K. (2019). Cyclooxygenase-2 in cancer: A review. Journal of Cellular Physiology. 234:5683-5699.
[https://doi.org/10.1002/jcp.27411]

-
Gupta A, Singh AK, Kumar R, Jamieson S, Pandey AK and Bishayee A. (2021). Neuroprotective potential of ellagic acid: A critical review. Advances in Nutrition. 12:1211-1238.
[https://doi.org/10.1093/advances/nmab007]

-
Juvekar A, Sakat S, Wankhede S, Juvekar M and Gambhire M. (2009). Evaluation of antioxidant and anti-inflammatory activity of methanol extract of Oxalis corniculata. Planta Medica. 75:PJ178.
[https://doi.org/10.1055/s-0029-1234983]

-
Kalavati S and Patil SB. (2007). Antiimplantation and abortifacient activities of Oxalis corniculata in albino rats. Nigerian Journal of Natural Products and Medicine. 11:58-60.
[https://doi.org/10.4314/njnpm.v11i1.11883]

-
Kim CW, In MJ and Kim DC. (2015). In vitro antioxidant activity of ethanol extract from Boehmeria nivea L. leaves. Food Engineering Progress. 19:76-81.
[https://doi.org/10.13050/foodengprog.2015.19.1.76]

- Kim JW, Gim SB, Oh JM, Yun MY, Lee KM and Kim DH. (2012). Effect of CHT in anti-oxidative and anti-inflammatory related factors. Journal of Haehwa Medicine. 20:29-39.
-
Kim MS, Kim NS, Kwon J, Kim HR, Lee DY, Oh MJ, Kim HJ, Lee CH and Oh CH. (2018). Anti-inflammatory and immune regulatory effects of Aucklandia lappa Decne 70% ethanol extract. Korean Journal of Medicinal Crop Science. 26:8-18.
[https://doi.org/10.7783/KJMCS.2018.26.1.8]

-
Kwon DJ, Sung MJ, Youn GS, Choi SY and Park JS. (2013). Suppression of iNOS and COX-2 expression by flavokawain A via blockade of NF-κB and AP-1 activation in RAW264.7 macrophages. Food and Chemical Toxicology. 58:479-486.
[https://doi.org/10.1016/j.fct.2013.05.031]

-
Lee CY, Kim KM and Son HS. (2013). Optimal extraction conditions to produce rosemary extracts with higher phenolic content and antioxidant activity. Korean Journal of Food Science and Technology. 45:501-507.
[https://doi.org/10.9721/KJFST.2013.45.4.501]

-
Lee EJ, Lee DB, Song BN, Park BR, Lee SH, Choi JH and Park SY. (2020). Physicochemical properties and anti-inflammatory effects of Astragalus membranaceus(Fisch.) Bunge fermented by Aspergillus awamori. Korean Journal of Medicinal Crop Science. 28:347-353.
[https://doi.org/10.7783/KJMCS.2020.28.5.347]

-
Lee KM, Choi BM, Park TJ, Hong HH and Kim SY. (2022). Anti-inflammatory effect of Crypsinus hastatus biorenovation extract. Journal of Applied Biological Chemistry. 65:49-55.
[https://doi.org/10.3839/jabc.2022.007]

-
Liu W, Li J, Zhang X, Zu Y, Yang Y, Liu W, Xu Z, Gao H, Sun X, Jiang X and Zhao Q. (2020). Current advances in naturally occurring caffeoylquinic acids: Structure, bioactivity, and synthesis. Journal of Agricultural and Food Chemistry. 68:10489-10516.
[https://doi.org/10.1021/acs.jafc.0c03804]

-
Liu Z, Ren Z, Zhang J, Chuang CC, Kandaswamy E, Zhou T and Zuo L. (2018). Role of ROS and nutritional antioxidants in human diseases. Frontiers in Physiology. 9:477. https://www.frontiersin.org/articles/10.3389/fphys.2018.00477/full, (cited by 2022 Sep 1).
[https://doi.org/10.3389/fphys.2018.00477]

-
Ma K, Zhang H, Baloch Z. (2016). Pathogenetic and therapeutic applications of tumor necrosis factor-α(TNF-α) in major depressive disorder: A systematic review. International Journal of Molecular Sciences. 17:733. https://www.mdpi.com/1422-0067/17/5/733, (cited by 2022 Sep 1).
[https://doi.org/10.3390/ijms17050733]

-
Medzhitov R. (2010). Inflammation 2010: New adventures of an old flame. Cell. 140:771-776.
[https://doi.org/10.1016/j.cell.2010.03.006]

-
Nathan C and Aihao D. (2010). Nonresolving inflammation. Cell. 140:871-882.
[https://doi.org/10.1016/j.cell.2010.02.029]

-
Oyaizu M. (1986). Studies on products of browning reaction: Antioxidant activities of products of browning reaction prepared from glucosamine. The Japanese Journal of Nutrition and Dietetics. 44:307-315.
[https://doi.org/10.5264/eiyogakuzashi.44.307]

- Park JH and Kim JM. (2001). Pharmacognostical studies on the folk medicine ‘Koaeng I Bab’. Korean Journal of Pharmacognosy. 32:233-237.
- Park MK, Cho SH, Ahn TK, Kim DH, Kim SY, Lee JW, Kim JI, Seo EW, Son KH and Lim JH. (2020). Immunomodulatory effects of β-sitosterol and daucosterol isolated from Dioscorea batatas on LPS-stimulated RAW264.7 and TK-1 cells. Journal of Life Science. 30:359-369.
-
Poljsak B, Šuput D and Milisav I. (2013). Achieving the balance between ROS and antioxidants: When to use the synthetic antioxidants. Oxidative Medicine and Cellular Longevity. 2013:956792. https://www.hindawi.com/journals/omcl/2013/956792, / (cited by 2022 Sep 1).
[https://doi.org/10.1155/2013/956792]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M and Rice-Evans C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine. 26:1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Ren J and Chung SH. (2007). Anti-inflammatory effect of α-linolenic acid and its mode of action through the inhibition of nitric oxide production and inducible nitric oxide synthase gene expression via NF-κB and mitogen-activated protein kinase pathways. Journal of Agricultural and Food Chemistry. 55:5073-5080.
[https://doi.org/10.1021/jf0702693]

- Sakat S, Juvekar A and ambhire N. (2010). In vitro antioxidant and anti-inflammatory activity of methanol extract of Oxalis corniculata Linn. International Journal of Pharmacy and Pharmaceutical Sciences. 2:146-155.
-
Socodato R, Portugal CC, Canedo T, Domith I, Oliveira NA, Paes-de-Carvalho R, Relvas JB and Cossenza M. (2015). c-Src deactivation by the polyphenol 3-O-caffeoylquinic acid abrogates reactive oxygen species-mediated glutamate release from microglia and neuronal excitotoxicity. Free Radical Biology and Medicine. 79:45-55.
[https://doi.org/10.1016/j.freeradbiomed.2014.11.019]

-
Sowmya and Nivedhitha MS. (2021). Evaluation of antioxidant activity of Oxalis Corniculata-an in vitro study. International Journal of Dentistry and Oral Science. 8:3620-3623.
[https://doi.org/10.19070/2377-8075-21000740]

- Sreejith G, Jayasree M, Latha PG, Suja SR, Shyamal S, Shine VJ, Anuja GI, Sini S, Shikha P, Krishnakumar NM, Vilash V, Shoumya S and Rajasekharan S. (2014). Hepatoprotective activity of Oxalis corniculata L. ethanolic extract against paracetamol induced hepatotoxicity in Wistar rats and its in vitro antioxidant effects. Indian Journal of Experimental Biology. 52:147-152.
- Srikanth M, Swetha T and Veeresh B. (2012). Phytochemistry and pharmacology of Oxalis corniculata Linn.: A review. International Journal of Pharmaceutical Sciences and Research. 3:4077-4085.
-
Tanaka T, Narazaki M and Kishimoto T. (2018). Interleukin(IL-6) immunotherapy. Cold Spring Harbor Perspectives in Biology. 10:a028456. https://cshperspectives.cshlp.org/content/10/8/a028456.short, (cited by 2022 Sep 1).
[https://doi.org/10.1101/cshperspect.a028456]

-
Tian Y, Zhou S, Takeda R, Okazaki K, Sekita M and Sakamoto K. (2021). Anti-inflammatory activities of amber extract in lipopolysaccharide-induced RAW264.7 macrophages. Biomedicine and Pharmacotherapy. 141:111854. https://www.sciencedirect.com/science/article/pii/S0753332221006363, (cited by 2022 Sep 1).
[https://doi.org/10.1016/j.biopha.2021.111854]

-
Tzanavari T, Giannogonas P and Karalis KP. (2010). TNF-α and obesity. TNF Pathophysiology. 11:145-156.
[https://doi.org/10.1159/000289203]

-
Wei S, Yang D, Yang J, Zhang X, Zhang J, Fu J, Zhou G, Liu H, Lian Z and Han H. (2019). Overexpression of Toll-like receptor 4 enhances LPS-induced inflammatory response and inhibits Salmonella typhimurium growth in ovine macrophages. European Journal of Cell Biology. 98:36-50.
[https://doi.org/10.1016/j.ejcb.2018.11.004]

