
천궁에서 미나리총채벌레의 우점과 날개형 분석
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The study aimed to investigate its wing forms and dominant species of thrips inflicting C. officinale.
T. nigropilosus was collected by the biting method in a total 17 different cultivation sites during 2020 - 2022 and the species was identified by stereo microscope. A Total eight species including T. nigropilosus, T. tabaci, Haplothrips chinensis, Frankliniella intonsa, T. palmi, Microcephalothrips abdominalis, F. occidentalis and Anaphothrips obscurus were identified in four and thirteen cultivation sites in 2020 and 2022, respectively. T. nigropilosus was the more abundant species than T. tabaci. Their wing form was divided into macropterous (long-winged) and brachypterous (short-winged) and the macropterous individuals were dominant than brachypterous.
The dominant species is chrysanthemum thrips, Thrips nigropilosus and it has two wing forms discriminated as macropterous and brachypterous.
Keywords:
Cnidium officinale Makino, Thrips nigropilosus Uzel, Brachypterous, Chrysanthemum thrips, Macropterous, Wing Forms서 언
산형과 (Family Umbelliferae)의 다년생 식물인 천궁 (Cnidium officinale Makino)은 중국 원산으로 중국과 일본 및 국내에서 재배하고 있으며 일본을 거쳐 국내로 들여온 것으로 알려져 있다 (Kim et al., 2012; Iwai et al., 2023).
현재 국내 재배지는 강원특별자치도 (평창군, 삼척시, 정선군, 태백시, 영월군), 경상북도 (봉화군, 영양군, 울진군) 및 경상남도 (거창군) 지역이다. 재배자들은 천궁의 이어짓기가 어렵거나 안 된다는 사실을 알고 있지만, 타 작물과 비교하여 수익성이 높다고 생각하여 매년 재배지를 옮겨 재배하고 있다. 2020년 천궁 생산량과 생산액은 1,123 톤과 312 억원이었고 2021년은 1,268 톤과 242 억원으로 생산량은 다소 증가하였으나 생산액은 감소하였다 (KFS, 2022).
천궁은 다년생 식물로 지하부 근경을 건조, 절단 후 약재로 사용한다 (Oh et al., 2010). 진경, 진정, 혈압 강하, 혈관 확장, 항균, 항진 작용 그리고 비타민 E, 결핍증 치료 등의 효능이 알려져 있다 (Lee et al., 2002).
천궁을 가해하는 여러 해충 중 총채벌레류 발생과 관련하여 농촌진흥청 농업기술연구소 (ATRI, 1994)는 파총채벌레 (Thrips tabaci)를 보고하였고 Jung 등 (2019)은 꽃노랑총채벌레 (Frankliniella occidentalis), 대만총채벌레 (F. intonsa), 파총채벌레, 미나리총채벌레 (T. nigropilosus), 볼록총채벌레 (Scirtothrips dorsalis) 및 대관령총채벌레 (Anaphothrips obscurus) 6 종을 확인하였다.
Chrysanthemum thrips 또는 pyrethrum thrips라고 부르는 미나리총채벌레는 유럽이 원산지이지만 전 세계의 온대지역에 분포하는 광식성 해충이다 (Nakahara, 1993). 케냐의 Tanacetum cinerartifolim (Trevir)에서 대규모로 발생하여 피해를 준 것이 첫 보고 (Glynne and Sylvester, 1966)이며 미국, 영국 및 일본에서는 국화 (Chrysanthemum morifolium Ramat)의 주요 해충으로 보고되어 있다 (Stannard, 1968; Mound et al., 1976; Ganahara-Kikumura et al., 2012). 국화과 (Asteraceae family) 식물을 선호하며 잎을 자주 가해한다 (Kucharczyk et al., 2019).
국화에서는 거무스름한 배설과 함께 탈색으로 인해 화훼의 품질이 크게 나빠진다 (Ganahara-Kikumura et al., 2012). 또한, 제충국에서는 어린잎보다는 성숙한 잎을 보다 집중적으로 가해함에 따라 식물체의 활력과 광합성 능력을 매우 감소시켜 생산성을 떨어뜨린다 (Bullock, 1965). 형태적으로는 파총채벌레 또는 T. urticae와 비슷하다 (Masumoto and Okajima, 2013).
천궁을 가해하는 여러 총채벌레류를 보고하였으나 현재까지 우점종에 관한 정보는 없는 실정이다. 본 연구는 국내 천궁 주산지에서 미나리총채벌레가 우점종임을 확인하였고 그 날개형 조사 결과를 처음으로 보고하고자 한다.
재료 및 방법
1. 총채벌레류 포획
천궁을 가해하는 총채벌레류는 전라북도의 진안군, 경상북도의 영주시, 영양군, 강원특별자치도의 태백시, 영월군, 정선군, 평창군, 충청북도의 제천시 등 8 지역 18 재배지에서 포획하였다 (Table 1). 2020년 포획은 7월 21일부터 9월 1일까지였고 2022년은 7월 20일부터 8월 28일까지였다.
총채벌레류 포획은 천궁 잎에 있는 이슬이 사라진 오후에 진행하였다. 재배지별로 천궁 10 개체를 임의로 선택하여 잎에서 피해 흔적의 육안조사 및 루페 (10 ×, GWJ Company, Bermuda Dunes, CA, USA)로 존재 여부를 확인한 후 20 ㎝ × 40 ㎝의 알루미늄 밧드에 A4 종이를 고정시킨 다음 천궁 줄기 아래에 두고 줄기를 10 번 이상 흔들어 총채벌레류가 밧드 위로 떨어지도록 하였다.
총채벌레류의 유무를 확인한 후 빠른 시간에 포획하기 위해에어필터식 흡충기 (SL13014, Shinil Science Inc., Paju, Korea)를 사용하였다. 흡충기는 3 부분으로 구성되어 있는데 총채벌레를 흡입할 수 있는 스테인리스 흡입관과 총채벌레류를 모을 수 있는 drum vial (Ø26 × H67 ㎜), 그리고 총채벌레류가 drum vial 안으로 흡입될 수 있도록 입 속에서 공기를 빨아 당길 수 있는 작은 플라스틱 관이 부착되어 있다.
총채벌레류가 포획된 drum vial에 70%의 에탄올 20 ㎖ 씩을 투입하여 바로 치사시켰다. 에탄올이 들어간 drum vial을 실험실로 가져와 실체현미경 (S8 APO, Leica Microsystems GmbH, Wetzlar, Germany)을 이용하여 간이 동정하였다. 정확한 분자 동정을 위해 개체별로 번호를 표시한 후 마이크로 튜브 (MCT-150-C-S, Corning Inc., Corning, NY, USA)에 담아 –20℃ 냉동고 (F-A201GDW, LG Electronics Inc., Seoul, Korea)에 보관하였다.
2. 유전자 마커를 활용한 교차검증
경상북도 영양군 B 재배지 포획 개체 (대만총채벌레 4 마리)와 C 재배지 포획 개체 (미나리총채벌레 8 마리, 꽃노랑총채벌레 4 마리, 파총채벌레 4 마리) 등 총 20 마리를 임의로 선택한 다음 DNeasy genomic DNA Extraction kit (QIAGEN GmbH, Hilden, Germany)을 이용하여 제조사의 제시방법에 따라 개별 개체에서 gDNA를 추출하였다.
200 ㎕의 Lysis 용액에 총채벌레 개체 1 마리씩 넣고 플라스틱 페슬 (F19923-0000, Bel-Art Products Inc., Wayne, NJ, USA)로 조직을 마쇄한 후 56℃에서 30 분 동안 DNA의 추출을 유도하였다. 플라스틱 페슬은 총채벌레에서 DNA을 추출하기 위해 사용하였다. 그런 다음 DNA binding 칼럼을 이용하여 원심분리기 (DH.WCF00010, Daihan Scientific Co., Ltd., Wonju, Korea)를 통해 gDNA를 분리하였다. 그 후 Washing buffer인 AW1과 AW2 buffer를 넣어 잔여 불순물을 제거하고 Elution buffer를 이용하여 gDNA을 분리하였다. 분리한 시료는 PCR 전까지 –20℃ 냉동고 (F-A201GDW, LG Electronics Inc., Seoul, Korea)에서 보관하였다.
미토콘드리아 영역 유전자 중 표적 유전자의 증폭은 50 ㎕에 10 mM dNTP, 5 µM의 프라이머 (LCO: GGTCAACAAATCATAAGATATTGG, HCO: TAAACTTCAGGGTGACCAAAAATCA), 4 ㎕ gDNA, 그리고 1 ㎕ DNA Taq Polymerase (GeneAll Biotechnology Co., Ltd., Seoul, Korea)을 이용하여 증폭하였다. Polymerase chain reaction (PCR) 장비는 MiniAmpTM Plus Thermal Cycler (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 사용하였으며 PCR 조건은 95℃에서 30 초, 53℃에서 30 초, 그리고 72℃에서 120 초 과정을 35 회 증폭한 후 마지막으로 72℃에서 10 분간 extension을 실시하였다.
PCR 결과 산물 5 ㎕를 2% agarose gel에 전기영동으로 전개시켜 증폭 여부를 확인한 후, 남은 PCR 결과산물을 Qiaquick PCR Purification Kit (QIAGEN GmbH, Hilden, Germany)를 이용하여 정제하였다. 정제한 PCR 증폭산물은 마크로젠 (MACROGEN, Seoul, Korea)에 의뢰하여 염기서열 분석을 진행하였다. 분석한 염기서열은 National Center for Biotechnology Information (NCBI, Bethesda, MD, USA)에 등록된 총채벌레류들의 mitochondrial cytochrome oxidase I 부분 염기서열과 nucleotide BLAST (blastn, https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome) 분석 후 유사도가 가장 높은 종을 찾아 확인하였다.
3. 통계분석
지역별로 포획한 미나리총채벌레 개체수를 날개형에 따라 장시형과 단시형으로 구분하였고 R software (ver. 4.2.0, www.r-project.org, Vienna, Austria)를 이용하여 Steel-Dwass test (Steel, 1961)로 두 날개형 간의 유의수준을 비교하였다.
결과 및 고찰
1. 천궁 재배지별 포획 총채벌레류의 형태적 종 구분
2020년 2 지역 4 재배지 (영양군 3, 태백시 1)와 2022년 6 지역 13 재배지 (진안군 2, 영주시 2, 영양군 2, 태백시 1, 영월군 1, 정선군 3, 제천시 1, 평창군 1) 등 8 지역 17 재배지에서 포획하였다.
2020년 4 재배지와 2022년 13 재배지에서는 미나리총채벌레, 파총채벌레, 중국관총채벌레 (Haplothrips chinensis), 대만총채벌레, 오이총채벌레 (T. palmi), 좀머리총채벌레 (Microcephalothrips abdominalis), 꽃노랑총채벌레 및 대관령 총채벌레 등 8 종을 포획하였고 포획수에서는 미나리총채벌레가 가장 많았고 그 다음이 파총채벌레였으며 다른 6 종 중에서는 꽃노랑총채벌레, 대만총채벌레였다. 조사한 15 재배지의 우점종은 미나리총채벌레였으나, 2022년 강원 정선 B 재배지와 평창 재배지의 우점종은 파총채벌레였다.
천궁 재배지에서는 미나리총채벌레가 우점하고 파총채벌레가 다발생하고 있음을 확인하였으며 오이총채벌레, 중국관총채 벌레 및 좀머리총채벌레 3 종을 추가로 동정하였다 (Table 2).
Jung 등 (2019)은 두 작물 (천궁과 토천궁)의 각 1 재배지에서 총채벌레류 종별 포획비율을 분석한 결과 두 작물에서 많이 포획된 종은 대만총채벌레, 꽃노랑총채벌레 또는 꽃노랑총채벌레, 대만총채벌레였고 그 다음이 미나리총채벌레였다고 보고하였다. 이러한 결과를 고려하면 포획 연도와 포획 지역 및 포획 개체 수에서도 차이를 나타낸다는 것을 확인할 수 있었으며 본 조사의 결과를 통해 국내 천궁 재배지의 발생종과 우점종 및 우점종의 날개형 정보를 제공할 수 있다는 것을 확인하였다.
총채벌레류 중 몇몇 종은 현재 식물바이러스를 매개하는 것으로 알려져 있다. 토마토에서는 꽃노랑총채벌레가 토마토반점위조바이러스 (TSWV, tomato spotted wilt virus)를 전파하며 (Gilbertson et al., 2015), 고추에서 TSWV의 파총채벌레 체내 증식 여부를 알아보기 위해 RT-qPCR로 시기별 바이러스 농도를 분석하였고 유충에서 성충으로 발육하는 동안 최소 2 회의 바이러스 농도 증가 피크를 확인하였다. 이 결과는 고추에서 국내 서식 파총채벌레의 TSWV 매개 능력 보유를 제시하고 있다 (Kim et al., 2023).
천궁에서 Yoo 등 (2015)은 천궁엽맥황화바이러스 (CnVYV, cnidium vein yellowing virus-1, 2), Honma 등 (2019)은 천궁바이러스 X (CnX, cnidium virus X), Igori 등 (2020)은 소철괴사위축바이러스 (CNSV, cycas necrotic stunt virus), Belete 등 (2022)은 천궁바이러스 1 (CnV1, cnidium virus 1), Gudeta 등 (2022)은 CnClV1 (cnidium closterovirus 1), Chung 등 (2022)과 Lee 등 (2023)은 사과줄기홈바이러스 (ASGV, apple stem grooving virus), Park 등 (2023a, 2023b)은 각각 CnPV1 (cnidium polerovirus 1)과 천궁 바이러스 2 (CnV2, cnidium virus 2) 등을 보고하였다. 고추의 파총채벌레 결과로 추정해 볼 때 미나리총채벌레의 천궁 바이러스 매개 가능성을 예상할 수 있다.
2. 천궁 재배지 발생 주요 종의 유전자 마커 기반 종 구분을 통한 교차검증
형태적 종 동정 결과의 정확성을 유전자 마커로 교차검증하였다. 2020년 7월 21일 경상북도 영양군의 B와 C 재배지에서 포획하여 육안 동정한 미나리총채벌레, 꽃노랑총채벌레, 파총채벌레, 대만총채벌레 등 4 종을 대상으로 분석한 결과 B재배지의 대만총채벌레 4 마리는 모두 대만총채벌레로 동정되었고 상동성은 99.7%였다.
C 재배지의 미나리총채벌레 8 마리 또한 모두 미나리총채벌레로 동정되었으며 상동성은 98.4%였다. 꽃노랑총채벌레 4 마리 중 2 마리는 꽃노랑총채벌레로 동정되었고 상동성은 99.7%와 100.0%였으며 1 마리는 파총채벌레로 100.0%의 상동성을 나타냈다. 나머지 1 마리는 시료 오염으로 제외하였다. 파총채벌레 4 마리는 모두 파총채벌레로 동정되었고 100.0%의 상동성을 나타냈다. 요약하면 NCBI에 등록된 유전자 정보와 총채벌레 19 마리의 상동성은 98.4 - 100.0%이며 형태 동정의 정확도는 약 95%인 것으로 나타났다 (Table 3).
3. 미나리총채벌레의 날개형 구분
2020년과 2022년 비슷한 시기에 전체 15 재배지에서 포획하여 동정한 미나리총채벌레는 모두 장시형이 우점하는 것으로 나타났다 (Fig. 1 and Fig. 2). 2020년 결과에서 장시형은 60.0% - 94.3%, 단시형은 5.7% - 43.5%를 나타냈고 (Fig. 2A) 2022년 결과에서 장시형은 69.2% - 94.8%, 단시형은 5.2% - 30.8%를 나타냈다 (Fig. 2B).

Wing comparison between macropterous (A) and brachypterous (B) of Thrips nigropilosus under 80 × magnification of the stereo microscope.The red dashed oval means macropterous wing. This species was collected in Cnidium officinale cultivation site of Taebaek, Gangwon State on 28, August 2020.
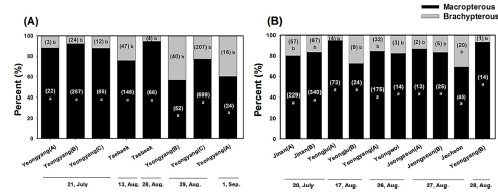
The wing forms difference of Thrips nigropilosus caught in Cnidium officinale cultivation sites.T. nigropilosus was caught by the biting method in ten plants per plot. The collection periods are from 21, July to 1, Sep., 2020 in four sites (A) and from 20, July to 28, Aug., 2022 in ten sites (B), respectively. The parentheses in the bar graph mean the numbers of caught. “a” and “b” indicate significant differences as determined by the Steel-Dwass test using R software (p < 0.05).
날개 다형성 (wing polymorphism)은 곤충에서 흔한 현상으로 일부 곤충에서 날개형은 단순 유전조절 (genetic control) 또는 폴리진 (polygenic)의 영향을 받는다 (Roff, 1986). 완전 변태류의 날개형은 1 쌍의 대립유전자가 지배하는 종이 많고, 불완전변태류에서는 폴리진이 지배하는 종이 많다 (Roff and Fairbairn, 1991). 총채벌레류는 불완전변태류에 속하고 완전변태류와 불완전변태류의 중간 성질을 가지고 있다 (Mound and Marullo, 1996). 날개 다형성이 있는 총채벌레류는 일반적으로 발육기간 중에 겪는 환경조건으로 인해 날개형이 결정되는 것으로 추정하고 있다 (Ananthakrishnan, 1984).
미나리총채벌레의 날개형은 암수 성충 모두에서 발생하지만 수컷은 단시형을 (Morison, 1957), 암컷은 3 종류 날개형 (장시형, 중간형 및 단시형)을 가진다 (Nakao, 1993). 장시형은 정상적인 앞날개와 뒷날개를 가지고 있지만, 단시형은 뒷날개가 줄어들었거나 없는 형태이다. 암컷의 날개형 결정과 관련된 주요 환경요인으로 광주기, 온도 및 먹이식물을 제시하였다. 알에서 유충 말기까지의 단일 (short-day)은 단시형을, 장일 (long-day)은 장시형 발생을 촉진시킨다. 단일은 일반적으로 암컷의 생식휴면 유도효과가 있고 고온은 단시형의 발생을 억제하는 것으로 알려져 있다 (Nakao, 1994).
대관령총채벌레 또한 미나리총채벌레와 마찬가지로 3 가지 날개형이 있으며 광주기, 기주식물의 품질 및 개체군 밀도와 환경조건에 따라 달라질 수 있다고 하였다. 단일에서 대관령 총채벌레 암컷의 단시형 비율이 증가한다고 하였고 온도는 대관령총채벌레의 날개형성에 영향이 없다고 제시하였다 (Kamm, 1972). 암컷의 날개형은 최소한 부화 직전 또는 직후의 광주기에 영향을 받는다고 하였다 (Köppä, 1970). 다른 총채벌레인 Haplothrips karnyi의 날개형도 일장, 온도 및 서식밀도 등의 환경조건에 따라 결정된다고 알려져 있다 (Crespi, 1988).
이와 더불어 날개형의 계절적 변이가 일부 총채벌레목에서 자주 나타난다. 대관령총채벌레, T. angusticeps, T. dilatatus, T. discolor, F. fusca, F. iridis, Platythrips tnicatus 및 Sericothrips abnormis에서 단시형의 비율이나 무시형 암컷은 추운 계절에 높다고 하였다 (Mound et al., 1976).
쑥 (Artemisia princeps) 또한 미나리총채벌레의 기주식물로 알려져 있고 쑥에서 성충은 연중 발생하며 암컷의 단시형 비율은 겨울철에 높았고 장시형은 봄철에 높았다고 하였다 (Nakao et al., 1997). 10월 하순부터 3월까지 성충으로 탈피한 암컷 대부분은 단시형이었고 다른 시기에 성충으로 탈피한 성충은 장시형이라고 하였다. 이 결과는 미나리총채벌레가 성충으로 월동하며 월동암컷 대부분은 단시형임을 제시한다 (Nakao et al., 1997).
2년 간의 미나리총채벌레 포획은 모두 7월과 8월에 진행하였다. 광주기로 본다면 모두 장일에 해당한다. 계절 변이에 따른 날개형 비율을 확인하기 위해서는 단일조건에서 조사가 필요하다고 판단한다. 다만, 천궁은 11월에 수확하는 작물로 일본의 쑥 사례와 같은 연구를 진행하기 위해서는 먼저 재배지 근처의 야생기주 조사를 선행해야 한다.
본 연구는 천궁을 가해하는 우점종인 미나리총채벌레의 동정과 날개형에 관한 기초연구 결과로 다양한 수단을 이용한 방제법 개발과 바이러스의 보독 및 매개체 가능성 연구에 도움이 될 것으로 기대한다.
Acknowledgments
본 연구는 산림청 국립산림과학원 연구개발사업(과제번호: FE0100-2022-03-2022)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
- Agricultural Technology Research Institute(ATRI). (1994). Cnidium officinale. In Compendium of medicinal plant pests with color plates. Agricultural Technology Research Institute. Seoul, Korea. p.102.
- Ananthakrishnan TN. (1984). Reproductive biology of thrips. Indira Publishing House, Oakland County. MI, USA. p.158.
-
Belete MT, Igori D, Kim SE, Lee SH and Moon JS. (2022). Complete genome sequence of cnidium virus 1, a novel betanucleorhabdovirus infecting Cnidium officinale. Archives of Virology. 167:973-977.
[https://doi.org/10.1007/s00705-021-05348-9]

-
Bullock JA. (1965). The assessment of populations of Thrips nigropilosus Uzel. on pyrethrum. Annals of Applied Biology. 55:1-12.
[https://doi.org/10.1111/j.1744-7348.1965.tb07862.x]

-
Chung BN, Kwon SJ, Yoon JY and Cho IS. (2022). First report of Cnidium officinale as a natural host plant of apple stem grooving virus in South Korea. Plant Disease. 106:338. https://apsjournals.apsnet.org/doi/full/10.1094/PDIS-04-21-0781-PDN, (cited by April 26, 2023).
[https://doi.org/10.1094/PDIS-04-21-0781-PDN]

-
Crespi BJ. (1988). Adaptation, compromise, and constraint: The development, morphometrics, and behavioral basis of a fighter-flier polymorphism in male Hoplothrips karnyi(Insecta: Thysanoptera). Behavioral Ecology and Sociobiology. 23:93-104.
[https://doi.org/10.1007/BF00299892]

-
Ganaha-Kikumura T, Ohno S, Kijima K, Matsumoto M and Maekado N. (2012). Species composition of thrips(Thysanoptera: Thripidae) and spider mites(Acari: Tetranychidae) on cultivated Chrysanthemum(Asteraceae) in Okinawa, southwestern Japan. Entomological Science. 15:232-237.
[https://doi.org/10.1111/j.1479-8298.2011.00501.x]

-
Gilbertson RL, Batuman O, Webster CG and Adkins S. (2015). Role of the insect supervectors Bemisia tabaci and Frankliniella occidentalis in the emergence and global spread of plant viruses. Annual Review of Virology. 2:67-93.
[https://doi.org/10.1146/annurev-virology-031413-085410]

- Glynne JGD and Sylvester NK. (1966). Pyrethrum an insect repellent. Part 1: Literature Reviews, Pyrethrum Post. 3:38-41.
-
Gudeta WF, Belete MT, Igori D, Kim SE and Moon JS. (2022). Complete genome sequence of cnidium closterovirus 1, a novel member of the genus Closterovirus infecting Cnidium officinale. Archives of Virology. 167:1491-1494.
[https://doi.org/10.1007/s00705-022-05448-0]

-
Honma H, Tsushima D, Kawakami H, Fujihara N, Tsusaka T, Kawashimo M, Nishimura T and Fuji S. (2019). Complete nucleotide sequence of a new potexvirus, ‘Cnidium virus X’, isolated from Cnidium officinale in Japan. Archives of Virology. 164:1931-1935.
[https://doi.org/10.1007/s00705-019-04261-6]

-
Igori D, Lee HK, Yang HJ, Lee DS, Kim SY, Kwon B, Oh J, Kim TD, An C, Moon JS and Lee SH. (2020). First report of the cycas necrotic stunt virus infecting Cnidium officinale in South Korea. Plant Disease. 104:3275-3275.
[https://doi.org/10.1094/PDIS-01-20-0092-PDN]

-
Iwai K, Kon T, Fujita Y, Abe H, Honma H, Kawasumi N, Kawakami H, Kawashimo M, Sakurai M and Fuji SI. (2023). Genetic diversity of viruses infecting cnidium plants(Cnidium officinale) in Japan. VirusDisease. 34:431-439.
[https://doi.org/10.1007/s13337-023-00835-w]

-
Jung CR, Jeong DH, Park HW, Kim HJ, Jeon KS and Yoon JB. (2019). Molecular identification of thrips in two medicinal crops, Cnidium officinale Makino and Ligusticum chuanxiong Hort. Korean Journal of Medicinal Crop Science. 27:17-23.
[https://doi.org/10.7783/KJMCS.2019.27.1.17]

-
Kamm JA. (1972). Environmental influence on reproduction, diapause, and morph determination of Anaphothrips obscurus (Thysanoptera: Thripidae). Environmental Entomology. 1:16-19.
[https://doi.org/10.1093/ee/1.1.16]

-
Kim CY, Abdisa E, Esmaeily M, Khan F, Lee DH and Kim YG. (2023). Detection of the TSWV-infected onion thrips, Thrips tabaci, and the viral multiplication in the insect vector. Korean Journal of Pesticide Science. 27:135-144.
[https://doi.org/10.7585/kjps.2023.27.2.135]

- Kim JC, Jang WC, Kim SH and Park JH. (2012). General information, cultivars and characteristics. In Easy guide to understanding cultivation of Cnidium officinale Makino and Ligusticum chuanxiong Hort. Bongwha Highland Medicinal Plants Experiment Station. Bonghwa, Korea. p.7-21.
- Köppä P. (1970). Studies on the thrips(Thysanoptera) species most commonly occurring on cereals in Finland. Annales Agriculturae Fenniae. 9:191-265.
- Korea Forest Service(KFS). (2022). 2021 Production of forest products. Korea Forest Service. Daejeon, Korea. p.23.
-
Kucharczyk H, Kucharczyk M, Winiarczyk K, Lubiarz M and Tchórzewska D. (2019). Effects of temperature on the development of Thrips nigropilosus Uzel(Thysanoptera: Thripidae) on Mentha × piperita L. and the impact of pest on the host plant. Acta Scientiarum Polonorum Hortorum Cultus. 18:219-233.
[https://doi.org/10.24326/10.24326/asphc.2019.3.21]

-
Lee DS, Lee HK, Kim SY, Kwon BR, Yang HJ, Park CY and Lee SH. (2023). Complete genome sequences of two apple stem grooving viruses in Cnidium officinale in Korea. Microbiology Resource Announcements. 12:e00902-22. https://journals.asm.org/doi/full/10.1128/mra.00902-22, (cited by 2023 Feb 4).
[https://doi.org/10.1128/mra.00902-22]

- Lee JH, Choi HS, Chung MS and Lee MS. (2002). Volatile flavor components and free radical scavenging activity of Cnidium officinale. Korean Journal of Food Science and Technology. 34:330-338.
-
Masumoto M and Okajima S. (2013). Review of the genus Thrips and related genera(Thysanoptera, Thripidae) from Japan. Zootaxa. 3678:1-65.
[https://doi.org/10.11646/zootaxa.3678.1.1]

-
Morison GD. (1957). A review of British grasshouse Thysanoptera. Transactions of the Royal Entomological Society of London. 109:467-534.
[https://doi.org/10.1111/j.1365-2311.1957.tb00334.x]

- Mound LA and Marullo R. (1996). The Thrips of central and south America: An introduction(lnsecta: Thysanoptera). Memoris on Entomology. Vol. 6. Associated Publishers, Gainesville. FL, USA. p.488.
- Mound LA, Morison GD, Pitkin BR and Palmer JM. (1976). Thysanoptera: Handbooks for the identification of British insects. Royal Entomological. Society of London. Vol. 1, Part 11. p.79.
- Nakahara S. (1993). The genus Thrips Linnaeus(Thysanoptera: Thripidae) of the New World. Technical Bulletin-United States. Department of Agriculture. No. 1822. Washington DC, USA. p.183.
-
Nakao S, Yabu S and Nakashima A. (1997). The impacts of the long-distance transportation of plant materials for the revegetation on local populations of insects. Environmental Systems Research. 25:665-669.
[https://doi.org/10.2208/proer1988.25.665]

-
Nakao S. (1993). Effects of temperature and photoperiod on wing form determination and reproduction of Thrips nigropilosus Uzel(Thysanoptera: Thripidae). Applied Entomology and Zoology. 28:463-472.
[https://doi.org/10.1303/aez.28.463]

-
Nakao S. (1994). Photothermic control of wing form and reproductive diapause in female Thrips nigropilosus Uzel(Thysanoptera: Thripidae). Japanese Journal of Applied Entomology and Zoology. 38:183-189.
[https://doi.org/10.1303/jjaez.38.183]

- Oh YJ, Seo HR, Choi YM and Jung DS. (2010). Evaluation of antioxidant activity of the extracts from the aerial parts of Cnidium officinale Makino. Korean Journal of Medicinal Crop Science. 18:373-378.
-
Park YC, Kim KK, Jun HJ, Kang EH, Lee SR, Ahan JK, Seo HK, Lee SH and Hoe KL. (2023a). Complete genome sequence of a novel member of the genus Polerovirus from Cnidium officinale in South Korea. Archives of Virology. 168:104. https://link.springer.com/article/10.1007/s00705-023-05732-7, (cited by 2023 Feb 1).
[https://doi.org/10.1007/s00705-023-05732-7]

-
Park YC, Kim KK, Jun HJ, Kang EH, Lee SR, Ahan JK, Seo HK, Lee SH and Hoe KL. (2023b). Complete genome sequence of cnidium virus 2, a novel cytorhabdovirus isolated from Cnidium officinale in South Korea. Archive of Virology. 168:170. https://link.springer.com/article/10.1007/s00705-023-05784-9, (cited by 2023 Feb 1).
[https://doi.org/10.1007/s00705-023-05784-9]

-
Roff DA and Fairbairn DJ. (1991). Wing dimorphisms and the evolution of migratory polymorphisms among the insecta. American Zoology. 31:243-251.
[https://doi.org/10.1093/icb/31.1.243]

-
Roff DA. (1986). The evolution of wing dimorphism in insects. Evolution. 40:1009-1020.
[https://doi.org/10.1111/j.1558-5646.1986.tb00568.x]

-
Stannard LJ. (1968). The thrips, or Thysanoptera, of Illinois. Illinois Natural History Survey Bulletin. 29:213-552.
[https://doi.org/10.21900/j.inhs.v29.166]

-
Steel RGD. (1961). Some rank sum multiple comparisons tests. Biometrics. 17:539-552.
[https://doi.org/10.2307/2527854]

-
Yoo RH, Zhao F, Lim SM, Igori D, Kim SM, An TJ, Lee SH and Moon JS. (2015). The complete genome sequences of two isolates of cnidium vein yellowing virus, a tentative new member of the family Secoviridae. Archives of Virology. 160:2911-2914.
[https://doi.org/10.1007/s00705-015-2557-1]

