
연도별 국내산 품종과 중국산 단삼 품종의 약리활성물질 함량 및 변이
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study was conducted to determine color parameters, and identify pharmaceutical constituents and phytochemical characteristics of Korean cultivars (Hongdan, Dasan, and Kosan) of Salvia miltiorrhiza root (Danshen) by crop years compared with those of the Chinese cultivar [“Zhongdanyaozhi No. 1 (ZD1)”].
Redness (a*), yellowness (b*), extract yield, salvianolic acid B (Sal B), and tanshinone ⅡA (TanⅡA) were generally higer in Korean cultivars than in ZD1, implying effective quality control with Korean cultivars in Danshen. Sal B and TanⅡA content were found to be the highest in Korean cultivar ‘Hongdan’ (3-fold higher than ‘ZD1’) in the 2020 crop year. Sal B was chosen as a major markers to assess Korean Danshen quality. However, Sal B detection was apparently incomplete and insufficient for quality control, because Sal B degradation was crop years dependent, Sal B was degraded to some small molecular phenolic acids, such as caffeic acid, protocatechuic aldehyde, lithospermic acid, and danshensu, which were elucidated by liquid chromatography. Analysis of Pearson’s correlation heatmap revealed negative correlation between Sal B and small phenolic acids. The Sal B content of Danshen was correlated to the redness of color parameter, the total terpenoid content, TanⅡA content, suggesting that it would be reasonable to simultaneously detect these characteristics for Danshen quality control.
This study provides constructive and meaningful references for the qualitative and quantitative analyses of S. miltiorrhiza root, which can help establish better quality standards.
Keywords:
Salvia miltiorrhiza Bunge, Chinese Cultivars, Color Index, Crop Years, Korean Cultivars, Pharmaceutical Constituents, Salvianolic acid B, Tanshinone ⅡA서 언
단삼 (Salvia miltiorrhiza Bunge)은 꿀풀과 (Lamiaceae)의 Salvia속에 속하는 낙엽 다년생 식물로서 (Han, 2004) 원산지가 중국으로 심혈관 및 뇌혈관 질환의 치료에 사용되고 있다 (Zhou et al., 2005).
최근까지 단삼은 전량을 중국 수입에 의존해 왔으나 농약 잔류성 등 안전성 문제와 중국의 물가 상승으로 국내산 단삼의 수요가 증가하였다.
농림축산식품부에서 발간한 특용작물 생산실적에 따르면 2018년 약용작물 재배면적은 11,715 ㏊로 그중 단삼의 전체 재배면적은 1 ㏊였으나, 2019년부터 점차 증가하여 2021년에 약용작물 전체 재배면적 10,706 ㏊ 중 단삼의 전체 재배면적은 8 ㏊로 점증하였다 (MAFRA, Korea).
2010년부터 국내 적응 사업을 시작하여 2012년 국내 생산이 성공하였으며 (Yang et al., 2017), 국내 최초 단삼 품종인 “다산 (Dasan)” 품종 (Jeong et al., 2023) 과 높은 수량과 병충해에 강한 “고산 (Gosan)” 품종이 개발된 바 있다 (RDA, 2018).
Choi 등 (2020)은 재배면적이 적은 6 개의 약용작물에 대한 소득 분석 결과 단삼의 10 a당 총수입과 경영비는 각각 2,549 천원과 933 천원이었으며, 경영비 대비 총수입이 높고 시간당 소득이 44.9 천원으로 높아 농업노동력의 고령화에 대비한 노동절감형 품목임을 보고한 바 있다.
단삼의 활성 성분은 salvianolic acid A (Sal A), salvianolic acid B (Sal B), lithospermic acid, rosmarinic acid 및 danshensu (DS)로 알려진 R-(+)-(3,4-dihydroxyphenyl)lactic acid (Li, 1998)를 포함한 수용성 페놀계 그룹과 tanshinone I (Tan I), tanshinone IIA (TanⅡA), tanshinone IIB, cryptotanshinone (CT) 및 dihydrotanshinone I (DHTS)을 포함하는 친유성 tanshinone 계열의 성분으로 나누어진다 (Li et al., 2010).
단삼에서 가장 풍부한 화합물인 salvianolic acid (Sal A 및 Sal B 포함)는 단삼의 3% - 5%를 차지할 만큼 함량이 매우 높다고 알려져 있으며 (Zhao et al., 2008), 항산화 (Zhang et al., 2014), 항염 (Chen et al., 2001), 항혈전 및 심장 보호 활성 (Zhao et al., 2017), 혈관신생작용 (angiogenesis) 및 골수세포의 alkaline phosphatase 활성을 증강하는 약리작용이 보고되고 있다 (Shim et al., 2010; Ho and Hong, 2011).
Tanshinone 계열의 화합물의 경우 기본골격인 phenanthrene-quinone 구조로 독성에 기인한 항종양 효과 (Dong et al., 2011), DNA와 세포 내 지질 과산화 생성물 사이의 상호작용을 효과적으로 억제함으로써 나타나는 항산화 활성 (Zhou et al., 2013), 미세 순환을 개선하고 혈관 혈류를 향상시키는 관상동맥 확장 효과 (Wei et al., 2016) 및 심장 보호 (Hu et al., 2015), amyloid beta (Aβ) 신경독성으로부터 보호 효과 (Jiang et al., 2014) 및 진통 활성 (Mannelli et al., 2018) 등을 나타낸다고 보고되고 있다.
단삼은 식품 공전 내용 중 뿌리 부분을 제한적 식품 원료로 수록되어 있어, 식품 제조 가공에서 부원료로 사용할 수 있으나 대한민국 약전에서는 생약으로 사용하는 경우, 주요 페놀화합물인 Sal B가 건조물의 4.1% 이상을 함유하도록 규정하고 있다 (MFDS, 2022).
약용작물을 원료로 하는 생약재의 활용에 있어 품질관리 및 안전성 확보는 필수적이며 한약재의 순도나 품질이 확보된 의약품으로 사용될 수 있도록 정확한 품질관리를 위한 생약의 지표성분 함량 기준 및 시험방법에 관한 연구가 필수적이다.
특히 단삼의 경우 특정 질환에 대한 약리 효과가 수용성의 salvianolic acid보다는 지용성인 tanshinone 계열의 성분에 기인하는 것으로 확인되고 있는 바, 생약재로서의 품질관리를 위해 2004년 생약의 지표 성분 함량 기준 및 시험방법에 관한 연구 (II)를 통해 단삼의 지표 성분으로 TanIIA를 설정하였으며, HPLC 방법으로 정량법을 확립하여 유통품에서의 정상적인 함량 범위는 0.03% - 0.12%, 규격품은 0.03% 이상으로 제안한 바 있다 (Kang, 2004).
또한, 중국 약전에서는 TanIIA를 Sal B와 함께 단삼의 품질을 평가하는 성분 중의 하나로 공식적으로 등재되어 있고 (Pang et al., 2016), 0.20% 이상 함유하도록 제안되고 있으나, 단삼의 활용에 있어 포함된 성분 함량은 재배지의 지리적 조건 (Peng et al., 2014), 수확 및 가공 (Zhou et al., 2014), 가뭄 스트레스에 (Liu et al., 2011) 기인하여 매우 크게 차이를 나타낸다고 보고되고 있다. 또한 실제 유통되는 중국산 단삼으로 검정한 결과, 산지에 따른 차이 및 오랜 유통 과정에 의해 낮은 수준의 TanIIA 함량을 가지는 것으로 보고되고 있어 (Kang, 2004), 단삼의 품질관리를 위한 지표 물질로 활용되지 못하고 있다.
또한 한약재 위품과 유통 실태에 대한 단삼에 대한 시장 유통에서 단삼은 국내에서 재배가 가능하나 대부분 중국산이 유통되고 있어 비정품으로 S. przewalskii Maxim의 학명을 가진 감서서미초 (甘西鼠尾草), 감숙단삼 (甘肅丹參)과 S. yunnanensis C. H. Wright의 학명을 가진 운남서미초 (雲南鼠尾草), 전단삼 (滇丹參)의 혼입이 우려된다고 보고한 바 있다 (Moon et al., 2017).
게다가 TanIIA 및 Sal B는 단삼뿐만 아니라 배암차즈기 (S. plebeia) 및 S. umbratica와 같은 다른 Salvia속 식물에서도 분리되기 때문에 (Jenks and Kim, 2013; Martínez-Cruz and Paredes-López, 2014), 단삼의 품질관리를 위한 marker로서 TanIIA와 Sal B만을 검출하여 사용하는 것만으로는 매우 제한적이고 불충분할 것으로 판단된다.
단삼의 품질관리를 위한 주요한 성분의 정성 및 정량 분석 방법이 개발되고 적용되어 자외선 (ultraviolet, UV, Zheng et al., 2012), 적외선 (infrarred, IR, Liu et al., 2012), 퓨리에 변환 근적외선 (fourier transform near infrared, FT-NIR, Li et al., 2010)을 포함한 분광학적 방법, 박층크로마토그래피를 이용한 분석 방법 (Martelanc et al., 2009), 뿐만 아니라 액체크로마토그래피 (liquid chromatography, LC, Hou et al., 2011), 액체크로마토그래피-질량분석법 (liquid chromatography-mass spectrometry, LC-MS, Chen et al., 2011), 고속 역류 크로마토그래피 (high speed counter current chromatography, HSCCC, Sun et al., 2011), 모세관 전기영동 (capillary electrophoresis, CE, Zhao et al., 2014) 및 전기 화학 (electrochemical, Wang et al., 2012) 등의 개별 성분 분석 방법뿐만 아니라 단삼의 주성분인 Sal B를 포함한 phenolic acid 및 terpenoid 계열의 tanshinone 성분들을 동시에 분석할 수 있는 HPLC 분석 방법 (Chen et al., 2012) 등이 개발·적용되었다.
LC를 이용하는 방법은 생약 제제의 임상 적용에서 유효성과 안전성을 보장하는 중요한 방법이며 여러 화합물의 정성 및 정량 분석을 통해 품질관리뿐만 아니라 단삼의 약물동력학적 연구, 생체 내 대사의 확인 등의 연구 분야에 적용할 수 있으나 순수한 표준물질이 확보되지 못한 현장의 경우에서도 일반적인 품질관리의 근거를 확보할 수 있는 민감하고 포괄적인 특성화된 표준 방법의 개발이 필요하다고 생각된다.
유통되고 있는 생약재의 보관 시스템 및 유통기간의 설정 기준은 식품 및 화학 의약품에 비하여 미흡하고, 일정 기간 보관하였다가 원료로서 공급되므로 보관, 저장이 잘못되거나 유통되는 시간이 길어지면, 부패나 변질이 발생할 가능성이 높고 생약재 품질의 전체적인 저하를 일으킬 수 있다 (Lee et al., 2008). 따라서 단삼의 품종별 함량 차이, 보관 기간에 따른 단삼 성분의 정량적 변이 특성 및 성분의 유연관계를 파악하여 성분 간의 거동적인 평가는 필수적이라 생각된다.
본 연구는 보관 기간에 따른 단삼 성분의 정량적 변이 분석을 위해 서로 다른 연도 (2019년, 2020년)에 수확한 국내산 단삼 품종 3 종 (다산, 고산, 홍단), 2020년 중국 산둥성에서 재배·수확되었다고 표기된 수입 단삼 제품 [Zhongdanyaozhi No. 1 (ZD1)]을 대상으로 하여 추출물을 제조하고 추출물의 색차 분석, Sal B를 포함한 10 종의 수용성 페놀계 그룹와 4 종의 tanshinone 계열 성분 HPLC 분석, total phenol 함량, total Àavonoid 함량, total terpenoid 함량을 조사하여 서로 간의 상관성을 분석함으로써 단삼의 새로운 상대적 품질평가 시험 가능성을 제시하고자 하였다.
재료 및 방법
1. 수확 연도 및 품종별 단삼 시료의 준비
수확 연도 및 품종별 단삼 시료를 확보하기 위해 각 품종별 단삼을 대상으로 이전 연도 (2019년 수확 단삼의 경우 2018년, 2020년 수확 단삼의 경우 2019년)에 재배되고 재배지에서 월동한 개체의 뿌리를 3월에 수확하였다. 수확된 뿌리 중 직경 0.5 ㎝ - 1 ㎝ 사이의 뿌리를 약 5 ㎝ 길이로 잘라 종근으로 하여 4월에 파종하고 10월까지 생육시킨 후 해당 연도 10월 26일에 수확하여 성분 분석을 위한 시료로 활용하였다.
단삼의 재배는 표준재배법을 적용하여 농촌진흥청 인삼특작부 시험포장 (음성군 소이면)에서 진행하였고 질소 (N), 인산 (P2O5), 칼륨 (K2O)의 비율을 9 - 8 - 10 ㎏/10a로 설정하고, 퇴비는 1,000 ㎏/10a를 전량 기비로 사용하여 재배지를 관리하였다.
종근의 식재는 4월 하순에 흑색 비닐로 덮인 두둑에 종근의 상부가 위를 향하도록 세워 심고 주변 토양을 이용하여 3 ㎝ 두께로 덮었다. 식재 간격은 조간 (포기 간격)을 30 ㎝, 주간 (줄 간격)을 15 ㎝로 설정하였고, 시험구는 난괴법을 이용한 3 회 반복으로 배치하였다.
각각 수확된 국내산 단삼 품종 3 종 (다산, 고산, 홍단)은 지근을 제외한 주근을 5 ㎝의 절편으로 절단한 후 55℃로 설정된 dry oven (SUNGCHAN, Pocheon, Korea)을 사용하여 열풍으로 12시간 건조하였고 총 항량 수준이 약 90%가 되도록 하였다.
중국산 품종인 ZD1은 2020년에 수확하여 건조되어 수입된 시중 유통품을 대상으로 하였고 2019년, 2020년에 수확한 국내산 단삼 품종 3 종과 중국산 품종 모두 동일한 수준의 수분함량이 될 때까지 추가 건조하였다. 건조가 끝난 시료들을 대상으로 분쇄기로 조말 분쇄한 후 50호 표준체 망 (300 ㎛) (CHUNGGYE, Gunpo, Korea)을 통과시킨 후 –18℃에 보관하였으며 원물 시료의 균일성을 확보하기 위하여 각 건조 및 분말화된 시료를 잘 혼합하고 혼합된 전체 시료 중 무작위적으로 3 부분을 채취하여 시료로 사용하였다 (Fig 1).

Preparation of the powder and methanol extract in Korean cultivars and Chinese cultivar of Salvia miltiorrhiza root. (A); Chinese cultivar harvested at 2020 and storaged in room temperature (Zhongdanyaozhi No. 1, Shandong Province, China, ZD1). (B) - (D); Korean cultivars was harvested at 2020. (B); “Dasan” cultivar, (C); “Kosan” cultivar, (D); “Hongdan” cultivar. Methanolic extract (30 ㎎/㎖) of varieties, respectively.
2. 시료 추출물 제조
서로 다른 연도 (2019년, 2020년)에 수확한 국내산 단삼 품종 3 종 시료와 중국산 단삼 품종, 각 1 g을 칭량하여 50 ㎖의 methanol를 첨가하고, 상온 (25℃)에서 30 분간 초음파를 처리한 후 (120 V, 60 ㎐, UCP-20, JeioTech, Daejeon, Korea), 다시 30 분간 교반하여 (100 rpm) 추출하였다.
각 추출액을 filter paper (No. 6, Whatman International Ltd., Maidstone, England)로 여과하고, 감압 농축 (Eyela Co., Ltd., Tokyo, Japan)하여 추출물을 제조하였다 (Fig. 1).
3. 색차분석
서로 다른 연도 (2019년, 2020년)에 수확한 국내산 단삼 품종 3 종 (다산, 고산, 홍단)과 중국산 단삼 품종 (ZD1)의 각 추출된 시료를 30 ㎎/㎖의 농도로 제조하여 culture dish (SPL life sciences, Pocheon, Korea)에 10 ㎖씩 분주하여 D65-10 광원을 이용한 색차계 (X-rite vs450, X-Rite Inc., Grand Rapids, MI, USA)를 이용하여 3 회 반복 측정하였다. 색차 데이터는 CIELAB체계를 이용한 명도 (L*), 적색도 (a*) 및 황색도 (b*)를 수치화한 후 성분과 색차 간 상관성 분석에 사용하였다.
4. HPLC 분석조건
Salvianolic acid A (Sal A), salvianolic acid C (Sal C) 표준품은 MedChemExpress (Romulus, MI, USA)의 시약을 사용하였고, danshensu (DS), protocatechuic aldehyde (PCA), vanillic acid (VA), caffeic acid (CA), rosmarinic acid (RA), lithospermic acid (LA), salvianolic acid B (Sal B), dihydrotanshinone Ⅰ (DHTS), cryptotanshinone (CT), tanshinone Ⅰ(Tan Ⅰ)과 tanshinone Ⅱa (TanIIA) 표준품은 Sigma-aldrich (St. Louis, MO, USA)에서 protocatechuic acid (PA) 표준품은 HWI pharma services GmbH (Germersheim, Germany)에서 구매하여 사용하였다.
추출 및 농축된 시료는 syringe ¿lter (13JP020AN, 0.20 ㎛, Advantec Mfs. Inc., Dublin, CA, USA)에 여과한 후 HPLC 분석에 사용하였다. HPLC system은 Shimadzu LC-20AT (Shimadzu Co., Kyoto, Japan) 을 사용하였으며, Column은 YMC-Pack ODS-AM column (250 ㎜ × 4.6 ㎜ I.D., 5 ㎛, YMC Co., Ltd., Kyoto, Japan)을 사용하였다.
단삼의 14 가지 성분 (DS, PCA, PA, VA, CA, RA, LA, Sal B, Sal A, Sal C, DHTS I, CT, Tan I, TanIIA)을 동시 분석할 수 있는 validation이 확인된 HPLC를 이용하여 Chen 등 (2012)의 방법을 변형하여 적용하였다 (Table 1).

HPLC operating condition of simultaneous analytical method for 14 pharmaceutical constituents in Salvia miltiorrhiza.
각 성분에 대한 표준품을 5 ㎍/㎖, 10 ㎍/㎖, 20 ㎍/㎖, 40 ㎍/㎖, 80 ㎍/㎖ 의 농도로 희석하여 분석한 후 회귀방정식과 결정계수 (R2)를 산출하였으며 각 시료의 면적을 표준 곡선에 적용하여 함량을 결정하였다.
5. 총페놀, 총플라보노이드, 총터페노이드 함량 분석
Total phenolic contents (TPC)는 Folin-Ciocalteu’s 방법을 (Khan et al., 2012) 응용하여 측정하였다.
제조한 추출물을 1 ㎎/㎖로 희석하여 사용하였고, 시료 20 ㎕에 Folin-Ciocalteu’s phenol reagent (Sigma-Aldrich Co., St. Louis, MO, USA) 100 ㎕와 80 ㎕의 7.5% sodium carbonate (DAEJUNG Co., Ltd., Siheung, Korea)를 첨가한 후 상온에서 45 분간 암실 반응시킨 후 760 ㎚에서 micro plate reader (Epoch, Agilent Technologies Inc., Santa Clara, CA, USA)를 사용하여 흡광도 측정하였다.
표준 곡선은 gallic acid (Sigma-Aldrich Co., St. Louis, MO, USA) 시약을 이용하였고, 함량은 ㎍·gallic acid equivalents (GAE)/㎖로 나타내었다.
Total Àavonoid contents (TFC)는 Khan 등 (2012)의 방법을 이용하였다.
제조한 추출물을 5 ㎎/㎖로 희석하여 사용하였고, 시료 20 ㎕에 95% ethanol 60 ㎕, 10% aluminium chloride hexahydrate 4 ㎕, 1 M potassium acetate 4 ㎕과 distilled Water 112 ㎕를 첨가한 후 상온에서 40 분간 반응시킨 후 415 ㎚에서 micro plate reader (Epoch, Agilent Technologies Inc., Santa Clara, CA, USA)를 사용하여 흡광도 측정하였다.
표준 곡선의 작성은 quercetin (Sigma-Aldrich Co., St. Louis, MO, USA)을 이용하여 작성하였고, 함량은 ㎍·quercetin equivalents (QE)/㎖로 나타내었다.
Total terpenoid contents (TTC)는 Biswajit 등 (2021)에 의한 방법을 적용하였다.
제조한 추출물 시료 200 ㎕ (1 ㎎/㎖)를 70%에 perchloric acid 1 ㎖, vanillin-glacial acetic acid (5%, w/v)을 넣고 섞어준다. 그 후 glacial acetic acid 5 ㎖를 추가한 후 548 ㎚에서 UV spectrophotometer (Thermo Fisher scientific Inc., Waltham, MA, USA)를 사용하여 흡광도를 측정하였다.
표준 곡선은 ursolic acid (Sigma-Aldrich Co., St. Louis, MO, USA)을 이용하여 작성하였고, 함량은 ㎍·ursolic acid equivalents (UAE)/㎖로 나타내었다.
6. 통계처리
모든 실험은 3 회 반복 실험하였고 각 평균값과 표준오차를 구하였다. 반복별 통계분석은 SAS v9.4 (SAS Institute Inc., Cary, NC, USA)을 이용하여 DMRT (Duncan’s Multiple Range Test) 5% 수준에서 유의성을 검정하였다 (p < 0.05).
서로 다른 연도 (2019년, 2020년)에 수확한 국내산 단삼 품종 3 종 (다산, 고산, 홍단)과 중국산 단삼 품종 (ZD1)이 나타내는 성분 함유량을 데이터화하여 각 성분 간의 상관관계를 가시화하기 위한 heatmap 분석과 Pearson’s correlation heatmap 분석은 MetaboAnalyst 5.0 (www.metaboanalyst.ca)를 사용하였다.
결과 및 고찰
1. 수확연도별 국내산 단삼 품종 3 종과 중국산 단삼 품종의 색차 비교
2020년에 수확한 서로 다른 품종에 따른 추출물의 색차 분석을 진행한 결과 중국산 단삼 품종 (ZD1) 추출물은 높은 L* 값 (73.12)과 낮은 a* (16.9), b* (55.78) 값을 나타냈지만 국내산 품종의 추출물은 L* 값이 53 – 58, a* 값은 44.79 – 53.31, b* 값은 90.38 – 94.95로 중국산 단삼 품종 (ZD1) 추출물보다 높은 값을 나타내었다 (Table 2). 메탄올을 용매로 사용하여 추출·농축한 추출물의 추출 수율에서도 중국산 단삼 품종 (ZD1) 추출물의 추출물의 경우 27.52%인데 반하여 국내 품종의 추출물은 48.59% – 51. 67%로 나타나 더 높았다 (Table 2).

Color index of methanol extract by CIELAB value on different crop years of Korean and Chinese cultivars in S. miltiorrhiza root.
국내 품종에 대한 추출물을 대상으로 한 연도별 단삼의 색차 분석에서 L* 값은 2020년에 수확된 단삼보다 2019년에 수확된 단삼의 경우 다소 증가한 반면 적색도와 황색도를 나타내는 a* 값과 b* 값은 반대로 감소하였다. 특히 a* 값의 경우 동일 연도에 수확한 것이라도 품종별로 큰 차이를 나타내어 다산이나 고산보다 홍단이 더 높은 값을 나타내었고, 이러한 차이는 2020년 수확된 품종별 단삼 시료보다 수확 후 저장 시간이 경과한 2019년도 품종별 단삼 시료에서 더욱 큰 차이를 나타내었다.
고산 품종의 경우 다산이나 홍단보다 a* 값과 b* 값이 2020년도에 비해 2019년에 더 감소하는 경향을 나타내었다. 또한 이러한 a* 값과 b* 값은 단삼의 추출 수율과도 상관관계를 나타내어 감소한 a* 값과 b* 값 따라 추출 수율도 감소하였다.
반면 홍단의 경우 수확 후 시간이 지남에 따라 다른 품종과 다르게 L* 값이나 b* 값은 그대로 유지되었고 a* 값과 수율은 다소 감소하였으나 다른 품종과 비교하여 높은 수준으로 유지되는 것을 확인하였다.
단삼의 친유성 tanshinone 계열의 성분은 terpenoids 종류이지만 Salvia 종의 독특한 화학 성분으로 다른 생약 및 한약재에서는 발견되지 않으며 (Zhao et al., 2011), 특히 diterpenoid인 tanshinone 및 Tan I, TanIIA, CT, DHTS, danshenxinkun A, przewaquinone A, tanshinol A, tanshinol B 등을 포함하는 유사체는 단삼의 색상 발현에 직접적인 영향을 나타낸다고 하였다 (Pang et al., 2016).
Zhan 등 (2019)은 일반 단삼과 주황색을 띠는 단삼 간의 품질 차이를 조사한 연구에 따르면 주황색을 띠는 단삼이 일반 단삼보다 tanshione 계열의 성분 함량이 작은 수준으로 포함하고 있는 것을 확인하였고, 붉은색을 띠는 TanIIA, Tan I의 함량을 감소할수록 뿌리가 적색에서 주황색을 나타낸다고 하였다.
또한, 돌연변이 흰색 단삼과 일반 단삼과 비교한 논문에서도 흰색을 띠는 단삼은 중요한 유효성분인 TanIIA, TanIIB와 색소와 관련된 quinone, Àavonoids 등의 함량이 일반 단삼과 비교하였을 때 매우 낮은 수준을 나타낸다고 보고하여 앞선 연구와 결과가 일치하였다 (Su et al., 2021).
이러한 보고와 함께 홍단 품종이 추출 수율과 함께 tanshinone 계열의 화합물이 함량을 예측할 수 있는 적색도가 다른 품종보다 높은 수준으로 나타난다는 점을 고려하여 볼 때 유용한 물질을 높은 수준으로 축적하는 품종 육성의 필요성을 나타낸다고 할 수 있으며, 약용작물의 경우 수확 후 저장 기간이 길어짐에 따라 유용성분을 포함하는 이차대사산물과 추출물의 수율이 감소할 수 있음을 고려하여 볼 때 기존의 저장 방식인 건조 후 세절하여 상온에 보관하는 방식을 개선할 필요성을 제시한다고 하겠다.
또한 약용작물의 품질평가 기준이 되는 축적된 대사산물의 양은 가용부위 자체와 추출물이 나타내는 색상 변이를 나타낼 수 있으며 이러한 색상의 차이를 통해 우수한 품종의 선발, 생물적 및 비 생물적 스트레스에 대한 저항성 정도의 판단, 한약재로 사용되는 약용작물에 대한 품질 판단의 기준으로 사용할 수 있을 것으로 판단된다.
Yang 등 (2019)은 Cattleya intermedia를 대상으로 한 꼬투리 색상 및 성장 단계와 관련된 대사산물의 아미노산, Àavonoid, 식물 호르몬 등 총 557 개의 다변량 분석에서 적색 꼬투리가 녹색 꼬투리에 비하여 Àavonoid와 proanthocyanin의 함량이 높고 shikimic acid 경로와 phytohormone 대사 경로에 있는 화합물, 특히 zeatin과 indoleacetic acid 등의 식물성 호르몬과 그 유도체가 극단적으로 높은 수준으로 포함하고 있다고 보고하였다.
이상의 결과를 비교하여 볼 때 식물의 전 생애에 걸쳐 식물의 성장과 발달을 조절하는 중요한 신호 분자인 특정 식물 호르몬이 이러한 색상의 증가에 따라 함께 증가할 수 있으며 색상 발현의 정도를 기준으로 하여 작물의 생산성도 예측할 수 있을 것으로 생각된다.
2. 수확연도별 국내산 단삼 품종 3 종과 중국산 단삼 품종의 약리활성 물질 분석 비교
단삼의 14 가지 성분을 대상으로 한 표준품을 농도별로 희석하여 HPLC 분석 후 표준 곡선을 작성하고 결정계수를 확인한 결과 danshensu (DS, y = 18686x + 4235, R2 = 0.9996), protocatechuic acid (PA, y = 13595x – 14406, R2 = 0.9997), protocatechuic aldehyde (PCA, y = 30798x – 25646, R2 = 0.9995), vanillic acid (VA, y = 16596x – 6629.2, R2 = 0.9999), ca൵eic acid (CA, y = 22393x – 26224, R2 = 0.9998), rosmarinic acid (RA, y = 749.51x + 1046.5, R2 = 0.9954), lithospermic acid (LA, y = 4455.1x – 17621, R2 = 0.9901), salvianolic acid A (SalA, y = 47158x – 182113, R2 = 0.9982), salvianolic acid B (SalB, y = 13917x – 18557, R2 = 0.9997), salvianolic acid C (SalC, y = 6261.5x – 27598, R2 = 0.9985), dihydrotanshinone Ⅰ (DHTS, y = 39402x + 24974, R2 = 0.9999), cryptotanshinone (CT, y = 239262x + 100139, R2 = 0.9999), tanshinone Ⅰ(TanⅠ, y = 21089x + 68375, R2 = 0.9997, tanshinone ⅡA (TanⅡA, y = 54766x – 15526, R2 = 0.9995) 모두에서 직선성, 정확성을 확인하여 해당 분석법이 단삼의 약리 활성 물질을 동시적으로 정량·정석 분석할 수 있는 시험법임을 확인하였다.
2019년도와 2020년도에 국내산 단삼 품종 3 종 (다산, 고산, 홍단) 시료로부터 100% 메탄올 추출물을 획득하고 phenolic acid group, tanshinone group으로 나누어 메탄올 추출물 ㎎당 각 성분의 함량과 건조 원물에 대한 각 성분의 함량을 검정하였으며 중국산 단삼 품종 (ZD1)과 비교하였다 (Table 3, Table 4, Table 5, and Table 6).

Hydrophilic phenolic acids contents of methanolic extracts in S. miltiorrhiza Bunge by different cultivars and crop years.

Hydrophilic phenolic acids contents of raw material in S. miltiorrhiza Bunge by different cultivars and crop years.
먼저 메탄올 추출물 ㎎당 친수성의 phenolic acid 계열 성분의 함량 비교에서 서로 다른 연도 (2019년 및 2020년)에 수확한 홍단, 고산, 다산 품종을 비교하였을 때, phenolic acid 계열 10 종 중 DS, PA, PCA, VA, LA가 모든 품종에서 2019년에 생산한 단삼이 2020년에 생산된 단삼보다 약간 증가하는 경향을 나타낸 반면 Sal A, Sal B, Sal C의 경우는 연도별로 큰 함량의 차이를 나타내지 않고 유지됨을 확인하였다 (Table 3).
국내산 품종 간의 함량 차이는 2020년에 생산된 단삼의 경우 대한민국 약전의 품질관리 기준이 되는 Sal B는 홍단 품종에서 72.88 ± 5.60 ㎍/㎎·EX으로 가장 높은 함량을 나타내었고 고산과 다산 품종은 각각 61.84 ± 13.47 ㎍/㎎·EX와 61.68 ± 10.08 ㎍/㎎·EX으로 유사한 수준으로 확인되었으며 이러한 경향은 2019년에 생산된 단삼의 경우에서도 같은 경향을 나타내었다 (Table 3).
Phenolic acid 계열 10 종의 총 함량에서도 홍단 품종이 가장 높은 함량을 나타내어 Sal B를 포함한 phenolic acid 계열의 물질을 높은 수준으로 함유한 품종은 홍단임을 확인하였다 (Table 3 and Fig. 2).
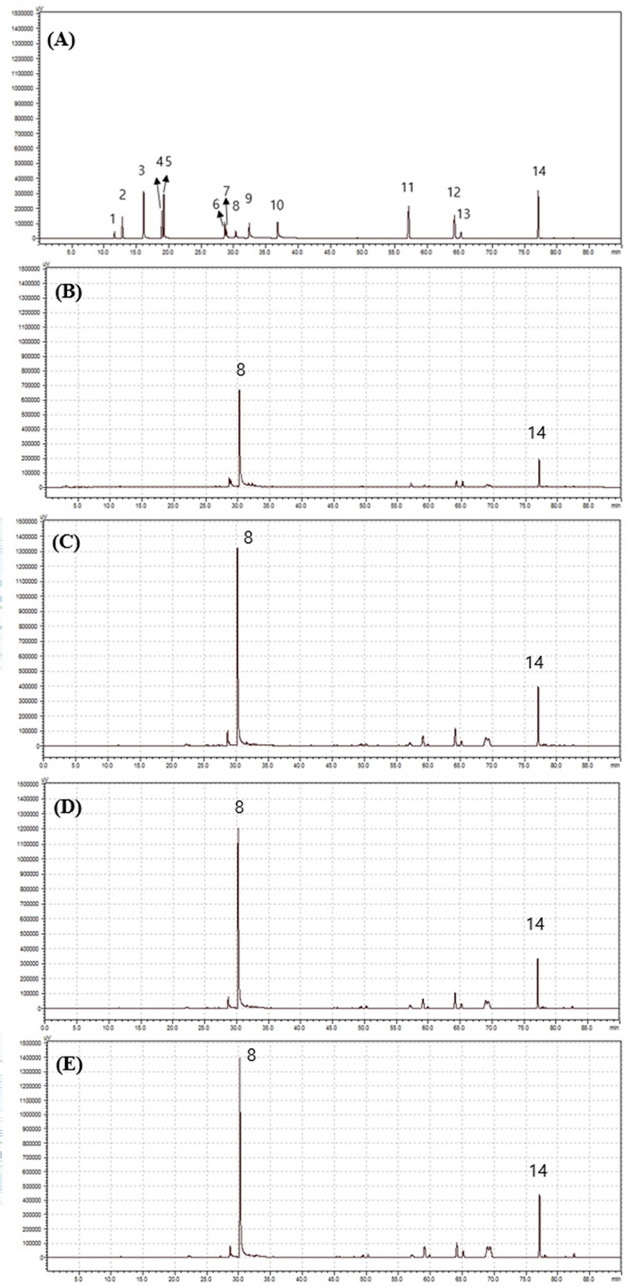
HPLC chromatogram of 14 pharmaceutical constituents in Korean cultivars and Chinese cultivar of S. miltiorrhiza root. (A); standard mixuture (25 ㎍/㎖, 1; danshensu (DS), 2; protocatechuic acid (PA), 3; protocatechuic aldehyde (PCA), 4; vanillic acid (VA), 5; caffeic acid (CA), 6; rosmarinic acid (RA), 7; lithospermic acid (LA), 8; salvianolic acid B (Sal B), 9; salvianolic acid A (Sal A), 10; salvianolic acid C (Sal C), 11; dihydrotanshinone I (DHTS), 12; cryptotanshinone (CT), 13; tanshinone I (Tan I), 14; tanshinone IIA (TanIIA), (B); Chinese cultivar harvested at 2020 and storaged in room temperature (Zhongdanyaozhi No. 1, Shandong Province, China, CP). (C) - (E); Korean cultivars was harvested at 2020. (C); “Dasan” cultivar, (D); “Kosan” cultivar, (E); “Hongdan” cultivar. Methanolic extact (10 ㎎/㎖) of varieties, respectively.
수율이 고려된 건조 원물에 대한 각 성분의 함량을 연도별로 비교하였을 때 2019년에 생산된 단삼에서 메탄올 추출물 ㎎당 각 성분의 함량이 높았던 DS, PA, PCA, VA, LA 중 VA만이 여전히 높았고 다른 phenolic acid 계열은 유사한 수준으로 나타났으며 Sal A, Sal B, Sal C의 경우는 모든 품종에서 2019년에 생산된 단삼보다 2020년에 생산된 단삼에서 더 높은 수준으로 함유된 것이 확인되어 보관 기간이 길어질수록 함량이 감소함을 확인할 수 있었다 (Table 4).
동일 연도에 재배한 국내산 단삼 품종 3 종 (다산, 고산, 홍단)과 중국산 단삼 품종 (ZD1)의 함량 차이를 메탄올 추출물 ㎎당 각 성분의 함량으로 비교에서 하였을 경우 저분자 phenolic acid에 속하는 DS, CA, LA 등의 성분 함량이 국내산 품종보다 중국산 단삼 품종 (ZD1)에서 높은 함량을 나타내었으며 반대로 Sal B의 함량은 국내산 품종보다 중국산 단삼 품종 (ZD1)에서 더 낮은 수준을 나타내었다 (Table 3).
특히 DS의 경우 국내산 품종은 0.046 – 0.048 ㎍/㎎·EX을 나타낸 반면 중국산 단삼 품종 (ZD1)은 0.071 ± 0.00 ㎍/㎎·EX 함량을 나타내어 약 36% 중국산 단삼 품종이 더 높은 함량을 나타내었고, LA는 중국산 단삼 품종 (ZD1)의 경우 9.00 ± 0.63 ㎍/㎎·EX, 국내 품종은 3.437 – 3.963 ㎍/㎎·EX의 함량을 나타내어 2.6 배 높은 함량을 나타내었다. 반면 Sal B는 중국산 단삼 품종 (ZD1)에서 49.61 ± 3.35 ㎍/㎎·EX인데 비하여 국내 품종의 경우 61.677 – 72.877 ㎍/㎎·EX의 수준으로 높게 나타나 중국산 단삼 품종 (ZD1)의 Sal B의 함량은 국내 품종에 비교하여 약 68% 수준으로 낮은 경향을 나타내었다 (Table 3).
수율이 고려된 건조 원물에 대한 각 성분의 함량에서는 DS를 제외한 모든 phenolic acid의 함량이 국내 품종이 중국산 단삼 품종 (ZD1)보다 더 높은 수준으로 확인되었다 (Table 4).
위의 결과를 통하여 수확 후 건조 및 보관 방법 등이 명확히 확인되지 않는 2020년 생산되어 제품화된 중국산 단삼 품종 (ZD1)과 수확 후 시간이 지난 제품 (2019년에 수확되어 1차 가공되어 상온에서 보관된 국내 품종)에서 나타나는 지표 물질인 Sal B 분해와 저분자 phenolic acid로의 전환과 증가를 이루어짐을 확인할 수 있었다.
이러한 결과는 남단삼 (S. bowleyana Dunn)을 대상으로 하여 Sal B를 분리 정제, 정량하고 gastric cancer cells에 대한 항암 효과를 확인한 연구에서 Sal B가 LA와 DS의 축합을 통해 형성된다는 보고 (Chen et al., 2020)와 Sal B의 생물 전환에 있어 alkaline solution 환경에서 (pH 10) Fusarium oxysporum의 작용으로 ester 결합 해리됨으로써 LA와 DS로 가수분해되고 다시 또 다른 ester 결합의 해리로 인하여 prolithospermic acid로 전환되는 생물 전환이 이루어지며 Sal B를 오랫동안 저장하기 위하여 pH 7의 환경을 유지하여야 한다는 보고 (Kan et al., 2012) 및 빛의 노출에 따라 Sal B가 단량체인 PCA로 분해된다는 연구와 (Li et al., 2009) 추출이나 가공 과정에서 적용되는 가열 조건은 Sal B를 DS와 CA로 분해될 수 있다는 보고 (Pang et al., 2016)를 고려하여 볼 때 수확·건조 후 보관된 단삼의 경우 명확한 저장 조건이 제공되지 않은 상태에서 보관 기간이 길어지면 지표 물질이 되는 Sal B를 포함한 salvianolic acid 계열 물질이 다른 저분자의 phenolic acid 계열 물질로 분해될 수 있으며 이에 따라 원물에서의 지표 성분에 대한 감소가 이루어진다는 것을 알 수 있었다.
또한 연도별, 품종별 함량 변이의 데이터를 바탕으로 한 상관관계를 분석한 Pearson’s correlation heatmap에서 수용성의 phenolic acid 중 Sal B는 수용성의 phenolic acid 중 RA의 경우 Sal B과 양의 상관관계 (R2 = 0.418)를 나타낸 반면 Sal B의 분해와 관계된 저분자의 phenolic acid인 CA (R2 = -0.431), PCA (R2 = -0.421), LA (R2 = -0.361), DS (R2 = -0.361)와 음의 상관관계를 나타내었다. 이러한 Sal B와 음의 상관관계를 나타낸 저분자의 phenolic acid는 Sal C에서 Sal B와의 음의 상관관계보다 더 높은 수준의 음의 상관관계를 나타내었다 (Fig. 3).
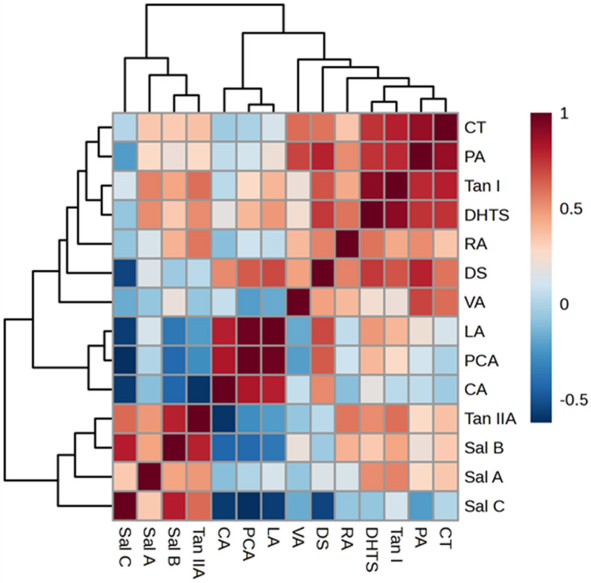
Pearson’s correlation heatmap showing the correlation between each of 14 pharmaceutical constituents in Korean cultivars and Chinese cultivar of Salvia miltiorrhiza root. DS; danshensu, PA; protocatechuic acid, PCA; protocatechuic aldehyde, ;VA vanillic acid, CA; caffeic acid, RA; rosmarinic acid, LA; lithospermic acid, Sal B; salvianolic acid B, Sal A; salvianolic acid A, Sal C; salvianolic acid C, DHTS; dihydrotanshinone I, CT; cryptotanshinone, Tan I; tanshinone I, TanIIA; tanshinone IIA. The darker red color indicates proportional correlation, while the darker blue color indicates inverse correlation.
Di 등 (2013)은 RA는 Sal B의 전구물질로 작용하며 RA가 산화로 phenoxyl radical을 형성하고 형성된 2개의 phenoxyl radical이 자발적인 결합으로 Sal B를 합성할 수 있다고 하였으며, 단삼에서 존재하는 phenylalanine ammonia-lyase (PAL)의 촉매 활성에 의하여 rosmarinic acid의 축적을 증가시키고, SmPAL1 (phenylpropanoid pathway에서 phenylalanine을 phenylalanine ammonia-lyase의 작용에 의하여 4-coumaroyl-CoA를 전환)의 발현을 억제하면 RA와 Sal B, 모두 그 함량이 감소한다고 보고하여 (Song et al., 2011), RA와 Sal B는 합성 기전에서 같은 경향의 함량 변이를 나타냄을 확인할 수 있었다.
또한 Sal B의 분해 가능 경로에서 고온, 알칼리성 조건 및 장액 환경 (simulated intestinal Àuids, SIF)에서 분해되어 Sal B의 푸란 고리 (furan ring)가 절단되면 Sal D 또는 Sal E가 생성되고 다시 Sal E는 결합 및 재배열로 인해 Sal C가 생성될 수 있을 뿐 아니라 Sal C는 Sal B로부터 CA가 소실되어 형성되는 LA가 추가로 분해되면 생성되는 생성물임을 제시한 연구 결과 (Xu et al., 2008)를 비교하여 볼 때 Sal B와 합성 기전에 관여하는 전구물질인 RA의 함량은 양의 상관관계를, Sal B와 분해 기전에 관여하는 CA, LA 등의 다른 저분자의 phenolic acid 계열 성분의 함량은 음의 상관 관계에 있으며 CA, LA 등의 다른 저분자인 phenolic acid의 추가적인 분해를 통해 나타나는 Sal C가 음의 상관관계를 나타냄을 확인할 수 있었다 (Fig. 3).
메탄올 추출물 ㎎당 소수성의 tanshinone 계열 성분의 함량 비교에서 서로 다른 연도 (2019년 및 2020년)에 수확한 국내산 단삼 품종 3 종 (다산, 고산, 홍단)을 비교하였을 때, 2020년 생산된 단삼보다 2019년에 생산한 단삼에서 tanshinone 계열 성분 4 종 중 DHTS, Tan I, CT는 모든 품종에서 증가하는 경향을 나타내었으며 특히 CT의 경우 홍단, 고산, 다산 품종에서 2020년 생산된 단삼의 경우 각각 1.15 ± 0.30 ㎍/㎎·EX, 1.06 ± 0.29 ㎍/㎎·EX, 1.44 ± 0.13 ㎍/㎎·EX을 나타낸 것에 비하여 2019년 생산된 단삼의 경우 각각 6.21 ± 1.14, 3.32 ± 0.40, 2.85 ± 1.56 ㎍/㎎·EX으로 2 배에서 6 배 수준으로 더 높은 함량을 나타내었다. 또한 홍단 품종에서 Tan I의 경우 2019년 생산된 단삼에서의 함량이 (13.27 ± 1.91 ㎍/㎎·EX) 2020년 생산된 단삼 (6.77 ± 0.37 ㎍/㎎·EX) 보다 약 2 배 이상 높은 것을 확인할 수 있었다. 반면 TanIIA의 경우 연도별 함량에 있어 낮은 수준의 함량적 차이를 나타내었으나 통계학적으로 큰 의미가 있는 변이는 없었다 (Table 5).

Hydrophobic diterpenoid quinones contents of methanolic extracts in S. miltiorrhiza Bunge by different cultivars and crop years
반면 수율이 고려된 건조 원물에 대한 각 tanshinone 계열 성분의 함량을 연도별로 비교하였을 경우 2019년에 생산된 단삼에서 2020년 생산된 단삼보다 DHTS, Tan I, CT이 증가하는 경향은 유사하였으며 그 증가 폭은 더욱 큰 경향을 나타내었고 반대로 TanIIA의 경우 2020년 생산된 단삼에 비하여 2019년에 생산된 단삼에서 통계적으로 유의한 수준으로 감소함을 확인할 수 있어 메탄올 추출물 ㎎당 tanshinone 계열 성분의 변이에서 관찰된 경향성을 수율이 고려된 건조 원물 당 tanshinone 계열 성분의 변이를 통해 더욱 확실히 알 수 있었다 (Table 6).

Hydrophobic diterpenoid quinones contents of of raw material in S. miltiorrhiza Bunge by different cultivars and crop years
동일 연도에 재배한 국내산 단삼 품종 3 종 (다산, 고산, 홍단)과 중국산 단삼 품종 (ZD1)의 함량 차이를 메탄올 추출물 ㎎ 당 tanshinone 계열의 각 성분 함량으로 비교에서 하였을 경우 국내산 품종보다 중국산 단삼 품종 (ZD1)에서 DHTS, Tan I, CT의 함량은 유의적으로 높았지만, TanIIA의 경우 반대로 낮은 함량을 나타내었다 (Table 5). 하지만 수율이 고려된 건조 원물에 대한 각 tanshinone 계열 성분의 함량 분석의 결과를 고려하여 보면 중국산 단삼 품종 (ZD1)에서 DHTS, Tan I, CT의 함량이 높은 것은 정해진 농도의 추출물에서의 상대적 함량에 근거한 것으로 추출 수율을 고려하였을 때 모든 tanshinone 계열 성분이 국내산 품종이 가지는 성분 함량보다 낮은 수준을 나타내었다 (Table 6).
연도별, 품종별 함량 변이의 데이터를 바탕으로 Pearson’s correlation heatmap으로 가시화하여 단삼에 포함되는 각 성분의 상관관계를 분석한 결과 TanIIA는 DHTS (R2 = 0.524), Tan I (R2 = 0.601), CT (R2 = 0.362) 등의 tanshinone 계열 성분보다 단삼의 지표성분으로 알려진 Sal B (R2 = 0.792)와 더 높은 수준의 양의 상관관계를 나타냄을 확인할 수 있었다 (Fig. 3).
이러한 연구 결과는 제안된 tanshinone 계열 성분의 생합성 경로에 관여하는 단백질의 발현에서 합성 메커니즘의 전반에 cytochromes P450 유전자가 큰 역할을 하고 있으며 cytochromes P450 중 하나인 CYP76AK1의 상향 조절에 의하여 tanshinone 계열 성분의 생산이 증가할 수 있으며 (Contreras et al., 2019), RNA interference에 의한 CYP76AK1 유전자 발현의 억제로 TanIIA, Tan I, CT의 농도가 함께 낮아진다는 연구 결과를 비교하여 볼 때 (Guo et al., 2016), cytochromes P450의 상향 조절과 이에 따른 높은 수준으로 생산되는 TanIIA이 합성 경로의 downstream에 해당하는 다른 tanshinone 계열 성분의 축적에 중요한 역할을 한다는 것을 나타낸다고 하겠다.
또한 TanIIA의 성분이 다른 어떠한 성분보다도 Sal B의 성분과 큰 양의 상관관계를 가진다는 것은 품질 표준화와 품질평가에 있어 보관 과정이나 저장 조건의 부적합으로 인해 화학적 변화가 큰 지표 물질인 Sal B와 함께 비교적 해당 성분이나 함량 변화에 영향성이 적은 지용성의 TanIIA의 성분을 함께 고려하여 기준을 설정, 평가하는 것이 필요하다고 할 수 있겠다.
국내산 단삼 품종 3 종 (다산, 고산, 홍단) 간 비교에서는 tanshinone 계열의 각 성분 함량과 총량에서 홍단이 가장 높았으며 그다음으로 다산, 고산 순으로 확인되었다 (Table 6, Fig. 2).
3. 수확연도별 국내산 단삼 품종 3 종과 중국산 단삼 품종의 총페놀, 총플라보노이드, 총터페노이드 함량 분석
2019년도와 2020년도에 수확된 국내산 단삼 품종 3 종 (다산, 고산, 홍단) 시료로부터 100% 메탄올 추출물을 대상으로 TPC 함량과 TFC, TTC 함량을 측정하고 중국산 단삼 품종의 추출물과 비교한 결과는 Table 7과 같다.
서로 다른 연도 (2019년 및 2020년)에 수확한 국내산 단삼 품종 3 종 (다산, 고산, 홍단)을 비교하였을 때, TPC 함량은 2020년 생산된 단삼보다 2019년에 생산한 단삼에서 더 높은 함량을 나타내었으며 TFC의 경우 2019년이 통계적으로 약간 높은 경향을 나타내었으나 큰 변화를 나타내지는 않았고 TTC의 경우 거의 변화가 없었다 (Table 7).

Total phenol, total flavonoid and total terpenoid contents of methanolic extracts in S. miltiorrhiza Bunge by different cultivars and crop years
이러한 연구 결과는 백자작나무 (Betula pubescens ssp. tortuosa) 잎의 TPC와 개별 저분자량 페놀의 변화 연구에서 TPC와 phenolic acid 및 저분자의 phenol성 화합물의 함량이 양(+)의 상관관계를 가진다는 보고 (Nurmi et al., 1996)와 저분자의 phenolic acid의 함량이 증가는 2 개 이상의 페놀기가 중합이나 축합된 형태의 polyphenol보다 총 페놀 함량의 함량 증가에 더 높은 수준으로 기여한다는 보고 (Carregosa et al., 2019)를 비교하여 볼 때 2019년에 생산한 단삼에서 더 높은 TPC와 TFC를 나타낸 것은 Sal B 등의 폴리페놀 지표성분이 저분자의 phenolic acid로 분해․전환되었기 때문으로 판단된다.
국내산 단삼 품종 3 종 (다산, 고산, 홍단) 간의 TPC를 비교하였을 때 2019년, 2020년 모두 홍단 품종이 가장 높은 함량을 보였고, 2020년에 생산된 다산 품종과 고산 품종은 차이를 나타내지 않았으나 2019년에 생산된 다산 품종은 고산 품종보다 높은 함량을 나타내었고 동일 연도에 재배한 국내산 단삼 품종 3 종 (다산, 고산, 홍단)은 중국산 단삼 품종 (ZD1)보다 더 높은 함량을 보였다.
TFC의 경우 2020년에 생산된 국내산 단삼 품종 3 종 (다산, 고산, 홍단) 간 함량 차이를 나타내지 않았으나 2020년에 생산된 국내산 품종의 경우 홍단 품종이 가장 높은 함량을 나타내었고 다산, 고산 순으로 확인되었으며 모든 국내산 단삼 품종이 중국산 단삼 품종 (ZD1)보다 높은 함량을 나타내었다 (Table 7).
TTC에서 2019년, 2020년에 생산된 홍단 품종에서 가장 높은 함량을 나타내었으나 다산 품종과 비교하여 통계적으로 유의적인 수준은 아니었으나 각 연도에 생산된 홍단 품종과 다산 품종의 TTC는 고산 품종의 함량에 비하여 약 4 배 수준으로 높았고 고산 품종의 TTC는 가장 낮은 함량인 중국산 단삼 품종 (ZD1)과 유사한 수준을 나타내었다. 국내산 단삼 품종 중 홍단 품종이 모든 연차에서 기존의 국내 품종인 다산과 고산보다 모든 부분에서 가장 높은 함량을 보였고, TPC, TFC, TTC 결과는 품종별로 모두 같은 양상을 나타내었다 (Table 7).
4. 단삼의 색차, 14 종 약리활성 물질 함량, 총페놀, 총플라보노이드, 총터페노이드 함량 간 상관관계 분석
앞서 분석된 각 시료가 나타내는 색차, 14 종의 단삼의 약리활성물질에 대한 함량, TPC, TFC, TTC의 함량 사이의 상관관계를 Pearson’s correlation heatmap으로 확인한 결과는 Fig. 4과 같다.
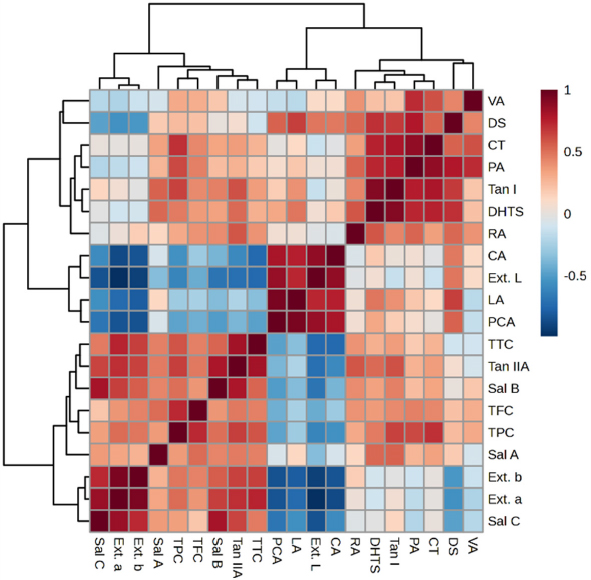
Pearson’s correlation heatmap showing the correlation between 14 pharmaceutical constituents, color index, total phenol, total flavonoid and total terpenoid content in Korean cultivars and Chinese cultivar of S. miltiorrhiza root. DS; danshensu, PA; protocatechuic acid, PCA; protocatechuic aldehyde, ;VA vanillic acid, CA; caffeic acid, RA; rosmarinic acid, LA; lithospermic acid, Sal B; salvianolic acid B, Sal A; salvianolic acid A, Sal C; salvianolic acid C, DHTS; dihydrotanshinone I, CT; cryptotanshinone, Tan I; tanshinone I, TanIIA; tanshinone IIA, color parameters [(Ext. L; lightness, Ext. a; (+) redness, Ext. b; (+) yellowness) and TPC; total phenol content are expressed as gallic acid equivalence (㎍/㎖ extract), TFC; total flavonoid content are expressed as quercetin equivalence (㎍/㎖ extract), TTC; total terpenoid content are expressed as ursolic acid equivalence (㎍/㎖ extract). The darker red color indicates proportional correlation, while the darker blue color indicates inverse correlation.
추출물에 대한 적색도를 나타내는 a*와 유의적인 양의 상관관계를 나타내는 것은 Sal A (R2 = 0.847), Sal C (R2 = 0.847), TanIIA (R2 = 0.707), Sal B (R2 = 0.653)의 순으로 나타났으며 salvianolic acid 계열 화합물을 제외한 저분자의 phenolic acid와는 음의 상관관계를 나타내었으며 (CA ; R2 = -0.869, LA ; R2 = -0.731, DS ; R2 = -0.544, PA ; R2 = -0.168) tanshinone 계열의 화합물 중 TanIIA을 제외한 DHTS, CT, Tan I과는 연관성이 적은 것으로 확인되었다. 또한 황색도를 나타내는 b*와 각 성분과의 상관관계는 적색도를 나타내는 a*와 동일한 양상으로 상관성을 나타내는 것을 확인하였다 (Fig. 4).
Wei 등 (2015)은 중국의 2년생 단삼을 채취하여 유효성분 HPLC 분석 및 색차 분석의 연관성을 보았을 때 단삼의 색이 붉을수록 Sal B와 TanIIA의 함량이 높은 것으로 나타났고, 특히 이러한 색상의 변화는 수용성 성분보다 지용성 성분 함량에 더 영향을 준다고 하였다. 또한 Shi 등 (2018)에서도 품종, 산지, 채취 시간이 다른 중국의 18 종의 단삼을 대상으로 성분 분석과 색차 분석을 진행하였을 때 단삼의 색이 붉을수록 TanIIA와 Sal B 함량이 높다고 보고하였다.
이상의 연구 결과와 비교하여 본 연구에서는 단삼 추출물의 색차와 14 종의 단삼의 약리활성물질의 함량 간 상관관계에서 TanIIA, Sal B이 영향을 미치며 Sal B보다는 TanIIA가 더 높은 상관관계를 나타내는 것은 동일하게 나타났으나 단삼 추출물의 적색도는 Sal A나 Sal C와 같은 다른 salvianolic acid 계열의 함량과도 높은 수준의 상관관계를 나타내며 TanIIA 이외의 다른 tanshinone 계열 화합물의 함량과는 큰 연관성을 가지지 못하는 것으로 확인되었다.
TTC의 경우 14 종의 단삼의 약리활성물질의 함량, 적색도와의 상관관계에 있어서도 TTC 함량은 TanIIA와 가장 높은 양의 상관관계 (R2 = 0.822)를 나타내었으며 적색도와도 높은 양의 상관관계 (R2 = 0.739)를 나타내었기에 TanIIA가 TTC 함량과 적색도에 가장 많은 영향을 끼치는 요소인 것을 알 수 있었으며 5 종의 약용작물로부터 TPC, TFC와 항산화 활성의 상관관계를 검정한 연구에서 가장 높은 TTC를 나타낸 고량강 (高良薑, Alpinia offcinarum Hance)이 가장 높은 superoxide anion radical (O2•-) 소거 활성을 나타내었다는 연구 결과를 고려하여 볼 때 (Chang et al., 2012) 단삼에서의 TanIIA의 함량, TTC, 적색도는 단삼의 품질과 기능성을 평가하고 표준화할 수 있는 지표가 될 수 있음을 확인하였다.
이와 함께 가장 높은 수준의 TanIIA의 함량, TTC, 적색도를 나타낸 국내산 품종인 홍단 품종은 기존 국내 품종보다 더 많은 유효성분 함량을 가진 차세대 품종이라고 판단된다.
TPC, TFC의 경우 PCA, LA, CA를 제외하고는 모두 양의 상관관계를 나타내었으며 CT, TanIIA, Tan I, Sal B와 함께 PA가 다른 저분자의 phenolic acid인 PCA, LA, CA와는 다르게 TPC, TFC에 대하여 각각 유의미한 수준의 양의 상관관계 (R2 = 0.623, R2 = 0.455)를 나타낸 바, TPC, TFC에 영향을 미치는 저분자의 phenolic acid 중에서도 PA가 가장 크게 기여한다는 것을 알 수 있었으며 이러한 연구 결과는 단삼의 Sal B에 대한 안정성 연구에서 pH와 온도에 따라 17 개의 분해 산물을 형성할 수 있으며 (Xu et al., 2008) Sal B의 분해로 형성되는 다른 저분자의 phenolic acid에 PA는 포함되지 않는 결과를 고려하여 볼 때 PA가 활성 물질의 함량 및 품질관리에 사용될 수 있는 저분자의 phenolic acid 중 하나임을 확인할 수 있었다.
본 연구를 통하여 국내산 단삼 품종 3 종 (다산, 고산, 홍단)과 중국산 단삼 품종 (ZD1) 간의 색차, HPLC 분석을 통한 14 종의 단삼의 약리활성물질의 함량, TPC, TFC, TTC 함량을 검정·비교하였으며 기존 지표 물질로 알려진 Sal B 이외에 품질을 평가하거나 표준화할 수 있는 지표로 TanIIA 함량, 적색도, TTC 함량을 활용할 수 있음을 제시하였으며 이러한 분석을 통하여 국내산 단삼 품종 3 종 중에서도 “홍단” 품종의 우수성을 제시하였다.
단삼과 같은 생약을 의약품 원료로 제제화하여 임상에 사용하는 경우 일반적으로 다른 생약 소재와의 시너지 효과를 위하여 복합제제로 구성하고 이러한 복합제제의 구성을 위해 다른 생약 소재와 함께 열수로 통합 추출하는 경우가 대부분이다. 하지만 이런 경우 지표 물질인 Sal B는 열에 의한 CA 및 DS 같은 저분자의 phenolic acid로 분해·전환될 수 있다는 점, 지용성 성분인 tanshinone 계열의 성분은 열수로 추출하는 경우 미량의 함량밖에 얻을 수 없다는 점을 고려해 볼 때 추후 품질을 평가할 수 있는 새로운 지표 물질과 기준을 제시하고 단삼의 약리효과를 온전하게 나타낼 수 있는 제제를 구축하여 유용한 지용성의 이차대사산물을 효과적으로 추출하여 활용할 수 있는 안전하고 효과적인 추출 방법의 개발과 품질 표준화 방법이 필요하다고 하겠다.
Acknowledgments
본 성과물은 농촌진흥청 연구사업(과제번호: RS-2022-RD010073)에 의해 이루어진 결과로 이에 감사드립니다
References
-
Biswajit B, Mimi G, Md. A.A, Kishor M and Samir K.S. (2021). Terpenoids enriched ethanol extracts of aerial roots of Ceriops decandra(Griff.) and Ceriops tagal(Perr.) promote diuresis in mice. Heliyon. 7:e07580. chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.cell.com/heliyon/pdf/S2405-8440(21)01683-2.pdf, (cited by 2023 October 16).
[https://doi.org/10.1016/j.heliyon.2021.e07580]

-
Carregosa D, Carecho R, Figueira I and N Santos C. (2019). Low-molecular weight metabolites from polyphenols as effectors for attenuating neuroinflammation. Journal of Agricultural and Food Chemistry. 68:1790-1807.
[https://doi.org/10.1021/acs.jafc.9b02155]

-
Chang CL, Lin CS and Lai GH. (2012). Phytochemical characteristics, free radical scavenging activities, and neuroprotection of five medicinal plant extracts. Evidence-Based Complementary and Alternative Medicine. 2012:98429. https://www.hindawi.com/journals/ecam/2012/984295/, (cited by 2023 October 23).
[https://doi.org/10.1155/2012/984295]

-
Chen B, Huang C, Zhang Y, Tang X, Li S, Wang Q and Lin Y. (2020). Salvia bowleyana Dunn root is a novel source of salvianolic acid B and displays antitumor effects against gastric cancer cells. Oncology Letters. 20:817-827.
[https://doi.org/10.3892/ol.2020.11611]

-
Chen H, Zhang Q, Wang X, Yang J and Wang Q. (2011). Qualitative analysis and simultaneous quantification of phenolic compounds in the aerial parts of Salvia miltiorrhiza by HPLC-DAD and ESI/MSn. Phytochemical Analysis. 22:247-257.
[https://doi.org/10.1002/pca.1272]

-
Chen X, Deng Y, Xue Y and Liang J. (2012). Screening of bioactive compounds in Radix Salviae miltiorrhizae with liposomes and cell membranes using HPLC. Journal of Pharmaceutical and Biomedical Analysis. 70:194-201.
[https://doi.org/10.1016/j.jpba.2012.06.030]

-
Chen YH, Lin SJ, Ku HH, Shiao MS, Lin FY, Chen JW and Chen YL. (2001). Salvianolic acid B attenuates VCAM-1 and ICAM-1 expression in TNF-alpha-treated human aortic endothelial cells. Journal of Cellular Biochemistry. 82:512-521.
[https://doi.org/10.1002/jcb.1176]

- Choi DW, Kim DC, Lee HA and Lim CR. (2020). Statistical difference of production efficiency in medicinal crop farm. Journal of Korean Society for Quality Management. 48:453-462.
-
Contreras A, Leroy B, Mariage PA and Wattiez R. (2019). Proteomic analysis reveals novel insights into tanshinones biosynthesis in Salvia miltiorrhiza hairy roots. Scientific Reports. 9:5768. https://www.nature.com/articles/s41598-019-42164-3, (cited by 2023 October 23).
[https://doi.org/10.1038/s41598-019-42164-3]

-
Di P, Zhang L, Chen J, Tan H, Xiao Y, Dong X, Zhou X and Chen W. (2013). 13C Tracer reveals phenolic acids biosynthesis in hairy root cultures of Salvia miltiorrhiza. ACS Chemical Biology. 8:1537-1548.
[https://doi.org/10.1021/cb3006962]

-
Dong Y, Morris-Natschke SL and Lee KH. (2011). Biosynthesis, total syntheses, and antitumor activity of tanshinones and their analogs as potential therapeutic agents. Natural Product Reports. 28:529-542.
[https://doi.org/10.1039/c0np00035c]

-
Guo J, Ma X, Ca, Y, Ma Y, Zha, Z, Zhou YJ, Liu W, Guan M, Yang J, Cui G, Kang L, Yang L, Hhen Y, Tang J, Lin H, Ma X, Jin B, Liu Z, Peters RJ, Zha ZK, and Huang L. (2016). Cytochrome P450 promiscuity leads to a bifurcating biosynthetic pathway for tanshinones. New Phytologist. 210:525-534.
[https://doi.org/10.1111/nph.13790]

- Han WS. (2004). Isolation of antimicrobial compounds from Salvia miltiorrhiza Bunge. Korean Journal of Medicinal Crop Science. 12:179-182.
-
Ho JHC and Hong CY. (2011). Salvianolic acids: small compounds with multiple mechanisms for cardiovascular protection. Journal of Biomedical Science. 18:30. https://jbiomedsci.biomedcentral.com/articles/10.1186/1423-0127-18-30, (cited by 2023 October 16).
[https://doi.org/10.1186/1423-0127-18-30]

-
Hou JJ, Wu WY, Da J, Yao S, Long HL, Yang Z, Cai LY, Yang M, Liu X, Jiang BH and Guo DA. (2011). Ruggedness and robustness of conversion factors in method of simultaneous determination of multi-components with single reference standard. Journal of Chromatography A. 1218:5618-5627.
[https://doi.org/10.1016/j.chroma.2011.06.058]

-
Hu Q, Wei B, Wei L, Hua K, Yu X, Li H and Ji H. (2015). Sodium tanshinone IIA sulfonate ameliorates ischemia-induced myocardial inflammation and lipid accumulation in Beagle dogs through NLRP3 inflammasome. International Journal of Cardiology. 196:183-192.
[https://doi.org/10.1016/j.ijcard.2015.05.152]

-
Jenks AA and Kim SC. (2013). Medicinal plant complexes of Salvia subgenus Calosphace: An ethnobotanical study of new world sages. Journal of Ethnopharmacology. 146:214-224.
[https://doi.org/10.1016/j.jep.2012.12.035]

-
Jiang P, Li C, Xiang Z and Jiao B. (2014). Tanshinone IIA reduces the risk of Alzheimer’s disease by inhibiting iNOS, MMP-2 and NF-κBp65 transcription and translation in the temporal lobes of rat models of Alzheimer’s disease. Molecular Medicine Reports. 10:689-694.
[https://doi.org/10.3892/mmr.2014.2254]

-
Joeng JT, Lee JH, Lee WM, An TJ, Hur M, Ma KH, Kim YG and Han JW. (2023). Cultivation and quality characterization of new variety Salvia miltiorrhiza ‘Dasan’. Korean Journal of Medicinal Crop Science. 31:371-376.
[https://doi.org/10.7783/KJMCS.2023.31.6.371]

-
Kan S, Lin H, Li JA, Shao L and Chen D. (2012). Biotransformation of salvianolic acid B by Fusarium oxysporum f. sp. cucumerinum and its two degradation routes. Natural Product Communications. 7:885-888.
[https://doi.org/10.1177/1934578X1200700720]

- Kang JS. (2004). Research report. Development of quantitative method and analysis of standard compounds from crude drugs(II). Korean Food and Drug Administration. Cheongju, Korea. p.2.
-
Khan RA, Khan MR, Sahreen S and Ahmed M. (2012). Evaluation of phenolic contents and antioxidant activity of various solvent extracts of Sonchus asper(L.) Hill. Chemistry Central Journal. 6:12. https://bmcchem.biomedcentral.com/articles/10.1186/1752-153X-6-12, (cited by 2023 October 22).
[https://doi.org/10.1186/1752-153X-6-12]

- Lee Ay, Chun JM, Jang S, Choo BK, Lee Hw and Kim HK. (2008). Change of quality in Poncirus trifoliata Rafinesque according to storage conditions. Korean Journal of Medicinal Crop Science. 16:188-191.
-
Li LN. (1998). Biologically active components from traditional Chinese medicines. Pure and Applied Chemistry. 70:547-554.
[https://doi.org/10.1351/pac199870030547]

-
Li MH, Peng Y and Xiao PG. (2010). Distribution of tanshinones in the genus Salvia(family Lamiaceae) from China and its systematic significance. Journal of Systematics and Evolution. 48:118-122.
[https://doi.org/10.1111/j.1759-6831.2010.00070.x]

-
Li W and Qu H. (2010). Rapid quantification of phenolic acids in Radix Salvia miltrorrhiza extracts solutions by FT-NIR spectroscopy in transflective mode. Journal of Pharmaceutical and Biomedical Analysis. 52:425-431.
[https://doi.org/10.1016/j.jpba.2010.01.009]

-
Li YG, Song L, Liu M, Hu ZB, Wang ZT. (2009). Advancement in analysis of Salviae miltiorrhizae Radix et Rhizoma(Danshen). Journal of Chromatography A. 1216:1941-1953.
[https://doi.org/10.1016/j.chroma.2008.12.032]

-
Liu H, Wang X, Wang D, Zou Z and Liang Z. (2011). Effect of drought stress on growth and accumulation of active constituents in Salvia miltiorrhiza Bunge. Industrial Crops and Products. 33:84-88.
[https://doi.org/10.1016/j.indcrop.2010.09.006]

-
Liu XH, Xu HJ, Sun SQ, Huang J, Li GY, Zhu Y, Gao HY, Zhang ZC and Wang JH. (2012). Analysis and identification of Chinese drugs by three-step infrared spectroscopy-A case study of Danshen. Analytical Methods. 4:3344-3350.
[https://doi.org/10.1039/c2ay25554e]

- Ministry of Agriculture, Food and Rural Affairs(MAFRA). (2018). Special crops production statics. Ministry of Agriculture, Food and Rural Affairs. Sejong, Korea. p.4-6.
- Ministry of Agriculture, Food and Rural Affairs(MAFRA). (2021). Special crops production statics. Ministry of Agriculture, Food and Rural Affairs. Sejong, Korea. p.4-6.
-
Mannelli LDC, Piccolo M, Maione F, Ferraro MG, Irace C, De Feo V, Ghelardini C and Mascolo N. (2018). Tanshinones from Salvia miltiorrhiza Bunge revert chemotherapy-induced neuropathic pain and reduce glioblastoma cells malignancy. Biomedicine and Pharmacotherapy 105:1042-1049.
[https://doi.org/10.1016/j.biopha.2018.06.047]

-
Martelanc M, Vovk I and Simonovska B. (2009). Separation and identification of some common isomeric plant triterpenoids by thin-layer chromatography and high-performance liquid chromatography. Journal of Chromatography A. 1216:6662-6670.
[https://doi.org/10.1016/j.chroma.2009.07.038]

-
Martínez-Cruz O and Paredes-López O. (2014). Phytochemical profile and nutraceutical potential of chia seeds(Salvia hispanica L.) by ultra high performance liquid chromatography. Journal of Chromatography A. 1346:43-48.
[https://doi.org/10.1016/j.chroma.2014.04.007]

- Ministry of Food and Drug Safety(MFDS). (2022). The Korean pharmacopoeia. Ministry of Food and Drug Safety. Chongju, Korea. p.25-26.
- Moon BC, Choi G and Yuan Y. (2017). Origins of herbal medicines and adulterants in Korea and China. Korea Institute of Oriental Medicine. Daejeon, Korea. p.35.
-
Nurmi K, Ossipov V, Haukioja, E and Pihlaja K. (1996). Variation of total phenolic content and individual low-molecular-weight phenolics in foliage of mountain birch trees(Betula pubescens ssp. tortuosa). Journal of Chemical Ecology, 22:2023-2040.
[https://doi.org/10.1007/BF02040093]

-
Pang H, Wu L, Tang Y, Zhou G, Qu C and Duan J. (2016). Chemical analysis of the herbal medicine Salviae miltiorrhizae Radix et Rhizoma (Danshen). Molecules. 21:51. https://www.mdpi.com/1420-3049/21/1/51, (cited by 2023 October 10).
[https://doi.org/10.3390/molecules21010051]

-
Peng L, Ru M, Wang KR, Li B, Wang YC, Xia PG and Liang ZS. (2014). Spaceflight environment-induced variation in root yield and active constituents of Salvia miltiorrhiza. Planta Medica. 80:1029-1035.
[https://doi.org/10.1055/s-0034-1382908]

- Rural Development Administration(RDA). (2018). Guide of agricultural technology 122. The new resources plants. Rural Development Administration. Wanju, Korea. p.193-208.
- Shi D, Long Y, Dai Y, Lu Q, Zhang J, Sun L, Li G and Ni D. (2018). Scientific analysis of traditional identification experience of “Redder is better” based on correlation between intrinsic quality and appearance color of Salviae miltiorrhizae Radix et Rhizoma. Chinese Journal of Experimental Traditional Medical Formulae. 24:6-10.
- Shim KM, Kim SE and Kang SS. (2010). Effect of water extract of danshen on bone regeneration of rat calvarial defect model. Korean Journal of Veterinary Research. 50:171-177.
-
Song J and Wang Z. (2011). RNAi-mediated suppression of the phenylalanine ammonia-lyase gene in Salvia miltiorrhiza causes abnormal phenotypes and a reduction in rosmarinic acid biosynthesis. Journal of Plant Research. 124:183-192.
[https://doi.org/10.1007/s10265-010-0350-5]

- Su Y, Zhang J, Xu Z, Li J, Wang P, Song Z, Tian G, Li L, Song J and Wang J. (2021). Integrative analysis of metabolome and transcriptome reveals the mechanism of color formation in white root(Salvia miltiorrhiza). Industrial Crops and Products. 170:113784. https://www.sciencedirect.com/science/article/pii/S0926669021005483?casa_token=RghcLFTn1X4AAAAA:q7-F7wVUETXXXg-jF4EEHJPHEE6jZY5A3c4d31K1jjNW3CUmbcDhYzl7Amdn5UGwgFQY58KpUjc, (cited by 2023 October 23).
-
Sun A, Zhang Y, Li A, Meng Z and Liu R. (2011). Extraction and preparative purification of tanshinones from Salvia miltiorrhiza bunge by high-speed counter-current chromatography. Journal of Chromatography B. 879:1899-1904.
[https://doi.org/10.1016/j.jchromb.2011.05.014]

-
Wang J, Li Y, Wu S, Song G and Ye B. (2012). Study on the electrochemical properties of salvianic acid A sodium and its analytical application. Journal of the Chinese Chemical Society. 59:947-952.
[https://doi.org/10.1002/jccs.201100757]

- Wei G, Li J, Liu Q and Zhang Y. (2015). Correlation analysis between radix Salviae miltiorrhizae colour and contents of active ingredients. Shandong Agricultural Sciences. 2015:59-62.
-
Wei Y, Xu M, Ren Y, Lu G, Xu Y, Song Y and Ji H. (2016). The cardioprotection of dihydrotanshinone I against myocardial ischemia-reperfusion injury via inhibition of arachidonic acid omega-hydroxylase. Canadian Journal of Physiology and Pharmacology. 94:1267-1275.
[https://doi.org/10.1139/cjpp-2016-0036]

-
Xu M, Han J, Li HF, Fan L, Li, AH and Guo DA. (2008). Analysis on the stability of total phenolic acids and salvianolic acid B from Salvia miltiorrhiza by HPLC and HPLC-MSn. Natural Product Communications. 3:669-676.
[https://doi.org/10.1177/1934578X0800300503]

- Yang EJ, Seon YK, Seo YS and Shin BY. (2017). Component analysis and comparison of biological activities of Salvia miltiorrhiza Bunge from different cultivation regions. Journal of the Korean Society of Food Science and Nutrition. 46:929-936.
-
Yang F, Yang T, Liu K, Yang Q, Wan Y, Wang R and Li G. (2019). Analysis of metabolite accumulation related to pod color variation of Caragana intermedia. Molecules. 24:717. https://www.mdpi.com/1420-3049/24/4/717, (cited by 2023 September 22).
[https://doi.org/10.3390/molecules24040717]

-
Zhan Z, Fang W, Ma X, Chen T, Cui G, Ma Y, Kang L, Nan T, Lin H, Tang J, Zhang Y, Lai C, Ren Z, Wang Y, Zhao Y, Shen Y, Ling W, Zeng W, Guo J and Huang L. (2019). Metabolome and transcriptome analyses reveal quality change in the orange-rooted Salvia miltiorrhiza(Danshen) from cultivated field. Chinese Medicine. 14:42. https://cmjournal.biomedcentral.com/articles/10.1186/s13020-019-0265-6, (cited by 2023 September 15).
[https://doi.org/10.1186/s13020-019-0265-6]

-
Zhang H, Liu YY, Jiang Q, Li KR, Zhao YX, Cao C and Yao J. (2014). Salvianolic acid A protects RPE cells against oxidative stress through activation of Nrf2/HO-1 signaling. Free Radical Biology and Medicine. 69:219-228.
[https://doi.org/10.1016/j.freeradbiomed.2014.01.025]

-
Zhao GR, Zhang HM, Ye TX, Xiang ZJ, Yuan YJ, Guo ZX and Zhao LB. (2008). Characterization of the radical scavenging and antioxidant activities of danshensu and salvianolic acid B. Food and Chemical Toxicology. 46:73-81.
[https://doi.org/10.1016/j.fct.2007.06.034]

-
Zhao J, Hu DJ, Lao KM, Yang ZM and Li SP. (2014). Advance of CE and CEC in phytochemical analysis (2012–2013). Electrophoresis. 35:205-224.
[https://doi.org/10.1002/elps.201300321]

-
Zhao J, Lou J, Mou Y, Li P, Wu J and Zhou L. (2011). Diterpenoid tanshinones and phenolic acids from cultured hairy roots of Salvia miltiorrhiza bunge and their antimicrobial activities. Molecules. 16:2259-2267.
[https://doi.org/10.3390/molecules16032259]

-
Zhao T, Chang L, Zhang B, Lu M, Wang X, Orgah JO, Wang Y, Tian X, Yang J, Fan G, Zhang B and Zhu Y. (2017). Specific combination of salvianolic acids as core active ingredients of Danhong injection for treatment of arterial thrombosis and its derived dry gangrene. Frontiers in Pharmacology. 8:361. https://www.frontiersin.org/articles/10.3389/fphar.2017.00361/full, (cited by May 2022).
[https://doi.org/10.3389/fphar.2017.00361]

-
Zheng X, Gong X, Li Q and Qu H. (2012). Application of multivariate curve resolution method in the quantitative monitoring transformation of salvianolic acid A using online UV spectroscopy and mass spectroscopy. Industrial and Engineering Chemistry Research. 51:3238-3245.
[https://doi.org/10.1021/ie201536y]

-
Zhou GJ, Wang W, Xie XM, Qin MJ, Kuai BK and Zhou TS. (2014). Post-harvest induced production of salvianolic acids and significant promotion of antioxidant properties in roots of Salvia miltiorrhiza(Danshen). Molecules. 19:7207-7222.
[https://doi.org/10.3390/molecules19067207]

-
Zhou L, Zuo Z and Chow MSS. (2005). Danshen: An overview of its chemistry, pharmacology, pharmacokinetics, and clinical use. The Journal of Clinical Pharmacology. 45:1345-1359.
[https://doi.org/10.1177/0091270005282630]

-
Zhou S, Chen W, Su H and Zheng X. (2013). Protective properties of tanshinone I against oxidative DNA damage and cytotoxicity. Food and Chemical Toxicology. 62:407-412.
[https://doi.org/10.1016/j.fct.2013.08.084]
