한국 및 중국 재래종 생강의 형태학적 특성 및 진저롤 함량 비교
1농촌진흥청 국립원예특작과학원 인삼특작부 연구사2농촌진흥청 국립원예특작과학원 인삼특작부 연구사
3농촌진흥청 국립원예특작과학원 인삼특작부 농업주사보
4농촌진흥청 국립원예특작과학원 인삼특작부 연구관
5전북특별자치도 보건환경연구원 주무관
2Researcher, Department of Herbal Crop Research, NIHHS, RDA, Eumseong, 27709, Korea
3Researcher, Department of Herbal Crop Research, NIHHS, RDA, Eumseong, 27709, Korea
4Researcher, Department of Herbal Crop Research, NIHHS, RDA, Eumseong, 27709, Korea
5Researcher, Jeonbuk state Institute of Health and Environment, Imsil, 55928, Korea
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Ginger is a perennial herb belonging to the Zingiberaceae family, used worldwide as a spice and medicinal crop. Despite its widespread application, there are no domestically developed ginger varieties in Korea most are imported. This study aimed to lay the groundwork for future ginger breeding efforts by evaluating and comparing the agricultural characteristics and active components of native ginger varieties collected within the country and those imported from China.
Korean landrace (KL) and Chinese landrace (CL) resources were collected. KL had a greater number of stems but shorter lengths than CL. KL was characterized by densely packed slices forming a straight Type I configuration, whereas CL featured moderately packed slices in a curved Type II layout. Regarding the rhizome slices, KL comprised a higher number of smaller slices, in contrast to CL, which had fewer but significantly larger slices. The weight of KL rhizomes averaged 457.7 ± 67.8 g, surpassing that of the CL rhizomes, which weighed 394.1 ± 64.0 g, indicating a statistically meaningful difference. Further analysis of the concentration of the three gingerols (6-, 8-, and 10-gingerol) in fresh ginger revealed that KL contained a significantly higher gingerol concentration than CL.
The findings of this study are of significant value as foundational data for establishing parameters for variety breeding and for assessing each genetic resource under uniform cultivation conditions.
Keywords:
Gingerol, Zingiber officinale Rosc, Landrace, Rhizome Characteristic서 언
생강은 생강과 (Zingiberaceae)에 속하는 다년생 초본식물로 세계적으로 향신료와 약용작물로 이용되고 있다. 또한 독특한 매운맛과 향을 내며, 진저롤 (gingerol), 쇼가올 (shogaol)과 같은 풍부한 유용 성분이 함유되어 식품으로도 많이 사용되고 있다. 항산화 작용 (Siddaraju and Dharmesh, 2007), 항암 작용 (Cheng et al., 2011; Prasad and Tyagi. 2015), 항염 작용 (Grzanna et al., 2005), 진통 및 해열 작용 (Ojewole, 2006) 등 다양한 효능으로 최근에는 화장품, 생활용품, 의약품 소재 등으로 활용범위를 넓히고 있다.
생강은 세계적으로 인도와 중국, 동남아시아 등에서 많이 생산되나 일부 아프리카와 아메리카 대륙에서도 생산되고 있다. 2022년 전 세계 생강 재배면적은 511,575 ㏊, 생산량은 5,557,000 톤으로 최근 5 년 동안 점진적으로 증가하고 있다 (RDA, 2023).
2022년 국내 생강 재배면적은 2,225 ㏊, 생산량은 11,610톤으로 (RDA, 2023), 연간 변동은 있으나 대략 2,000 ㏊ 정도의 재배면적을 유지하고 있다. 경북과 충남 지역에서 약 70% 이상 재배되고 있으나 전남, 강원뿐만 아니라 제주도에서도 일부 재배되고 있다.
생강은 꽃가루의 높은 불임성으로 인해 종자 형성이 힘들어 (Jayachandran and Vijayagopal, 1979; Das et al., 1999; Dhamayanthi et al., 2003) 번식의 주된 방법은 덩이줄기를 이용한 영양번식이지만 형태학적으로 매우 다양한 특성을 보유한다 (Nayak et al., 2005; Mahdi et al., 2013).
인도와 중국에서는 생강이 다양한 지역에서 자라며 돌연변이 발생 및 자연선택과 같은 과정을 거치며 약 30 종 이상의 다양한 품종이 형성되었다 (Kizhakkayil and Sasikumar, 2011). 인도네시아에서도 근경의 크기와 색 그리고 성분 차이에 의해 생강 품종이 육성되어 emprit ginger (Zingiber officinale var amarum) 등 3 품종이 일반적으로 재배되고 있다 (Wahyuni et al., 2024).
말레이시아의 경우, 근경 형태와 내부 색, 섬유질 함량 등 차이에 따라 Halia Bentong 등 다양한 품종을 육성하여 사용하고 있다 (Mahdi et al, 2013). 그밖에 필리핀, 일본 등에도 다양한 품종이 보고되고 있으며 (Kizhakkayil and Sasikumar, 2011), 콜히친 (colchicine) (Zhou et al., 2020; Prasath et al., 2022), 감마선 (Abdullah et al., 2018; Magdy et al., 2020) 처리 등을 통해 기능 성분을 증가시키고 수량이 많은 생강 품종 육종을 육성하려는 연구가 진행되고 있다. 중국 등 아시아 4 개국 (Yudthavorasit et al., 2014), 말레이시아 (Abd Malek et al., 2005), 호주 (Johnson et al., 2021) 등에서는 재배된 생강의 gingerol 등 유효성분을 프로파일링을 진행하고 있다.
2000년대 이후 국내 생강의 품종 육성을 위해 콜히친 (colchicine) 처리를 통한 배수체 유도, 생강 개화 유도를 위한 연구 감마선 처리를 통한 우량계통 육성 등을 진행했으나 국외 대비 육종 연구는 부족한 실정이다. 2010년, 2018년에 총 2 건이 품종 출원되었으나 최종 거절되어 2024년 2월 기준으로 등록된 생강 품종은 없다 (KSVS, 2024).
국내 일부 지역에서는 오랫동안 국내 환경에 적응하여 고유한 특성을 갖춘 재래종을 재배하기도 하지만 국내 대부분의 농가에서는 매년 중국 등에서 수입한 씨생강을 이용하여 재배한 후 수확하는 것이 보통이다. 따라서 수입국의 생강 재배상황과 운송 일정 등에 영향을 받아 수입되는 씨생강의 가격 변동성이 크고 수입 씨생강에 의한 출현 지연 등 재배상 문제가 나타나기도 한다. 최근 신선 생강뿐 아니라 건조 생강 수입량 또한 점차 늘고 있어 국내 생강의 생산 기반이 흔들리고 있다. 따라서 수입을 대체하기 위해 품질이 균일하고 수량성이 높은 생강의 품종 개발이 시급하다.
현재 국내 생강은 근경 크기, 줄기 수 등 생육 특성에 따라 소강, 중강, 대강으로 구분하고 있는 일본 (Jang et al., 1997)과 같이 대, 중, 소생강으로 구분하며 부르고 있으나 분류 기준은 모호한 편이다. 또한 유통, 가공 시 유효성분 함량 변화에 대한 연구는 많으나 유전자원에 따른 형태학적 특성 조사 및 성분 분석 연구는 부족하다.
따라서 본 연구는 국내에서 수집한 지역 재래종과 중국에서 수입된 생강의 농업적 형질 특성과 유효성분을 비교함으로써 향후 품종 육성을 위한 작물학적 기초자료를 구축하기 위해 수행하였다.
재료 및 방법
1. 시험재료 및 재배 방법
본 시험에 사용한 재료는 직접 수집한 것으로, 국내 선발재래종 (KL)은 2022년 4월 충남 태안 지역에서 수집한 종 (유전자원 IT번호 345784)을 선발하여 사용하였고, 중국 재래종 (CL)은 2023년 4월 국내에 수입된 것을 사용하였다.
생강 재배는 2023년 4월 중순부터 10월 하순까지 국립원예 특작과학원 인삼특작부 시험포장 (해발 160 m)에서 실시하였다. 시비량은 퇴비 2,000 ㎏/10a, N – P2O5 - K2O을 3.5 – 3.5 - 2 ㎏/10a 전량 기비로 사용하였다. 추비의 경우, 1회 추비는 6월 말, 2회 추비는 8월 말에 N는 6.8 ㎏/10a, K2O은 4.1 ㎏/10a씩 실시하였다. 두둑 너비는 160 ㎝, 높이 30 ㎝로 만들었으며 이후 두께 약 3 ㎜의 흑색 기능성 필름으로 멀칭하였다.
씨생강은 30 g - 40 g으로 잘라 베노밀·티람 수화제로 소독한 다음 2 ㎜ - 3 ㎜ 싹을 틔운 후 사용하였다. 4월 중순, 재식거리는 40 ㎝ (주간) × 40 ㎝ (조간)으로 하여 3 열로 파종하였다. 관수, 병해충 방제 등 기타 관리는 생강 영농기술길잡이 (RDA, 2023)에 준하였다.
2. 생강 생육 특성 조사
생육 특성은 국립종자원의 생강 특성조사요령을 참고하여 20 개체를 조사하였다 (KSVS, 2010). 출아기는 5∼7월에 걸쳐 조사하였는데, 전체 파종 수의 40% 이상의 싹이 지상으로 출아 되었을 때로 산정하였다. 최종 지상부 생육 및 지하부 특성은 10월 중순에 조사하였다.
생강 식물체 높이는 성묘의 지제부부터 잎 끝까지의 길이, 줄기 길이는 성묘의 지제부부터 최상위엽 시작 부분까지의 길이를 측정하였다. 줄기 굵기는 주 줄의 지면으로부터 5 ㎝ 위의 굵기를 버니어 캘리퍼스 (Mitutoyo, Kawasaki, Japan)를 이용하여 측정하였다.
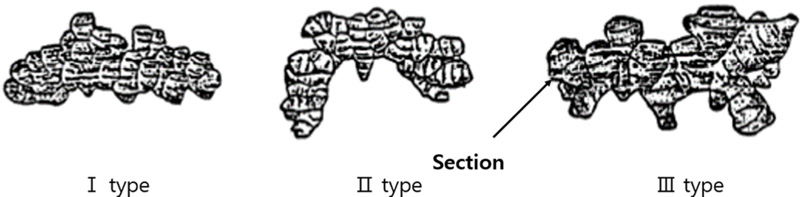
근경 형태는 Fig. 1를 참고하였고 조각 수와 크기는 자체조사 기준을 설정한 후 지수로 표현하였다. 근경 무게는 한식물체에서 형성된 모든 근경의 무게를 측정하였다.
3. 색도 측정
근경 내부 색도는 색차계 (CR-400 series, Konica Minolta Inc., Tokyo, Japan)를 이용하여 4 ㎝ 높이에서 동일한 부위 (중간)를 측정하였고 각 시료 당 10 개 이상의 명도 (L-value, lightness), 적색도 (a-value, redness), 황색도 (b-value, yellowness) 를 측정하여 평균값 ± 표준편차로 나타냈다. 표준 백색판의 L값은 97.45, a 값은 0.003, b 값은 1.59이었다.
4. 유효성분 분석
생강의 불순물을 제거하기 위해 표면의 흙을 수세하여 생강의 껍질을 벗겨낸 후, 페어퍼타올로 물기를 제거하여 분쇄한 뒤 사용하였다. 생강의 gingerol 정량은 Jo 등 (2011)의 연구를 참고하여 분석하였다. 균질화한 시료 3 g을 칭량한 후 30 ㎖ methanol (HPLC grade, Sigma-Aldrich, St. Louis, MO, USA)을 가하여 초음파 수조에서 30분간 sonication 한 후 0.45 ㎛ membrane filter로 여과한 것을 시험용액으로 사용하였다.
이동상 A는 water (HPLC grade, Sigma-Aldrich, St. Louis, MO, USA), 이동상 B는 acetonitrile (HPLC Grade, Sigma-Aldrich, St. Louis, MO, USA)로 하였으며, HPLC (1260 infinity, Agilent Technologies Inc., Santa Clara, CA, USA)를 이용하여 Table 1의 조건으로 gingerol을 정량하였다.
표준물질은 Sigma-Aldrich사 (St. Louis, MO, USA) 제품으로 6-gingerol, 8-gingerol 및 10-gingerol을 methanol에 희석하여 제조한 후 검량선을 작성하여 정량하였다.
5. 통계분석
실험 결과는 평균값 ± 표준편차로 표시하였다. 결과에 대한 통계처리는 SAS Enterprise Guide 9.4 (Statistical analysis system, 2009, Cary, NC, USA)를 이용하여 t-test로, 지상부 생육 특성과 근경 무게에 대한 상관관계는 Pearson’s correlation 분석을 실시하여 실험재료 간 유의차를 5%, 1%, 0.1% 수준에서 분석하였다 (p < 0.05, p <0.01, and p < 0.001).
결과 및 고찰
1. 생강 2종의 지상부 생육 특성
파종 약 50 일 후인 6월 초순부터 줄기 길이, 줄기 수 등 지상부 생육 차이가 나타났다 (Table 2). 줄기 길이와 줄기 수의 경우 국내 선발 재래종 (KL) 자원이 각 13.7 ± 2.4 ㎝, 5.3 ± 1.4 ㎝로 유의하게 큰 값을 나타냈지만, 줄기 굵기는 중국 재래종 (CL) 자원에서 5.0 ± 0.7 ㎜로 더 큰 값이 조사되었다.
생육 후기에는 지상부의 특성 차이가 육안으로도 쉽게 구별 되었고 (Fig. 2) 실제 생육 조사 결과 역시 뚜렷한 차이를 나타냈다. 생육 초기에 조사한 식물체 높이는 유의한 차이를 나타내지 않았으나 수확기에는 CL 자원이 67.4 ± 9.3 ㎝로 KL 자원보다 약 16 ㎝ 정도 큰 값을 나타내었다. 줄기 길이도 CL 자원이 43.9 ± 8.4 ㎝로 큰 값을 나타냈는데, 생육 초기에는 KL 자원이 줄기 길이와 식물체 높이 값이 더 크게 조사되었으나 생육이 진행될수록 CL 자원의 줄기 신장이 두드러졌다. 줄기 수의 경우, 생육 초기와 같이 KL 자원이 39.2 ± 7.6개의 줄기를 형성했는데 CL 자원에 비해 약 3 배 많은 값이었다. 줄기 굵기는 CL 자원이 유의하게 큰 수치를 나타냈다.

Morphological difference between two type of ginger after harvest. (A); KL (Korean landrace). (B); CL (Chinese landrace).
수확 직후 생강 한 개체의 모든 줄기와 잎을 떼어 무게를 조사한 결과 KL 자원이 340.8 ± 78.2 g으로 큰 값을 나타냈는데, KL 자원의 줄기가 더 많이 형성되었고 형성된 각 줄기에 달린 잎 수가 많아져 전체적으로 지상부 무게가 증가했을 것으로 추정한다.
본 연구 결과, 생강의 지상부 특성인 식물체 높이, 줄기 수 등은 자원별로 유의한 차이가 나타났으며 이는 나이지리아, 중국 등에서 자원별로 줄기 수와 굵기 등에서 차이가 난다는 결과와 일치하였다 (Chukwudi et al., 2020; Wang et al., 2014).
2. 생강 2 종의 지하부 생육 특성
지하부 생육 특성은 모든 항목에서 유의한 차이가 발생했다 (Table 3). 근경 형태의 경우, KL 자원은 조각의 밀집 정도가 높고 일직선 형태인 Ⅰ형, CL 자원은 조각의 밀집 정도가 중간이고 구부러진 Ⅱ형였다. 근경을 이루는 조각 (section)은 수량뿐만 아니라 가공적성에 영향을 주는 한 요소이다. KL 자원은 근경을 이루는 개별 조각의 크기 수가 적고 작은 형태이고 CL 자원은 개별 조각 크기 수가 적으나 큰 형태였다. 근경 무게는 KL 자원이 457.7 ± 67.8 g으로 394.1 ± 64.0 g의 CL 자원보다 높은 값을 나타내었고 통계적으로 유의미한 차이가 인정되었다.
생강 2 종의 근경을 절단하여 육질의 색을 측정한 결과, KL 자원은 회색띤 노랑색, CL 자원은 노랑색을 나타내며 미세한 차이를 나타냈다 (Fig. 3). 색차계를 이용하여 내부 색을 측정했을 때 2 종 생강의 L 값은 12.86 - 14.17, 황색도를 나타내는 b 값은 6.58 - 6.99 범위로 유의미한 차이는 없었다. 반면, 적색도를 나타내는 a 값은 KL 자원은 0.59 ± 0.11, CL 자원은 –0.12 ± 0.28로 유의미한 차이를 나타냈다 (Table 4).

Rhizome characteristic of two type of ginger.(A); Rhizome Shape. (B); Size and internal color of rhizome section. KL; Korean landrace, CL; Chinese landrace.
이는 국내산 생강과 중국산 생강의 외피 색을 비교했을 때 L 값은 중국산이 국내산보다 약간 밝은 상태, b 값은 국내산이 중국산보다 노란색이 더 많이 분포하는 등 차이를 보인 결과 (Chung et al., 1996)와 다소 차이를 보였다.
인도네시아의 경우 근경 색, 크기 등에 따라 생강을 분류하여 사용 목적을 달리하고 있고 (Supu et al., 2018), 인도, 호주 등 다양한 국가에서 품종에 따라 수량, 품질 및 근경 특성 변이에 대하여 많은 보고가 진행 중이다 (Singh, 2000; Abraham and Latha, 2003; Lincy et al., 2008; Wang et al., 2014).
본 연구 결과에서도 기존 연구와 같이 생강 자원에 따라 근경 특성과 품질에서 차이를 보였다. 근경 조각 크기 등과 같은 특성은 자원 또는 품종 고유 형질에서 기인한 것으로 생각되며 향후 품종 육성 시 조사 지표 항목으로 이용 가능할 것으로 추측한다.
3. 생강 2 종의 지상부 생육 및 근경 무게 상관관계
생강 2종의 식물체 높이, 줄기 길이, 줄기 수, 줄기 굵기, 지상부 무게와 최종 근경 무게 간의 pearson 상관관계를 분석하였다 (Table 5). 식물체 높이의 경우, KL 자원이 줄기 길이와만 상관성을 보였으나 CL 자원은 줄기 길이와 줄기 굵기 모두 상관관계를 나타내었다. 줄기 길이는 KL 자원에서 지상부 무게만이 상관성을 보였으나 CL 자원은 줄기 굵기와 지상부 무게 모두 정의 상관관계를 보였다.
근경 무게의 경우 KL, CL 자원 모두 줄기 수, 지상부 무게와 유의한 정의 상관관계를 나타냈다. 생강 수량은 지상부의 특성과 밀접한 관계가 있다고 알려졌으며 줄기 수, 잎 수 등과 정의 상관관계가 인정된다 (Roy and Wamanan, 1990; Sasikumar et al., 1992). 국내에서 수집한 98점 생강의 작물학적 특성과 수량과의 상관관계를 분석한 결과 수량은 식물체 높이, 잎 수, 잎 폭, 줄기 굵기와 고도의 상관성이 있다고 보고 (Jang et al., 1997) 한 결과와 일부 일치하였다.
본 연구 결과와 선행 문헌을 참고하였을 때 생강의 개체 당 줄기 수, 줄기 굵기, 식물체 높이와 같은 지상부 특성들은 향후 자원 선발 지표로 적합할 것으로 생각되며, 줄기 수와 지상부 무게는 근경 무게를 추정할 수 있는 지표로도 활용할 수 있을 것으로 기대한다.
4. 생강 2 종의 유효성분 함량 비교
생강은 gingerol, shogaol 등 다양한 생리활성 화합물이 포함되어 영양학적 가치를 인정받고 있다 (Butt and Sultan, 2011). 특히 gingerol은 생강의 맛과 향에 영향을 주는 휘발성 페놀 화합물로 6-, 8-, 10-gingerol 등으로 분류되며 저장, 유통 중 품질을 측정하는 지표물질로 많이 사용되고 있다 (Kim et al., 2023).
신선한 생강에서 가장 풍부한 gingerol 3 종 (6-, 8-, 10-gingerol)을 분석한 결과, gingerol 그룹 함량이 CL 자원보다 KL 자원에서 높게 분석되었고 통계적으로 유의미한 차이를 나타냈다 (Fig. 4). 성분별로 보면, 6-gingerol이 가장 높게 분석 되었는데 KL 자원은 1.278 ± 0.086 ㎎/g, CL 자원은 0.795 ± 0.044 ㎎/g이었다. 이는 6-gingerol은 gingerol 그룹 중 주요 화합물로서 타 종류의 gingerol보다 근경에 높은 농도로 존재한다는 기존 연구 (Semwal et al., 2015)와 일치하였다.
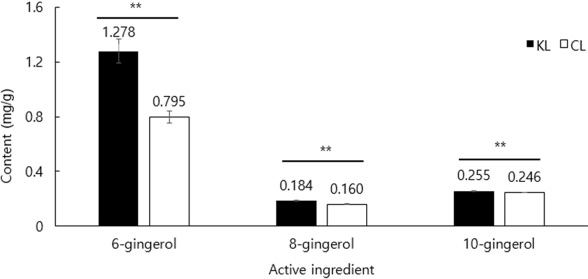
Content of gingerol of two type of ginger.KL; Korean landrace, CL; Chinese landrace. The vertical error bars represent the standard errors (n = 3). Significantly different according to Student’s t-test (*p < 0.05 and **p < 0.01).
10-gingerol 함량은 KL 자원 (0.246 ± 0.001 ㎎/g), CL 자원 (0.255 ± 0.002 ㎎/g) 이었고, 8-gingerol 역시 KL 자원 (0.184 ± 0.004 ㎎/g), CL 자원 (0.160 ± 0.003 ㎎/g) 순이었다. 신선한 생강에서 6-gingerol 함량은 일반적으로 10-gingerol의 3배 정도 높으며, 8-gingerol보다 높았다는 이전 연구와 일부 일치하였다 (Yudthavorasit et al., 2014; Johnson et al., 2021; Kim et al., 2023).
중국에서 수입된 생강과 국내 지역 재래종의 gingerol 등 유효성분을 분석했던 최근 국내 연구결과 (Kim et al., 2023) 와 본 연구의 결과를 보면, 생강 자원마다 유효성분은 차이는 발생할 수 있고 이는 자원선별 시 중요한 측정 항목으로 생각된다. 다만, 다양한 유전자원과 성분 분석을 위한 충분한 샘플 수를 마련하여 유효성분이 주요 측정항목으로 활용될 수 있도록 신뢰성을 확보해야 할 것이다.
생강은 근경의 특성에 따라 가격과 소비자 수요가 변동할 수 있는 약용 및 조미채소로 (Chukwudi et al., 2020) 보유 자원에 대한 형태학적 특성과 유용성분 함량을 분석하는 것은 품종 육성을 위한 매우 기초적이고 중요한 작업이다. 본 연구 결과는 동일한 재배 조건에서 각 자원을 평가하며 품종 육성을 위한 조사지표 설정 등 기초자료로서 가치 있을 것으로 생각된다. 그러나 국내 생강의 품종 육성을 위해 다양한 자원의 수집과 평가, 유용형질 확보 연구 등이 다각적이면서도 정기적으로 이루어져야 할 것이다.
Acknowledgments
본 논문은 농촌진흥청 연구사업(과제번호 : PJ017167)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
- Abd Malek SN, Halijah Ibrahim HI, Hong SokLai HS, Lee GuanSerm LG, Chan KamSeng CK and Mohd Ali NA. (2005). The essential oils of Zingiber officinale variants. Malaysian Journal of Science. 24:37-43.
-
Abdullah S, Kamaruddin NY and Harun AR. (2018). The effect of gamma radiation on plant morphological characteristics of Zingiber officinale Roscoe. International Journal on Advanced Science Engineering Information Technology. 8:2085-2091.
[https://doi.org/10.18517/ijaseit.8.5.4641]

- Abraham Z and Latha M. (2003). Correlation and path analysis in ginger(Zingiber officinale Rosc.). Journal of Spices and Aromatic Crops. 12:187-189.
-
Butt MS and Sultan MT. (2011). Ginger and its health claims: Molecular aspects. Critical Reviews in Food Science and Nutrition. 51:383-393.
[https://doi.org/10.1080/10408391003624848]

-
Cheng XL, Liu Q, Peng YB, Qi LW and Li P. (2011). Steamed ginger(Zingiber officinale): Changed chemical profile and increased anticancer potential. Food Chemistry. 129:1785-1792.
[https://doi.org/10.1016/j.foodchem.2011.06.026]

-
Chukwudi UP, Agbo CU, Echezona BC, Eze EI, Kutu FR and Mavengahama S. (2020). Variability in morphological, yield and nutritional attributes of ginger(Zingiber officinale) germplasm in Nigeria. Research on Crops. 21:634-642.
[https://doi.org/10.31830/2348-7542.2020.099]

- Chung TY, Jeong MC, Lee SE, Kin DC and Kim OW. (1996). Morphological characteristics of ginger depending on habitat. Korean Journal of Food Science and Technology. 25:834-840.
- Das P, Rai S and Das AB. (1999). Cytomorphological barriers in seed set of cultivated ginger(Zingiber officinale Rosc.). Iranian Journal of Botany. 8:120-129.
- Dhamayanthi KPM, Sasikumar B and Remashree AB. (2003). Reproductive biology and incompatibility studies in ginger (Zingiber officinale Rosc.). Phytomorphology. 53:123-131.
-
Grzanna R, Lindmark L and Frondoza CG. (2005). Ginger— An herbal medicinal product with broad anti-inflammatory actions. Journal of Medicinal Food. 8:125-132.
[https://doi.org/10.1089/jmf.2005.8.125]

- Jang WS, Kim JS and Choi JE. (1997). Genetic variability, correlation and path analysis for yield components in Korea domestic ginger. Korean Journal of Agricultural Science. 24:6-10.
- Jayachandran K and Vijayagopal P. (1979). Attempts on breaking self incompatibility in ginger(Zingiber officinale Rosc.). Agricultural Research Journal of Kerala. 17:256-257.
-
Jo MH, Ham IK, Lee GH, Lee JK., Lee GS, Park SK, Kim TI and Lee EM. (2011). Comparison of active ingredients between field grown and in vitro cultured rhizome of Korean native ginger(Zingiber officinale Roscoe). Korean Journal of Plant Resources. 24:404-412.
[https://doi.org/10.7732/kjpr.2011.24.4.404]

-
Johnson JB, Mani JS, White S, Brown P and Naiker M. (2021). Quantitative profiling of gingerol and its derivatives in Australian ginger. Journal of Food Composition and Analysis. 104:104190. https://www.sciencedirect.com/science/article/abs/pii/S0889157521003902, (cited by 2024 February 01).
[https://doi.org/10.1016/j.jfca.2021.104190]

-
Kim SJ, Kim JS, Kim MJ, Kang JY, Choi HJ, Kim SY, Lee HE, Kwon TH, and Kang MS. (2023). Comparison of antioxidant and functional compounds in Korean conventional and Chinese seed ginger(Zingiber officinale Roscoe) following steam treatment. Journal of Food Hygiene and Safety. 38:264-272.
[https://doi.org/10.13103/JFHS.2023.38.4.264]

-
Kizhakkayil J and Sasikumar B. (2011). Diversity, characterization and utilization of ginger: A review. Plant Genetic Resources. 9:464-477.
[https://doi.org/10.1017/S1479262111000670]

- Korea Seed and Variety Service(KSVS). (2010). Data by Characteristics investigation method. ‘Ginger(Zingiber officinale Rosc.)’. Korea Seed and Variety Service. Gimcheon, Korea. https://www.seed.go.kr/seed/192/subview.do, (cite by 2023 February 23).
- Korea Seed and Variety Service(KSVS). (2024). Data by Variety Protection Registration Status. https://www.seed.go.kr/seed/270/subview.do, (cite by 2024 February 01).
-
Lincy AK, Jayarajan K and Sasikumar B. (2008). Relationship between vegetative and rhizome characters and final rhizome yield in micro propagated ginger plants(Zingiber officinale Rosc.) over two generations. Scientia Horticulture 118:70-73.
[https://doi.org/10.1016/j.scienta.2008.05.012]

-
Magdy AM, Fahmy EM, Abd EL-Rahman MAA and Awad G. (2020). Improvement of 6-gingerol production in ginger rhizomes (Zingiber officinale Roscoe) plants by mutation breeding using gamma irradiation. Applied Radiation and Isotopes. 162:109193. https://www.sciencedirect.com/science/article/abs/pii/S0969804320303225, (cited by 2024 February 23).
[https://doi.org/10.1016/j.apradiso.2020.109193]

- Mahdi HJ, Andayani R and Aziz I. (2013). Determination of phylogenetic and molecular characteristics of three Malaysian ginger cultivars(Zingiber officinale Roscoe) using microsatellite DNA. Tropical Life Sciences Research. 24:65-76.
-
Nayak S, Naik PK., Acharya L, Mukherjee AK., Panda PC and Das P. (2005). Assessment of genetic diversity among 16 promising cultivars of ginger using cytological and molecular markers. Zeitschrift für Naturforschung C. 60:485-492.
[https://doi.org/10.1515/znc-2005-5-618]

-
Ojewole JA. (2006). Analgesic, antiinflammatory and hypoglycaemic effects of ethanol extract of Zingiber officinale(Roscoe) rhizomes (Zingiberaceae) in mice and rats. Phytotherapy Research: An International Journal Devoted to Pharmacological and Toxicological Evaluation of Natural Product Derivatives. 20:764-772.
[https://doi.org/10.1002/ptr.1952]

-
Prasad S and Tyagi AK. (2015). Ginger and its constituents: Role in prevention and treatment of gastrointestinal cancer. Gastroenterology Research and Practice. 2015:142979. https://www.hindawi.com/journals/grp/2015/142979/, (cited by 2024 February 01).
[https://doi.org/10.1155/2015/142979]

-
Prasath D, Nair RR and Babu PA. (2022). Effect of colchicine induced tetraploids of ginger(Zingiber officinale Roscoe) on cytology, rhizome morphology, and essential oil content. Journal of Applied Research on Medicinal and Aromatic Plants. 31:100422. https://www.sciencedirect.com/science/article/abs/pii/S2214786122000547, (cited by 2024 February 23).
[https://doi.org/10.1016/j.jarmap.2022.100422]

- Roy AR and Wamanan PP. (1990). Varietal performance and correlations among grwoth and yield attributes of ginger(Zingiber officinale Roscoe). 34:57-61.
- Rural Development Administration(RDA). (2023). Ginger. Rural Development Administration, Jeonju, Korea. p.12-15.
- Sasikumar B, Babu KN, Abraham J and Ravindran PN. (1992). Variability, correlation and path analysis in ginger germplasm. Indian Journal of Genetics and Plant Breeding. 52:428-431.
-
Semwal RB, Semwal DK, Combrinck S and Viljoen AM. (2015). Gingerols and shogaols: Important nutraceutical principles from ginger. Phytochemistry. 117:554-568.
[https://doi.org/10.1016/j.phytochem.2015.07.012]

-
Siddaraju MN and Dharmesh SM. (2007). Inhibition of gastric H+,K+-ATPase and Helicobacter pylori growth by phenolic antioxidants of Zingiber officinale. Molecular Nutrition Food Research. 51:324-332.
[https://doi.org/10.1002/mnfr.200600202]

- Singh PP, Singh VB, Singh HP and Rajan S. (2000). Genetic diversity in ginger(Zingiber officinale Rosc.) with reference to essential oil content. Journal of Spices and Aromatic Crops. 9:161-164.
-
Supu RD, Diantini A and Levita J. (2018). Red ginger(Zingiber officinale var. rubrum): Its chemical constituents, pharmacological activities and safety. Fitofarmaka Jurnal Ilmiah Farmasi. 8:25-31.
[https://doi.org/10.33751/jf.v8i1.1168]

-
Wahyuni WT, Farid M, Batubara I and Yamauchi K. (2024). Antioxidant components of the three different varieties of Indonesian ginger essential oil: In vitro and computational studies. Food Chemistry Advances. 4:100558. https://www.sciencedirect.com/science/article/pii/S2772753X23003799, (cited by 2024 February 01).
[https://doi.org/10.1016/j.focha.2023.100558]

-
Wang L, Gao FS, Xu K and Li X. (2014). Natural occurrence of mixploid ginger(Zingiber officinale Rosc.) in China and its morphological variations. Scientia Horticulturae. 172:54-60.
[https://doi.org/10.1016/j.scienta.2014.03.043]

-
Yudthavorasit S, Wongravee K and Leepipatpiboon N. (2014). Characteristic fingerprint based on gingerol derivative analysis for discrimination of ginger(Zingiber officinale) according to geographical origin using HPLC-DAD combined with chemometrics. Food Chemistry. 158:101-111.
[https://doi.org/10.1016/j.foodchem.2014.02.086]

-
Zhou J, Guo F, Fu J, Xiao Y and Wu J. (2020). In vitro polyploid induction using colchicine for Zingiber Offcinale Roscoe cv. ‘Fengtou’ ginger. Plant Cell, Tissue and Organ Culture. 142:87-94.
[https://doi.org/10.1007/s11240-020-01842-1]