꾸지뽕나무 잎 추출물의 1,1-Diphenyl-2-picrylhydrazyl Radical 소거 활성 성분 분석
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The 1,1-diphenyl-2-picrylhydrazyl (DPPH) assay is the most commonly used for measuring antioxidant activity. Recently, research on measuring DPPH radical scavenging ability using liquid chromatography (LC) analysis has been increasing. In addition, active compound analysis can be effectively performed using mass spectrometer (MS).
The antioxidant compounds present in the extracts of Cudrania tricuspidata leaves were analyzed using using an online LC-DPPH radical scavenging activity measurement system and MS. The results showed that the DPPH radical scavenging active compound in C. tricuspidata leaves was 6,8-diprenylorobol, a prenylated isoflavonoid. As a result of a comparative analysis of extracts by ethanol concentration, 6,8-diprenylorobol content of the 95% ethanol extract was found to be the highest at 210.63 ± 2.09 ㎍/㎖, while the hot water extract showed the lowest content at 0.06 ± 0.01 ㎍/㎖.
6,8-Diprenylorobol exhibits various physiological activities, including anti-inflammatory activity, therefore, it can be used as an important marker compound for C. tricuspidata leaves. Additionally, to extract 6,8-diprenylorobol from C. tricuspidata leaves, an ethanol concentration of 40% or higher should be used.
Keywords:
Cudrania tricuspidata, 1,1-Diphenyl-2-picrylhydrazyl Radical Scavenging Activity, 6,8-Diprenylorobol, Liquid Chromatography, Liquid Chromatography-Mass Spectrometer서 언
꾸지뽕나무 (Cudrania tricuspidata)는 뽕나무과 (Moraceae)에 속하는 낙엽교목으로 우리나라를 비롯하여 일본, 중국 등 동아시아 지역에 주로 분포하고 있으며 (Jung et al., 2013), 예로부터 열매를 비롯하여 잎, 줄기, 뿌리 등 다양한 부위가 식용 및 약용으로 사용되어 왔다 (Xin et al., 2017; Park et al., 2019).
꾸지뽕나무 뿌리 부위는 항산화 활성 (Cha et al., 1999), 신경보호 및 항염증 관련 활성 (Ko et al., 2020; Ko et al., 2021), 피부 미백과 관련된 tyrosinase 저해 활성 (Oh et al., 2007), 제2형 당뇨병, 비만 및 암과 같은 대사 증후군 치료효과 (Quang et al., 2015) 등의 활성을 나타내는 것으로 보고되었으며, 열매 부위는 항산화 활성 (Cha et al., 1999), 혈구 세포의 생성 촉진과 함께 혈중 지질 개선, 간 기능 개선, 염증 개선 등 다양한 효과 (Hwang et al., 2023)와 비알코올성 지방간의 예방 및 개선 효과 (Lee et al., 2019) 등이 있는 것으로 알려져 있다.
꾸지뽕나무 잎의 생리활성으로는 기본적인 항산화 활성 (Cha et al., 1999)과 함께 면역세포의 활성 증대 효과 (Byun et al., 2016), 활성산소 소거 활성에 따른 신경세포 보호 효과 (Kang et al., 2012), nitric oxide 생성 억제를 통한 항염증 활성 (Tuan Anh et al., 2017), 항알레르기 활성과 아토피성 피부염 및 건선 치료 효과 (Kim et al., 2019; Kim et al., 2020a), 고요산혈증과 통풍 치료 관련 효과 (Song et al., 2018) 등이 보고되었다.
또한 에탄올 추출물의 지방세포 분화 억제 효과 (Do et al., 2011; Choi et al., 2023), 항비만 효과 (Park et al., 2021), lipase 활성 억제 효과에 의한 비만 치료 효과 (Kim et al., 2012b), 기능성 소화불량 환자의 위장 증상 완화 (Shin et al., 2021), 산화적 스트레스로 인한 간 손상에 대한 보호 및 치료 효과 (Kim et al., 2012a; Cho et al., 2019) 등 각종 소화기 질환이나 비만과 관련된 효과도 보고되었다.
이밖에도 tyrosinase 저해 활성과 angiotensin converting enzyme 저해 활성 (Lee et al., 2011), 염증 억제에 의한 Helicobacter pylori에 대한 효과 (Lee et al., 2023b)나 Listeria monocytogenes를 비활성화 (Woo et al., 2019)와 같은 활성이 꾸지뽕나무 잎에서 나타나는 것으로 보고되었다.
이와 같은 생리활성에 관여하는 성분 관련 연구들에서 뿌리, 잎, 나무껍질, 줄기 및 열매를 포함하는 꾸지뽕나무에는 xanthone, flavonoid, 유기산 및 다당류를 비롯한 다양한 성분이 존재하는 것으로 확인되었다. 특히, xanthone, flavonoid 등이 주목할만한 항염증, 항산화, 항종양, 간 보호, 신경 보호 및 항비만 등의 효과를 나타내는 것으로 보고되고 있다 (Xin et al., 2017).
꾸지뽕나무 뿌리에서 분리된 성분으로서 cudratricusxanthone 류와 cudraxanthone류 등 다양한 xanthone 성분들과 kuwanon C와 같은 flavonoid 성분들이 대표적인 활성 성분으로 보고되고 있다 (Quang et al., 2015; Park et al., 2019; Ko et al., 2020).
꾸지뽕나무 열매에 존재하는 주요 성분으로는 6,8-diprenylorobol, 6,8-diprenylgenistein과 같이 prenyl기를 포함하는 isoflavonoid가 알려져 있다 (Jeon et al., 2012; Lee et al., 2023a).
꾸지뽕나무 잎의 성분 연구에서 deoxynojirimycin이나 rutin (Do et al., 2011), kaempferol 및 kaempferol 배당체 (Park et al., 1992), quercetin 및 quercetin 배당체 (Seo et al., 2022) 등의 성분과 함께 6,8-diprenylorobol이나 cudraisoflavone L과 같은 prenyl기를 포함하는 isoflavonoid가 잎에 존재하는 것으로 확인되었다 (Tuan Anh et al., 2017).
항산화 활성 측정방법 중 약용식물 연구에서 가장 일반적으로 활용되고 있는 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical 소거능은 활성 정도에 따라 나타나는 색상변화를 분광학적 기기로 손쉽게 측정할 수 있어서 다양한 약용식물의 항산화 활성 연구에 활용되고 있다 (Im and Lee, 2014; Kim, 2014; Kim et al., 2014; Cha, 2015; Li and Jeong, 2015).
최근 다양한 연구에서 액체크로마토그래프 (liquid chromatography, LC)와 연계하여 LC 분석과 항산화 활성 측정을 동시에 측정하는 시스템의 활용이 증가되고 있다 (Jeon et al., 2009; Hong et al., 2014; Zhang et al., 2015; Im et al., 2017). 이와 함께 질량분석기 (mass spectrometer, MS)를 병행해서 활용하면 항산화 활성 성분 분석의 정확성을 높일 수 있게 된다 (Lee et al., 2022; Lee, 2023; Lee et al., 2023c).
본 연구에서는 DPPH radical 소거 활성을 LC의 column에서 분리된 용리액이 검출기로 이동하는 중간에 radical 용액과 반응시킨 후 측정하는 시스템을 활용하여 꾸지뽕나무 잎 추출물에 존재하는 radical 소거 활성 성분에 대한 탐색을 실시하였다. 확인된 radical 소거 활성 성분 peak의 MS 분석을 동일한 LC 분리 조건에서 실시하여 확인된 성분의 표준품을 확보하여 대조 분석을 실시하였으며, 에탄올 농도별 추출물을 비교 분석함으로써 꾸지뽕나무 잎의 radical 소거 활성 성분에 대한 효율적인 추출 조건을 추가로 확인하였다.
재료 및 방법
1. 식물재료 및 시약
꾸지뽕나무 (Cudrania tricuspidata) 잎 시료는 2023년 6월에 전남 나주 지역에 자생하는 나무에서 400 g을 채집하여 사용하였다. 시료는 40℃의 건조기에서 2 일간 건조하였으며, 직경 2 ㎜ 이하로 분쇄한 것을 4℃에 냉장보관하면서 사용하였다.
추출과 분석에 사용된 용매는 LC grade의 Duksan Pure Chemical (Seoul, Korea) 제품을 사용하였으며, 6,8-diprenylorobol 표준품은 BIOSYNTH international (Louisville, KY, USA)에서 구입한 것을 사용하였다. Ascorbic acid와 catechin은 Sigma-Aldrich (St. Louis, MO, USA)에서 구입한 것을 사용하였다.
2. 추출물 제조
에탄올 농도별 꾸지뽕나무 잎 추출물은 분쇄 시료 10 g에 10%, 20%, 40%, 60%, 80%, 95% 에탄올 200 ㎖를 혼합한 후 분당 180 회의 속도를 적용하여 24 시간 동안 상온에서 진탕 추출을 실시하였다.
열수 추출물은 분쇄 시료 10 g에 정제수 200 ㎖를 혼합하여 100℃에서 2 시간 동안 환류 추출을 실시하였다. 각 추출액은 0.45 ㎛ syringe filter (Whatman, Maidstone, England)로 여과를 실시한 후 4℃ 이하로 냉장 보관하면서 분석에 사용하였다.
3. Online LC-DPPH radical 소거능 측정
꾸지뽕나무 잎 추출물 시료의 성분 분리 조건 설정을 위한 LC profile 분석을 위해 LC-30A (Shimadzu, Kyoto, Japan) 액체크로마토그래피와 column으로서 Kinetex C18 (4.6 ㎜ × 150 ㎜, 3 ㎛, Phenomenex, Torrance, CA, USA)을 적용한 분석을 실시하였다.
시료 주입량은 5 ㎕, column oven은 40℃를 유지하였으며, 이동상으로 0.1% formic acid를 포함한 물 (A)과 acetonitrile (B)을 사용하여 유속은 0.6 ㎖/min을 적용하였다. 검출기는 LC profile 분석에서 가장 일반적으로 사용되는 SPD-10Avp (Shimadzu, Kyoto, Japan) 자외선 (ultraviolet; UV) 검출기를 사용하였으며, 파장은 254 ㎚로 설정하였다.
이동상 비율별로 LC profile을 비교한 결과 Table 1과 같은 이동상 조건에서 꾸지뽕나무 잎 추출물의 주요 성분 peak들이 양호하게 분리되는 것을 확인하였다.
Online LC-DPPH radical 소거능 측정을 위해서 Table 1의 이동상 조건을 적용한 LC에서 분리된 용출액과 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical 용액의 반응을 유도하는 시스템을 활용하였다 (Lee et al., 2022). DPPH radical 용액의 공급을 위해서 추가로 LC-20AD pump (Shimadzu, Kyoto, Japan)를 이용하였으며, radical 용액이 혼합된 이후 radical 소거 반응을 위해 길이 1 m의 reaction tubing을 설치하였다.
Methanol에 50 μM로 용해시킨 DPPH radical 용액을 사용하였으며, 유속은 0.2 ㎖/min으로 유지하면서 검출기 (SPD-10Avp, Shimadzu, Kyoto, Japan)는 517 ㎚로 설정하였다. DPPH radical 소거 활성 성분 peak의 UV spectrum은 DPPH radical 용액을 정지한 상태로 200 ㎚ - 400 ㎚ 범위에서 측정하였다.
4. Radical 소거 활성 성분의 LC-MS/MS 분석
꾸지뽕나무 잎 추출물 중 DPPH radical 소거 활성 성분 peak에 대한 질량분석은 online LC-DPPH radical 소거능 측정과 동일한 기기 및 분리 조건이 적용된 LC 시스템과 LCMS-8050 (Shimadzu, Kyoto, Japan) 질량분석기 (mass spectrometer, MS)를 사용하여 실시하였다.
MS 분석을 위한 기기 세부 조건은 Table 2와 같이 적용하였으며, positive와 negative mode에서 100 m/z - 1,000 m/z의 범위의 MS scan 분석을 실시하였다.
5. 활성 성분의 DPPH radical 소거능 측정
Radical 소거 활성 성분의 항산화 활성을 확인하기 위해 개별 성분의 DPPH radical 소거능을 측정하였다.
Methanol에 농도별로 용해시킨 시료액 20 ㎕와 200 µM로 용해시킨 DPPH 용액 180 ㎕를 혼합하여 20분간 암실에서 반응시킨 후 Eon microplate reader (BioTek Instru-ments, Winooski, VT, USA)를 사용하여 517 ㎚에서 흡광도를 측정하였다.
대조군으로 ascorbic acid와 catechin을 사용하였으며, 시료액 대신 methanol을 사용한 blank의 흡광도를 기준으로 소거능을 계산하였다.
6. 에탄올 농도별 추출물의 활성 성분 비교 분석
에탄올 농도별 꾸지뽕나무 잎 추출물과 열수 추출물의 활성 성분의 비교 분석을 위한 정량분석은 online LC-DPPH radical 소거능 측정과 동일한 기기 및 분리 조건이 적용된 LC 시스템에서 실시하였다.
활성 성분의 정량분석을 위한 6,8-diprenylorobol 표준품 용액은 1,000 ㎍/㎖, 200 ㎍/㎖, 40 ㎍/㎖, 10 ㎍/㎖ 농도로 조제하여 분석에 사용하였으며, UV 검출기 파장은 6,8-diprenylorobol의 UV spectrum 특성을 감안하여 265 ㎚로 설정하였다.
결과 및 고찰
1. Online LC-DPPH radical 소거능
약용식물과 같은 천연물의 항산화 활성 측정방법 중 하나인 DPPH radical 소거능은 DPPH radical과 항산화 활성 성분 결합하여 radical 상태가 변하면서 나타나는 탈색반응을 분광학적 기기에서 측정하는 방법이다 (Blois, 1958). 이러한 측정 특성은 가장 보편적인 액체크로마토그래프 (liquid chromat-ography, LC)의 검출기인 자외선-가시광선 검출기에서도 측정이 가능함에 따라 LC와 연동된 시스템을 활용하여 추출물의 성분 분리와 분리된 성분의 항산화 활성을 측정할 수 있게 되었다 (Jeon et al., 2009; Hong et al., 2014; Zhang et al., 2015; Im et al., 2017).
이러한 시스템을 활용하면 무수히 많은 성분이 혼합된 약용식물 추출물에서 별도의 분리 및 정제 과정을 거치지 않고도 항산화 활성 성분의 추적과 분석을 용이하게 수행할 수 있게 된다.
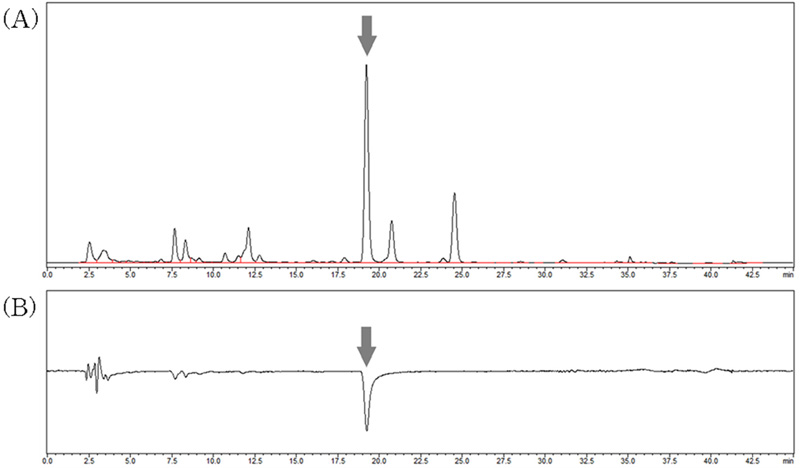
Online LC-DPPH radical 소거능 측정에 앞서 꾸지뽕나무잎 추출물의 주요 성분 peak들이 양호하게 분리되는 조건을 검토하였으며, Table 1과 같은 이동상 조건에서 Fig. 1(A)와 같이 주요 성분 peak들이 나타나는 LC profile을 확인할 수 있었다. 동일한 분리 조건을 적용한 online LC-DPPH radical 소거능을 측정한 결과에서 Fig. 1(B)와 같이 머무름시간 19 분 – 19.5 분 사이에서 강한 radical 소거 활성을 가지는 성분 peak가 나타났다.
2. Radical 소거 활성 peak의 질량분석
꾸지뽕나무 잎 추출물의 DPPH radical 소거 활성 성분 peak에 대한 분자량 등 기본적인 성분 특성을 검토하기 위해서 LC profile 분석 및 online LC-DPPH radical 소거능 측정과 동일한 분리 조건을 적용한 질량분석기 (mass spectrometer, MS) 분석을 실시하였다.
LC profile 분석 및 online LC-DPPH radical 소거능 측정결과에서 확인된 활성 성분 peak의 머무름시간 19 분 – 19.5 분 사이에서 Fig. 2(A)와 같이 높은 강도로 생성된 MS peak를 확인할 수 있었다.
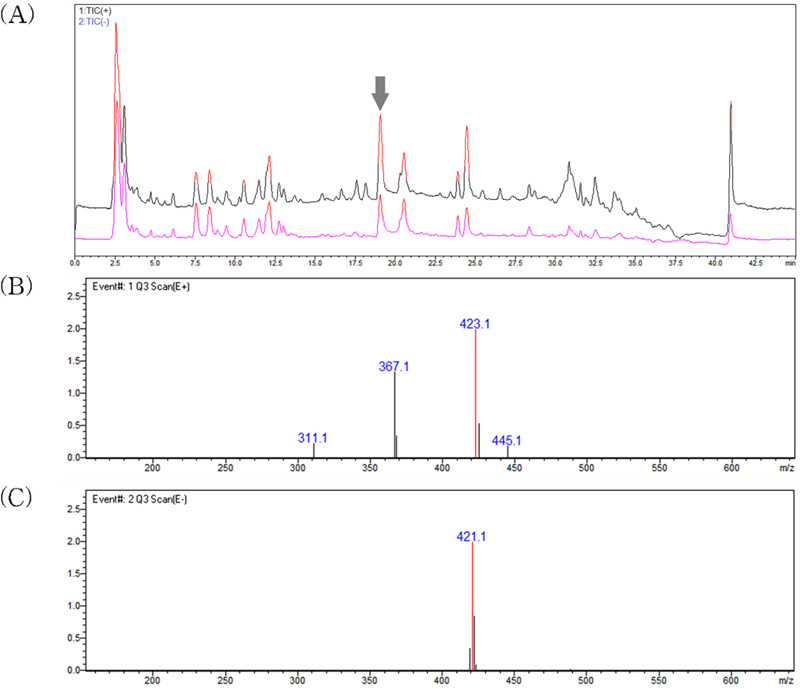
LC-MS analysis results of the major active peak in leaf extracts of C. tricuspidata.(A) total ion chromatograms, (B) positive mode MS spectra of active peaks identified at 423.1 m/z ([M+H]+) and 455.1 m/z ([M+Na]+), (C) negative mode MS spectra of active peak identified at 421.1 m/z ([M-H]-).
Scan mode의 MS 분석 결과를 제시한 Fig. 2(B, C)에서 positive mode와 negative mode에서 각각 [M+H]+와 [M-H]-의 형태인 423.1 m/z와 421.1 m/z가 확인되었으며, positive mode에서는 추가로 [M+Na]+ 형태로 추정되는 445.1 m/z가 나타났다.
Positive mode spectra에서는 모분자인 423.1 m/z에서 56 m/z가 감소된 367.1 m/z와가 나타났으며, 다시 367.1 m/z에서 56 m/z가 감소된 311.1 m/z가 나타났다. 이는 분자 구조에 동일한 형태의 functional group 두 개가 포함되었음을 나타내는 결과이다.
확인된 radical 소거 활성 성분 peak의 추가적인 정보를 확보하기 위하여 해당 peak의 UV spectrum 측정하였으며, Fig. 3(A)와 같은 결과를 확인할 수 있었으며, radical 소거 활성성분 peak의 UV spectrum이 꾸지뽕나무 열매에 존재하는 주요 성분들로 알려진 6,8-diprenylorobol, 6,8-diprenylgenistein, 4′-O-methylalpinumisoflavone과 같이 분자 구조에 prenyl group을 포함하는 isoflavonoid와 유사함을 확인하였다 (Jeon et al., 2012).
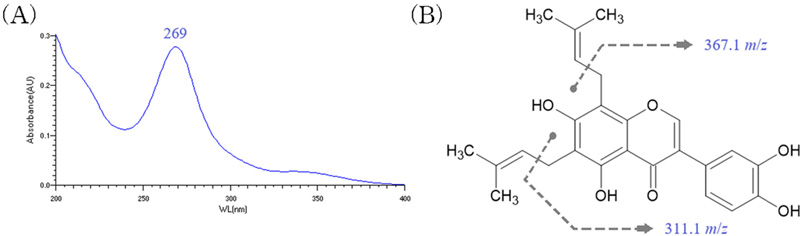
UV spectrum (A) and chemical structure (B) of 6,8-diprenylorobol.Gray dashed arrow is the positive mode LC-MS ionization fragmentation point shown in Fig. 2(B), 56 m/z (-C4H8) that are part of the prenyl groups included in 6,8-diprenylorobol are sequentially fragmented (423.1 m/z → 367.1 m/z → 311.1 m/z).
이와 함께 MS 분석 결과로 확인된 positive mode에서 나타난 조각 ion 특성을 검토한 결과, 꾸지뽕나무를 대상으로 하는 기존의 연구에서 보고하고 있는 성분들 중 Fig. 3(B)와 같이 isoflavone 구조에 2개의 prenyl group을 포함하는 6,8-diprenylorobol에서 retro Diels Alder (RDA) 반응에 의해 순차적으로 prenyl group의 일부 (-C4H8)가 조각나면서 나타나는 형태임을 확인할 수 있었다 (Buckett et al., 2020).
LC 및 LC-MS 분석 결과를 바탕으로 실시한 표준품 대조 분석 결과에서 radical 소거 활성 성분 peak가 Fig. 3(B)에 제시한 것과 같이 6,8-diprenylorobol임이 최종 확인되었다.
6,8-Diprenylorobol 포함한 prenyl화 flavonoid 성분의 대표적인 생리활성으로서 항염증 활성에 대한 보고가 있다 (Lv et al., 2023). 특히 6,8-diprenylorobol은 항염증 활성과 관련해서 nitric oxide 생성을 억제하는 효과 (Tuan Anh et al., 2017)와 함께 염증 유발과 관련된 xanthine oxidase에 대한 강력한 억제 효과를 나타내는 것으로 확인되었다 (Kim et al., 2020). 또한 신경 보호 효과나 피부 보호와 관련된 활성을 나타내는 것으로 보고되고 있으며 (Xin et al., 2017), 자궁내막증 관리에도 효과를 나타내는 것으로 알려져 있다 (Song et al., 2022).
꾸지뽕나무 잎 추출물의 radical 소거 활성 성분으로 확인된 6,8-diprenylorobol의 radical 소거능을 확인하기 위해 항산화 활성이 뛰어난 것으로 알려진 ascorbic acid, catechin을 대조군으로 하여 DPPH radical 소거능을 비교하였다. Table 3에 제시한 결과와 같이 DPPH radical을 50%의 수준으로 소거하는데 필요한 농도 (50% scavenging concentration; SC50) 측정에서 6,8-diprenylorobol은 99.26 ㎍/㎖의 SC50으로 강력한 항산화 활성을 가지는 catechin의 SC50인 61.49 ㎍/㎖와 비교하여 62.28% 수준을 나타났다. 또한 비타민 C로도 알려진 ascorbic acid의 SC50 (73.29 ㎍/㎖)과도 비교할만한 수준의 DPPH radical 소거능임을 알 수 있었다.
3. Radical 소거 활성 성분의 정량분석
6,8-Diprenylorobol 표준품의 농도별 용액을 조제하여 꾸지뽕나무 잎 추출물 분석 조건과 동일한 조건에서 분석을 실시한 후 작성한 검량선 정보를 Table 4에 제시하였다.
Table 5에 제시한 추출 조건별 함량 비교 분석 결과에서 95% ethanol 추출물의 6,8-diprenylorobol 함량이 210.63 ± 2.09 ㎍/㎖로 가장 높게 나타났으며, 생약이나 약용작물의 인체 적용을 위해 많이 검토되는 열수 추출 조건에서는 0.06 ± 0.01 ㎍/㎖로 가장 낮은 함량을 보였다. Ethanol 농도가 낮아짐에 따라 함량이 점차 낮아졌으며, 20% 이하의 ethanol 농도에서는 현저히 낮은 함량을 나타냈다.
이와 같은 추출 특성은 Fig. 3(B)에 제시한 6,8-diprenylorobol의 화학 구조적 특성으로 인해 상대적으로 극성이 낮은 ethanol과 같은 유기용매 농도 의존적인 용출 특성이 반영된 것으로 판단된다.
한편, 95% ethanol 추출물의 6,8-diprenylorobol 함량을 기준으로 20% 이하의 ethanol 추출에서는 0.3%에도 미치는 못하는 낮은 상대 함량을 보였으며, 40% ethanol 추출에서 26.29%로 급격히 증가되는 상대 함량을 나타냈다.
60%와 80% ethanol 추출에서 각각 51.06%와 62.83%의 상대 함량으로 ethanol 농도가 높아질수록 6,8-diprenylorobol 성분의 추출에 유리하지만 다양한 요인들을 고려해야 하는 산업적인 측면에서는 40% 이상의 ethanol 농도 수준을 기준으로 추출 조건에 검토할 수 있을 것으로 판단되었다.
꾸지뽕나무 잎 추출물에 존재하는 항산화 활성 성분 탐색을 위해 online LC-DPPH radical 소거능 측정 시스템과 MS를 활용한 분석을 실시한 결과, DPPH radical 소거 활성 성분이 prenyl화 isoflavonoid 성분인 6,8-diprenylorobol임이 확인되었다.
열수 추출 및 에탄올 농도별 추출물의 비교 분석 결과에서 95% ethanol 추출물의 6,8-diprenylorobol 함량이 210.63 ± 2.09 ㎍/㎖로 가장 높게 나타났으며, 열수 추출물에서 0.06 ± 0.01 ㎍/㎖로 가장 낮은 함량을 보였다. 95% ethanol 추출물의 6,8-diprenylorobol 함량을 기준으로 비교한 상대적인 함량에서 ethanol 농도 의존적인 함량 결과를 나타냄에 따라 꾸지뽕나무 잎에서 6,8-diprenylorobol 성분의 추출을 목적으로 하는 경우에는 40% 이상의 ethanol 농도를 추출에 적용하는 것이 유리한 것으로 나타났다.
한편, 6,8-diprenylorobol은 항염증 활성, 신경보호 효과, 피부 보호 관련 효과 등 다양한 생리활성을 나타내는 것으로 보고되고 있으므로 꾸지뽕나무 잎의 중요한 지표로서 활용될 수 있을 것이며, 본 연구에서 ethanol 추출에 적용한 상온 추출 외에도 가열 추출이나 초음파 추출 등 다양한 추출 방법에 대한 추가적인 검토가 필요할 것으로 판단되었다.
References
-
Blois MS. (1958). Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Buckett L, Schinko S, Urmann C, Riepl H and Rychlik M. (2020). Stable isotope dilution analysis of the major prenylated flavonoids found in beer, hop tea, and hops. Frontiers in Nutrition. 7:619921. https://www.frontiersin.org/articles/10.3389/fnut.2020.619921/full, (cited by 2023 Dec 27).
[https://doi.org/10.3389/fnut.2020.619921]

-
Byun EB, Jang BS, Sung NY and Byun EH. (2016). Immunomodulatory activity of crude polysaccharide separated from Cudrania tricuspidata leaf. Journal of the Korean Society of Food Science and Nutrition. 45:1099-1106.
[https://doi.org/10.3746/jkfn.2016.45.8.1099]

- Cha BC. (2015). Changes in the constituents and antioxidant activity in accordance with the processing conditions of Citrus unshiu Markovich. Korean Journal of Pharmacognosy. 46:23-30.
- Cha JY, Kim HJ, Chung CH and Cho YS. (1999). Antioxidative activities and contents of polyphenolic compound of Cudrania tricuspidata. Journal of the Korean Society of Food Science and Nutrition. 28:1310-1315.
-
Cho SS, Yang JH, Seo KH, Shin SM, Park EY, Cho SS, Jo GU, Eo JH, Park JS, Oh DS, Kim JB, Na CS, Ku SK, Cho IJ and Ki SH. (2019). Cudrania tricuspidata extract and its major constituents inhibit oxidative stress-induced liver injury. Journal of Medicinal Food. 22:602-613.
[https://doi.org/10.1089/jmf.2018.4322]

-
Choi SY, Yoo GJ, Hur JY and Choi IW. (2023). Analysis of the contents of Morus alba L. and Cudrania tricuspidata leaves and inhibitory effects on adipocyte differentiation. Journal of the Korean Society of Food Science and Nutrition. 52:426-430.
[https://doi.org/10.3746/jkfn.2023.52.4.426]

-
Do GP, Lee HJ, Do JR and Kim HK. (2011). Inhibition of adipogenesis in 3T3-Ll adipocytes with water and ethanol extracts of Cudrania tricuspidata leaves. Korean Journal of Food Preservation. 18:244-249.
[https://doi.org/10.11002/kjfp.2011.18.2.244]

-
Hong JS, Kang BG, Jang YS, Kim SH, Wang Z, Park YH, Park JH and Lim SS. (2014). Studies on standardization of licorice based on its active components with on-line HPLC bioassay system. Korean Journal of Plant Resources. 27:401-414.
[https://doi.org/10.7732/kjpr.2014.27.5.401]

- Hwang MS, Choi JY, Kim KM and Song ID. (2023). Biological effects of C. tricuspidata extract in normal rodents. Journal of Life Science, 33:363-370.
- Im DY and Lee KI. (2014). Antioxidative activity and tyrosinase inhibitory activity of the extract and fractions from Arctium lappa roots and analysis of phenolic compounds. Korean Journal of Pharmacognosy. 45:141-146.
-
Im DY, Pyo BS, Kim SM and Lee KI. (2017). Measurement of the anti-oxidative properties of extract from medicinal plants using an on-line HPLC-DPPH assay. Journal of Life Science. 27:44-49.
[https://doi.org/10.5352/JLS.2017.27.1.44]

-
Jeon JS, Kim SM, Lee HJ, Um BH, Kim HK and Kim CY. (2012). Preparative isolation and purification of prenylated isoflavonoids from Cudrania tricuspidata fruits using centrifugal partition chromatography. Journal of Liquid Chromatography and Related Technologies. 35:1607-1615.
[https://doi.org/10.1080/10826076.2011.621151]

-
Jeon YE, Lee YS, Lim SS, Kim SJ, Jung SH, Bae YS, Yi JS and Kang IJ. (2009). Evaluation of the antioxidant activity of the fruiting body of Phellinus linteus using the on-line HPLC-DPPH method. Journal of the Korean Society for Applied Biological Chemistry. 52:472-479.
[https://doi.org/10.3839/jksabc.2009.081]

-
Jung GT, Ju IO, Choi SR, Yoo DH and Noh JJ. (2013). Food nutritional characteristics of fruit of Cudrania tricuspidata in its various maturation stages. Korean Journal of Food Preservation. 20:330-335.
[https://doi.org/10.11002/kjfp.2013.20.3.330]

-
Kang YK, Lee EA and Park HR. (2012). Neuroprotective effect according to reactive oxygen species scavenging activity from extracts of Cudrania tricuspidata leaves. Korean Journal of Food and Cookery Science. 28:821-828.
[https://doi.org/10.9724/kfcs.2012.28.6.821]

-
Kim JS. (2014). Antioxidant, α-glucosidase inhibitory and antimicrobial activities of extracts from Maesa japonica(Thunb.). Korean Journal of Medicinal Crop Science. 22:289-294.
[https://doi.org/10.7783/KJMCS.2014.22.4.289]

-
Kim JW, Cho NJ, Kim EM, Park KS, Kang YW, Nam JH, Nam MS and Kim KK. (2020a). Cudrania tricuspidata leaf extracts and its components, chlorogenic acid, kaempferol, and quercetin, increase claudin 1 expression in human keratinocytes, enhancing intercellular tight junction capacity. Applied Biological Chemistry. 63:23. https://applbiolchem.springeropen.com/articles/10.1186/s13765-020-00505-1, (cited by 2024 Feb 23).
[https://doi.org/10.1186/s13765-020-00505-1]

-
Kim JY, Kim SY, Kwon HM, Kim CH, Lee SJ, Park SC and Kim KH. (2014). Comparison of antioxidant and anti-inflammatory activity on chestnut, chestnut shell and leaves of Castanea crenata extracts. Korean Journal of Medicinal Crop Science. 22:8-16.
[https://doi.org/10.7783/KJMCS.2014.22.1.8]

-
Kim JY, Wang Y, Li ZP, Baiseitova A, Ban YJ and Park KH. (2020b). Xanthine oxidase inhibition and anti-LDL oxidation by prenylated isoflavones from Flemingia philippinensis root. Molecules. 25:3074. https://www.mdpi.com/1420-3049/25/13/3074, (cited by 2023 Dec 27).
[https://doi.org/10.3390/molecules25133074]

- Kim KY, Ha MA and Shin YW. (2019). Comparison on anti-allergic activities of leaves from domestic and Chinese species of Cudrania tricuspidata. Korea Journal of Herbology, 34:9-17.
-
Kim OK, Ho JN, Nam DE, Jun WJ, Hwang KT, Kang JE, Chae OS and Lee JM. (2012a). Hepatoprotective effect of Curdrania tricuspidata extracts against oxidative damage. Journal of the Korean Society of Food Science and Nutrition. 41:7-13.
[https://doi.org/10.3746/jkfn.2012.41.1.007]

-
Kim YS, Lee YS, Kim JH, Sohn EJ, Kim CS, Lee YM, Jo KH, Shin SD, Song YJ, Kim JH and Kim JS. (2012b). Inhibitory activities of Cudrania tricuspidata leaves on pancreatic lipase in vitro and lipolysis in vivo. Evidence-Based Complementary and Alternative Medicine. 2012:878365. https://www.hindawi.com/journals/ecam/2012/878365/, (cited by 2023 Dec 27).
[https://doi.org/10.1155/2012/878365]

-
Ko WM, Kim NY, Lee H, Woo ER, Kim YC, Oh HC and Lee DS. (2021). Anti-inflammatory effects of compounds from Cudrania tricuspidata in HaCaT human keratinocytes. International Journal of Molecular Sciences. 22:7472. https://www.mdpi.com/1422-0067/22/14/7472, (cited by 2023 Dec 27).
[https://doi.org/10.3390/ijms22147472]

-
Ko WM, Yoon CS, Kim KW, Lee H, Kim NY, Woo ER, Kim YC, Kang DG, Lee HS, Oh HC and Lee DS. (2020). Neuroprotective and anti-inflammatory effects of kuwanon C from Cudrania tricuspidata are mediated by heme oxygenase-1 in HT22 hippocampal cells, RAW264.7 macrophage, and BV2 microglia. International Journal of Molecular Sciences. 21:4839. https://www.mdpi.com/1422-0067/21/14/4839, (cited by 2023 Dec 27).
[https://doi.org/10.3390/ijms21144839]

-
Lee DH, Son YH, Jang JH, Lee SY and Kim HJ. (2023a). The growth characteristics and the active compounds of Cudrania tricuspidata fruits in different cultivation environments in South Korea. Plants. 112:2107. https://www.mdpi.com/2223-7747/12/11/2107, (cited by 2023 Dec 27).
[https://doi.org/10.3390/plants12112107]

-
Lee HJ, Do JR, Kwon JH and Kim HK. (2011). Physiological activities of extracts from different parts of Cudrania tricuspidata. Journal of the Korean Society of Food Science and Nutrition. 40:942-948.
[https://doi.org/10.3746/jkfn.2011.40.7.942]

- Lee HJ, Park SE and Kim S. (2019). Cudrania tricuspidata fruit extract ameliorates free fatty acid-induced lipid accumulation in HepG2 cells. Journal of Life Science. 29:1144-1151.
-
Lee JY, Son HG, Koo Y, Jung SH, Park SD, Shim JJ, Lee JL and Lee YH. (2023b). Protective effects of Cudrania tricuspidata against Helicobacter pylori-induced inflammation in C57BL/6 mice. Journal of Medicinal Food. 26:224-231.
[https://doi.org/10.1089/jmf.2022.K.0133]

-
Lee KI, Back JH, Pyo BS and Choi CH. (2023c). Radical scavenging active compound analysis in extract of coffee silver skin. Korean Journal of Medicinal Crop Science. 31:211-221.
[https://doi.org/10.7783/KJMCS.2023.31.4.211]

-
Lee KI, Pyo BS, Choi CH and Cha SW. (2022). Radical scavenging active compound screening analysis in extract of Coffea arabica L. leaves. Korean Journal of Medicinal Crop Science. 30:264-277.
[https://doi.org/10.7783/KJMCS.2022.30.4.264]

-
Lee KI. (2023). Radical scavenging active compound analysis in extract of Humulus japonicus using an online LC-DPPH assay. Korean Journal of Pharmacognosy. 54:184-190.
[https://doi.org/10.22889/KJP.2023.54.4.184]

-
Li H and Jeong JM. (2015). Antioxidant activities of various berries ethanolic extract. Korean Journal of Medicinal Crop Science. 23:49-56.
[https://doi.org/10.7783/KJMCS.2015.23.1.49]

-
Lv HW, Wang QL, Luo M, Zhu MD, Liang HM, Li WJ, Cai H, Zhou ZB, Wang H, Tong SQ and Li XN. (2023). Phytochemistry and pharmacology of natural prenylated flavonoids. Archives of Pharmacal Research 46:207-272.
[https://doi.org/10.1007/s12272-023-01443-4]

-
Oh SS, Seo EJ, Kim HY, Ryu YB, Lee JH, Gal SW and Park KH. (2007). Tyrosinase inhibitory xanthones from Cudrania tricuspidata. Journal of Life Science, 17:476-481.
[https://doi.org/10.5352/JLS.2007.17.4.476]

- Park JC, Young HS and Choi JS. (1992). Constituents of Cudrania tricuspidata in Korea. Yakhak hoeji 36:40-45.
- Park JH, Guo L, Kang HM, Son BG, Kang JS, Lee YJ, Park YH, Je BI and Choi YW. (2021). Leaves of Cudrania tricuspidata on the shoot positional sequence show different inhibition of adipogenesis activity in 3T3-L1 cells. Journal of Life Science. 31:209-218.
- Park SY, Kim EN and Jeong GS. (2019). Isolation and quantitative analysis of cudratricusxanthone A and cudraxanthone D from roots of Cudrania tricuspidata Bureau. Korean Journal of Pharmacognosy. 50:59-64.
-
Quang TH, Ngan NTT, Yoon CS, Cho KH, Kang DG, Lee HS, Kim YC and Oh HC. (2015). Protein tyrosine phosphatase 1B inhibitors from the roots of Cudrania tricuspidata. Molecules. 20:11173-11183.
[https://doi.org/10.3390/molecules200611173]

-
Seo JI, Yu JS, Lee EK, Park KB and Yoo HH. (2022). Molecular networking-guided strategy for the pharmacokinetic study of herbal medicines: Cudrania tricuspidata leaf extracts. Biomedicine and Pharmacotherapy. 149:112895. https://www.sciencedirect.com/science/article/pii/S0753332222002840?via%3Dihub, (cited by 2023 Dec 27).
[https://doi.org/10.1016/j.biopha.2022.112895]

-
Shin JY, Oh TH, Kim JY, Shim JJ and Lee JL. (2021). Efficacy and safety of the Cudrania tricuspidata extract on functional dyspepsia: A randomized double-blind placebo-controlled multicenter study. Journal of Clinical Medicine. 10:5323. https://www.mdpi.com/2077-0383/10/22/5323, (cited by 2024 Feb 23).
[https://doi.org/10.3390/jcm10225323]

-
Song JS, Song GH, Park SW and Lim WS. (2022). Inhibitory effects of 6,8-diprenylorobol on endometriosis progression in humans by disrupting calcium homeostasis and mitochondrial function. Antioxidants. 11:171. https://www.mdpi.com/2076-3921/11/1/171, (cited by 2024 Feb 23).
[https://doi.org/10.3390/antiox11010171]

-
Song SH, Park DH, Bae MS, Choi CY, Shim JH, Yoon G, Cho YC, Oh DS, Yoon IS and Cho SS. (2018). Ethanol extract of Cudrania tricuspidata leaf ameliorates hyperuricemia in mice via inhibition of hepatic and serum xanthine oxidase activity. Evidence-Based Complementary and Alternative Medicine. 2018:8037925. https://www.hindawi.com/journals/ecam/2018/8037925/, (cited by 2024 Feb 23).
[https://doi.org/10.1155/2018/8037925]

-
Tuan Anh HL, Tuan DT, Trang DT, Tai BH, Nhiem NX, Yen PH, Kiem PV, Minh CV, Duc TM, Kang HK, Kim YC and Kim YH. (2017). Prenylated isoflavones from Cudrania tricuspidata inhibit NO production in RAW 264.7 macrophages and suppress HL-60 cells proliferation. Journal of Asian Natural Products Research. 19:510-518.
[https://doi.org/10.1080/10286020.2016.1232253]

-
Woo HJ, Kang JH, Lee CH and Song KB. (2019). Application of Cudrania tricuspidata leaf extract as a washing agent to inactivate Listeria monocytogenes on fresh-cut romaine lettuce and kale. International Journal of Food Science & Technology. 55:276-282.
[https://doi.org/10.1111/ijfs.14305]

-
Xin LT, Yue SJ, Fan YC, Wu JS, Yan D, Guan HS and Wang CY. (2017). Cudrania tricuspidata: an updated review on ethnomedicine, phytochemistry and pharmacology. RSC Advances. 7:31807-31832.
[https://doi.org/10.1039/C7RA04322H]

-
Zhang H, Xi W, Yang Y, Zhou X, Liu X, Yin S, Zhang J and Zhou Z. (2015). An on-line HPLC-FRSD system for rapid evaluation of the total antioxidant capacity of Citrus fruits. Food Chemistry. 172:622-629.
[https://doi.org/10.1016/j.foodchem.2014.09.121]