
광주기 조절을 통한 단삼의 생장, 외적품질, 생리적 특성 개선
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Salvia miltiorrhiza Bunge, a medicinal plant belonging to the Lamiaceae family, is commonly used as a health-promoting tea in China. This study investigated and analyzed the improvements in S. miltiorrhiza growth, external quality, vegetation indices, and photosynthetic performance through photoperiod control.
The study was conducted with four different photoperiods: 8, 12, 16, and 24 hours of light period (h·d-1). The results showed that the 12 h·d-1 - 16 h·d-1 photoperiods were most effective for promoting shoot growth. This was determined by evaluating plant sizes, shoot biomass; various remote sensing vegetation indices including normalized difference vegetation index, photochemical reflectance index, and modified chlorophyll absorption ratio index; and five chlorophyll fluorescence parameters (Fv/Fm, ΦDo, ABS/RC, DIo/RC, and PIABS). Similarly, the root growth, root biomass, and external quality parameters (CIELAB color space values and visual score) indicated that a 12 h·d-1 - 16 h·d-1 photoperiod was the most effective. Conversely, continuous light conditions for 24 h·d-1 photoperiod significantly decreased most growth parameters and both shoot and root external qualities, suggesting inefficiency in such conditions.
Therefore, the study recommends cultivating S. miltiorrhiza under a 12 h·d-1 - 16 h·d-1 range photoperiod to improve the growth, external qualities, and physiological characteristics.
Keywords:
Salvia miltiorrhiza, Chlorophyll Fluorescence, CIELAB, Danshen, Daylength, Lamiaceae, Medicinal Crop, Vegetation Indices서 언
단삼 (Salvia miltiorrhiza Bunge)은 꿀풀과 (Lamiaceae)에 속한 약용작물의 일종으로 중국에서 건강증진용 차 (tea)의 재료로 활발하게 이용되고 있다 (Moon and Cha, 2020; Shi et al., 2019). 단삼은 공식적으로 중국약전 (Chinese pharmacopoeia) 에서 혈액을 활성화 (blood-invigorating) 시키는 약초로 등재되어 있으며 전통 중국 의학의 개념에 따르면 독성이 없고 차가운 성질이 있다고 기록되어 있다 (Yeung, 2012).
국내에는 2012년부터 본격적인 단삼의 재배가 시작된 것으로 알려져 있으며 본산인 중국 보다 향상된 품질의 단삼을 생산하기 위한 다각도의 연구가 필요하다 (Kim et al., 2015; Shin et al., 2024). 2015년에 조사된 바에 따르면 국내 단삼의 재배면적은 약 4 ㏊에 생산량은 약 41 t 정도이며 ‘다산’이나 ‘고산’과 같은 여러 국내 신품종들이 출원되고 있어 (Jeong et al., 2023; RDA, 2018), 장래에는 국내에서 단삼의 재배 및 이용이 확대될 것으로 기대된다.
특히 단삼은 심혈관 질환에 효과가 있는 것으로 널리 알려져 있으며 (Chen and Chen, 2017; Cheng, 2007; Li et al., 2018), 알츠하이머 증상 개선 (Chong et al., 2019; Hügel and Jackson, 2014; Zhang et al., 2016), 항골다공증 (Guo et al., 2014), 항당뇨 (Jia et al., 2019), 항염증 (Liu et al., 2018), 항산화 (Kang et al., 1997; Zhao et al., 2006) 등 다양한 질환과 증상에 효과가 있는 것으로 보고되었다.
또한 단삼에는 다양한 유효성분들이 존재하는데 대표적으로 탄시논 (tanshinone, Chang et al., 1990), 크립토탄시논 (cryptotanshinone, Li et al., 2021), 살비아놀산 (salvianolic acid) 과 로즈마린산 (rosmarinic acid) 및 밀티론 (miltirone) 등이 있다 (Wang, 2010). 이와 같이 단삼은 제약산업에서 활용될 수 있는 잠재력이 있으며 추후 국내에서 건강기능식품 및 건강보조식품으로 개발될 수 있을 것으로 기대된다.
단삼의 다양한 약리학적 이점이 밝혀졌음에도 불구하고 단삼의 효율적 재배생산을 위한 연구는 아직까지도 다소 한정적인 실정이다. 각기 다른 재식밀도와 멀칭 재료 비교 (Kim et al., 2013), 칼륨 시비량 차등 적용 (Lu et al., 2013), 단삼의 실내 생산을 위한 인공광원을 활용한 재배연구 (Choi et al., 2020; Zhang et al., 2020), 주야간 온도에 따른 생장과 외적품질에 관한 연구 (Kim et al., 2024) 등 몇 가지 생리학적 연구들이 수행되었으나 아직 광주기 (photoperiod)가 단삼의 생장과 품질 변화에 미치는 영향에 대해서는 연구된 바가 없다.
단삼의 주요 소비국인 중국에서는 단삼의 뿌리가 얼마나 진한 붉은색을 띄는가에 따라 시장가격이 정해지며 (Liu et al., 2020), 따라서 높은 시장가격을 받기 위해서는 식물의 생장뿐만 아니라 외적 품질도 함께 향상시킬 수 있는 방안이 필요하다.
광주기는 명기 (light period)와 암기 (dark period)의 길이를 통해 계절적 차이를 감지하는 메커니즘을 가진 식물들의 생존에 선택적 이점을 제공하며 (Jackson, 2009), 식물의 생장과 발달에 큰 영향을 미치는 요인 중 하나다 (Pouteau et al., 2006).
원예작물 중 단일식물로 널리 알려져 있는 국화 (Chrysanthemum morifolium)는 암기가 임계 최소값 (critical minimum) 보다 길 때 개화가 유도되는 것으로 알려져 있으며 (Higuchi et al., 2012), 섬꼬리풀 (Veronica nakaiana)과 벼룩이울타리 (Eremogone juncea)의 경우에는 광주기가 개화에 영향을 미치지 않는 것으로 보고되었다 (Im and Lee, 2023; Kang et al., 2022). 반면에 약용작물의 일종인 기린초속 (Phedimus)은 장일 조건에서 상대적으로 우수한 생장 수준을 나타내는 것으로 보고되었다 (Lee, 2023). 한편, 들깨 (Perilla frutescens)는 단일 조건에서 개화가 유도되는 것으로 알려져 있으나 주요 사용 부위가 잎이기 때문에 장일처리를 통해 화아분화를 억제하여 지속적으로 고품질의 잎을 수확하는 방식으로 재배되고 있다 (Jung et al., 2003; Sul et al., 2022).
이처럼 식물의 이용 부위나 특성에 따라 광주기를 조절하여 수확 목적에 맞는 효율적인 재배가 가능하며 각각의 종에 맞는 광주기를 구명하기 위해 다각도의 실험적 접근이 필요하다. 하지만 단삼의 재배 환경에 대한 조절에서 광주기가 단삼의 생장, 외적품질, 생리적 특성에 미치는 영향 및 적정 광주기 확립에 대한 연구가 이루어지지 않아 약용작물로의 품질 향상 및 수확량 증대를 위해 단삼에 대한 광주기 조절에 관한 연구가 필요한 실정이다.
이에 본 연구에서는 서로 다른 광주기의 영향을 받은 단삼의 생장과 외적품질의 변화를 조사하였으며, 추가적으로 식생지수 (vegetation indices) 및 엽록소 형광 (chlorophyll fluorescence) 반응 분석을 통해 단삼의 생리적 특성의 개선 가능성을 평가하였다.
재료 및 방법
1. 식물재료
본 연구에서는 광주기 (photoperiod)의 영향을 받은 단삼 (Salvia miltiorrhiza)의 생장 수준과 외적 품질 변화의 비교를 위해 경기도 양평군에 위치한 단삼 농장인 양평우뚝약선농원으로부터 3 주간 육묘 된 단삼묘를 분양받아 활용하였다.
2. 실험조건 및 광주기 설정
본 실험은 서울특별시 노원구에 위치한 삼육대학교 환경원예학과 실험온실에 배치되어 있는 식물생장상 (growth chamber, KGC-175VH, Koencon, Hanam, Korea) 내에서 8 주간 수행하였다. 광주기는 총 네 가지 단계로 나누어 설계하였으며, 명기 (light period)가 각각 8, 12, 16, 24 h·d-1이 되도록 설정하였다.
식물생장상 내부의 인공광원으로 설치한 light-emitting diode (LED)는 적색 : 청색 : 백색 : 원적외선을 4 : 2 : 8 : 2의 비율로 배치되었다. 생장상 내부의 광도는 휴대용 분광복사계 (SpectraPen mini, Photon Systems Instruments, Drásov, Czech Republic)를 이용하여 광합성 광량자속밀도 (photosynthetic photon flux density, PPFD)가 500 μmol·m-2·s-1이 되도록 식물과 LED 간의 거리를 조절하였다.
배지는 원예용 무비상토 (Hanareumsangto, Shinsung Mineral, Goesan, Korea), 입자가 3 ㎜ - 5 ㎜ 크기인 펄라이트 (Ecolite Perlite, Homan Saneob, Jeongeup, Korea)와 버미큘라이트 (Ecolite Jilseog, Homan Saneob, Jeongeup, Korea)를 각각 1 : 1 : 1 (v/v/v)의 비율로 혼합하여 사용하였다. 식물생장상 내 환풍 시스템으로 인한 식물체의 과도한 수분 손실을 방지하기 위해 높이가 16.0 ㎝이고 Ø10 ㎜ 크기의 4개의 환기구가 있는 투명한 사각 플라스틱 커버를 씌웠으며, 가로, 세로, 높이가 각각 35.0 ㎝ × 27.5 ㎝ × 7.5 ㎝ 크기인 직사각형 원예용 포트에 단삼묘를 재식하였다.
실험 기간 동안 평균온도와 상대습도는 각각 30.0 ± 1.0℃, 76.2 ± 15.4%였다. 관수는 정수처리된 물에 제4종 복합비료 (High Grade S 7-10-6, Hyponex, Osaka, Japan) 1000 ppm을 희석하여 두상관수하였다. 이때, 관수량은 처리 직후를 기점으로 1 주 – 5 주차까지는 500 ㎖, 6 주 – 7 주차까지는 800 ㎖, 8 주차에는 900 ㎖를 매주 1회 관수하였다.
3. 생장, 외적품질, 식생지수 및 엽록소 형광 반응 분석
광주기의 영향을 받은 단삼의 생장 수준을 평가하기 위해 초장, 초폭, 줄기의 지름, 근장, 지상부의 개수, 뿌리의 개수, 엽장, 엽폭, 엽수, 피복 면적, 생체중과 건물중을 나타내는 바이오매스 (biomass)를 조사하였다.
이때, 식물체 크기와 관련된 조사 방법은 Park 등 (2023)의 방법을 참고하였으며, 초장은 지표면으로부터 식물의 지상부 가장 높은 부분의 길이를 측정하였고 초폭은 식물체를 측면에서 바라볼 때 가장 넓은 부위를 측정하였다. 근장은 식물체의 뿌리 중 가장 긴 뿌리를 기준으로 하여 측정하였다.
외적품질은 단삼의 표면 색상을 조사하였으며, 이를 위한 매개변수로 Commission Internationale de l'Eclairage Lab 색공간 (CIELAB color space) 값 (L*, a*, b*), 각 색상에 대한 고유번호를 나타내는 Royal Horticultural Society (RHS) 값, 시각점수 (visual score)를 평가하였다. 지상부 CIELAB 값의 측정은 Lee 등 (2022a)의 측정 방법을 참고하여 분광광도계 (CM-2600d, Konica Minolta, Tokyo, Japan)를 CIELAB D65/10°로 설정한 뒤 무작위의 잎을 선정하여 측정하였으며, 정반사광 (specular component included, SCI)이 포함된 CIELAB L*, a*, b* 값을 얻었다.
한편, 지하부 CIELAB 값의 경우에는 뿌리의 측면의 색상을 잎의 색상을 측정하였을 때와 동일한 설정을 적용하여 측정하였다. RHS 값은 각각의 L*, a*, b* 결과 값을 RGB로 환산한 후 ASA (2024)의 RHS Color Fan에 나열되어있는 RHS 색상 차트와 서로 대조하여 각 처리별로 RHS 값 2 개를 선정하여 평가하였다. 추가로 각 처리별 식물의 엽색은 Zettl (2024)이 고안한 Converting Colors를 이용하여 엽색과 뿌리 색상의 CIELAB L*, a*, b* 결과 값을 변환 색상으로 시각화하였다.
마지막으로 시각점수는 Kim 등 (2024)의 평가방법을 참고하였으며, 교수, 전문농업인, 연구원, 대학원생 등 12 인이 0 - 10 사이의 범위로 시각점수를 매겼다. 이때, 추가로 엽록소 함량을 조사하기 위해 SPAD 값 (SPAD units)을 측정하였으며, 휴대용 엽록소계 (SPAD-502Plus, Konica Minolta, Tokyo, Japan)를 활용하여 조사하였다.
원격탐사 식생지수 (remote sensing vegetation indices)는 휴대용 식물생리지수 측정계 (PolyPen RP410, Photon Systems Instruments, Drásov, Czech Republic)를 활용하였다. 이때, 정규식생지수 (normalized difference vegetation index, NDVI, Rouse et al., 1973, 수식 1), 광화학 반사율지수 (photochemical reflectance index, PRI, Gamon et al., 1992; Gamon et al., 1997, 수식 2), 수정된 엽록소 흡광량지수 (modified chlorophyll absorption ratio index, MCARI, Daughtry et al., 2000, 수식 3)와 관련 수식은 다음과 같으며, 이를 이용하여 광주기의 영향을 받은 단삼의 생리적 상태의 개선 가능성을 평가하였다.
| (1) |
| (2) |
| (3) |
엽록소 형광 (chlorophyll fluorescence) 반응 분석은 휴대용 엽록소 형광 측정기 (FluorPen FP 110/D, Photon Systems Instruments, Drásov, Czech Republic)를 사용하였으며, 총 다섯 가지 매개변수 (Fv/Fm, ΦDo, ABS/RC, DIo/RC, PIABS)를 분석하였다. 엽록소 형광 반응을 조사하기 위해 제조사의 가이드라인을 참조하여 탈착식 암적응 리프클립 (detachable dark-adapt leaf-clip)을 활용하여 식물체를 약 15 분간 암적응 시킨 후 측정하였다 (PSI, 2024).
Stirbet와 Govindjee (2011)와 PSI (2024)의 연구를 참조한 각 매개변수의 명칭, 수식, 세부설명은 다음과 같다. 광계 II (PSII)의 최대 양자 수율 (maximum quantum yield)을 나타내는 Fv/Fm (수식 4), 흡수된 광자가 소멸될 확률 (probability of photon dissipated)을 나타내는 ΦDo (수식 5), 반응중심 (reaction center, RC)당 흡광량 (absorption flux, ABS)을 나타내는 ABS/RC (수식 6), 반응중심당 소산되는 에너지의 양 (dissipated energy flux)을 나타내는 DIo/RC (수식 7), 흡광량기준 (absorption basis)의 성능지수 (performance index, PI) 를 타내는 PIABS (수식 8)를 이용하여 광주기의 영향을 받은 단삼의 생리적 상태를 평가하였다.
| (4) |
| (5) |
| (6) |
| (7) |
| (8) |
4. 통계분석
실험 결과의 분석은 SAS 9.4 (SAS Institute, Cary, NC, USA) 를 사용하여 일원배치 분산분석 (one way ANOVA)을 수행하였다. 실험은 완전임의배치법 (completely randomized design) 으로 처리구별 단삼 20 개체를 배치하였다. 평균간 비교는 5% 수준의 던컨의 다중검정 (Duncan’s Multiple Range Test, DMRT)으로 통계분석 하였다 (p < 0.05).
결과 및 고찰
1. 단삼의 생장 매개변수-
광주기의 영향을 받은 단삼 (Salvia miltiorrhiza)은 생장에 다양한 영향을 받는 것으로 나타났다 (Fig. 1 and Table 1). 본 실험 결과에서 광주기의 영향을 받은 단삼의 초장은 8 h·d-1 - 16 h·d-1의 처리구에서 높게 나타났으며 (11.55 ㎝ - 13.37 ㎝), 초폭은 15.71 ㎝ - 18.14 ㎝의 범위를 가지는 것으로 나타났다. 이러한 결과는 연속광 (continuous light, 24 h·d-1) 조건하에서 나타난 초장 (7.00 ㎝)과 초폭 (12.13 ㎝)의 결과와 유의미한 차이 (p < 0.01 - p < 0.001)를 가지는 것으로 분석되었다.

Representative image of Salvia miltiorrhiza as affected by four different photoperiods for eight weeks.(A) 8 h·d-1. (B) 12 h·d-1. (C) 16 h·d-1. (D) 24 h·d-1.

Plant growth parameters of Salvia miltiorrhiza as affected by four different photoperiods for eight weeks.
식물은 일장에 따라 다양한 생리적 반응을 나타내며 이를 광주기성이라고 한다 (Nam et al., 2024). 식물의 생장과 바이오매스 향상에 관한 다양한 환경요인 중 온도, 광도 및 광주기가 상당히 주요한 요인으로 꼽히고 있다 (Heuvelink and Dorais, 2011; Went, 1953).
과거, Liu 등 (2020)의 연구에 따르면 단삼은 연작피해가 큰 것으로 보고되어 배지의 교체가 용이하고 양액 재배가 가능한 시설재배 방법을 고려할 만하다. 현재 단삼은 주로 노지재배로 생산되고 있는 실정이기 때문에 광주기의 적용이 어려운 실정이다. 그러나 이전 연구에 따르면 단삼은 인공광원을 활용한 재배가 가능한 것으로 보고되었으며 (Choi et al., 2020; Zhang et al., 2020), 따라서 폐쇄형 육묘시설 및 식물공장 시스템에서는 단삼 재배에 있어 광주기의 적용이 가능할 것으로 보인다 (Goto, 2012).
이전 연구에 따르면, 새싹 채소용 비트 (Beta vulgaris ssp. vulgaris)를 재배할 때 16 h·d-1 처리구에 비해 12 h·d-1 처리구에서 더 높은 초장과 수확량을 나타내는 것으로 보고되었다 (Hernández-Adasme et al., 2023). 반면에 상추 (Lactuca sativa ‘Seonhong Jeokchukmyeon’)는 명기 (light period)가 길어질수록 식물의 초장과 생체중 및 건물중이 비례하여 증가하는 것으로 나타났으며 연속광 조건하에서 생장이 가장 크게 증대되는 것으로 보고되었다 (Park et al., 2012).
본 실험에서 단삼 줄기의 지름은 16 h·d-1에서 0.63 ㎝로 가장 두꺼웠던 것으로 나타났다. 지상부의 개수는 처리간 유의미한 차이는 없는 것으로 나타났으나, 12 h·d-1 - 16 h·d-1 범위에서 2.8 개로 높게 나타나는 경향을 보였다. 엽장과 엽폭은 초장과 초폭의 결과와 유사하게 8 h·d-1 - 16 h·d-1에서 높게 나타났으며, 연속광 처리구 (각각 3.24 ㎝, 2.08 ㎝)와 유의미한 차이 (p < 0.05 - p < 0.01)를 나타내었다. 엽수는 12 h·d-1 - 16 h·d-1의 범위에서 48.3 개 – 49.3 개로 나타났으며, 피복 면적은 초장과 초폭의 결과와 유사하게 8 h·d-1 - 16 h·d-1 처리구에서 동등한 유의수준을 나타내었다 (279.1 ㎠ - 357.0 ㎠). 이러한 결과들을 토대로 볼 때, 단삼의 지상부의 크기를 증대시키기 위해서는 12 h·d-1 - 16 h·d-1 범위의 광주기 하에서 단삼을 재배하는 것이 효과적이었다.
한편, 근장은 16 h·d-1 처리구에서 26.67 ㎝로 가장 길었으며, 뿌리의 개수는 16 h·d-1 - 24 h·d-1 범위에서 6.8 개 – 6.9 개로 유의미하게 증대되었다 (Fig. 2).
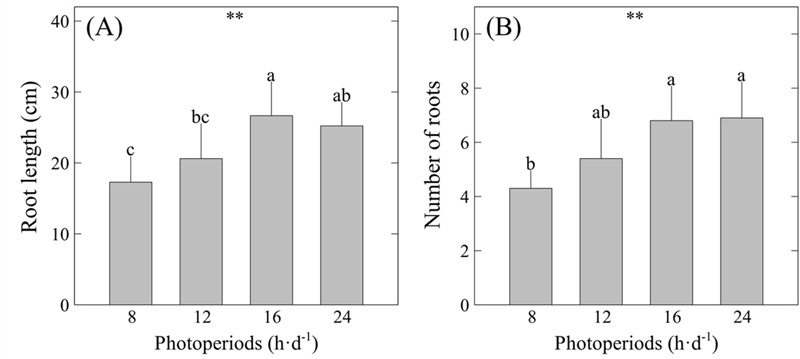
Root length and number of roots of S. miltiorrhiza as affected by four different photoperiods for eight weeks.(A) root length. (B) number of roots. Vertical bars indicate standard deviation (n = 20). Asterisks (**) indicate significance at p < 0.01. Different lowercase letters indicate significant differences at p < 0.05 based on Duncan's Multiple Range Test (DMRT).
Lowe 등 (1976)의 연구에 따르면 카사바 (Manihot esculenta) 는 장일 조건에서 지상부 생장이 촉진되었으나 괴경 (tuber)의 발달이 저해되는 것으로 나타났다. 이와 달리, 마카 (Lepidium meyenii)는 상대적으로 단일 조건에 비해 장일 조건에서 하배축의 직경과 미세근 (fine root)의 크기가 비대해지는 것으로 보고되어 (Zaytseva et al., 2022), 작물마다 지하부의 생장을 촉진시키는 광주기가 서로 상이함을 알 수 있었다.
본 연구 결과에 따르면 단삼의 주요 이용 부위인 뿌리의 크기와 개수를 초기생육 단계에서 동시에 증대시키기 위해서는 16 h·d-1의 광주기 하에서 재배하는 것이 가장 효율적임을 알 수 있었다. 다만, 본 연구에서의 광주기 조절 적용 기간이 8 주인 점을 감안할 때, 보다 장기적인 실험 기간을 적용한 후속 연구와 생육 기간 전반에 걸친 모니터링이 필요할 것으로 판단된다.
바이오매스 (biomass) 분석에서 단삼의 지상부 생체중은 12 h·d-1 처리구에서 6.34 g으로 가장 높게 나타났으며, 지상부 건물중은 16 h·d-1 처리구에서 1.48 g으로 가장 높게 나타났다 (Table 2).

Shoots and roots fresh and dry weight, and relative moisture content of S. miltiorrhiza as affected by four different photoperiods for eight weeks.
과거 연구에서 춘화처리한 배추 (Brassica rapa ssp. pekinensis ‘Qingtai No. 4’)는 12 h·d-1 – 18 h·d-1 범위의 광주기 내에서 16 h·d-1의 광주기일 때 가장 높은 생체중을 나타내는 것으로 보고되었으며 (Liu et al., 2023), 새싹 채소용 비트의 건물중과 샐러드무 (Raphanus sativus)의 바이오매스는 16 h·d-1 처리구에서 가장 높게 나타나 (Guo et al., 2019; Hernández-Adasme et al., 2023), 본 연구의 결과와 일부 유사하였다. 반면, 아이스플랜트 (Mesembryanthemum crystallinum)는 생육 기간에 상관없이 20 h·d-1의 광주기 하에서 가장 높은 생체중과 건물중을 나타내는 것으로 보고되었다 (Xia and Mattson, 2022).
위와 같은 연구 결과들을 토대로 볼 때, 각 식물종 마다 생장을 효과적으로 증대시킬 수 있는 적정 광주기가 다름을 알 수 있었다. 본 연구에서 단삼의 지하부 생체중은 12 h·d-1 - 16 h·d-1 범위에서 2.31 g - 2.35 g 수준이었던 것으로 조사되었으며, 지하부 건물중의 경우에는 12 h·d-1 - 24 h·d-1 범위에서는 통계적으로 유의미한 차이가 나타나지 않은 것으로 확인되어 (0.57 g – 0.85 g), 단일 조건에 비해 장일 조건에서 재배하는 것이 상대적으로 단삼의 지하부 바이오매스를 증대에 유리함을 알 수 있었다.
광주기의 영향을 받은 단삼의 생장 매개변수의 결과를 종합하여 볼 때, 지상부와 지하부를 막론하고 크기가 크고 무거운 바이오매스를 가진 식물체를 생산하기 위해서는 12 h·d-1 - 16 h·d-1 범위의 광주기에서 재배하는 것이 가장 적합한 것으로 판단된다.
2. 단삼의 외적품질 변화
식물의 외적품질은 소비자의 직관적 평가에 영향을 미치기 때문에 충분히 고려되어야 할 사항이며 (Lee and Nam, 2023), 오랜 시간에 걸친 비생물적 스트레스는 식물의 생장뿐만 아니라 외적품질에도 영향을 미칠 수 있으므로 주의해야 한다 (Nam et al., 2022).
잎의 외적품질에 관한 결과에서 명도 (lightness)를 나타내는 색공간 (color space) 매개변수인 CIELAB L* 값은 처리간 유의미한 차이가 없는 것으로 나타났다 (Table 3). 반면에 녹색 (−) - 적색 (+)을 나타내는 색공간 매개변수인 CIELAB a*는 연속광 하에서 –8.18로 유의미한 차이가 나타났다. 한편, 청색 (−) - 황색 (+)을 나타내는 색공간 매개변수인 CIELAB b*는 연속광 하에서 27.78로 가장 높게 나타났으나 그 다음으로 높게 나타났던 8 h·d-1의 광주기 (26.51)와 통계적인 차이는 없는 것으로 나타났다. 지상부의 크기, 지상부 생체중과 건물중 및 CIELAB 색공간 분석 결과를 종합적으로 판단할 때, 지상부의 생장상태가 상대적으로 저조하였던 8 h·d-1, 24 h·d-1 처리구의 경우 잎의 황색도 (yellowness)가 높아지는 것을 알 수 있었으며, 특히 연속광 하에서는 녹색도 (greenness)도 함께 낮아져 상대적으로 외적품질이 하락했음을 알 수 있었다.

Leaf and root color reading values of Commission Internationale de l'Eclairage Lab (CIELAB) of S. miltiorrhiza as affected by four different photoperiods for eight weeks.
이전 연구에서 바위솔 (Orostachys japonica)의 지하부 건물중과 b*가 음의 상관관계를 가지는 것으로 나타났으며 (Lee et al., 2022b), 바위솔국 (Delosperma cooperi)의 경우 생장매개변수와 L*, b*가 음의 상관관계를 가지는 것으로 보고되었다 (Lee et al., 2022c). 이와 일부 유사하게 본 연구에서도 생장 수준이 상대적으로 저조하였던 연속광 조건하에서 엽색의 b*가 증가하는 것으로 관찰되었다. 한편, 뿌리의 외적품질에 관한 결과에서 L*은 잎에서 나타났던 결과와 유사하게 통계적으로 유의미한 차이가 없는 것으로 나타났다. a*의 경우에는 16 h·d-1 처리구에서 13.19로 가장 높게 나타났으며, b*는 12 h·d-1 - 16 h·d-1 범위에서 17.04 - 17.16으로 다른 처리구에 비해 유의미하게 높게 나타나 광주기의 영향을 받은 단삼의 뿌리 적색도 (a*)와 황색도 (b*)는 동시에 상승하는 것으로 보인다.
단삼의 지상부 Royal Horticultural Society (RHS) 근삿값은 8 h·d-1의 광주기의 경우 146D, 147C로 평가되었으며, 12 h·d-1 - 16 h·d-1의 범위에서는 146C, 147C로 이보다는 근소하게 더 어두운 색이었던 것으로 평가되었다 (Table 4).

Royal Horticultural Society (RHS) values, converted color, and visual score of S. miltiorrhiza as affected by four different photoperiods for eight weeks.
한편, 연속광 하에서는 147C, 148C로 엽색이 약간 황화한 것으로 평가되었다. 지상부 시각점수의 결과에서는 12 h·d-1 - 16 h·d-1에서 7.1 – 7.3 범위의 점수로 높게 평가되었다. 지하부 RHS 근삿값은 8 h·d-1 - 16 h·d-1 모두 174A, 177B로 평가되었으나 연속광 하에서는 175A, 177A로 약간 어두운 색을 띄는 것으로 평가되었다. 이러한 결과는 명도와 황색도가 연속광 조건하에서 동시에 하락하는 경향이 있었기 때문인 것으로 보인다. 한편, 지하부의 시각점수는 16 h·d-1 처리구가 6.3 점으로 가장 높게 나타났다.
단삼의 외적품질의 결과를 종합하여 볼 때, 광주기의 효과는 지상부의 경우 12 h·d-1 - 16 h·d-1, 지하부의 경우에는 16 h·d-1의 수준에서 재배하는 것이 가장 효과적인 것으로 판단되나 RHS 값을 분석한 결과 8 h·d-1, 12 h·d-1와 색상의 유의미한 차이는 없는 것으로 평가되었고, 시각점수는 다소 높았다.
3. 식생지수 및 엽록소 형광 반응 분석
조사 결과 중 광주기의 영향을 받은 단삼의 엽록소 함량 (SPAD units)은 통계적으로 유의미한 차이는 없는 것으로 분석되었다 (Table 5). 한편, 원격탐사 식생지수 (remote sensing vegetation indices)를 나타내는 매개변수 중 정규식생지수 (normalized difference vegetation index, NDVI), 광화학 반사율지수 (photochemical reflectance index, PRI), 수정된 엽록소 흡광량지수 (modified chlorophyll absorption ratio index, MCARI)의 결과에서 단삼은 서로 다른 광주기 하에서 다양한 반응을 나타내었다.

Chlorophyll content (SPAD units), normalized difference vegetation index (NDVI), photochemical reflectance index (PRI), modified chlorophyll absorption ratio index (MCARI), and five chlorophyll fluorescence parameters (Fv/Fm, ΦDo, ABS/RC, DIo/RC, and PIABS) of S. miltiorrhiza as affected by four different photoperiods for eight weeks.
앞서 언급된 NDVI, PRI, MCARI는 비파괴적인 방법으로 식물의 생리 지수를 평가하는데 사용되고 있으며, 다양한 연구에서 그 유용성이 입증되었다 (Catania et al., 2023; Jang et al., 2023; Oh and Lee, 2022). 단삼을 대상으로 한 광주기를 조절한 처리구 간에 NDVI 수치는 유의미한 차이가 없는 것으로 나타났다. PRI는 식물이 광합성 효율을 저해시키는 메커니즘인 크산토필 색소 상호전환 역학 (xanthophyll pigment interconversion)을 비파괴적인 방법으로 조사하기 위해 사용된다 (Magney et al., 2016). 이 PRI의 경우에는 8 h·d-1 - 16 h·d-1의 광주기 하에서 0.011 - 0.017의 범위였으며, 통계적 유의미한 차이는 나타나지 않았다. 그러나 연속광 조건하에서는 PRI가 –0.008로 나타나 통계적으로 유의미한 차이가 있었던 것으로 분석되었다. 이는 단삼이 8 h·d-1 - 16 h·d-1의 광주기 하에서는 스트레스 상태에 있을 가능성이 적은 반면, 연속광에 노출되는 경우 상대적으로 스트레스 상태에 놓이게 됨을 간접적으로 알 수 있었다.
MCARI는 연속광 조건하에서 0.363으로 통계분석상 유의미한 차이가 있는 것으로 나타났다. 이 MCARI는 지면의 반사율과 잎의 엽록소 농도에 따라 그 결과값이 결정되며 일반적으로 식물의 엽록소 함량과 반비례한다 (Nagler et al., 2000).
본 연구에서도 광주기의 영향을 받은 단삼의 엽록소 함량과 MCARI의 평균값이 반비례하는 경향이 있는 것으로 나타나 과거 연구 결과를 뒷받침하였으며, 추가 후속 연구를 통해 PRI와 MCARI를 단삼의 스트레스 지표로 활용하는 것이 가능할 것으로 전망된다.
엽록소 형광 (chlorophyll fluorescence) 반응 분석은 식물의 스트레스 반응을 분석하는 기법으로 가장 광범위하게 사용되며 (Park et al., 2023; Van Kooten and Snel, 1990), 다양한 생리학적 연구에 적용되었다 (Kawakatsu and Fukuda, 2023; Shin et al., 2023; Zheng et al., 2023). 광계II (PSII) 의 최대 양자 수율 (maximum quantum yield)을 나타내는 매개변수인 Fv/Fm는 스트레스를 받지 않은 고등식물의 경우 약 0.780 - 0.840의 범위를 가지는 것으로 알려져 있다 (Yoo et al., 2012; Muniz et al., 2014; Asadi-Sanam et al., 2015; Hwang et al., 2019).
본 연구 결과에서 Fv/Fm는 8 h·d-1 - 16 h·d-1 범위에서 0.801 - 0.809 수준으로 나타나 단삼이 해당 범위의 광주기 하에서는 스트레스를 받지 않는 것으로 평가되었다. 그러나, 연속광 조건하에서는 Fv/Fm가 0.752로 정상 범위의 최소값인 0.780 보다 낮았던 것으로 나타나 현저한 양자수율의 하락을 관찰할 수 있었다.
한편, 흡수된 광자가 소멸될 확률 (probability of photon dissipated)을 나타내며, 식물의 스트레스 지표로 사용되는 ΦDo는 연속광 조건하에서 0.247로 높게 나타났다. 반응 중심 (reaction center, RC)당 흡광량 (absorption flux, ABS)을 나타내는 ABS/RC는 연속광 조건하에서 0.196로 가장 높게 나타나 광계II의 반응중심의 일부가 불활성화한 것으로 평가되었으며, 반응중심당 소산되는 에너지의 양 (dissipated energy flux)을 나타내는 DIo/RC는 ΦDo 및 ABS/RC의 결과와 유사하게 연속광 조건하에서 0.517로 가장 높은 것으로 나타나 연속광 조건하에서는 단삼이 생리적 스트레스를 받는 것으로 판단된다.
마지막으로 흡광량 기준 (absorption basis)의 성능지수 (performance index, PI)를 타내는 PIABS는 8 h·d-1 - 16 h·d-1 범위의 광주기에서 3.32 - 3.53 수준으로 높게 나타났으며, 연속광 조건에서는 2.35로 통계적으로 유의미하게 낮은 것으로 나타나 해당 결과들을 뒷받침하였다.
단삼의 생장 매개변수, 외적품질의 변화, 식생지수 및 엽록소 형광 반응의 결과를 종합적으로 평가할 때, 단삼의 지상부 생장과 외적품질을 촉진시키기 위해서는 12 h·d-1 - 16 h·d-1의 범위에서 재배하는 것이 가장 효과적인 것으로 판단되며, 지하부의 경우에는 지하부의 크기, 바이오매스, 외적품질에 관한 매개변수의 분석 결과를 토대로 할 때, 지상부와 마찬가지로 12 h·d-1 - 16 h·d-1의 광주기에서 단삼을 재배하는 것이 가장 효과적인 것으로 판단된다.
노지 재배는 자연광에 의존하기 때문에 광주기 설정이 어려워 본 연구 결과를 적용하기 어려우나, 폐쇄형 육묘시설이나 식물공장 시스템에서는 적용이 가능할 것으로 판단된다. 결론적으로 폐쇄형 육묘시설 혹은 식물공장 시스템과 같은 재배시설에서 단삼을 재배할 때, 12 h·d-1 - 16 h·d-1 범위의 광주기를 설정하여 재배하는 것이 단삼의 생장과 외적품질, 생리적 특성 개선에 가장 유리하였다.
Acknowledgments
본 연구는 2023년 삼육대학교 교내학술연구비 지원에 의해 수행된 결과로 이에 감사드립니다.
References
-
Asadi-Sanam S, Pirdashti H, Hashempour A, Zavareh M, Nematzadeh GA and Yaghoubian Y. (2015). The physiological and biochemical responses of eastern purple coneflower to freezing stress. Russian Journal of Plant Physiology. 62:515-523.
[https://doi.org/10.1134/S1021443715040056]

- Azalea Society of America(ASA). (2024). RHS Color fan 1. Azalea Society of America. Herndon, VA, USA. https://www.azaleas.org/rhs-color-fan-1/, (cited by 2024 March 21).
-
Catania P, Roma E, Orlando S and Vallone M. (2023). Evaluation of multispectral data acquired from UAV platform in olive orchard. Horticulturae. 9:133. https://www.mdpi.com/2311-7524/9/2/133, (cited by 2024 March 24).
[https://doi.org/10.3390/horticulturae9020133]

-
Chang HM, Cheng KP, Choang TF, Chow HF, Chui KY, Hon PM, Tan FWL, Tang Y and Zhong ZP. (1990). Structure elucidation and total synthesis of new tanshinones isolated from Salvia miltiorrhiza Bunge(Danshen). Journal of Organic Chemistry. 55:3537-3543.
[https://doi.org/10.1021/jo00298a029]

-
Chen W and Chen G. (2017). Danshen(Salvia miltiorrhiza Bunge): A prospective healing sage for cardiovascular diseases. Current Pharmaceutical Design. 23:5125-5135.
[https://doi.org/10.2174/1381612823666170822101112]

-
Cheng TO. (2007). Cardiovascular effects of Danshen. International Journal of Cardiology. 121:9-22.
[https://doi.org/10.1016/j.ijcard.2007.01.004]

-
Choi HL, Seo JW, Hwang MH, Lee HI, Kim MJ and Yu CY. (2020). Growth characteristics and functional analysis of Salvia miltiorrhiza Bunge by artificial light sources. Korean Journal of Medicinal Crop Science. 28:200-208.
[https://doi.org/10.7783/KJMCS.2020.28.3.200]

-
Chong CM, Su H, Lu JJ and Wang Y. (2019). The effects of bioactive components from the rhizome of Salvia miltiorrhiza (Danshen) on the characteristics of Alzheimer’s disease. Chinese Medicine. 14:19. https://link.springer.com/article/10.1186/s13020-019-0242-0, (cited by 2024 March 28).
[https://doi.org/10.1186/s13020-019-0242-0]

-
Daughtry CS, Walthall CL, Kim MS, De Colstoun EB and McMurtrey III JE. (2000). Estimating corn leaf chlorophyll concentration from leaf and canopy reflectance. Remote Sensing of Environment. 74:229-239.
[https://doi.org/10.1016/S0034-4257(00)00113-9]

-
Gamon JA, Penuelas J and Field CB. (1992). A narrow-waveband spectral index that tracks diurnal changes in photosynthetic efficiency. Remote Sensing of Environment. 41:35-44.
[https://doi.org/10.1016/0034-4257(92)90059-S]

-
Gamon JA, Serrano L and Surfus JS. (1997). The photochemical reflectance index: An optical indicator of photosynthetic radiation use efficiency across species, functional types, and nutrient levels. Oecologia. 112:492-501.
[https://doi.org/10.1007/s004420050337]

-
Goto E. (2012). Plant production in a closed plant factory with artificial lighting. Acta Horticulturae. 956:37-49.
[https://doi.org/10.17660/ActaHortic.2012.956.2]

-
Guo R, Li W, Wang X, Chen B, Huang Z, Liu T, Chen X, XuHan X and Lai Z. (2019). Effect of photoperiod on the formation of cherry radish root. Scientia Horticulturae. 244:193-199.
[https://doi.org/10.1016/j.scienta.2018.09.044]

-
Guo Y, Li Y, Xue L, Severino RP, Gao S, Niu J, Qin L, Zhang D and Brömme D. (2014). Salvia miltiorrhiza: An ancient Chinese herbal medicine as a source for anti-osteoporotic drugs. Journal of Ethnopharmacology. 155:1401-1416.
[https://doi.org/10.1016/j.jep.2014.07.058]

-
Hernández-Adasme C, Palma-Dias R and Escalona VH. (2023). The effect of light intensity and photoperiod on the yield and antioxidant activity of beet microgreens produced in an indoor system. Horticulturae. 9:493. https://www.mdpi.com/2311-7524/9/4/493, (cited by 2024 April 02).
[https://doi.org/10.3390/horticulturae9040493]

-
Heuvelink E and Dorais M. (2011). Crop growth and yield. In Heuvelink E. (ed.), Tomatoes. CABI Publishing. Oxfordshire, England. p.85-144.
[https://doi.org/10.1079/9780851993966.0085]

-
Higuchi Y, Sumitomo K, Oda A, Shimizu H and Hisamatsu T. (2012). Day light quality affects the night-break response in the short-day plant chrysanthemum, suggesting differential phytochromemediated regulation of flowering. Journal of Plant Physiology. 169:1789-1796.
[https://doi.org/10.1016/j.jplph.2012.07.003]

-
Hügel HM and Jackson N. (2014). Danshen diversity defeating dementia. Bioorganic and Medicinal Chemistry Letters. 24:708-716.
[https://doi.org/10.1016/j.bmcl.2013.12.042]

-
Hwang HS, Jeong HW, Kim HM and Hwang SJ. (2019). Application of mechanical stimulation for overgrowth retardation to tomato grafted seedlings using air circulation fans in greenhouse. Acta Horticulturae. 1296:241-246.
[https://doi.org/10.17660/ActaHortic.2020.1296.31]

-
Im NH and Lee HB. (2023). Manipulation of flowering by cold temperature and photoperiodic control in Veronica nakaiana Ohwi, a Korean endemic species. Horticulture, Environment, and Biotechnology. 64:905-915.
[https://doi.org/10.1007/s13580-023-00535-w]

-
Jackson SD. (2009). Plant responses to photoperiod. New Phytologist. 181:517-531.
[https://doi.org/10.1111/j.1469-8137.2008.02681.x]

-
Jang IT, Lee JH, Shin EJ and Nam SY. (2023). Evaluation of growth, flowering, and chlorophyll fluorescence responses of Viola cornuta cv. Penny Red Wing according to spectral power distributions. Journal of People, Plants, and Environment. 26:335-349.
[https://doi.org/10.11628/ksppe.2023.26.4.335]

-
Jeong JT, Lee JH, Lee WM, An TJ, Lee YJ, Hur M, Ma K, Kim YG and Han JW. (2023). Cultivation and quality characterization of new variety Salvia miltiorrhiza ‘Dasan’. Korean Journal of Medicinal Crop Science. 31:371-376.
[https://doi.org/10.7783/KJMCS.2023.31.6.371]

-
Jia Q, Zhu R, Tian Y, Chen B, Li R, Li L, Lili W, Yiwen C, Dandan Z, Fangfang M, Sihua G and Zhang D. (2019). Salvia miltiorrhiza in diabetes: A review of its pharmacology, phytochemistry, and safety. Phytomedicine. 58:152871. https://www.sciencedirect.com/science/article/abs/pii/S094471131930042X, (cited by 2024 March 28).
[https://doi.org/10.1016/j.phymed.2019.152871]

- Jung CS, Oh KW, Kim HK, Kwon YC, Pae SB, Park CB and Kwack YH. (2003). Flowering response according to different seeding dates and day-length treatment in perilla. Korean Journal of Crop Science. 48:490-494.
-
Kang H, Im NH, An SK, Lee HB and Kim KS. (2022). Flowering responses of Eremogone juncea(M. Bieb.) fenzl to photoperiod, chilling treatment, and cold storage. Horticulture, Environment, and Biotechnology. 63:173-180.
[https://doi.org/10.1007/s13580-021-00395-2]

-
Kang HS, Chung HY, Jung JH, Kang SS and Choi JS. (1997). Antioxidant effect of Salvia miltiorrhiza. Archives of Pharmacal Research. 20:496-500.
[https://doi.org/10.1007/BF02973947]

-
Kawakatsu T and Fukuda N. (2023). Dense planting and environmental control(temperature, light intensity, and concentration of nutrient solution) can increase the yield of ginseng(Panax ginseng C. A. Meyer) seedlings in indoor cultivation with artificial light. Horticulture, Environment, and Biotechnology. 64:571-582.
[https://doi.org/10.1007/s13580-022-00506-7]

-
Kim EA, Lee JH and Nam SY. (2024). Experimental control of day and night temperatures to improve the growth and external quality of Salvia miltiorrhiza Bunge. Horticultural Science and Technology. 42:42-51.
[https://doi.org/10.7235/HORT.20240008]

-
Kim SH, Hwang IW, Chung SK, Seo YJ, Kim JS, Jeong YJ and Kim MY. (2015). Physicochemical properties of Salvia miltiorrhiza Bunge following treatment with enzymes. Korean Journal of Food Preservation. 22:699-707.
[https://doi.org/10.11002/kjfp.2015.22.5.699]

-
Kim YG, Yeo JH, Han SH, Hur M, Lee YS and Park CB. (2013). Characteristics of growth and yield by planting density and mulching materials in Salvia miltiorrhiza Bunge. Korean Journal of Medicinal Crop Science. 21:179-183.
[https://doi.org/10.7783/KJMCS.2013.21.3.179]

- Lee JH. (2023). Effects of light quality, temperature, photoperiod, and GA3 concentration on growth of six Phedimus species. Ph. D. Thesis. Sahmyook University. p.65-79.
- Lee JH, Kim HB and Nam SY. (2022a). Evaluation of the growth and leaf color of indoor foliage plants under high temperature and continuous lighting conditions at different light intensity. Journal of Agricultural Life and Environmental Sciences. 34:26-36.
-
Lee JH and Nam SY. (2023). Influence of three types of LED light quality on the growth and leaf color of Sempervivum ‘Black Top’. Journal of Agriculture and Life Science. 57:39-47.
[https://doi.org/10.14397/jals.2023.57.2.39]

-
Lee JH, Soh SY, Kim HJ and Nam SY. (2022b). Effects of LED light quality on the growth and leaf color of Orostachys japonica and O. boehmeri. Journal of Bio-Environment Control. 31:104-113.
[https://doi.org/10.12791/KSBEC.2022.31.2.104]

-
Lee JH, Soh SY and Nam SY. (2022c). Growth evaluation of potted Delosperma cooperi(Hook. f.) L. Bolus to shading levels, potting media, and fertilization rates. Flower Research Journal. 30:1-9.
[https://doi.org/10.11623/frj.2022.30.1.01]

-
Li H, Gao C, Liu C, Liu L, Zhuang J, Yang J, Zhou C, Feng F, Sun C and Wu J. (2021). A review of the biological activity and pharmacology of cryptotanshinone, an important active constituent in Danshen. Biomedicine and Pharmacotherapy. 137:111332. https://www.sciencedirect.com/science/article/pii/S0753332221001177, (cited by 2024 March 28).
[https://doi.org/10.1016/j.biopha.2021.111332]

-
Li ZM, Xu SW and Liu PQ. (2018). Salvia miltiorrhiza Burge (Danshen): A golden herbal medicine in cardiovascular therapeutics. Acta Pharmacologica Sinica. 39:802-824.
[https://doi.org/10.1038/aps.2017.193]

-
Liu H, Ma S, Xia H, Lou H, Zhu F and Sun L. (2018). Anti-inflammatory activities and potential mechanisms of phenolic acids isolated from Salvia miltiorrhiza f. alba roots in THP-1 macrophages. Journal of Ethnopharmacology. 222:201-207.
[https://doi.org/10.1016/j.jep.2018.05.008]

-
Liu H, Niu M, Zhu S, Zhang F, Liu Q, Liu Y, Liu R and Zhang Y. (2020). Effect study of continuous monoculture on the quality of Salvia miltiorrhiza bge roots. BioMed Research International. 2020:4284385. https://www.hindawi.com/journals/bmri/2020/4284385/, (cited by 2024 March 28).
[https://doi.org/10.1155/2020/4284385]

-
Liu S, Lu J, Tian J, Cao P, Li S, Ge H, Han M and Zhong F. (2023). Effect of photoperiod and gibberellin on the bolting and flowering of non-heading Chinese cabbage. Horticulturae. 9:1349. https://www.mdpi.com/2311-7524/9/12/1349, (cited by 2024 April 02).
[https://doi.org/10.3390/horticulturae9121349]

-
Lowe SB, Mahon JD and Hunt LA. (1976). The effect of daylength on shoot growth and formation of root tubers in young plants of cassava(Manihot esculenta grantz). Plant Science Letters, 6:57-62.
[https://doi.org/10.1016/0304-4211(76)90179-6]

- Lu L, He CE, Jin Y, Zhang X and Wei J. (2013). Effects of the applications of phosphorus and potassium fertilizers at different growth stages on the root growth and bioactive compounds of 'Salvia miltiorrhiza' Bunge. Australian Journal of Crop Science. 7:1533-1543.
-
Magney TS, Vierling LA, Eitel JU, Huggins DR and Garrity SR. (2016). Response of high frequency photochemical reflectance index(PRI) measurements to environmental conditions in wheat. Remote Sensing of Environment. 173:84-97.
[https://doi.org/10.1016/j.rse.2015.11.013]

-
Moon K and Cha J. (2020). Enhancement of antioxidant and antibacterial activities of Salvia miltiorrhiza roots fermented with Aspergillus oryzae. Foods. 9:34. https://www.mdpi.com/2304-8158/9/1/34, (cited by 2024 April 02).
[https://doi.org/10.3390/foods9010034]

-
Muniz CR, Freire FCO, Viana FMP, Cardoso JE, Sousa CAF, Guedes MIF, van de Schoor R and Jalink H. (2014). Monitoring cashew seedlings during interactions with the fungus Lasiodiplodia theobromae using chlorophyll fluorescence imaging. Photosynthetica. 52:529-537.
[https://doi.org/10.1007/s11099-014-0061-6]

-
Nagler PL, Daughtry CST and Goward SN. (2000). Plant litter and soil reflectance. Remote Sensing of Environment. 71:207-215.
[https://doi.org/10.1016/S0034-4257(99)00082-6]

-
Nam JW, Lee JH, Lee JG, Hwang SY and Nam SY. (2022). Characteristics of growth and leaf color of Hylotelephium telephium cv. Lajos and H. sieboldii cv. Mediovariegatum as affected by shading levels. Flower Research Journal. 30:172-183.
[https://doi.org/10.11623/frj.2022.30.4.02]

- Nam SY, Park SK, Lee JH and Jang IT. (2024). Introductory horticulture 3rd edition. RGB press. Seoul, Korea. p.55-61.
-
Oh SI and Lee AK. (2022). Effect of rooting promoter treatments on cutting and growth of Sedum takesimense. Horticultural Science and Technology. 40:12-20.
[https://doi.org/10.7235/HORT.20220002]

-
Park JE, Park YG, Jeong BR and Hwang SJ. (2012). Growth and anthocyanin content of lettuce as affected by artificial light source and photoperiod in a closed-type plant production system. Korean Journal of Horticultural Science and Technology. 30:673-679.
[https://doi.org/10.7235/hort.2012.12020]

-
Park SH, Lee JH and Nam SY. (2023). An analysis of the growth and photosynthetic responses of potted Veronica pusanensis Y.N.Lee according to the shading levels. Journal of People, Plants, and Environment. 26:219-231.
[https://doi.org/10.11628/ksppe.2023.26.3.219]

- Photon Systems Instruments(PSI). (2024). FluorPen FP 110 PAR-FluorPen FP 110 Monitoring Pen MP 100. FluorPen & PAR FluorPen, Photon Systems Instruments. Drásov, Czech Republic. https://handheld.psi.cz/documents/FluorPen_Monitoring_Manual_02_2021.pdf, (cited by 2024 April 02).
-
Pouteau S, Ferret V and Lefebvre D. (2006). Comparison of environmental and mutational variation in flowering time in Arabidopsis. Journal of Experimental Botany. 57:4099-4109.
[https://doi.org/10.1093/jxb/erl186]

- Rouse JW, Haas RH, Schell JA and Deering DW. (1973). Monitoring vegetation systems in the Great Plains with ERTS. NASA SP-351. Washington DC, USA. p.309-317.
- Rural Development Administration(RDA). (2018). Development of a new cultivar of Salvia miltiorrhiza, ‘Gosan’, a medicinal crop that helps blood circulation, Rural Development Administration. Wanju, Korea. http://www.rda.go.kr/board/board.do?mode=view&prgId=day_farmprmninfoEntry&dataNo=100000745564, (cited by 2024 March 21).
-
Shi M, Huang F, Deng C, Wang Y and Kai G. (2019). Bioactivities, biosynthesis and biotechnological production of phenolic acids in Salvia miltiorrhiza. Critical Reviews in Food Science and Nutrition. 59:953-964.
[https://doi.org/10.1080/10408398.2018.1474170]

- Shin EJ, Lee JH and Nam SY. (2023). Changes in growth, visual qualities, and photosynthetic parameters in Peperomia species and cultivars under different color temperatures of white lighting conditions. Journal of Agricultural Life and Environmental Sciences. 35:307-321.
-
Shin YR, Ryu BR, Kang MJ, Kim MJ, Jeong JT, Han JW, Lee GW and Lim JD. (2024). Pharmaceutical constituents contents and deviations in Korean and Chinese cultivars of Salvia miltiorrhiza root(Danshen) followed by crop years. Korean Journal of Medicinal Crop Science. 32:90-104.
[https://doi.org/10.7783/KJMCS.2024.32.2.90]

-
Stirbet A and Govindjee G. (2011). On the relation between the Kautsky effect(chlorophyll a fluorescence induction) and photosystem II: basics and applications of the OJIP fluorescence transient. Journal of Photochemistry and Photobiology B: Biology. 104:236-257.
[https://doi.org/10.1016/j.jphotobiol.2010.12.010]

-
Sul S, Baek Y and Cho YY. (2022). Effects of light intensity, light quality and photoperiod for growth of perilla in a closed-type plant factory system. Journal of Bio-Environment Control. 31:180-187.
[https://doi.org/10.12791/KSBEC.2022.31.3.180]

-
Van Kooten O and Snel JF. (1990). The use of chlorophyll fluorescence nomenclature in plant stress physiology. Photosynthesis Research. 25:147-150.
[https://doi.org/10.1007/BF00033156]

- Wang BQ. (2010). Salvia miltiorrhiza: chemical and pharmacological review of a medicinal plant. Journal of Medicinal Plants Research. 4:2813-2820.
-
Went FW. (1953). The effect of temperature on plant growth. Annual Review of Plant Physiology. 4:347-362.
[https://doi.org/10.1146/annurev.pp.04.060153.002023]

-
Xia J and Mattson N. (2022). Response of common ice plant (Mesembryanthemum crystallinum L.) to photoperiod/daily light integral in vertical hydroponic production. Horticulturae. 8:653. https://www.mdpi.com/2311-7524/8/7/653, (cited by 2024 March 21).
[https://doi.org/10.3390/horticulturae8070653]

-
Yeung JHK. (2012). New results on the pharmacology and clinical use of the TCM-drug Salvia miltiorrhiza. In Wagner H and Ulrich-Merzenich G. (ed.)., Evidence and rational based research on Chinese drugs. Springer. Vienna, Austria. p.237-282.
[https://doi.org/10.1007/978-3-7091-0442-2_6]

-
Yoo SY, Eom KC, Park SH and Kim TW. (2012). Possibility of drought stress indexing by chlorophyll fluorescence imaging technique in red pepper(Capsicum annuum L.). Korean Journal of Soil Science and Fertilizer. 45:676-682.
[https://doi.org/10.7745/KJSSF.2012.45.5.676]

-
Zaytseva O, Terrel Gutierrez M and Graeff-Hönninger S. (2022). Effect of day length on growth and root morphology of yellow maca(Lepidium meyenii) seedlings. International Journal of Plant Biology. 13:71-81. https://www.mdpi.com/2037-0164/13/2/8, (cited by 2024 May 24).
[https://doi.org/10.3390/ijpb13020008]

- Zettl A. (2024). Converting Colors. Converting Colors website. Available via https://convertingcolors.com, (cited by 2024 March 28).
-
Zhao GR, Xiang ZJ, Ye TX, Yuan YJ and Guo ZX. (2006). Antioxidant activities of Salvia miltiorrhiza and Panax notoginseng. Food Chemistry. 99:767-774.
[https://doi.org/10.1016/j.foodchem.2005.09.002]

-
Zhang S, Ma J, Zou H, Zhang L, Li S and Wang Y. (2020). The combination of blue and red LED light improves growth and phenolic acid contents in Salvia miltiorrhiza Bunge. Industrial Crops and Products. 158:112959.
[https://doi.org/10.1016/j.indcrop.2020.112959]

-
Zhang XZ, Qian SS, Zhang YJ and Wang RQ. (2016). Salvia miltiorrhiza: A source for anti-Alzheimer’s disease drugs. Pharmaceutical Biology. 54:18-24.
[https://doi.org/10.3109/13880209.2015.1027408]

-
Zheng W, Tian Y, Shi H, Chen M, Hong S, Xu K, Cheng J and Zang Y. (2023). Exogenous 5-aminolevulinic acid promotes plant growth and salinity tolerance of grape rootstocks in coastal areas. Horticulture, Environment, and Biotechnology. 64:179-191.
[https://doi.org/10.1007/s13580-022-00474-y]








