
폐쇄형 식물공장 시스템하에서 서로 다른 LED 광질에 의한 단삼의 생장 특성 및 광화학 반응 차이
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Salvia miltiorrhiza Bunge, an important medicinal crop, is documented in China's oldest pharmacopoeia, Shennong Bencaojing. However, research on the effects of light quality on its growth and photochemical responses is limited.
This study utilized T5 light-emitting diode (LED) bars with red (630 ㎚), green (520 ㎚), blue (450 ㎚), purple phyto (450 ㎚, 650 ㎚, and far-red), warm white (3000 K), natural white (4100 K), and cool white (6500 K) lights. The results indicated that white LEDs enhanced the shoot growth, chlorophyll content (SPAD units) and root number of S. miltiorrhiza more effectively than monochromatic LEDs and purple phyto-LEDs. Far-red wavelengths, approximately 17.6% of which are included in the purple phyto-LEDs, have been suggested to influence root length positively. Biomass was heavier under white LEDs, suggesting the importance of including the full spectrum of wavelengths within the photosynthetically active radiation range. White LEDs provided superior growth and photochemical efficiency, with slight variations based on the types of white light. Although green LED alone had negative effects, green wavelengths may be more crucial than far-red wavelengths when included in a composite spectrum.
S. miltiorrhiza exhibited optimal growth and photochemical responses under white LED lights. Although green LED light alone has negative effects, green wavelengths within a composite spectrum may play a more important role than far-red wavelengths. However, further research is required to confirm these findings and fully understand the specific contributions of each wavelength.
Keywords:
Salvia miltiorrhiza, Chlorophyll Fluorescence, Commission Internationale de l'Eclairage Lab, Danshen, Lamiaceae, Light-Emitting Diode, Medicinal Crop, Plant Factory서 언
꿀풀과 (Lamiaceae)에 속한 단삼은 (Salvia miltiorrhiza Bunge)은 경제적, 약리학적 이점이 뛰어난 것으로 알려져 있으며 (Su et al., 2015), 중국에서 가장 오래된 약학서인 ‘신농본초경’에도 기록되어 있는 중요한 약용작물이다 (Jiang et al., 2019).
단삼은 주로 중국에서 건강개선을 위한 차 (tea)의 재료로 활용되며 (Wei et al., 2017; Shi et al., 2019; Moon and Cha, 2020), 특히 심혈관 계통의 질환에 효과적인 것으로 알려져 있다 (Liu et al., 2014; Chen and Chen, 2017; Li et al., 2018). 이외에도 항암 (Chen et al., 2014), 항골다공증 (Guo et al., 2014), 망막병증의 개선 (Zhang et al., 2013), 항산화 (Zhao et al., 2006; Zhang et al., 2010), 항염증 (Ma et al., 2016)과 같이 다양한 질환과 증상 개선에 효과가 있는 것으로 보고되었다.
이처럼 단삼은 약리학적 이점이 크며, 국내에서 단삼 신품종인 “다산” (Dasan, Jeong et al., 2023), “고산” (Gosan, RDA, 2018), “홍단” (Hongdan, Han et al., 2024)과 같은 여러 단삼 품종들이 개발되어, 장래에 국내 농가로의 보급이 활발해질 것으로 기대된다.
과거 연구에 따르면 단삼은 연작피해가 발생될 우려가 있는 작물로 (Liu et al., 2020), 양액재배 방식이나 배지의 교체가 용이한 시설재배와 같은 재배 방법을 고려할만하다 (Kim et al., 2024a). 따라서 단삼의 생장과 생리적 건전성을 향상시키기 위해 인공광원을 활용한 재배 방법에 초점을 둔 생리학적 연구가 필요한 실정이다.
최근 인공광원을 활용한 약용작물의 재배 및 연구가 활발히 이루어지고 있으며 (Liu et al., 2014; Seo et al., 2022; Kim et al., 2024b), 단삼 또한 인공광원을 활용한 재배가 시도되고 있다 (Choi et al., 2020; Zhang et al., 2020). 그러나 이러한 단삼의 재배방식은 아직 기초 연구 수준에 머무르고 있는 실정이기 때문에 다양한 실험적 접근이 필요하다.
인공광원 중 발광 다이오드 (light-emitting diode, LED)는 낮은 발열량과 긴 수명, 저렴한 가격 및 스펙트럼 조절의 용이성 등 다양한 이점들로 인해 폐쇄형 식물공장 시스템과 같은 실내재배에서 주로 활용되고 있으며 (Goto, 2012; Singh et al., 2015; Lee and Nam, 2023a), 보광 (supplemental lighting)이나 광주기 (photoperiod)의 조절을 위한 목적으로도 이용되고 있다 (Hwang et al., 2022; Choi et al., 2024; Kim et al., 2024a). 이와 같은 이유로 현재까지 LED를 활용한 다양한 생육 조사 연구들이 수행되어 왔으며 (Lee et al., 2022a; Shin et al., 2023a; Si et al., 2024), 광질에 따른 생리적 건전성 평가 (Choi et al., 2022; Roh and Yoo, 2023), 외적품질 변화에 대한 분석 (Kim et al., 2022; Lee and Nam, 2023b; Shin et al., 2023b) 등 다양한 연구들이 시도되었다.
근래에 식물의 생장과 생리적 특성을 개선시키기 위한 광질 (light quality) 조절 실험은 색온도별 백색 LED의 사용이나 다양한 경우의 수의 단색광 LED를 조합하는 실험 이외에도 식물재배용 보라색 LED (purple phyto-LED)를 활용한 연구들 또한 수행되고 있다 (Jang et al., 2023; Lee and Nam, 2023a; Shin et al., 2024a; Vereshchagin et al., 2024).
이때, 광질과 같은 비생물적 요인의 영향을 받은 식물의 생리적 건전성을 평가하는 방법 중 엽록소 형광 (chlorophyll fluorescence) 반응 분석을 통해 생리적 건전성을 평가하기도 한다 (Adak, 2018). 이 방법은 비파괴적인 방법을 통해 식물의 생리적 건전성을 판단하는 지표 중 하나인 광화학 반응을 빠르게 분석할 수 있는 것이 특징이며 (Jang et al., 2023), 여러 연구에서 광계II (PSII)의 반응중심 (reaction center)의 활성도 및 건전성을 파악하는 방법으로 널리 활용되어왔다 (Kwon et al., 2023; Park et al., 2023a; Shin et al., 2023a).
이에 본 연구에서는 서로 다른 LED 광질에 의한 단삼의 생장 및 광화학 반응의 차이를 분석하기 위해 서로 다른 광질을 가진 일곱 가지의 LED를 적용하였으며, 이에 대한 분석 자료를 제시하였다.
재료 및 방법
1. 식물재료
본 연구는 서로 다른 LED 광질이 단삼 (Salvia miltiorrhiza Bunge)의 생장과 광화학 반응에 어떤 차이를 발생시키는지 알아보기 위해 수행되었으며, 경기도 양평군에 위치한 양평우뚝 약선농원으로부터 3 주간 육묘된 단삼묘를 분양받아 활용하였다.
2. 재배 환경의 설정
실험은 서울특별시 노원구에 위치한 삼육대학교 환경원예학과 실험온실 별관에 위치한 가로 × 세로 × 높이가 각각 6.4 m × 5.2 m × 2.4 m 크기인 폐쇄형 식물공장 시스템에서 수행하였다.
배지는 원예용 상토 (Hanareumsangto, Shinsung Mineral, Goesan, Korea)를 사용하였으며, 가로 × 세로 × 높이의 크기가 각각 48.5 ㎝ × 33.0 ㎝ × 8.0 ㎝ 크기인 직사각형 원예용 포트에 단삼을 재식하였다. 이때, 단삼의 개체 간 재식밀도는 가로 × 세로가 각각 8.0 ㎝ × 15.0 ㎝이 되도록 하였다.
인공광원은 T5 light-emitting diode (LED) 바 (bar, Zhong Shan Jinsung Electronic, China)를 사용하였으며, 적색 LED (630 ㎚), 녹색 LED (520 ㎚), 청색 LED (450 ㎚), 적색과 청색 및 원적외선 (far-red)의 복합 스펙트럼을 나타내는 식물 재배용 보라색 LED (purple phyto-LED, 450 ㎚, 650 ㎚ + far-red), 전구색 LED (warm white, 3000 K,), 주백색 LED (natural white, 4100 K), 주광색 LED (cool white, 6500 K)을 사용하였다 (Fig. 1).
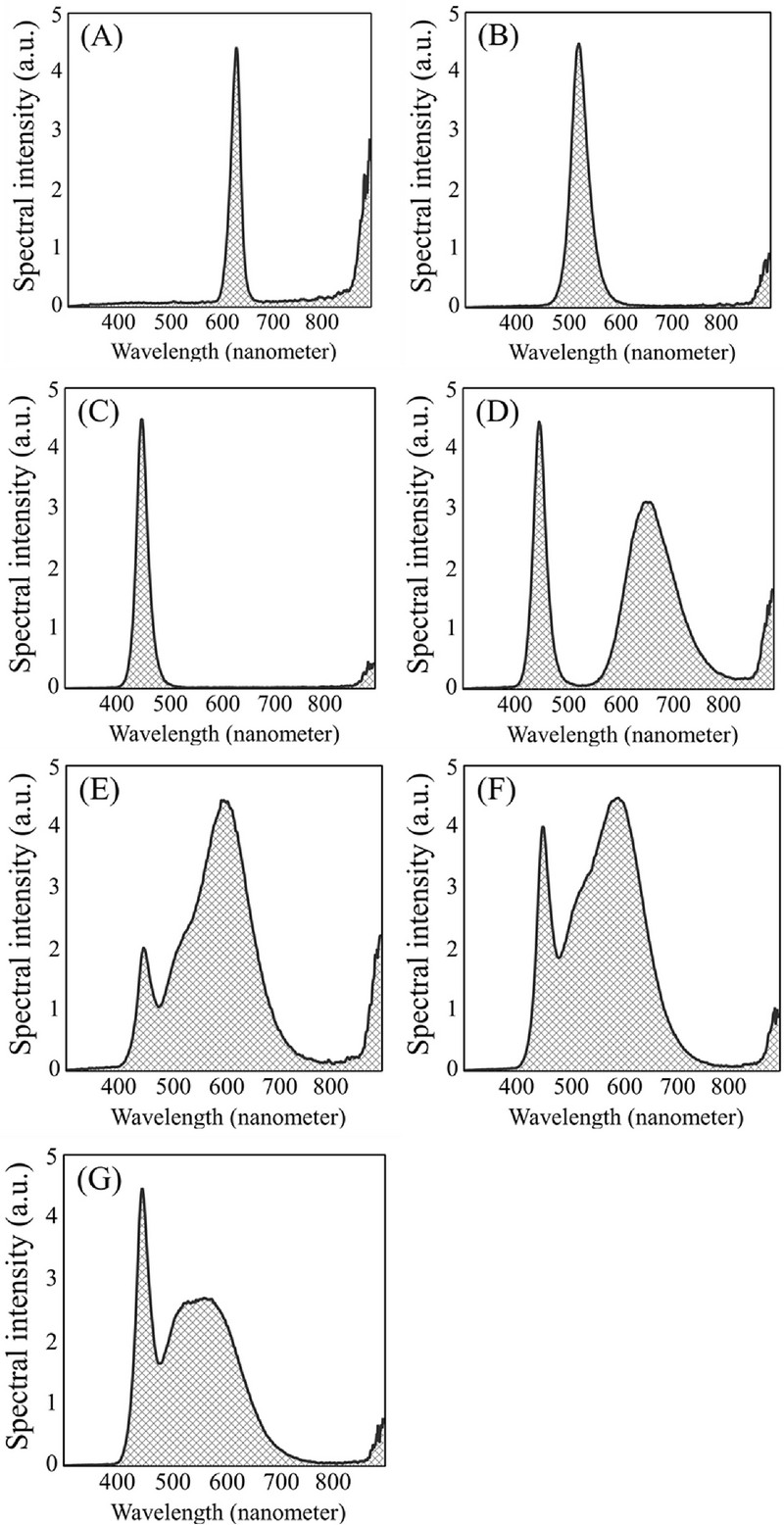
Spectral intensity of light-emitting diodes (LEDs) used in this study.(A) red LED light, (B) green LED light, (C) blue LED light, (D) purple phyto-LED light, (E) warm white LED light, (F) natural white LED light, and (G) cool white LED light.
이때, 식물재배용 보라색 LED는 적색과 청색 다이오드를 혼합하여 사용한 것이 아닌 개별 다이오드에서 적색, 청색, 원적외선 파장이 복합적으로 방출되었으며, 700 ㎚ - 800㎚ 범 위의 원적외선이 약 17.6% 수준으로 방출되었다. 추가적으로 적색, 녹색, 청색은 각각 4.7, 1.2, 1.5%의 원적외선을 나타내었으며, 전구색, 주백색, 주광색의 경우에는 각각 4.5, 3.8, 3.6% 수준이었다. LED 바는 길이 1.2 m, 소비전력 20 W, 정격전압 AC 220 V, 주파수 60 ㎐를 나타내었다. 명기/암기는 각각 14/10 시간 (h·d-1)으로 설정하였다. 광량자속밀도 (photon flux density, PFD)는 350 ㎚ – 800 ㎚ 범위 내에서 100 μmol·m-2·s-1이 되도록 식물과 LED 바 사이의 거리를 매주 조정하였다. 광량자속밀도는 휴대용 분광복사계 (SpectraPen mini, Photon Systems Instruments, Drásov, Czech Republic)를 이용하여 측정하였다.
처리구간 광의 교섭을 방지하기 위해 각각의 처리구간에 검정색 폴리에틸렌 필름 (polyethylene film)을 설치하였다. 실험의 평균온도와 상대습도는 각각 20.0 ± 1.0℃, 54.7 ± 17.2%였다.
관수는 정수 처리된 물을 매주 1.5 ℓ씩 두상관수 하였으며, 추가로 실험 6 주차에 제4종 복합비료 (High Grade S 7-10-6, Hyponex, Osaka, Japan) 1000 ppm으로 희석한 비료액 1.5 ℓ를 1 회로 두상관수 하였다.
3. 생장 매개변수와 질적 매개변수
단삼의 생장 수준을 분석하기 위해 초장, 초폭, 줄기의 지름, 근장, 피복 면적, 지상부의 개수, 뿌리의 개수, SPAD 값 (SPAD units)을 활용한 엽록소 함량, 지상부와 지하부의 생체중과 건물중, 식물체 전체 생체중과 건물중, 잎과 뿌리의 질적 매개변수를 표현하기 위한 Commission Internationale de l'Eclairage Lab (CIELAB) 색공간 (color space) 값, 고유한 색상 번호를 나타내는 Royal Horticultural Society (RHS) 값, 변환 색상, 시각점수 (visual score)를 조사 및 분석하였다.
이때, 식물체 크기와 관련된 매개변수의 조사 방법은 Park 등 (2023a)의 연구를 참조하였으며, 초장은 지면으로부터 식물의 가장 높은 부위까지를 기준으로 하여 조사하였다. 초폭은 식물체를 위에서 바라볼 때 가장 넓은 부위를 기준으로 하여 조사하였으며, 근장은 가장 긴 뿌리를 기준으로 측정하였다.
엽록소 함량은 휴대용 엽록소계 (SPAD-502Plus, Konica Minolta, Tokyo, Japan)를 활용하여 무작위의 잎을 조사하였으며, CIELAB도 이와 유사하게 무작위의 잎을 CIELAB D65/10°로 설정된 분광광도계 (CM-2600d, Konica Minolta, Tokyo, Japan)를 사용하여 측정하였다 (Lee, 2023). 이때, 엽맥을 회피하여 측정하였으며, 10회 반복 측정을 통해 정반사광 (specular component included, SCI)이 포함된 CIELAB L*, a*, b* 평균값을 얻었다.
RHS 값은 L*, a*, b* 값 RGB로 변환한 후, ASA (2024)에 나와 있는 색상 차트를 대조하여 근삿값을 각각 두 개씩 구하였다. 변환 색상의 경우에는 Zettl (2024)이 고안한 Converting Colors를 활용하여 가로 × 세로, 50 × 10 픽셀 (pixel)의 컬러 칩 (color chip)을 추출하였다.
시각점수의 평가 방법은 Kim 등 (2024c)의 연구를 참조하였으며, 교수와 전문농업인, 연구원 및 대학원생 등 총 12인이 0 – 10 점 사이의 점수로 평가하였다.
추가적으로 단삼의 종합적인 생장수준을 분석하기 위해 Dickson quality index (DQI)를 사용하였으며, Dickson 등 (1960)의 연구를 참고하였다 (수식 1). 식물의 지상부와 지하부의 상대 수분함량 (relative water content, RMC)은 수식 2를 활용하여 계산하였다. 마지막으로 단삼 지상부의 충실도 (compactness)를 조사하기 위해 Kim 등 (2016)의 연구를 참고하여 적용하였으며, 이와 관련된 수식은 아래와 같다 (수식 3).
| (수식 1) |
| (수식 2) |
| (수식 3) |
(SD; stem diameter, SH; shoot height, RDW; root dry weight, SDW; shoot dry weight, TDW; total dry weight, FW; fresh weight, DW; dry weight)
4. 광화학 반응 분석
광화학 반응을 분석하기 위한 엽록소 형광 (chlorophyll fluorescence)은 휴대용 엽록소 형광 측정기 (FluorPen FP 110/D, Photon SystemsInstruments, Drásov, Czech Republic)를 사용하였으며, 총 15개의 엽록소 형광 매개변수를 평가하였다. 이때, 엽록소 형광 반응을 측정하기 위해 제조사의 가이드라인에 따라 탈착식 암적응 리프클립 (detachable dark-adapted leaf-clip)을 활용하여 단삼의 잎을 약 15분간 암적응 시킨 후 측정하였으며 (PSI, 2024), 엽맥이 지나지 않는 부위에 리프클립의 측정부를 배치하였다. 이때, 각 처리별 15회 반복 측정하였다.
각 엽록소 형광 매개변수의 수식과 설명은 Stirbet와 Govindjee (2011), PSI (2024) 및 Lee 등 (2022b)의 연구를 참고하였으며, 이에 대한 설명과 수식은 아래와 같다.
여러 단계의 광합성 전자 전달 흐름의 과정과 식물의 생리적 건전성을 판단하는 매개변수로 활용되고 있는 OJIP 엽록소 형광 매개변수 (Küpper et al., 2019) 중 J 단계 (jump step)의 상대 가변 형광량 (relative variable fluorescence)을 나타내는 Vj (수식 4), I 단계 (intermediate step)의 상대가 변형광량을 나타내는 Vi (수식 5), 광계II (PSII)의 광화학 (photochemical) 양자 수율 (quantum yield)을 나타내는 Fm/Fo, 광계II의 1차 수율을 나타내는 Fv/Fo (수식 6), 최대 양자 수율을 나타내는 Fv/Fm (수식 7), 엽록소 형광 과도 (transient)의 기울기 (slope)를 나타내는 Mo (수식 8), 흡광량 기준 (absorption basis, ABS)의 성능지수 (performance index, PI)를 나타내는 PIABS (수식 9), 형광 매개변수 Fv/Fm와 동일하게 최대 양자 수율을 나태는 ΦPo (수식 10), 갇힌 엑시톤 (exciton)이 QA를 넘어 전자 전달 사슬 (electron transport chain)로 전자를 이동시킬 확률을 나타내는 Ψo (수식 11), 전자 수송 (electron transport)의 양자 수율을 나타내는 ΦEo (수식 12), 흡수된 광 자가 소멸될 확률 (probability of photon dissipated)을 나타내는 ΦDo (수식 13), 반응중심 (reaction center, RC)당 흡광 량을 나타내는 ABS/RC (수식 14), 반응중심당 포획된 에너지 (trapped energy)의 양을 나타내는 TRo/RC (수식 15), 반응중 심당 QA에서 QB로의 전자 전달량 (electron transport flux)을 나타내는 ETo/RC (수식 16), 반응중심당 소산되는 에너지의 양 (dissipated energy flux)을 나타내는 DIo/RC (수식 17)를 이용하여 LED 광질의 영향을 받은 단삼의 광화학 반응의 차이를 평가하였다.
| (수식 4) |
| (수식 5) |
| (수식 6) |
| (수식 7) |
| (수식 8) |
| (수식 9) |
| (수식 10) |
| (수식 11) |
| (수식 12) |
| (수식 13) |
| (수식 14) |
| (수식 15) |
| (수식 16) |
| (수식 17) |
5. 통계분석
실험 결과의 분석은 SAS 9.4 (SAS Institute, Cary, NC, USA)를 사용하여 일원배치 분산분석 (one-way ANOVA)을 수행하였다. 실험은 완전임의배치법 (completely randomized design)으로 단삼 1 개체를 1 반복으로 하여 처리구별 10 반복 배치하였다. 평균간 비교는 5% 수준의 던컨의 다중검정 (Duncan’s Multiple Range Test, DMRT)으로 통계분석 하였다 (p < 0.05).
결과 및 고찰
1. 식물체 크기, 엽록소 함량 차이
본 연구 결과에서 단삼 (Salvia miltiorrhiza Bunge)의 초장은 적색과 청색 및 원적외선 (far-red) 스펙트럼 (spectrum)이 포함된 식물재배용 보라색 (purple phyto) light-emitting diode (LED)와 주백색 (natural white, 4100 K), 주광색 (cool white, 6500 K)과 같은 백색 LED 처리구하에서 각각 7.17, 6.87, 7.09 ㎝로 높게 나타났다 (Fig. 2 and Table 1).

Plant growth parameters, chlorophyll content (SPAD units), and Dickson quality index (DQI) of Salvia miltiorrhiza as influenced by different LED light qualities for ten weeks.

Representative image of Salvia miltiorrhiza as influenced by different LED light qualities for ten weeks.(A) red LED light, (B) green LED light, (C) blue LED light, (D) purple phyto-LED light, (E) warm white LED light, (F) natural white LED light, and (G) cool white LED light.
그러나 이와 달리 청색 LED하에서는 5.30 ㎝로 가장 낮은 초장을 나타내었으며, 이러한 결과는 Zhang 등 (2020)의 연구에서 단독으로 사용된 청색광이 단삼묘의 생육을 억제시켰다는 보고와 일치하였다. 한편, 단삼의 초폭은 식물재배용 보라색, 전구색 (warm white, 3000 K), 주백색, 주광색 LED하에서 상대적으로 넓었던 나타났으나, 적색, 녹색, 청색을 포함한 단색광 처리구하에서는 상대적으로 좁은 크기의 초폭을 가지는 것으로 나타났다.
위와 같은 결과는 단색광 처리구와 달리 복합적인 스펙트럼을 가지고 있는 마이크로웨이브 무전극 램프 (microwave electrodeless light)하에서 단삼의 지상부 생장 수준이 상대적으로 더 우수하였다는 기존의 연구 결과와 유사하였다 (Choi et al., 2020).
과거, Shin 등 (2024a)의 연구에 따르면 치커리 (Cichorium intybus) “아시아슈가 (Asia Sugar)”, “로사이탈리아나 (Rossa Italiana)” 품종은 단색광이나 식물재배용 보라색 LED하에서 재배할 때에 비해 백색 LED하에서 묘의 생육이 더욱 우수해 지는 것으로 나타났으며, 이와 반대로 화훼작물로 취급되는 Viola cornuta “Penny Red Wing” 품종의 경우 백색 LED하에서 재배하는 것에 비해 식물재배용 보라색 LED하에서 재배하는 것이 지상부 생장과 개화 발달 수준이 크게 개선되는 것으로 보고되었다 (Jang et al., 2023).
매개변수 중 줄기의 지름은 주광색 LED하에서 0.73 ㎝로 가장 굵었으며, 근장은 식물재배용 보라색 LED 처리구하에서 32.10 ㎝로 가장 긴 것으로 나타났다. 이전 연구에 따르면 치커리 “아시아슈가” 품종은 원적외선 파장이 포함되어 있는 식물재배용 보라색 LED하에서 근장이 가장 길었던 것으로 보고되었으며 (Shin et al., 2024a), 이는 본 연구의 결과와 유사하였다. 한편, 피복 면적은 주백색과 주광색 LED 처리구하에서 452.8 ㎠ – 486.6 ㎠ 범위로 높게 나타났다. 지상부의 개수는 적색과 주백색 LED 처리구하에서 각각 2.3, 2.1 개로 나타났으나, 청색 LED하에서는 1.0개로 나타나, 청색 파장은 상대적으로 지상부의 분열을 억제시키는 것으로 보인다.
뿌리의 개수는 주백색과 주광색 LED 처리구하에서 각각 7.1. 8.2 개로 나타났으며, 적색 LED하에서는 2.9 개로 가장 적었다. 한편, 엽록소 함량 (SPAD units)은 전구색, 주백색, 주광색을 포함한 세 가지 백색 LED 처리구하에서 41.74 – 44.84의 범위로 높게 나타났다. 그러나 이와 반대로 녹색과 식물재배용 보라색 LED 처리구에서 각각 30.42, 31.72로 낮게 나타나 원적외선 파장과 단독으로 사용된 녹색 파장은 상대적으로 단삼 잎의 단위면적당 엽록소의 밀도를 감소시키는 것으로 추정된다.
Dickson quality index (DQI)는 식물의 초장, 줄기의 지름, 지상부와 지하부의 건물중, 식물체 전체 건물중을 활용하여 계산되며 식물의 종합적인 생장 수준을 평가하는 척도로 활용되고 있다 (Dickson et al., 1960; Kuan-Hung et al., 2019; Park et al., 2023b). 이 DQI는 세 가지 백색 LED 처리구하에서 3.25 – 4.12의 범위로 높게 나타났으며, 이러한 결과는 인공광원 내 광합성 유효방사 (photosynthetically active radiation, PAR)의 분포 중 특정 광파장의 결핍이 없을 때 단삼의 생장과 관련된 양적 매개변수의 총합과 엽록소 함량을 유의미하게 증대시키는 것으로 평가되었다.
기존 연구에서 녹색 LED를 단용으로 사용할 때 식물의 생육에 부정적인 영향을 미치는 것으로 보고되어 왔으나 (Lee, 2023; Lee and Nam, 2023a; Shin et al., 2024a), 전체 광합성 유효방사 내에서 녹색 파장의 부재는 식물의 생육을 저해시키는 것으로 보인다 (Folta and Maruhnich, 2007; Johkan et al., 2012; Wang and Polta, 2013; Smith et al., 2017). 반면에 분광분포 (spectral power distribution) 내에서 적색과 청색 파장이 존재한다는 가정하에 원적외선 파장의 유무는 녹색 파장의 유무에 비해 단삼의 식물체 크기 변화에 상대적으로 적은 중요도를 가지고 있는 것으로 보이며, 이와 관련된 후속 연구가 필요할 것으로 보인다.
결과적으로 단삼의 지상부 생장, 엽록소 함량, 뿌리의 개수를 증대시키기 위해서는 단색광 및 식물재배용 보라색 LED에 비해 백색 LED의 사용이 유리함을 알 수 있었으며, 분광분포 내에서 원적외선 파장이 포함되는 경우 근장의 향상에 긍정적인 영향을 미치는 것으로 평가되었다.
2. 바이오매스, 상대 수분함량 차이
바이오매스 (biomass)와 관련된 결과에서 단삼의 지상부 생체중은 식물재배용 보라색, 전구색, 주광색 처리구에서 각각 5.42, 5.98, 5.53 g으로 다른 처리구들에 비해 상대적으로 무거웠던 것으로 조사되었으나, 지상부 건물중은 전구색과 주광색 LED하에서 각각 0.76, 0.89 g으로 무겁게 나타났다 (Table 2).

Shoot and root weights and relative water content of S. miltiorrhiza as influenced by different LED light qualities for ten weeks.
단삼의 지하부 생체중은 식물재배용 보라색 LED와 세 가지 백색 LED 처리구에서 5.20 g – 7.58 g의 범위로 나타났으며, 지하부 건물중은 세 가지 백색 LED하에서 1.13 g – 1.34 g의 범위로 다른 처리구에 비해 무거웠던 것으로 평가되었다.
단삼의 전체 생체중은 식물재배용 보라색 LED와 세 가지 백색 LED 처리구하에서 10.51 g – 13.56 g의 범위로 나타났으며, 전체 건물중은 다른 처리구에 비해 세 가지 백색 LED하에서 1.79 g – 2.23 g으로 상대적으로 무거웠다.
지상부와 지하부의 상대 수분함량 (relative water content)은 식물재배용 보라색 LED와 전구색 LED 처리구에서 높게 나타났다. Seif 등 (2021)의 연구에 따르면 적색광의 영향을 받은 국화 (Chrysanthemum)는 기공 (stomatal)의 크기가 감소되고 기공 개폐 속도의 조절로 인해 수분 손실에 대한 능력이 향상되는 것으로 나타났다. 본 연구 결과에서 스펙트럼 내에서 적색 파장의 비율이 상대적으로 높은 경우 단삼의 세포 내 수분함량이 증대되는 것으로 추정되며, 단색광 처리구 내에서도 적색 LED는 녹색과 청색 LED에 비해 높은 상대 수분함량을 나타내어 이를 뒷받침 하였다.
양적 매개변수 중 지상부 건물중과 초장을 활용하여 계산된 묘의 충실도 (compactness)는 주광색 LED 처리구에서 6.50로 가장 높게 나타났으며, 녹색과 청색 LED하에서 각각 1.24, 1.23으로 낮은 충실도를 나타내어 지상부의 크기 대비 탄수화물 축적량이 상대적으로 낮았던 것으로 분석되었다.
결과적으로 바이오매스는 단색광 및 식물재배용 보라색 LED에 비해 백색 LED하에서 더 무거웠던 것으로 나타났다. 따라서 단삼의 광합성량의 증대를 유도시키고 건실한 식물체를 재배하기 위해서는 광합성 유효방사 내에서 특정 광파장의 결핍을 피하는 것이 좋음을 알 수 있었다.
3. 잎과 뿌리의 외적품질 차이
본 연구에서 Commission Internationale de l'Eclairage Lab 색공간 (CIELAB color space)과 관련된 매개변수 중 잎의 명도 (lightness, CIELAB L*)는 녹색 LED하에서 45.11로 가장 높게 나타났으며, 뿌리에서는 식물재배용 보라색 LED 처리구에서 44.19로 가장 높게 나타났다 (Fig. 3).
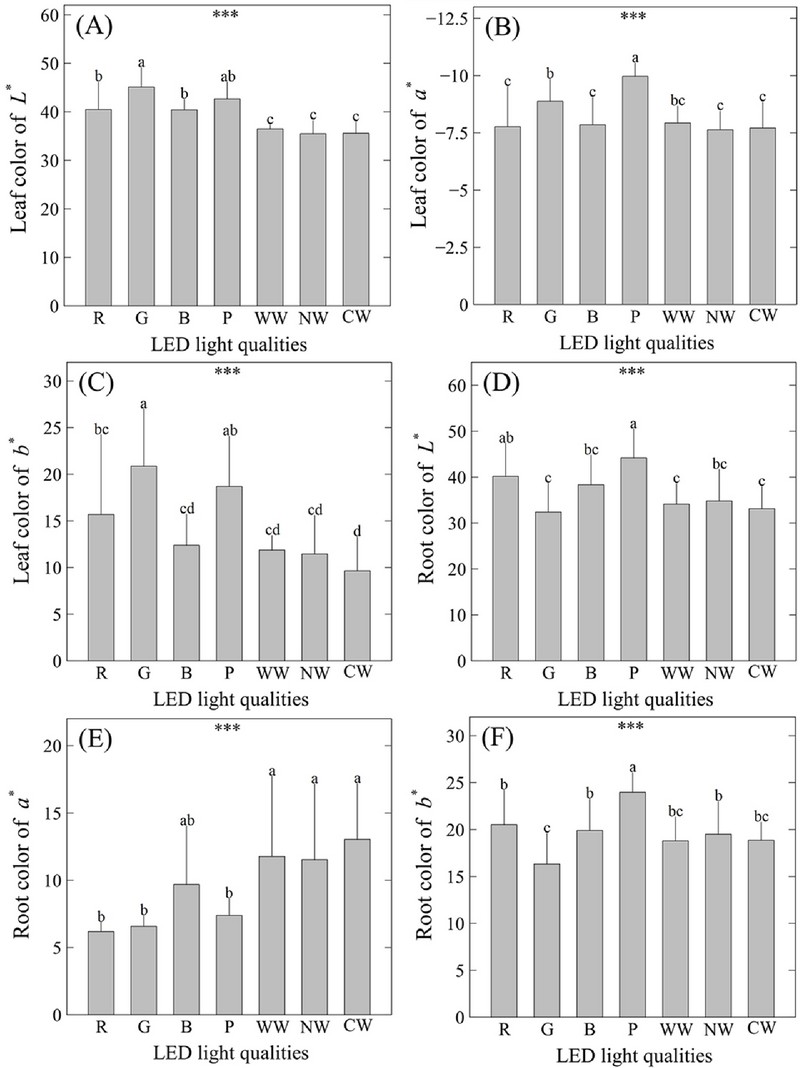
Shoot and root color reading values of Commission Internationale de l'Eclairage Lab (CIELAB) of S. miltiorrhiza as influenced by different LED light qualities for ten weeks. (A) leaf color of L*. (B) leaf color of a*. (C) leaf color of b*. (D) root color of L*. (E) root color of a*. (F) root color of b*. R; red LED light. G; green LED light. B; blue LED light. P; purple phyto-LED light. WW; warm white LED light. NW; natural white LED light. CW; cool white LED light. Vertical bars indicate standard deviation (n = 10). Asterisks (***) indicate significance at p < 0.001. Different lowercase letters indicate significant differences at p < 0.05 based on Duncan's Multiple Range Test (DMRT).
이 CIELAB는 단삼의 외적품질을 평가하기 위한 질적 매개 변수로써 주야간 온도, 광주기 (photoperiod)의 영향을 평가하는데 유용하게 활용되었으며 (Kim et al., 2024a; Kim et al., 2024c), 품종별 품질 비교 연구에서도 유용하게 활용되었다 (Shin et al., 2024b). 과거 연구에서 엽색의 L*은 식물의 생장과 관련된 양적 매개변수들과 음의 상관관계를 가지는 것으로 보고되었으며 (Lee et al., 2022c; Lee et al., 2022d), 이는 본 연구의 결과를 뒷받침 하였다. 이는 생육이 불량한 식물체의 단위면적당 엽색소의 밀도가 상대적으로 낮아지기 때문인 것으로 추정되며, 이에 따라 잎의 명도가 증가하는 것으로 보인다.
적색 (+)과 녹색 (−)을 나타내는 매개변수인 CIELAB a*는 잎의 경우 식물재배용 보라색 LED 처리구하에서 −9.97로 가장 높았으며, 뿌리의 경우에는 전구색, 주백색, 주광색의 세 가지 백색 LED 처리구에서 각각 11.77, 11.53, 13.04로 높게 나타났다. 따라서 단삼을 재배할 때, 광합성 유효방사 내에서 특정 파장의 결핍이 없는 경우 단삼의 뿌리 색상을 더 붉게 만드는 것으로 보인다. 이전 연구 결과에 따르면 단삼 뿌리의 적색도에 영향을 미치는 것은 여러 탄시논 유도체 (e.g. cryptotanshinone, tanshinone I, tanshinone IIA, tanshinone IIB etc.)와 기타 페놀류 등의 함량과 관계가 있는 것으로 알려져 있으며 (Chen et al., 2018; Kim et al., 2024c; Su et al., 2021), Liu 등 (2018)은 뿌리의 껍질 색상에 따라 탄시논의 함량을 평가할 수 있을 것으로 보았다. 따라서 차후 CIELAB a*, RGB 등과 같은 질적 매개변수와 유효성분 함량간의 상관관계 분석에 대한 후속연구가 필요할 것으로 판단된다.
황색 (+)과 청색 (−)을 나타내는 매개변수인 CIELAB b*는 잎의 경우 녹색 LED하에서 20.88로 가장 높게 나타났으며 이는 L*의 결과와 유사하였는데, 이는 식물이 비생물적 스트레스 상태에 놓였을 때 L*과 b*가 양의 상관관계를 나타내었다는 기존의 연구 결과와 유사하였다 (Lee et al., 2022c; Lee et al., 2022d). 한편, 뿌리의 경우에는 식물재배용 보라색 LED 처리구에서 23.97로 가장 높게 나타났다.
결과에서 잎의 RHS 값은 녹색, 식물재배용 보라색 LED하에서 146D, 147C로 잎이 상대적으로 밝은 녹색인 것으로 평가되었으며, 적색, 청색 LED하에서는 138B, 148B로 이보다 조금 더 진한 녹색인 것으로 평가되었다 (Table 3). 반면에 잎의 명도와 황색도가 상대적으로 낮았던 세 가지 백색 LED하에서는 147B, 148B로 진한 녹색 계통인 것으로 평가되었다.

RHS values, converted color, and visual score of S. miltiorrhiza as influenced by different LED light qualities for ten weeks.
뿌리의 RHS 값은 녹색 LED하에서 172A, 199A로 어두운 갈색인 것으로 평가되었으며, 세 가지 백색 LED하에서는 166B, 177B로 적갈색을 띄는 것으로 평가되었다. 잎의 시각 점수 (visual score)는 전구색 LED 처리구가 8.9 점으로 가장 높게 평가되었고 청색 LED 처리구에서는 2.4 점으로 가장 낮았다. 이와 유사하게 뿌리의 시각 점수 또한 전구색 처리구에서 8.4 점으로 가장 높은 것으로 평가되었으며, 청색 LED 처리구에서 3.1 점으로 가장 낮은 것으로 평가되었다.
결과적으로 지상부 외적품질의 경우 생장 수준이 상대적으로 저조하였던 녹색 LED 처리구하에서는 명도 L*과 황색도 b*의 현저한 상승이 관찰되었으며, 생장이 불량할 때 상대적으로 외적품질도 함께 하락함을 알 수 있었다. 한편, 지하부의 경우에는 지상부와 달리 복합 스펙트럼을 나타내는 식물재배용 보라색 LED 처리구하에서 L*과 b*의 현저한 증가가 관찰되었으며, 세 가지 백색 LED하에서는 비교적 낮은 평균값을 나타내었다. 한편, 단삼의 가장 중요한 질적 매개변수인 적색도 a*는 세 가지 백색 LED하에서 높게 나타나, 백색 LED하에서 재배될 때 단삼의 뿌리가 적갈색을 띄며, 시각 점수를 기반으로 한 선호도 등이 크게 향상됨을 알 수 있었다.
4. 광화학 반응 차이
OJIP 엽록소 형광 (chlorophyll fluorescence) 반응을 이용한 광화학 (photochemical) 반응 분석에서 LED 광질에 따라 서로 다른 차이를 나타내었다 (Fig. 4 and Table 4). 결과에서 엽록소 형광 매개변수 중 J 단계 (jump step)의 상대 가변 형 광량 (relative variable fluorescence)을 나타내는 Vj는 녹색 LED하에서 0.469로 가장 높게 나타났으며, I 단계 (intermediate step)의 상대 가변 형광량을 나타내는 Vi는 적색과 녹색 LED 하에서 0.787로 높게 나타났다.

Various chlorophyll fluorescence parameters of S. miltiorrhiza as influenced by different LED light qualities for ten weeks.
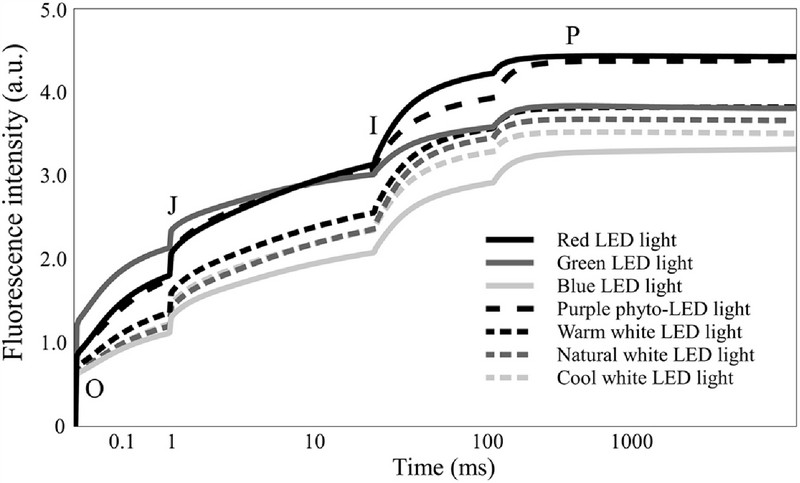
OJIP fluorescence intensity of S. miltiorrhiza as influenced by different LED light qualities for ten weeks.Mean values are measured over fifteen repetitions (n = 15). O; origin stage, J; jump stage, I; intermediate stage, and P; peak of chlorophyll fluorescence.
광계II (PSII)의 광화학 (photochemical) 양자 수율 (quantum yield)을 나타내는 Fm/Fo, 광계II의 1차 수율을 나타내는 Fv/Fo, 최대 양자 수율을 나타내는 Fv/Fm는 주백색 LED 처리구에서 각각 5.53, 4.53, 0.819로 가장 높게 나타났다.
엽록소 형광 과도 (transient)의 기울기 (slope)를 나타내는 Mo는 녹색 LED하에서 0.895로 가장 높게 나타났다. 이러한 결과는 일부 비활성화된 반응중심에 의해 초기 형광 단계 Fo의 형광 방출량이 높아지고 최대 형광 단계인 Fm(=Fp)의 형광 방출량이 크게 감소하였기 때문인 것으로 평가되었다.
흡광량 기준 (absorption basis)의 성능지수 (performance index, PI)를 나타내는 PIABS는 주백색 LED 처리구에서 6.51로 가장 높게 나타나 광계II의 반응중심이 상대적으로 건전한 상태임을 알 수 있었다. 그러나 이와 반대로 녹색 LED 처리구하에서는 PIABS가 0.87로 가장 낮게 나타나 반응중심의 일부가 불활성화 된 것으로 보이며 식물이 스트레스 상태에 놓여있음을 알 수 있었다.
형광 매개변수 Fv/Fm과 동일하게 최대 양자 수율을 나태는 ΦPo, 갇힌 엑시톤 (exciton)이 QA를 넘어 전자 전달 사슬 (electron transport chain)로 전자를 이동시킬 확률을 나타내는 Ψo, 전자 수송 (electron transport)의 양자 수율을 나타내는 ΦEo는 주백색 LED하에서 각각 0.819, 0.694, 0.569로 가장 높게 나타났다 (Fig. 5). 그러나 이와 달리 가장 낮은 수치를 기록하였던 녹색 LED하에서는 각각 0.665, 0.531, 0.354로 나타났다. 한편, 흡수된 광자가 소멸될 확률 (probability of photon dissipated)을 나타내는 ΦDo는 녹색 LED 처리구에서 0.333으로 가장 높게 나타났으며, 이와 반대로 주백색 LED하에서는 0.192로 가장 낮았던 것으로 나타나 위 결과들을 뒷받침하였다.
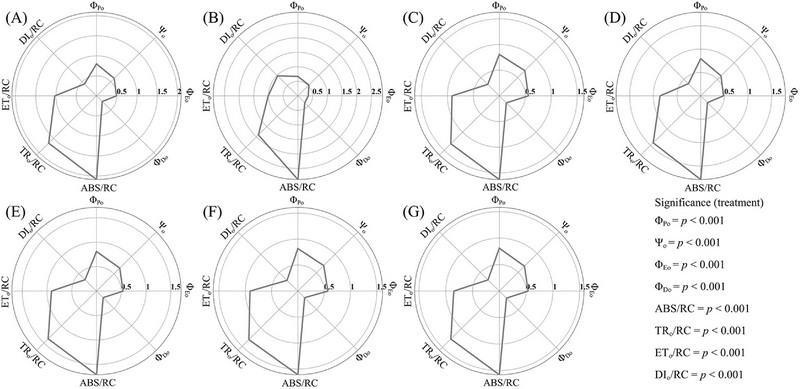
Quantum yields and specific energy fluxes per active photosystem II (PSII) reaction center (RC) of S. miltiorrhiza as influenced by different LED light qualities for ten weeks.Mean values are measured over fifteen repetitions (n = 15). (A) red LED light, (B) green LED light, (C) blue LED light, (D) purple phyto-LED light, (E) warm white LED light, (F) natural white LED light, and (G) cool white LED light. ΦPo; maximum quantum yield of primary photosystem II (PSII) photochemistry, Ψo; probability that a trapped exciton moves an electron into the electron transport chain beyond QA, ΦEo; quantum yield of electron transport, ΦDo; probability that an absorbed photon is dissipated, ABS/RC; absorption (ABS) flux per reaction center (RC), TRo/RC; trapped energy flux per RC, ETo/RC; electron transport flux from QA to QB per RC, DIo/RC; dissipated energy flux per RC.
주로 식물의 생리적 건전성을 분석하기 위해 사용하는 매개 변수인 Fv/Fm, ΦPo는 스트레스를 받지 않은 고등식물의 경우 0.780-0.840의 범위를 나타내는 것으로 알려져 있다 (Björkman and Demmig, 1987; Yoo et al., 2012; Asadi-Sanam et al., 2015; Joachimiak et al., 2022). 결과적으로 현저하게 낮은 최대 양자 수율을 나타내었던 녹색 LED 처리구를 제외한 나머지 처리구에서는 Fv/Fm, ΦPo가 0.795-0.819 범위로 나타나 정상 범주 내에 속한 것으로 평가되었다.
반응중심 (reaction center, RC)당 흡광량을 나타내는 ABS/RC, 반응중심당 포획된 에너지 (trapped energy)의 양을 나타내는 TRo/RC, 반응중심당 QA에서 QB로의 전자 전달량 (electron transport flux)을 나타내는 ETo/RC는 주광색 LED 처리구에서 각각 1.58, 1.28, 0.85로 모든 처리구 중 가장 낮았으나, 녹색 LED하에서는 이와 상반된 결과를 나타내었다. 한편, 반응중심당 소산되는 에너지의 양 (dissipated energy flux)을 나타내는 DIo/RC 또한 녹색 LED 처리구하에서는 0.976으로 가장 높게 나타났으나, 주백색과 주광색 LED하에서 각각 0.292, 0.299로 낮게 나타났다.
식물이 녹색이라는 점 때문에 통념상 녹색 파장이 식물의 생장에 큰 영향을 미치지 않는 것으로 알려져 왔으나 (Virtanen et al., 2022), 녹색 파장은 적색이나 청색 파장이 침투할 수 없는 엽조직 깊숙한 곳까지 침투할 수 있으며 잎의 광합성에 유리하게 작용할 수 있다고 제안되었다 (Liu and Van Iersel, 2021).
그러나 단삼을 재배할 때 녹색 LED를 단용으로 사용하는 경우 비생물적 스트레스로 작용하여 광계II의 반응중심의 일부를 비활성화 시키는 것으로 추정된다. 이와 같은 결과는 ΦDo, ABS/RC, DIo/RC와 같은 스트레스 지표가 적색, 청색, 백색 LED 처리구에 비해 녹색 LED하에서 상대적으로 높아지고 PIABS와 같이 식물의 생리적 건전성을 나타내는 지표는 낮아졌다는 이전 연구 결과와 유사하였다 (Lee, 2023; Shin et al., 2024a). 반면에 스펙트럼 내에서 적색과 청색 파장이 존재한다는 가정하에서는 녹색 파장의 부재가 단삼의 반응중심 활성도에 상대적으로 부정적인 영향을 미치는 것으로 보인다. 따라서 단삼을 재배할 때, 광합성 유효방사 내에서 특정 광파장의 부재나 편중 없이 적절한 분광분포의 형성이 중요함을 알 수 있었다.
결론적으로 단삼의 식물체 크기, 바이오매스, 외적품질, 광화학 반응을 기반으로 할 때, 단삼은 백색 LED에서 재배될 때 가장 우수한 생장과 광화학 반응의 건전성을 나타내었다. 그러나 유의해야할 점은 세부적인 관점에서 전구색, 주백색, 주광색에 따라 다양한 매개변수들의 결과에서 근소한 차이를 보였다. 한편, 녹색 LED를 단용으로 사용하였을 때 단삼의 생장과 광화학 반응에서 부정적인 결과를 나타내었으나, 복합 스펙트럼 내에서 녹색 파장의 유무는 원적외선 파장의 유무에 비해 상대적으로 중요한 위치에 있는 것으로 추정되며 이에 대한 후속연구가 필요할 것으로 판단된다.
Acknowledgments
본 연구는 2023년 삼육대학교 교내학술연구비 지원에 의해 수행된 결과로 이에 감사드립니다.
References
-
Adak MK. (2018). Analysis of chlorophyll fluorescence: A reliable technique in determination of stress on plants. In Sengar RS and Singh A. (eds.)., Eco-friendly agro-biological techniques for enhancing crop productivity. Springer Singapore. Gateway East, Singapore. p. 63-88.
[https://doi.org/10.1007/978-981-10-6934-5_4]

-
Asadi-Sanam S, Pirdashti H, Hashempour A, Zavareh M, Nematzadeh GA and Yaghoubian Y. (2015). The physiological and biochemical responses of eastern purple coneflower to freezing stress. Russian Journal of Plant Physiology. 62:515-523.
[https://doi.org/10.1134/S1021443715040056]

- Azalea Society of America(ASA). (2024). RHS Color fan 1. Azalea Society of America. Herndon, VA, USA. https://www.azaleas.org/rhs-color-fan-1/, (cited by 2024 June 21).
-
Björkman O and Demmig B. (1987). Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77 K among vascular plants of diverse origins. Planta. 170:489-504.
[https://doi.org/10.1007/BF00402983]

-
Chen GJ, Lee MS, Lin MK, Ko CY and Chang WT. (2018). Blue light decreases tanshinone IIA content in Salvia miltiorrhiza hairy roots via genes regulation. Journal of Photochemistry and Photobiology B: Biology. 183:164-171.
[https://doi.org/10.1016/j.jphotobiol.2018.04.013]

-
Chen W and Chen G. (2017). Danshen(Salvia miltiorrhiza Bunge): A prospective healing sage for cardiovascular diseases. Current Pharmaceutical Design. 23:5125-5135.
[https://doi.org/10.2174/1381612823666170822101112]

-
Chen X, Guo J, Bao J, Lu J and Wang Y. (2014). The anticancer properties of Salvia miltiorrhiza Bunge(Danshen): A systematic review. Medicinal Research Reviews. 34:768-794.
[https://doi.org/10.1002/med.21304]

-
Choi DS, Lee JH and Oh MM. (2024). Effects of supplemental UV-A LED radiation on growth and bioactive compounds in spinach. Journal of Bio-Environment Control. 33:45-54.
[https://doi.org/10.12791/KSBEC.2024.33.1.045]

-
Choi DS, Nguyen TKL and Oh MM. (2022). Growth and biochemical responses of kale to supplementary irradiation with different peak wavelengths of UV-A light-emitting diodes. Horticulture, Environment, and Biotechnology. 63:65-76.
[https://doi.org/10.1007/s13580-021-00377-4]

-
Choi HL, Seo JW, Hwang MH, Lee HI, Kim MJ and Yu CY. (2020). Growth characteristics and functional analysis of Salvia miltiorrhiza Bunge by artificial light sources. Korean Journal of Medicinal Crop Science. 28:200-208.
[https://doi.org/10.7783/KJMCS.2020.28.3.200]

-
Dickson A, Leaf AL and Hosner JF. (1960). Quality appraisal of white spruce and white pine seedling stock in nurseries. The Forestry Chronicle. 36:10-13.
[https://doi.org/10.5558/tfc36010-1]

-
Folta KM and Maruhnich SA. (2007). Green light: A signal to slow down or stop. Journal of Experimental Botany. 58:3099-3111.
[https://doi.org/10.1093/jxb/erm130]

-
Goto E. (2012). Plant production in a closed plant factory with artificial lighting. Acta Horticulturae. 956:37-49.
[https://doi.org/10.17660/ActaHortic.2012.956.2]

-
Guo Y, Li Y, Xue L, Severino RP, Gao S, Niu J, Qin LP, Zhang D and Brömme D. (2014). Salvia miltiorrhiza: an ancient Chinese herbal medicine as a source for anti-osteoporotic drugs. Journal of Ethnopharmacology. 155:1401-1416.
[https://doi.org/10.1016/j.jep.2014.07.058]

-
Han JW, Jeong JT, Lee, JH, Kang MJ, Lim JD, Lee WM and Ma KH. (2024). Cultivation and quality characterization of new variety Salvia miltiorrhiza “Hongdan” with high active ingredients. Korean Journal of Medicinal Crop Science. 32:80-89.
[https://doi.org/10.7783/KJMCS.2024.32.2.80]

-
Hwang HS, Jeong HW, Jeong JH, Jo DH and Hwang SJ. (2022). Changes in growth and anthocyanin content of Brassica juncea L. affected by light intensity and photoperiod in plant factory with artificial lighting. Horticultural Science and Technology. 40:586-594.
[https://doi.org/10.7235/HORT.20220053]

-
Jang IT, Lee JH, Shin EJ and Nam SY. (2023). Evaluation of growth, flowering, and chlorophyll fluorescence responses of Viola cornuta cv. Penny Red Wing according to spectral power distributions. Journal of People, Plants, and Environment. 26:335-349.
[https://doi.org/10.11628/ksppe.2023.26.4.335]

-
Jeong JT, Lee JH, Lee WM, An TJ, Lee YJ, Hur M, Ma K, Kim YG and Han JW. (2023). Cultivation and quality characterization of new variety Salvia miltiorrhiza ‘Dasan’. Korean Journal of Medicinal Crop Science. 31:371-376.
[https://doi.org/10.7783/KJMCS.2023.31.6.371]

-
Jiang Z, Gao W and Huang L. (2019). Tanshinones, critical pharmacological components in Salvia miltiorrhiza. Frontiers in Pharmacology. 10:439237. https://www.frontiersin.org/journals/pharmacology/articles/10.3389/fphar.2019.00202/full, (cited by 2024 June 24).
[https://doi.org/10.3389/fphar.2019.00202]

-
Joachimiak AJ, Libik-Konieczny M, Wójtowicz T, Sliwinska E and Grabowska-Joachimiak A. (2022). Physiological aspects of sex differences and Haldane’s rule in Rumex hastatulus. Scientific Reports. 12:11145. https://www.nature.com/articles/s41598-022-15219-1, (cited by 2024 June 28)
[https://doi.org/10.1038/s41598-022-15219-1]

-
Johkan M, Shoji K, Goto F, Hahida SN and Yoshihara T. (2012). Effect of green light wavelength and intensity on photomorphogenesis and photosynthesis in Lactuca sativa. Environmental and Experimental Botany. 75:128-133.
[https://doi.org/10.1016/j.envexpbot.2011.08.010]

-
Kim EA, Lee JH and Nam SY. (2024c). Experimental control of day and night temperatures to improve the growth and external quality of Salvia miltiorrhiza Bunge. Horticultural Science and Technology. 42:94-103.
[https://doi.org/10.7235/HORT.20240008]

-
Kim EA, Lee JH, Sunwoo Y, Shin EJ and Nam SY. (2024a). Improvement in growth, external quality, and physiological characteristics of Salvia miltiorrhiza Bunge through photoperiod control. Korean Journal of Medicinal Crop Science. 32:152-162.
[https://doi.org/10.7783/KJMCS.2024.32.3.152]

- Kim HJ, Lee JH, Lee JH, Ko MS and Nam SY. (2022). A study on indoor cultivation of Petrosedum rupestre and P. rupestre cv. Angelina using commercial white T5 LEDs. Journal of Agricultural, Life and Environmental Sciences. 34:354-367.
-
Kim HM, Kim YJ and Hwang SJ. (2016). Optimum wattage and installation height of nano-carbon fiber infrared heating lamp for heating energy saving in plug seedling production greenhouse in winter season. Journal of Bio-Environment Control. 25:302-307.
[https://doi.org/10.12791/KSBEC.2016.25.4.302]

-
Kim YJ, Yeom MS, Lee JY, Park SY and Oh MM. (2024b). Biomass and ginsenosides content of ginseng sprouts upon exposure to several white LED lights with different correlated color temperatures and color rendering indexes. Horticultural Science and Technology. 42:167-179.
[https://doi.org/10.7235/HORT.20240014]

-
Kuan-Hung LIN, Chun-Wei WU and Chang YS. (2019). Applying Dickson quality index, chlorophyll fluorescence, and leaf area index for assessing plant quality of Pentas lanceolata. Notulae Botanicae Horti Agrobotanici Cluj-Napoca. 47:169-176.
[https://doi.org/10.15835/nbha47111312]

-
Küpper H, Benedikty Z, Morina F, Andresen E, Mishra A and Trtílek M. (2019). Analysis of OJIP chlorophyll fluorescence kinetics and QA reoxidation kinetics by direct fast imaging. Plant Physiology. 179:369-381.
[https://doi.org/10.1104/pp.18.00953]

-
Kwon AR, Jang WS, Kim SI, Seong BJ and Guak S. (2023). Effect of soil water status on growth, photosynthesis, and antioxidant enzyme activity in Rehmannia glutinosa var. ‘Togang’. Korean Journal of Medicinal Crop Science. 31:235-246.
[https://doi.org/10.7783/KJMCS.2023.31.4.235]

-
Lee JH and Nam SY. (2023a). Vegetative propagation of six Pachyphytum species as influenced by different LED light qualities. Horticultural Science and Technology. 41:237-249.
[https://doi.org/10.7235/HORT.20230022]

-
Lee JH and Nam SY. (2023b). Influence of three types of LED light quality on the growth and leaf color of Sempervivum ‘Black Top’. Journal of Agriculture & Life Science. 57:39-47.
[https://doi.org/10.14397/jals.2023.57.2.39]

- Lee JH, Choi DH, Roh YH, Kwon YB, Afolabi AS, Choi IL, Kim Y, Shin JC, Kim M, Kim J, Wang LX and Kang HM. (2022a). Comparison of quality, yield and economic feasibility of cherry tomato(Solanum lycopersicum var. cerasiforme) fruit under quantum dot LED(QD-LED) and white-LED. Journal of Agricultural, Life and Environmental Sciences. 34:181-193.
-
Lee JH, Soh SY and Nam SY. (2022d). Growth evaluation of potted Delosperma cooperi(Hook. f.) L. bolus to shading levels, potting media, and fertilization rates. Flower Research Journal 30:1-9.
[https://doi.org/10.11623/frj.2022.30.1.01]

-
Lee JH, Soh SY, Kim HJ and Nam SY. (2022c). Effects of LED light quality on the growth and leaf color of Orostachys japonica and O. boehmeri. Journal of Bio-Environment Control. 31:104-113.
[https://doi.org/10.12791/KSBEC.2022.31.2.104]

-
Lee JH, Yoo HJ and Nam SY. (2022b). Chlorophyll fluorescence response of indoor foliage plants as affected by light intensity levels under high temperature and continuous lighting conditions. Journal of Agriculture & Life Science. 56:19-26.
[https://doi.org/10.14397/jals.2022.56.1.19]

- Lee JH. (2023). Effects of light quality, temperature, photoperiod, and GA3 concentration on growth of six Phedimus species. Ph. D. Thesis. Sahmyook University. p.21-49.
-
Li ZM, Xu SW and Liu PQ. (2018). Salvia miltiorrhiza Burge(Danshen): A golden herbal medicine in cardiovascular therapeutics. Acta Pharmacologica Sinica. 39:802-824.
[https://doi.org/10.1038/aps.2017.193]

-
Liu H, Niu M, Zhu S, Zhang F, Liu Q, Liu Y, Liu R and Zhang Y. (2020). Effect study of continuous monoculture on the quality of Salvia miltiorrhiza bge roots. BioMed Research International. 2020:4284385. https://www.hindawi.com/journals/bmri/2020/4284385/, (cited by 2024 June 26).
[https://doi.org/10.1155/2020/4284385]

-
Liu J and Van Iersel MW. (2021). Photosynthetic physiology of blue, green, and red light: light intensity effects and underlying mechanisms. Frontiers in Plant Science. 12:619987. https://www.frontiersin.org/journals/plant-science/articles/10.3389/fpls.2021.619987/full, (cited by 2024 June 30).
[https://doi.org/10.3389/fpls.2021.619987]

-
Liu K, Zhang JW, Liu XG, Wu QW, Li XS, Gao W, Wang HY, Li P and Yang H. (2018). Correlation between macroscopic characteristics and tissue-specific chemical profiling of the root of Salvia miltiorrhiza. Phytomedicine. 51:104-111.
[https://doi.org/10.1016/j.phymed.2018.10.011]

-
Liu Y, Huang Y, Zhao C, Qin X, Zhu Q, Chen S and Qu J. (2014). Salvia miltiorrhiza injection on pulmonary heart disease: A systematic review and meta-analysis. The American Journal of Chinese Medicine. 42:1315-1331.
[https://doi.org/10.1142/S0192415X14500827]

-
Ma S, Zhang D, Lou H, Sun L and Ji J. (2016). Evaluation of the anti-inflammatory activities of tanshinones isolated from Salvia miltiorrhiza var. alba roots in THP-1 macrophages. Journal of Ethnopharmacology. 188:193-199.
[https://doi.org/10.1016/j.jep.2016.05.018]

-
Moon K and Cha J. (2020). Enhancement of antioxidant and antibacterial activities of Salvia miltiorrhiza roots fermented with Aspergillus oryzae. Foods. 9:34. https://www.mdpi.com/2304-8158/9/1/34, (cited by 2024 June 26).
[https://doi.org/10.3390/foods9010034]

-
Park EW, Hwang JH, Hwang HS, Jeong HW, Hwang SY, Yu J and Hwang SJ. (2023b). Appropriate cold treatment periods and shading levels on Codonopsis lanceolata for plug seedling production in summer season. Journal of Bio-Environment Control, 32:157-164.
[https://doi.org/10.12791/KSBEC.2023.32.2.157]

-
Park SH, Lee JH and Nam SY. (2023a). An analysis of the growth and photosynthetic responses of potted Veronica pusanensis Y.N.Lee according to the shading levels. Journal of People, Plants, and Environment. 26:219-231.
[https://doi.org/10.11628/ksppe.2023.26.3.219]

- Photon Systems Instruments(PSI). (2024). FluorPen FP 110 PAR-FluorPen FP 110 Monitoring Pen MP 100. FluorPen & PAR FluorPen, Photon Systems Instruments. Drásov, Czech Republic. https://handheld.psi.cz/documents/FluorPen_Monitoring_Manual_02_2021.pdf, (cited by 2024 June 21).
- Roh YS and Yoo YK. (2023). Light quality of light emitting diodes affects growth, chlorophyll fluorescence and phytohormones of Tulip ‘Lasergame’. Horticulture, Environment, and Biotechnology. 64:245-255.
-
Rural Development Administration(RDA). (2018). Development of a new cultivar of Salvia miltiorrhiza, ‘Gosan’, a medicinal crop that helps blood circulation, Rural Development Administration. Wanju, Korea. http://www.rda.go.kr/board/board.do?mode=view&prgId=day_farmprmninfoEntry&dataNo=100000745564, (cited by 2024 June 24).
[https://doi.org/10.1007/s13580-022-00481-z]

- Seif M, Aliniaeifard S, Arab M, Mehrjerdi MZ, Shomali A, Fanourakis D, Li T and Woltering E. (2021). Monochromatic red light during plant growth decreases the size and improves the functionality of stomata in chrysanthemum. Functional Plant Biology. 48:515-528. https://www.publish.csiro.au/fp/fp20280, (cited by 2024 June 30).
-
Seo JW, Lee JG, Yoo JH, Lim JD, Kim MJ and Seong ES. (2022). Growth characteristics and biological activities in Astragalus membranaceus seedlings of exposed to different types of artificial light. Korean Journal of Medicinal Crop Science. 30:339-346.
[https://doi.org/10.1071/FP20280]

-
Shi M, Huang F, Deng C, Wang Y and Kai G. (2019). Bioactivities, biosynthesis and biotechnological production of phenolic acids in Salvia miltiorrhiza. Critical Reviews in Food Science and Nutrition. 59:953-964.
[https://doi.org/10.7783/KJMCS.2022.30.5.339]

-
Shin EJ, Lee JH and Nam SY. (2023a). Changes in growth, visual qualities, and photosynthetic parameters in Peperomia species and cultivars under different color temperatures of white lighting conditions. Journal of Agricultural Life and Environmental Sciences. 35:307-321.
[https://doi.org/10.1080/10408398.2018.1474170]

- Shin EJ, Lee JH and Nam SY. (2024a). Evaluation of growth, vegetation indices, and photosynthesis of Cichorium intybus L. seedlings as affected by LED light qualities in a closed nursery facility. Horticultural Science and Technology. 42:350-364.
-
Shin YC, Yeon JY, Joo SH, Moon YE and Kim WS. (2023b). Effect of light quality on petal coloring in potted miniature roses. Flower Research Journal. 31:173-181.
[https://doi.org/10.7235/HORT.20240029]

-
Shin YR, Ryu BR, Kang MJ, Kim MJ, Jeong JT, Han JW, Lee GW and Lim JD. (2024b). Pharmaceutical constituents contents and deviations in Korean and Chinese cultivars of Salvia miltiorrhiza root(Danshen) followed by crop years. Korean Journal of Medicinal Crop Science. 32:90-104.
[https://doi.org/10.11623/frj.2023.31.3.07]

-
Si C, Lin Y, Luo S, Yu Y, Liu R, Naz M and Dai Z. (2024). Effects of LED light quality combinations on growth and leaf colour of tissue culture-generated plantlets in Sedum rubrotinctum. Horticultural Science and Technology. 42:53-67.
[https://doi.org/10.7783/KJMCS.2024.32.2.90]

-
Singh D, Basu C, Meinhardt-Wollweber M and Roth B. (2015). LEDs for energy efficient greenhouse lighting. Renewable and Sustainable Energy Reviews. 49:139-147.
[https://doi.org/10.7235/HORT.20240005]

-
Smith HL, McAusland L and Murchie EH. (2017). Don’t ignore the green light: exploring diverse roles in plant processes. Journal of Experimental Botany. 68:2099-2110.
[https://doi.org/10.1016/j.rser.2015.04.117]

-
Stirbet A and Govindjee G. (2011). On the relation between the Kautsky effect(chlorophyll a fluorescence induction) and photosystem II: basics and applications of the OJIP fluorescence transient. Journal of Photochemistry and Photobiology B: Biology. 104:236-257.
[https://doi.org/10.1093/jxb/erx098]

-
Su CY, Ming QL, Rahman K, Han T and Qin LP. (2015). Salvia miltiorrhiza: Traditional medicinal uses, chemistry, and pharmacology. Chinese Journal of Natural Medicines. 13:163-182.
[https://doi.org/10.1016/j.jphotobiol.2010.12.010]

-
Su Y, Zhang J, Xu Z, Li J, Wang P, Song Z, Tian G, Li L, Song J and Wang J. (2021). Integrative analysis of metabolome and transcriptome reveals the mechanism of color formation in white root(Salvia miltiorrhiza). Industrial Crops and Products. 170:113784.
[https://doi.org/10.1016/S1875-5364(15)30002-9]

-
Vereshchagin M, Pashkovskiy P and Tarakanov I. (2024). Adding phyto-LED spectrum to white-LED light increases the productivity of lettuce plants. Horticulturae. 10:795. https://www.mdpi.com/2311-7524/10/8/795, (cited by 2024 July 31).
[https://doi.org/10.1016/j.indcrop.2021.113784]

-
Virtanen O, Constantinidou E and Tyystjärvi E. (2022). Chlorophyll does not reflect green light–how to correct a misconception. Journal of Biological Education. 56:552-559.
[https://doi.org/10.3390/horticulturae10080795]

-
Wang Y and Folta KM. (2013). Contributions of green light to plant growth and development. American Journal of Botany. 100:70-78.
[https://doi.org/10.1080/00219266.2020.1858930]

-
Wei WJ, Zhou PP, Lin CJ, Wang WF, Li Y and Gao K. (2017). Diterpenoids from Salvia miltiorrhiza and their immune-modulating activity. Journal of Agricultural and Food Chemistry. 65:5985-5993. https://pubs.acs.org/doi/full/10.1021/acs.jafc.7b02384?casa_token=fLAAOMOubKMAAAAA%3A8EVakievo2jverxuqoPUqbZtctsKyghE_UosApV6CJO1DFzXTYLEhPn6W9cJnfXJ6g07CJ_BtGVZ1Ul9, (cited by 2024 June 26).
[https://doi.org/10.3732/ajb.1200354]

- Yoo SY, Eom KC, Park SH and Kim TW. (2012). Possibility of drought stress indexing by chlorophyll fluorescence imaging technique in red pepper(Capsicum annuum L.). Korean Journal of Soil Science and Fertilizer. 45:676-682.
-
Zettl A. (2024). Converting Colors. Converting Colors website. Available via https://convertingcolors.com, (cited by 2024 June 21).
[https://doi.org/10.7745/KJSSF.2012.45.5.676]

- Zhang L, Dai SZ, Nie XD, Zhu L, Xing F and Wang LY. (2013). Effect of Salvia miltiorrhiza on retinopathy. Asian Pacific Journal of Tropical Medicine. 6:145-149.
-
Zhang S, Ma J, Zou H, Zhang L, Li S and Wang Y. (2020). The combination of blue and red LED light improves growth and phenolic acid contents in Salvia miltiorrhiza Bunge. Industrial Crops and Products. 158:112959.
[https://doi.org/10.1016/S1995-7645(13)60011-5]

-
Zhang Y, Li X and Wang Z. (2010). Antioxidant activities of leaf extract of Salvia miltiorrhiza Bunge and related phenolic constituents. Food and Chemical Toxicology. 48:2656-2662.
[https://doi.org/10.1016/j.indcrop.2020.112959]

-
Zhao GR, Xiang ZJ, Ye TX, Yuan YJ and Guo ZX. (2006). Antioxidant activities of Salvia miltiorrhiza and Panax notoginseng. Food Chemistry. 99:767-774.
[https://doi.org/10.1016/j.fct.2010.06.036]
