
새싹 율무의 유전 독성 평가
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
‘Johyun’ yulmoo which is a new variety of Coix lacryma-jobi var. mayuen Stapf sprout (CS), is the most widely known as medicinal crop for its effects against anti-inflammatory activity. Despite its medicinal activity, there has been no examination of its genotoxicity. Here, we investigated the genotoxicity of CS using Good Laboratory Practice.
An in vitro mammalian chromosomal aberration test, bacterial reverse mutation assay, and micronucleus test were conducted. 1. Chromosome aberration assay : Structural aberrations and aberrant metaphases were not detected at any concentrations of CS tested in this study. 2. Bacterial reverse mutation assay : CS did not induce mutagenicity or affect the number of revertant colonies at any of the tested doses for all five strains for the 50 ㎍/㎖ treated group, with or without metabolic activation with the microsomal enzyme mixture (S9 mixture). 3. Micronucleus test : The percentage of micronucleated polychromatic erythrocytes among the total polychromatic erythrocytes population compared to the percentage in the negative control group was not affected at any of the CS dosing groups tested.
CS did not induce any genotoxicity, as determined by the in vitro chromosome aberration test, bacterial mutation assay, and micronucleus test.
Keywords:
Coix lacryma-jobi L. var. mayuen Stapf, Sprout, Genotoxicity, Chromosome Aberration Test, Bacterial Reverse Mutation Assay, Micronucleus Test서 언
빠른 경제 성장, 국민 소득의 증가 및 의료 기술의 발달은 삶의 편리성을 가져왔지만 서구화된 식습관으로 인해 많은 변화가 일어나면서 각종 질환과 스트레스에 시달리게 되었다. 그로 인해 건강에 대한 인식과 관심이 높아지면서, 안전하고 건강한 먹거리를 추구하는 웰빙 (well-being) 문화 확산에 따라 친환경 농산물의 소비는 지속적으로 증가하고 있다.
한국농촌경제연구원 (KREI)에 따르면 국내 친환경 농산물 시장이 연평균 5.3% 성장세를 보이고 있으며, 그 규모는 ‘20 년 약 2조 2224억 원, ‘25년 2조 6286억 원에 달할 것으로 전망되고 있다. 하지만 안전성이 확보되지 않은 식품의 과잉 섭취는 독성 및 부작용을 가져올 수 있어 심각한 사회문제를 야기할 수 있기에 이에 대한 철저한 규제 및 관리가 요구되고 있다 (Kim et al., 2006).
새싹작물은 우리나라의 대다수 지역에서 재배되고 있으며, 높은 영양학적 가치, 단기간 재배 기간, 그리고 병충해에 피해를 받기 전에 수확할 수 있어 잔류농약에 대한 우려가 없는 이점을 가지고 있다 (Kim et al., 2015; Kim et al., 2019; Lee et al., 2019). 여기서 ’새싹‘은 단기간 동안 (싹이 튼 후 7 일 가량) 종자에서 발생하는 싹으로 생육단계 초기의 어린 배축을 식용 (食用)으로 하는 것을 말한다 (Nam et al., 2018). 또한, 새싹작물을 각종 질병의 예방을 위해 약초 (藥草)로 사용되기도 한다.
대표적인 새싹작물로는 비만 개선에 좋은 새싹브로콜리, 변비에 좋은 새싹배추, 고혈압을 낮추는 새싹순무, 혈관 질환에 사용되는 새싹메밀, 비타민이 풍부한 새싹 다채 및 피부에 좋은 새싹밀 등이 있다. 이러한 새싹작물에서의 다양한 기능성 보고는 새싹에 대한 이용 가능성을 증가시키고, 또한 다양한 작물로 확대될 것으로 예상된다 (Lee et al., 2021; Nguyen et al., 2022; Huda et al., 2023).
율무 (Coix lacryma-jobi L. var. mayuen Stapf)는 종자를 식용으로 사용하며 한방에서는 율무의 껍질을 제거한 씨를 의이인 (薏苡仁)이라고 하며 자양강장제, 진통, 소염제, 건위, 폐결핵 및 이뇨 시에 사용해 왔다 (Weng et al., 2022; Hidaka et al., 1992). 또한, 방약합편에 수재되어 있는 약재로 습비증을 낫게 하며 폐위, 손발 경련이 있을 때 쓰인다. 식품의약품 안전처 고시 “식품의 기준 및 규격”을 보면 식품원료의 곡류 (고유번호 : A가134500)에 속하며 사용 부위는 씨앗으로 되어 있다.
성미 (性味)는 무독 (無毒), 감담 (甘淡), 양 (凉)하며 곡물이지만 단백질이 16%나 높게 함유되어 있고, 주로 지질, 코익솔, 스테롤, 아미노산, 비타민 B1 (thiamine), 비타민 B2 (riboflavin) 및 코익세놀이드 (coixenolide) 등 지방산이 풍부하고 섬유질 함량이 높아 식품 및 의약품의 원료로도 사용된다 (Patel et al., 2017).
「동의보감 (東醫寶鑑)」에서는 근육통, 관절통, 방광결석 및 부종에 효과가 있다고 하였고,「본경 (本經)」에 의하면 뭉친 근육을 풀어주는 효능이 있다고 하였다 (Li et al., 2013; Kim, 2012). 또한, 식욕을 억제하는 효능으로 인해 현재 비만치료제로 널리 사용되며 혈당 강하 작용, 콜레스테롤 감소 효과가 있고 (Song et al., 2016; Lee et al., 2009) 종기나 사마귀 치료에, 대소변불통 (大小便不通), 창만 (脹滿), 중풍 (中風), 각기 (脚氣)에 큰 효험이 있는 것으로 밝혀져 있다.
최근 율무로부터 다양한 생리활성물질이 분리·동정되었는데, 항염증 작용의 benzoxazinones (Wang et al., 2012), 혈당 강 하 작용의 coixans (Otsuka et al., 1988), 그리고 항암 작용을 하는 α-monolinolein (Takahashi et al., 1986; Lee et al., 2008; Chung et al., 2011) 등이 보고되었다.
율무의 한 품종인 “조현 (Johyun)” 율무는 박피, 다수성인 “수원6호”와 조숙종이면서 기존 재배종에 비하여 단간인 ‘오카야마 재래종’을 교배한 계통을 모본으로, 조숙종이면서 다수 성인 ‘UCN300-25’를 부본으로 하여 육성한 품종이다 (Jang et al., 2005). 이러한 품종은 새싹율무를 활용한 신약개발 및 기능성 식품에 대한 연구가능성을 제시하며, 산업발전 전략에 참고가 될 수 있다.
따라서 본 실험에서는 “조현” 율무의 새싹을 식품으로 사용하기 위한 안전성 확인을 위해 “조현” 율무 새싹을 이용하여 현재 의약품 등의 독성시험기준 (식품의약품안전처고시, 제 2018-93호)에 명시되어 있는 CHO-K1 세포를 이용한 체외 염색체이상시험, 세균을 이용한 복귀돌연변이 시험 및 마우스 골수세포를 이용한 소핵시험을 통해 새싹율무의 유전 독성을 평가하였으며 유의한 결과를 얻었기에 보고하는 바이다.
재료 및 방법
1. 실험기관
본 실험은 대구가톨릭대학교 GLP센터 (Gyeongsan, Korea)에서 실험의 전 과정을 진행하였다. 동물실험윤리위원회 IACUC (Institutional Animal Care and Use Commitee: 제 IACUC-2019-030호)의 승인 하에 대구가톨릭대학교 GLP센터 표준작업지침서 및 동물보호법에 따라 표준작업지침서 및 동물보호법에 따라 실시하였다.
유전 독성 평가는 식품의약품안전처 (KFDA) 고시 의약품 등의 독성시험기준 (제2017-71호, 2017년 8월 30일) 및 OECD Guidelines for the Testing of Chemicals No.471 ‘Bacterial Reverse Mutation Test’ (Adopted: 21st July 1997) (Maron et al., 1983), No. 473. ‘In Vitro Mammalian Chromosomal Aberration Test’ (Adopted: 21st July 1997), No.474. ‘Mammalian Erythrocyte Micronucleus Test’ (29, July 2016)에 준하여 실시하였다.
2. 실험물질
본 연구의 실험물질인 새싹율무는 “조현” 율무 (UCN300-25) 품종에서 생산하였으며 종자소독 후 2 일 동안 침종, 상자 재배 25℃, 7 일 및 수확 후 58℃, 3 일 동안 건조시켜 건조 수율은 7%로 농촌진흥청에서 공급받았다.
건조된 새싹 율무를 분쇄기 (WF2211214, Waring Commercial, Torrington, CT, USA)로 분쇄한 후, 체에 걸러 파우더를 얻었다. 이 파우더를 160℃에서, 30 분 동안 건열멸균하여 멸균증류수에 현탁하고, 본 시험 직전 최고농도로 조제한 후, 용매대조물질로 단계 희석하여 사용하였다.
3. 새싹 율무의 CHO-K1 세포를 이용한 염색체 이상시험
실험을 위해 Chinese hamster ovary fibroblast (CHO-K1)를 한국세포주은행 (Seoul, Korea)에서 구입하여 사용하였다. 배양액으로 Minimum Essential Medium Eagle (Gibco, Life Technologies, Rockville, MD, USA)에 10% Fetal Bovine Serum (Gibco, Invitrogen, Carlsbad, CA, USA), 1% penicillin/streptomycin (Gibco, Invitrogen, Carlsbad, CA, USA)의 비율로 첨가하여 사용하였으며, 5%의 CO2가 공급되는 37℃ 인큐 베이터 조건에서 배양하여 3 일 – 4 일마다 계대배양하였다. 배가 시간 (doubling time)은 15 시간으로 배양플라스크 바닥의 면적에 70% - 80% 이상 생육하여 염색체 수 (mode)는 22 개로 설정하였다.
염색체이상시험에 있어서 농도결정시험을 확인하기 위해 세포 독성평가를 CHO-K1세포에서 수행하여 세포증식억제 처리 농도를 결정하였다. 시험 물질은 5000 μg/㎖를 최고농도로 설정하고 공비를 2로 하여 14 개의 농도단계 (0.06, 0.13, 0.25, 5, 10, 20, 40, 80, 160, 310, 630, 1250, 2500, 5000 μg/㎖)를 적용하여 시험 수행을 위한 최고농도를 결정하였다.
세포독성 지표인 상대 세포수 증가 (RICC, relative increase in cell counts)는 세포 생존수를 계수하였을 때, (55±5)% 이하에서 세포 독성 농도를 산출하였다. RICC55는 혈구계수기를 이용하여 배양용기 당 세포 생존수를 계측하여 세포수를 산출하였고, 용매 대조군의 세포수를 100%로 설정하고 세포 증식률을 산출하였다.
농도결정시험 결과 대사활성계 존재 6 시간 처리군 (+S9 mix)은 0.63 ㎎/㎖, 부재 6 시간 처리군 (-S9 mix)은 1.25 ㎎/㎖, 부재 22 시간 처리군 (-S9 mix)은 0.08 ㎎/㎖으로 RICC55 농도를 산출하였다.
그 결과에 따라 새싹 율무 농도를 대사활성계 존재 6 시간 처리군은 (0.04 ㎎/㎖, 0.16 ㎎/㎖, 0.63 ㎎/㎖)로, 대사활성계 부재 6 시간 처리군은 (0.08 ㎎/㎖, 0.31 ㎎/㎖, 1.25 ㎎/㎖)로, 대사활성계 부재 22 시간 처리군은 (0.005 ㎎/㎖, 0.02 ㎎/㎖, 0.08 ㎎/㎖)로 설정하여 본 실험을 수행하였다 (Table 1). 새싹 율무는 증류수에 현탁시켜 단계 희석하여 진행하였다.

Cytotoxicity data of Coix lacryma-jobi L. var. mayuen Stapf sprout extract for dose-determination on Chinese hamster ovary fibroblast.
음성대조군은 시료 대신 증류수를 사용하고, 양성대조군은 대사활성계의 존재 (+S9 mix)하에 cyclophophamide (CPA, Tocris Bioscience, Bristol, England)로 10 μg/㎖을 처리하고, 대사활성계의 비존재군 (-S9 mix)은 mitomycin C (MMC, Sigma-Aldrich, St.Louis, MO, USA)로 0.5 μg/㎖ (6 시간)와 0.15 μg/㎖ (22 시간)로 각각 처리하였다.
염색체이상시험에서 새싹 율무의 6 시간 처리군은 25T culture flask (SLP, Pocheon, Korea)에 2 × 105 개의 세포를 분주하여 세포배양액 5 ㎖에서 약 3 일간 배양하였다. 그 후, 시료 처리 전에 각 플라스크의 기존배양액을 제거하고 농도의 시험 물질 용액 0.5 ㎖ (+S9 mix) / 5 ㎖ (새싹 율무 0.25 ㎖, 배양액 4.25 ㎖)을 분주하였다. 대사활성계의 존재군 (+S9 mix)은 6 시간의 처리를 하였고, 대사활성계의 비존재군 (-S9 mix)은 0 ㎖ (S9 mix) / 5 ㎖만 첨가하였다. 6 시간 후 phosphate buffered saline (PBS)로 세포 표면을 1 회 세척한 후 새로운 배지 5 ㎖ 첨가하여 16 시간 추가 배양하였다.
새싹 율무 22 시간 처리군은 25T culture flask용기에 2 × 105 개의 세포를 분주하여 세포배양액 5 ㎖에서 약 3 일간 배 양하였다. 그 후, 각 플라스크의 기존배양액을 제거하여 농도의 시험 물질 용액 0.5 ㎖ (S9 mix) / 5 ㎖ (새싹 율무 0.25 ㎖, 배양액 4.25 ㎖)을 첨가하여 22 시간 동안 배양하였다.
모든 plate 샘플에서 시험 물질 처리 약 22 시간 후에 colcemid를 100 ㎕ (0.2 ㎍/㎖) 씩 처리한 다음 2 시간 경과 후 세포를 수거하였다. 150 × g으로 5분간 원심분리하여 상등액을 제거하고 37℃, 75 mM KCl 저장액을 첨가하여 15 분 간 incubation하였다.
Carnoy’s 고정액 (acetic acid : methanol = 1 : 3)을 세포에 처리하여 고정시켜 염색체 표본을 제작하고 3% Giemsa (Merck, Darmstadt, Germany) 액으로 약 15 분간 염색한 후 염색체 이상을 계수하였다.
농도당 300 개의 분열중기세포를 코드화한 표본을 이용한 BLIND 방법으로 관찰하였으며, 일본환경돌연변이학회 (Japanese Environmental Mutagen and Genome Society, JEMS) 포유동물시험분과회판 “염색체이상 아틀라스 (JEMS-MMS, 1988)”에 따라 염색체 이상의 계수 및 형태 판별을 분류하였다.
염색체의 이상은 구조적 이상 [염색체형의 절단 (chromosome break, csb) 및 교환 (chromosome exchange, cse)과 염색분체형의 절단 (chromatid break, ctb) 및 교환 (chromatid exchange, cte)]과 수적 이상으로 구분하여 계수하였다. 염색체 구조적 이상에 있어서 염색체형의 절단은 동원체를 갖지 않는 염색체가 있기 때문에 이상중기상 (aberrant metaphases)의 염색체 이상의 수 (total aberration) 및 빈도는 gap의 빈도만 기록하고 양성판정에는 포함시키지 않았다.
이상중기상 (aberrant metaphases)의 빈도에 대한 통계처리는 OECD Guidelines, Testing of Chemicals No. 473을 참조하여 gap을 제외한 숫자만을 대상으로 실시하였다 (OECD, 2014).
각각의 중기상 (metaphase)을 1 개 이상의 이상을 포함한 것 (aberrant metaphases)과 염색체 이상이 없는 것 (normal metaphase)으로 나누고, 이상중기상의 빈도에 대해 통계처리를 실시하였다. 또한 수정이상에 대해서는 각 중기상을 핵내 배화 (ER, endoreduplication) 및 배수체 (PP, polyploidy)를 계수하여 그 빈도에 대하여 이상중기상과 동일한 방법으로 통계 처리하였다.
실험데이터의 통계분석은 SPSS version 19.0k (SPSS Inc., Chicago, IL, USA)를 이용하였고 유의수준은 0.01에서 Chisquare test 및 Fisher’s exact test를 실시하였다. 유의성이 있는 경우 Cochran-Armitage trend test를 통해 염색체 이상의 발생 빈도에 대한 용량의존성을 확인하였다.
4. 새싹 율무의 미생물 복귀돌연변이 시험
시험에 사용된 균주는 변이원성시험에 가장 일반적으로 사용되며, 변이원성물질에 대한 감수성이 높고, OECD guideline에서 추천되고 있는 균주를 사용하였다. Salmonella typhimurium의 히스티딘 요구성 균주로 TA98, TA100, TA1535, TA1537과 Escherichia coli의 트립토판 요구성 균주 WP2uvrA 총 5 개의 균주를 형질 확인 후 계대 배양한 것을 사용하였다.
전 배양 시간은 10 시간으로, 시험균주들은 각각 15 ㎖의 액체배지 (Nutrient broth No. 2, OxidTM, Basingstoke, England)에 접종하여 shaking incubator (VS-8480 SF, Vision Scientific Co., Ltd., Daejeon, Korea) 선회수 180 회/분의 조건으로 진탕배양하였다.
최소배지는 Top agar (BD Difco, Franklin Lakes, NJ, USA)와 Vogel-Bonner E 최소배지 (× 50, Vogel and Bonner, 1956) 및 40% glucose를 함유한 것을 사용하였다. 이들 균주는 균주 현탁액 10 ㎖과 dimethyl sulfoxide (DMSO) 0.875 ㎖ (Sigma-Aldrich, St. Louis, MO, USA)을 혼합하여 0.5 ㎖씩을 분주하여 보관하였다.
TA98, TA100, TA1535, TA1537 균주의 경우 Bacto agar 배지에 0.5 mM histidine/biotin을 첨가하여 사용하였으며, WP2ubrA균주의 경우 0.5 mM tryptophan을 첨가하였다. 미 생물 대사 활성 효소인 S9 mix는 기존의 시험법을 토대로 제 조하였고 미생물 복귀돌연변이를 유도하는 각 균주에 대한 변 이원성 양성대조물질은 2-(2-furyl)-3-(5-nitro-2-furyl)acrylamide (Wako Pure Chemical Industries, Ltd, Osaka, Japan), 2-aminoanthracene (Sigma-Aldrich, St. Louis, MO, USA), 9-aminoacridine (Sigma-Aldrich, St. Louis, MO, USA), benzo (a)pyrene (Sigma-Aldrich, St. Louis, MO, USA), sodium azide (Sigma-Aldrich, St. Louis, MO, USA)을 사용하였고 음 성대조군에는 증류수를 처리하였다.
대사활성계 S9 (MOLTOXTM, Boone, NC, USA)를 멸균 증류수 (JW Pharmaceutical, Gwacheon, Korea) 2.1 ㎖를 첨 가하여 해동 한 후, cofactor mix 4.9 ㎖을 섞어 30% S9 Mix를 제조하였으며 cofactor mix의 조성은 20 mM HEPES (pH 7.2), 50 mM MgCl2, 330 mM KCl, 50 mM G-6-9·Na, 40 mM NADPP·Na, distilled water이었다.
조제한 S9 Mix는 얼음에 채워 사용하였고, 균주를 nutrient broth에 배양하여 대수기 (1 × 109 cells/㎖) 상태에 도달하도록 한 다음 Top agar 2 ㎖에 균현탁액 0.1 ㎖, 시험 물질 0.05 ㎖, 대사활성계 적용 시 S9 mix 0.5 ㎖를 넣고 대사활성계 미적용 (-S9 mix) 시 PBS (pH 7.4) 0.5 ㎖를 low glucose agar 배지에 부어 굳힌 후에 37℃에서 48 시간 동안 배양하여 복귀돌연변이 집락을 계수하였다.
OECD guideline (TG471)에 근거하여 5,000 ㎍/㎖을 최고 농도로 공비 3을 적용하여 5단계 농도군 (61.7, 185, 556, 1670, 5000 ㎍/plate)으로 농도결정시험을 실시하였으며, 동일한 조건으로 대사활성계 적용 및 미적용 모두 5,000 ㎍/㎖를 최고농도로 설정하였다. 양성대조물질은 각 시험균주의 특성에 맞추어 dimethyl sulfoxide에 용해하여 아래의 농도로 처치하였다.
시험의 실시는 preincubation법으로써 대사활성화계의 존재와 부재 조건을 병행하여 실시하였다. 90 ㎜ 직경의 plate에 생성된 colony를 콜로니카운터 (Colony counter model 570, Suntex, New Taipei City, Taiwan)을 사용하여 계수하였다. 생육저해유무의 확인은 모든 plate를 육안 관찰하여 확인하였으며, 단계희석법에서 생균수 측정하여 균 농도를 측정하였다.
미생물 복귀돌연변이 시험에서는 통계학적 방법은 적용하지 않았다. 용매 대조군의 평균값에 대한 비율인 ‘fold–increase’는 용매 대조군의 평균값과 새싹 율무 처리군의 평균값을 비 교하기 위하여 계산하였다.
5. 새싹 율무의 마우스 조혈세포를 이용한 체내 소핵시험
소핵시험에 널리 사용되고 있는 7주령의 수컷 ICR 계통 마 우스 29 수 (선별 후 25 마리 사용)를 ㈜코아텍 (Pyeongtaek, Korea)에서 구입 후, 특정병원균 부재 (SPF) 실험동물실 사육실에서 1 주일간 적응시켜 시험에 사용하였다. 동물사육실의 환경은 온도 22 ± 3℃, 상대습도 55 ± 15%, 조명 12 시간 (오전 8 시 - 오후 8 시), 소음 60 ㏈ 이하, 조도 150 lux - 300 lux, 암모니아 농도 20 ppm 이하의 조건으로 유지하였다.
실험동물은 마우스용 polysulfone cage (260W × 420L × 150H ㎜)에 5 마리씩 넣어 사육하였고, 사료는 방사선으로 멸균된 고형사료 Teklad Certified Irradiated Global 18% Protein Rodent Diet (ENVIGO, Denver, PA, USA)를, 음수는 자외선 소독된 음용 수도수를 자유 섭취시켰다.
본 시험의 최고농도는 용량설정시험 결과를 토대로 2000 ㎎/㎏·bw/day로 설정하여 용매 대조군 1 군, 투여군 3 군 (500, 1000, 2000 ㎎/㎏/day), 양성대조군 1 군 (mitomycin C, 2.0 ㎎/㎏/day)으로 총 5 군을 구성하였으며, 각 군당 수컷 마우스 5 마리의 동물로 구성하였고 투여액량은 20 ㎖/㎏로 1 일, 1 회, 2 일간 경구투여용 금속제 존데를 이용하여 강제 경구 투여하였다.
시험 물질 마지막 투여로부터 약 22 시간 후에 경추탈골하여 마우스를 희생시켰고, 마우스 대퇴골의 골수세포를 FBS로 세척하여 세포현탁액을 얻었다. 세포 현탁액을 원심분리기 1,000 rpm에서 5 분간 원심분리 후 상층액을 버리고, 침전된 골수세포는 소량의 FBS로 잘 부유시켜 slide glass에 도말하여 골수도말검체를 제작하였다. 골수도말검체는 acridine orange (40 ㎍/㎖)로 염색한 후 골수세포증식과 다염성 적혈구 (polychromatic erythrocyte, PCE)에 생성된 소핵을 관찰하였다.
표본 관찰은 맹검법 (blind method)에 의해 실시하였고 골 수세포증식 및 다염성 적혈구의 소핵은 각각 광학현미경 및 FITC filter가 장착된 형광현미경 (Axio Imager A1, Carl Zeiss, Oberkochen, Germany)으로 관찰하였다. 소핵 빈도를 관찰하기 위하여 군당 500개의 전체 적혈구와 4,000 개의 다염성 적혈구를 관찰 및 이중 소핵 다염성 적혈구 (PCE with one or more micronuclei, MNPCE)의 출연 빈도를 측정하였다. 계수 시, 크기는 최대 적혈구 직경의 1/2 크기의 것에서 작게는 식별 가능한 것까지 하였으며 주변 유핵세포의 핵과 동일한 염색성을 나타내는 원형, 반원형 및 기타 도너츠형의 소체를 소핵으로 계수하였으며, 소핵과 이물질을 구별하였다. 계수가 끝난 후 다염성 적혈구 (PCE) 중의 소핵 출현 빈도 (MNPCE)와 전체 적혈구 중의 다염성 적혈구의 비율, PCE/(PCE+MNPCE)을 구하였다.
결과 판정은 소핵을 가진 다염성 적혈구 수가 용량 의존적으로 증가하는 경우, 하나 이상의 농도에서 양성 반응을 나타낼 경우 및 소핵을 가진 다염성 적혈구의 수가 용매 대조군의 historical data의 범위를 벗어나는 경우 양성으로 판정하였다.
통계처리 및 판정에 있어, 소핵 유발빈도, 소핵 출현 빈도 및 전체 적혈구 당 다염성 적혈구 비율, PCE/(PCE+MNPCE)에 대한 유의성 검정은 5%의 유의수준에서 one-way ANOVA test를 실시하였다. SPSS 19.0K (IBM Corp., Armonk, NY, USA) 통계프로그램을 이용하였으며 통계처리 후 5% 수준에서 유의성을 판정하였다 (p < 0.05).
결 과
1. 새싹 율무의 염색체 이상 시험
새싹 율무의 염색체이상 유발성 유무를 확인하기 위하여 난 소유아세포 (CHO-K1)를 이용하여 대사활성계의 부재 (-S9 mix)와 존재 (+S9 mix)하에서 농도결정시험 결과를 바탕으로 관련 시험법에 따라 55±5%의 세포독성이 나타나며 중기염색체 관찰이 가능한 농도를 최고 농도로 하여, 세포독성이 나타나는 중간 농도와 세포독성이 없는 농도를 본시험 농도로 설정하였다.
농도결정시험 결과, 대사활성계 존재 6 시간 처리군 (+S9 mix)은 0.63 ㎎/㎖, 부재 6 시간 처리군 (-S9 mix)은 1.25 ㎎/㎖, 부재 22 시간 처리군 (-S9 mix)은 0.08 ㎎/㎖의 농도에서 55±5%의 세포증식억제율이 나타났으며, 중기염색체의 관찰도 가능하였다. 이 농도를 최고농도로 하고 공비 4의 3 단계로 본시험의 농도를 다음과 같이 설정하였다 (Table 1).
대사활성계 존재 (+S9 mix, 6시간 처리군) : 0.04, 0.16, 0.63 ㎎/㎖
대사활성계 부재 (-S9 mix, 6시간 처리군) : 0.08, 0.31, 1.25 ㎎/㎖
대사활성계 부재 (-S9 mix, 22시간 처리군) : 0.005, 0.02, 0.08 ㎎/㎖
염색체이상시험 결과, 대사활성계 존재 (+S9 mix) 6 시간 처리군에서의 0, 0.04, 0.16, 0.63 ㎎/㎖ 농도에서 각각 0.0, 0.0, 0.3%로 관찰되었으며, 수적이상세포의 출현빈도는 각각 0.7, 0.7, 0.7%로 관찰되었고 (Table 2 and Fig. 1), 대사활성계 부재 (-S9 mix) 6 시간 처리군에서의 0.06, 0.31, 1.25 ㎎/㎖ 농도에서 각각 0, 0.3, 0.3%로 관찰되었으며, 수적이상 세포의 출현빈도는 각각 1.3, 1.3, 1%로 관찰되었다 (Table 3 and Fig. 2). 또한, 대사활성계 부재 (+S9 mix) 22 시간 처리 군에서의 0.005, 0.02, 0.08 ㎎/㎖ 농도에서는 각각 0.0, 0.0, 0.3%로 관찰되었으며 (Table 4 and Fig. 3), 수적이상세포의 출현빈도는 각각 0.7, 1.0, 1.0%로 관찰되었다.
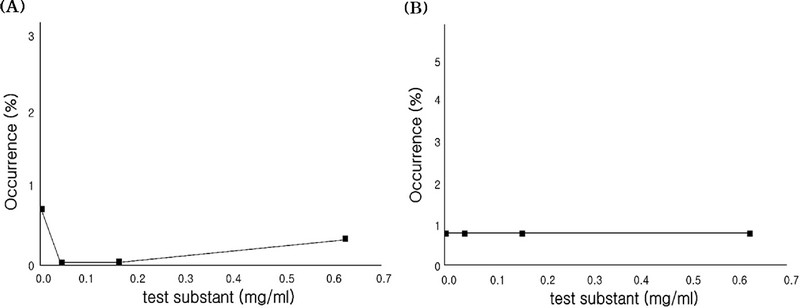
Frequency of aberrant metaphases for Coix lacryma-jobi L. var. mayuen Stapf sprout at 6 hrs treatment with S9 mix.(A); numerically aberrant metaphases (B); structurally aberrant metaphases.
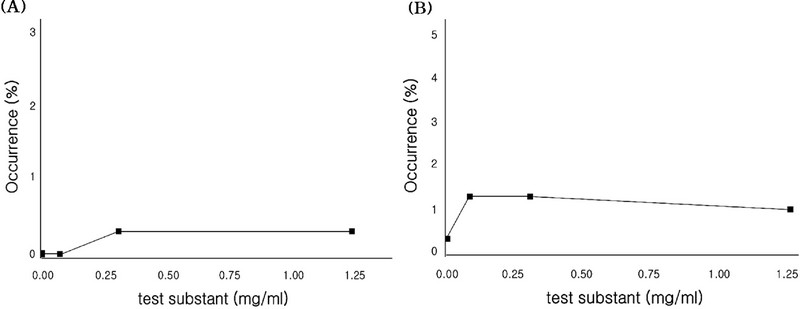
Frequency of aberrant metaphases for Coix lacryma-jobi L. var. mayuen Stapf sprout at 6 hrs treatment without S9 mix.(A); numerically aberrant metaphases (B); structurally aberrant metaphses.
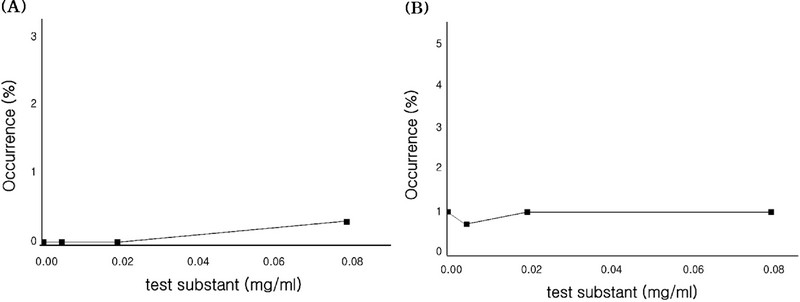
Frequency of aberrant metaphases for Coix lacryma-jobi L. var. mayuen Stapf sprout at 22 hrs treatment without S9 mix.(A); numerically aberrant metaphases (B); structurally aberrant metaphases.
따라서 대사활성계 존재 (+S9 mix) 6 시간 처리군에서 염색체의 구조적 및 수적 이상 빈도가 용매 대조군과 비교하여 유의한 차이가 확인되지 않았고, 대사활성계 부재 (+S9 mix) 6 시간 처리군에서도 3 단계 농도에서 염색체의 구조적 및 수적 이상 빈도가 용매 대조군과 비교하였을 시 유의한 차이가 확인되지 않았다. 그리고 대사활성계 부재 (-S9 mix) 22 시간 처리군의 경우 3 단계 농도에서 염색체의 구조적 및 수적 이상 빈도가 용매 대조군과 비교하여 유의한 차이가 확인되지 않았다.
본 시험에 있어서 양성대조물질에 의한 구조적 염색체이상 발생빈도가 모든 처리군에서 용매 대조군과 비교하여 유의하게 높은 것으로 (p < 0.01) 관찰되었으며, 음성 (용매) 대조값 및 양성 대조값은 시험시설의 적정범위 내였으므로 본 시험의 조건이 적절한 것으로 확인되었다. 이상의 결과에 따라 본 시험 조건 하에서 시험 물질인 새싹 율무는 CHO-K1 세포에 구조적 및 수적 염색체 이상을 유발하지 않는 것으로 판단되었다.
2. 새싹 율무의 세균을 이용한 복귀돌연변이시험 평가
새싹 율무의 발암성 유발 유·무 판단을 위한 자료를 얻기 위하여 박테리아에 대한 복귀돌연변이시험을 실시하였으며, 시험에는 히스티딘 요구성 균주인 Salmonella typhimurium TA98, TA100, TA1535, TA1547과 트립토판 요구성 균주인 Escherichia coli WP2 uvrA를 포함한 총 5 균주를 이용하여 복귀돌연변이시험을 실시하였다.
용매 대조군 및 시험 물질 첨가 5 단계의 농도 0, 61.7, 185, 556, 1670, 그리고 5000 ㎍/plate로 농도결정시험을 실시하였다. 그 결과, 대사활성계 존재 유무와 관계없이 모든 균주에서 복귀돌연변이 집락수의 증가가 관찰되지 않았다. 또한, 50% 이상의 복귀돌연변이 집락수 감소와 background lawn이 엷어지는 명백한 세포독성 또한 모든 plate에서 나타나지 않았다.
시험 물질을 Top agar에 첨가하였을 때 대사활성계 존재 유무와 관계없이 시험 물질의 침전 및 결정이 1670, 5000 ㎍/plate의 농도에서 관찰되었으며 plate 중충 후에도 시험 물질의 침전 및 결정이 관찰되었으나, 콜로니 계수에는 영향을 미치지 않았다. 따라서 본 시험의 농도는 해당 시험법에 따라 대사활성계 적용 유무와 상관없이 5000 ㎍/plate의 농도를 최고 농도로 설정하고 0, 61.7, 185, 556, 1670, 5000 ㎍/plate (TA98, TA100, TA1535, TA1537, WP2 uvrA)의 농도로 실시하였다 (Table 5).

Range-finding study of Coix lacryma-jobi L. var. mayuen Stapf sprout with and without metabolic activation.
본 시험 결과, 대사활성계 적용 유무와 상관없이 용매 대조군과 비교 시, 5 개의 모든 균주 및 모든 농도에서 복귀돌연변이 집락수 및 용량 의존성에 따른 증가가 나타나지 않음을 확인하였다. 또한, 농도결정시험과 본 시험의 양성 대조군 및 용매 대조군의 콜로니 수는 시험시설의 적정범위 내로 확인되었다. 또한, 각 균별 양성대조군의 콜로니빈도가 음성대조군보다 약 2 배 – 36 배 높은 것으로 확인되어 시험이 적합하게 수행되었음을 확인하였다 (Table 6).
이상의 결과에 따라 본 시험 조건 하에서 시험 물질인 새싹 율무는 상기의 5 개 균주에 대하여 복귀돌연변이를 유발하지 않는 것으로 판단되었다.
3. 새싹 율무의 소핵실험 평가
투여에 의한 군간 체중을 관찰한 결과 용매 대조군에서 34.4 ± 1.65 g, 500 ㎎/㎖ 투여군에서는 33.8 ± 1.47 g, 1000 ㎎/㎖ 투여군에서는 32.9 ± 1.11 g, 2000 ㎎/㎖ 투여군에서는 34.7 ± 1.76 g, 양성 대조군에서 34.2 ± 0.72 g으로 유의한 차이가 없었다 (Table 7 and Table 8).
동물 개체별로 500개의 전체 적혈구 중 다염성 적혈구 (MNPCE / 4,000 PCE)의 평균 비율에 있어서 모든 투여군의 평균 비율이 용매 투여군과 비교하여 유의성은 없었다. 또한 전체 적혈구 4000 개 중 다염성 적혈구의 비율 비교에 있어서 시험 물질 투여군과 용매 대조군간 평균 차이의 유의성이 없었다. 또한 동물 개체별로 4000 개의 다염성적혈구에서 관찰한 소핵 출현 적혈구의 평균 빈도는 0.11 ± 0.034 g, 500 ㎎/㎖ 투여군에서는 0.11 ± 0.041 g, 1000 ㎎/㎖ 투여군에서는 0.09 ± 0.038 g, 2000 ㎎/㎖ 투여군에서는 0.08 ± 0.011 g, 양성 대조군에서 0.08 ± 0.011 g로 관찰되었다.
통계 결과, 소핵 출현 적혈구의 평균 빈도는 용매 대조군과 비교하여 유의성이 없었다. 또한, 시험 물질 투여군들에 있어서 시험 물질에 의한 용량의존성 반응이 없었다. 또한, 양성 대조군은 용매 대조군의 다염성 적혈구에서 관찰한 소핵 출현 적혈구의 평균 빈도보다 유의하게 높은 것으로 관찰되어 (p < 0.05) 시험 물질의 소핵 출현 빈도 확인을 위한 시험 조건이 적절한 것으로 확인되었다. 이상의 결과에 따라 본 시험 조건 하에서 시험 물질인 새싹 율무는 설치류 조혈세포에 대하여 소핵을 유발하지 않는 것으로 판단되었다.
고 찰
새싹 율무의 약리학적 우수성으로 영약적 가치를 증대시키는 시도가 이루어지고 있음에도 불구하고, 새싹 율무에 대한 안전성 연구 데이터는 전무한 실정이다.
동의보감에 수재되어 있는 약재로 최근 새싹 율무의 식물화 학적 성분 및 항산화 활성을 통해 여러 효능이 증명된 바 있으며 새싹 율무 원방의 안전성이 밝혀진 바 있다. 따라서, 본 시험에서 유전독성연구는 OECD와 KFDA 지침에 따라 복귀돌연변이시험, 염색체이상시험 및 마우스 골수세포를 이용한 소핵시험을 통하여 새싹 율무의 안전성을 확보하고자 하였다.
염색체이상시험에서 CHO-K1 세포주를 이용하였으며, 본 시험의 용량 설정을 위한 예비실험 결과 RICC55 농도가 대사활성계 존재하에서는 세균을 이용한 복귀돌연변이시험은 새싹 율무 처리군에서 S9 mix 존재 유무에 상관없이 복귀돌연변이 콜로니 수는 음성 대조군과 비교하였을 때, 증가 양상을 나타내지 않은 반면에 양성 대조물질에서 유발된 복귀돌연변이 콜로니 수는 대사활성계 미적용 (S9-) 및 적용 (S9+)의 모든 시험 균주에 대하여 음성 (용매) 대조 값이 증가하는 것으로 나타났다.
염색체 이상 시험에서 새싹 율무 처리군은 세포주의 처리시간 및 S9 mix 처리 유무에 상관없이 5% 미만 비정상적인 염색체이상을 나타내었지만, 음성 대조군에 비해 유의적인 변화는 없었다. 소핵시험은 새싹 율무 처리군에서 음성 대조군과 비교 시에 소핵을 가진 다염성 적혈구의 증가를 관찰할 수 없었으며 통계학적 유의성도 나타나지 않았다.
본시험 결과, 대사활성계존재 6 시간 처리군, 대사활성계 부재 6 시간 처리군 및 대사활성계 부재 22 시간 처리군 등 모두에서 염색체의 수적 및 구조적 이상 빈도가 용매 대조군과 비교하여 유의한 차이가 확인되지 않았다. 이상의 결과에 따라 시험 물질인 새싹 율무는 수적 및 구조적 염색체이상을 유발하지 않는 것으로 사료된다.
본 시험 물질인 새싹 율무의 미생물 복귀돌연변이 시험을 확 인하기 위해 히스티딘 요구성 균주인 Salmonella typhimurium TA98, TA100, TA1535, TA1537과 트립토판 요구성 균주 Escherichia coli WP2uvrA 총 5 개의 균주를 이용하여 복귀돌연변이시험을 실시하였다. 용매 대조군 및 시험 물질 첨가 5 단계의 농도 0, 61.7, 185, 556, 1670, 그리고 5000 ㎍/plate로 농도결정시험을 실시한 결과, 모든 농도에서 명백한 세포독성은 관찰되지 않았다. 따라서 본 시험은 대사활성계 미적용 및 적용 (0, 61.7, 185, 556, 1670, 그리고 5000 ㎍/plate로 TA98, TA100, TA1535, TA1537 그리고 WP2uvrA 균주를 가지고 실시하였으며, 그 결과, 대사활성계 적용 유무와 관계 없이 모든 균주의 모든 농도에서 콜로니 생성 수치의 재현성 있는 증가가 나타나지 않았으며, 용량의존성도 확인되지 않았다. 농도결정시험과 본 시험의 결과 값으로 시험의 재현성이 확인되었다. 농도결정시험과 본 시험의 용매 대조군 및 양성 대조군의 콜로니 수는 시험시설의 적정범위 내로 확인되었으며, 각 균별 양성 대조군의 콜로니 빈도가 음성 대조군보다 약 2 ∼ 36배 높은 것으로 확인되어 시험이 적합하게 수행되었음을 확인하였다. 이상의 결과에 따라 시험 물질인 새싹 율무는 상기 5개 균주에 대하여 복귀돌연변이를 유발하지 않는 것으로 사료된다.
유전독성을 평가하기 위하여 ICR 마우스 8 주령의 조혈세포를 이용한 체내 소핵시험을 실시하였으며, 예비시험 결과, 모든 시험 물질 투여군에서 사망동물 및 일반증상의 이상증상 이 관찰되지 않았다. 투여에 의한 군간 체중 및 동물개체별로 500 개의 전체 적혈구 중 다염성 적혈구의 평균비율을 관찰한 결과, 용매 대조군과 비교하여 유의한 차이는 없었다. 예비시험의 결과를 기초로 2000 ㎎/kg를 최고 투여농도로 하여 본 시험을 실시하였다. 시험 물질의 흡수 후, 48 시간까지의 소핵 출현 빈도를 관찰하기 위하여 시험 물질을 2 일간 투여하였다. 본시험 결과, 시험 물질 투여군(500 ㎎/㎏, 1000 ㎎/㎏, 2000 ㎎/㎏)에서 전체 적혈구 중 다염성 적혈구의 수는 용매 대조군과 비교하여 뚜렷한 골수세포의 증식억제는 나타나지 않았으며, 시험 물질 투여군들에 있어서 시험 물질에 의한 용량의 존성 반응이 없었다. 개체 당 약 4,000 개의 다염성 적혈구에서 관찰한 소핵유발빈도 역시 용매 대조군과 비교하여 통계적으로 유의한 결과를 보이지 않았으며 시험 물질 투여군들에 있어서 시험 물질에 의한 용량의존성 반응이 없었다. 한편 양성 대조군은 소핵유발빈도에서 용매 대조군에 비해 통계적으로 유의하며 현저한 증가를 보였다. 시험 물질 투여 후 모든 투여군에서 용매 대조군과 비교하여 통계적으로 유의한 차이는 없었지만 다염성 적혈구에서 관찰한 소핵 출현 적혈구의 평균 빈도는 유의하게 (p < 0.05) 높아 시험 물질의 소핵 출현 빈도 확인을 위한 시험조건이 적절한 것으로 판단되었다. 이상의 결과를 종합하여 볼 때, 시험 물질인 새싹 율무는 설치류 조혈세포에 대하여 소핵형성에 영향을 주지 않는 것으로 사료된다. 소핵시험은 새싹 율무 처리군에서 음성 대조군과 비교 시에 소핵을 가진 다염성 적혈구의 증가를 관찰할 수 없었으며 통계학적 유의성도 나타나지 않았다.
상기의 결과를 종합하면 새싹 율무는 염색체이상시험, 미생물 복귀돌연변이시험 및 소핵시험 전체의 결과에서 안전성이 뒷받침되며 비교적 안전한 약물로 판단할 수 있다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: PJ014251022019) 및 2024년도 과학기술정보통신부 연구사업(과제번호: 2018R1A5A2025272)의 재원에 의해 한국연구재단의 지원으로 이루어진 결과로 이에 감사드립니다.
References
-
Chung CP, Hsu CY, Lin JH, Kuo YH, Chiang W and Lin YL. (2011). Antiproliferative lactams and spiroenone from adlay bran in human breast cancer cell lines. Journal of Agricultural and Food Chemistry. 59:1185-1194.
[https://doi.org/10.1021/jf104088x]

-
Hidaka Y, Kaneda T, Amino N and Miyai K. (1992). Chinese medicine, Coix seeds increase peripheral cytotoxic T and NK cells. Biotherapy. 5:201-203
[https://doi.org/10.1007/BF02171052]

-
Huda MN, Li X, Jahan T, He Y, Guan C, Zhang K, Gao A, Georgiev MI and Zhou M. (2023). Acceleration of the genetic gain for nutraceutical improvement of adlay(Coix L.) through genomic approaches: Current status and future prospects. Food Reviews International. 39:5377-5401.
[https://doi.org/10.1080/87559129.2022.2067175]

- Jang JH, Yi ES, Choi BY, Kim IJ, Park JS, Kim SK and Kim HD. (2005). New variety “Johyun” of Coix lachryma-jobi var. mayuen Stapf with early maturity and short plant height. Korean Journal of Medicinal Crop Science. 13:122-125.
- Japanese Environmental Mutagen Society-Mammalian Mutagenicity Study Group(JEMS-MMS). (1988) Atlas of chromosome aberration by chemicals. Mammalian Mutagenicity Study Group, Japanese Environmental Mutagen Society. Tokyo, Japan. https://www.j-ems.org/groups/mms.html, (cited by 2024 June 24).
- Kim JD. (2012). Literature on the quality and effect of Job’s tears(Coix Lachryma-jobi. var. mayuen S.). Korean Journal of Agricultural History Society. 11:89-122.
-
Kim JS, Cho JS and Lee CH. (2015). Effect of environmental factors on sprout germination, growth, and storage of six Aster species. Horticulatural Science and Techonology. 33:638-646
[https://doi.org/10.7235/hort.2015.14147]

-
Kim JY, Kim JY, Jenis J, Li ZP, Ban YJ, Baiseitova A and Park KH. (2019). Tyrosinase inhibitory study of flavonolignans from the seeds of Silybum marianum(milk thistle). Bioorganic and Medicinal Chemistry. 27:2499-2507
[https://doi.org/10.1016/j.bmc.2019.03.013]

- Kim JY, Lee MK, Hwang BS, Kim GC and Hwang IG. (2019). Antioxidant activity and tyrosinase inhibitory activities of Codonopsis lancerolata extreact and solvent fraction. Korean Journal of Food Nutrition. 32:611-619.
- Kim YJ, Park HT and Han HS. (2006). A study on the production and marketing of sprouts and leaf vegetables. Korea Rural Economic Ins. 26:5-6
-
Lee HJ, Chung MJ, Kim DJ and Choe M. (2009). Effects of Oenanthe javanica, Coicis lachryma-jobi L. var., and Plantaginis asiatica L. water extracts on activities of key enzymes on lipid metabolism. Journal of the Korean Society of Food Science and Nutrition. 38:1516-1521.
[https://doi.org/10.3746/jkfn.2009.38.11.1516]

-
Lee HJ, Lee JH, Jung JT, Lee YJ, Oh MW, Chang JK, Jeong HS and Park CG. (2019). Changes in free sugar, coixol contents and antioxidant activities of adlay sprout(Coix lacryma-jobi L.var. ma-yuen Stapf.) according to different growth stage. Korean Journal of Medicinal Crop Science. 27:339-347
[https://doi.org/10.7783/KJMCS.2019.27.5.339]

-
Lee MY, Lin HY, Cheng F, Chiang W and Kuo YH. (2008). Isolation and characterization of new lactam compounds that inhibit lung and colon cancer cells from adlay(Coix lachryma-jobi L. var. ma-yuen Stapf) bran. Food and Chemical Toxicology. 46:1933-1939.
[https://doi.org/10.1016/j.fct.2008.01.033]

-
Lee SH, Eun CH, Baek JH and Kim IJ. (2021). Adipocyte differentiation inhibition, whitening, antibacterial and antioxidant activities of extracts from Aloe vera by-product. Journal of Applied Biological Chemistry. 64:171-176
[https://doi.org/10.3839/jabc.2021.025]

-
Li PC, Tsai WH and Chien CT. (2013). Dietary Monascus adlay supplements facilitates suppression of cigarette smoke-induced pulmonary endoplasmic reticulum stress, autophagy, apoptosis and emphysema-related PLGF in rat. Food Chemistry. 136:765-774.
[https://doi.org/10.1016/j.foodchem.2012.08.007]

-
Maron DM and Ames BN. (1983). Revised methods for the Salmonella mutagenicity test. Mutation Research/Environmental Mutagenesis and Related Subjects. 113:173-215.
[https://doi.org/10.1016/0165-1161(83)90010-9]

-
Nam TG, Kim DO and Eom SH. (2018) Effects of light sources on major flavonoids and antioxidant activity in common buckwheat sprouts. Food Science and Biotechnology. 27:169-176.
[https://doi.org/10.1007/s10068-017-0204-1]

- Organisation for Economic Co-operation and Development (OECD). (2014). OECD Guidelines for the Testing of Chemicals. No. 473. In vitro mammalian chromosomal aberration test. Organisation for Economic Co-operation and Development. Paris, France. https://www.oecd.org/env/test-no-473-in-vitro-mammalian-chromosomal-aberration-test-9789264264649-en.htm, (cited by 2024 June 24).
-
Otsuka H, Hirai Y, Nagao T and Yamasaki K. (1988). Anti-inflammatory activity of benzoxazinoids from roots of Coix lachryma-joby var. ma-yuen. Journal of Natural Products. 51:74-79.
[https://doi.org/10.1021/np50055a009]

-
Patel B, Patel G, Shah S and Parmar S. (2017). A Review: Coix lacryma jobi L. Research Journal of Pharmacognosy and Phytochemistry. 9:248-252.
[https://doi.org/10.5958/0975-4385.2017.00046.2]

-
Song MY, Jung HW and Park YK. (2016). Antiobesity effect of water extract of Coix lachrymajobi var. mayuen in high fat fed C5BL/6 mice. Journal of Korean Medicine Obesity Research. 16:27-35
[https://doi.org/10.15429/jkomor.2016.16.1.27]

-
Takahashi M, Konno C and Hikino H. (1986). Isolation and hypoglycemic activity of coixans A, B and C, glycans of Coix lachryma-jobi var. ma-yuen seeds. Planta Medica. 52:64-65.
[https://doi.org/10.1055/s-2007-969074]

-
Vogel HJ and Bonner DM. (1956) Acetylornithinase of Eschericki coli: Partia1 purification and some properties. Journal of Biological Chemistry. 218:97-106.
[https://doi.org/10.1016/S0021-9258(18)65874-0]

-
Wang L, Sun J, Yi Q, Wang X and Ju X. (2012). Protective effect of polyphenols extract of adlay(Coix lachryma-jobi L. var. mayuen Stapf) on hypercholesterolemia-induced oxidative stress in rats. Molecules. 17:8886-8897.
[https://doi.org/10.3390/molecules17088886]

-
Weng WF, Peng Y, Pan X, Yan J, Li XD, Liao ZY and Zhou ML. (2022). Adlay, an ancient functional plant with nutritional quality, improves human health. Frontiers in Nutrition. 9:1019375. https://www.frontiersin.org/journals/nutrition/articles/10.3389/fnut.2022.1019375/full, (cited by 2024 July 03).
[https://doi.org/10.3389/fnut.2022.1019375]
