
Lipopolysaccharide로 유도된 RAW 264.7 대식세포와 Dextran Sulfate Sodium 유도 급성 대장염 마우스에 대한 콩배나무 추출물의 항염증 효과
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Inflammatory bowel disease (IBD) is a pathological condition of the gastrointestinal tract characterized by chronic and relapsing inflammation. This study investigated the anti-inflammatory effects of Pyrus calleryana var. fauriei extract (PCE) in vitro and in vivo.
Lipopolysaccharide (LPS)-treated RAW 264.7 cells and dextran sulfate sodium (DSS)-induced colitis mice were used to evaluate the effects of PCE. In RAW 264.7 cells, PCE inhibited nitric oxide production and phagocytosis without cytotoxicity, and the production of the pro-inflammatory cytokines tumor necrosis factor-α and interleukin (IL)-6. Colitis was induced in the mice using 2% DSS for 5 days, and PCE was administered for 14 days. PCE treatment relieved the symptoms of colitis, such as weight loss, diarrhea, and bloody feces. Moreover, PCE ameliorated splenomegaly and colonic shortening, indicators of colitis. PCE reduced the levels of inflammatory cytokines, IL-6 and IL-22. Histological analysis revealed that PCE treatment alleviated colonic mucosal damage and macrophage infiltration.
These results suggest that PCE has anti-inflammatory activity on LPS-treated RAW 264.7 cells, and ameliorates the clinical symptoms and colonic mucosal damage of DSS-induced colitis in mice. Therefore, PCE is a potential therapeutic candidate for the treatment of IBD.
Keywords:
Pyrus calleryana var. fauriei, Dextran Sulfate Sodium, Inflammatory Bowel Disease, Lipopolysaccharide, RAW 264.7 Cell서 언
염증성 장질환 (inflammatory bowel disease, IBD)은 대장에 한정되어 나타나는 궤양성 대장염 (ulcerative colitis, UC)과 위장관 전체에 걸쳐 병변이 발생하는 크론병 (crohn’s disease, CD)으로 구분되는 만성·재발성 염증을 특징으로 하는 질환이다 (Baumgart and Sandborn, 2007).
IBD는 점막장벽 손상으로 대장 상피의 투과성이 증가되어 염증성 사이토카인의 발현과 산화적 스트레스의 증가로 장염증을 초래하는 면역질환이다 (Michielan and D’Incà, 2015). IBD의 원인은 유전적 감수성을 가장 중요하게 여기고 있으며, 그 외에 장내 미생물군, 환경적 요인, 면역 이상 등과 관련성이 있는 것으로 보고되고 있다 (Zhang and Li, 2014; Gajendran et al., 2019). 또한, IBD는 서구화된 식습관의 변화와 진단기술의 발달로 아시아 국가의 도시 지역에서 발병률이 빠르게 증가하고 있어 세계적인 공중보건 문제로 부상되었다 (Ananthakrishnan et al., 2020; Kaplan and Windsor, 2021)
IBD의 치료는 점막에 발생한 염증과 임상 증상을 완화하고, 이후 증상이 재발하지 않도록 예방하는 것을 목표로 한다. IBD 치료제는 항생제, aminosalicylates, corticosteroids, 면역조절제 (thiopurines), 면역억제제 (azathioprine), 생물학제제 (tumor necrosis factor-α inhibitors) 등이 사용되고 있으며, 최근에는 다양한 기전의 생물학적 제제가 빠르게 개발되고 있다 (Agrawal et al., 2020; Cai et al., 2021).
그러나, 장기간의 약물치료는 약물 내성이 발생하여 치료에 효과가 없거나, 면역기능 감소로 기회감염 및 종양의 위험을 증가시키는 부작용이 발생한다 (Piodi et al., 2014). 이러한 약물 내성과 질병 재발의 문제를 개선하기 위해 새로운 치료제 개발의 필요성이 강조되는데, 천연물 소재는 다양한 생체활성물질을 함유하고 있어 장내 미생물과 면역체계를 조절하여 IBD 천연물 유래 치료제 개발에 관심이 커지고 있다 (Joo, 2014).
최근 대장염의 보조 치료를 위한 기능성 식품이 점차 주목을 받고 있는데, 이전 연구에서 식이 폴리페놀은 염증 반응을 억제하여 장을 보호하고, 장점막의 무결성을 유지하는데 도움이 된다고 보고하였으며 (Romier et al., 2009; Vezza et al., 2016), 폴리페놀 성분은 흡수·대사되어 여러 조직이나 기관에 전달되어 다양한 생리활성을 나타낸다고 하였다. 뿐만 아니라, 흡수되지 않은 폴리페놀 성분은 장내 미생물에 의해 대사되어 염증 부위에 작용하고, 장 건강을 강화하는 미생물의 성장을 촉진하여 IBD의 잠재적인 치료제로 주목받고 있다 (Rienks et al., 2018; Lavelle and Sokol, 2020). 또한, 역학 연구에서는 폴리페놀 섭취가 암, 제2형 당뇨, 대사증후군, 크론병의 위험을 감소시켰고 (Grosso et al., 2017), IBD 동물모델에서는 폴리페놀 투여가 궤양성 대장염의 증상을 완화시키고, 임상에서 나타나는 장내 미생물 불균형을 개선하는 효과를 보고하였다 (Chen et al., 2021; Chen et al., 2024).
콩배나무 (Pyrus calleryana var. fauriei)는 장미과의 배나무속 (Pyrus)에 속하는 낙엽관목으로, Pyrus는 항암, 항염증, 항산화, 항균활성 등 다양한 약리학적 효능이 보고되었다 (Cho et al., 2018; Shingh et al., 2024). 콩배나무에는 많은 종류의 페놀화합물이 함유되어 있으며, 최근에는 콩배나무 열매에서 추출한 에센셜 오일의 항균 및 항염증 효과가 보고되었다 (Tian et al., 2024). 그러나, 콩배나무 잎·줄기에 대한 생리활성 연구는 미흡한 편이며, 항염증 기능성 평가에 대한 연구는 보고되지 않았다.
실험동물 모델은 질병의 원인을 조사하고 새로운 치료 전략을 시험할 수 있는 로드맵을 제공하는데 매우 중요하다. IBD 유도 물질 중 dextran sulfate sodium (DSS)은 장염 초기에 관찰되는 체중감소, 설사, 혈변 등의 임상증상과 대장축소 및 점막궤양 등 궤양성 대장염의 주요 특징을 잘 나타내는 표준 IBD 모델로 다양한 기능성 소재의 효능평가와 관련 기전 규명을 위해 많이 활용되고 있다 (Wirtz et al, 2007). 한편, RAW 264.7 대식세포는 lipopolysaccharide (LPS)에 의해 활성화되어 항염증 화합물의 효능평가를 위한 in vitro 모델로 많은 연구에 활용되고 있다 (Taciak et al., 2018).
본 연구는 LPS로 활성화된 마우스 대식세포 RAW 264.7 세포와 2% DSS로 유도한 염증성 대장염 마우스 모델을 활용하여 콩배나무 추출물의 항염증 효과를 규명하고자 하였다.
재료 및 방법
1. 콩배나무 추출물 (PCE)
시료는 전라북도에서 채집한 콩배나무 잎, 줄기를 사용하였다. 세포 실험에 사용한 추출물은 한국식물추출물은행 (KRIBB)에서 분양받아 (분양번호: 032-081, bar code: PB3367.3) 사용하였다. 동물실험에 사용한 추출물은 기능성 식품소재 개발을 위하여 100% 에탄올을 사용하여 90 분간 3 회 초음파 추출기 (JAC-4020, CASSCIENCE, Daejeon, Korea)로 추출하여 여과하였다. 추출액은 농축 (N-1300, EYELA, Tokyo, Japan)하여 동결건조 (TFD8503, Ilshinbiobase, Dongducheon, Korea)한 콩배나무 추출 분말 (수율: 4.8%)을 사용하였다.
2. 세포배양
RAW 264.7 세포는 10% fetal bovine serum (Gibco-BRL, Paisley, Scotland, England), 100 units/㎖ penicillin, 100 ㎍/㎖ streptomycine을 포함하는 Dulbecco’s Modified Eagle’s Medium (DMEM, Corning Incorporated, Corning, NY, USA) 배지를 사용하여 37℃, 5% CO2 배양기에서 배양하였으며, 세포가 배양접시의 80% 정도 자란 후 계대 배양하였다.
3. 세포독성 평가
RAW 264.7 세포에 대한 PCE의 세포 독성은 WST (water soluble tetrazolium) assay 방법으로 세포 생존율을 측정하였다. 1 × 105 cells/well 농도로 RAW 264.7 세포를 48 well plate에 분주하여 24 시간 배양한 후, PCE를 0, 50, 100, 200, 400, 800, 1600 ㎍/㎖의 농도로 24 시간 처리하였다.
배양 후, EZ-Cytox kit (DoGenBio, Seoul, Korea)를 사용하여 제조사의 방법에 따라 측정하였으며, 시료 무첨가 세포군의 생존율에 대한 PCE 처리군의 세포 생존율을 백분율로 계산하였다.
4. Nitric oxide (NO) 및 사이토카인 생성 측정
NO 생성을 측정하기 위해 RAW 264.7 세포를 1 × 105 cells/well 농도로 48 well plate에 분주하여 24 시간 배양한 후, PCE 추출물과 LPS (1 ㎍/㎖)를 처리하여 24 시간 배양하였다.
NO 측정은 세포 배양 상등액과 Griess reagent를 1 : 1로 혼합하여 10 분간 반응시켜 540 ㎚에서 흡광도를 측정하였다. Tumor necrosis factor-α (TNF-α)와 interleukin (IL)-6 분석은 세포 배양액을 수거하여 5,000 rpm에서 10 분간 원심분리한 상층액을 ELISA kit (R&D systems, Minneapolis, MN, USA)로 분석하였다.
5. 대식세포의 식균작용
RAW 264.7 세포의 식균작용은 phagocytosis assay (zymosan substrate) kit (Abcam, Cambrige, England)를 사용하여 측정하였다. RAW 264.7 세포를 96 well plate에 1 × 105 cells/well로 분주하여 24 시간 배양한 후, PCE (0, 200 ㎍/㎖)와 LPS (1 ㎍/㎖)를 처리한 배지로 교환하여 24 시간 배양한 후, 제조사의 방법에 따라 측정하였다.
6. 동물실험
본 실험에 사용한 실험동물은 체중 20 g - 22 g의 수컷 C57BL/6 마우스로 대한바이오링크 (Eumseong, Korea)에서 제공받아 온도 23 ± 1℃, 습도 55 ± 5%, 12 시간 자동명암이 조절되는 동물실험실에서 1 주간 적응시킨 후, 체중을 측정하여 무작위법으로 그룹당 7 마리씩 구성하였다.
실험군은 (1) 대조군 (NC, normal control), (2) 대장염 유도군 (DSS, 2% DSS), (3) 저농도 투여군 (PCE10, 2% DSS + PCE 10 ㎎/㎏) (4) 고농도 투여군 (PCE100, 2% DSS + PCE 100 ㎎/㎏)으로 나누어 14 일간 투여하였다.
PCE는 PBS에 녹여 0.2 ㎖ 용량으로 매일 오전 같은 시간에 경구투여하였고, NC군과 DSS군은 PBS를 투여하였다. 본 연구의 동물실험은 (재)홍천메디칼허브연구소 실험동물운영위원회 승인 (HIMH A23-02)을 받아 관련 규정을 준수하여 수행하였다.
7. DSS 투여 및 disease activity index (DAI) 측정
급성 대장염은 2% DSS (M.W. 36 - 50 kDa, MP biomedicals, Irvine, CA, USA)를 멸균 정제수에 녹여 5 일간 음용수로 자유 급이하였고, 이후에는 멸균 정제수로 교체하였다. 음수량과 체중은 매일 오전에 측정하였고, 설사와 혈변은 ColoScreen Ⅲ kit (#5071, Helena Laboratories, Beaumont, TX, USA)를 사용하여 측정하였다.
대장염의 질병 활성도 (DAI, disease activity index)는 Berberat 등 (2005)의 논문을 참고하여 Table 1의 기준에 따라 체중감소, 설사, 혈변을 매일 체크한 후, 각 항목의 척도로 계산한 점수를 합산하였다.
8. 채혈 및 사이토카인 분석
이소플루란 (TerrellTM Liquid Isoflurane, Piramal Critical Care Inc., Bethlehem, PA, USA) 흡입마취제로 심마취한 후, 안와 정맥에서 채혈한 혈액을 4,000 rpm에서 10 분간 원심분리 (Eppendorf SE, Hamburg, Germany)하여 혈장을 분리하였다. 혈중 IL-6와 IL-22는 ELISA kit (R&D systems, Minneapolis, MN, USA)를 사용하여 분석하였다.
9. 조직학적 분석
10% formaldehyde (Sigma-Aldrich, St. Louis, MO, USA) 용액에 고정한 대장조직은 파라핀 포매 후 5 ㎛ 두께로 박절하여 hematoxylin and eosin 염색을 실시하였다. 대장 조직의 병리학적 분석은 Erben 등 (2014)의 chemical induced colonic inflammation 평가 기준에 근거하여 대장조직의 염증세포 침윤과 상피세포 손상 및 점막조직 궤양 변화를 3점 척도로 평가하였다 (Table 2).
10. 통계 방법
실험결과는 평균 ± 표준편차 [Means ± standard deviation (SD)]로 나타내었고, 통계분석은 GraphPad 7.05 프로그램 (GraphPad Software Inc., San Diego, CA, USA)을 사용하여 One-way ANVOA를 실시하였다.
투여 기간에 따른 체중, 설사, 혈변, DAI 변화는 two-way ANOVA로 분석하였으며, 통계적 유의성은 Dunnett’s multiple range test로 5% 수준에서 유의성 검정을 실시하였다 (*p < 0.05).
결과 및 고찰
1. RAW 264.7 세포의 세포독성
RAW 264.7 세포에 PCE를 농도별로 (0, 50, 100, 200, 800, 1600 ㎍/㎖) 처리하였을 때, PCE가 200 ㎍/㎖ 이하에서는 세포 생존율이 90% 이상이었고, 400 ㎍/㎖ - 1600 ㎍/㎖에서는 세포 생존율이 각각 89.02 ± 0.48%, 79.37 ± 2.97%, 47.98 ± 0.01%로 나타났다 (Fig. 1A).
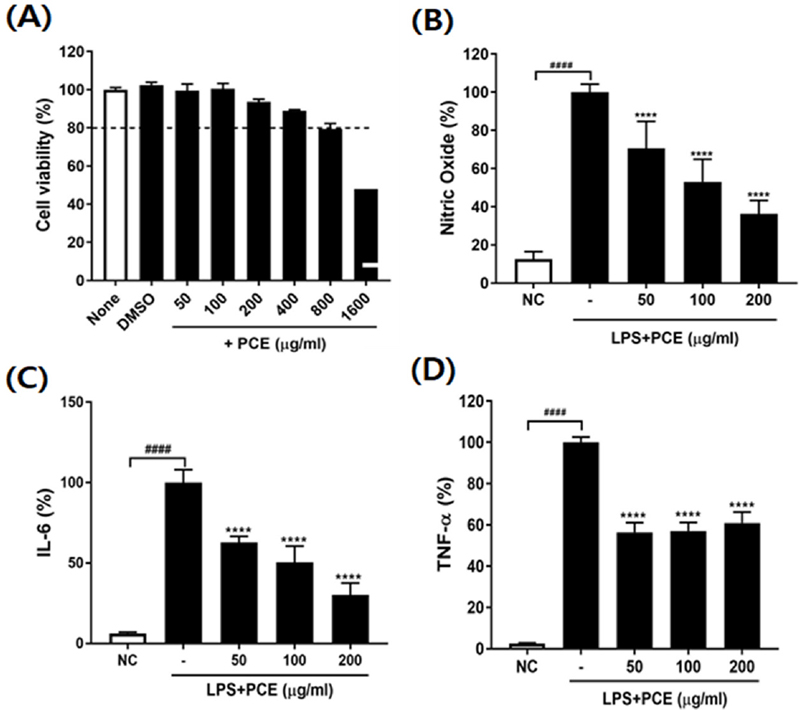
Effect of Pyrus calleryana extract (PCE) on viability of cells, NO production, and pro-inflammatory cytokines secretion on LPS-stimulated RAW 264.7 cells.(A) Cell viability, (B) Nitric oxide (%), (C) IL-6, (D) TNF-α. LPS; lipopolysaccharide, IL-6; interleukin-6, TNF-α; tumor necrosis factor alpha. Values are the means ± SD (n = 3). Symbols indicate a significantly different by the Dunnett’s multiple range test after one-way ANOVA. ####p < 0.0001 vs NC group; ****p < 0.0001 vs LPS-only treated group.
따라서, PCE 처리 농도를 RAW 264.7 세포에 세포독성이 없는 200 ㎍/㎖ 이하로 설정하여 실험하였다.
2. RAW 264.7 세포의 NO 생성억제 효과
LPS 처리군의 NO 생성량을 100%로 하여 PCE 처리 시 NO 생성 억제율을 계산한 결과, LPS를 처리한 RAW 264.7 세포에서 NO 생성이 유의적으로 증가하여 염증 반응이 유도되었음을 확인하였다 (Fig. 1B).
반면, LPS와 함께 PCE를 농도별로 처리하였을 때, RAW 264.7 세포의 NO 생성량이 LPS 단독 처리군보다 각각 29.39%, 46.95%, 63.68% 농도 의존적으로 현저하게 감소하였다 (p < 0.0001).
일반적으로 그람음성 박테리아 세포벽의 구성성분인 LPS로 활성화된 RAW 264.7 세포는 감염 초기에는 염증성 사이토카인, NO 및 prostaglandin E2 등의 염증성 분자를 생성하여 외부 병원체를 제거하도록 자극되나 (Zhu et al., 2015), 염증 반응이 지속적으로 일어나면 류마티스, 패혈증, 당뇨, 암과 같은 질병과 밀접하게 연관되는 것으로 보고되었다 (Lamkanif and Dixit, 2012).
본 연구에서 활성화된 대식세포에 PCE를 처리하여 NO 생성량이 현저히 억제되는 결과를 통하여 볼 때, PCE는 과도한 면역반응을 억제하는 항염증 소재로 활용 가능성이 높은 것을 확인하였다.
3. RAW 264.7 세포의 염증성 사이토카인 생성억제 효과
비정상적인 조건에서 활성화된 대식세포는 다양한 염증성 사이토카인과 염증매개 분자를 분비하여 독성을 나타낸다 (Fujiwara and Kobayashi, 2005).
본 연구에서는 LPS를 처리한 RAW 264.7 세포의 염증성 사이토카인 TNF-α와 IL-6 분비에 대한 PCE의 억제활성을 측정하였다 (Fig. 1C and 1D). PCE를 농도별로 처리하였을 때, IL-6 농도는 LPS 단독 처리군보다 각각 37.27%, 49.67%, 69.80% 농도 의존적으로 현저하게 감소하였으며 (p < 0.0001), TNF-α 농도도 PCE 처리군에서 39.6% - 43.61% 유의적으로 감소하였다 (p < 0.0001).
LPS와 같은 염증물질에 자극된 대식세포는 NO 뿐만 아니라, 면역세포 간 상호작용을 중재하는 pro-inflammatory 사이토카인인 TNF-α, IL-6, IL-1β 등을 분비한다 (Duque and Descoteaus, 2014). 또한, pro-inflammatory 사이토카인은 염증성 장질환, 건선, 류마티스 관절염, 암 등의 염증질환과 자가면역질환에서 염증과 조직손상을 증폭하여 악화시킨다 (Sozzani et al., 2014).
PCE는 LPS로 과도하게 발현된 pro-inflammatory cytokine인 TNF-α와 IL-6의 생성을 억제함으로써 만성염증 및 이로 인한 질환발생의 가능성을 조절할 수 있는 항염증 소재임을 확인하였다.
4. RAW 264.7 세포의 식세포 작용 억제
대식세포는 선천적인 면역체계에서 병원성 항원을 제거하는 주요 역할을 하는 세포 구성요소로 염증매개체의 분비가 증가할수록 식세포 작용이 활성화된다 (Hirayama et al., 2017).
LPS로 염증반응을 유도한 RAW 264.7 세포에서는 식세포 작용이 현저히 증가하였으나 (Fig. 2A), PCE를 200 ㎍/㎖ 농도로 처리하였을 때, LPS로 활성화된 대식세포의 식세포 작용이 55.47% 유의적으로 감소하였다 (p < 0.0001).
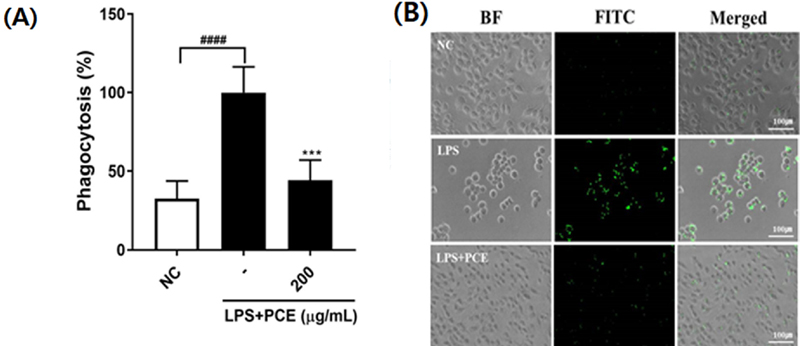
Effect of Pyrus calleryana extract (PCE) on phagocytosis activity of RAW 264.7 macrophages.(A) Efficiency of phagocytosis, (B) Representative microscopy images of RAW 264.7 cells exposed to fluorescent zymosan (green). Values are the means ± SD (n = 3). Symbols indicate a significantly different by the Dunnett’s multiple range test after one-way ANOVA. Scale bar = 100 ㎛. ####p < 0.0001 vs NC group; ***p < 0.001 vs LPS-only treated group.
본 연구 결과는 이전 연구에서 플라보노이드 성분이 식세포 작용을 조절하는 것으로 보고한 결과 (Nishi et al., 2024)와 일치하였으며, PCE가 만성염증을 억제하는 중요한 면역조절 활성이 있음을 확인하였다.
5. IBD 마우스의 질병활성지수 (DAI)
2% DSS를 5 일간 자유급이하면서 14 일동안 PCE를 투여 하였을 때, 염증성 대장염의 임상 증상과 DAI 결과를 Fig. 3에 제시하였다.
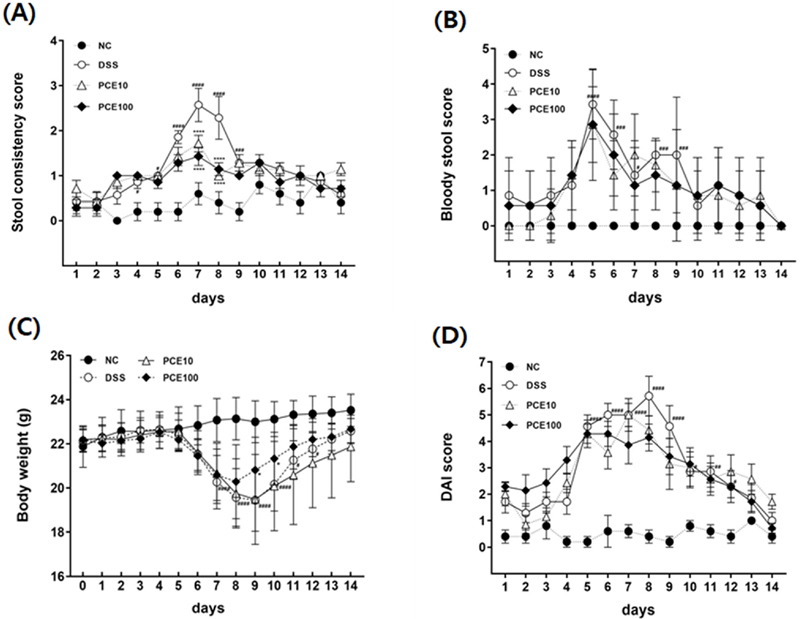
Effect of Pyrus calleryana extract (PCE) on the development of DSS-induced colitis mice.Mice were administered 2% DSS in drinking water (ad libitum) for 5 days with or without PCE (10 or 100 mg/kg, oral adminstration) for 14 days. (A) Stool consistency score, (B) Bloody stool score, (C) Body weight changes, (D) DAI score. DAI; disease activity index. Values are the means ± SD (n = 7). #p < 0.05, ##p < 0.01, ###p < 0.001, ####p < 0.0001 vs NC group, *p < 0.05, ****p < 0.0001 vs DSS group. Symbols indicate a significantly different by the Dunnett’s multiple range test after two-way ANOVA.
설사 증상은 실험 6일차에서 실험 8일차에 급격히 증가하였고, 이후 개선되는 양상을 보였다 (Fig. 3A). 설사 지수가 가장 높게 나타난 실험 7일차의 DSS군 설사 지수는 2.57 ± 0.98이었고, PCE 투여군은 각각 1.71 ± 0.51, 1.43 ± 0.53로 DSS군보다 유의적으로 설사 지수가 감소하였다 (p < 0.0001). 실험 9일차 이후 설사 증상이 회복되는 기간에는 그룹간 차이가 없었다.
혈변 지수는 실험 5일차에 가장 높았으며 (Fig. 3B), 각 실험군의 혈변 지수는 DSS군 3.43 ± 0.95, PCE10군 2.86 ± 1.29, PCE100군 2.86 ± 1.03으로, PCE 처리군에서 혈변 지수가 감소하는 경향을 보였으나, 통계적 유의성은 없었다.
DSS군은 2% DSS 섭취 종료 후, 실험 6일차부터 체중이 현저하게 감소하였고, 실험 10일차부터 체중이 증가하였다 (Fig. 3C). 반면, PCE 고농도 투여군인 PCE100군은 같은 기간 DSS군보다 체중감소가 억제되었고, 체중증가는 실험 9일차에 나타났으며, 체중도 유의적으로 증가하였다.
DAI 점수는 실험 8일차에 최고 수치를 나타내었다 (Fig. 3D). 실험군의 DAI 점수는 DSS군 5.71 ± 1.98, PCE10군 4.43 ± 1.38, PCE100군 4.14 ± 1.35로 PCE 처리군에서 DSS군보다 DAI 점수가 감소하는 것을 확인하였다.
이 결과로부터 PCE는 2% DSS로 유도한 염증성 대장염 모델의 초기 주요 증상인 체중감소, 설사, 혈변을 개선하여 항염증 작용이 있음을 나타내었다.
6. IBD 마우스의 비장 무게 및 대장 길이 변화
DSS로 유도한 IBD 마우스의 비장 무게, 대장 길이 및 대장 무게를 Fig. 4에 제시하였다. 비장은 면역의 필수적인 조직으로 비장 크기는 염증의 심각성을 나타내는 지표로 활용된다 (Han et al., 2024).
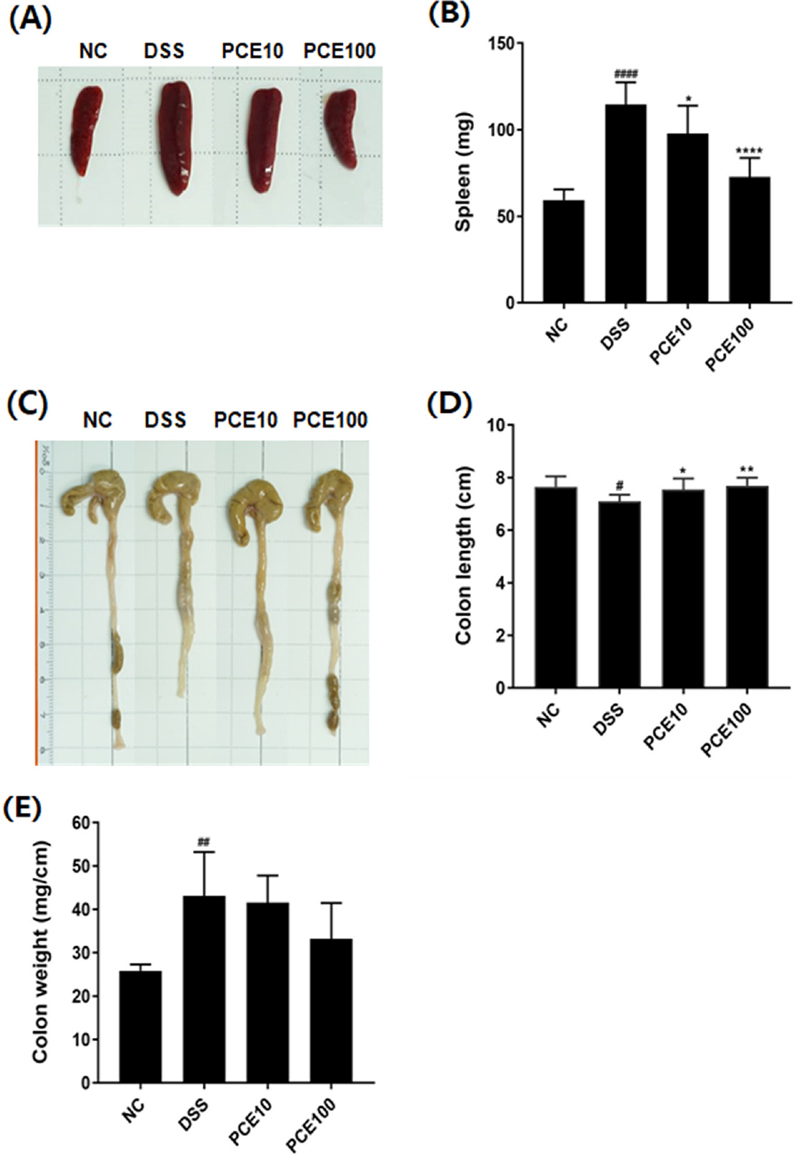
Effect of Pyrus calleryana extract (PCE) on spleen weights and colon lengths in DSS-induced colitis mice.Mice were administered 2% DSS in drinking water (ad libitum) for 5 days with or without PCE (10 or 100 mg/kg, oral adminstration) for 14 days. (A) Representative photograph of spleen, (B) Spleen weight, (C) Representative photograph of colon, (D) The length and weight of colon. Values are the means ± SD (n = 7). #p < 0.05, ##p < 0.01, ####p < 0.0001 vs NC group, *p < 0.05, **p < 0.01, ****p < 0.0001 vs DSS group. Symbols indicate a significantly different by the Dunnett’s multiple range test after oneway ANOVA.
DSS군의 비장무게는 114.66 ± 12.73 ㎎으로 NC군 59.45 ± 6.17 ㎎보다 1.93 배 유의적으로 증가하였다 (p < 0.0001). PCE 처리군의 비장 무게는 PCE10군 97.90 ± 15.99 ㎎ (p < 0.05), PCE100군 72.78 ± 10.96 ㎎ (p < 0.0001)으로 DSS섭취로 증가된 비장 무게가 유의적으로 감소하였다 (Fig. 4B). 본 연구에서 PCE는 DSS 섭취로 인한 비장 비대증을 개선하는 효과를 나타내었다.
대장 길이는 DSS군이 7.10 ± 0.25 ㎝로 NC군 7.66 ± 0.40 ㎝보다 8.3% 유의적으로 감소하여 (p < 0.05), DSS로 유도된 염증성 대장염의 초기 증상인 대장 축소증상을 확인하였다. 반면, PCE 투여군의 대장 길이는 각각 7.46 ± 0.19 ㎝ (p < 0.05), 7.70 ± 0.30 ㎝ (p < 0.01)로 DSS군보다 대장 길이가 유의적으로 증가하였다 (Fig. 4D).
대장 무게는 NC군 25.84 ± 1.520 ㎎/㎝, DSS군 43.16 ± 10.10 ㎎/㎝로 DSS 섭취 시 대장 무게가 67.03%의 수준으로 유의적으로 증가하였고 (p < 0.01), PCE 투여군에서는 DSS군보다 대장 무게가 감소하는 경향을 보였으나, 통계적 유의성은 없었다 (Fig. 4E).
본 연구결과는 DSS로 유도한 IBD 마우스에 녹차 플라보노이드를 투여하였을 때, 체중감소, 혈변 및 설사 등의 증상 개선, 결장 단축 억제 및 조직학적 손상을 개선한 이전 연구 결과와 일치하였다 (Oz et al., 2013).
7. IBD 마우스의 혈중 IL-6, IL-22 농도
DSS로 유도한 IBD 마우스에서 염증성 사이토카인에 대한 PCE의 영향을 확인하기 위해 혈중 IL-6와 IL-22를 분석하였다 (Fig. 5).
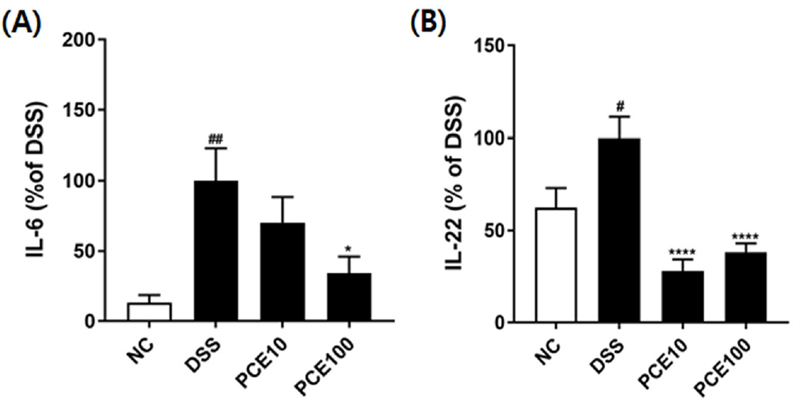
Effect of Pyrus calleryana extract (PCE) on the levels of IL-6 and IL-22 in DSS-induced colitis mice.Mice were administered 2% DSS in drinking water (ad libitum) for 5 days with or without PCE (10 or 100 ㎎/㎏, oral adminstration) for 14 days. (A) IL-6, (B) IL-22. Values are the means ± SD (n = 7). #p < 0.05, ##p < 0.01 vs NC group, *p < 0.05, ****p < 0.0001 vs DSS group. Symbols indicate a significantly different by the Dunnett’s multiple range test after one-way ANOVA.
IBD 모델에서 염증이 발생한 장 점막세포에서 중요한 병리학적 역할을 수행하는 염증매개체인 염증성 사이토카인을 자발적으로 방출하지만 관련 메카니즘은 아직 알려지지 않았다 (Duan et al., 2021).
본 실험에서 DSS군의 IL-6와 IL-22 농도는 NC군에 비해 현저하게 증가하였고, PCE 처리 시 DSS 섭취로 증가된 혈중 염증성 사이토카인의 농도가 유의적으로 감소하였다.
염증 매개체는 염증 발달을 주도하는 핵심 요인으로 염증성 사이토카인은 염증조직에서 지속적으로 증가하여 장 장벽 손상을 일으킨다 (Leppkes and Neurath, 2020). IL-6는 결장 손상을 유발하고, 염증성 대장염의 발달에 따라 증가하게 된다 (Marafini et al., 2019). Yu 등 (2013)은 궤양성 대장염 마우스와 궤양성 대장염 관련 암환자의 생검 표본에서 IL-22의 발현을 조사한 결과, IL-22의 발현이 정상 대조군보다 증가되어 IL-22 마커를 염증성 대장염의 중증도를 판단하는 바이오마커로 활용할 수 있다고 제안한 바 있다.
8. IBD 마우스의 대장조직 분석
대장 조직의 병리학적 변화를 분석하기 위해 hematoxylin과 eosin으로 염색을 실시하였고 광학현미경을 이용하여 Fig. 6에 제시하였다.
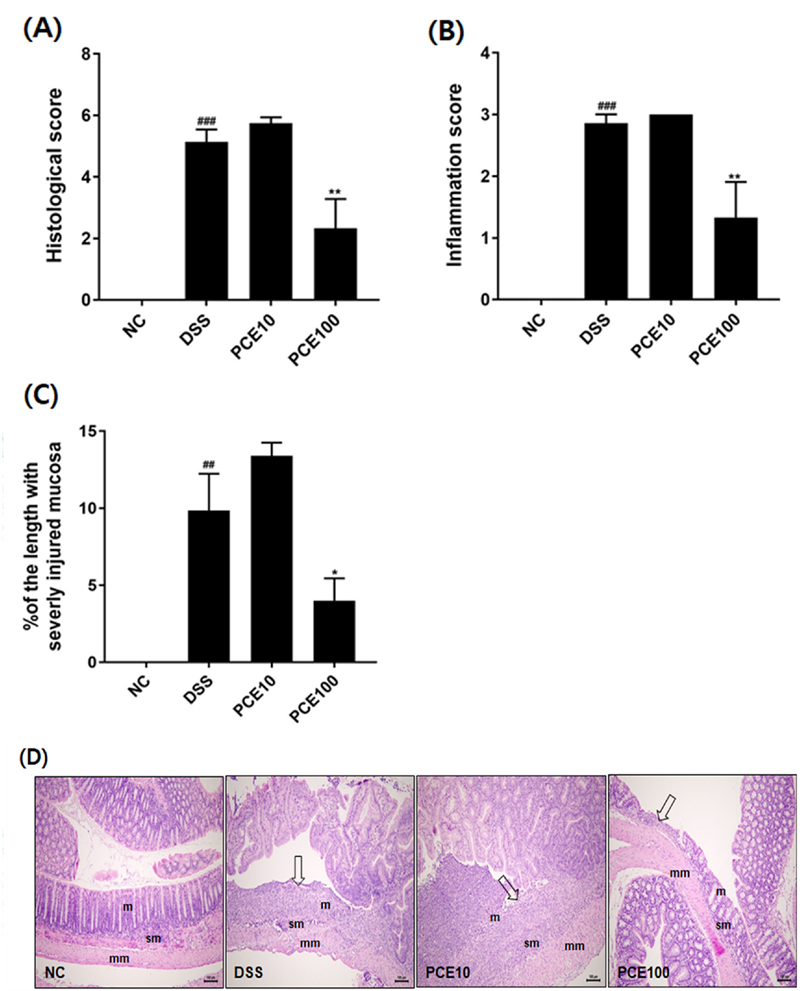
Effect of Pyrus calleryana extract (PCE) on colonic histology in DSS-induced colitis mice.Mice were administered 2% DSS in drinking water (ad libitum) for 5 days with or without PCE (10 or 100 ㎎/㎏, oral adminstration) for 14 days. (A) Histological score, (B) Inflammation score, (C) Percentage (%) of the length with severity injured mucosa, (D) H&E stained colonic section (scale bar = 100 ㎛). m; mucosa, sm; submucosa, mm; muscular layer. Arrow, focal or extensive mucosal ulcerative colitis. Values are the means ± SD (n = 7). ##p < 0.01, ###p < 0.001 vs NC group, *p < 0.05, **p < 0.01 vs DSS group. Symbols indicate a significantly different by the Dunnett’s multiple range test after one-way ANOVA.
DSS군에서는 국소성 또는 넓은 범위의 궤양성 소견이 발견되었고, 염증세포의 침윤이 근육층까지 확장되었다. 반면, PCE100군에서는 DSS군과 비교하였을 때, 염증세포 침윤과 점막 손상이 눈에 띄게 개선되었다. 또한, 대장 전체 길이에서 심하게 손상된 부위의 대장 길이를 측정한 결과, DSS군 9.85%, PCE10군 13.4%, PCE100군 4.01%로 PCE 고농도 투여군에서 대장 손상부위가 감소하는 것을 확인하였다 (p < 0.05). 음전하를 띤 DSS는 장상피 세포에 독성을 주어 장벽을 손상시키고, 결장 상피의 투과성을 증가시켜 점액과 잔세포 (goblet cell) 손실, 결장상피 궤양, 호중구의 고유판 (lamina propria)과 점막하조직의 침윤을 일으키는 것으로 보고되었다 (Chassaing et al., 2015).
일반적으로 염증성 단핵구는 감염이나 조직손상에 반응하여 대부분의 경우에는 병원체를 제거하는 작용을 하지만, IBD에서는 염증이 악화되는 경우에 염증성 단핵구가 손상된 조직으로 침윤된다 (Bain and Mowat, 2014). 따라서, 궤양성 대장염은 비정상적인 면역활성과 염증 반응으로 점막치유를 방해하여 더 많은 조직손상을 초래하는 악순환을 반복하는 질환이다.
본 연구에서는 LPS로 유도한 대식세포와 급성 대장염 마우스 모델에서 PCE의 항염증 활성과 대장염 증상을 완화시키는 항염증 소재의 기능성을 확인하였으나, 후속 연구에서 PCE의 유효 지표성분을 분리하여 항염증 효능과 작용기전을 규명함으로써 천연물 유래 염증성 기능성 소재개발의 가능성을 높일 수 있을 것이다.
Acknowledgments
본 연구는 (재)홍천메디칼허브연구소 자체연구개발사업(과제명: 면역조절 기능성 소재개발 플랫폼 구축사업: 면역질환모델 활용 기능성 평가 연구)의 지원에 의해 이루어진 것으로 이에 감사드립니다.
References
-
Agrawal M, Kim ES and Colmbel JF. (2020). JAK inhibitors safety in ulcerative colitis: Practical implications. Journal of Crohn’s and Colitis. 14:S755-S760.
[https://doi.org/10.1093/ecco-jcc/jjaa017]

-
Ananthakrishnan AN, Kaplan GG and Ng SC. (2020). Changing global epidemiology of inflammatory bowel diseases: Sustaining health care delivery into the 21st century. Clinical Gastroenterology and Hepatology. 18:1252-1260.
[https://doi.org/10.1016/j.cgh.2020.01.028]

-
Bain CC and Mowat AM. (2014). Macrophages in intestinal home-ostasis and inflammation. Immunological Reviews. 260:102-117.
[https://doi.org/10.1111/imr.12192]

-
Baumgart DC and Sandborn WJ. (2007). Inflammatory bowel disease: Clinical aspects and established and evolving therapies. Lancet. 369:1641-1657.
[https://doi.org/10.1016/S0140-6736(07)60751-X]

-
Berberat PO, A-Rahim YI, Yamashita K, Warny MM, Csizmadia E, Robson SC and Bach FH. (2005). Heme oxygenase-1-generated biliverdin ameliorates experimental murine colitis. Inflammatory Bowel Disease. 11:350-359.
[https://doi.org/10.1097/01.MIB.0000164017.06538.8a]

-
Cai Z, Wang S and Li J. (2021). Treatment of inflammatory bowel disease: A comprehensive review. Frontiers in Medicine. 8:765474. https://www.frontiersin.org/journals/medicine/articles/10.3389/fmed.2021.765474/full, (cited by 2024 October 29).
[https://doi.org/10.3389/fmed.2021.765474]

-
Chassaing B, Aitken JD, Malleshappa M and Vija-Kumar M. (2015). Dextran sulfate sodium(DSS)-induced colitis in mice. Current Protocols in Immunology. 104:15-25.
[https://doi.org/10.1002/0471142735.im1525s104]

-
Chen B, Luo J, Han Y, Du H, Liu J, He W, Zhu J, Xiao J, Wang J, Cao Y, Xiao H and Song M. (2021). Dietary tangeretin alleviated dextran sulfate sodium-induced colitis in mice via inhibiting inflammatory response, restoring intestinal barrier function, and modulating gut microbiota. Journal of Agricultural and Food Chemistry. 69:7663-7674.
[https://doi.org/10.1021/acs.jafc.1c03046]

-
Chen Y, Shui M, Yuan Q, Li H, Zhou H, Wang Y, Chen Z and Wang S. (2024). Oral chondrotin sulfate functionalized natural polyphenol for targeted therapy of ulcerative colitis. Material and Design. 238:112645. https://www.sciencedirect.com/science/article/pii/S0264127524000170, (cited by 2024 October 29).
[https://doi.org/10.1016/j.matdes.2024.112645]

-
Cho KH, Parveen A, Kang MC, Subedi L, Lee JH, Park SY, Jin MR, Yoon H, Son YK and Kim SY. (2018). Pyrus ussuriensis Maxim. leaves extract ameliorates DNCB-induced atopic dermatitis-like NC/Nga mice. Phytomedicine. 48:76-83.
[https://doi.org/10.1016/j.phymed.2018.05.006]

-
Duan L, Cheng S, Li L, Liu Y, Wang D and Liu G. (2021). Natural anti-inflammatory compounds as drug candidates for inflammatory bowel disease. Frontiers in Pharmacology. 12:684486. https://www.frontiersin.org/journals/pharmacology/articles/10.3389/fphar.2021.684486/full, (cited by 2024 October 29).
[https://doi.org/10.3389/fphar.2021.684486]

-
Duque GA and Descoteaux A. (2014). Macrophage cytokines : Involvement in immunity and infectious disease. Frontiers in Immunology. 5:491. https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2014.00491/full, (cited by 2024 October 29).
[https://doi.org/10.3389/fimmu.2014.00491]

- Erben U, Loddenkemper C, Doerfel K, Spiekermann S, Haller D, Heimesaat MM, Zeitz M, Siegmund B and Kühl AA. (2014). A guide to histomorphological evaluation of intestinal inflammation in mouse models. International Journal of Clinical and Experimental Pathology. 7:4557-4576.
-
Fujiwara N and Kobayash K. (2005). Macrophages in inflammation. Current Drug Targets-Inflammation and Allergy. 4:281-286.
[https://doi.org/10.2174/1568010054022024]

-
Gajendran M, Loganathan P, Jimenez G, Catinella AP, Ng N, Umapathy C, Ziade N and Hashash JG. (2019). A comprehensive review and update on ulcerative colitis. Disease-a-Month. 65:100851. https://www.sciencedirect.com/science/article/abs/pii/S0011502919300318, (cited by 2024 October 29).
[https://doi.org/10.1016/j.disamonth.2019.02.004]

-
Grosso G, Stepaniak U, Micek A, Stefler D, Bobak M and Pająk A. (2017). Dietary polyphenols are inversely associated with metabolic syndrome in Polish adults of the HAPIEE study. European Journal of Nutrition. 56:1409-1420.
[https://doi.org/10.1007/s00394-016-1187-z]

-
Han U, Gao M, Wang F, Luo Z, Jiang X, Qiu Y, Su J, Duan X, Luo S, Tang S, Khan A, Zou Z, Chen C, Yin Q, Qiu J and Zhang H. (2024). Protective effects of patchouli alcoholic against DSS-induced ulcerative colitis. Scientific Reports. 14:16745. https://www.nature.com/articles/s41598-024-66259-8, (cited by 2024 October 29).
[https://doi.org/10.1038/s41598-024-66259-8]

-
Hirayama D, Iida T and Nakase H. (2017). The phagocytic function of macrophage-enforcing innate immunity and tissue homeostasis. International Journal of Molecular Science. 19:92. https://www.mdpi.com/1422-0067/19/1/92, (cited by 2024 October 29).
[https://doi.org/10.3390/ijms19010092]

-
Joo YE. (2014). Natural product-derived drugs for the treatment of inflammatory bowel diseases. Intestinal Research. 12:103-109.
[https://doi.org/10.5217/ir.2014.12.2.103]

-
Kaplan GG and Windsor JW. (2021). The four epidemiological stages in the global evolution of inflammatory bowel disease. Nature Reviews Gastroenterology and Hepatology. 18:56-66.
[https://doi.org/10.1038/s41575-020-00360-x]

-
Lamkanfi M and Dixit VM. (2012). Inflammasomes and their roles in health and disease. Annual Review of Cell and Developmental Biology. 28:137-161.
[https://doi.org/10.1146/annurev-cellbio-101011-155745]

-
Lavelle A and Sokol H. (2020). Gut microbiota-derived metabolites as key actors in inflammatory bowel disease. Nature Reviews Gastroenterology and Hepatology. 17:223-237.
[https://doi.org/10.1038/s41575-019-0258-z]

-
Leppkes M and Neurath MF. (2020). Cytokines in inflammatory bowel diseases - Update 2020. Pharmacological Research. 158:104835. https://www.sciencedirect.com/science/article/abs/pii/S1043661820311439, (cited by 2024 October 29).
[https://doi.org/10.1016/j.phrs.2020.104835]

-
Marafini I, Sedda S, Dinallo V and Monteleone G. (2019). Inflammatory cytokines: From discoveries to therapies in IBD. Expert Opinion Biological Therapy. 19:1207-1217.
[https://doi.org/10.1080/14712598.2019.1652267]

-
Michielan A and D’Incà R. (2015). Intestinal permeability in inflammatory bowel disease: Pathogenesis, clinical evaluation, and therapy of leaky gut. Mediator Inflammation. 2015:628157. https://onlinelibrary.wiley.com/doi/full/10.1155/2015/628157, (cited by 2024 October 29).
[https://doi.org/10.1155/2015/628157]

-
Nishi K, Nakatani Y, Ishida M, Kadota A and Sugahara T. (2024). Anti-inflammatory activity of the combination of nobiletin and docosahexaenoic acid in lipopolysaccharide-stimulated RAW 264.7 cells: A potential synergistic anti-inflammatory effect. Nutrients. 16:2080. https://www.mdpi.com/2072-6643/16/13/2080, (cited by 2024 October 29).
[https://doi.org/10.3390/nu16132080]

-
Oz HS, Chen T and de Villiers WJ. (2013). Green tea polyphenols and sulfasalazine have parallel anti-inflammatory properties in colitis models. Frontiers in Immunology. 4:132. https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2013.00132/full, (cited by 2024 October 29).
[https://doi.org/10.3389/fimmu.2013.00132]

-
Piodi LP, Poloni A and Ulivieri FM. (2014). Managing osteoporosis in ulcerative colitis: Something new? World Journal of Gastroenterology. 20:14087-14098.
[https://doi.org/10.3748/wjg.v20.i39.14087]

-
Rienks J, Barbaresko J, Oluwagbemigun K, Schmid M and N¨othlings U. (2018). Polyphenol exposure and risk of type 2 diabetes: dose-response meta-analyses and systematic review of prospective cohort studies. American Journal of Clininical Nutrition. 108:49-61.
[https://doi.org/10.1093/ajcn/nqy083]

-
Romier B, Schneider YJ, Larondelle Y and During A. (2009). Dietary polyphenols can modulate the intestinal inflammatory response. Nutrition Reviews. 67:363-378.
[https://doi.org/10.1111/j.1753-4887.2009.00210.x]

-
Singh S, Verma R and Sharma H. (2024). Exploring the therapeutic potential and bioactive compounds in Pyrus species. Pharmacological Research - Modern Chinese Medicine. 10:100342. https://www.sciencedirect.com/science/article/pii/S2667142523001288, (cited by 2024 October 29)
[https://doi.org/10.1016/j.prmcm.2023.100342]

-
Sozzani S, Abbracchio MP, Annese V, Danese S, De Pita O, De Sarro G, Maione S, Olivieri I, Parodi A and Sarizi-Puttini P. (2014). Chronic inflammatory diseases: Do immunological patterns drive the choice of biotechnology drugs? A critical review. Autoimmunity. 47:287-306.
[https://doi.org/10.3109/08916934.2014.897333]

-
Tian M, Wang Q, Jia X, Tian Y, Hong Y and Ying Z. (2024). Chemical constitutes, antibacterial and anti-inflammatory properties of Pyrus calleryana Dcne. essential oil. Industrial Crops and Products. 2024:117353. https://www.sciencedirect.com/science/article/abs/pii/S0926669023011184, (cited by 2024 October 29).
[https://doi.org/10.1016/j.indcrop.2023.117353]

-
Taciak B, Białasek M, Braniewska A, Sas Z, Sawicka P, Kiraga Ł, Rygiel T and Kro´l M. (2018). Evaluation of phenotypic and functional stability of RAW 264.7 cell line through serial passages. PLoS One. 13:e0198943. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0198943, (cited by 2024 October 29).
[https://doi.org/10.1371/journal.pone.0198943]

-
Vezza T, Rodriguez-Nogales A, Algieri F, Utrilla MP, Rodriguez-Cabezas ME and Galvez J. (2016). Flavonoids in inflammatory bowel disease: A review. Nutrients. 8:211. https://www.mdpi.com/2072-6643/8/4/211, (cited by 2024 October 29).
[https://doi.org/10.3390/nu8040211]

-
Wirtz S, Neufert C, Weigmann B and Neurath MF. (2007). Chemically induced mouse models of intestinal inflammation. Nature Protocols 2:541-546.
[https://doi.org/10.1038/nprot.2007.41]

-
Yu LZ, Wang HY, Yang SP, Yuan ZP, Xu FY, Sun Chao and Shi RH. (2013). Expression of interleukin-22/STAT3 signaling pathway in ulcerative colitis and related carcinogenesis. World Journal of Gastroenterology. 19:2638-2649.
[https://doi.org/10.3748/wjg.v19.i17.2638]

-
Zhang YZ and Li YY. (2014). Inflammatory bowel disease: Pathogenesis. World Journal of Gastroenterology. 20:91-99.
[https://doi.org/10.3748/wjg.v20.i1.91]

-
Zhu L, Zhao Q, Yang T, Ding W and Zhao Y. (2015). Cellular metabolism and macrophage functional polarization. International Reviews of Immunology. 34:82-100.
[https://doi.org/10.3109/08830185.2014.969421]

