
육묘 트레이 셀 수, 육묘 기간 및 정식 시기가 백수오의 묘 소질과근경 수확량에 미치는 영향
1충청남도농업기술원 인삼약초연구소 팀장2충청남도농업기술원 딸기연구소 팀장
3충청남도농업기술원 인삼약초연구소 소장
4전북대학교 원예학과 교수
2Researcher, Strawberry Research Institute, CNARES, Nonsan 32914, Korea
3Director, Ginseng & Medicinal Plant Research Institute, CNARES, Geumsan 32723, Korea
4Professor, Department of Horticulture, Jeonbuk National University, Jeonju 54896, Korea
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Seed propagation has become the most popular method for rhizome production in Cynanchum wilfordii Radix. However, no systematic seed propagation systems have been established. This study was conducted to determine the effect of plug-tray cell number and nursery period on the seedling quality and rhizome yield of C. wilfordii and evaluate the suitability of transplanting time.
Seeds were sown from March 8 to April 21, 2022, at 15-day intervals, and the seedlings were grown in trays with varying cell numbers (50, 72, 105, and 128 cells) for 30, 40, or 50 days in a glass greenhouse. Seedlings grown in trays containing 105 cells for 40 days were transplanted from April 17 to June 1, 2023, at 14-day intervals. The results of the first experiment showed that the seedling quality of C. wilfordii improved with increasing cell volume of the plug-tray and with increasing nursery period. Overall, good seedlings were obtained when grown in trays of 50 cells for at least 40 days. The highest rhizome yield occurred in the 105-cell treatment when the seedlings were grown for 40 days or more. Regarding the effect of transplanting time on rhizome yield, the yield increased with advancing transplanting time. For example, fresh rhizome weight was approximately 95 g at the earliest time of transplanting on April 17, estimated at 309 ㎏․10a-1.
Seedling quality and rhizome yield improved with larger tray cells and longer nursery periods. The highest yield was achieved with seedlings grown in 105 cell trays for 40 days and transplanted in mid-April in the area of Chungcheongnam-Do.
Keywords:
Cynanchum wilfordii Radix, Nursery Periods, Plug Tray Cell Numbers, Seedling, Transplanting Times.서 언
백수오는 (Cynanchum wilfordii Radix)는 박주가리과에 속하는 다년생 덩굴성 식물로 중국과 일본, 한국에서 서식한다. 2년 – 3년 재배한 덩이뿌리를 생약재로 이용하고, 주요 성분으로는 gagaminine, cynandione A, cynanchone A, wilfoside KIN, wilfoside CIN 등이 있으며 (Lee et al., 2008), 효능으로는 자양 강장, 보혈 작용 등이 있다고 알려져 있고 (Hwang et al., 1999), 항산화 및 항균, 항간질, 항암 등이 생리 활성이 보고된 바 있다 (Kim et al., 2005).
백수오의 재배법에 관한 연구는 파종 시기 (Choi et al., 1996), 파종 방법 (Choi, 1998), 피복재배 시 파종 방법과 재식 밀도 (Kim et al., 2002), 종자 발아 (Hwang et al., 2012; Yoo et al., 2013) 등이 있으며, 번식 방법으로는 종자를 직파하는 종자 번식법과 근경을 잘라 번식하는 뿌리 나누기법이 있다 (Yoo et al., 2013).
뿌리 나누기법은 근경 수확 후 판매하고 남은 가는 근경을 사용하는 방법으로 (Choi et al., 1996; Kim et al., 2005), 3년생 종근을 이용할 경우에는 오히려 수량이 감소한다는 보고가 있다 (Yoo et al., 2013). 백수오의 생산효율을 높이기 위해 종자를 직파한 후 1년생 묘를 수확하고 이를 다음 해 종근으로 이용하는 것이 가장 적합하다는 연구 결과가 있으나 (Choi, 1998), 상품수량이 종자 직파 대비 3% 증수되어 1년생 종근 이용 효과가 크지 않아 농가에서 크게 활용되지 못하고 있는 실정이다.
농가에서는 관행적으로 채종 후 노지육묘 또는 직파해 왔으나 활착률 제고, 기계화 정식 등을 위해 공정육묘 체계의 도입이 요구되고 있다 (Nam et al., 2022). 공정육묘는 육묘 후 이식 재배 시 종자의 소모가 적어 경제적이고, 작물 생육의 균일성을 높일 수 있는 이점이 있다 (Calson et al., 1992; Kim et al., 2009).
플러그 트레이를 통한 육묘는 이식 과정 동안 뿌리 시스템이 방해받지 않고 유지됨에 따라 이식 후 빠르게 활착되어 생장이 빨리 재개될 수 있다는 장점이 있다 (Hochmuth et al., 2006).
다양한 플러그 트레이의 셀의 수와 크기에 따라 재식 밀도, 배지의 양, 공급되는 양·수분의 양이 달라지며, 이는 생육에 영향을 미치므로 적정한 셀의 수 및 크기의 선택이 중요하다 (Jang et al., 2014). 일반적으로 셀의 크기가 클수록 생육이 빠르고 육묘 기간이 길어지며, 정식 후 초기 생육 및 수량이 높은 것으로 보고되고 있다 (Shin et al., 2000; Kim et al., 2001; Kim et al., 2013). 그러나 사용하는 트레이의 셀 수가 적고 크기가 클수록 재식 밀도가 낮아져, 동일한 주 수의 묘 생산을 위해 더 많은 육묘 면적과 생산비가 요구되고, 이는 단위면적 당 묘의 생산성 감소로 이어진다.
농가의 인식 개선으로 플러그 묘 이식 재배 방법이 점차 확산되고 있으나 우량묘 생산 방법에 대한 연구가 충분하지 않다. 따라서 본 연구에서는 트레이의 셀 수와 육묘 기간이 유묘 소질과 정식 후 수량에 미치는 영향을 구명하는데 목적이 있다.
재료 및 방법
1. 실험 재료
실험 재료는 2021년에 채종하여 5℃에서 저장된 백수오 재래종 종자를 사용하였다. 육묘는 충청남도 금산군 인삼약초연구소 (36.1190° N, 127.4783° E) 유리온실 내에서 실시하였다.
유리온실 내 온도는 최저 15℃ 이하로 내려가지 않도록 관리하였고, 종자 파종을 위해 육묘 전용 경량상토인 원예범용 상토 (Baroker, Seoulbio. Co., Ltd., Eumsung, Korea)를 트레이에 충진하여 충분히 습윤시킨 뒤 셀 당 종자 1 립을 파종하였다.
2. 플러그 트레이 셀 수와 육묘 기간이 묘 품질과 근경 수량에 미치는 영향 구명
플러그 트레이 셀 수와 육묘 기간이 백수오의 묘 품질과 근경 수량에 미치는 영향을 구명하기 위한 실험을 2022년에 수행하였다. 정식일 5월 20일을 기준으로 육묘 기간 50, 40, 30일을 역산하여 각각 3월 30일, 4월 11일, 4월 21일에 백수오 종자를 다양한 셀 크기의 플러그 트레이에 파종하였다.
사용한 플러그 트레이 (World, Co., Ltd., Chuncheon, Korea)의 규격은 50, 72, 105 및 128 셀이었고, 셀 당 용적은 각각 72, 43, 30 및 25 ㎖로 확인되었다.
육묘 시험 기간 중 온도와 습도는 실외용 온실제어반 (AION-GMS-P, Aion ENG Co., Daejeon, Korea)을 사용하여 1 시간 간격으로 측정하였다. 일 평균온도는 24 시간 평균값으로 하였고, 적산 온도는 0℃ 이상의 일평균온도 누적값으로 산출하였다. 육묘 기간에 따른 평균온도는 각각 20.8, 20.5, 20.3℃였고, 상대습도는 대략 48%, 50%, 48%였다 (data not shown). 육묘 기간 별로 전 생육기간에 누적된 적산 온도는 각각 610.8, 816.8, 1034.3℃로 나타났다.
트레이 셀 수와 육묘 기간의 효과를 구명하는 시험에서 유묘의 형태적 특성과 묘 소질은 농촌진흥청 농업과학기술 연구 조사 분석기준에 준하여 출아율, 초장, 엽수, 하배축장, 엽면적, 생체중, 근중 및 내충격도 (Impact resistance)를 시험구 당 10 주씩 3 반복 임의로 채취하여 조사하였다 (RDA, 2012; Park et al., 2020).
내충격도는 유묘를 30 ㎝ 높이에서 낙하시켜 파손된 정도 (0 = 81% 이상 파손, 1 = 61 – 80% 파손, 2 = 41 – 60% 파손, 3 = 21 – 40% 파손, 4 = 1 – 20% 파손, 5 = 파손 전무)에 따른 지수 (0 – 5)로 나타내었다 (An et al., 2021).
정식했던 재배지의 토양은 사양토로서, 토양의 이화학성을 확인하였다 (㏗ 7.8, EC 1.02 dS·m-1, 유기물 함량 17.1 g·㎏-1, 유효인산 458.6 ㎎·㎏-1, Ex. K 0.1 c㏖c·㎏-1, Ex Ca 10.1 c㏖c·㎏-1, Ex. Mg 1.9 c㏖c·㎏-1). 시비는 10a 당 N – P2O5 – K2O를 각각 8 ㎏, 4 ㎏, 4 ㎏, 그리고 완숙퇴비 1,000 ㎏을 전량 기비로 시용한 후 점적관수 시설을 설치한 다음 흑색 비닐로 피복하였다.
정식 시 재식 거리는 조간 거리 30 ㎝, 주간 거리 20 ㎝로 하였으며 지주는 정식 60 일 후 직경 22 ㎜, 높이 2 m의 파이프를 열과 열 사이에 1 m 간격으로 설치하였고, 나일론 끈을 상단과 하단에 배열한 후 오이 재배용 네트를 부착시켜 덩굴을 유인하였다.
정식 후 165일 뒤 (2022년 11월 3일)에 수확한 근경의 생육 특성과 수확량을 조사하였다. 근경의 수, 길이 및 두께는 주근과 지근으로 구분하여 반복 당 5 개체를 측정하여 평균값으로 나타내었다.
3. 정식시기에 따른 근경의 생장특성 및 수확량 구명
정식시기에 따른 근경의 생장 특성 및 수확량을 구명하기 위해서 105 셀 트레이에 셀 당 1 립씩 정식시기에 맞추어 파종하여 시기별 40 일된 묘를 2023년 4월 17일, 5월 2일, 5월 17일 및 6월 1일에 정식하였다. 모든 시험에서 육묘 기간 중 관수는 1 일 1 회, 두상관수를 실시하여 생육에 알맞은 적습 상태가 되도록 하였다.
재배지의 관리 및 근경의 생육 특성과 수확량은 위 실험에서 언급한 것과 같은 방법으로 조사하였다.
4. 통계처리
모든 시험에서 시험구는 완전임의배치법 3 반복으로 배치하여 수행하였다. 통계분석은 SAS EG (SAS Institute Inc., Cary, NC, USA) 프로그램을 이용하여 분산분석 (ANOVA)을 실시하였다.
각 측정군의 평균과 표준편차 (means ± standard deviation)를 산출하고, 평균 간 유의성 비교는 5% 수준에서 Tukey’s Studentized Range Test (HSD)와 Duncan’s Multiple Range Test (DMRT)로 실행하였다 (*p < 0.05).
결과 및 고찰
1. 육묘 기간과 플러그 트레이 셀 수가 유묘 생장에 미치는 영향
이식 재배를 위한 육묘 시 육묘 기간과 플러그 트레이 셀의 수는 작물의 생육에 다양한 영향을 주는 것으로 알려져 있으며 (Kim et al., 2013), 백수오 플러그 묘 생육은 육묘 기간과 트레이 크기에 영향을 받는 것으로 확인되었다 (Table 1).
백수오 묘의 생육 특성 중 거의 모든 항목에서 육묘기간이 증가함에 따라 묘의 생장이 증가하는 것을 보였다. 엽장, 엽폭, 근중, 엽면적 및 내충격도는 육묘 기간 40 일과 50 일이 30일에 비해서 향상되었지만 통계적으로 유의적인 차이를 보이지 않았다. 육묘 기간별 트레이 크기의 생장 변화는 대부분 항목에서 30 일부터 유의한 차이가 있었는데, 대체적으로 셀의 용적이 증가할수록 생육이 향상되는 경향을 보였다.
묘의 초장은 육묘 기간 50 일 처리 시 50 셀 (17.0 ㎝) > 72 셀 (16.3 ㎝) > 128 셀 (15.9 ㎝) > 105 셀 (14.9 ㎝) 순으로 향상 효과를 보였는데, 이런 결과는 초장은 화분의 용량에 직접적으로 영향을 받는다는 연구 결과와 일치하였다 (Megersa et al., 2018). 유묘의 근 생체중은 트레이 셀의 용적이 가장 큰 50 셀 처리구에서 2.1 g으로 105 셀 (1.4 g)이나 128 셀 (1.3 g)에 비해서 1.6 배 증가하였다.
이러한 유묘의 생육의 차이는 플러그 트레이 셀의 수와 크기에 따라 재식밀도, 배지의 양, 공급되는 양·수분의 양이 다른데서 기인되었으며 (Jang et al., 2014), 황기 (Jeong et al., 2020), 자소엽, 산두근, 참당귀 (Oh et al., 2014), 황금줄사철 (Park et al., 2021) 등의 약용작물 외에도 다양한 원예작물에서 육묘 시 플러그 트레이 셀의 크기에 따라 생육의 차이가 있다는 결과와 일치하였다. Kim 등 (2019)은 플러그 트레이 셀의 크기가 작을 수록 정식시기가 빨라진다고 보고하였는데, 이는 트레이 셀의 크기가 작을수록 발근이 빠르고 또한 뿌리 돌림 현상인 분형근이 나타나기 때문이라고 설명하였다.
본 실험의 결과에서는 셀의 크기가 작을수록 분형근이 빨리 형성되긴 하였으나, 묘의 근중은 셀의 크기가 클수록 증가하는 경향이었다. 이는 플러그 용기의 셀 크기가 적어짐에 따라 근권이 제한되어 생육이 적은 것으로 보여진다. 그러나 유묘의 내충격도는 셀의 용적이 작을수록 증가하였는데 (Table 1), 이는 분형근 발생이 셀 용적이 작을수록 빨리 형성되었고, 형성된 분형근이 묘의 충격에 따른 손상 정도를 감소시켜 줄 수 있었기 때문으로 생각된다.
트레이 셀의 크기에 따라 재배되는 작물의 육묘기간이 달라지며 또한 플러그 셀의 크기에 따른 육묘 기간과 정식시기가 작물의 생육에 영향을 미치는 것으로 알려져 있다 (Kim et al., 2015; Kim et al., 2019).
백수오 육묘 시 플러그 트레이 셀의 크기에 따라 육묘 기간의 생육 변화를 확인한 결과, 묘의 소질은 트레이 셀의 용적이 증가할수록, 그리고 육묘 기간이 길수록 향상되는 것으로 나타났다. 특별히 50 셀 트레이에서 40 일 이상 육묘하였을 때 백수오 유묘의 전반적인 생육 특성이 향상되는 것으로 나타났다.
백수오 플러그묘 생산은 육묘 시 생육만으로 판단이 어려우며, 수확 시 수량을 고려해서 판단해야 함으로 수량에 저해가 발생하지 않는 육묘 일수와 적정한 플러그 셀 크기의 선발이 중요할 것으로 보인다.
2. 육묘 기간과 플러그 트레이 셀 수가 근경 수확량에 미치는 영향
플러그 트레이 셀 수에 따라 육묘된 백수오 묘를 정식한 후 165 일째 (11월 3일)에 수확하여 근경의 생육 특성 및 수량을 조사한 결과, 주근경의 수는 육묘 기간이 길어짐에 따라 증가하는 경향을 보였으나, 지근경의 수는 40 일 육묘 기간 처리구에서 가장 높은 것으로 관찰되었으며 이러한 육묘 기간의 영향은 근장에서도 유사하게 관찰되었고 주근경 수와 지근경 수 모두 105 셀 처리구에서 가장 높았다. (Table 2).

Effect of nursery period and plug tray cell number on rhizome growth characteristics of Cynanchum wilfordii at harvest.
셀의 수가 주근경장에 미치는 영향은 지근경장에 미치는 것에 비해서 미미하였는데, 105 셀에서 지근경장은 24.8 ㎝로 가장 길었다. 근경의 직경은 주근경의 경우 육묘기간 30 일과 50 일 처리구가 40 일 처리구에 비해 더 두꺼웠던 반면, 지근경의 직경은 40 일 육묘기간 처리가 30 일과 50 일 처리구에 비해 더 두꺼웠다.
트레이 셀의 수가 근경의 두께에 미치는 영향을 살펴보면, 근경의 직경은 근경의 종류에 상관없이 105 셀에서 가장 두꺼운 경향을 보였다. 일반적으로 주 당 생근경중은 육묘 기간이 늘어날수록 증가하였다. 트레이 셀의 수가 근경중에 미치는 영향을 살펴보면 근경 수가 많고 근경이 가장 굵었던 105 셀 처리구에서 약 169 g으로 가장 높았는데, 이러한 결과는 육묘기간 40 일과 50 일 처리구에서 분명하게 관찰되었다 (Table 2).
백수오의 근경수량은 육묘 기간이 길수록 증가하지만, 흥미롭게도 육묘 시 묘의 생장에 우수했던 트레이 셀 수가 수확 후 근경의 수량 증가로 이어지지 않았다.
Kim 등 (2015)과 Shin 등 (2000)은 적정한 묘령의 플러그 묘가 초기 생육과 수량에 유리하다고 보고한 바와 같이 본 연구에서 가장 높은 근경 수확량은 트레이 105 셀 처리구에서 관찰되었는데, 이 처리구에서 묘의 품질은 대체적으로 트레이셀의 용적이 더 큰 50 셀이나 70 셀 처리구에 비하여 좋지않았다. 이에 대한 이유를 밝히기 위해서 추가적인 연구가 필요할 것으로 생각한다.
3. 정식시기가 근경 지하부 생육과 수확량에 미치는 영향
40 일간 육묘한 유묘를 2023년 4월 17일, 5월 2일, 5월 17일 및 6월 1일에 정식한 후 10월 31일 일시 수확하여 각 정식 시기 처리별로 주근경과 지근경의 수, 근경 길이, 근경 굵기 및 생근경중을 조사하였고, 또한 10 a 당 총 근경 수량을 계산하였다 (Table 3).

Effect of transplanting time on the rhizome growth characteristics of Cynanchum wilfordii at harvest.
근경 수는 근경의 종류에 상관없이 정식 시기에 영향을 받지 않았지만, 근경의 길이는 주근경과 지근경 모두에서 정식 시기가 늦어질수록 증가하는 것으로 나타났다. 가장 늦은 6월 1일 정식 시 주근경과 지근경은 각각 28.6 ㎝와 22.9 ㎝로 가장 길게 나타난 반면, 근경의 비대는 정식 시기가 빠를수록 증가하였다. 주근경의 경우 정식 시기가 이를수록 근경 직경은 증가하였으나, 측근경의 직경은 정식이 가장 빨랐을 때 (4월 17일)가 다른 3 가지의 처리구에 비해 유의적으로 두꺼웠다. 예를 들어, 4월 17일 처리구에서 주근경의 직경은 22.9 ㎜로 가장 굵었고, 지근도 10.3 ㎜로 유의하게 굵었다.
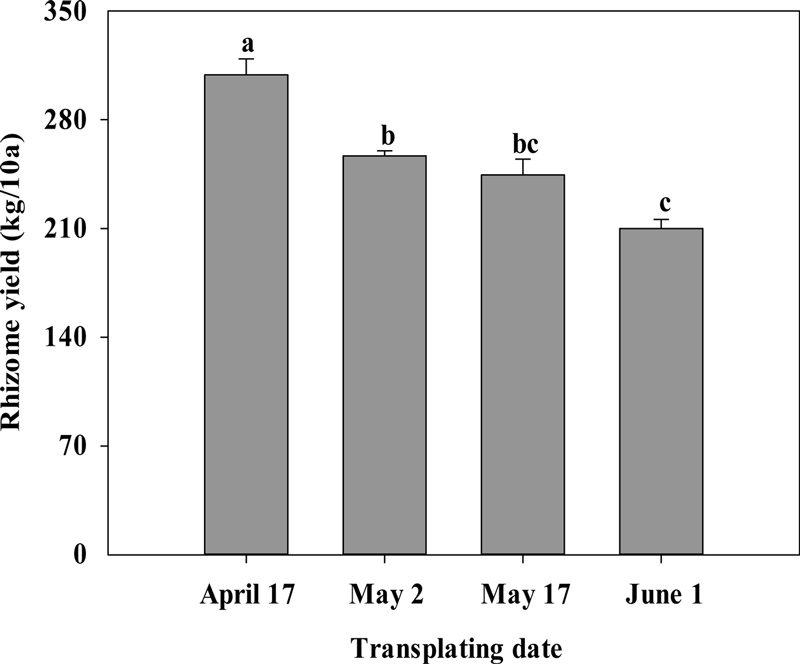
Effect of transplanting time on rhizome yield per 10 a of Cynanchum wilfordii. Vertical bars represent standard deviation of means (n = 3).
주 당 생근경의 무게는 정식시기가 빠를수록 증가하였다 (Table 3). 예를 들어, 4월 17일 처리구에서 생근경중은 95.1 g으로 가장 높았다. 이 수량을 10 a로 환산하였을 때 총근경수량은 4월 17일 처리구에서 308.9 ㎏으로 가장 많았는데, 정식 시기가 늦어질수록 근경 수량은 감소하였다. 6월 1일에 정식할 경우, 근경 수량은 4월 17일 처리구에 비하여 32% 가량 감소하였는데, 그 원인으로는 정식시기가 늦어질수록 충분한 생육기간 확보를 하지 못한 것으로 생각된다.
다른 연구에서도 재식 시기가 식물의 생장과 수량 특성에 영향을 미친다고 보고된 바, 식방풍의 경우 3월 20일에 비하여 4월 10일 파종은 근직경과 측근수에서 생육이 저하되었고 (Chung et al., 1994), 지황의 2 기작 재배에서 재식 시기가 빠를수록 생육 지연없이 수확이 가능하였으며 (Kwon, 2024), 당귀의 뿌리 형질은 정식 시기가 빠를수록 형질이 우수하였다 (Yu et al., 2003).
본 연구에서도 유사한 결과를 보여 백수오 육묘 재배 시 정식 시기를 앞당겨 재배기간을 늘리면 수량 증대에 도움이 될 것으로 보여진다.
본 연구에서는 플러그 트레이를 활용한 백수오 육묘 시 생육에 유리한 적정 규격 및 육묘기를 찾고, 이식 시기가 정식 후 수량에 미치는 영향을 구명하고자 하였다. 그 결과 플러그 트레이의 규격과 육묘 기간은 백수오 유묘 생육에 영향을 미치는 것을 확인하였다.
플러그 트레이 규격은 72 셀과 128 셀 규격에서 초장이 길었으나, 오히려 높은 재식밀도에 의한 도장으로 묘의 소질이 저하되어 이식 후 수량 면에서는 105 셀에서 가장 유리하였다. 육묘 기간은 초장과 분형근 상태를 고려하여 40 일 이상의 일수를 확보하는 것이 적절하다고 판단된다.
적정 이식 시기는 충분한 생육기간을 확보함으로써 뿌리의 부피생장을 촉진시키기 위하여 4월 17일에 이식하였을 때, 수량 증대에 유리하였다.
따라서 연구결과들을 종합해보면, 농가에서 백수오의 육묘 이식 재배를 활용하기 위해서는 트레이 105 셀에 파종하여 40일이상 육묘하여 늦어도 4월 중순에 정식하여 재배하는 것이 근경의 수량 증진에 유리할 것으로 생각된다. 하지만 다른 요인들, 예를 들면 재배지 토성, 재배관리 방법 및 다른 환경적 요인들도 백수오의 재배 및 수확량에 영향을 미칠 것으로 판단되어 더욱 종합적인 연구가 필요하다고 생각한다.
References
- An DH, Cha YL, Kim KS, Shin WC and Lee JE. (2021). Evaluation of rapeseed seedling quality according to varieties and seedling ages for spring cultivation transplanting. Korean Journal of Crop Science. 66:256-264.
-
Calson WH, Kaczperski MP and Rowley EM. (1992). Bedding plants. In Larson RA. (eds.). Introduction to floriculture. Academic Press. New York. NY, USA. p.511-550.
[https://doi.org/10.1016/B978-0-12-437651-9.50025-7]

-
Chang A, Kwak BY, Yi KT and Kim JS. (2012). The effect of herbal extract(EstroG-100) on pre, peri and post menopausal women: A randomized double blind, placebo controlled study. Phytotherapy Research. 26:510-516.
[https://doi.org/10.1002/ptr.3597]

- Choi IS, Son SY, Cho JT, Park JS, Han DH and Chung IM. (1996). Effect of seeding date on the growth and yield of Cynanchum wilfordii Hemsly. Korean Journal of Medicinal Crop Science. 4:114-118.
- Choi IS. (1998). Effects of seedling ages on growth and yield of Cynanchum wilfordii Hemsly. Korean Journal of Medicinal Crop Science. 6:121-125.
- Chung SH, Kim KJ, Suh DH, Lee KS and Choi BS. (1994). Changes in growth and yield of Peucedanum japonicum Thunberg by planting time, mulching, and planting density. Korean Journal of Medicinal Crop Science. 2:121-126.
-
Hochmuth G, Cantliffe D, Chandler C, Stanley C, Bish E, Waldo E and Duval J. (2006). Containerized strawberry transplants reduce establishment-period water use and enhance early growth and flowering compared with bare-root plants. Hort Technology. 16:46-54.
[https://doi.org/10.21273/HORTTECH.16.1.0046]

-
Hwang BY, Kim YH, Ro JS, Lee KS and Lee JJ. (1999). Acetophenones from the roots of Cynanchum wilfordii Hemsley. Archives of Pharmacal Research. 22:72-74.
[https://doi.org/10.1007/BF02976439]

-
Hwang IS, Yoo JH, Seong ES, Lee JG, Kim HY, Kim NJ, Lee JD, Ham JK, Ahn YS, Kim NY and Yu CY. (2012). The effect of temperature and seed soaking on germination in Cynanchum wilfordii(Maxim.) Hemsl. Korean Journal of Medicinal Crop Science. 20:136-139.
[https://doi.org/10.7783/KJMCS.2012.20.2.136]

-
Jang YA, Lee HJ, Choi CS, Um YC and Lee SG. (2014). Growth characteristics of cucumber scion and pumpkin rootstock under different levels of light intensity and plug cell size under an artificial lighting condition. Journal of Bio-Environment Control. 23:383-390.
[https://doi.org/10.12791/KSBEC.2014.23.4.383]

-
Jeong HW, Kim HM, Lee HR, Kim HM and Hwang SJ. (2020). Growth of Astragalus membrannaceus during nursery period as affected by different plug tray cell size, number of seeds per cell, irrigation interval, and EC level of nutrient solution. Korean Journal of Horticultural Science and Technology. 38:210-217.
[https://doi.org/10.7235/HORT.20200020]

- Kim CK, Oh JY and Kang SJ. (2001). Effect of plug cell size and seedling age on growth and yield of Chinese chives(Allium tuberosum R.). Journal of the Korean Society for Horticultural Science. 42:167-170.
-
Kim HC, Cho YH, Ku YG and Bae JH. (2015). Seedling qualities of hot pepper according to seedling growth periods and growth and yield after planting. Korean Journal of Horticultural Science and Technology. 33:839-844.
[https://doi.org/10.7235/hort.2015.15083]

- Kim MJ, Kim IJ, Nam SY, Lee CH and Song BH. (2002). Effects of sowing method and planting density on growth and root yield of Cynanchum wilfordii Hemsly. Korean Journal of Medicinal Crop Science. 47:418-421.
- Kim MJ, Song BH, Nam SY, Kim IJ, Lee CH and Yun T. (2005). Effects of nonsupporting methods on growth and yield of Cynanchum auriculatum Royle ex Wight. Korean Journal of Medicinal Crop Science. 13:268-272.
-
Kim SE, Lee MH, Ahn BJ and Kim YS. (2013). Effects of spacing and plug cell size on seedling quality and yield and qualities of tomatoes. Protected Horticulture and Plant Factory. 22:256-261.
[https://doi.org/10.12791/KSBEC.2013.22.3.256]

- Kim SK, Jung TW, Lee YY, Song DY, Yu HS, Lee CW, Kim YG, Kwak CG and Jong SK. (2009). Effect of nursery stage and plug cell size seedling growth of waxy corn. Korean Journal Crop Science. 54:407-415.
-
Kim YS, Park YG and Jeong BR. (2019). Seedling quality and early growth and fruit productivity after transplanting of squash as affected by plug cell size and seedling raising period. Protected horticulture and plant factory. 28:185-196.
[https://doi.org/10.12791/KSBEC.2019.28.3.185]

- Kwon AR. (2024). Development of double cropping cultivation techniques of Rehmannia glutinosa Libosch. for reduction of replant failure via soil fumigation and identification of related fungal strains. Ph. D. Thesis. Jeonbuk National University. p.41-46.
-
Lee EJ, Jang M, Lim TG, Kim TS, Ha HI, Lee JH, Hong HD and Cho CW. (2020). Selective activation of the estrogen receptor-β by the polysaccharide from Cynanchum wilfordii alleviates menopausal syndrome in ovariectomized mice. International Journal of Biological Macromolecules. 165:1029-1037.
[https://doi.org/10.1016/j.ijbiomac.2020.09.165]

- Lee HW, Park SY, Lee AY, Chae SW, Choi GY, Choo BG and Kim HK. (2008). Quantitative analysis of Cynanchum wilfordii Hemsley. Korean Journal of Oriental Medicine. 14:107-111.
- Lee JH and Kwon KT. (2012). Determination of harvest time and nominal origin from Cynanchi wilfordii Radix. Journal of Korean Medicine. 33:160-168.
- Megersa HG, Lemma DT and Banjawu DT. (2018). Effects of plant growth retardants and pot sizes on the height of potting ornamental plants: A short review. Journal of Horticulture. 5:1-5.
- Ministry of Agriculture, Food and Rural Affairs (MAFRA). (2023). 2022 an actual output of crop for a special purpose. Ministry of Agriculture, Food and Rural Affairs. Sejong, Korea. p.6.
-
Nam HH, Kim KS and Kim BS. (2022). Seed harvesting and seedling raising methods for seedling production in Angelica dahurica. Korean Journal of Medicinal Crop Science. 30:180-186.
[https://doi.org/10.7783/KJMCS.2022.30.3.180]

-
Oh HJ, Park YG, Park JI and Jeong BR. (2014). Effect of cell size on growth and development of plug seedlings of three indigenous medicinal plants. Protected Horticulture and Plant Factory. 23:71-76.
[https://doi.org/10.12791/KSBEC.2014.23.2.71]

-
Park JH, Yoon YH and Ju JH. (2021). Effect of cell size and seedling raising stage on growth of cuttings form Euonymus fortunei 'Emerald and Gold' seedlings in a plug tray. Journal of Environmental Science International. 30:685-691.
[https://doi.org/10.5322/JESI.2021.30.8.685]

- Park JK, Han WY, Han KS, Ryu JS, Won OJ, Jeong TU, Yoon YH and Bae JW. (2020). Seedling soils and tray types mediate growth characteristics of perilla seedlings. Korean Journal of Crop Science 65:63-71.
- Rural Development Administration (RDA). (2012). Criteria for agricultural research and investigation. Rural Development Administration. Wanju, Korea. p.407-413.
- Shin YA, Kim KY, Kim YC, Seo TC, Chung JH and Pak HY. (2000). Effect of plug cell size and seedling age on seedling quality and early growth after transplanting of red pepper. Korean Journal of Horticultural Science and Technology. 41:49-52.
-
Yoo JH, Seong ES, Lee JG, Kim CJ, Choi JH, Lee GH, Hwang IS, Hang EB, Lee JD, Ahn YS, Park CB and Yu CY. (2013). Comparison of the characteristics of seed germination and the first stage of growth in Cynanchum wilfordii(Maxim.) by different light conditions. Korean Journal of Medicinal Crop Science. 21:329-333.
[https://doi.org/10.7783/KJMCS.2013.21.5.329]

- Yu HS, Jo JS, Park CH, Park CG, Sung JS, Park HW, Seong NS and Jin DC. (2003). Plant growth and bolting affected by transplanting time in Angelica gigas. Korean Journal of Medicinal Crop Science. 11:392-396.