
해당화 물 추출물의 급성독성 및 유전독성에 관한 연구
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Rosa rugosa Thnub. water extract (WRT) has been used as a folk medicine with various pharmacological properties for a long time in Asia. This study was conducted to evaluate the acute and genetic toxicity of WRT.
No test substance-related deaths, clinical signs, weight changes, or macroscopic manifestations were observed in Sprague-Dawley (SD) rats or Institute of Cancer Research (ICR) mice test animals. WRT did not increase the number of revertant colonies of Salmonella typhimurium or Escherichia coli strains in the presence or absence of metabolic activity. Moreover, it did not induce structurally abnormal chromosomes in Chinese hamster lung (CHL) cells with or without metabolic activity, which did not increase by more than 2-fold compared to that in the negative controls. In the in vivo micronucleus test, WRT did not affect the formation of micronuclei compared with the the negative control.
Acute toxicity test for WRT extract in SD rats did not reveal any clinical signs and weight loss. Ames test, in vitro mammalian chromosomal aberration, and in vivo micronucleus test did not reveal WRT genotoxicityt.
Keywords:
Rosa rugosa Thunb., Acute Toxicity, Ames Test, Acute Mammalian Chromosomal Aberration Test, Micronucleus Test서 언
해당화 (Rosa rugosa Thunb.)는 장미과에 속하는 넓은 잎의 교목으로 동아시아 지역에 널리 분포하며 꽃은 매괴화 (玫瑰花)라 부르고 5월 - 6월에 피는 것으로 알려져 있다. 해당화는 예로부터 한의학적으로 이기 [理氣, 기를 다스려 기체 (氣滯), 기역 (氣逆), 기허 (氣虛)증을 치료], 해울 [解鬱, 막힌 기 (氣)를 풀어 기체 (氣滯)를 치료], 화혈 [和血, 혈 (血)이 부족하거나 뭉친 것을 고르게 해줌], 및 산어 [散瘀, 어혈을 없애고 부기를 가라앉힘] 효능이 있어 위통, 당뇨, 설사 등 민간요법 치료제로 이용되어 왔다 (Altıner and Kılıçgün, 2008).
해당화는 vitamin C와 유기산이 풍부하며 꽃은 strictinin, pedunculagin, 가수분해형 탄닌, tellimagrandin I, tellimagrandin II, rugosin A, rugosin G 등의 성분을 가지고 있다. 해당화의 뿌리는 quercetin, campesterol, glucopyranoside 등의 플라보노이드 성분이 함유된 것으로 보고되었다 (Park, 2008; Kang and Sohn, 2010; Kim and Lee, 2018; Kwak et al., 2019).
유효성 분야에서 염증반응에 대한 해당화의 효능이 연구되었는데, interleukin (IL)-6 매개성 질환을 예방하고, 염증 유발 물질인 lipopolysaccharide에 의한 nitric oxide 분비를 억제하는 것으로 보고되었다 (Ahn and Hyun, 2022; Kim et al., 2022).
해당화를 비롯한 여러 한약재는 민간요법으로 자주 이용되고 있지만 일부 한약재가 잠재적인 독성 (Kim et al., 2008)을 가진다고 보고되고 있고 약용작물 또는 한약제제로 이용되는 생약재의 안전성 정보 확보가 미흡하다고 알려져 있다 (Jung et al., 2018).
안전성 정보는 제품개발을 위해 필수적이기 때문에 약용작물의 안전성 정보를 확보하는 것은 향후 약용작물을 이용한 제품개발의 기초자료로 활용될 수 있다. 해당화는 혈중 중성 지방을 낮추는 효과가 탁월한 것으로 보고 됨에 따라 기능성 식품으로서의 이용 및 의약품 소재로서 주목을 받고 있다 (Choi et al., 2011; Nho et al., 2019).
본 연구는 해당화 물 추출물의 안전성 정보를 제공하기 위해 식약처 가이드라인에 따른 설치류 급성독성평가와 OECD 가이드라인에 따라 박테리아를 이용한 복귀돌연변이시험, 포유류 배양세포를 이용한 염색체이상시험 및 설치류 조혈세포를 이용한 소핵시험을 포함한 유전독성시험을 수행해 안전성 정보를 얻어 해당화를 이용한 연구와 제품 개발에 기여하고자 한다.
재료 및 방법
1. 시료 제작
2020년 7월 하순 신안군에서 재배되고 있는 것으로부터 크기, 모양과 색깔을 지닌 해당화 0.9 ㎏를 원료로 제작하였다. 해당화는 분쇄기 (RT-04, Mill-Tech, Tainan, Taiwan)를 이용하여 분쇄하여 얻어진 시료를 한약 추출용 부직포에 넣었다. 10 ℓ의 정제수를 첨가한 후 환류 추출기 (COSMOS 660, Kyungseo E&P, Incheon, Korea)를 이용하여 105℃, 3 시간의 조건으로 3 회, 추출 후 대형 회전 감압농축기 (Eyela, NVC-2200, Bohemia, NY, USA)를 이용하여 55℃, 30 hPa에서 농축하여 10 brix 내외의 표준 추출물을 제작하였다.
표준 추출물은 초저온냉동고 (TSE600D, Thermo scientific, Waltham, MA, USA)에 –70℃ 조건으로 동결하였으며 동결된 추출물은 동결건조기 (LYOPH-PRIDE 20R, IlShin Lab Co., Ltd., Dongducheon, Korea)로 옮겨 106 시간 동안 동결건조하고 402 g을 획득하였다 (수율: 약 44.7%).
상기 방법으로 제조된 해당화의 물 추출물을 WRT (water extract from Rosa rugosa Thnub.)로 명기하고 멸균수에 녹여 농도별 시료를 제조하였으며 각 시험에 사용하였다.
2. 실험동물
급성독성평가를 위한 실험동물은 약 6주령, 수컷 (체중: 211.2 g - 231.7 g)과 암컷 (체중: 172.2 g - 192.2 g) Sprague-Dawley (SD) 랫드를 사용하였으며, 설치류 골수세포를 이용한 소핵시험에서는 약 7주령, 수컷 (체중: 30 g - 35 g), 암컷 (체 중: 20 g - 25 g) ICR 마우스를 오리엔트바이오 (Seongnam, Korea)에서 구입하여 사용하였다.
Specific Pathogen Free animals (SPF) 동물실의 사육환경은 온도를 20 ± 3℃, 상대습도는 38.0% - 65.0%, 명암주기를 12 시간으로 조정하였고, 사육실의 조도는 150 ∼ 300 lux로 하였고, 환기횟수를 시간당 15 회 이상, 소음에 대한 노출은 60 ㏈ 이하로 하였고 암모니아의 농도는 20 ppm 이하를 나타낼 수 있도록 유지하였다.
SD 랫드는 스테인리스 철망 사육 상자 [260 ㎜ (width) × 350 ㎜ (dimension) × 210 ㎜ (height)]에 1 마리씩, ICR 마우스는 폴리카보네이트 사육 상자에 깔짚 (BETA CHIP, Northeastern Products Corporation, Warrensburg, NY, USA)을 깔아 3 마리씩 사육했다.
고형사료 (PMI LabDiet 5053, PMI Nutrition International, St. Louis, MO, USA)와 음수를 자유롭게 섭취하도록 하고 사육 상자와 및 급이기는 주 2 회로 교체하였다. 음수는 먹는 물 수질기준 및 검사 등에 관한 규칙 (환경부령 제833호, 물 환경보존법 시행규칙, 2019. 12. 20)에 따라 분석하고 오염이 없는 것을 확인한 뒤 동물에게 제공하였다.
모든 동물은 5 일 동안 순화 기간을 거치면서 일반증상 (외관, 태도, 이상 반응 등)을 확인한 뒤 실험에 사용하였으며 일반증상의 관찰은 폐사, 피부, 안구, 호흡, 점막, 자율, 순환계, 중추 신경계, 신체 운동, 행동 유형, 경련, 진전, 유연 및 수면 등을 포함하였다 (Mota et al., 2009).
모든 실험동물 실험은 동물보호법 (법률 제4379호, 1991. 5. 31, 개정법률 제14651호, 2017. 3. 21)에 근거하여 단회투여시험 동물실험 (승인번호: NIKOM-2020-021)과 설치류 골수세포를 이용한 소핵시험 동물실험 (승인번호: NIKOM-2021-006)에 대하여 한약비임상시험센터의 동물실험윤리위원회로부터 검토, 심의 및 승인을 받아 진행하였다.
3. 급성독성평가
순화가 끝난 동물은 체중이 평균 체중의 ± 20% 내에 있는지 확인하고 암/수 모두 무작위로 군 당 5 마리씩 배정했다. 음성대조군은 멸균 증류수를, 시험물질군은 WRT 500 ㎎/㎏, 1,000 ㎎/㎏ 및 2,000 ㎎/㎏의 용량으로 구분했다.
실험 시작일에 WRT를 단회경구투여하고 투여 직후 30 분, 1 시간, 2 시간 및 4 시간에 일반증상을 관찰했다. 투여 당일 일반증상 관찰을 끝내고 14 일 동안 1 일 1 회, 일반증상을 확인했다. 체중은 투여일 (실험시작일, 0일)로부터 1 일, 3 일, 7 일, 14일에 측정하였다. 실험종료일 (14 일)에 실험동물은 CO2 흡입을 통해 희생시키고, 부검을 통해 장기의 이상 발생 여부를 육안으로 관찰하였다.
4. 박테리아를 이용한 복귀돌연변이 시험
균주는 Salmonella typhimurium TA98, TA100, TA1535 및 TA1537를 Molecular Toxicology (MOLTOX, Boone, NC, USA)로부터 구입해 사용하였다.
양성대조물질로 sodium azide (SA), 2-nitrofluorene (2-NF), 2-aminoanthracene (2-AA), 9-aminoacridine (9-AA), benzo [a]pyrene (B[a]P)을 Sigma-Aldrich (Saint Louis, MO, USA)에서 구입하여 사용하였으며 (Gee et al., 1998), 대사 활성화를 위한 S9 (11-05L.2, MOLTOX, Boone, NC, USA)과 보조효소 (309-50611, Oriental yeast, Tokyo, Japan)는 S9 mix의 농도가 5%가 되도록 조제하여 사용하였다.
시험 조건은 전배양법을 통해 군별로 2 개의 플레이트를 사용하였고 (Meijerhof, 1992), 시험군은 대사활성계 비적용 (-S9 mix) 또는 적용 (+S9 mix) 2 가지 계열로 나누어 실시하였으며 음성대조군은 멸균 증류수를, 시험물질군은 WRT를 4.88, 19.5, 78.1, 31.3, 1,250 및 5,000 ㎍/plate 용량을, 양성대조군은 균주별 양성대조물질을 사용했다.
음성대조물질, 시험물질 및 양성물질을 100 ㎕, pH 7.4 인산완충액 또는 S9 mix 500 ㎕, 균주현탁액 100 ㎕의 순서로 시험관에 각각 넣고 진탕배양기 (VS-1205SW, Vision Scientific, Daegu, Korea)에서 37℃, 120 rpm 조건으로 20 분 동안 진탕배양 하였다. 진탕배양이 끝나고 혼합액에 아미노산을 첨가한 top agar 2 ㎖을 섞고 minimal glucose agar plate에 도말하였다. 플레이트는 배양기 (LIB-150M, Labtech, Jeonju, Korea)에서 37℃ 조건으로 48 시간 동안 배양했다.
배양 종료 후에는 현미경 (E-200, Nikon, Tokyo, Japan)을 이용하여 기본성장균층 (background lawn)의 형태를 관찰한 뒤 육안으로 복귀변이 colony 수를 계수하였다.
5. 포유류 배양세포를 이용한 체외 염색체이상시험
CHL/IU 세포 (CRL-1935)는 American Type Culture Collection (ATCC, Rockville MD, USA)으로부터 구입해 사용하였으며 양성대조물질인 mitomycin C (MMC)와 benzo[a]pyrene (B[a]P)는 Sigma-Aldrich (Saint Louis, MO, USA)에서 구입하여 사용하였고 대사 활성화를 위한 S9과 보조효소는 S9 mix의 농도가 30%가 되도록 조제하여 사용하였다.
실험 계열은 대사활성계 적용 단시간처리 (6 시간), 대사활성계 미적용 단시간처리 (6 시간) 및 대사활성계 미적용 장시간처리 (22 시간)로 분류하였다.
각 계열별로 음성대조군은 멸균증류수를, 시험물질은 WRT 1.953, 7.81, 31.3, 125, 500 및 2,000 ㎍/㎖를, 양성대조군은 MMC 0.1 ㎍/㎖ 또는 B[a]P 20 ㎍/㎖를 적용해 분류하였다. 각 그룹별 2 개 배양 용기를 사용하고 세포 독성 지표인 상대 세포수 [relative increase in cell counts (RICC)]를 산출하여 세포독성을 확인하였으며 RICC 계산식은 다음과 같이 하였다.
검체 제작 2 시간 전 colcemid를 처리해 중기세포를 유도하고 세포를 떼어낸 뒤 고정과정을 통해 슬라이드에 도말하였다. 슬라이드는 5% Giemsa’s 염색약을 사용해 염색하고 검체 판독은 그룹당 300 개의 중기세포를 관찰하고 염색체 구조 이상 유무를 평가했다. Giemsa's 염색약은 Sigma-Aldrich (Saint Louis, MO, USA)에서, colcemid는 Gibco (Walthem, Massachusetts, USA)에서 구입하여 사용하였다.
6. 설치류 조혈세포를 이용한 체내 소핵시험
양성대조물질인 mitomycin C (MMC)는 Sigma-Aldrich (Saint Louis, MO, USA)에서 구입하여 사용하였다.
순화 기간을 거친 동물의 체중을 측정하고 체중이 평균 체중 대비 ± 20% 이내에 분포한 동물을 각 그룹에 세 마리씩 무작위로 배정하였고 그룹은 음성대조군, 실험물질군 및 양성 대조군으로 분류하였으며 음성대조군은 멸균 증류수를, 시험 물질군은 WRT 7.81 ㎎/㎏, 31.3 ㎎/㎏, 125 ㎎/㎏, 500 ㎎/㎏ 및 2,000 ㎎/㎏ 용량으로 하였으며, 양성대조군은 MMC 2 ㎎/㎏을 사용하였다.
음성대조물질과 시험물질은 1 일 1 회, 24 시간 간격으로 2 일 동안 경구 투여하였고, 양성대조물질인 MMC는 물질투여 2 일 차에 1 회 복강투여하였다. 일반증상은 투여 후 3 일 동안 1 일 1 회로 관찰하였고, 체중은 실험물질 투여 전과 부검 전에 측정했다.
동물을 CO2 흡입을 유도해 희생시키고, 대퇴골에서 골수를 채취하였으며 채취한 골수는 4℃, 1,000 rpm 조건에서 5 분 동안 원심분리한 후 상층액을 제거하고 슬라이드에 도말해 검체를 제작하였다.
슬라이드 당 4,000 개의 다염성 적혈구 (polychromatic erythrocyte, PCE)를 관찰하고, 소핵 다염성 적혈구 (micronucleated polychromatic erythrocyte, MNPCE)의 빈도를 측정하고 골수 독성을 평가하기 위해 정염성 적혈구 (normochromatic erythrocyte, NCE)와 다염성 적혈구를 계수해 전적 혈구 수 (PCE+NCE)를 얻고 이를 정염성 적혈구 수로 나누어 비율을 구하였다.
7. 통계분석
통계분석은 SPSS 통계프로그램 (Statistical Package for the Social Sciences (version 25, IBM Corp., Armonk, NY, USA)을 이용하여 평균과 표준편차를 산출하였다.
체중과 소핵발생율의 유의성 검정은 일원배치 분산분석 (one-way ANOVA)을 실시한 후 5%의 유의수준에서 Duncan’s Multiple Range Test를 통해 이루어졌다 (DMRT, p < 0.05). 염색체이상시험에서 염색체이상 발생률의 군간 비교는 Fisher’s exact test를 실시해 비교했다.
결 과
1. 급성독성 평가
투여일과 투여 후 1 일, 3 일, 7 일 및 14 일에 체중과 일반증상을 관찰한 결과, 2,000 ㎎/㎏ 용량으로 WRT를 투여 한 수컷 랫드는 3 일차에 음성대조군과 비교하여 통계학적으로 유의한 차이를 나타내었다 (p < 0.05). 하지만 이런 차이는 실험종료일 (14 일)에 음성대조군의 체중이 증가되면서 통계학적 유의성이 나타나지 않았다 (Table 1).
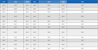
Body weight changes of rats in acute toxicity assessment of water extract from Rosa rugosa Thnub (g).
일반증상은 실험동물의 폐사 (death), 피부 (skin), 안구 (eyes), 호흡 (respiratory system), 점막 (mucous membranes), 자율 (autonomic), 순환계 (cirulatory), 중추신경계 (central nervous system), 신체운동 (somatomotor activity), 행동유형 (behavior pattern), 경련 (convulsion), 진전(tremor), 경련 (convulsion), 유연(salivation) 및 수면 (sleep) 등을 관찰하였으며, 모든 실험개체군에서 특이적인 증상은 나타나지 않았다. 부검 시 피 부, 꼬리, 귀, 비장, 위, 십이지장, 맹장, 직장, 췌장, 간, 담낭, 부신, 신장 등 미세장기를 제외하고 관찰한 결과 특이적인 부검 소견은 없었다.
따라서 WRT 단회 투여는 랫드 암/수 모두에게 급성독성을 유발하지 않는 것으로 판단된다.
2. 복귀돌연변이시험
Background lawn 형성을 관찰한 결과 WRT 처리에 의한 독성은 확인되지 않았다 (Table 2).
복귀돌연변이시험은 전통적으로 음성대조군과 비교해 colony 수가 2 배 이상 증가하였을 때 유전자 변이를 일으킨 것으로 간주한다고 하였다 (Cariello and Piegorsch, 1996). 각 균주의 colony를 계수한 결과, 양성대조군은 음성대조군과 비교하여 평균 colony 수가 2 배 이상 증가하여 실험의 적합성을 확인했다. 용량별 WRT 처리군은 음성대조군과 비교하여 colony 평균 수가 2 배 이상 증가하지 않는 것을 확인하였다. 따라서 WRT는 본 시험조건에서 유전자 변이를 유발하지 않는 것으로 판단된다.
3. 염색체이상시험
세포 독성을 알아보기 위해 RICC를 산출한 결과, 모든 계열의 500 ㎍/㎖ 및 2,000 ㎍/㎖ 농도의 RICC 비율이 50% 이하로 감소된 것을 확인하였다 (Table 3). 세포독성 비율이 50% 이상이면 세포독성에 의한 위양성 결과를 나타낼 수 있기 때문에 분석에서 제외하였다 (Galloway, 2000).
세포독성이 나타난 농도를 제외하고 검체를 판독한 뒤 그룹 간 fisher’s exact test를 수행한 결과, WRT 처리군과 음성대조군 간 통계학적 유의성이 확인되지 않았다 (p > 0.05). 양 성대조군은 음성대조군과 비교하여 통계학적 유의성을 나타내었다 (p < 0.05).
본 시험조건에서 WRT를 CHL/IU 세포에 처리했을 때 염색체에 구조적 이상을 유발하지 않는 것으로 판단된다.
4. 소핵시험
투여 직전 또는 희생일에 체중과 일반증상을 관찰한 결과 일부 그룹 간 체중의 통계학적 유의성이 나타났고 특이적인 일반증상은 관찰되지 않았다 (Table 4).
PCE/(PCE+NCE)의 빈도를 계산한 결과 WRT 투여에 의한 골수 독성은 관찰되지 않았다. 다염성 적혈구 중 소핵을 갖는 적혈구의 출현빈도 (MNPCEs)를 계수한 결과, 양성대조군의 소핵 출현 빈도는 음성대조군에 비해 통계학적 유의성을 나타냈다 (p < 0.05).
WRT 처리군의 소핵 출현빈도를 음성대조군과 비교한 결과 통계학적 유의성이 나타나지 않는 것으로 확인되었다.
따라서 본 시험조건에서 WRT는 설치류 골수에 소핵 형성을 유발하지 않는 것으로 판단된다.
고 찰
동물들은 통증이 있거나 스트레스를 받게 되면 다양한 반응을 나타낸다. 대표적으로 설치류는 통증이나 스트레스가 심할 때 피모가 서 있거나 부분적인 탈모가 유발되며, 사료 섭취량 또는 음수량이 줄어들면서 체중이 감소한다. 따라서 실험 중에 나타나는 일반증상 (행동, 외형적 증상 등)의 관찰은 통증 이나 스트레스에 대한 지표가 된다 (Morton et al., 1985).
2,000 ㎎/㎏ 용량으로 WRT를 투여한 수컷 랫드는 3 일차에 음성대조군과 비교하여 통계학적으로 유의한 차이가 나타났었지만 14 일차에 음성대조군의 체중이 증가되면서 통계학적 유의성이 나타나지 않았다 (Table 1).
대조군에 비해 10% 체중 변화는 발암성시험에 적합한 독성학적 징후이며, 급성독성평가와 같은 일반독성시험에서 대조군 대비 20% 또는 7 일 이상 25% 이상 체중이 감소할 경우 체중에 기반한 독성학적 의미를 가진다 (Berlo et al., 2022).
단회투여 후 14 일 동안 독성학적 의미를 갖는 일반증상은 관찰되지 않았고, 부검을 통해 전 개체군의 장기를 관찰한 결과 특이적인 병변이 확인되지 않았다. 이러한 결과는 WRT를 2,000 ㎎/㎏ 용량까지 단회투여했을 때 통증, 스트레스 및 체중변화를 유발하지 않기 때문에, 단회투여에 의한 개략의 치사량은 2,000 ㎎/㎏을 초과하는 용량으로 생각된다.
복귀돌연변이시험은 초기 연구에서 발암성을 가진 물질의 90%를 스크리닝할 수 있었을 정도로 변이원성 물질에 대한 감수성이 높고 Salmonella typhimurium은 시험에 가장 일반적으로 사용하는 균주로 알려져 있다 (McCann et al., 1975; O'brien et al., 1980).
균주 종류에 따라 변이원성물질과 반응하게 되면 DNA상의 염기쌍 하나가 다른 염기쌍으로 치환되는 점돌연변이 (point mutation), 염기서열 3개를 읽는 단위의 코돈 (reading frame) 이 바뀌는 프레임쉬프트 돌연변이 (frameshift muation) 등의 유형으로 복귀돌연변이가 일어난다 (Bringezu and Simon, 2022). 박테리아를 이용한 복귀돌연변이시험에서 유전자 돌연변이를 판단하는 방법은 다양하지만 주로 음성대조군에 비해 복귀돌연변이 집락의 수가 과거 음성대조군 결과의 범위를 벗어나 2∼3 배 증가하고, 용량 상관관계가 있을 때 돌연변이성을 판단한다(Levy DD, 2019).
WRT 처리에 따른 복귀돌연변이 수를 계수한 결과, 음성대조군에 비해 대사활성계 유무에 관계없이 해당화 물 추출물 5,000 ㎍/plate 이하 농도에 모든 시험물질군의 복귀돌연변이 수가 2 배 이상 증가하지 않아 음성결과로 판정하였다. S. typhimurium은 원핵생물이기 때문에, 동물 또는 사람의 물질 대사과정을 흉내 내기 위해 물질의 대사활성화를 거친다. 변이원성 물질로 알려진 benzo[α]pyrene은 대사활성화가 이루어 졌을 때만 변이원성 물질로 작용한다 (Volker, 2008).
대사활성화를 적용하거나 적용하지 않았을 때 WRT가 복귀돌연변이 수를 증가시키지 않는 것으로 보아 WRT는 대사활성화가 이루어져도 복귀돌연변이를 유발하지 않는 것으로 판단된다.
염색체의 구조적 이상은 임상적으로 다양한 종양성 질환에서 흔히 발견되는 특징이며, 두 염색분체가 동일한 위치에서 절단 및 재결합됨으로써 나타나는 염색체이상 (chromosome-type aberration)과 단일염색분체가 절단 및 재결합됨으로써 나타나는 염색분체이상 (chromatid-type aberration)로 구분한다 (Krzysztof and Clara, 2002). 하위 유형으로는 염색분체절단 (chromatid break), 염색분체교환 (chromatidexchange), 염색체 절단 (choromosome break), 염색체교환 (chromosome exchange)으로 분류된다 (Galloway, 2000). 일반적으로 세포생존률이 50% 이하로 감소될 경우 세포독성에 의한 염색체의 구조적 이상이 나타나기 때문에 판독을 실시하지 않는다 (Galloway, 2000).
WRT는 125 ㎍/㎖ 이상 농도에서 CHL/IU 세포에 대한 독성을 나타내 상대적으로 고농도에서 염색체의 구조적 이상을 유발하는지 확인할 수 없었지만 125 ㎍/㎖ 농도까지 염색체의 구조적 이상을 유발하지 않는 것으로 판단된다.
소핵은 미성숙 적혈구로 분화하는 과정에서 주핵과 탈핵되지 않고 세포질에 남게 되며, 이러한 소핵을 골수 또는 말초 혈액의 미성숙 적혈구에서 검출된다. 동물종 간에 차이는 있지만, 체내 대사, 약물 동태 및 DNA 복구 기능이 반영되기 때문에 유전독성 평가를 위한 합리적인 방법으로 알려져 있다 (Krishna and Hayashi, 2000).
ICR 마우스에 WRT를 투여하고 골수를 분석한 결과 음성대조군과 비교했을 때 소핵 발생율이 통계학적 유의성이 나타나지 않았고, WRT에 의한 골수 독성도 관찰되지 않았다.
결론적으로, WRT는 본 시험 조건에서 WRT는 급성독성과 유전독성을 유발하지 않는 것으로 판단된다. 다만, 의약품의 비임상 안전성 평가는 반복투여독성 및 생식독성을 포함한 다 양한 시험법으로 구성되어 있으며 본 연구 이외의 추가적인 연구가 이루어져야 해당화의 안전성을 자세히 확보할 수 있을 것으로 사료된다.
Acknowledgments
본 연구는 전라남도 장흥군의 지원(정남진 한약재 산업 활성화 기반 구축 사업)의 지원으로 이루어진 결과로 이에 감사드립니다.
References
-
Ahn MA and Hyun TK. (2022). Anti-inflammatory effects of Rosa rugosa extracts in RAW264.7 cells exposed to particulate matter(PM10). Journal of Plant Biotechnology. 49:145-149.
[https://doi.org/10.5010/JPB.2022.49.2.145]

-
Altıner D and Kılıçgün H. (2008). The antioxidant effect of Rosa rugosa. Drug Metabol Drug Interact. 23:323-327.
[https://doi.org/10.1515/DMDI.2008.23.3-4.323]

-
van Berlo D, Woutersen M, Muller A, Pronk M, Vriend J and Hakkert B. (2022). 10% Body weight(gain) change as criterion for the maximum tolerated dose: A critical analysis. Regulatory Toxicology and Pharmacology. 134:105235. https://www.sciencedirect.com/science/article/pii/S0273230022001222, (cited by 2024 June 16)
[https://doi.org/10.1016/j.yrtph.2022.105235]

-
Bringezu F and Simon S. (2022). Salmonella typhimurium TA100 and TA1535 and E. coli WP2 uvrA are highly sensitive to detect the mutagenicity of short alkyl-N-Nitrosamines in the bacterial reverse mutation test. Toxicology Reports. 9:250-255.
[https://doi.org/10.1016/j.toxrep.2022.02.005]

-
Cariello NF and Piegorsch WW. (1996). The Ames test: the two-fold rule revisited. Mutation Research. 369:23-31.
[https://doi.org/10.1016/S0165-1218(96)90044-0]

-
Choi HJ, An TJ, Ahn YS, Park CB, Kim JI, Park SH, Yang H, Do KH and Moon YS. (2011). Safety evaluation from aflatoxin risk of Korean Angelicae Gigantis Radix based on critical control points. Korean Journal of Medical Crop Science. 19:47-53.
[https://doi.org/10.7783/KJMCS.2011.19.1.047]

-
Galloway SM. (2000). Cytotoxicity and chromosome aberrations in vitro: Experience in industry and the case for an upper limit on toxicity in the aberration assay. Environmental and Molecular Mutagenesis. 35:191-201.
[https://doi.org/10.1002/(SICI)1098-2280(2000)35:3<191::AID-EM6>3.3.CO;2-W]

-
Gee P, Sommers CH, Melick AS, Gidrol XM, Todd MD, Burris RB and Zeiger E. (1998). Comparison of responses of base-specific Salmonella tester strains with the traditional strains for identifying mutagens: The results of a validation study. Mutation Research / Genetic Toxicology and Environmental Mutagenesis. 412:115-130.
[https://doi.org/10.1016/S1383-5718(97)00172-1]

- Jung YH, Ham YM, Yoon SA, Oh DJ, Kim CS and Yoon WJ. (2018). Antioxidant and anti-inflammatory effects of Ficus erecta var. sieboldii leaf extract in murine macrophage RAW 264.7 cells. Korean Journal of Plant Resources. 31:303-311.
- Kang NS and Sohn EH. (2010). Immunomodulatory effects of fructus and semen from Rosa rugosa on macrophages. Korean Journal of Plant Resources. 23:399-405.
-
Kim E, Mok HK and Hyun TK. (2022). Variations in the antioxidant, anticancer, and anti-inflammatory properties of different Rosa rugosa organ extracts. Agronomy. 12:238. https://www.mdpi.com/2073-4395/12/2/238, (cited by 2024 June 16)
[https://doi.org/10.3390/agronomy12020238]

-
Kim JW, Um M and Lee JW. (2018). Antioxidant activities of hot water extracts from different parts of Rugosa rose(Rosa rugosa Thunb.). Journal of the Korean Wood Science and Technology. 46:38-47.
[https://doi.org/10.5658/WOOD.2018.46.1.38]

- Kim SH, Choi EJ, Kim DH, Lee KY, Lee M, Baek SW, Kwak SJ, Kang TS, Kim YC and Sung SH. (2008). Stability test of the extracts of Cimicifugae Rhizoma, Achyranthis Radix, Artemisia Capillaris Herba, Moutan Cortex Radicis and Arecae Semen for toxicity study. Korean Journal of Phamacognosy. 39:241-245.
-
Krishna G and Hayashi M. (2000). In vivo rodent micronucleus assay: Protocol, conduct and data interpretation. Mutation Research / Fundamental and Molecular Mechanisms of Mutagenesis. 455:155-166.
[https://doi.org/10.1016/S0027-5107(00)00117-2]

-
Mrózek K and Bloomfield CD. (2002). Chromosome aberrations. In Boffetta P and Hainaut P. (ed.). Encyclopedia of cancer. Academic Press. MA, USA. p.485-496.
[https://doi.org/10.1016/B0-12-227555-1/00505-0]

-
Kwak M, Eom SH, Gil J, Kim JS and Hyun TK. (2019). Variation in bioactive principles and bioactive compounds of Rosa rugosa fruit during ripening. Journal of Plant Biotechnology. 46:236-245.
[https://doi.org/10.5010/JPB.2019.46.3.236]

-
McCann J, Choi E, Yamasaki E, Ames BN. (1975). Detection of carcinogens as mutagens in the Salmonella/microsome test: Assay of 300 chemicals. Proceedings of the National Academy of Sciences. 72:5135-5139.
[https://doi.org/10.1073/pnas.72.12.5135]

-
Meijerhof R. (1992). Pre-incubation holding of hatching eggs. World's Poultry Science Journal. 48:57-68.
[https://doi.org/10.1079/WPS19920006]

-
Morton DB and Griffiths PH. (1985). Guidelines on the recognition of pain, distress and discomfort in experimental animals and an hypothesis for assessment. Veterinary Record. 116:431-436.
[https://doi.org/10.1136/vr.116.16.431]

-
Mota J and Rico-Hesse R. (2009). Humanized mice show clinical signs of dengue fever according to infecting virus genotype. Journal of Virology. 83.17:8638-8645.
[https://doi.org/10.1128/JVI.00581-09]

-
Nho JH, Jang JH, Lee MJ, Yang B, Woo KW, Lee HJ, Kim AH, Sim MO, Cho HW and Jung HK. (2019). Safety evaluation test of galgeun-tang applied to guidelines for the testing of chemicals, Korean Journal of Medicinal Crop Science. 27:173–185.
[https://doi.org/10.7783/KJMCS.2019.27.3.173]

-
O'brien AD, Rosenstreich DL, Scher I, Campbell GH, Macdermott RP and Formal SB. (1980). Genetic control of susceptibility to Salmonella typhimurium in mice: Role of the LPS gene. The Journal of Immunology. 124:20-21.
[https://doi.org/10.4049/jimmunol.124.1.20]

- Park BJ. (2008). Isolation of main component and antioxidant activities on the stem and root of Rosa rugosa. Korean Journal of Plant Resources. 21:402-407.
-
Arlt VM, Stiborova M, Henderson CJ, Thiemann M, Frei E, Aimova D, Singh R, da Costa GG, Schmitz OJ, Farmer PB, Wolf CR and Phillips DH. (2008). Metabolic activation of benzo[a]pyrene in vitro by hepatic cytochrome P450 contrasts with detoxification in vivo : Experiments with hepatic cytochrome P450 reductase null mice. Carcinogenesis. 29:656-665.
[https://doi.org/10.1093/carcin/bgn002]

-
Levy DD, Zeiger E, Escobar PA, Hakura A, van der Leede BM, Kato M, Moore MM and Sugiyama KI. (2019) Recommended criteria for the evaluation of bacterial mutagenicity data(ames test). Genetic Toxicology and Environmental Muatagenesis. 848, 403074
[https://doi.org/10.1016/j.mrgentox.2019.07.004]
